قطبیت در شیمی مقدار چگالی بار الکترونهای اطراف اتمها را در مولکولها و ترکیبات شیمیایی مشخص میکند. این پارامتر، به توزیع بار الکتریکی درون یک مولکول اشاره دارد که موجب ایجاد نواحی با بار مثبت و منفی مشخص میشود. این جدایی بار میتواند در پیوندهای شیمیایی یا در سراسر کل مولکول رخ دهد. در این مطلب از مجله فرادرس میآموزیم قطبیت در شیمی چیست و چگونه میتوان آن را تشخیص داد.
آنچه در این مطلب میآموزید:
-
با مفهوم قطبیت در شیمی و الکترونگاتیوی آشنا میشوید.
-
میآموزید قطبیت پیوند و قطبیت مولکول چه تفاوتی دارند.
-
میتوانید ساختار هندسی مولکولهای مختلف را رسم کنید.
-
میآموزید چگونه قطبیت مولکول را با استفاده از رسم ساختار هندسی و فرمول شیمیایی تشخیص دهید.
-
با اهمیت تشخیص قطبیت مواد و ویژگی مواد قطبی آشنا میشوید.
-
میآموزید قطبیت چه تاثیری بر نیروهای بین مولکولی میگذارد.

در ابتدای این مطلب میآموزیم قطبیت در شیمی چیست. سپس به بررسی قطبیت پیوندها و مولکولها پرداخته و روش رسم ساختار هندسی مولکولها را میآموزیم. در ادامه، روش تشخیص قطبیت مواد را با استفاده از الکترونگاتیوی، شکل هندسی و فرمول شیمیایی آموخته و اهمیت تشخیص قطبیت مواد را میشناسیم. در نهایت با اثر قطبیت بر نیروهای بین مولکولی آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید قطبیت در شیمی چیست.
قطبیت در شیمی
قطبیت در شیمی مفهومی است که مشخص میکند توزیع بار الکتریکی منفی حاصل از توزیع الکترونها در پیوندهای شیمیایی و ترکیبات شیمیایی چگونه است. میزان قطبیت پیوند مشخص میکند که در صورت تشکیل یک پیوند شیمیایی، الکترونها بیشتر به سمت هسته کدام اتم جذب میشوند.
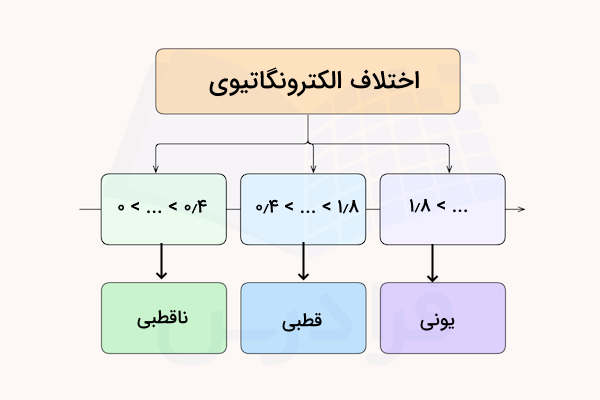
در واقع کمیتی به نام الکترونگاتیوی اتمهای درگیر در پیوند مشخص میکند که قطببیت پیوند و در نهایت قطبیت ترکیب شیمیایی چگونه است. با به دست آوردن اختلاف الکترونگاتیوی دو اتم درگیر در پیوند، قطبیت و نوع پیوند آن مشخص میشود.
| اختلاف الکترونگاتیوی | نوع پیوند |
| بین صفر تا ۰٫۴ | کووالانسی غیرقطبی |
| بین ۰٫۴ تا ۱٫۸ | کووالانسی قطبی |
| بیش از ۱٫۸ | یونی |
با تشکیل پیوند کووالانسی و اشتراک الکترون، اختلاف الکترونگاتیوی اتمهای درگیر در پیوند در مولکول باعث جذب الکترونها در یک سمت مولکول بیش از سمت دیگر میشوند. این عامل میتواند باعث قطبی شدن موکلول شود.
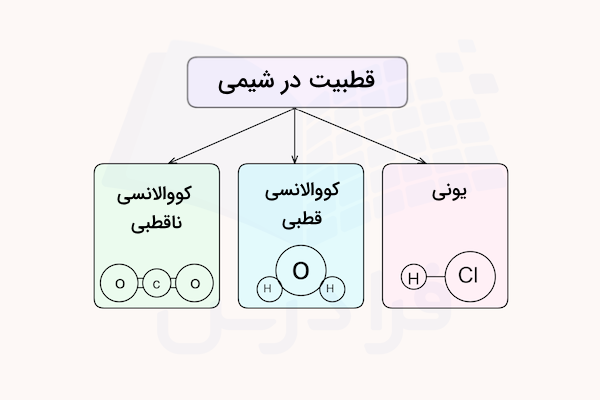
پیوندهای شیمیایی از لحاظ قطبیت و اختلاف الکترونگاتیوی به سه دسته تقسیم میشوند.
- پیوند کووالانسی ناقطبی
- پیوند کووالانسی قطبی
- پیوند یونی
در نهایت با تشخیص قطبیت پیوندها در یک ترکیب شیمیایی میتوان قطبیت مولکول را تشخیص داد. در واقع قطبیت یک مولکول تحت تاثیر پیوندهای آن و هندسه مولکولی آن است. برای مثال، آب که ساختار مولکولی خمیدهای دارد یک مولکول قطبی است و کربن دی اکسید که ساختاری خطی و متقارن دارد یک مولکول ناقطبی است.
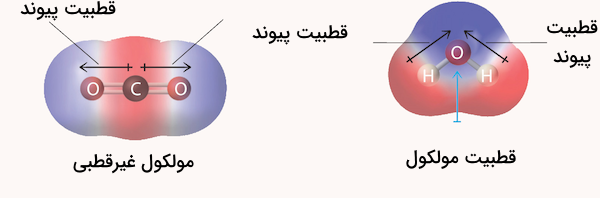
در ادامه روش تشخیص قطبیت پیوند و مولکولهای شیمیایی را توضیح میدهیم. درک قطبیت در شیمی برای پیشبینی رفتار مولکولها، حلالیت و واکنشپذیری در واکنشهای مختلف شیمی، ضروری است.
الکترونگاتیوی چیست؟
قطبی یا غیرقطبی بودن یک پیوند کووالانسی توسط یک ویژگی اتمهای شرکتکننده در پیوند به نام الکترونگاتیوی تعیین میشود. الکترونگاتیوی توانایی یک اتم برای جذب الکترونها (یا چگالی الکترونی) به سمت هسته اتم است و مشخص میکند که الکترونهای مشترک بین دو اتم چگونه توزیع شوند.هرچه یک اتم الکترونها را قویتر جذب کند، الکترونگاتیوی آن بیشتر است.
در یک پیوند کووالانسی قطبی، الکترونها به سمت اتمی با الکترونگاتیوی بالاتر کشیده میشوند. بنابراین اتم دارای چگالی الکترونی بیشتر، دارای بار جزئی منفی () میشود. در مقابل اتمی که از چگالی بار الکترونی آن کاسته شده، دارای بار جزئی مثبت () میشود. هرچه اختلاف الکترونگاتیوی بین دو اتم بیشتر باشد، توزیع الکترونی قطبیتر و بارهای جزئی اتمها بزرگتر میشود.
الکترونگاتیوی اتم ها
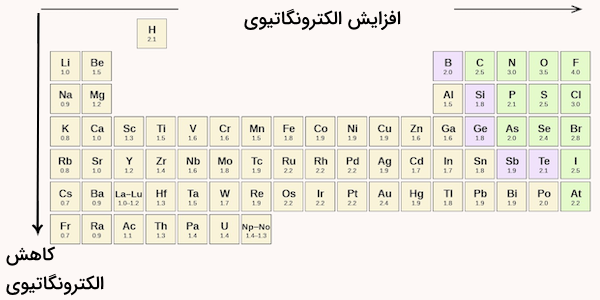
به طور کلی، الکترونگاتیوی از چپ به راست در یک دوره جدول تناوبی افزایش مییابد و از بالا به پایین در یک گروه کاهش مییابد. بنابراین نافلزها که در بالای سمت راست جدول قرار دارند، معمولا الکترونگاتیوی بیشتری دارند. در مقابل مقدار الکترونگاتیوی اتمهای فلزی کمتر است. الکترونگاتیوی اتمهای گاز نجیب معمولا بررسی نمی شود زیرا این موارد تمایلی به تشکیل پیوند و ایجاد ترکیب شیمیایی ندارند.
یادگیری شیمی دهم با فرادرس
برای درک بهتر اینکه قطبیت در شیمی چیست، ابتدا باید با مفاهیمی چون توزیع الکترون در اتمها، آرایش الکترونی، رسم ساختار لوویس و انحلالپذیری آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش دروس پایه دهم بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه قطبیت در شیمی دسترسی داشته باشید.
قطبیت پیوند در شیمی
زمانی که دو اتم با الکترونگاتیوی متفاوت پیوند کووالانسی برقرار میکنند، اتم با الکترونگاتیوی بیشتر جفت الکترونهای مشترک را به سوی خود میکشد. اتمی که الکترونها را بیشتر جذب میکند، دارای بار جزئی منفی میشود، در حالی که اتم دیگر بار جزئی مثبت پیدا میکند. این وضعیت یک دوقطبی (یا دوقطبی الکتریکی) ایجاد میکند. پیوند بین این دو اتم یک پیوند کووالانسی قطبی است.
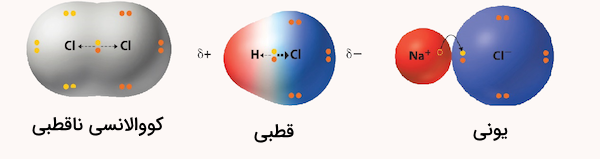
زمانی که دو اتم با الکترونگاتیوی مشابه پیوند کووالانسی برقرار میکنند، الکترونها به طور مساوی به اشتراک گذاشته میشوند و یک پیوند کووالانسی غیرقطبی شکل میگیرد. نوع پیوندی که بین دو اتم تشکیل میشود را میتوان با محاسبه اختلاف الکترونگاتیوی آنها تعیین کرد.
اگر اختلاف الکترونگاتیوی بین دو اتم بین صفر تا ۰٫۴ باشد، پیوند آنها کووالانسی غیرقطبی است، زیرا اختلاف به حدی کم است که الکترونها به طور مساوی به اشتراک گذاشته میشوند. اگر اختلاف الکترونگاتیوی بین ۰٫۴ تا ۱٫۸ باشد، پیوند کووالانسی قطبی است. این اختلاف نشان میدهد که یکی از اتمها الکترونگاتیوی بیشتری دارد و الکترونها را به سمت خود میکشد.
این پدیده زمانی رخ میدهد که یکی از اتمها الکترونگاتیوی بیشتری نسبت به دیگری داشته باشد و در نتیجه جفت الکترونهای مشترک را محکمتر به سوی خود بکشد. همچنین، زمانی که یک اتم دارای جفت الکترونهای غیرپیوندی باشد و بردار اختلاف الکترونگاتیوی در همان جهت قرار گیرد، پیوند قطبی تشکیل میشود. گشتاور دوقطبی مانند کمیت برداری عمل میکند.
وقتی اختلاف الکترونگاتیوی بین دو اتم ۱٫۸ یا بیشتر باشد، پیوند بین آنها یونی خواهد بود. در یک پیوند یونی، الکترونگاتیوی یکی از اتمها آنقدر زیاد است که الکترونها به جای اشتراکگذاری، از یک اتم به اتم دیگر منتقل میشوند. پیشنهاد میکنیم برای آشنایی بیشتر با مقایسه الکترونگاتیوی عناصر موجود در پیوند شیمیایی و تشخیص قطبیت آن، مطلب مقایسه الکترونگاتیوی عناصر در جدول مجله فرادرس را مطالعه کنید.
گشتاور دو قطبی چیست؟
در یک پیوند کووالانسی قطبی، الکترونها به طور نابرابر بین دو اتم درگیر در پیوند به اشتراک گذاشته میشوند و همین امر باعث ایجاد بارهای جزئی مثبت و منفی میگردد. جدایی این بارهای جزئی، یک دوقطبی ایجاد میکند. واژه «دوقطبی» به معنای وجود دو قطب مثبت جزئی و قطب منفی جزئی که از هم جدا شدهاند است. این دو قطب، مقدار مشخصی گشتاور (ممان) دوقطبی خواهند داشت.
قطبیت ناشی از توزیع نابرابر بارهای جزئی میان اتمهای مختلف در یک ترکیب است. اتمهایی مانند نیتروژن، اکسیژن و هالوژنها که الکترونگاتیوی بیشتری دارند، تمایل دارند بار جزئی منفی داشته باشند. در مقابل، اتمهایی مانند کربن و هیدروژن بیشتر خنثی هستند یا بار جزئی مثبت پیدا میکنند.

اندازه گیری گشتاور دو قطبی
اندازهگیری گشتاور دوقطبی نسبتا آسان است. اگر یک ماده بین دو صفحه باردار قرار گیرد، مولکولهای قطبی باعث افزایش بار ذخیرهشده روی صفحات میشوند و از این طریق میتوان گشتاور دوقطبی را به دست آورد. اندازه گشتاور دوقطبی پیوند با حرف یونانی نمایش داده میشود و با فرمول زیر محاسبه میگردد، که در آن Q مقدار بار جزئی (تعیینشده توسط اختلاف الکترونگاتیوی) و r فاصله بین بارهاست.
این گشتاور پیوندی را میتوان به صورت یک بردار نمایش داد، یعنی کمیتی که هم مقدار و هم جهت دارد. بردارهای دوقطبی با فلشهایی نشان داده میشوند که از اتم با الکترونگاتیوی کمتر به سمت اتم با الکترونگاتیوی بیشتر اشاره میکنند. یک علامت کوچک دلتا ( , ) در انتهای اتمها قرار میگیرد تا سر جزئی مثبت یا منفی پیوند مشخص شود. طول فلش متناسب با مقدار اختلاف الکترونگاتیوی بین دو اتم است.
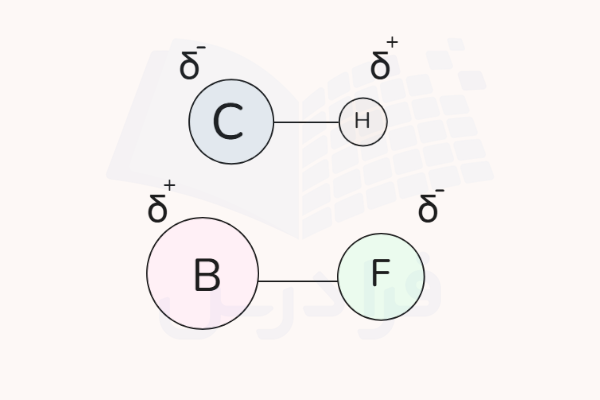
در ادامه هر یک از این ساختارها را بررسی میکنیم.
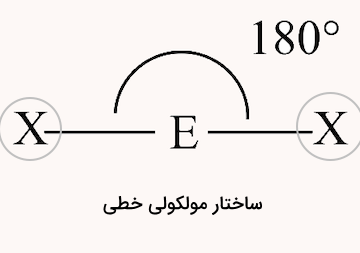
دو ناحیه الکترونی
مولکولهای دو اتمی که تنها یک پیوند دارند، به همراه مولکولهای سه اتمی که در آن اتم مرکزی تنها دو پیوند دارد و جفت الکترون غیرپیوندی ندارد، ساختاری خطی دارند. در این مولکولها، برآیند ممانهای پیوند میتواند خلاف جهت بوده و یکدیگر را خنثی کنند و مولکول ناقطبی باشد. در مقابل اگر ممان پیوندها هر دو در یک جهت باشند، یک سمت مولکول جزئی مثبت و سمت دیگر جزئی منفی شده و مولکول قطبی خواهد بود.
شکل این ساختار در ادامه مشخص شده است.
سه ناحیه الکترونی
در مولکولهایی با ۳ ناحیه الکترونی، نواحی میتوانند شامل ۳ پیوند یا ۲ پیوند و یک جفت الکترون باشند. مولکولی که ۳ پیوند داشته باشد ساختاری مثلثی مسطح با زوایای ۱۲۰ درجه تشکیل میدهد. اما مولکولی که در آن اتم مرکزی داراری یک جفت الکترون غیر پیوندی باشد ساختاری خمیده خواهد داشت.
شکل این ساختارها در ادامه مشخص شده است.
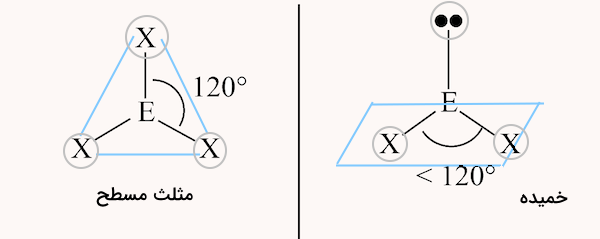
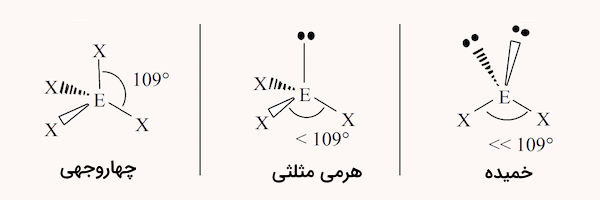
چهار ناحیه الکترونی
در مولکولهایی که در آنها اتم مرکزی ۴ ناحیه الکترونی وجود دارد، ساختارهای زیر ممکن است شکل بگیرد.
| نواحی الکترونی | شکل مولکول |
| ۴ پیوند | تتراهدرال (چهاروجهی) |
| ۳ پیوند و ۱ جفت الکترون | هرمی مثلثی |
| ۲ پیوند و ۲ جفت الکترون ناپیوندی | خمیده |
شکل این ساختارها در ادامه مشخص شده است.
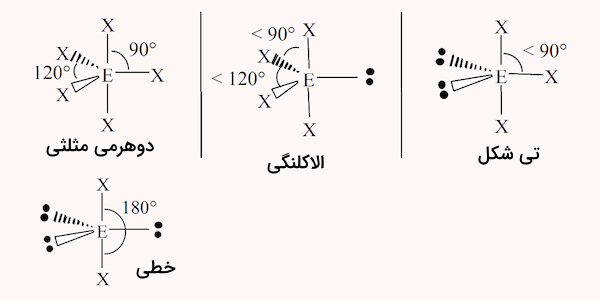
پنج ناحیه الکترونی
در مولکولهایی که در آنها اتم مرکزی ۵ ناحیه الکترونی وجود دارد، ساختارهای زیر ممکن است شکل بگیرد.
| نواحی الکترونی | شکل مولکول |
| ۵ پیوند | دوهرمی مثلثی |
| ۴ پیوند و یک جفت الکترون | الاکلنگی |
| ۳ پیوند و ۲ جفت الکترون | تی شکل |
| ۲ پیوند و ۳ جفت الکترون | خطی |
شکل این ساختارها در ادامه مشخص شده است.
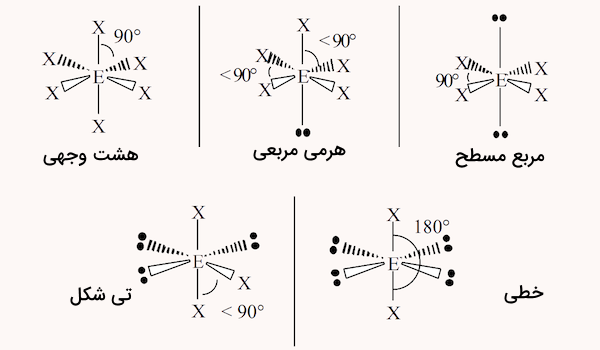
شش ناحیه الکترونی
در مولکولهایی که در آنها اتم مرکزی ۶ ناحیه الکترونی وجود دارد، ساختارهای زیر ممکن است شکل بگیرد.
| نواحی الکترونی | شکل مولکول |
| ۶ پیوند | اوکتاهدرال (هشت وجهی) |
| ۵ پیوند و یک جفت الکترون | هرمی مربعی |
| ۴ پیوند و ۲ جفت الکترون | مربع مسطح |
| ۳ پیوند و ۳ جفت الکترون | تی شکل |
| ۲ پیوند و ۴ جفت الکترون | خطی |
شکل این ساختارها در ادامه مشخص شده است.
روش تشخیص قطبیت مواد
برای تشخیص قطبیت مولکول میتوانیم از اختلاف الکترونگاتیوی برای ترکیبات دو اتمی و از ساختار هندسی برای تشخیص قطبیت مولکولهای چند اتمی استفاده کنیم. در ادامه این روشها را توضیح میدهیم.
مولکول دو اتمی
مولکولهای دو اتمی مولکولهایی هستند که تنها از دو اتم تشکیل شدهاند. این اتمها میتوانند یکسان (جورهسته) یا متفاوت (ناجور هسته) باشند. برای تشخیص قطبیت این مواد کافی است با به دست آوردن اختلاف الکترونگاتیوی بین اتمها به قطبیت آنها پی ببریم.
برای مثال مولکولهای دو اتمی جورهستهای مانند هیدروژن و نیتروژن ناقطبی و مولکولهایی مانند سدیم کلرید، سدیم کلرید و … قطبی یا یونی هستند. پیشنهاد میکنیم برای درک بهتر این روش تشخیص قطبیت و اثر الکترونگاتیوی بر پیوندهای کووالانسی، فیلم آموزش تاثیر الکترونگاتیوی در پیوند کووالانسی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مولکول چند اتمی
برای تشخیص قطبیت مولکولهای چند اتمی، ابتدا باید بتوانیم شکل هندسی ساختار را رسم کنیم. سپس با استفاده از تعیین ممان (گشتاور) دو قطبی هر پیوند و جهت آنها (از جزء مثبت به منفی)، برآیند ممانهای دو قطبی را تعیین کنیم.
اگر این ممانهای دو قطبی پیوند یکدیگر را خنثی کنند مولکول ناقطبی خواهد بود. اگر این بردارها همدیگر را خنثی نکنند، برآیندی خواهند داشت که از جزء مثبت به جزء منفی مولکول جهتگیری میکند.

جدول تشخیص سریع قطبیت مولکول
قطبی یا غیر قطبی بودن برخی از مولکولها را میتوان با توجه به فرمول شیمیایی آنها به سرعت تشخیص داد. یکی از مثالهای این موارد مولکولهای ناقطبی دواتمی جورهسته هستند. در ادامه، قطبیت این موارد به همراه فرمول شیمیایی عمومی آنها را توضیح میدهیم.
| فرمول شیمیایی عمومی | نوع مولکول |
| AB | قطبی با ساختار خطی |
| قطبی با یک اتم هیدروژن | |
| قطبی با یک گروه هیدروکسید | |
| قطبی با یک اتم اکسیژن در یک سر مولکول | |
| قطبی با یک اتم نیتروژن در یک سر مولکول | |
| غیر قطبی دو اتمی جور هسته | |
| غیر قطبی، بیشتر ترکیبات هیدروکربنی | |
| غیر قطبی، هیدروکربنهایی با تقارن نقطهای |
مولکولهای خطی با دو اتم متفاوت اکثر مواقع دارای اختلاف الکترونگاتیوی بالایی هستند و قطبی هستند. برای مثال کربن مونوکسید () یکی از این موارد است. همچنین، مولکولهایی با یک هیدروژن، هیدروکسید، اکسیژن یا نیتروژن در یک سر مولکول، اکثرا قطبی هستند. برای مثال مولکولهای هیدروژن فلوئورید ()، اتانول ()، آب () و آمونیاک ()، به ترتیب از مثالهای این موارد هستند.
ترکیبات هیدروکربنی اکثرا مولکولهایی با زنجیرههای طولانی هستند که از تعداد زیادی کربن و هیدروژن تشکیل شدهاند و به دلیل طولانی بودن زنجیره هیدروکربنی نسبتا متقارن، نمیتوانند قطبی باشند. برای مثال، پروپان و بوتان با ۳ و ۴ اتم کربن از مولکولهای هیدروکربنی غیرقطبی هستند.
مثال تشخیص قطبیت مواد
برای تشخیص قطبیت مولکولهای چند اتمی، ابتدا تعداد نواحی الکترونی را در مولکول تشخیص میدهیم. سپس بسته به نوع پیوند و تعداد جفت الکترونهای غیر پیوندی و همچنین نوع اتمهای متصل به اتم مرکزی، میتوانیم شکل هندسی مولکول را حدس زده و ممان دوقطبی پیوندها را رسم کنیم. در نهایت با تشخیص برآیند ممانهای دو قطبی پیوند، قطبیت مولکول تعیین میشود.
برای درک بهتر این موارد، به مثالهای زیر دقت کنید.
مثال ۱
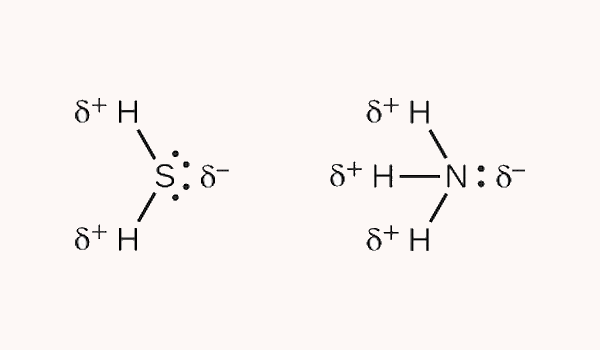
قطبیت مولکولهای گوگرد دی اکسید و آمونیاک را تعیین کنید.
پاسخ
برای تعیین قطبیت این مواد ابتدا ساختار هندسی آنها را تعیین میکنیم. مولکول گوگرد دی اکسید ساختاری خمیده دارد زیرا از دو جفت الکترون غیرپیوندی و دو پیوند تشکیل شده است. مولکول آمونیاک ساختاری هری مثلثی دارد زیرا از سه پیوند نیتروژن – هیدروژن و یک جفت الکترون ناپیوندی تشکیل شده است.
سپس با استفاده از مقادیر الکترونگاتیوی اتمها، سر مثبت و منفی هر پیوند را مشخص میکنیم. نیتروژن نسبت به هیدروژن و گوگرد نسبت به هیدروژن الکترونگاتیوتر هستند.
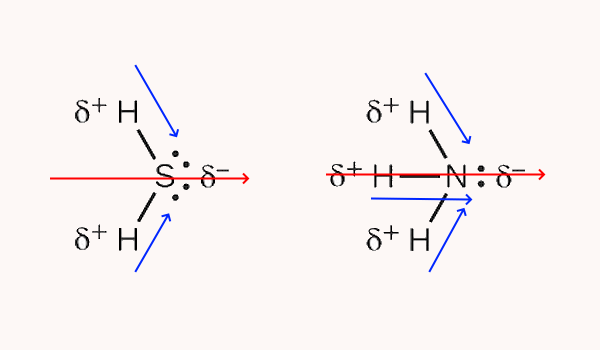
سپس با رسم بردارهای گشتاور دوقطبی هر پیوند و برآیند گرفتن از آنها، قطبیت کلی مولکولها تعیین میشود. در شکل زیر، گشتاور دوقطبی هر پیوند با رنگ آبی و گشتاور دوقطبی مولکول با رنگ قرمز مشخص شده است. بنابر این هر دو مولکول گوگرد دی اکسید و آمونیاک قطبی هستند.
مثال ۲
قطبیت مولکولهای کربن تترا کلرید و و را تعیین کنید.
پاسخ
در مولکول کربن تترا کلرید، چهار پیوند کربن – کلر به صورت متقارن قرار دارند و بردارهای دو قطبی همدیگر را خنثی میکنند. اتم کربن در این مولکول ۴ گروه الکترونی دارد که همگی به اتمهای کلر متصل هستند و ساختاری متقارن را تشکیل میدهند. در نتیجه، برآیند بردارهای گشتاور دو قطبی این مولکول یکدیگر را خنثی کرده و مولکول غیرقطبی خواهد بود.
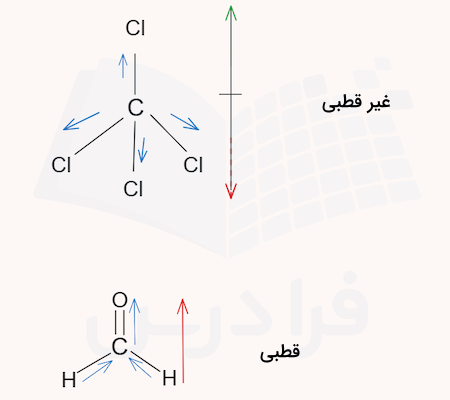
در مقابل، مولکول ساختاری خمیده و نامتقارن دارد. در این مولکول اتم کربن ۳ ناحیه الکترونی دارد که یکی از آنها پیوند دوگانه است و پیوندهای کربن هیدروژن را به عقب رانده و ساختاری خمیده ایجاد میکند. در نتیجه، برآیند ممان دوقطبی پیوندها از کربن یه سمت اکسیژن خواهد بود.
مثال ۳
ساختار شیمیایی مولکول را رسم کرده و شکل هندسی و قطبیت آن را مشخص کنید.
پاسخ
برای رسم ساختار هندسی این مولکول، ابتدا نیتروژن را در مرکز قرار میدهیم و هیدروژن و دو فلوئور را اطراف آن میگذاریم، سپس جفت الکترون غیر پیوندی روی نیتروژن را بالای اتم مرکزی رسم میکنیم، با توجه به این که چهار منطقه الکترونی اطراف نیتروژن وجود دارد، ساختار آن هرمی مثلثی است.
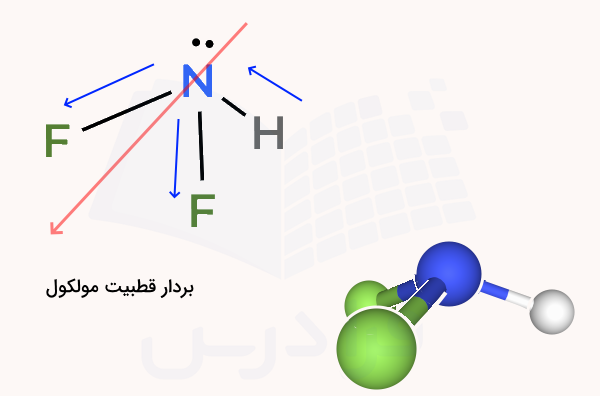
در پیوندهای نیتروژن – فلوئور، بردار گشتاور از نیتروژن به فلوئور و در پیوند هیدروژن نیتروژن، به سمت نیتروژن است. در نتیجه مولکول قطبی خواهد بود و بردارهای آن به شکل بالا رسم میشوند.
اهمیت تشخیص قطبیت مواد
قطبیت یک خاصیت فیزیکی ترکیبات است که با سایر ویژگیهای فیزیکی مانند نقطه ذوب و جوش، حلالیت و برهمکنشهای بینمولکولی ارتباط دارد. در بیشتر موارد، بین قطبیت یک مولکول و تعداد و نوع پیوندهای کووالانسی قطبی یا غیرقطبی موجود در آن رابطه مستقیمی وجود دارد.
با درک و تشخیص قطبیت مواد در شیمی می توانیم بسیاری از ویژگیها و رفتار شیمیایی آنها را درک کنیم. در ادامه اثر قطبیت مواد بر حلالیت، جهتگیری مغناطیسی، نقطه ذوب، کشش سطحی و ویسکوزیته را بررسی میکنیم.
حلالیت
قطبیت مولکولها یکی از مهم ترین عوامل در تعیین حلال مناسب برای آنها و تعیین میزان انحلالپذیری است. حلالهای قطبی در حل کردن مواد قطبی موثرتر هستند و حلالهای غیرقطبی برای حل کردن مواد غیرقطبی مناسبترند.
برای آنکه مولکولهای حلشونده بتوانند در میان مولکولهای حلال پخش شوند و حل شوند، باید بر نیروهای جاذبه بین مولکولی لاندن یا پیوند هیدروژنی غلبه کنند. بنابراین، اگر مولکولهای ماده حل شونده دارای نیروهای بین مولکولی مشابهی با حلال باشند، میتوانند به راحتی در حلال حرکت کرده و برهمکنش ایجاد کنند و حل شوند. به همین دلیل، از مخلوط شدن یک ماده غیر قطبی و یک ماده قطبی، محلول تشکیل نمیشود.
جهت گیری در میدان مغناطیسی
مولکولهای قطبی تمایل دارند زمانی که در یک میدان الکتریکی قرار میگیرند، طوری جهتگیری کنند که سر مثبت مولکول به سمت صفحه منفی و سر منفی به سمت صفحه مثبت قرار گیرد. میتوان از یک جسم باردار الکتریکی برای جذب مولکولهای قطبی استفاده کرد، اما مولکولهای غیرقطبی جذب نمیشوند.
این پدیده باعث میشود باریکه مولکلهای قطبی (مانند آب) در صورت قرارگیری در میدان الکتریکی یا مغناطیسی، مقداری خمیده شده و جهتگیری کنند. این رفتار مولکولها در میدان الکتریکی کاملا به قطبیت آنها وابسته است.
نقطه ذوب
مولکولهای قطبی دارای نقطه ذوب و جوش بالاتری نسبت به مولکولهای ناقطبی با همان حدود جرم مولی هستند. این پدیده به دلیل نیروهای بین مولکولی دوقطبی – دوقطبی است که بین مولکولهای قطبی شکل میگیرد.
یکی از رایجترین برهمکنشهای قبلی بین مولکولها، پیوند هیدروژنی است. برای مثال، آب با جرم مولی ۱۸ که دارای پیوند هیدروزنی بین مولکولهای خود است، دمای جوشی حدود ۱۰۰ درجه سانتی گراد دارد و متان با جرم مولی ۱۶ که یک مولکول غیر قطبی است، دمای جوش ۱۶۱ – درجه سانتیگراد دارد.
به طور خلاصه، هرچه قطبیت و گشتاور دوقطبی مولکول بیشتر باشد، نیروهای بینمولکولی قویتر و خواص فیزیکی مانند نقطه ذوب و جوش بیشتر میشود.
کشش سطحی
به دلیل نیروهای جاذبه بین مولکولی قویتر در مولکولهای قطبی، کشش سطحی آنها نسبت به مولکولهای غیرقطبی بیشتر است.
ویسکوزیته
مایعات قطبی، ویسکوزیته بالاتری نسبت به مایعات غیرقطبی دارند. برای مثال، مولکول ناقطبی هگزان، ویسکوزیته خیلی کمتری نسبت به آب دارد. با این وجود، اندازه مولکول نسبت به قطبیت مولکول بیشتر بر ویسکوزیته مایعات اثر میگذارد. به همین دلیل ویسکوزیته آب با وجود قطبی بودن نسبت به مولکول غیر قطبی بزرگی مانند هگزادکان کمتر است.

اثر قطبیت بر نیروهای بین مولکولی
قطبیت مولکولها تاثیر زیادی بر نیروهای بینمولکولی دارد. مولکولهای قطبی دارای دوقطبی دائمی هستند و برهمکنش دوقطبی – دوقطبی میان آنها برقرار میشود، در حالی که مولکولهای غیرقطبی تنها نیروهای پراکندگی لاندن دارند که ضعیفترند.
اگر مولکولها دارای پیوند H-O، H-N یا H-F باشند، قویترین نیرو یعنی پیوند هیدروژنی ایجاد میشود. به همین دلیل، مولکولهای قطبی و دارای پیوند هیدروژنی نیاز به انرژی گرمایی بیشتری برای شکستن برهمکنشها دارند و نقطه ذوب و جوش بالاتری دارند، در حالی که مولکولهای غیرقطبی با نیروهای ضعیف لاندن ویژگیهای ضعیفتر فیزیکی نشان میدهند.
یادگیری شیمی عمومی در فرادرس
قطبیت در شیمی یکی از مهم ترین مفاهیم است که پایه و اساس محلولسازی، رفتار مواد و واکنشپذیری را تشکیل میدهد. برای درک بهتر قطبیت در شیمی باید با مفاهیمی چون الکترونخواهی، مفهوم پیوند شیمیایی، قاعده هشتایی و اوربیتالهای مولکولی آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه مفهوم قطبیت در شیمی دسترسی داشته باشید.
مولکول آمفیاپاتیک چیست؟
به مولکولهای بزرگی که یک سر آنها دارای گروه قطبی و سر دیگر آنها گروه ناقطبی دارد، آمفیپاتیک یا «آمفیفیلیک» (Amphiphilic) گفته میشود. این مولکولها سورفکتانتهای خوبی هستند و میتوانند برای تولید امولسیون پایدار یا مخلوطی از آب و چربی استفاده شوند.
آزمون قطبیت در شیمی
برای درک و یادگیری بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید. در انتها میتوانید با کلیک بر روی گزینه «دریافت نتیجه آزمون»، تعداد پاسخهای صحیح خود را مشاهده کنید.
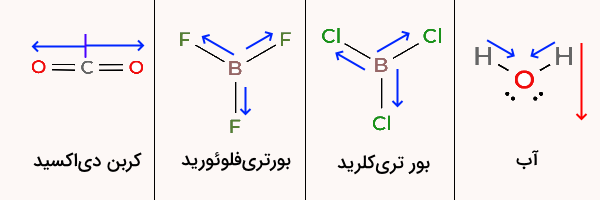
کدام یک از مولکولهای زیر قطبی است؟
بور تری فلوئورید
بور تری کلرید یک مولکول با ۳ ناحیه الکترونی و ساختار مثلث مسطح است زیرا تمامی پیوندها همسان هستند. به همین شکل، مولکول بور تری فلوئورید نیز یک مولکول غیر قطبی خواهد بود. کربن دی اکسید ساختاری خطی دارد و غیر قطبی است. تنها مولکول آب با ساختار خمیده مولکولی قطبی است.
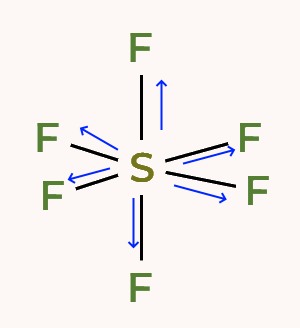
مشخص کنید مولکول یک مولکول قطبی است یا غیر قطبی؟ کدام اتم در این مولکول بار جزئی منفی دارد؟
غیر قطبی، فلوئور
غیر قطبی، گوگرد
این مولکول به دلیل آرایش هشتوجهی متقارن، غیرقطبی است. در هر پیوند، فلوئور بار جزئی منفی و گوگرد بار جزئی مثبت دارد.
کدام یک از مولکولهای زیر قطبی است؟
مولکولهای دو اتمی هیدروژن و فلوئور، مولکولهای جور هسته و ناقطبی هستند و مولکول کربن تترا کلرید نیز ساختاری هرمی دارد و تمامی پیوندهای آن یکسان هستند و تقارن مولکول باعث ناقطبی بودن آن میشود. تنها مولکول هیدروژن کلرید دارای قطبیت است. ممان دو قطبی این مولکول از هیدروژن به سمت اتم کلر رسم میشود.
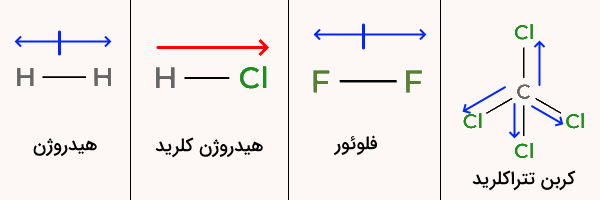
کدام یک از مولکولهای زیر ساختاری خطی دارد؟
در بین این مولکولها تنهای دی هیدروژن بلریم دارای ساختار خطی است زیرا اتم بلریم مرکزی هیچ جفت الکترون غیرپیوندی ندارد. اکسیژن در آب، گوگرد در گوگرد دی اکسید و نیتروژن در آمونیاک همگی جفت الکترونهای غیر پیوندی دارند که باعث خمیده یا هرمی بودن ساختار آنها میشود.
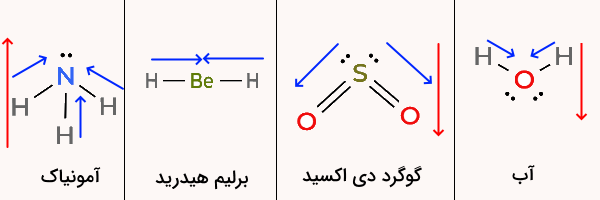
کدام یک از ترکیبات زیر دارای گشتاور دو قطبی است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
کدام یک از ترکیبات زیر دارای گشتاور دو قطبی نیست؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
کدام یک از پیوندهای زیر، دارای بیشتری گشتاور دوقطبی است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
کدام مولکول به علت وجود جفت الکترون غیر پیوندی روی اتم مرکزی، قطبی است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
کدام مولکول با وجود پیوندهای قطبی، غیرقطبی است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
کدام یک از مولکولهای زیر قطبی نیست؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
