عناصر غیر فلزی عناصری هستند که با دریافت الکترون، یونهای منفی (آنیون) تولید میکنند. این عناصر معمولا ۴، ۵، ۶، ۷ یا ۸ الکترون در لایه ظرفیت خود دارند. عناصر غیر فلزی، خواص فلزات را ندارند و در دمای اتاق به شکل مایع، گاز یا جامد یافت میشوند. از عناصر غیر فلزی میتوان به کربن، گوگرد و فسفر اشاره کرد. در این مطلب از مجله فرادرس میآموزیم مفهوم عناصر غیر فلزی چیست و این مواد چه خواص و کاربردهایی دارند.
آنچه در این مطلب میآموزید:
-
با تمامی عناصر غیر فلزی در جدول تناوبی آشنا میشوید.
-
خواص غیر فلزی مواد مانند نوع پیوند و الکترونگاتیوی بالا را میآموزید.
-
میتوانید تفاوتهای کلیدی عناصر غیر فلزی با فلزات را درک کنید.
-
با بار الکتریکی و آلوتروپهای نافلزات آشنا میشوید.
-
دستهبندیهای مختلف عناصر غیر فلزی و واکنشهای آنها را میآموزید.
-
کاربردهای مختلف این عناصر در صنایع مختلف را میشناسید.

در ابتدای این مطلب با مفهوم عناصر غیر فلزی آشنا شده و میآموزیم کدام عناصر غیرفلزی هستند. در ادامه با خواص غیرفلزی مواد و خواص فیزیکی و شیمیایی عناصر غیرفلزی آشنا میشویم. سپس میآموزیم بار الکتریکی این عناصر و آلوتروپهای آنها کدامند. پس از آن دستهبندی و انواع عناصر غیر فلزی را بررسی کرده و واکنشها و کاربرد این مواد را میآموزیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید مفهوم عناصر غیر فلزی چیست.
عناصر غیر فلزی چیست؟
عناصر غیر فلزی گروه کوچکی از عناصر جدول تناوبی را تشکیل میدهند که به غیر از هیدروژن، باقی آنها در سمت راست جدول تناوبی قرار دارند. این مواد، خواص مواد فلزی را ندارند، آنیون تشکیل میدهند (بجز هیدروژن) و رسانای خوبی برای گرما و الکتریسیته نیستند. این مواد از نظر شیمیایی، الکترونگاتیوی بالایی دارند و تمایل دارند الکترون را جذب کنند.
در مجموع ۱۷ عنصر جدول تناوبی به طور قطعی به عنوان نافلز معرفی شدهاند و بین ۱ تا ۶ عنصر از عناصر شبهفلز نیز گاهی با نام غیرفلز شناخته میشوند. این مواد خواص مختلف و گستردهای دارند و گازهای بیرنگی مانند هیدروژن تا بلورهای درخشان ید را شامل میشوند. برخی از عناصر غیرفلزی از فراوانترین عناصر روی زمین و در اتمسفر هستند. برای مثال، ٪۹۸ کیهان کشف شده تاکنون، شامل عناصر غیر فلزی هیدروژن و هلیوم است.
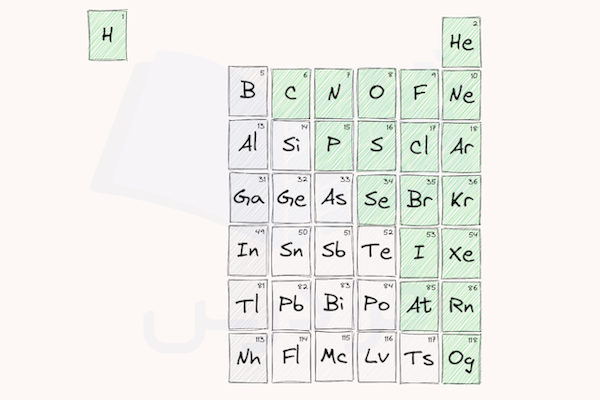
لیست عناصر غیر فلزی
عناصر غیر فلزی، بجز هیدروژن که اولین عنصر جدول تناوبی است، در سمت راست جدول و در کنار خط اریب عناصر شبه فلز واقع شدهاند. در ادامه، لیست عناصر غیر فلزی به همراه نام فارسی عناصر و نماد شیمیایی آنها و عدد اتمی آنها را معرفی میکنیم.
| نام و نماد شیمیایی و حالت فیزیکی | عدد اتمی |
| هیدروژن (H)، گاز | ۱ |
| هلیوم (He)، گاز | ۲ |
| کربن (C)، جامد | ۶ |
| نیتروژن (N)، گاز | ۷ |
| اکسیژن (O)، گاز | ۸ |
| فلوئور (F)، گاز | ۹ |
| نئون (Ne)، گاز | ۱۰ |
| فسفر (P)، جامد | ۱۵ |
| گوگرد (S)، جامد | ۱۶ |
| کلر (Cl)، گاز | ۱۷ |
| آرگون (Ar)، گاز | ۱۸ |
| سلنیوم (Se)، جامد | ۳۴ |
| برم (Br)، مایع | ۳۵ |
| کریپتون (Kr)، گاز | ۳۶ |
| ید (I)، جامد | ۵۳ |
| زنون (Xe)، گاز | ۵۴ |
| رادون (Rn)، گاز | ۸۶ |
| اوگانسون (Og)، گاز | ۱۱۸ |
همچنین برخی از عناصر شبهفلز مانند بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان و تلوریم گاهی اوقات به عنوان عناصر غیرفلزی شناخته شده یا دستهبندی میشوند. باقی عناصر شبه فلزی مانند استاتین و تنسین در دسته بندی تایید شدهای به عنوان غیرفلز قرار نگرفتهاند.
یادگیری علوم نهم با فرادرس
برای درک بهتر عناصر غیر فلزی و ویژگیهای آنها ابتدا باید با مفاهیمی چون انواع مواد، جدول تناوبی عناصر و انواع ترکیبات یونی و کووالانسی آشنا شویم. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش دروس پایه نهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه عناصر غیرفلزی دسترسی داشته باشید.
خواص غیر فلزی مواد
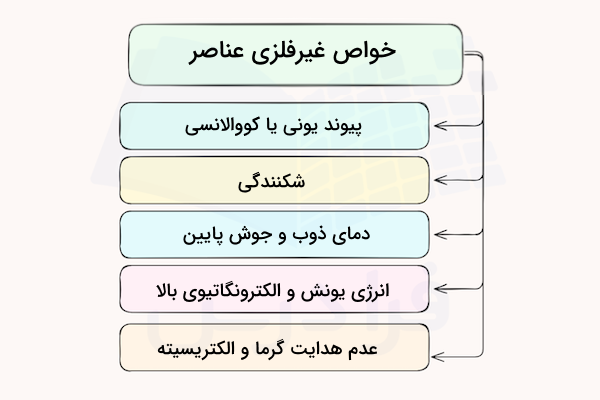
اغلب مواد و عناصر غیر فلزی، ۵ ویژگی مشترک دارند. این خواص، تشکیل پیوند یونی یا کووالانسی، شکنندگی، دمای ذوب و جوش پایین، انرژی یونش و الکترونگاتیوی بالا و عدم هدایت گرما و الکتریسیته هستند.
با این حال، برخی موارد استثنا نیز وجود دارد. برای مثال، هرچند بیشتر غیر فلزها نقطه ذوب پایینی دارند، نمک دارای نقطه ذوب بسیار بالای ۸۰۱ درجه سلسیوس است. در ادامه خواص غیر فلزی عناصر را بررسی میکنیم.
تشکیل پیوند یونی یا کووالانسی
نافلزها برای تشکیل ترکیبات شیمیایی، پیوندهای کووالانسی یا یونی ایجاد میکنند. پیوند کووالانسی زمانی شکل میگیرد که دو عنصر، الکترونهای ظرفیت خود را به اشتراک میگذارند تا یک لایه کامل الکترونی به دست آید. از ترکیبات کووالانسی میتوان به اتانول، گلوکز و دیاکسید کربن اشاره کرد.
پیوند یونی زمانی تشکیل میشود که یک عنصر، الکترونهایی را از عنصر دیگر بگیرد و یک کاتیون و یک آنیون ایجاد شود. یونهای با بار مخالف یکدیگر را جذب کرده و به هم میپیوندند تا یک ترکیب یونی تشکیل دهند. از این ترکیبات میتوان به نمک خوراکی، کربنات، سولفات و کلرید پتاسیم اشاره کرد.
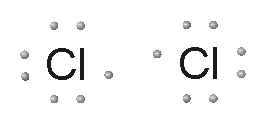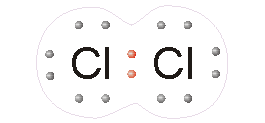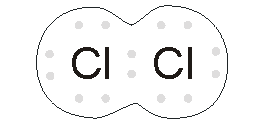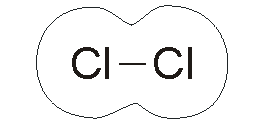
شکنندگی
عناصر غیر فلزی، چه ترکیبات یونی تشکیل دهند و چه ترکیبات کووالانسی، ساختاری شکننده دارند. ترکیبات حاصل از عناصر غیر فلزی را نمیتوان شکل داد و مانند فلزات خاصیت چکشخواری ندارند و نمیتوان از آنها ورقههای نازک یا لوله تولید کرد. دلیل این ساختار شکننده، طبیعت پیوند کووالانسی و یونی این ترکیبات است.
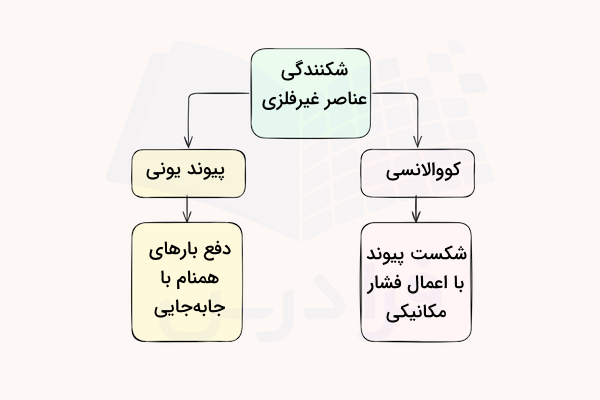
در این پیوندها الکترون به اشتراک گذاشته شده (کووالانسی) یا توسط هسته اتم دیگر جذب میشود (یونی) تا بر نیروهای دافعه الکترواستاتیکی غلبه کند. در پیوند یونی، یونهای مثبت و منفی با قدرت به هم متصل شده و یک ساختار کریستالی شکننده را تشکیل میدهند. با جابجایی این ساختار بر اساس نیروی مکانیکی، یونها همنام همدیگر را دفع کرده و ساختار میشکند. پیوندهای کووالانسی نیز با ایجاد نیروی مکانیکی میتوانند ساختار خود را از دست داده و در هم شکنند.
نقطه ذوب و جوش پایین
با وجود اینکه تمامی غیر فلزات نقطه ذوب و جوش پایینی ندارند، دمای ذوب و جوش اکثر آنها نسبت به ترکیبات فلزی پایینتر است. به همین دلیل است که برخی از عناصر غیر فلزی در دمای اتاق به شکل گاز یا مایع هستند.
نقطه ذوب و جوش پایین این ترکیبات به دلیل ضعیف بودن نیروهای بین مولکولی این ترکیبات است. در ترکیبات کووالانسی، نیروهای بین مولکولی بسیار ضعیف هستند و با ایجاد نیروی خارجی از بین میروند. در ترکیبات یونی این نیرو قویتر است اما نه به اندازه پیوندهای بین ترکیبات فلزی. به همین دلیل با اعمال گرما یا فشار مناسب، این ترکیبات نیز میتوانند تغییر فاز دهند.
انرژی یونش بالا و الکترونگاتیوی
عناصر غیر فلزی، انرژی یونش بالایی دارند. این بدین معنی است که اغلب نمیتوان به راحتی الکترونها را از آنها جدا کرد. انرژی یونش بالا، به دلیل بزرگی هسته آنها در مقایسه با لایههای الکترونی است.
این هستههای بزرگ و با بار الکتریکی مثبت، به شدت الکترونها را جذب میکنند. نیروی جاذبه به حدی زیاد است که میتواند الکترونهای اتمهای مجاور را نیز جذب کند. به همین علت است که عناصر غیر فلزی، الکترونگاتیوی بالایی دارند. مقدار انرژی یونش و الکترونگاتیوی عناصر با حرکت از چپ به راست جدول تناوبی (از فلزات به سمت نافلزات)، افزایش مییابد.
عدم هدایت گرما و الکتریسیته
عناصر غیر فلزی (بجز برخی موارد استثنا)، نمیتوانند به خوبی گرما و جریان الکتریسیته را از خود عبور دهند. نارسانا بودن عناصر غیر فلزی آنها را به مواد اولیه مناسبی برای تولید عایقهای مختلف تبدیل کرده است.
فلزات، در صورت جذب گرما یا الکتریسیته، ساختار خود را حفظ میکنند. در مقابل، نافلزت در صورت وجود نیروی سینتیکی زیاد میشکنند و اوربیتالهای پر الکترونی آنها در صورت اعمال ولتاژ، اجازه ورود الکترون اضافی را نمیدهند. در ادامه، تفاوت فلزات و عناصر غیر فلزی را نام میبریم.
| عناصر غیر فلزی | عناصر فلزی |
| نقطه ذوب و جوش پایین | نقطه ذوب و جوش بالا |
| گاز، جامد یا مایع در دمای اتاق | جامد در دمای اتاق (بجز جیوه) |
| میتوانند شفاف یا کدر باشند. | اغلب درخشان |
| چگالی پایین | چگالی بالا |
| تولید آنیون | تولید کاتیون |
| شکننده | چکشخوار و انعطافپذیر |
| عدم هدایت گرما و الکتریسیته | هادی خوب گرما و الکتریسیته |
| تولید اکسیدهای غیرفلزی بازی یا اسیدی کووالانسی | تولید اکسیدهای فلزی بازی یونی |
خواص فیزیکی و شیمیایی عناصر غیر فلزی
عناصر غیر فلزی خواصی متضاد عناصر فلزی دارند. این عناصر رسانای خوبی برای گرما و الکتریسیته نیستند، چکش خوار نیستند و به راحتی میشکنند. غیرفلز به عنصری گفته میشود که بیشتر ویژگیهای فلزی را ندارد. از نظر فیزیکی، غیرفلزات معمولا فرار هستند، کشسانی کمی دارند و عایق خوبی برای گرما و برق هستند.
از نظر شیمیایی، انرژی یونش و الکترونگاتیوی بالایی دارند و در واکنش با عناصر یا ترکیبات دیگر، معمولا الکترون میگیرند یا به اشتراک میگذارند. با حرکت از سمت چپ به راست جدول تناوبی، خواص نافلزی افزایش یافته و خواص فلزی کاهش مییابد. با حرکت در گروههای جدول تناوبی از بالا به پایین، خواص فلزی افزایش یافته و خواص نافلزی کاهش مییابند. در ادامه، خواص فیزیکی و شیمیایی عناصر غیر فلزی را بررسی میکنیم.
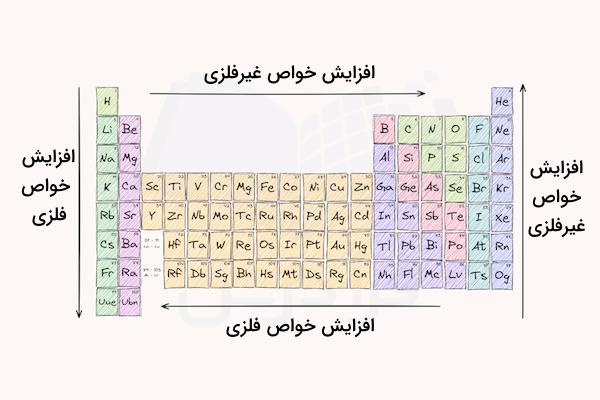
خواص فیزیکی نافلزات
همانطور که در قسمت قبل توضیح دادیم، از مهمترین خواص عناصر غیرفلزی این است که گرما و الکتریسیته را به خوبی از خود عبور نمیدهند. از این ویژگی این عناصر در بسیاری از مواد و تجهیزات (برای مثال تولید عایقها) استفاده میشود. در ادامه به توضیح سایر خواص فیزیکی این عناصر میپردازیم.
- رسانای بسیار ضعیف گرما و جریان الکتریکی (بجز گرافیت)
- انعطافناپذیر
- جامدات شکننده
- میتوانند حالت ماده جامد، مایع یا گاز را در دمای اتاق داشته باشند.
- چکشخوار و نرم نیستند. (بجز نانو لولههای کربنی)
- این ترکیبات تولید کننده صدا نیستند و در صورت برخورد به سایر مواد صدایی مانند فلزات تولید نمیکنند.
- نقطه ذوب و جوش پایین
- میتوانند بیرنگ، رنگی یا براق باشند.
- براق بودن بور، گرافیت (کربن)، سیلیسیوم، فسفر سیاه، ژرمانیم، آرسنیک، سلنیوم، آنتیموان، تلوریم و ید نتیجه بازتاب نور مرئی ورودی توسط الکترونها است.
خواص شیمیایی نافلزات
یکی از مهمترین خواص شیمیایی نافلزات، الکترونگاتیوی بالای آنها و جذب الکترون و تولید آنیون است. این ویژگی این مواد از آنها ترکیبات بسیار گوناگون و ارزشمندی میسازند که در بسیاری از صنایع و واکنشهای شیمیایی استفاده میشوند. در ادامه به توضیح خواص شیمیایی عناصر غیر فلزی میپردازیم.
- تعداد الکترونهای لایه ظرفیت بین ۴ تا ۸ الکترون
- از دست دادن (یا در برخی موارد دریافت) الکترون به سادگی
- تولید اکسیدهای اسیدی در صورت تماس با اکسیژن
- الکترونگاتیوی بسیار بالا
- ترکیبات اکسنده
- اتمهای کوچکتر از فلزات
- پیوندهای بین مولکولی واندروالسی بین اتمهای گاز یا مایع
بار الکتریکی عناصر غیر فلزی
عناصر غیر فلزی انرژی یونش و الکترونخواهی بالایی دارند. مقدار الکترونگاتیوی برای این مواد بالا است و اندازه شعاع اتمی کوچکی دارند. به همین دلیل این عناصر به راحتی آنیون (یون منفی) تولید میکنند. این عناصر با دریافت الکترون به آرایش الکترونی گاز نجیب هم دوره خود رسیده و پایدار میشوند. تنها عنصر هیدروژن است که با از دست دادن تک الکترون خود به کاتیون مثبت تبدیل میشود.
برای مثال، هالوژنهایی مانند فلوئور، کلر، برم و ید که در گروه ۱۷ جدول تناوبی هستند، با دریافت یک الکترون و تولید آنیون یک بار منفی، به آرایش الکترونی پایدار هشتایی گاز نجیب میرسند. این آنیونهای تولید شده میتوانند با بسیاری از مواد دیگر از جمله فلزات و هیدروژن وارد واکنش شده و ترکیبات گوناگونی را بسازند. در ادامه، مقدار بار الکتریکی مواد غیر فلزی و یونهای تولید شده از این عناصر معرفی شدهاند.
| نام نافلز | یون تولید شده |
| هیدروژن | |
| نیتروژن | |
| اکسیژن | |
| فلوئور، کلر، برم، ید | ، ، ، |
| فسفر | |
| گوگرد |
نکته
عناصر غیر فلزی شامل عناصر پایداری مانند کربن و گازهای نجیبی هستند که معمولا یون تولید نمیکنند. عنصر کربن در شرایطی بسیار ویژه ممکن است یونهایی با بار ۴+ یا ۴- تولید کند. هرچند، پایداری ترکیبات تولید شده از یون کربن قابل توجه نیست.
همچنین، گازهای نجیب بیشتر به صورت تک اتم گازی و واکنش نداده در طبیعت یافت میشوند. این مواد نیز ممکن است در شرایط خاص آزمایشگاهی و به صورت مصنوعی به یون تبدیل شوند اما حالت خنثی آنها به صورت حالت پایدارشان شناخته میشود.
آلوتروپ عناصر غیر فلزی
بیش از نیمی از عناصر غیرفلزی دگرشکلها (آلوتروپ) کمتر پایداری دارند که هر کدام ویژگیهای فیزیکی متفاوتی نشان میدهند. مثلا کربن که پایدارترین شکلش گرافیت است، میتواند به صورت الماس، فولرن باکمینستر، آمورفوس یا پاراکریستالی هم دیده شود. دگرشکلها برای عناصر نیتروژن، اکسیژن، فسفر، گوگرد، سلنیوم و ید هم وجود دارند.

دسته بندی عناصر غیر فلزی
عناصر غیر فلزی را میتوان بر اساس ویژگیهای مختلف در گروههای متفاوتی دستهبندی کرد. این دستهبندیها بر اساس حالت ماده، نوع ترکیبات و … است. در ادامه این دستهبندیها را توضیح میدهیم.
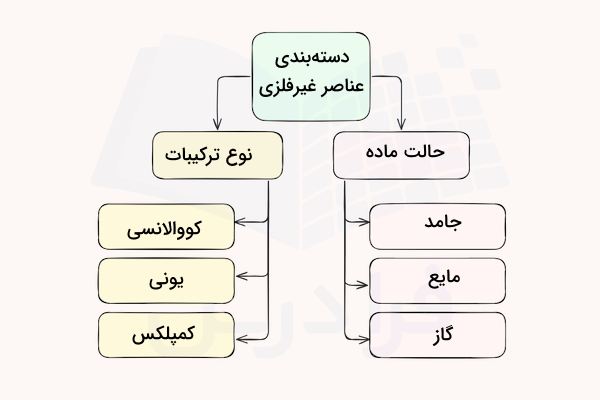
دسته بندی بر اساس حالت ماده
عناصر غیر فلزی را میتوان بر اساس حالت ماده به چند دسته جامد، مایع و گاز دستهبندی کرد. بیشتر عناصر غیر فلزی در دمای اتاق به حالت گاز هستند و گازهای نجیب اغلب به حالت تکاتمی یافت میشوند. از بین تمامی عناصر غیر فلزی، تنها برم در دمای اتاق به صورت مایع است.
- عناصر غیر فلزی گازی: هیدروژن، هلیوم، نیتروژن، اکسیژن، نئون، آرگون، کریپتون، زنون، رادون، اوگانسون
- عناصر غیر فلزی جامد: کربن، فسفر، گوگرد، سلنیم، ید
- عناصر غیر فلزی مایع: برم

عناصر غیر فلزی جامد، اغلب میتوانند چند حالت فیزیکی داشته باشند. برخی از این حالتها برای عناصر رایجتر و پایدارتر از سایر حالتها است. برای مثال، عنصر کربن بیشتر به حالت گرافیت یافت میشود اما در حالت الماس نیز وجود دارد. فسفر حالتهای مختلفی مانند جامد زرد، جامد سفید و گازی دارد. عنصر ید جامدی قهوهای رنگ است که به راحتی تصعید شده و بخاری بنفش رنگ تولید میکند.

دسته بندی بر اساس نوع ترکیبات
برخی از عناصر غیر فلزی مانند هالوژنها یونهایی با الکترونخواهی بسیار بالا و واکنشپذیری قابل توجه تولید میکنند. از ترکیب این عناصر با یون فلزات معمولا ترکیبات یونی به وجود میآید. برخی دیگر از عناصر مانند کربن و گوگرد، تمایل به اشتراکگذاری الکترونهای خود و تشکیل ترکیبات کووالانسی دارند. برخی دیگر از عناصر غیر فلزی میتوانند با در اختیارقرار دادن جفت الکترون خود به اوربیتالهای خالی فلزات، به عنوان لیگاند عمل کرده و ترکیبات کمپلکس تشکیل دهند.
در ادامه این عناصر را بررسی میکنیم.
- ترکیبات کووالانسی: هیدروژن، کربن، نیتروژن، اکسیژن، فسفر، گوگرد، سلنیوم
- ترکیبات یونی: هالوژنها، اکسیژن، نیتروژن، گوگرد، سلنیوم
- ترکیبات کمپلکس: نیتروژن، اکسیژن، فسفر، گوگرد، سلنیوم، کربن
حالت اکسایش عناصر غیر فلزی
حالتهای اکسایش رایج نافلزها در ترکیبات یونی و کووالانسی آنها در ادامه آورده شده است. به یاد داشته باشید که یک عنصر در ترکیب با عنصری با الکترونگاتیوی بالاتر، حالت اکسایش مثبت و در ترکیب با عنصری با الکترونگاتیوی کمتر، حالت اکسایش منفی خواهد داشت.
- هیدروژن: ۱+ و ۱-
- کربن: از ۴+ تا ۴-
- نیتروژن: از ۵+ تا ۳-
- فسفر: ۵+، ۳+ و ۳-
- اکسیژن: ۱- و ۲-
- گوگرد و سلنیوم: ۶+، ۴+ و ۲-
- فلوئور: ۱-
- کلر، برم و ید: ۸+، ۵+، ۳+، ۱+ و ۱-
- زنون: ۸+، ۶+، ۴+ و ۲+
تنوع حالتهای اکسایش که در بیشتر نافلزها دیده میشود، به این معناست که بسیاری از واکنشهای شیمیایی آنها شامل تغییر در حالت اکسایش از طریق واکنشهای اکسایش – کاهش است.
انواع عناصر غیر فلزی
عناصر غیر فلزی را میتوان از جهات مختلفی دستهبندی کرد. رایجترین نوع دستهبندی بر اساس واکنشپذیری آنها است که بر اساس آن به گروههای زیر تقسیم میشوند.
- گازهای نجیب: غیر واکنش پذیر
- هالوژنها: واکنش پذیری زیاد
- واکنشپذیری متغیر: عناصری مانند کربن، هیدروژن، نیتروژن، اکسیژن، فسفر، گوگرد
- برخی از شبه فلزات
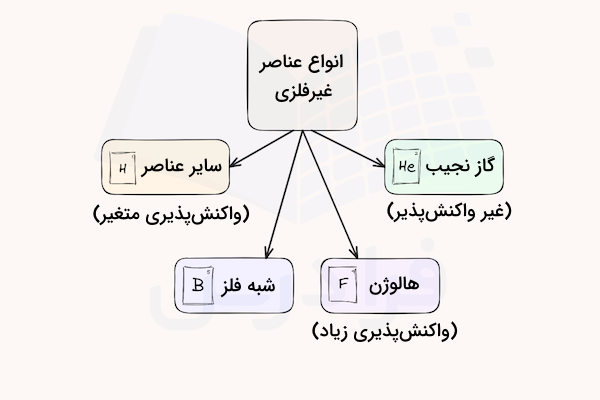
در ادامه هر یک از این گروهها و خواص ویژه آنها را بررسی میکنیم. پیشنهاد میکنیم برای آشنایی بیشتر با خواص تناوبی عناصر مانند بار موثر هسته و تغییرات انرژی یونش در هر گروه جدول تناوبی، فیلم آموزش شیمی معنی ۱ فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
گازهای نجیب
شش عنصر در جدول تناوبی به نام گازهای نجیب شناخته میشوند. این عناصر شامل هلیوم، نئون، آرگون، کریپتون، زنون و رادون (که رادیواکتیو است) هستند. این مواد در آخرین ستون سمت راست جدول تناوبی قرار دارند و به دلیل واکنشپذیری بسیار پایین، به این نام معروف هستند. آرایش الکترونی لایه ظرفیت گازهای نجیب به شکل زیر است.
گازهای نجیب بیرنگ و بدون بو بوده و قابل اشتعال نیستند. به علت کامل بودن لایه الکترونی بیرونی، نیروهای بین اتمی آنها بسیار ضعیف است و به همین دلیل نقطه ذوب و جوش آنها بسیار پایین است. از نظر شیمیایی، جدا کردن الکترون از این عناصر دشوار است، تمایل کمی به جذب الکترون دارند و الکترونگاتیوی بالایی دارند. ترکیبات ساخته شده توسط گازهای نجیب نسبتا زیاد نیست و بیشتر آنها شامل ترکیب اکسیژن یا فلوئور با کریپتون، زنون یا رادون است.
هالوژن ها
هالوژنها از نظر شیمیایی انرژی یونش، میل الکترونی و الکترونگاتیوی بالایی دارند و اکسندههای قوی هستند. این چهار عنصر (فلوئور، کلر، برم و ید) معمولا با فلزات ترکیبات یونی درست میکنند، در حالی که بقیه غیرفلزات به جز اکسیژن، بیشتر با فلزات ترکیبات کووالانسی میسازند.

هیدروژن
هیدروژن در برخی جنبهها مانند فلز رفتار میکند و در برخی دیگر شبیه غیرفلز است. به عنوان مثال، مثل فلزات میتواند در محلول آبی به صورت کاتیون حل شده ظاهر شود. همچنین میتواند جایگزین فلزات قلیایی در ترکیباتی مانند کلریدها و نیتراتها شود و در بعضی کمپلکسهای فلزات قلیایی به صورت غیرفلز عمل کند. هیدروژن این حالتها را با تشکیل پیوند کووالانسی یا یونی، یا با پیوند به جفت الکترون آزاد به صورت یون، به دست میآورد.
هیدروژن با آرایش الکترونی عضوی از گروه ۱ است. اما در واقع، شیمی هیدروژن خیلی شبیه فلزات گروه ۱ نیست. بعضی از نسخههای جدول تناوبی، هیدروژن را بالای فلوئور در گروه ۱۷ قرار میدهند، چون با افزودن یک الکترون به اتم هیدروژن، لایه ظرفیت آن کامل میشود. این اتم، سه ایزوتوپ پروتیوم، دوتریوم و تریتیوم را دارد. وقتی از هیدروژن یا نماد H صحبت میشود، منظور ترکیب طبیعی این سه ایزوتوپ است. اکثر عناصر جدول تناوبی با هیدروژن ترکیب میشوند و ترکیبات حاصل را هیدرید مینامند.
اکسیژن
اکسیژن معمولا در ترکیبات حالت اکسایش منفی دو دارد، اما میتواند حالتهای اکسایش -۲، -۱، -۱/۲، ۰، +۱ و +۲ نیز داشته باشد. حالتهای اکسایش در اکسیدها، پراکسیدها و سوپراکسیدها به صورت زیر است:
- اکسیدها: با حالت اکسایش -۲
- پراکسیدها: با حالت اکسایش -۱
- سوپراکسیدها: با حالت اکسایش -۱/۲
اکسیژن در شرایط عادی با خودش، نیتروژن یا آب واکنش نمیدهد، اما در دمای ۲۰ درجه سانتیگراد و فشار یک اتمسفر در آب حل میشود. این ماده معمولا با بازها یا اسیدها نیز واکنش نمیدهد. فلزات گروه یک (فلزات قلیایی) بسیار واکنشپذیرند و باید دور از اکسیژن نگهداری شوند تا اکسید نشوند.
کربن
کربن در حالت عنصری (غیرترکیبی) به اشکال گوناگونی مانند الماس، گرافیت، زغال، کُک، دوده، گرافن و فولرن وجود دارد. الماس، یک ماده بلوری بسیار سخت است که در حالت خالص، بیرنگ و شفاف است. هر اتم کربن در ساختار الماس، چهار پیوند یگانه با چهار اتم دیگر در گوشههای یک چهاروجهی تشکیل میدهد.
گرافیت، جامدی نرم، لغزنده و خاکستری – سیاه است که رسانایی الکتریکی دارد. گرافیت از لایههایی از اتمهای کربن تشکیل شده است که در هر لایه، هر اتم کربن با سه اتم کربن دیگر در آرایشی مسطح مثلثی احاطه شده است.

فسفر
فسفر تنها عضو گروه خود است که به صورت عنصری در طبیعت یافت نمیشود و در بسیاری از اشکال آلوتروپی وجود دارد. فسفر سفید جامد، مومی و سفید رنگ است که نقطه ذوب آن ۴۴٫۲ درجه سلسیوس و نقطه جوش آن ۲۸۰ درجه سلسیوس است. این عنصر در آب نامحلول است و در آن نگهداری میشود.
فسفر سفید به شکل مولکولهای چهارتایی وجود دارد که چهار اتم فسفر در گوشههای یک چهاروجهی منظم قرار دارند. هر اتم فسفر با سه اتم دیگر پیوند کووالانسی تک برقرار میکند. فسفر سفید فعالترین آلوتروپ فسفر است و بسیار سمی است.

گوگرد
گوگرد دارای چندین آلوتروپ است که رایجترین آنها گوگرد لوزیشکل زرد است و در دمای اتاق پایدار است. گوگرد در دمای ۴۴۵ درجه سلسیوس به جوش میآید و بخار آن شامل مولکولهای دوتایی، ششتایی و هشتتایی است.
ساختار گوگرد طوری است که برای کامل کردن هشت الکترون آخر خود، پیوندهای کووالانسی تشکیل میدهد و در حلقهها و زنجیرهها دو پیوند یگانه میسازد.
واکنش عناصر غیر فلزی
همانطور که در بخشهای قبل آموختیم، عناصر غیر فلزی الکترونگاتیو هستند و میتوانند آنیون تولید کنند. به همین دلیل به خوبی با برخی از مواد واکنش داده و با برخی دیگر وارد واکنش نمیشوند. در ادامه، برخی از واکنشهای این عناصر را بررسی میکنیم.
پیشنهاد میکنیم برای درک بهتر شیوه انجام این واکنشها و پیشبینی فرآوردههای احتمالی آنها، مطلب انواع واکنشهای شیمیایی مجله فرادرس را مطالعه کنید.
واکنش با هوا
بسیاری از عناصر غیرفلزی با هوا وارد واکنش میشوند. به همین دلیل برای نگهداری ایمن و پایدار برخی از این مواد، آنها را درون آب نگهداری میکنند.
واکنش با آب
عناصر غیر فلزی با آب واکنش نمیدهند. به همین دلیل برای جلوگیری از واکنش برخی از مواد با هوا (مانند فسفر که در حضور هوا آتش میگیرد) آنها را در آب نگهداری میکنند. اما اکسیدهای غیر فلزی میتوانند با آب واکنش داده و اسید تولید کنند. برای مثال، واکنش کربن دی اکسید و آب به شکل زیر است.
واکنش با اسید
هیچ یک از عناصر غیر فلزی با اسیدها واکنش نمیدهند.
واکنش با باز
واکنش بین نافزلات و بازها مقداری پیچیده است. واکنش گاز کلر با بازهایی مانند سدیم هیدروکسید، فرآوردههایی مانند سدیم هیپوکلریت، سدیم کلرید و آب تولید میکند. در حالت کلی میتوان گفت که از واکنش اکسیدهای غیر فلزی با باز، نمک و آب تولید میشود. به واکنش کربن دی اکسید و سدیم هیدروکسید دقت کنید.
واکنش با اکسیژن
عناصر غیرفلزی در حضور اکسیژن میتوانند اکسیدهای غیر فلزی تولید کنند. این اکسیدهای تولید شده میتوانند خنثی یا اسیدی باشند. در ادامه، واکنش برخی از نافلزات با اکسیژن آورده شده است.
گوگرد:
کربن:
فسفر:
هیدروژن:
نیتروژن:
واکنش با فلزات
واکنش بین یک عنصر نافلز و فلز یکی از رایجترین واکنشها در شیمی است که ترکیبات یونی را تولید میکند. زیرا اختلاف الکترونگاتیوی بین آنها زیاد است. فلزها کاتیون و نافلزها آنیون تشکیل میدهند و ترکیب حاصل، در شرایط عادی به صورت جامد است. برای مثال، فلز سدیم با نافلز کلر وارد واکنش شده و سدیم کلرید (نمک خورکی) را تولید میکند.
فرآورده واکنش فلزات و نافلزات اغلب یک نمک است. برای مثال، واکنش فلز آلومینیوم و نافلز برم به شکل زیر است.

واکنش اکسیژن با فلزات
لیتیم با اکسیژن واکنش داده و اکسید سفید رنگ لیتیم تولید میکند.
سدیم با اکسیژن واکنش داده و مخلوط سفید رنگی از اکسید سدیم و پراکسید سدیم میسازد.
پتاسیم با اکسیژن واکنش داده و مخلوطی از پراکسید پتاسیم و سوپراکسید پتاسیم تولید میکند.
روبیدیم و سزیم نیز به همین روش سوپراکسید تولید میکنند. فلزات گروه دو (فلزات قلیایی خاکی) نیز با اکسیژن واکنش داده و اکسید فلزی میسازند.
بریلیم به دلیل وجود لایهای از اکسید بریلیم روی سطحش به سختی میسوزد و اجازه واکنش بیشتر با اکسیژن را نمیدهد. ژرمانیوم، قلع و سرب با اکسیژن واکنش داده و مونوکسیدها و دیاکسیدهای آمفوتری (واکنش با اسید و باز) تولید میکنند.
واکنش های نیتروژن
نیتروژن مانند کربن میتواند حداکثر چهار پیوند جفتالکترونی ایجاد کند. این عنصر، میتواند با خودش و سایر عناصر دوره دوم پیوند دو یا سهگانه تشکیل دهد. شکل پایدار این ماده مولکول دو اتمی نیتروژن با یک پیوند سه گانه قوی است.
این نافلز با هیدروژن ، هیدروژن و غیرفلزات واکنش داده و ترکیباتی اغلب کووالانسی و مولکولی تشکیل میدهد. در دمای بالا با هیدروژن واکنش داده و آمونیاک تولید میکند.
تولید آمونیاک:
همچنین نیتروژن دی اکسید نیز از ترکیب این نافلز با اکسیژن تشکیل میشود. نیتریدهایی که از واکنش این ماده با برخی فلزات تشکیل میشود و هیدرازین از واکنش آن با هیدروژن نیز از دیگر ترکیبات مهم تشکیل شده از این عنصر غیرفلزی است.
تولید هیدرازین:
واکنش های فسفر
فسفر با فلزات واکنش داده و فسفیدها را تولید میکند. فسفیدهای غنی از فلز، جامداتی سخت، با نقطهذوب بالا، رسانایی الکتریکی و جلای فلزی هستند، در حالی که فسفیدهای غنی از فسفر که شامل واحدهای زنجیرهای فسفر به هم پیوسته هستند، دارای نقطهذوب پایینتر و پایداری حرارتی کمتر میباشند.
در گروه ۱۵، نیتروژن و فسفر از نظر شیمیایی مانند نافلزها رفتار میکنند، آرسنیک و آنتیموان مانند شبهفلزها، و بیسموت مانند یک فلز رفتار میکند. چند مثال از واکنش تولید فسفیدها در ادامه آورده شده است.
سایر عناصر
اغلب عناصر دیگر گروه ۱۵ و ۱۶ جدول تناوبی، غیر فلز هستند و به همین دلیل ترکیبات مشابهی را تشکیل میدهند. پایدارترین شکل گوگرد، حلقههای است که به شکل «میللنگ» کنار هم چیده شدهاند. گوگرد مذاب شامل زنجیرههای بلند S – S است.
هر دو عنصر S و Se میتوانند پلیسولفیدها و پلیسلنیدها را تشکیل دهند. همچنین، این ترکیبات با فلوئور واکنش داده و ترکیبات مختلفی را تشکیل میدهند. ترکیبات تشکیلشده بین دو یا چند نافلز، اختلاف الکترونگاتیوی کمی دارند و پیوند کووالانسی (اشتراک الکترونها) ایجاد میشود. این مواد معمولا ماهیت مولکولی دارند و در دمای اتاق و فشار معمولی، به صورت گاز، مایع یا جامد فرار هستند.

یادگیری شیمی عمومی با فرادرس
برای درک بهتر خواص انواع عناصر غیرفلزی و فلزی نیاز است با مفاهیمی چون مفهوم پیوند، انرژی یونش، آرایش الکترونی، رفتار گازها و … آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه خواص مواد دسترسی داشته باشید.
کاربرد عناصر غیر فلزی
عناصر غیر فلزی در بسیاری از صنایع و واکنشهای شیمیایی شرکت میکنند. این عناصر به دلیل الکترونگاتیوی بالا میتوانند با بسیاری از عناصر دیگر، ترکیبات گوناگونی را به وجود آورند. در ادامه این مطلب از مجله فرادرس، برخی از کاربردهای این عناصر را نام میبریم.
صنایع کشاورزی
از عنصر نیتروژن در تولید ماده شیمیایی ارزشمند آمونیاک و تولید کودهای شیمیایی استفاده میشود.
تصفیه آب
عنصر غیر فلزی کلر به عنوان یکی از اصلیترین مواد افزوده شده به آب برای تصفیه و میکروبزدایی از آن است.
سوخت و تولید انرژی
از ماده هیدروژن در تولید و استفاده مستقیم به عنوان سوخت در بسیاری از موارد مانند موشکها استفاده میشود. نیتروژن مایع به طور گسترده به عنوان خنککننده استفاده میشود. اکسیژن بخش مهمی از هوایی است که تنفس میکنیم و در جوشکاری، برشکاری و سوختهای موشک کاربرد دارد.
سایر کاربردها
مزایای گوناگون مواد غیر فلزی باعث شده که این مواد در طیف وسیعی از کاربردهای عملی مورد استفاده قرار گیرند. در ادامه برخی دیگر از این کاربردها را نام میبریم.
- عایقها: از آنجا که قطعات غیر فلزی رسانای برق نیستند، برای عایقکاری قطعات و سیمکشیهای الکتریکی مناسباند.
- تولید نفت و گاز: مقاومت در برابر خوردگی و سبکی مواد غیر فلزی، آنها را برای استفاده در لولهها و پوششهای داخلی صنعت نفت و گاز مناسب میسازد.
- ساخت خودرو، هواپیما و کشتی: به دلیل سبک بودن، بسیاری از قطعات غیر فلزی مانند پلاستیک و فایبرگلاس در صنایع خودروسازی، هوافضا و دریایی استفاده میشوند.
- نوارها و چسبها: مواد غیر فلزی به دلیل مقاومت در برابر شرایط شدید مانند خوردگی و حرارت، در تولید نوارها و چسبها کاربرد دارند.
همچنین این عناصر به علت کارایی در شرایط مختلف، برای آببندی مناسباند و در موادی مانند فوم و لاستیک در طیف وسیعی از کاربردها به کار میروند.
source
