هموگلوبین پروتئینی است که به کمک حضور آن در گلبولهای قرمز، اکسیژن به سادگی و با سرعت بالا در خون جابهجا میشود. این پروتئین در بدن اکثر مهرهداران وجود دارد و اکسیژن را از اندامهای تنفسی مانند ششها یا آبششها به نقاط و بافتهای مختلف بدن میبرد. هموگلوبین میتواند با اتصال به کربن دیاکسید این گاز را هم به جابهجا کند و با انتقال آن به اندامهای تنفسی به دفع کربن دیاکسید از بدن کمک کند. با توجه به این فعالیت بسیار مهم هموگلوبین، تصمیم گرفتیم در این مطلب از مجله فرادرس به این موضوع بپردازیم که هموگلوبین چیست و چرا حضور آن در گلبولهای قرمز خون از اهمیتی حیاتی برخوردار است.
آنچه در این مطلب میآموزید:
-
یاد میگیرید هموگلوبین چیست و چرا فعالیت آن برای ادامه حیات ما ضروری است.
-
با جزء به جزء ساختار هموگلوبین یعنی پروتئینهای سازنده و مولکول هِم آشنا میشوید.
-
فعالیتهای مختلف هموگلوبین مانند انتقال اکسيژن، مونوکسید کربن و غیره را میشناسید.
-
مراحل مختلفی که برای سنتز هموگلوبین طی میشود را میآموزید.
-
مدلهای مختلفی که برای درک تنظیم فعالیت هموگلوبین ارائه شدهاند را یاد میگیرید.
-
با انواع بیماریهای مرتبط با هموگلوبین مانند تالاسمی و کم خونی داسیشکل آشنا میشوید.

برای درک بهتر فعالیت هموگلوبین و نحوه اتصال اکسیژن یا دیگر گازهای تنفسی به آن، باید ساختار هموگلوبین را به خوبی بشناسیم، بنابراین در دومین بخش این مطلب با ساختار هموگلوبین آشنا میشویم تا در ادامه به سراغ فعالیت این پروتئین، انواع آن و حتی روش سنتز آن در گلبولهای قرمز برویم. فرایند اتصال اکسیژن به هموگلوبین و شیوه جدا شدن آن از این پروتئین نکات خاصی دارد که در بخشی جداگانه به بررسی آنها میپردازیم. پس از تسلط بر این که ساختار و فعالیت هموگلوبین چیست، با روش تجزیه این مولکول نیز آشنا میشویم تا در نهایت بخش کوتاهی را به بیماریهای مرتبط با هموگلوبین اختصاص دهیم.
هموگلوبین چیست؟
«هموگلوبین» (Hemoglobin | Hb) پروتئینی کروی است که در گلبولهای قرمز وجود دارد و مسئول انتقال اکسیژن از اندامهای تنفسی به بافتهای مختلف بدن است. بنابراین برای تامین نیاز بافتهای بدن به اکسیژن باید همیشه سطح مناسبی از هموگلوبین در خون وجود داشته باشد.
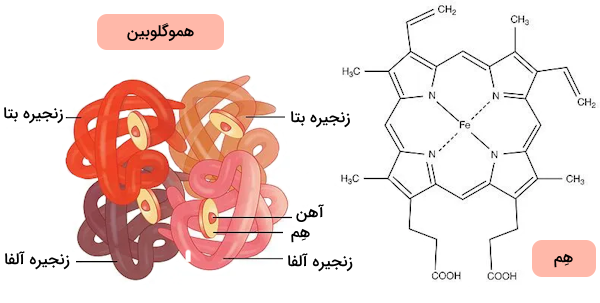
در ساختار هموگلوبین، یون آهن وجود دارد، به همین دلیل آن را در دسته «متالوپروتئینها» (Metalloprotein) قرار میدهیم. هموگلوبین یک «کروموپروتئین» (Chromoprotein) و حتی یک گلوبولین نیز هست. کروموپروتئینها دستهای از پروتئینها هستند که در ساختار خود کوفاکتوری رنگی دارند که به طور معمول یک مولکول غیرپروتئینی است و به واسطه اتصال آن به پروتئین، پروتئین مورد نظر مسئول عملکرد زیستی خاصی میشود. آهن موجود در هموگلوبین باعث شده است که این پروتئین یک کروموپروتئین باشد و رنگ قرمز گلبولهای قرمز و خون را ایجاد کند.
علاوه بر اکسیژن، هموگلوبین گازهای دیگر مانند کربن دیاکسید را منتقل میکند. هموگلوبین حدود ۲۰ الی ۲۵ درصد کل کربن دیاکسید حاصل از تنفس را به سمت ششها میبرد. کربن دیاکسید به قسمت پروتئين هم در ساختار هموگلوبین متصل میشود اما گاز نیتریک اکسید به گروه تیول در بخش گلوبین این پروتئین متصل میشود. نیتریک اکسید یک مولکول تنظیمی مهم در بدن است که میتواند به هموگلوبین متصل شود و همزمان با آزادسازی اکسیژن از هموگلوبین جدا شود.
میزان طبیعی هموگلوبین
میزان طبیعی هموگلوبین خون که بر حسب «گرم بر دسیلیتر» (g/dl) بیان میشود، در مردان و زنان یکسان نیست. سطح طبیعی هموگلوبین در مردان بین ۱۴ تا ۱۸ گرم بر دسیلیتر و در زنان بین ۱۲ تا ۱۶ گرم بر دسیلیتر است؛ اما برای تعیین میزان طبیعی هموگلوبین نباید تنها به جنسیت افراد توجه کنیم، زیرا سطح هموگلوبین طبیعی بر اساس جنسیت، سن و سطح سلامت افراد تعیین میشود. در جدول زیر میزان هموگلوبین طبیعی در سنهای مختلف را معرفی میکنیم.
| سن فرد | سطح طبیعی هموگلوبین بر حسب گرم بر دسیلیتر |
| نوزاد | ۱۴ تا ۲۴ |
| ۲ هفته | ۱۳ تا ۲۰ |
| ۳ ماه | ۹/۵ تا ۱۴/۵ |
| ۶ ماه تا ۶ سال | ۱۰/۵ تا ۱۴ |
| ۶ سال تا ۱۲ سال | ۱۱ تا ۱۶ |
| مرد بالغ | ۱۴ تا ۱۸ |
| زن بالغ | ۱۲ تا ۱۶ |
پایین بودن سطح هموگلوبین خون باعث میشود که فرد درگیر کم خونی یا آنمی شود، اما اگر سطح این پروتئین بالاتر از حد طبیعی آن باشد، متوجه میشویم که اریتروسیتوز (Erythrocytosis) رخ داده است. اریتروسیتوز به معنی افزایش تعداد گلبولهای قرمز خون است.
شناخت مولکولهای زیستی و نحوه فعالیت آنها با فرادرس
هموگلوبین یکی از مهمترین پروتئينهای بدن است اما سلولها و بافتهای مختلف ما صدها هزار پروتئین مختلف تولید میکنند که برای ادامه حیات ما ضروری هستند. این پروتئینها نه تنها سازنده بخش بزرگی از ساختار سلولها هستند، بلکه بسیاری از فعالیتهای سلولی بدون آنها امکانپذیر نیست. بجز پروتئینها در سلولها و بافتها شاهد حضور و فعالیت لیپیدها، کربوهیدراتها و نوکلئیک اسیدها هستیم که وظایف زیستی دیگری را بر عهده دارند.
برای شناخت بهتر فعالیت مولکولهای مختلف میتوان از منظر زیستشناسی سلولی و مولکولی به آنها نگاه کرد اما از طرفی برای شناخت مولکولهایی مثل هموگولبین بهتر است فیزیولوژی بدن را یاد بگیریم، بنابراین انتخاب مسیر یادگیری بسیار وابسته به موضوعی است که قصد مطالعه آن را داریم. در ادامه لینک دسترسی به فیلمهای آموزشی مرتبط به مولکولهای زیستی مختلف را در اختیار شما قرار میدهیم.

ساختار مولکولی هموگلوبین چیست؟
پروتئین هموگلوبین دارای «ساختار چهارگانه» (Quaternary structure) است، زیرا در ساختار آن چهار زنجیره پلیپپتیدی وجود دارند. در اصل هر مولکول هموگلوبین از چهار زنجیره پلیپپتیدی گلوبین تشکیل شده است و هر زیرواحد گلوبین، یک گروه «هم» (Heme) دارد که از اجزای زیر تشکیل شده است.
- یک «حلقه آلی پروتوپورفیرین» (Organic Protoporphyrin Ring)
- یک یون آهن در حالت دو ظرفیتی یا «آهن فرو» ()
برای شناخت دقیق هموگلوبین پیشنهاد میکنیم که با ساختار پروتئینها و مفاهیم مرتبط به آن به خوبی آشنا باشید. فیلم آموزش شیمی پروتئین ها فرادرس منبع موثقی برای یادگیری نکات مربوط به این زمینه است، به همین دلیل لینک دسترسی به آن را در کادر زیر درج کردهایم.
چهار زیرواحد گلوبین توسط پیوندهای دیسولفیدی به یکدیگر متصل میشوند و به گونهای در کنار هم قرار میگیرند که گروههای R آمینواسیدهای آبگریز به سمت داخل و گروههای R آمینواسیدهای آبدوست به سمت خارج پروتئین قرار بگیرند. این آرایش فضایی باعث حفظ شکل کروی سه بعدی هموگلوبین میشود. علاوه بر این، به کمک این آرایش فضایی خاص هموگلوبین در محیطهای آبی مانند خون، محلول است.
آرایش فضایی گروه R آمینواسیدها برای فعالیت صحیح هموگلوبین به حدی مهم است که در صورت تغییر توالی آمینواسیدهای ممکن است خواص هموگلوبین تغییر کند. این تغییر زمانی اهمیت بیشتری پیدا میکند که یک آمینواسید آبدوست با یک آمینواسید آبگریز یا برعکس جابهجا شوند.
به عنوان مثال در بیماری «کمخونی داسیشکل» (Sickle Cell Anaemia) یک آمینواسید والین به جای آمینواسید گلوتامیک اسید در رشته بتا گلوبین قرار میگیرد. والین یکی از آمینواسیدهای آبگریز است اما گلوتامیک اسید آمینواسیدی آبدوست است و قرارگیری والین به جای گلوتامیک اسید باعث تغییر آرایش فضایی هموگلوبین میشود.
اهمیت حضور آهن فرو در ساختار هموگلوبین در این نکته است که مولکول اکسیژن به صورت برگشتپذیر به آهن متصل میشود و ترکیب «اکسیهموگلوبین» (Oxyhaemoglobin) را ایجاد میکند که باعث میشود رنگ هموگلوبین به صورت قرمز روشن در بیاید.
گفتیم که هر زیر واحد گلوبین دارای یک گروه هم است، بنابراین در ساختار هر هموگلوبین ۴ گروه هم وجود دارند که هر کدام از آنها میتوانند به یک مولکول اکسیژن متصل شوند، بنابراین هر هموگلوبین میتواند به ۴ مولکول اکسیژن یا ۸ اتم اکسیژن متصل شود.
ساختار بخش پروتئینی
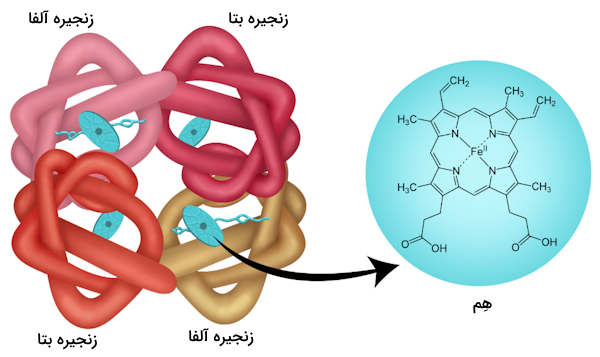
ساختار بخش پروتئینی هموگلوبین را در چهار سطح میتوان بررسی کرد.
- ساختار اول
- ساختار دوم
- ساختار سوم
- ساختار چهارم
ساختار اولیه به تعداد و توالی آمینواسیدهای موجود در زنجیره پپتیدی اشاره دارد. یک مولکول هموگلوبین از چهار زنجیره پپتیدی تشکیل شده است.
- دو زنجیره آلفا (α): هر زنجیره آلفا شامل ۱۴۱ آمینواسید است.
- دو زنجیره بتا (β): هر زنجیره بتا شامل ۱۴۶ آمینواسید است.
بنابراین برای ساخت یک مولکول هموگلوبین به ۵۷۴ آمینواسید نیاز داریم. نکته مهمی که در مورد زنجیرههای آلفا و بتا باید به یاد داشته باشیم این است که توالی آمینواسیدهای موجود در زنجیرههای آلفا با بتا متفاوت است و هرگونه تغییر در این توالی طبیعی، موجب اختلال در عملکرد هموگلوبین میشود.
ساختار دوم به آرایش پایدار زنجیرههای پپتیدی اشاره دارد. در هموگلوبین هر دو زنجیره آلفا و بتا به صورت ساختار مارپیچ آلفا (α-helix) در میآیند که توسط پیوندهای هیدروژنی پایدار میشوند. وجود آمینواسید پرولین یا ایجاد حلقهها و خمیدگیهای بتا باعث پایان یافتن این مارپیچها و اتصال بخشهای مختلف به یکدیگر میشوند.
ساختار سوم به وسیله تاخوردگی زنجیرههای پپتیدی برای ایجاد شکل کروی ایجاد میشود. برای تشکیل ساختار کروی پروتئین زنجیرههای آلفا و بتا تا میخورند و در این تاخوردگی شیوه قرارگیری آمینواسیدهای مختلف به صورت زیر است.
- آمینواسیدهای «آبدوست» (Hydrophilic) در سطح مولکول قرار میگیرند.
- آمینواسیدهای «آبگریز» (Hydrophobic) درون ساختار کروی پنهان میشوند.
مولکول هموگلوبین حاصل کنار هم قرار گرفتن چهار زیرواحد است و به همین دلیل «تترامر» (Tetramer) محسوب میشود. ساختار چهارم پروتئین به شیوه سازماندهی زیرواحدهای پلیپپتیدی در یک مولکول اشاره دارد. با توجه به این که یک مولکول هموگلوبین از چهار زیرواحد ساخته شده است، یک تترامر به حساب میآید که در اصل از دو دایمر آلفا-بتا تشکیل شده است.
نیروهایی که باعث انسجام ساختار چهارم و کنار هم ماندن مولکولها میشوند را در ادامه توضیح میدهیم.
- درون هر دایمر: برهمکنشهای آبگریز
- بین دو دایمر: برهمکنشهای قطبی ضعیف، یعنی پیوندهای یونی و هیدروژنی
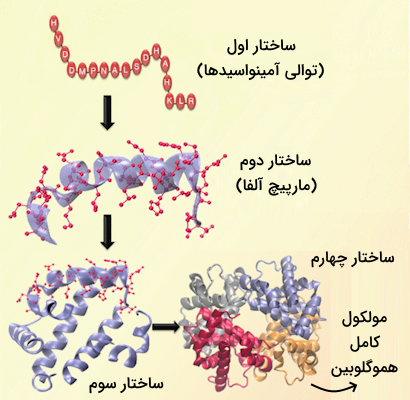
این برهمکنشهای ضعیف به دایمرها اجازه میدهند نسبت به موقعیت یکدیگر حرکت کنند و همین امر باعث تفاوت ساختاری هموگلوبین در حالتهای اکسیژندار و فاقد اکسیژن میشود. بر اساس همین اتصال یا عدم اتصال اکسیژن، هموگلوبین میتواند دو شکل متفاوت داشته باشد.
- فرم T یا فرم سخت: این فرم مربوط به حالتی است که اکسیژن به هموگلوبین متصل نیست. در این حالت دایمرها توسط پیوندهای یونی و هیدروژنی محکم به هم متصلاند و حرکت زنجیرهها محدود است.
- فرم R یا فرم راحت: این فرم به حالتی اشاره دارد که اکسيژن به هموگلوبین متصل است. در حقیقت اتصال اکسیژن باعث شکستن برهمکنشهای ضعیف بین دایمرها میشود، بنابراین زنجیرههای پپتیدی آزادی حرکت بیشتری پیدا میکنند.
در صورتی که تمایل به درک بهتر ساختارهای مختلف هموگلوبین دارید، پیشنهاد میدهیم مطلب «سطوح مختلف ساختاری پروتئین ها چیست؟ – به زبان ساده» از مجله فرادرس را مطالعه کنید.
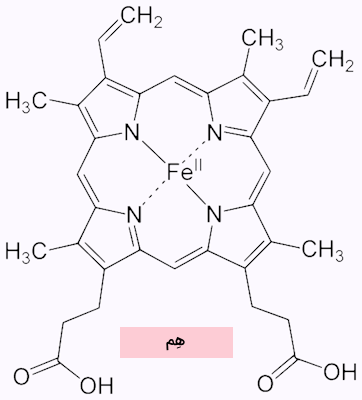
ساختار هِم
در بخش قبل نیز گفتیم که هِم ترکیبی از آهن و پورفیرین است، در حقیقت هِم مهمترین جزء ساختمانی هموگلوبین به حساب میآید. این ترکیب بهعنوان یک گروه پروستتیک عمل میکند و در ساختار پاکتمانندی جای گرفته که در نتیجه تاخوردگی ساختار سوم هموگلوبین ایجاد شده است.
هِم ترکیبی است که از پروتوپورفیرین IX و یک یون آهن دو ظرفیتی () تشکیل شده است. هِم یک مولکول حلقوی و مسطح است که در مرکز آن یون آهن قرار دارد. آهن دو ظرفیتی میتواند دو پیوند اضافی، یعنی یک پیوند با مولکول اکسیژن و دیگری با یک آمینواسید، برقرار کند. این پیوندها در دو سوی حلقه مسطح پروتوپورفیرین شکل میگیرند.
هر گروه هِم با یکی از زنجیرههای پلیپپتیدی هموگلوبین جفت میشود. اتصال هِم به زنجیره آلفا یا بتا از طریق پیوندی میان یون آهن و زنجیره جانبی هیستیدین صورت میگیرد. بنابراین، در هر مولکول هموگلوبین چهار گروه هِم وجود دارد و به همین دلیل، هر مولکول هموگلوبین میتواند چهار مولکول اکسیژن را حمل کند.
ویژگیهای منحصر به فرد هِم
هم مولکولی ویژه است که ویژگیهای شیمیایی و فیزیکی آن باعث شده است از لحاظ زیستی اهمیت بسیار بالایی داشته باشد. به عنوان مثال در ساختار مولکول هِم بخشی را میبینیم که خاصیت آبدوستی دارد و بخشی نیز خاصیت آبگریزی دارد.
- بخش آبدوست: اتم آهن مرکزی
- بخش آبگریز: گروههای متیل و وینیل بخش خارجی مولکول
وجود هر دو بخش آبگریز و آبدوست باعث میشود که مولکول هِم بتواند در بخشهای مختلف پروتئینها جاگیری کند، به عنوان مثال از این ویژگی هم در هنگام تغییر ساختار هموگلوبین و هم در هنگام اتصال به اکسیژن و آزادسازی آن به بافتها استفاده میشود.
ویژگی قابل توجه دیگری که هِم دارد، ظرفیت اتصال لیگاندها است. آهن میتواند به ۶ لیگاند متصل شود. در ساختار هِم اتمهای نیتروژن پورفیرین به چهار جایگاه متصل شدهاند بنابراین تنها دو جایگاه آزاد باقی میماند که در ادامه توضیح میدهیم هر کدام از آنها با چه مولکولهایی ارتباط برقرار میکنند.
- شاخه جانبی ایمیدازول که مربوط به آمینواسید هیستیدین ساختار پروتئین است.
- یک مولکول گازی که میتواند اکسیژن، کربن مونوکسید، نیتریک اکسید یا هیدروژن سولفید باشد.
با توجه به توانایی این مولکول در اتصال به گازهای مختلفی که نام بردیم، هِم را به عنوان یک حامل برای مولکولهای کوچک میشناسیم.
سومین ویژگی هِم نیز به اتم آهن موجود در ساختار آن برمیگردد. آهن میتواند بین حالتهای «فرو» () و «فریک» () تغییر وضعیت بدهد و به همین دلیل قابلیت شرکت در واکنشهای اکسایش-کاهش را برای مولکول هِم فراهم میکند.
وظایف هموگلوبین چیست؟
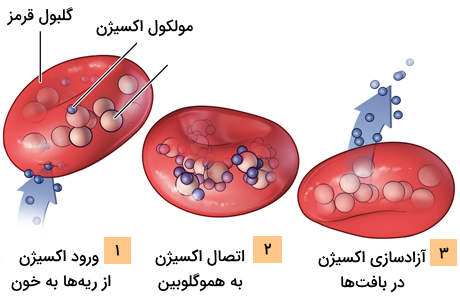
هموگلوبین مسئول اتصال به مولکولهای اکسیژن در دستگاه تنفسی، به طور خاص در انسان در ریهها و انتقال آنها به بافتهای مختلف برای استفاده سلولها در تنفس هوازی است. میزان انحلال اکسیژن در آب پایین است اما هموگلوبین به طور کامل محلول در آب است، به همین دلیل اتصال اکسیژن به هموگلوبین باعث میشود که اکسیژن بهطور موثرتری در سراسر بدن جابهجا شود.
وجود گروه هِم و یون آهن دو ظرفیتی در ساختار هموگلوبین باعث شده است که مولکولهای کوچکی مانند اکسیژن به راحتی به این پروتئین متصل شوند. با اتصال هر مولکول اکسیژن به هموگلوبین، ساختار هر چهار پلیپپتید ساختار هموگلوبین دچار تغییر میشود و دلیل این تغییر شکل نیز ایجاد تغییراتی در ساختار سوم پروتئین است. با وجود آن که فعالیت اصلی هموگلوبین انتقال اکسیژن است، این مولکول وظایف دیگری نیز دارد که در ادامه آنها را نام میبریم.
- انتقال کربن دیاکسید
- فعالیت به عنوان بافر
- پاکسازی نیتریک اکسید
در ادامه بخشهایی مجزا را به توضیح هر یک از این وظایف اختصاص میدهیم.
انتقال اکسیژن
هموگلوبین ظرفیت حمل اکسیژن خون را ۵۰ تا ۱۰۰ برابر افزایش میدهد. میل هموگلوبین به ترکیب با اکسیژن توسط «منحنی تفکیک اکسیژن از هموگلوبین» (Oxygen–Hemoglobin Dissociation Curve) توصیف میشود که شکل سیگموئیدی آن در تصویر زیر مشخص است.
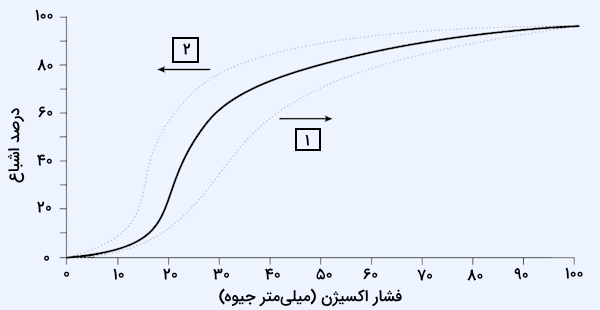
در این تصویر پیکان شماره ۱ مربوط به کاهش میل هموگلوبین به اکسیژن است، این کاهش میل ترکیبی به دلیل عوامل زیر رخ میدهد.
- سطح بالای کربن دیاکسید
- pH پایین
- دمای بالا
پیکان شماره دو نیز مربوط به زمانی است که عوامل زیر باعث افزایش میل هموگلوبین به اکسیژن میشوند.
- سطح پایین کربن دیاکسید
- pH بالا
- دمای پایین
همانطور که دیدیم حرکت منحنی تفکیک اکسیژن از هموگلوبین به سمت راست یا چپ تحت تاثیر عوامل محیطی است، در بخش عوامل موثر بر اتصال اکسیژن به هموگلوبین با جزئیات کامل شیوه اعمال اثر هر یک از این موارد را بررسی خواهیم کرد. دلیل سیگموئیدی یا S-شکل بودن نمودار بالا را به صورت زیر میتوان توضیح داد.
- در فشار اکسیژن بالا، مانند ریهها، میل ترکیبی هموگلوبین افزایش یافته و برداشت اکسیژن را تقویت میکند.
- در فشار اکسیژن پایین، مانند بافتها، میل ترکیبی هموگلوبین کاهش یافته و آزادسازی اکسیژن را تسهیل میکند.
انتقال کربن دی اکسید
هموگلوبین زمانی که به اکسیژن متصل نیست، تمایل زیادی به ترکیب با دارد ولی زمانی که به اکسیژن متصل میشود، میل آن برای اتصال به کربن دیاکسید کاهش یافته و را آزاد میکند.
اتصال به هموگلوبین از آن جهت مهم است که حدود ۱۰ تا ۲۰ درصد انتقال کل خون از این طریق انجام میشود، بنابراین هموگلوبین در انتقال به ریهها نیز نقش مهمی دارد. هموگلوبین به صورت غیر مستقیم نیز در انتقال کربن دیاکسید از طریق نقش بافری خود اثرگذار است.
کربن دیاکسید در بافتها پس از آزادسازی از سلولها، بلافاصله با آب واکنش داده و به کربنیک اسید» (Carbonic Acid) تبدیل میشود. پروتونهای حاصل آزاد شده از کربنیک اسید به هموگلوبین متصل و یونهای بیکربنات در خون حل میشوند. بنابراین کربن دیاکسید به طور عمده به صورت یونهای بیکربنات به ریه منتقل میشود.
هنگامی که خون به ریه میرسد، فشار جزئی بالای اکسیژن، یونهای هیدروژن را از هموگلوبین جدا میکند. این یونهای هیدروژن با یونهای بیکربنات ترکیب شده و کربنیک اسید را تشکیل میدهند. آنزیم کربنیک انهیدراز، کربنیک اسید را به آب و کربن دیاکسید تجزیه میکند. با توجه به این که فشار جزئی کربن دیاکسید در خون بیشتر از فشار آن در هوا است، این گاز در ریهها از خون خارج شده یا به بیان بهتر به درون هوای موجود در آلوئولها انتشار مییابد.
نقش بافری
هموگلوبین یک بافر خارجسلولی مهم در بدن انسان است. این پروتئین با فرایندی به نام «اثر بوهر» (Bohr’s Effect) به تنظیم pH خون کمک میکند. هموگلوبین از جمله فراوانترین پروتئینهای موجود در بدن است، به همین دلیل این پروتئین سهم عمدهای از توان بافری مایع خارج سلولی را بر عهده دارد؛ بهطوریکه در محاسبه «Base Excess | BE» استاندارد نیز لحاظ میشود. منظور از Base Excess، مقدار اسید یا بازی است که برای بازگرداندن pH نمونه خون یک فرد دچار کمخونی لازم است.
در ساختار پروتئینی هموگلوبین آمینواسیدهای هیستیدینی وجود دارند که شاخه جانبی آنها دارای pKa حدود ۶٫۸ میباشند. حضور این هیستیدینها باعث میشود که هموگلوبین در pH فیزیولوژیک نقش یک بافر را ایفا کند، زیرا گروههای هیستیدین میتوانند پروتون بپذیرند. نکتهای که در مورد این ظرفیت بافری باید بدانیم این است که ظرفیت بافری هموگلوبین در حالتی که هموگلوبین به اکسیژن متصل نیست، افزایش مییابد.
کربن دیاکسیدی که در نتیجه متابولیسم سلولی تولید میشود، با آب واکنش داده و کربنیک اسید را میسازد. سپس اسید کربنیک تجزیه میشود تا یونهای هیدروژن آزاد شوند. این یونهای هیدروژن به زنجیرههای جانبی آمینواسیدهای هیستیدین در هموگلوبین متصل میشوند. اتصال یونهای هیدروژن موجب میشود هموگلوبین در بافتهای متابولیک، اکسیژن خود را آزاد کند. به کمک تصویر زیر میتوانید درک بهتری از این موضوع به دست آورید که نقش بافری هموگلوبین چیست.
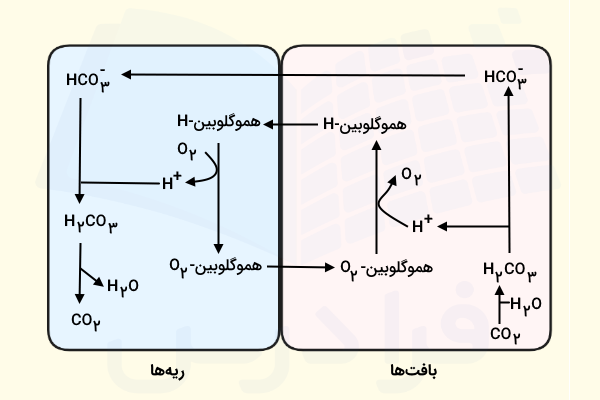
به این ترتیب، یونهای هیدروژن توسط هموگلوبین به کار گرفته شده و از کاهش pH خون جلوگیری میکنند. اما اهمیت این اثر بافتی هموگلوبین در چیست؟ اگر این اثر بافری هموگلوبین وجود نداشت، متابولیسم سلولی منجر به کاهش قابلتوجه pH خون میشد. البته نباید فراموش کرد که برآوردها نشان میدهند که نقش بافری هموگلوبین ۵۰ تا ۶۰ درصد از کل ظرفیت بافری خون را تشکیل میدهد و بقیه مربوط به بیکربنات و سایر پروتئینها است.
پاکسازی نیتریک اکسید
نیتریک اکسید یک رادیکال آزاد است که به عنوان یک میانجی برای فرآیند گشاد شدن عروق خونی فعالیت دارد و در روند درمان از استنشاق آن برای گشاد کردن عروق ریوی استفاده میکنند. این مولکول تمایل بالایی برای اتصال به هموگلوبین دارد. در اصل نیتریک اکسید میتواند به سرعت به آهن دو ظرفیتی متصل شده و «نتیروزیلهموگلوبین» (Nitrosylhaemoglobin) را تشکیل دهد.
میل اتصال NO به هموگولبین به حدی بالاست که تنها عامل محدودکننده پاکسازی کامل نیتریک اکسید، میزان پایین هموگلوبین است؛ یعنی اگر به میزان کافی هموگلوبین داشته باشیم، تمام نیتریک اکسید موجود به هموگلوبین متصل میشود.
نیمهعمر طبیعی نیتریک اکسید در پلاسمای خون حدود ۱ دقیقه است اما اگر غلظت هموگلوبین ۱۰ میلی مول بر لیتر باشد، نیمهعمر NO در محلول به حدود ۱ میکروثانیه کاهش مییابد. به عبارت دیگر، هیچ راهی وجود ندارد که نیتریک اکسید بتواند به عنوان یک عامل شلکننده اندوتلیال عمل کند. اگر مقداری NO در سطح اندوتلیوم یعنی سطح داخلی عروق، تولید شود و بلافاصله در معرض هموگلوبین قرار گیرد، در نیمهعمر ۱ میکروثانیه، یک مولکول NO تنها میتواند حدود ۰/۱ میکرومتر از محل تولیدش فاصله بگیرد، بنابراین هیچوقت به عضله صاف رگهای خونی یا بخشهای دیگر نمیرسد.
دلیل این که نیتریک اکسید از جریان خون به طور کامل حذف نمیشود این است که هموگلوبین داخل گلبولهای قرمز قرار دارد و میزان هموگلوبین آزاد خون پایین است. وجود هموگلوبینها در گلبولهای قرمز باعث افزایش فاصله نفوذ مولکولهای NO و افزایش نیمهعمر آن میشود. بنابراین، هموگلوبین با فعالیت به عنوان تنظیمکننده میزان نیتریک اکسید در خون، به خودتنظیمی جریان خون در هر منطقه کمک میکند. به طور خاص، این مکانیزم تضمین میکند که اثرات نیتریک اکسید بر روی عروق تحت کنترل باقی بمانند.
انواع هموگلوبین
هموگلوبین طبیعی انسان را میتوان بر اساس نوع زیرواحدهای غیر آلفا به سه دسته اصلی تقسیم کرد که در ادامه آنها را نام میبریم.
- هموگلوبین A
- هموگلوبین A۲
- هموگلوبین F
بجز این سه نوع هموگلوبین، ممکن است هموگلوبینهای دیگری نیز در خون دیده شوند که مربوط به اشکال غیرطبیعی یا جهش یافته هموگولبین هستند. در ادامه سه مورد از این هموگلوبینهای غیرطبیعی را نام میبریم.
- هموگلوبین E
- هموگلوبین S
- هموگلوبین C
هموگلوبین S مربوط به کمخونی داسیشکل است.
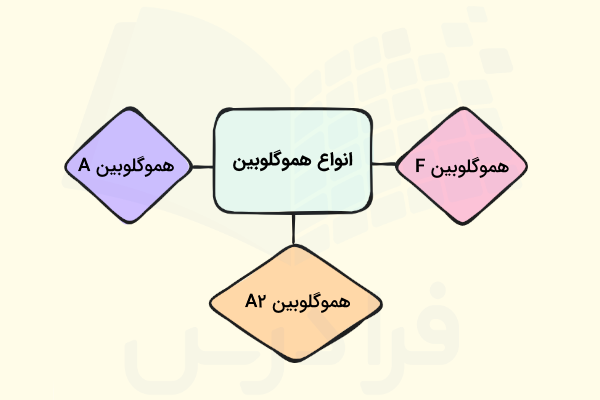
هموگلوبین A
این نوع هموگلوبین شکل غالب هموگلوبین در بزرگسالان است، به بیان دیگر حدود ۹۵ تا ۹۸ درصد کل هموگلوبین یک انسان بالغ از نوع هموگلوبین A است. ساختار این هموگلوبین از دو زیرواحد آلفا (α) و دو زیرواحد بتا (β) تشکیل شده است؛ بنابراین ساختاری که به عنوان ساختار هموگلوبین معرفی کردیم مربوط به هموگلوبین A است.
هموگلوبین A۲
حدود ۲ تا ۳ درصد از هموگلوبین موجود در خون یک فرد بالغ از نوع هموگلوبین A۲ است. این نوع شامل دو زیرواحد آلفا (α) و دو زیرواحد دلتا (δ) است.
هموگلوبین F
هموگلوبین F، هموگلوبین موجود در خون جنین و نوزادان است اما در افراد بالغ نیز به میزان بسیار کم، کمتر از ۱ درصد، وجود دارد. ساختار هموگلوبین F شامل دو زیرواحد آلفا (α) و دو زیرواحد گاما (γ) است.
سنتز هموگلوبین
حالا که فهمیدیم هموگلوبین چیست، باید به بررسی شیوه ساخت این مولکول حیاتی نیز بپردازیم. هموگلوبین در مسیری پیچیده که چندین مرحله دارد تولید میشود. گروه هم در چند مرحله به خصوص در میتوکندری و سیتوزول گلبولهای قرمز نابالغ تولید میشود. بخشهای پروتئین گلوبین نیز توسط ریبوزومها در سیتوزول ساخته میشوند.
تولید هموگلوبین در طول مراحل اولیه رشد سلول، از مرحله «پرواریتروبلاست» (Proerythroblast) تا «رتیکولوسیت» (Reticulocyte)، در مغز استخوان ادامه دارد. در پستانداران، با بلوغ سلول هسته سلول حذف میشود، اما در پرندگان و بسیاری از گونههای دیگر این اتفاق نمیافتد.
ممکن است تصور کنید که با حذف هسته سلول دیگر امکان تولید هموگلوبین وجود ندارد، زیرا دیگر ژنی وجود ندارد که بتوان از روی آن رونویسی کرد. اما حتی پس از حذف هسته در گلبولهای قرمز پستانداران، بقایای RNA ریبوزومی در سلول حضور دارند و امکان سنتز هموگلوبینهای جدید را فراهم میکند ولی باید به یاد داشت که این میزان بسیار محدود است.
سنتز گلوبین
ژنهای مربوط به زنجیرههای آلفا روی کروموزوم ۱۶ و ژنهای زنجیرههای بتا روی روی کروموزوم ۱۱ قرار دارند. نکتهای که اینجا باید به آن اشاره کرد این است که روی کروموزوم ۱۶ دو ژن آلفا وجود دارد، در حالی که روی کروموزوم ۱۱ تنها یک ژن بتا حضور دارد.
روند رونویسی از این ژنها مانند رونویسی از اکثر ژنها است، یعنی اطلاعات موجود در ژنوم توسط RNA پلیمراز دو به صورت RNA پیامرسان (mRNA) رونویسی میشود. پس از تغییرات mRNA اولیه و ایجاد mRNA بالغ، این مولکول از هسته خارج شده و در سیتوپلاسم از روی آن توسط ماشین ترجمه، زنجیرههای پلیپپتیدی ساخته میشوند.
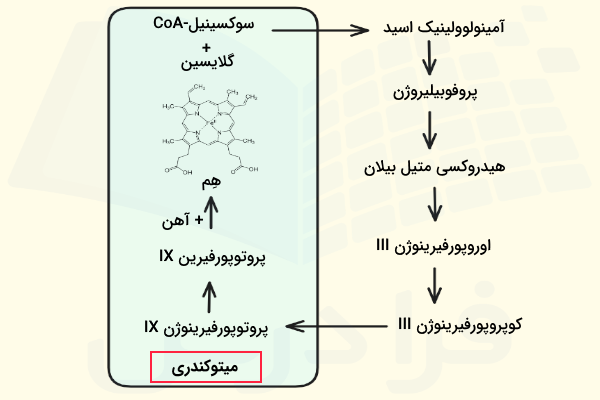
سنتز هِم
هم یک ساختار آهن-پورفیرینی است که به طور عمده در مغز استخوان سنتز میشود، اما کبد نیز بخشی از هموگلوبین خون را تولید میکند. هورمون اریتروپویتین که در کلیه تولید میشود، باعث تحریک ساخت، بلوغ و آزادسازی گلبولهای قرمز توسط مغز استخوان میگردد.
سنتز هِم با ترکیب گلایسین و «سوکسینیلکوآنزیم A» (سوکسینیل-CoA) آغاز میشود. اتصال این دو ترکیب باعث تولید «آمینولوولینیک اسید» (Aminolaevulinic Acid | ALA) میشود. سپس این مولکول طی واکنشهای متوالی که در آنها چندین ترکیب حدواسط تولید میشوند، بهتدریج تغییر یافته و در نهایت به هِم تبدیل میشود. اولین واکنش این مسیر و سه واکنش پایانی آن در میتوکندری سلول رخ میدهند، اما سایر مراحل در سیتوزول انجام میشوند.
برای اتصال هِم به پروتئین گلوبین باید آهن موجود در هِم به زنجیره آلفا یا بتای گلوبین متصل شود. با اتصال چهار هِم به هر زنجیره گلوبین، مولکول هموگلوبین به طور کامل شکل میگیرد.
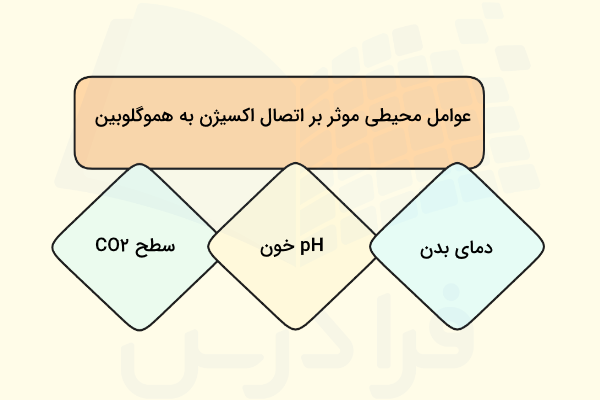
عوامل موثر بر اتصال اکسیژن به هموگلوبین
ظرفیت حمل اکسیژن توسط هموگلوبین نشاندهنده این است که چه مقدار اکسیژن در خون جابهجا میشود. علاوه بر «فشار نسبی اکسیژن» (P)، عوامل محیطی و برخی بیماریها نیز بر ظرفیت حمل و تحویل اکسیژن اثرگذار هستند. در جدول زیر میتوانید عوامل محیطی و بیماریهای موثر بر حمل اکسیژن توسط خون را ببینید.
| عوامل محیطی موثر بر اتصال اکسیژن به هموگلوبین | بیماریهای موثر بر اتصال اکسیژن به هموگلوبین |
| سطح کربن دیاکسید | کمخونی داسیشکل |
| pH خون | تالاسمی |
| دمای بدن | – |
عوامل محیطی
سه عامل محیطی میتوانند بر توانایی حمل اکسیژن هموگلوبین اثر بگذارند.
- سطح کربن دیاکسید
- pH خون
- دمای بدن
کربن دیاکسید موجود در خون با آب واکنش داده و «بیکربنات» () و «یون هیدروژن» () تولید میکند. با افزایش در خون، یونهای بیشتری تولید شده و pH کاهش مییابد.
این افزایش و کاهش pH، میل ترکیبی هموگلوبین به اکسیژن را کاهش میدهد، در نتیجه اکسیژن از مولکول هموگلوبین جدا میشود و منحنی تفکیک اکسیژن به سمت راست جابهجا میگردد. بنابراین، برای این که هموگلوبین به همان اندازهای اشباع شود که در pH بالاتر اشباع میشود، به اکسیژن بیشتری نیاز است.
افزایش دمای بدن نیز منحنی را به سمت راست جابهجا کرده و میل هموگلوبین به اکسیژن را کاهش میدهد. به عنوان مثال در هنگامی که فعالیت شدید عضلانی داریم، دمای بدن افزایش و در همین زمان میل هموگلوبین به اکسیژن کاهش مییابد.
بیماریها
کمخونی داسیشکل و تالاسمی دو بیماری هستند که بر روی میل هموگلوبین اثر میگذارند و به همین دلیل توانایی بدن برای انتقال اکسیژن به بافتهای مختلف و ظرفیت حمل اکسیژن توسط خون کاهش مییابند. در کمخونی داسیشکل گلبولهای قرمز خون دچار تغییر شکل شده و به صورت هلالی، کشیده و سخت درمیآیند. این تغییر شکل توانایی آنها را در انتقال اکسیژن کاهش میدهد. علاوه بر این، گلبولهای قرمز داسیشکل قادر به عبور از مویرگها نیستند و انسدادی که ممکن است ایجاد کنند خطراتی در پی دارد.
تالاسمی یک بیماری ژنتیکی نادر است که ناشی از نقص در زنجیرهی آلفا یا بتای هموگلوبین است. بیماران مبتلا به تالاسمی تعداد زیادی گلبول قرمز تولید میکنند، اما میزان هموگلوبین موجود روی سطح این سلولها از سلولهای افراد سالم کمتر است؛ در نتیجه، ظرفیت حمل اکسیژن در خون افراد مبتلا به تالاسمی نیز کمتر است.
اشباع اکسیژن
هموگلوبین میتواند با تمام ظرفیت خود به مولکولهای اکسیژن متصل شود و به صورت اشباع درآید که در این صورت به آن «اکسیهموگلوبین» (Oxyhemoglobin) میگوییم، اما هموگلوبین میتواند هیچ اتصالی به اکسیژن نداشته و به صورت «داکسیهموگلوبین» (Deoxyhemoglobin) وجود داشته باشد. در ادامه با اختصاص دادن بخشهایی جدا به این دو حالت هموگلوبین، با آنها بیشتر آشنا میشویم تا بهتر یاد بگیریم که هموگلوبین چیست.
اکسی هموگلوبین چیست؟
اکسیهموگلوبین در فرآیند تنفس فیزیولوژیک، زمانی تشکیل میشود که اکسیژن به بخش «هِم» پروتئین هموگلوبین در گلبولهای قرمز خون متصل میشود. این فرایند در مویرگهای ریوی مجاور آلوئولهای ریه رخ میدهد. سپس اکسیژن از طریق جریان خون به بافتها منتقل شده و به مایع بین سلولی آزاد میشود. اکسیهموگلوبین بهطور مستقیم در مقابله با کاهش pH خون نقشی ندارد. فرایند تنفس میتواند این وضعیت را با حذف کربن دیاکسید معکوس کند و در نتیجه باعث افزایش pH شود.
هموگلوبین در دو حالت ساختاری وجود دارد.
- «حالت سخت» (Tense| R)
- «حالت راحت» (Relaxed | R)
برخی عوامل که در ادامه نام میبریم، در سطح بافتها، حالت T را تقویت میکنند. این حالت دارای میل پیوندی پایین به اکسیژن است، در نتیجه اکسیژن را در بافتها آزاد میکند.
- pH پایین
- بالا
- افزایش «۲ و ۳ بیسفسفوگلیسرات» (2,3-BPG)
برعکس، pH بالا، پایین و 2,3-BPG کم باعث پایداری حالت R میشوند که تمایل بیشتری برای اتصال به اکسیژن دارد. فشار جزئی اکسیژن نیز بر میل ترکیبی هموگلوبین با اکسیژن تاثیر میگذارد. در فشارهای بالای اکسیژن، مثل شرایطی که در آلوئولهای ریوی وجود دارد، حالت R با میل ترکیبی بالا، حالت غالب هموگلوبین است، در حالی که در فشارهای پایین، مانند بافتهای مختلف بدن، حالت T بیشتر دیده میشود.
علاوه بر این، اتصال اکسیژن به در مولکول هِم باعث کشیده شدن یون آهن به درون صفحه حلقه پورفیرین و ایجاد تغییر شکلی جزئی در ساختار هموگلوبین میشود. این تغییر، اتصال اکسیژن به سه واحد هِم باقیمانده را آسانتر میکند؛ به این ترتیب اتصال اکسیژن به هموگلوبین یک فرآیند «همتعاونی» (Cooperative) است. در تصویر زیر میتوانید اثر اتصال و عدم اتصال اکسیژن به هموگلوبین را ببینید.
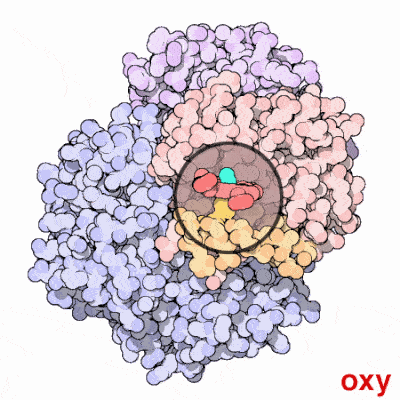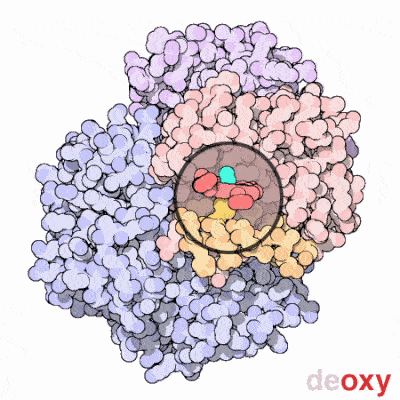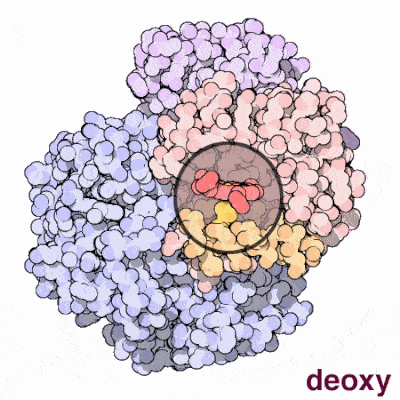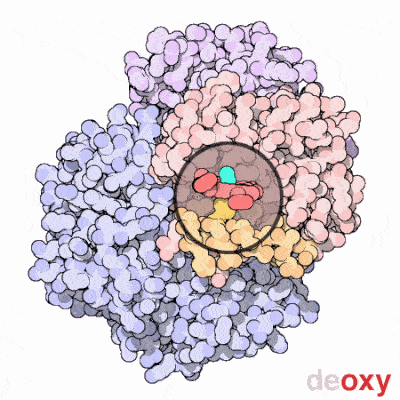
داکسی هموگلوبین چیست؟
داکسیهموگلوبین به هموگلوبینی گفته میشود که اکسیژن به آن متصل نیست. طیف نوری که اکسیهموگلوبین و داکسیهموگلوبین جذب میکنند با یکدیگر متفاوت هستند. در حقیقت اکسیهموگلوبین در طول موج ۶۶۰ نانومتر جذب بسیار کمتری نسبت به داکسیهموگلوبین دارد، اما در طول موج ۹۴۰ نانومتر جذب آن اندکی بیشتر است.
تفاوت در جذب نوری اکسیهموگلوبین با داکسیهموگلوبین، پایه عملکرد دستگاه «پالس اکسیمتر» (Pulse Oximeter) برای اندازهگیری میزان اکسیژن خون بیماران است. کبودی یا سیانوز نیز به خاطر همین تفاوت جذب نور به وجود میآید، به بیان دقیقتر در هنگام کبودی شاهد تغییر رنگ بافتها به رنگهای آبی تا بنفش هستیم که دلیل آن نیز کمبود اکسیژن در بافت مورد نظر است، بنابراین جذب نوری بافت مذکور با دیگر بافتها متفاوت است.
نکته دیگری که در مورد داکسیهموگلوبین باید بدانیم، خاصیت پارامغناطیس آن است، یعنی داکسیهموگلوبین به میزان کمی توسط میدانهای مغناطیسی جذب میشود. در مقابل، اکسیهموگلوبین دیامغناطیس است، یعنی به میزان کمی از میدان مغناطیسی دفع میشود.
مشتقات هموگلوبین
برخی مشتقات از هموگلوبین طبیعی بهدلیل تغییرات متابولیک درون گلبول قرمز (RBC) ایجاد میشوند. مهمترین مشتقات هموگلوبین را در ادامه نام میبریم.
- اکسیهموگلوبین (Oxyhemoglobin – HbO₂)
- هموگلوبین احیا شده (Reduced Hemoglobin – HHb) یا داکسیهموگلوبین
- کربامینوهـموگلوبین (Carbaminohemoglobin)
- متهموگلوبین (Methemoglobin – MetHb)
در بخش قبل با اکسیهموگلوبین و داکسیهموگلوبین به طور کامل آشنا شدیم، بنابراین در این بخش تنها به معرفی کربامینوهموگلوبین و متهموگلوبین میپردازیم.
کربامینوهموگلوبین
در بخشهای قبل، هنگامی که یاد گرفتیم روش انتقال کربن دیاکسید با استفاده از هموگلوبین چیست، متوجه شدیم هموگلوبین میتواند در بافتها به کربن دیاکسید نیز متصل شود. میتواند به گروه آلفا–آمینو (α-Amino Group) در انتهای N–ترمینال هر یک از چهار زنجیره پلیپپتیدی هموگلوبین متصل شود و کربامینوهموگلوبین را تشکیل دهد.
متهموگلوبین
در شرایط طبیعی، آهن موجود در هموگلوبین از نوع آهن دو ظرفیتی است، اما این یون میتواند توسط پراکسید هیدروژن () که در متابولیسم گلبول قرمز تولید میشود، اکسید شده و به حالت «آهن سه طرفیتی» () در بیاید و به این ترتیب متهموگلوبین تشکیل میشود. قادر به اتصال به اکسیژن نیست، بنابراین عملکرد هموگلوبین مختل میشود. بهطور طبیعی، حدود ۱٫۷ تا ۲٫۴ درصد از کل هموگلوبین به شکل متهموگلوبین وجود دارد.
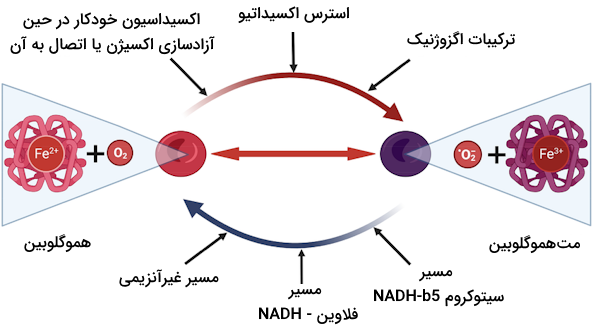
روش تنظیم فعالیت هموگلوبین چیست؟
در بخشهای قبل یاد گرفتیم که به طور همزمان چهار مولکول اکسیژن میتوانند به یک هموگلوبین متصل شوند، بنابراین برای توضیح اتصال تعاونی اکسیژن به هموگلوبین مدلهای آلوستریک مختلفی ارائه شدهاند که در ادامه آنها را نام میبریم.
- مدل MWC
- مدل KNF
- مدل استریوشیمیایی
برای آشنایی بیشتر با هر یک از این مدلها، بخشی را به صورت مجزا به آنها اختصاص میدهیم تا به خوبی یاد بگیریم شیوه تنظیم فعالیت هموگلوبین چیست و چه نظریههایی برای آن بیان شدهاند.
مدل MWC
در این حالت برای مولکول هموگلوبین دو حالت T و R در نظر میگیریم. اتصال لیگاند، مانند مولکول اکسیژن، باعث میشود که هموگلوبین از حالت سخت به حالت راحت تغییر ساختار بدهد. نکته مهم برای این مدل این است که هموگلوبین حالت میانهای ندارد و مستقیم از حالت T به حالت R تغییر وضعیت میدهد.
مدل KNF
در مدل KNF که ممکن است با عنوان «مدل کوشلند» نیز شناخته شود، یک حالت کنفورماسیونی پایه برای هموگلوبین تصور میشود که میتواند دستخوش تغییر شود. بر طبق این مدل، اتصال لیگاند به یک زیرواحد باعث تغییر شکل همان زیرواحد میشود و این تغییر بهصورت تدریجی و متوالی به زیرواحدهای دیگر منتقل میشود.
مدل استریوشیمیایی
مدل یا مکانیسم استریوشیمیایی ترکیبی از دو مدل MWC و KNF است. بر اساس این مدل، اتصال لیگاند به هر زیرواحد باعث تغییر ساختار سوم آن زیر واحد میشود، توجه داشته باشید که در اینجا منظور ما ساختار سوم پروتئین است. با توجه به این که زیرواحدهای آلفا یک و بتا یک با یکدیگر تعامل مستقیم دارند، تغییرات ایجاد شده به زیرواحدهای دیگر منتقل میشوند و به این ترتیب شاهد افزایش تدریجی میل اتصال لیگاند به سایتهای دیگر و حرکت تعادل آلواستریک از حالت T به R هستیم.
این مدل دارای یک محدودیت بسیار مهم است. مدل استریوشیمیایی هموگلوبین را فقط در دو حالت T یا R در نظر میگیرد و توجهی به حالتهای میانی این مولکول ندارد، در حالی که تحقیقات مختلف دانشمندان نشان میدهد که هموگلوبین فقط دارای دو ساختار T و R نیست.
روش تجزیه هموگلوبین چیست؟
برای بررسی تجزیه هموگلوبین باید تعیین کنیم که هموگلوبین در خارج سلول قرار دارد یا داخل سلول، زیرا اولین سرنوشتی که برای هموگلوبین به ذهن ما میآید این است که هموگلوبین همراه با گلبولهای قرمز پیر متابولیزه میشود؛ اما هموگلوبین آزاد و غیرسلولی نیز در خون وجود دارد که در اثر همولیز غیرمنتظره گلبولهای قرمز به خون آزاد شده است و باید از خون حذف شود. در ادامه در دو بخش جداگانه به هر سرنوشت هموگلوبین در هر یک از این شرایط میپردازیم تا یاد بگیریم که روش تجزیه هموگلوبین چیست.
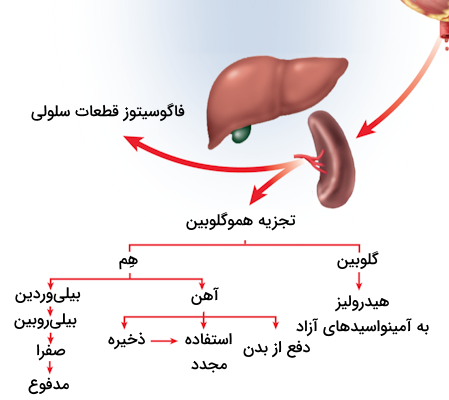
سرنوشت گلبولهای قرمز و هموگلوبین درون آنها
به طور معمول عمر یک گلبول قرمز حدود ۱۲۰ روز است. در طول این مدت ۱۲۰ روز گلبولهای قرمز انعطافپذیری خود را از دست میدهند و از نظر فیزیکی به شکل غیرطبیعی در میآیند. این سلولهای غیر طبیعی در نهایت توسط «سیستم رتیکولواندوتلیال» (Reticuloendothelial System) شناسایی میشوند. در این سیستم که بیشتر در طحال وجود دارد، سلولها باید از سینوسوئیدهایی باریک عبور کنند، سلولهای غیرطبیعی در حین عبور از سینوسوئیدها توسط ماکروفاژها شناسایی شده و تخریب میشوند.
این تخریب سلولی مانند تخریبی که برخی از سلولهای ایمنی انجام میدهند خشونتآمیز نیست، در اصل ماکروفاژها به آرامی سلول را بعلیده و با استفاده از لیزوزومهای خود آن را تجزیه میکنند. در همین حین هموگلوبین موجود روی گلبول قرمز نیز توسط ماکروفاژها تجزیه میشود. در این فرآیند، بخشهای هِم و گلوبین از یکدیگر جدا میگردند. زنجیرههای گلوبین یا دوباره بازیافت میشوند و یا به وسیله آنزیمهای پروتئاز به آمینواسیدهای منفرد تجزیه میشوند.
گروههای هِم در ماکروفاژها توسط «آنزیمهای میکروزومی» (Microsomal Enzymes) به بیلیروبین تبدیل میشوند. تجزیه هِم در دو مرحله زیر انجام میشود.
- آنزیم هِم اکسیژناز، هِم را به بیلیوردین تبدیل میکند.
- آنزیم بیلیوردین ردوکتاز، بیلیوردین را کاهش داده و به بیلیروبین تبدیل مینماید.
ماکروفاژها ترکیبات حاصل از تجزیه هموگلوبین را به خون بازمیگردانند، در ادامه این محصولات نهایی را نام میبریم.
- بیلیروبین
- آهن
- آمینواسیدها
از آنجا که بیلیروبین در آب نامحلول است، پس از ورود به خود به آلبومین متصل میشود. اتصال بیلیروبین به آلبومین باعث تشکیل کمپلکس بیلیروبین-آلبومین میشود. این کمپلکس، بیلیروبین را به هپاتوسیتهای موجود در کبد منتقل میکند، زیرا در این سلولها بیلیروبین به بیلیروبین دیگلوکورونید تبدیل میشود که محلول در آب است. سپس بیلیروبین دیگلوکورونید از طریق صفرا دفع میشود.
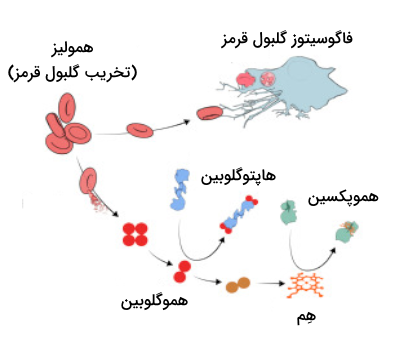
سرنوشت هموگلوبین آزاد
در بخش فعالیتهای هموگلوبین یاد گرفتیم که در پاکسازی نیتریک اکسید نقش هموگلوبین چیست. با توجه به این که هموگلوبین آزاد میتواند به سرعت نیتریک اکسید مورد نیاز برای انبساط عروق را پاکسازی کند، این هموگلوبین باید به سرعت از گردش خون حذف شود. چندین مکانسیم برای این موضوع وجود دارد اما به طور خلاصه میتوان گفت که پلاسما محیط مناسبی برای هموگلوبین آزاد نیست، زیرا این مولکول شکننده است و به هترودایمرهای آلفا-بتا تجزیه میشود.
تشکیل این هترودایمرها شرایط را پیچیدهتر میکند، چرا که کوچکتر بودن دایمرها به آنها این امکان را میدهد که به نواحی حساسی مانند توبولهای کلیوی و «گلیکوکالیکس اندوتلیال» (Endothelial Glycocalyx) نفوذ کنند.
راه حل اصلی برای پاکسازی هموگلوبین آزاد از خون بهره بردن از حضور «پروتئینهای اسکونجر» (Scavenger Protein) است که محلول هستند و میتوانند به هموگلوبینهای آزاد متصل شوند. دو پروتئینی که در ادامه نام میبریم، مهمترین انواع پروتئینهای اسکونجر هستند.
- «هاپتوگلوبین» (Haptoglobin)
- «هموپکسین» (Haemopexin)
اتصال این پروتئینها به هموگلوبین باعث میشود که کمپلکس تشکیل شده به سرعت توسط ماکروفاژهای سیستم رتیکولواندوتلیال شناسایی شده و از گردش خون حذف میشود.
استفاده از نرمافزارهای مختلف برای تعیین ویژگی های مولکول های زیستی
حالا که یاد گرفتیم هموگلوبین چیست زمان آن رسیده که به این موضوع بپردازیم که پیشرفت تکنولوژی به دانشمندان حوزههای مختلف علوم زیستی و پزشکی این امکان را داده است که پیش از شروع کارهای عملی در آزمایشگاه، بخش بزرگی از مسیر پژوهشی را به کمک نرمافزارهای مختلف تعیین توالی، پیشبینی ساختار مولکولی و غیره طی کنند.
یادگیری کار و استفاده از نرمافزارهای مختلف برای محققان علوم زیستی چالشهایی به همراه دارد، زیرا بسیاری از این افراد دانش زیادی در زمینه علوم کامپیوتر ندارند؛ بنابراین استفاده از فیلمهای آموزشی که گام به گام ابزارهای موجود در هر برنامه، روش استفاده از آنها و رسیدن به هدف نهایی را یاد میدهند، سودمند هستند. در ادامه لینک دسترسی به فیلم آموزش دادههای بیوانفورماتیکی، دادههای ژنتیکی و غیره را در اختیار شما قرار میدهیم.
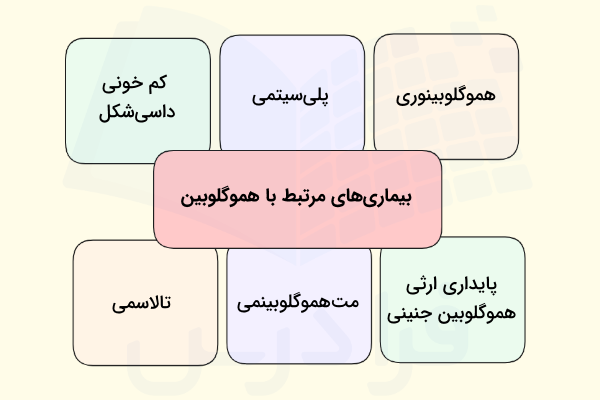
بیماریهای مرتبط با هموگلوبین
تا اینجای این مطلب با به دست آوردن اطلاعات کاملی در مورد ساختار و فعالیت هموگلوبین، متوجه شدیم که اهمیت هموگلوبین چیست، بنابراین میتوان به سادگی حدس زد که اختلال در ساختار هموگلوبین میتواند فعالیت آن را تحت تاثیر قرار دهد. بیماریهای مرتبط با هموگلوبین تنها به اختلالات ساختاری این پروتئین محدود نمیشوند، به همین دلیل در ادامه ضمن معرفی این بیماریها، توضیح کوتاهی در مورد آنها ارائه میدهیم.
- «کم خونی داسیشکل» (Sickle Cell Disease): اختلال ژنتیکی هموگلوبین باعث تغییر شکل گلبولهای قرمز شده و آنها را به شکل داس یا هلال ماه در میآورد و به همین دلیل توانایی حمل اکسیژن توسط این سلولها کاهش یافته و فرد مبتلا به بیماری کمخونی داسیشکل میشود.
- «تالاسمی» (Thalassemia): تالاسمی بیماری ژنتیکی خون است که در بیماران مبتلا به آن شاهد نقص در تولید زنجیرههای گلوبین هموگلوبین هستیم، همین موضوع منجر به کمخونی مزمن میشود.
- «پلیسیتمی» (Polycythemia): پلیسیتمی یعنی افزایش غیرطبیعی تعداد گلبولهای قرمز خون که باعث افزایش غلظت خون و اختلال در گردش خون میشود.
- «متهموگلوبینمی» (Methemoglobinemia): در این بیماری میزان متهموگلوبین خون به طرز غیرطبیعی بالا میرود و به این ترتیب توانایی خون برای حمل اکسیژن و رساندن آن به بافتها کاهش مییابد.
- «هموگلوبینوری» (Hemoglobinuria): در ادرار بیماران مبتلا به هموگلوبینوری، هموگلوبین آزاد وجود دارد و دلیل این اتفاق نیز تخریب شدید گلبولهای قرمز خون است.
- «پایداری ارثی هموگلوبین جنینی» (Hereditary Persistence Of Fetal Hemoglobin | HPFH): یک اختلال خوشخیم ژنتیکی که در آن تولید هموگلوبین جنینی (HbF) پس از تولد ادامه پیدا میکند.
جمعبندی
در این مطلب از مجله فرادرس به طور کامل یاد گرفتیم که هموگلوبین چیست و با بررسی ساختار آن متوجه شدیم که هموگلوبین از دو بخش گلوبین و هِم تشکیل شده است تا اکسیژن را در خون حمل کند. با بررسی بیشتر فعالیتهای هموگلوبین به این پی بردیم که هموگلوبین علاوه بر اکسیژن میتواند کربن دیاکسید را حمل کند.
اگر بخواهیم به این سوال جواب دهیم که روش تولید هموگلوبین چیست، باید نگاهی به گلبولهای قرمز خون داشته باشیم که هموگلوبینها روی سطح آنها وجود دارند. گلبولهای قرمز در مغز استخوانها تولید میشوند و در همین زمان اکثر هموگلوبینهای آنها تولید میشود زیرا بلوغ گلبولهای قرمز همراه با از دست دادن تمامی اندامکهای سلولی آنها است، بنابراین میزان تولید هموگلوبین در آنها بسیار کاهش مییابد.
در این متن به این موضوع نیز پرداختیم که انواع هموگلوبین چیست و با هموگلوبینهای A ،F و A۲ آشنا شدیم. یکی دیگر از مسائلی که در این مطلب بررسی شد، روش تجزیه هموگلوبین بود که برای این که بفهمیم تجزیه هموگلوبین چیست، به سرنوشت هموگلوبینهای موجود در سطح گلبولهای قرمز پیر و هموگلوبینهای آزاد حاصل از همولیز گلبولهای قرمز پرداختیم.
source
