وزن سنجی یکی از روشهای تجزیهای برای اندازهگیری کمی یک آنالیت ( ماده مورد بررسی) بر اساس جرم ماده جامد است. در این روش مقدار ماده مورد بررسی با استفاده از روش رسوبدهی از مخلوط جدا میشود. رسوب جدا شده باید ساختار شیمیایی شناخته شدهای داشته باشد یا بر اثر حرارت دادن به مادهای با ساختار مشخص تبدیل شود. در این مطلب از مجله فرادرس میآموزیم وزن سنجی چیست و اصول و انواع روشهای آن را بررسی میکنیم.
آنچه در این مطلب میآموزید:
-
میآموزید وزنسنجی چیست و اصول آن کدام است.
-
با مثال ها و مراحل انجام وزنسنجی آشنا میشوید.
-
روشهای مختلف وزنسنجی مانند رسوبی، تبخیری، حرارتی و الکتریکی را میشناسید.
-
با عوامل رسوبدهی و انواع رسوبهای تشکیل شده در روش وزنسنجی آشنا میشوید.
-
میآموزید مسائل مربوط به آزمایشهای وزنسنجی را حل کنید.
-
با الزامات، مزایا، معایب و خطاهای رایج این روش آشنا میشوید.

در ابتدای ابن مطلب میآموزیم وزن سنجی چیست و اصول آن کدام است. سپس به بررسی مثال، مراحل و انواع روشهای وزن سنجی میپردازیم. پس از آن با عوامل رسوبدهی آشنا میشویم و انواع رسوب را میشناسیم. در ادامه، مفهوم همرسوبی، محاسبات و الزامات روش وزن سنجی را میآموزیم. در نهایت با خطاها، مزایا و معایب و کاربرد این روش آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید وزن سنجی چیست.
وزن سنجی چیست؟
روش وزن سنجی (گراویمتری) که با عبارت (Gravimetric Analysis) شناخته میشود، به یک روش در شیمی تجزیه گفته میشود که در آن مقدار یک ماده (آنالیت) با تبدیل آن به یک محصول قابل جداسازی و توزین تعیین میشود. این روش شامل تمامی روشهای تجزیهای است که در آنها جرم یا تغییرات جرم اندازهگیری و بررسی میشود.
جرم یکی از بنیادیترین کمیتهای ماده است و به همین علت وزن سنجی یکی از قدیمیترین روشهای تجزیه کمی به شمار میرود. این تکنیک بر اصول رسوبدهی و توزین متکی است تا آنالیت موردنظر را جداسازی و مقدار آن را مشخص کند. این روش اغلب در پایشهای زیستمحیطی، تحلیلهای دارویی و کنترل کیفیت در صنایعی مانند صنایع غذایی و نوشیدنی به کار میرود.

اصول وزن سنجی چیست؟
آنالیز وزنی بر این اصل تکیه دارد که با دانستن درصد جرمی یک یون در مقدار معینی از یک ترکیب ناخالص، میتوان جرم همان یون را در یک ترکیب خالص محاسبه کرد. گراویمتری بر پایه اصول استوکیومتری و قانون پایستگی جرم انجام میشود. ایده اصلی این روش این است که با اندازهگیری جرم ترکیب جداشده، میتوان مقدار آنالیت موجود در نمونه اولیه را بهطور دقیق محاسبه کرد.
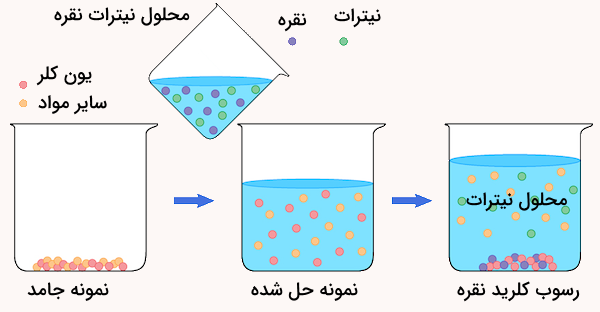
یکی از نمونههای وزنسنجی، تعیین مقدار یون کلر در یک نمونه است. در این روش، حجم مشخصی از محلول نمونه که حاوی یونهای کلر است، با محلول نیترات نقره واکنش میدهد تا کلرید نقره به صورت رسوب تشکیل شود. رسوب به دست آمده سپس صاف، خشک و توزین میشود تا جرم کلرید نقره مشخص گردد. با دانستن نسبتهای واکنش و جرم مولی ترکیبات، میتوان مقدار یون کلر موجود در نمونه اولیه را بر اساس جرم کلرید نقره محاسبه کرد.
یادگیری شیمی تجزیه با فرادرس
برای درک بهتر اینکه روش وزن سنجی چیست، ابتدا باید با مفاهیم و مسائلی چون آمادهسازی نمونه، روشهای آنالیز کلاسیک و آنالیز دستگاهی، انواع خطاها در شیمی تجزیه، تعریف دقت و صحت و … آشنا شویم. پیشنهاد میکنیم برای یادگیری این مسائل و مفاهیم به مجموعه فیلم آموزش شیمی تجزیه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه وزن سنجی دسترسی داشته باشید.
مثال وزن سنجی
یکی از مثالهای وزنسنجی، تعیین مقدار کلر در یک نمونه است. در این روش، حجم مشخصی از محلول نمونه که یونهای کلر در آن وجود دارد، با محلول نیترات نقره واکنش داده میشود تا رسوب کلرید نقره تشکیل شود. رسوب تشکیل شده سپس فیلتر، خشک و توزین میشود تا جرم کلرید نقره بهدست آید.
با دانستن نسبتهای استوکیومتری واکنش و جرم مولی ترکیبات، میتوان مقدار یون کلر موجود در نمونه اصلی را بر اساس جرم کلرید نقره تعیین کرد.
مراحل وزن سنجی
انواع روشهای وزن سنجی میتوانند بسته به روش استفاده شده در آنها شامل مراحل مختلفی باشند. با این وجود، چند مرحله کلی و اصلی در هر روش وزن سنجی وجود دارد که در ادامه به توضیح آنها میپردازیم. این مراحل آمادهسازی محلول، رسوبگیری، فیلتراسیون و شستن رسوب، خشک کردن و احتراق هستند.
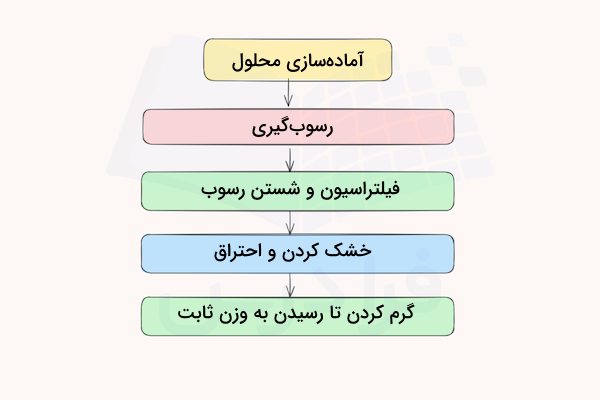
۱. آماده سازی محلول
ابتدا نمونه مورد آزمایش روی یک شیشه ساعت وزن شده و به بشر منتقل میشود. اگر نمک نمونه در آب انحلالپذیر باشد، آن را در مقدار کافی آب حل میکنند. در غیر این صورت نمونه در اسید حل شده و ممکن است مقداری آب اضافی برای به حجم رساندن محلول پس از انحلال کامل آن به آن اضافه شود. تهیه محلول اولین قدم برای انجام روش وزن سنجی است.
۲. رسوب گیری
محلول نمونه پیش از اضافه کردن عامل رسوبدهی گرم میشود. سپس عامل رسوبدهی مناسب به صورت تدریجی و کمی بیش از حد لازم به محلول اضافه میشود. محتویات محلول باید در زمان افزودن عامل رسوبدهی هم زده شود. پس از آن، محلول حاوی رسوب دوباره گرم شده و به مدت مشخصی کنار گذاشته میشود تا رسوب تهنشین شود.
پس از آن با افزودن چند قطره از عامل رسوبدهی با مایع بالای رسوب، کامل شدن فرآیند رسوبگیری بررسی میشود.
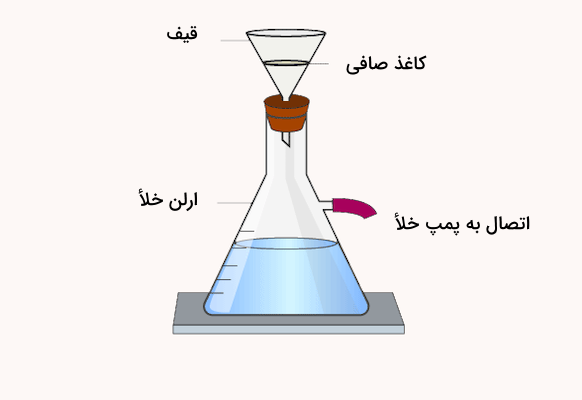
۳. فیلتراسیون و شستن رسوب
رسوب در قیف ریخته شده و با محلول شستوشوی مناسب شسته میشود. یک کاغذ صافی یا فیلتر مناسب برای جداسازی و فیلتراسیون رسوب از محلول روی قیف قرار داده میشود. برای اطمینان از خلوص بالای رسوب، فرآیند شستوشو با استفاده از معرفهای مناسب مانند محلول نیترات نقره و باریم کلرید بررسی میشود.
۴. خشک کردن
در این مرحله یک تکه کاغذ مچالهشده روی لبه قیف قرار داده میشود تا قیف حاوی رسوب خالصشده پوشانده شود. سپس قیف همراه با رسوب درون یک آون هوای گرم قرار داده میشود تا کاملا خشک شود.
۵. احتراق
هنگامی که کاغذ صافی حاوی رسوب کامل خشک شد، از روی قیف برداشته شده و به شکلی تا میشود که تمامی رسوب را در بر گیرد. سپس این کاغذ و محتویات آن به یک بوته چینی وزن شده منتقل میشود و روی سه پایه و شعله قرار میگیرد.
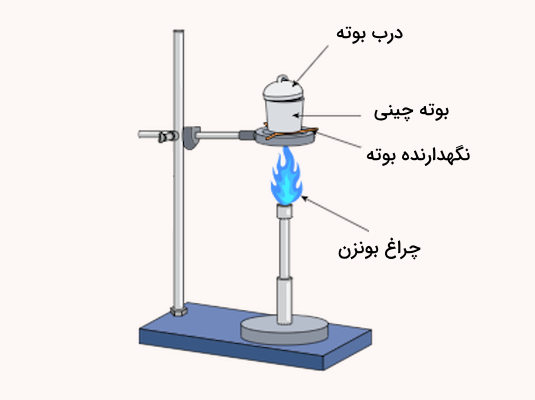
ابتدا بوته به آرامی حرارت داده میشود و پس از تبخیر کامل رطوبت، شعله بیشتر میشود تا کاغذ صافی کربنیزه گردد. وقتی کاغذ کاملا به کربن تبدیل شد، بوته کاملا حرارت داده میشود. پس از سوختن کامل کربن، بوته با درپوش پوشانده میشود. معمولا کل فرآیند احتراق حدود ۵۰ تا ۶۰ دقیقه طول میکشد.
۶. گرم کردن تا رسیدن به وزن ثابت
پس از پایان مرحله احتراق، بوته به دسیکاتور منتقل میشود تا خنک شود. سپس بوته و درپوش آن با هم وزن میشوند. پس از آن ماده جامد درون بوته دوباره حدود ۱۰ دقیقه آتش داده میشود سپس در دسیکاتور قرار میگیرد و وزن میشود. این چرخه حرارت دهی و توزین تا زمانی ادامه پیدا میکند که وزن بوته ثابت بماند.
در نهایت وزن رسوب را میتوان از اختلاف وزن بوته محتوی نمونه و بوته خالی به دست آورد. سپس با استفاده از جرم مولی ترکیب، تعداد مول آن یا درصد جرمی نمونه مورد بررسی محاسبه میشود.
روش های وزن سنجی
روشهای وزن سنجی متفاوتی وجود دارند که هر یک برای کاربردی خاصی به کار میروند. دو روش معمولتر وزن سنجی، وزن سنجی تبخیری و وزن سنجی رسوبی هستند.
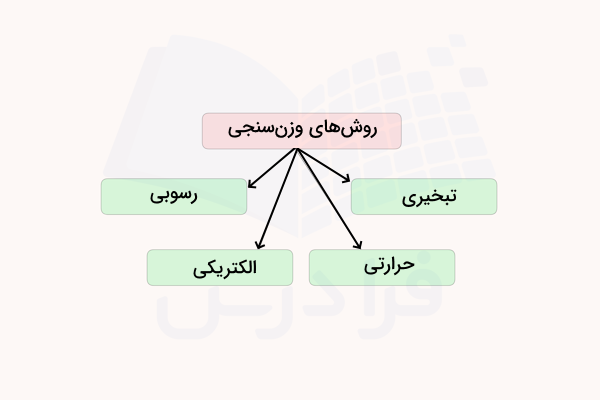
وزن سنجی رسوبی
وزنسنجی رسوبی شامل تشکیل یک رسوب نامحلول با افزودن یک معرف خاص به محلول آنالیت است. این کار با استفاده از یک عامل رسوبدهی و به وسیله جداسازی یونها از محلول حاوی نمونه انجام میشود. سپس رسوب حاصل صافی، خشک و توزین میشود تا مقدار آنالیت موجود در نمونه اولیه تعیین گردد. این رسوب وقتی تشکیل میشود که دو ماده محلول با هم واکنش دهند. مادهای که باعث تشکیل رسوب میشود، عامل رسوبدهی نامیده میشود.
برای مثال، وقتی محلول نیترات نقره با محلول کلرید سدیم ترکیب میشود، رسوب سفید رنگ کلرید نقره تشکیل میشود. در این واکنش، کلرید سدیم نقش عامل رسوبدهی را دارد. معادله این واکنش به شکل زیر است.

اندازه ذرات در وزن سنجی رسوبی
اندازه ذرات جامد تشکیل شده در این روش میتواند متفاوت باشد. برای مثال، ذرات تشکیل شده در این روش میتواند بین تا سانتیمتر باشد که جزو ذرات کلوئیدی محسوب میشوند و تمایلی به تهنشینی ندارند و جداسازی آنها بسیار سخت است.
از سوی دیگر اندازه ذرات میتواند به بزرگی چند دهم میلیمتر یا بیشتر باشد که به شکل خودبهخود تهنشین میشوند و جداسازی آنها آسان است. اندازه ذرات تشکیل شده در این روش به عواملی مانند حلالیت رسوب، دما، غلظت واکنشدهندهها و سرعت اختلاط واکنشدهندهها بستگی دارد. همچنین، محلولسازی صحیح یکی از کلیدهای افزایش دقت روش وزنسنجی است. پیشنهاد میکنیم برای آشنایی بیشتر با روشهای تهیه محلول، فیلم آموزش محلولسازی در آزمایشگاه فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مکانیسم تشکل رسوب
رسوب تشکیل شده در وزن سنجی رسوبی عموما با دو مکانسیم هستهزایی و رشد ذرات انجام میشود. این دو مکانیسم به شکل زیر هستند.
- هسته زایی: فرآیند اولیهای است که در آن حداقل تعداد اتمها، یونها یا مولکولها به هم میپیوندند و یک جامد پایدار تشکیل میدهند. اغلب این هستهها روی سطح ذرات معلق یا آلایندههایی مانند ذرات گرد و غبار شکل میگیرند.
- رشد ذرات: فرآیندی است که پس از هستهزایی اتفاق میافتد و باعث بزرگتر شدن ذرات میشود.
محاسبات روش وزن سنجی رسوبی
استوکیومتری واکنش رسوبگذاری، رابطهای ریاضی بین ماده مورد اندازهگیری (آنالیت) و رسوب تشکیلشده ایجاد میکند. اما گاهی در وزنسنجی رسوبی، ممکن است واکنشهای دیگری هم رخ دهد تا آنالیت به شکل دیگری تبدیل شود، پس فقط دانستن استوکیومتری واکنش رسوب کافی نیست.
حتی اگر همه واکنشهای شیمیایی را ندانیم، با استفاده از قانون پایستگی جرم میتوانیم رابطه بین مقدار آنالیت و رسوب را به دست آوریم. به مثال زیر دقت کنید.
مثال
میخواهیم مقدار ماده مگنتیت با فرمول شیمیایی را در یک نمونه معدنی به دست آوریم. برای اینکار نمونه ۱٫۵۴۱۹ گرمی را در اسید کلریدریک حل میکنیم و یونهای آهن (اا) و (ااا) تشکیل میشوند. یونهای آهن (ااا) با استفاده از آمونیاک به هیدروکسید آهن (ااا) تبدیل میشوند. با استفاده از وزن سنجی رسوبی، ۰٫۸۵۲۵ گرم اکسید آهن (ااا) به دست آمده است. مقدار درصد جرمی مگنتیت موجود در نمونه را محاسبه کنید.
پاسخ
برای محاسبه مقادیر خواسته شده از محاسبات استوکیومتری زیر بهره میگیریم.
وزن سنجی تبخیری
وزنسنجی تبخیری روشی است که با گرم کردن نمونه، یک جزء فرار را جدا میکند. این جزء فرار به صورت گاز درمیآید و سپس وزن آن اندازهگیری میشود. این روش به خصوص برای موادی که بهراحتی تحت شرایط خاص تبخیر میشوند، بسیار مناسب است. با استفاده از وزنسنجی تبخیری، میتوان گازهای فراری مانند کربن دی اکسید، کلر و … را جدا کرد. از این روش وزن سنجی به طور ویژه برای به دست آوردن تعداد مولکولهای آب هیدراتاسیون ترکیبات هیدرات استفاده میشود.
کاربرد روش وزن سنجی تبخیری
در این روش، از نیروی گرمایی یا انرژی شیمیایی برای جداسازی مواد جامد و اندازهگیری آنها استفاده میشود. برای مثال، محلول آبی اسید سولفوریک به جداسازی گاز کربن دی اکسید (یک گاز فرار) از سدیم بیکربنات کمک میکند. معادله این واکنش به شکل زیر است.
سولفیدها و سولفیتها را نیز میتوان با روش وزن سنجی تبخیری تعیین کرد. در این روش، هیدروژن سولفید یا دیاکسید گوگرد که پس از شست و شوی نمونه با اسید آزاد میشود، در یک جاذب مناسب جمعآوری میگردد. روش کلاسیک تعیین کربن و هیدروژن در ترکیبات آلی نیز یک روش وزنسنجی تبخیری است که در آن، محصولات احتراق یعنی کربن دی اکسید و آب بهطور انتخابی روی جاذبهای وزنشده جمعآوری میشوند.
چه روش آنالیز مستقیم باشد چه غیر مستقیم، در این روش وزن سنجی، شناخت دقیق فرآوردههای تجزیه ماده بسیار مهم است. این موضوع به ندرت برای ترکیبات آلی مشکلساز میشود، زیرا آنها معمولا به گازهای سادهای مانند کربن دی اکسید، آب و نیتروژن تجزیه میشوند. اما در ترکیبات معدنی، نوع فرآوردهها معمولا به دمای واکنش تجزیه وابسته است.
تجهیزات وزن سنجی تبخیری
بسته به روش تجزیه، تجهیزات مورد نیاز برای وزنسنجی تبخیری میتواند ساده یا پیچیده باشد. در سادهترین طراحی آزمایش، نمونه در یک بوته قرار داده شده و در یک دمای ثابت با استفاده از چراغ بونزن، چراغ مکر، آون آزمایشگاهی یا کوره مافلی تجزیه میشود. سپس جرم نمونه و جرم باقیمانده با استفاده از ترازوی تحلیلی اندازهگیری میشود.
برای به دام انداختن و توزین محصولات فرار حاصل از تجزیه حرارتی، به تجهیزات تخصصیتری نیاز است. در این روش، نمونه در یک محفظه بسته قرار گرفته و حرارت داده میشود. در طی فرآیند تجزیه، یک جریان گاز بیاثر محصولات فرار را از میان یک یا چند تله جاذب انتخابی عبور میدهد.
وزن سنجی الکتریکی
روش وزن سنجی الکتریکی برای جداسازی یونها از یک ماده (معمولا فلز) استفاده میشود. در این روش، محلول آنالیت الکترولیز میشود. در نتیجه کاهش الکترولیتی محلول، آنالیت روی کاتد تهنشین میشود. مقدار رسوب تشکیل شده با استفاده از اختلاف جرم الکترود قبل و بعد از انجام آزمایش به دست میآید.
وزن سنجی حرارتی
وزن سنجی حرارتی یکی از روشهای آنالیز حرارتی است که در آن جرم نمونه در نتیجه تغییر دمای آزمایش اندازهگیری میشود. این روش اطلاعاتی درباره پدیدههای فیزیکی و شیمیایی مانند انتقال فاز، جذب، تجزیه حرارتی و موارد مشابه ارائه میدهد.
در وزن سنجی حرارتی از نموداری به نام ترموگرام برای دستیابی به نتایج آنالیز استفاده میشود. در یک ترموگرام معمولی، هر تغییر جرم یا هر «پله» در نمودار، نشاندهنده از دست رفتن یک محصول فرار است. همانطور که در مثال زیر دیده میشود، میتوان از ترموگرام برای شناسایی واکنشهای تجزیه یک ترکیب استفاده کرد.

تجهیزات وزن سنجی حرارتی
در وزن سنجی حرارتی، نمونه روی یک سینی کوچک متصل به ترازوی الکترونیکی قرار میگیرد. سپس آن را به داخل کوره میبرند و دما به آرامی افزایش مییابد، در حالی که وزن نمونه به شکل مداوم ثبت میشود. در این دستگاه معمولا خطوط گاز برای خارج کردن گازهای فرار و مبدل حرارتی برای خنک کردن آزمایش تعبیه شده است.
وزن سنجی ذره ای
وزن سنجی ذرهای آنالیت با جدا کردن آن از ماتریس نمونه از طریق فیلتراسیون یا استخراج تعیین میشود. اندازهگیری کل جامدات معلق یکی از نمونههای رایج وزن سنجی ذرهای است. در این روش آنالیت به شکل ذرهای درون محلول وجود دارد و نیازی به حرارت دادن یا افزودن عامل رسوبدهی به محلول نیست. در چنین مواردی، میتوان جرم آنالیت را بدون نیاز به انجام واکنش شیمیایی به دست آورد.
تجهیزات وزن سنجی ذرهای
در این روش، ذرات آنالیت با استفاده از فیلتراسیون معمولی یا با استفاده از خلأ جداسازی میشود. فیلترهای استفاده شده در این روش میتوانند از انواع فیبر سلولز، فیبر شیشه، سلولز نیترات و پلی تترافلوئورو اتیلن (PTFE) باشند. استفاده از این فیلترهای مختلف به اندازه ذرات آنالیت وابسته است.

همچنین اگر فیلتراسیون ذرات در این روش مشکل باشد میتوان از روش جداسازی جذب سطحی با استفاده از ماده جاذب مناسب استفاده کرد.
عامل رسوب دهی
برخی از مواد شیمیایی به عنوان عامل رسوبدهی عمل می کنند. این مواد که با نامهای معرف رسوبگذاری و معرف رسوبدهی نیز شناخته میشود، ماده شیمیایی است که برای انجام واکنش رسوبی استفاده میشود. عامل رسوبدهی در یک روش وزن سنجی باید به شکل خاص و انتخابی با آنالیت واکنش دهد.
عوامل رسوبدهی معمولا بر اساس نوع ماده شیمیایی به دو دسته آلی و معدنی تقسیم میشوند. در ادامه برخی دیگر از خواصی که عامل رسوبدهی باید داشته باشد را توضیح میدهیم.
- اندازه ذرات کافی برای حفظ شدن روی کاغذ صافی
- خلوص بالا (عاری از ناخالصیها)
- حلالیت پایین بهگونهای که در طول فرآیند صافی و شستشو، از دست دادن قابل توجهی از ماده مورد تحلیل رخ ندهد.
- عدم واکنش با هوا (پایداری)
- ترکیب استوکیومتری مشخص پس از خشک شدن یا در صورت نیاز پس از سوختن
عامل رسوبدهی آلی
عوامل رسوبدهی آلی خاصیت انتخاب پذیری خوبی دارند. برای مثال موادی مانند دی متیل گلیوکسیم و ۸- هیدروکسی کینولین از این موارد هستند. این عوامل رسوبهایی با خاصیت انحلالپذیری کمتری تشکیل میدهند که در روش وزن سنجی یک مزیت محسوب میشود.
مشکل عوامل رسوبدهی آلی این است که رسوب تشکیل شده با این عوامل معمولا فرمول شیمیایی ناشناختهای دارد و باید آن را با استفاده از واکنش سوختن به اکسید فلزی تبدیل کرد.
عامل رسوبدهی معدنی
عوامل رسوبدهی معدنی، مواردی مانند یونهای ، و هستند. این عوامل، خاصیت واکنش انتخابی کمتری نسبت به عوامل آلی دارند.
انواع رسوب
در طی انجام مراحل وزن سنجی، اندازه ذرات تشکیل شده و نوع پراکندگی آنها میتواند بسته به دما و شرایط واکنش متفاوت باشد. اندازه ذرات رسوب تشکیل شده در این روش آنالیز بسیار مهم هستند و اساس انتخاب روش جداسازی رسوب از محلول را تشکیل میدهند.
مقدار اندازه ذرات در سیستم با پارامتری به نام فوق اشباعی نسبی (RSS) سنجیده میشود. از قانون «ون ویمارن» (Von Weymarn) پیروی میکند. این معادله که به شکل زیر است، تابعی از غلظت ماده حل شونده (Q) در هر لحظه و غلظت محلول (S) در زمان تعادل است.
طبق این معادله اندازه ذرات میتواند بزرگ (کریستالی) یا کوچک (کلوییدی) باشد و عواملی مانند افزایش دما، تنظیم pH، افزودن عامل کمپلکس کننده، استفاده از عامل رسوبدهی رقیق و … میتواند به بزرگشدن اندازه ذرات و به تبع آن راحتتر بودن جداسازی رسوب کمک کند.
رسوب کلوئیدی
رسوب کلوئیدی تهنشین نمیشود. اندازه ذرات کلوییدی بین تا سانتیمتر اتو این ذرات در سرتاسر محلول به دلیل حرکات براونی پراکنده میشوند. این ذرات را با استفاده از فیلتراسیون عادی نمیتوان جداسازی کرد. با این حال میتوان این ذرات را با روشهایی منعقد یا متراکم کرد تا جداسازی آنها ممکن شود.
منعقدسازی و متراکم سازی کلویید ها
برای منعقدسازی کلوییدها میتوان از حرارت دادن، هم زدن یا افزودن الکترولیت به محلول استفاده کرد. ذرات کلوییدی دارای بار الکتریکی هستند و به همین دلیل در محلول پراکنده میشوند. حرارت دادن مقدار بار اطراف ذرات کلوییدی را کاهش میدهد. همزدن محلول با افزایش انرژی سینتیکی ذرات، احتمال برخورد و متراکم و منعقد شدن آنها را افزایش میدهد. افزودن الکترولیت نیز به دلیل وجود یونهای فراوان باعث خنثی شدن بارهای احاطه کننده ذرات کلوییدی شده و باعث لخته شدن آنها میشود.
همچنین، برای کاهش احتمال از بین رفتن اثر لختگی و تشکیل دوباره کلوییدها میتوان از محلولهای الکترولیتی مانند اسید نتیریک، آمونیوم نیترات و … استفاده کرد. قابلیت جداسازی کلوییدهای منعقد شده را میتوان با استفاده از تماس رسوب با محلول داغی که رسوب از آن تشکیل میشود، افزایش داد. به این فرآیند، فرآیند هضم گفته میشود.
رسوب کریستالی
رسوب کریستالی اندازه ذرات بزرگتری دارد. رسوبات کریستالی معمولا راحتتر جداسازی و خالص سازی میشوند. همچنین میتواند اندازه ذرات کریستالهای تشکیل شده را با تنظیم حرارت، pH، استفاده از محلول رقیق، افزودن عامل رسوبدهی و … افزایش داد. همچنین فرآیند هضم ذرات با استفاده از محلول داغ (همانند کلوییدها) نیز یکی از روشهای جداسازی بهتر ذرات کریستالی است.
فرآیند هضم به دلیل انحلال و تبلور مجدد (ریکریستاله شدن) قابلیت فیلتر شدن ذرات را افزایش میدهد. به فرآیند تشکیل رسوب کریستالی، تبلور یا کریستالیزاسیون گفته میشود. پیشنهاد می کنیم برای آشنایی بیشتر با این فرآیند، مطلب تبلور مواد مجله فرادرس را مطالعه کنید.
هم رسوبی چیست؟
فرآیند همرسوبی فرآیندی است که طی آن موادی که در محلول حل شدهاند را از محلول به صورت رسوب دارای ناخالصی جدا میکند. در این فرآیند رسوبات ناخواسته، به دلیل فرآیندهایی چون جذب سطحی، تشکیل کریستال مخلوط، انسداد و به دام افتادن مکانیکی ذرات، همراه ماده خالص از محلول خارج میشوند. در ادامه هریک از این فرآیندها را توضیح میدهیم.
جذب سطحی
در این فرآیند ناخالصیها به صورت فیزیک یا شیمیایی به سطح رسوب مورد نظر متصل میشوند. این فرآیند یکی از اصلیترین دلایل پایین آمدن خلوص رسوب در فرآیند وزن سنجی است. برای کاهش این اثر میتوان از شستن محلول کلوییدی با الکترولیت، فرآیند هضم برای کلوییدها و کریستالها و انجام تبلور مجدد استفاده کرد.
تولید کریستال مخلوط
در این فرآیند، کریستال تشکیل شده شامل یونهایی به غیر از یونهای اصلی ترکیب مورد نظر است. برای مثال در کریستالهای سولفات استرانسیم ممکن است مولکولهای سولفات باریم و در کریستالهای منیزیم پتاسیم فسفات ممکن است مولکول منیزیم آمونیوم فسفات وجود داشته باشد. این فرآیند میتواند برای رسوبهای کلوییدی و کریستالی اتفاق بیافتد.

برای کاهش این اثر باید از عوامل رسوبدهی بهتری که به شکل انتخاب عمل میکنند و همچنین انجام فرآیند تبلور مجدد استفاده کرد.
انسداد
انسداد نوعی فرآیند همرسوبی است که در آن یک ترکیب که از یونهای خارجی در لایههای یونی محلول یا کلویید است به صورت فیزیکی در داخل رسوب و به دلیل تشکیل سریع رسوب به دام میافتد. برای حل این مشکل باید از فرآیند هضم استفاده کرد.
به دام افتادن مکانیکی
در این روش همرسوبی، قسمتی از محلول به صورت فیزیکی و به هنگام تشکیل سریع رسوب، داخل آن به دام میافتد. برای حل این مشکل نیز میتوان از فرآیند هضم استفاده کرد.
محاسبات روش وزن سنجی
در روش وزن سنجی پس از انجام آزمایش نیاز است تا جرم آنالیت، رطوبت یا گاز آزاد شده را محاسبه کنیم. در تمامی این موارد، دقت در توزین رسوبات و نمونهها و ظروف بسیار حائز اهمیت است. برای محاسبه جرم موارد زیر به این صورت عمل میکنیم.
- جرم آنالیت: کم کردن جرم بوته پس از رسیدن به وزن ثابت از جرم بوته و آنالیت اولیه
- جرم آب از دست رفته: کم کردن جرم آنالیت خشک از جرم آنالیت قبل از حرارت دادن
- جرم گاز آزاد شده: کم کردن جرم ظرف و نمونه پس از حرارت از جرم ظرف و نمونه قبل از حرارت ( همچنین در صورت استفاده از جاذب میتوان از اختلاف جرم جاذب قبل و بعد از آزمایش استفاده کرد.)
در نهایت پس از به دست آوردن اختلاف جرم یکی از موارد بالا و با توجه به واکنش شیمیایی انجام شده میتوانیم مقدار آنالیت موجود در نمونه را بیابیم. مقدار آنالیت معمولا بر حسب درصد جرم گزارش میشود و محاسبات آن مشابه محاسبات درصد جرمی است.
برای انجام محاسبات این روش باید جرم به دست آورده شده بر جرم نمونه تقسیم شده یا به مول تبدیل شود و به موارد خواسته شده با استفاده از ضرایب تبدیل استوکیومتری تبدیل شود. برای درک بهتر این موارد به مثالهای زیر دقت کنید.
مثال ۱
نمونهای به جرم ۰٫۷۳۳۶ گرم از یک آلیاژ که شامل مس و روی است در اسید کلریدریک ۸ مولار حل شده و در یک بالن ژوژه تا حجم ۱۰۰ میلیلیتر رقیق میشود. در یک آزمایش، مقدار روی موجود در ۲۵ میلیلیتر این محلول به صورت رسوب داده میشود و سپس به شکل جدا میگردد که ۰٫۱۱۶۳ گرم از این ترکیب به دست میآید.
درصد وزنی روی در این نمونه چقدر است؟
پاسخ
قانون پایستگی جرم میگوید تمام روی (Zn) موجود در آلیاژ، در نهایت در محصول یافت میشود. از فرمول شیمیایی این ترکیب مشخص است که در هر مول محصول ۲ مول روی وجود دارد.
سپس برای محاسبه درصد جرمی روی کافی است این مقدار را بر جرم نمونه تقسیم کردم و در ۱۰۰ ضرب کنیم.

مثال ۲
یک نمونه سنگ سیلیکاتی با جرم ۰٫۸۱۴۳ گرم به محلول تبدیل شده و سپس به گونهای فرآوری میشود که ۰٫۲۶۹۲ گرم مخلوط و به دست میآید. این مخلوط کلرید در ترکیبی از اتانول و آب حل شده و با واکنش داده میشود و ۰٫۳۳۱۴ گرم رسوب میکند. درصد وزنی در سنگ سیلیکاتی را محاسبه کنید.
پاسخ
برای پاسخ به این سوال باید دادههای سوال را به صورت معادلاتی بنویسیم. برای این کار به صورت زیر عمل میکنیم.
با این دو فرمول ۳ مورد مجهول جرم سدیم کلرید، پتاسیم کلرید و پتاسیم کلرات را داریم. با محاسبه جرم یکی از اجرا بر حسب دیگری و با استفاده از آن میتوانیم تعداد متغیرها را کاهش داده و معادله را حل کنیم. برای این کار از جرم مولی پتاسیم کلرید، پتاسیم کلرات و نسبت برابر کلر آنها استفاده میکنیم. این محاسبات به شکل زیر است.
در صورت سوال جرم پتاسیم کلرات به ما داده شده است و میتوانیم با معادله بالا، جرم پتاسیم کلرید را به دست آوریم.
سپس با استفاده از معادلاتی که در ابتدا نوشتیم، جرم سدیم کلرید به دست میآید.
در نهایت میتوانیم با استفاده از نسبت مولی سدیم در سدیم کلرید و سدیم اکسید و جرم به دست آمده سدیم کلرید، درصد جرمی سدیم اکسید نمونه را محاسبه کنیم.
الزامات روش وزن سنجی
برای دست یابی به اطلاعات دقیق و قابل استناد در روش وزن سنجی، باید شرایط انجام آنالیز برقرار باشد. در ادامه، مواردی که باید برای دستیابی به آنالیز وزن سنجی دقیق برقرار باشند را توضیح میدهیم.
- آنالیت مورد نظر باید به طور کامل رسوب کند.
- رسوب باید قبل از توزین کاملا خالص باشد.
- رسوب باید به شکلی باشد که بتوان آن را به راحتی فیلتر، شست و شو و توزین کرد.
- مهمترین شرط در وزن سنجی، انتخاب یک رسوب نامحلول است که پایداری کافی داشته باشد و برای انجام مراحل مختلف مناسب باشد.

خطاهای روش وزن سنجی
روش انالیز وزن سنجی مانند سایر روشهای آنالیز همواره با خطاهایی همراه است. شناخت این خطاها و جلوگیری از آنها میتواند به دقیقتر بودن نتایج کمک کند. در ادامه برخی از این عوامل خطا را توضیح میدهیم.
- اشتباه در مراحل توزین نمونه
- رسوبدهی ناقص یا معیوب
- آتشدادن رسوب در دمای خیلی پایین یا خیلی بالا
- قرار گرفتن رسوب آتشداده شده در معرض هوا
- استفاده از معرفها و تجهیزات نامرغوب
- خشکنشدن کامل رسوب پیش از توزین
- آلودگی نمونه یا رسوب با ناخالصیها
- از دست رفتن بخشی از ماده در مراحل فیلتراسیون و انتقال
- در نظر نگرفتن خطاهای همرسوبی در محاسبات نتیجه
جلوگیری از خطاهای وزن سنجی
در قسمت قبل آموختیم خطاهای موجود در روش وزن سنجی چیست. برای جلوگیری و کاهش این خطاها میتوان اقداماتی را طی انجام این روش انجام داد. این اقدامات را در ادامه توضیح میدهیم.
- از آنجا که روش وزن سنجی روشی خسته کننده و طولانی است، تمامی مراحل باید با صبر و دقت بالا انجام شوند.
- استفاده از محلول های رقیق برای رسوبگیری به دلیل کمتر بودن احتمال پیش رسوبدهی آنها مناسبتر هستند.
- عامل رسوبدهی باید به آرامی و همراه با هم زدن محلول اضافه شود. این کار باعث میشود کریستالهای تشکیل شده بزرگتر باشند و احتمال فوق اشباع شدن محلول کاهش یابد.
- رسوبدهی باید در شرایط دمایی بالا و گرم انجام شود زیرا تشکیل رسوب در دماهای بالا مطلوبتر است.
- مقدار کمی عامل رسوبدهی اضافی باید طی فرآیند رسوبگیری به محلول اضافه شود. با اینحال افزودن مقدار بسیار زیاد عامل رسوبدهی اضافه باعث آلوده شدن رسوب آنالیت میشود.
مزایای روش وزن سنجی
با وجود اینکه روش وزن سنجی میتواند با خطاهای بسیاری همراه باشد، در صورت استفاده صحیح از این روش میتوانیم به دادههای دقیقی برسیم و این روش یکی از دقیقترین روشها برای آنالیز مواد شیمیایی به شمار میآید. در ادامه برخی از مزایای این روش آنالیز را نام میبریم.
- در این روش از تجهیزات ساده و کمهزینهای استفاده میشود.
- در این روش خطاهای مربوط به ابزار و تجهیزات تقریبا صفر است و نیازی به استانداردسازی ندارد.
- این روش تقریبا برای تمامی کاتیونها و آنیونها قابل استفاده است.
- میتوان از این تکنیک برای گونههای خنثی مانند ید، کربن دی اکسید، آب و گوگرد دی اکسید استفاده کرد.
- این روش برای طیف گستردهای از مواد آلی مانند لاکتور، سالیسیلاتها، نیکوتین و کلسترول به کار میورد.
- خطاهای ناشی از وجود ناخالصیها در این روش به راحتی بررسی میشوند.
معایب روش وزن سنجی
همانطور که در قسمتهای قبل آموختیم، روش وزن سنجی میتواند با محدودیتها و معایبی نیز همراه باشد. در ادامه برخی از این معایب را نام میبریم.
- این روش به دلیل بالا بودن حجم نمونه یک روش ماکروسکوپیک است و برای مقادیر بسیار کم قابل استفاده نیست.
- مطالعه یک عنصر یا گروه کوچکی از عناصر باید به شکل جداگانه در هر بار آزمایش انجام شود.
- مراحل این روش معمولا پیچیده است و اشتباه کوچکی در فرآیند میتواند نتیجه آزمایش را به شکل قابل توجهی تحت تاثیر قرار دهد.
- این روش زمان بر و دشوار است و صبر زیادی را میطلبد.

کاربرد وزن سنجی
وزن سنجی بهطور گسترده در صنایعی مانند داروسازی، تصفیه آب، معدن، متالورژی و پایش محیطزیست کاربرد دارد. این روش همچنین در کنترل کیفیت محصولات غذایی (مانند تعیین میزان چربی در شیر)، سنجش عیار طلا در جواهرات، اندازهگیری مواد معدنی در آب و تعیین ناخالصیها در سنگهای معدنی مورد استفاده قرار میگیرد.
یادگیری شیمی دانشگاهی با فرادرس
در قسمتهای قبل آموختیم وزن سنجی چیست و روشهای مختلف آن کدام است. برای درک بهتر این روش و سایر روشهای آنالیز مواد نیاز است با مفاهیمی چون پتانسیومتری، الکتروشیمی، انواع پیلهای الکتروشیمیایی، کولنسنجی، وسایل آزمایشگاهی و ایمنی در آزمایشگاه شیمی آشنا شویم. پیشنهاد میکنیم برای یادگیری این مسائل و مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه آزمایشگاه شیمی تجزیه دسترسی داشته باشید.
تفاوت روش وزن سنجی و روش حجم سنجی
در این مطلب از مجله فرادرس آموختیم وزن سنجی چیست. روش حجم سنجی که معمولا با استفاده از تیتراسیون انجام میشود نیز یکی دیگر از روشهای محبوب و ساده آنالیز نمونه است. تفاوت این دو روش این است که در روش حجم سنجی، مقدار عنصر نمونه را استفاده از اندازهگیری حجم آن انجام میشود. اما در روش وزن سنجی مقدار آنالیت بر اساس جرم آن تعیین میشود.
در روش حجم سنجی، مقدار آنالیت بر حسب حجم آن گزارش میشود. حجم سنجی اساس کار آزمایشهای تیتراسیون است و تیتراسیون رسوبی نباید با روش وزن سنجی اشتباه گرفته شود. با اینکه در تیتراسیون رسوبی، رسوب تشکیل میشود، از تشکیل رسوب در محاسبات استفاده نمیشود و تنها حجم تیترانت استفاده شده اساس محاسبات قرار میگیرد. در روش تیتراسیون رسوبی از زمان تشکیل رسوب برای یافتن نقطه اکیوالان و کامل شدن واکنش استفاده میشود.
source
