ترکیب درصد یک ترکیب شیمیایی نسبت هر عنصر تشکیل دهنده آن را به تمامی عناصر سازنده بر حسب درصد بیان میکند. این پارامتر با تقسیم جرم مولی عناصر سازنده ترکیب بر جرم مولی کل ترکیب ضرب در عدد ۱۰۰ به دست میآید. ترکیب درصد هر ماده میتواند اجزای تشکیل دهنده ماده را به صورت کمی مشخص کند و برای آنالیز ترکیبات سازنده مواد به کار میرود. در این مطلب از مجله فرادرس میآموزیم ترکیب درصد چیست و چگونه محاسبه میشود.
آنچه در این مطلب میآموزید:
-
میآموزید ترکیب درصد چیست و فرمول محاسبه آن کدام است.
-
با روش محاسبه ترکیب درصد با استفاده از فرمول شیمیایی آشنا میشوید.
-
میتوانید ترکیب درصد را با استفاده از جرم عناصر محاسبه کنید.
-
روش پیدا کردن فرمول تجربی و مولکولی مواد را میآموزید.
-
با کاربرد ترکیب درصد در زندگی آشنا میشوید.
-
معایب استفاده از ترکیب درصد در محاسبات را درک میکنید.

در ابتدای این مطلب میآموزیم ترکیب درصد چیست و فرمول محاسبه آن کدام است. سپس روش محاسبه ترکیب درصد را به دو روش بررسی میکنیم. در ادامه، روش پیدا کردن فرمول تجربی و مولکولی را با استفاده از ترکیب درصد میآموزیم و با کاربرد این پارامتر در زندگی آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید ترکیب درصد چیست.
ترکیب درصد چیست؟
ترکیب درصد نسبت عناصر سازنده یک ترکیب شیمایی را به کل عناصر آن ترکیب بر حسب درصد بیان میکند. این پارامتر که اغلب به وسیله نسبت جرم مولی اجزای سازنده به جرم مولی کل ترکیب محاسبه میشود، میتواند نسبت جرم عناصر را در نمونه مشخص کند.
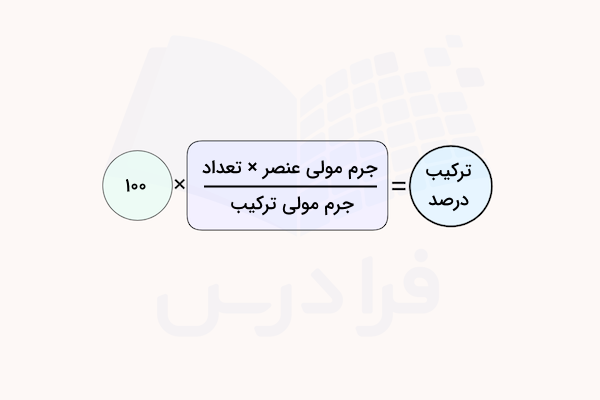
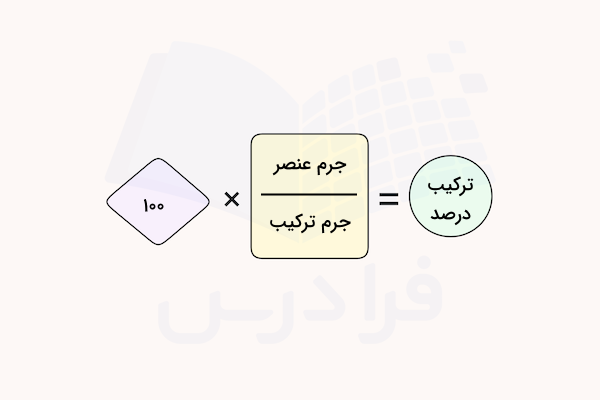
هر ترکیب شمیایی از دو یا چند عنصر تشکیل شده است. برای مطالعه ترکیبات شیمیایی ممکن است نیاز باشد تا نسبت دقیق اجزا تشکیل دهنده آن را بدانیم. ترکیب درصد پارامتری است که برای این مطالعات به کار میرود. درصد عناصر تشکیل دهنده هر ترکیب، مشخص کننده خواص فیزیکی و شیمیایی آن و رفتار آن در واکنشهای شیمیایی است. با مشخص بودن فرمول شیمیایی هر ترکیب میتوان به راحتی ترکیب درصد عناصر آن را با تقسیم جرم مولی عنصر به جرم مولی ترکیب ضربدر عدد ۱۰۰ به دست آورد.

فرمول ترکیب درصد چیست؟
ترکیب درصد ترکیبات شیمیایی با استفاده از فرمول زیر به دست میآید.
ترکیب درصد = (جرم مولی یک عنصر خاص در ترکیب × تعداد آن) ÷ جرم مولی ترکیب شیمیایی × ۱۰۰
ترکیب درصد در برخی از منابع و کتب با عنوان درصد جرمی یا درصد جرمی عناصر معرفی شده است. این نامگذاری به دلیل این است که مقدار درصد اجزا را بر حسب جرم مولی آنها به دست میآوریم. برای مثال کربن دی اکسید از ۲۷٫۲۹ درصد کربن و ۷۲٫۷۱ درصد اکسیژن تشکیل شده است. پس ترکیب درصد کربن دی اکسید برابر با ٪ ۲۷٫۲۹ کربن و ٪ ۷۲٫۷۱ اکسیژن است. همچنین، ترکیباتی که تنها از یک عنصر تشکیل شدهاند، (مانند مولکول دو اتمی هیدروژن) از ۱۰۰ درصد آن عنصر تشکیل شدهاند.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر اینکه ترکیب درصد چیست، ابتدا باید با مفاهیمی چون جرم مولی، مفهوم درصد، فرمول شیمیایی و جدول تناوبی عناصر آشنا شویم. پیشنهاد میکنیم برای یادگیری این مفاهیم و مطالب، مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی را مشاهده کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین میتوانید با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، به آموزشهای بیشتری در زمینه ترکیب درصد دسترسی داشته باشید.
محاسبه ترکیب درصد
ترکیب درصد را میتوان با استفاده از دو روش به دست آورد. یکی از این روشها استفاده از فرمول شیمیایی ماده و دیگری استفاده از جرم داده شده در صورت سوال است. در ادامه، این روشهای محاسبه را بررسی میکنیم.
محاسبه ترکیب درصد با استفاده از فرمول شیمیایی
فرمول شیمیایی مواد، اطلاعات دقیقی از عناصر تشکیل دهنده ترکیبات و نسبت حضور هریک از این عناصر در ترکیب را مشخص میکند. هر عنصر با نماد شیمیایی در فرمول شیمیایی ترکیب نوشته شده و تعداد این عناصر به شکل زیروند در سمت راست نماد آنها قرار میگیرد.
برای محاسبه ترکیب درصد یک ترکیب شیمیایی با استفاده از فرمول آن، باید مراحل زیر را دنبال کنیم.
- پیدا کردن جرم مولی تمامی عناصر تشکیل دهنده ترکیب شیمیایی با استفاده از جدول تناوبی عناصر بر حسب گرم بر مول
- به دست آوردن جرم مولی ترکیب با استفاده از جمع جرم مولی اجزای سازنده ترکیب
- تقسیم جرم مولی هر عنصر ضرب در تعداد آن به صورت جداگانه بر جرم مولی کل ترکیب شیمیایی
- ضرب عدد به دست آمده در عدد ۱۰۰
باید به این نکته توجه داشت که در صورت صحیح بودن محاسبات انجام شده، جمع درصدهای به دست آمده برای هر عنصر باید برابر با عدد ۱۰۰ شود.
مثال
برای درک بهتر این محاسبات، ترکیب درصد اجزای سازنده فسفر پنتاکلرید با فرمول شیمیایی را به دست میآوریم.
پاسخ
در اولین قدم باید جرم مولی عناصر تشکیل دهنده ترکیب یعنی فسفر و کلر را با استفاده از جدول تناوبی عناصر به دست آوریم. جرم مولی هر عنصر با عددی در این جدول مشخص شده است.
- جرم مولی فسفر: ۳۰٫۹۷۴ گرم بر مول
- جرم مولی کلر: ۳۵٫۴۵۳ گرم بر مول
سپس جرم مولی کل ترکیب را محسابه میکنیم. برای این کار باید جرم مولی هر عنصر را در تعداد آن ضرب کرده سپس باهم جمع کنیم.
جرم مولی فسفر پنتا کلرید = ۳۰٫۹۷۴ + (۵ × ۳۵٫۴۵۳) = ۲۰۸٫۲۳۹
در نهایت برای به دست آوردن ترکیب درصد هریک از اجزا، جرم مولی آن عناصر را بر جرم مولی کل تقسیم میکنیم. باید دقت داشته باشیم، اگر بیش از یک عنصر در یک ترکیب وجود داشته باشد باید تعداد آن عنصر نیز در فرمول ترکیب درصد لحاظ شود.
ترکیب درصد فسفر:
ترکیب درصد کلر:
بنابراین، فسفر پنتاکلرید از ٪۱۴٫۸۷ فسفر و ٪۸۵٫۱۳ کلر تشکیل شده است. جمع این دو مقدار برابر با عدد ۱۰۰ است.
محاسبه ترکیب درصد با استفاده از جرم داده شده
در برخی از مسائل ممکن است جرم نمونه بر حسب گرم و جرم عناصر تشکیل دهنده ماده مشخص شود. در این سوالات کافی است با تقسیم جرم عنصر به جرم ترکیب و ضرب آن در عدد ۱۰۰، ترکیب درصد عنصر در ترکیب را به دست آوریم.
برای مثال، اگر یک نمونه ۱۰ گرمی از عناصر کربن و هیدروژن داشته باشیم که حاوی ۲٫۵ گرم هیدروژن و ۷٫۵ گرم کربن است، ترکیب درصد اجزای آن به روش زیر به دست میآید.
حل مثال و تمرین از ترکیب درصد
برای درک بهتر اینکه روش محاسبه ترکیب درصد چیست، به مثالهای زیر دقت کنید.
مثال ۱
چه جرمی از کربن در ۳ گرم بوتان با فرمول شیمیایی وجود دارد؟
پاسخ
برای پاسخ به این سوال ابتدا ترکیب درصد کربن را در ترکیب بوتان به دست آورده و سپس آن را در جرم بوتان داده شده (۳ گرم) ضرب میکنیم تا جرم کربن موجود به دست آید. جرم مولی کربن ۱۲٫۰۱ گرم بر مول و جرم مولی هیدروژن ۱٫۰۱ گرم بر مول است.
جرم مولی بوتان به روش زیر به دست میآید.
سپس ترکیب درصد کربن را در بوتان به دست میآوریم.
سپس نسبت کربن موجود در این ترکیب را در جرم آن ضرب میکنیم تا جرم کربن به دست آید.
مثال ۲
آنالیز ۱۲٫۰۴ گرم از یک ماده که از اتمهای کربن، هیدروژن و نیتروژن تشکیل شده است، نشان میدهد این ماده از ۷٫۳۴ گرم کربن، ۱٫۸۵ گرم هیدروژن و ۲٫۸۵ گرم نیتروژن تشکیل شده است. ترکیب درصد این اجزا را در این ترکیب شیمیایی به دست آورید.
پاسخ
برای به دست آوردن ترکیب درصد اجزا این ترکیب کافی است جرم داده شده برای هر عنصر را بر جرم کلی ترکیب تقسیم کنیم. در این مثال، به دلیل اینکه جرم عناصر به صورت مستقیم داده شده است، نیازی به بدست آوردن جرم مولی عناصر و ترکیب نیست.
مثال ۳
آسپرین، یک ترکیب شیمیایی با فرمول است. ترکیب درصد اجزای این ماده را به دست آورید.
پاسخ
برای به دست آوردن ترکیب درصد اجزای آسپرین از روی فرمول شیمیایی آن نیاز است ابتدا جرم مولی کربن، هیدروژن و اکسیژن را از جدول تناوبی به دست آورده سپس جرم مولی آسپرین را محاسبه کنیم. در نهایت با تقسیم جداگانه جرم مولی عناصر در تعداد آنها بر جرم مولی آسپرین و ضرب آن در عدد ۱۰۰، درصد ترکیب اجزای آن به دست میآید.
- جرم مولی کربن: ۱۲٫۰۱۱ گرم بر مول
- جرم مولی هیدروژن: ۱٫۰۰۷۹۴ گرم بر مول
- جرم مولی اکسیژن: ۱۵٫۹۹۴ گرم بر مول
- جرم مولی آسپرین: ۱۸۰٫۱۶۰ گرم بر مول
درصد کربن، هیدروژن و اکسیژن به طریق زیر به دست میآید.
همانطور که مشاهده میکنید، محاسبه صحیح جرم مولی ترکیبات، یکی از مراحل مهم در محاسبه جرم مولی است. پیشنهاد میکنیم برای درک بهتر این پارامتر، فیلم آموزش جرم مولی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال ۴
مقدار عنصر هیدروژن موجود در ۵ گرم آب بر حسب درصد چقدر است؟
پاسخ
در این سوال، جرم کلی نمونه آب داده شده است. برای حل مسئله باید ابتدا مقدار هیدروژن موجود در ۵ گرم آب را با استفاده از نسبت اتمهای هیدروژن و اکسیژن بر حسب گرم به دست آوریم. برای این کار ابتدا گرم آب را به مول آب تبدیل کرده و سپس با استفاده از نسبت آن با اتم هیدروژن از روی مول هیدروژن و جرم مولی آن، گرم هیدروژن به دست میآید. محاسبات برای این کار به شکل زیر است.
سپس با تقسیم جرم هیدروژن به جرم کل نمونه میتوانیم درصد آن را به دست آوریم.
دقت داشته باشید در برخی از مسائل ممکن است بجای واژه ترکیب درصد از واژه «درصد جرمی» استفاده شود. این واژه نباید با درصد جرمی محلول که یکی از واحدهای غلظت است اشتباه گرفته شود. برای آشنایی بیشتر با این واحد و تفاوت آن با ترکیب درصد، مطلب درصد جرمی چیست را در مجله فرادرس مطالعه کنید. برای درک بهتر مثالهای حل شده، تمرینات زیر را انجام دهید.
تمرین ۱
مقدار ترکیب درصد عنصر هیدروژن در پروپانول با فرمول شیمیایی را به دست آورید.
برای به دست آوردن ترکیب درصد هیدروژن در پروپانول کافی است جرم مولی هیدروژن را در تعداد آن ضرب کرده و سپس آن را بر جرم مولی پروپانول تقسیم کرده و در عدد ۱۰۰ ضرب کنیم.
تمرین ۲
دی کلرین هپتوکسید با فرمول شیمیایی یک ماده به شدت واکنشپذیر است که در برخی از واکنش های آلی استفاده میشود. ترکیب درصد اکسیژن در این ماده چه قدر است؟
برای به دست آوردن ترکیب درصد اکسیژن در این ماده باید جرم مولی اکسیژن در تعداد آن را بر جرم مولی کل ماده تقسیم کرده و در عدد ۱۰۰ ضرب کنیم.
پیدا کردن فرمول مولکولی و فرمول تجربی با ترکیب درصد
فرمول مولکولی و فرمول تجربی فرمولهای شیمیایی هستند که مقادیر نسبت عناصر تشکیل دهنده را در یک ترکیب شیمیایی مشخص میکنند. فرمول تجربی، ساده ترین نسبت عناصر را در ترکیب مشخص میکند و فرمول مولکولی (فرمول شیمیایی) مقادیر دقیق و واقعی این عناصر را در ترکیب نشان میدهد.
برای مثال، در ترکیب هیدروژن پراکسید (آب اکسیژنه)، فرمول تجربی ماده و فرمول مولکولی آن است. ترکیب درصد ترکیبات شیمیایی یک پارامتر کاربردی در محاسبه و پیدا کردن نسبت عناصر در ترکیب و دستیابی به فرمول تجربی و مولکولی آنها است. در ادامه، میآموزیم روش پیدا کردن هر یک از این فرمولها با استفاده از ترکیب درصد چیست.
پیدا کردن فرمول تجربی
برای پیدا کردن فرمول تجربی ترکیبات، باید ترکیب درصد ماده را داشته باشیم. پس از آن، با استفاده از ترکیب درصد، درصد جرم هر یک از عناصر را در ترکیب پیدا کرده و با استفاده از جرم مولی عناصر، مقدار تقریبی مول هر عنصر را در ترکیب به دست میآوریم. در نهایت با استفاده از نسبتهای مولی به دست آمده میتوانیم فرمول تجربی ماده را بنویسیم. مراحل پیدا کردن فرمول تجربی با استفاده از ترکیب درصد به شکل زیر است.
- پیدا کردن ترکیب درصد ماده
- استفاده از ترکیب درصد برای به دست آوردن نسبت جرمی عناصر
- استفاده از جرم مولی عناصر برای پیدا کردن نسبت مولی عناصر
- تقسیم مقادیر مول بر کوچک ترین مول به دست آمده
- نوشتن فرمول تجربی
برای درک بهتر این مراحل، به مثالهای زیر دقت کنید.

مثال ۱
ترکیبی حاوی ٪۷۲ عنصر کلر، ٪۲۴ عنصر کربن و ٪۴ عنصر هیدروژن است. فرمول تجربی این ترکیب را بیابید.
پاسخ
برای پیدا کردن فرمول تجربی ابتدا نسبت جرم این عناصر را در ۱۰۰ گرم ماده به دست میآوریم. (درصدها را بر حسب گرم مینویسیم.)
- ۷۲ گرم کلر
- ۲۴ گرم کربن
- ۴ گرم هیدروژن
سپس با با تقسیم این مقادیر بر جرم مولی این عناصر، مقدار تقریبی تعداد مول مواد را در ترکیب به دست میآوریم.
در نهایت باید فرمول تجربی ماده را بنویسیم. دقت داشته باشید که فرمول تجربی مواد، سادهترین نسبت مواد را در ترکیب مشخص میکند. بنابر این اعداد به دست آمده را باید بر کوچکترین تعداد مول به دست امده تقسیم کنیم تا نسبتها ساده شوند.
پس فرمول تجربی این ماده به شکل است.
مثال ۲
یک نمونه از سنگ سیاه هماتیت که از اکسید آهن تشکیل شده است، شامل ۳۴٫۹۷ گرم آهن و ۱۵٫۰۳ گرم اکسیژن است. فرمول تجربی این سنگ را پیدا کنید.
پاسخ
در این سوال، جرم هر یک از عناصر سازنده ماده به شکل مستقیم به ما داده شده است. برای پیدا کردن فرمول تجربی، ابتدا تعداد مول آهن و اکسیژن موجود در این نمونه را با استفاده از جرم مولی این عناصر به دست میآوریم.
سپس این مقادیر را بر کوچکترین مول به دست آمده تقسیم میکنیم تا نسبت عناصر به دست آید.
پس فرمول تجربی این ماده است. دقت داشته باشید که در فرمول مواد نمیتوانیم نسبت اعشاری داشته باشیم به همین دلیل مقادیر بالا در عدد ۲ ضرب شدند.
پیدا کردن فرمول مولکولی
برای یافتن فرمول مولکولی ترکیبات، تمامی مراحل را مانند پیدا کردن فرمول تجربی انجام میدهیم. در نهایت باید با داشتن جرم مولی ترکیب و تقسیم جرم مولی ترکیب بر جرم مولی فرمول تجربی، نسبت دقیق عناصر تشکیل دهنده را به دست میآوریم. مراحل به دست آوردن فرمول مولکولی با استفاده از ترکیب درصد به شرح زیر است.
- پیدا کردن ترکیب درصد ماده
- استفاده از ترکیب درصد برای به دست آوردن نسبت جرمی عناصر
- استفاده از جرم مولی عناصر برای پیدا کردن نسبت مولی عناصر
- نوشتن فرمول تجربی
- تقسیم جرم مولی ترکیب بر جرم مولی فرمول تجربی
- نوشتن فرمول مولکولی با نسبتهای دقیق
برای درک بهتر این مراحل محاسبه، به مثال زیر دقت کنید.
مثال
نیکوتین ماده ای آلی است که از ۷۴٫۰۲ درصد کربن، ۸٫۷۱۰ درصد هیدروژن و ۱۷٫۲۷ درصد نیتروژن تشکیل شده است. اگر ۴۰٫۵۷ گرم نیکوتین حاوی ۰٫۲۵ مول از این ماده باشد، فرمول مولکولی آن را به دست آورید.
پاسخ
برای به دست آوردن فرمول مولکولی هر ترکیب، ابتدا باید فرمول تجربی آن را به دست آوریم. ابتدا درصدها را به گرم تبدیل کرده و با استفاده از جرم مولی عناصر، تعداد مول آنها را به دست میآوریم.
سپس با تقسیم این اعداد بر کوچکترین تعداد مول۷ نسبتهای مولی را به دست میآوریم.
بنابراین فرمول تجربی این ماده است. حال باید جرم مولی فرمول تجربی ماده را به دست آوریم. جرم مولی فرمول تجربی این ترکیب ۸۱٫۱۳ گرم بر مول است. حال برای پیدا کردن فرمول مولکولی باید جرم مولی ترکیب را به دست آورده و بر جرم فرمول تجربی آن تقسیم کنیم تا ضریب نسبتهای مولی عناصر به دست آید. برای این کار جرم ماده را بر مول داده شده در صورت سوال تقسیم میکنیم.
پس فرمول مولکولی این ماده به شکل زیر است.
کاربرد ترکیب درصد در زندگی
ترکیب درصد مواد مختلف نقش مهمی در زندگی روزمره انسان ها دارد. از این پارامتر در برچسب اطلاعات و ارزش غذایی محصوالات خوراکی و تحقیقات مختلف برای ساخت ترکیبات و وسایل استفاده میشود. در ادامه این موارد را توضیح میدهیم.

برچسب اطلاعات مواد غذایی
در برچسب ارزش غذایی تمامی ترکیبات خوراکی فرآوری شده، مقدار مواد و ترکیبات مهم موجود در این مواد غذایی بر حسب درصد بیان میشود. این درصدهای نوشته شده در واقع همان ترکیب درصد این اجزا در این مواد خوراکی است. برای مثال، در اکثر برچسبهای ارزش غذایی مواد مختلف، درصد کل چربی، کلسترول، سدیم، کربوهیدرات، قند و پروتئین مواد مشخص میشود.
همچنین، این گروهها در زیرگروههای دیگری مانند چربی اشباع و چربی ترانس نیز گزارش میشوند. برخی از این درصدهای گزارش شده به درصد مورد نیاز مصرف روزانه تبدیل شده و گزارش میشوند.
سایر کاربردهای ترکیب درصد
ترکیب درصد در بسیاری دیگر از صنایع و تحقیقات کاربردهای فراوانی دارد. در ادامه، برخی از این کاربردها را توضیح میدهیم.
- تحقیقات: به دست آوردن خلوص مواد شیمیایی
- علوم زیست محیطی: کمک به آنالیز آلایندهها
- علم مواد: مطالعه ترکیب آلیاژها، سرامیکها و مواد
- علوم جنایی: کمک به شناخت ترکیب مواد ناشناخته و مورد تحقیق
- داروسازی: به دست آوردن نسبت مناسب عناصر و مواد برای استفاده در داروها
- کشاورزی: شناسایی و آنالیز کودهای شیمیایی و بهینهسازی آنها
معایب ترکیب درصد
ترکیب درصد با وجود اینکه یکی از پارامترهای کاربردی در تشخیص اجزای تشکیل دهنده مواد مختلف است، معایبی نیز مانند مشخص نکردن ساختار دقیق ماده و … دارد. در ادامه برخی از این معایب را توضیح میدهیم.
- مشخص نکردن ساختار دقیق ماده: ترکیب درصد جزئیات دقیقی را در مورد ترتیب قرارگیری اتمها و ساختار ماده مشخص نمیکند.
- کاربردی نبودن در مخلوط های پیچیده: ترکیب درصد را نمیتوان برای مخلوطهای متشکل از چندین ترکیب استفاده کرد.
- نیاز به دادههای دقیق: محاسبه صحیح ترکیب درصد مواد نیازمند دسترسی به دادههایی بسیار دقیق در مورد هر عنصر است و این کار در عمل بسیار مشکل است.
- نامشخص بودن ترکیب مولکولی: در صورت بررسی نمونههای مجهول ممکن است چند ماده با فرمول های مولکولی متفاوت داشته باشیم که ترکیب درصد مشابهی دارند.
- وابستگی به شرایط اندازهگیری: ترکیب درصد میتواند بسته به اشتباهات و خطاها در اندازهگیری مقدار عناصر، مقادیر متفاوتی داشته باشد.
آزمون ترکیب درصد
برای درک بهتر انچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید. همچنین میتوانید پس از پاسخدهی به سوالات با کلیک بر روی گزینه دریافت نتیجه آزمون، تعداد پاسخهای صحیح خود را مشاهده کنید.
ترکیب درصد اجزای سزیم فلوئورید را به دست آورید.
و
و
و
و
برای پیدا کردن ترکیب درصد اجزا باید جرم مولی عناصر را بر جرم مولی ترکیب تقسیم کنیم.
ترکیب درصد اجزای کربن تترا کلرید با فرمول شیمیایی را به دست آورید.
و
و
و
و
برای پیدا کردن ترکیب درصد اجزا باید جرم مولی عناصر را بر جرم مولی ترکیب تقسیم کنیم.
درصد یون کلسیم را در ترکیب به دست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
درصد آمونیاک موجود در ماده تا سه رقم اعشار به دست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
ترکیب درصد اجزای کربن دی اکسید را به دست آورید.
و
و
و
و
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
ترکیب درصد اجزای سدیم کلرید را به دست آورید.
و
و
و
و
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
کدام گزینه در مورد ترکیب درصد اجزای آمونیاک صحیح است
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چند گرم از ماده شامل ۴٫۲۳ گرم باریم خواهد بود اگر این ماده ۸۶٫۹ درصد باریم داشته باشد؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
فرمول تجربی ماده ای که از ٪۴۰ کربن، ٪۶٫۷۱ هیدروژن و ۵۳٫۲۸ گرم اکسیژن تشکیل شده است را بیابید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
فرمول مولکولی ترکیبی با ٪۴۹٫۴۷ کربن، ٪ ۲۸٫۳۴ نیتروژن، ٪۵٫۲۰۱ هیدروژن و ۱۶٫۴۸ درصد اکسیژن و جرم مولی ۱۹۴٫۲ گرم بر مول را بیابید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
