محلول استاندارد محلولی است که از مواد استاندارد با غلظت مشخص و حجم مشخص تهیه میشود و در آزمایشگاه شیمی نگهداری و استفاده میشود. این محلولها در دو نوع اولیه با خلوص بالا و ثانویه با خلوص پایینتر تهیه میشوند. محلولهای استاندارد میتوانند با دقت بالایی برای استانداردسازی و اندازهگیری غلظت سایر مواد استفاده شوند. در این مطلب از مجله فرادرس میآموزیم محلول استاندارد چیست و انواع و ویژگیهای آن کدامند.
آنچه در این مطلب میآموزید:
-
محلول استاندارد و ویژگیهای آن را به طور کامل میآموزید.
-
تفاوت محلول استاندارد اولیه و ثانویه را درک میکنید.
-
با مثالهای انواع محلول استاندارد آشنا میشوید.
-
روشهای تهیه محلول استاندارد را به همراه محاسبات آن میآموزید.
-
مزایا و محدودیتهای استفاده از محلول استاندارد را میشناسید.
-
با روشهای استانداردسازی و کاربرد محلول استاندارد آشنا میشوید.

در ابتدای این مطلب میآموزیم محلول استاندارد چیست و چه ویژگیهایی دارد. سپس به بررسی انواع محلولهای استاندارد اولیه و ثانویه پرداخته و تفاوت آنها را توضیح میدهیم. در ادامه به بررسی خواص محلولهای استاندارد پرداخته و روش تهیه این محلولها را توضیح میدهیم. پس از آن به بررسی کاربردهای این محلولها و مزایا و معایب آنها و روشهای استانداردسازی میپردازیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با مفهوم محلول استاندارد آشنا شوید.
محلول استاندارد چیست؟
محلول استاندارد محلولی است که از مواد استاندارد تهیه شده و حجم و غلظت آن مشخص است. از محلولهای استاندارد در آزمایشگاههای شیمی تجزیه برای اندازهگیری غلظت یا تعیین سایر مواد به وسیله تیتراسیون استفاده میشود.
محلولهای استاندارد نقش مهمی در آزمایشها و آنالیزهای تجریهای دارند. از این محلولها برای تعیین خلوص مواد، آزمایشهای خنثی شدن اسید و باز، تعیین کیفیت فرآوردههای جامد، تعیین ذرات با غلظت کم در محلولها و .. استفاده میشود. غلظت محلولهای استاندارد میتواند بر حسب مولاریته، مولالیته، نرمالیته و … اندازهگیری شود.

یادگیری محلول سازی با فرادرس
برای درک بهتر اینکه مفهوم محلول استاندارد چیست، نیاز است ابتدا با مفاهیمی چون استوکیومتری، ترکیبات نمکهای جامد معدنی و اسیدهای تجاری، نحوه تهیه محلول بافر و … آشنا شویم. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش محلولسازی در آزمایشگاه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیتشتری در زمینه محلول استاندارد دسترسی داشته باشید.
محلول استاندارد اولیه چیست؟
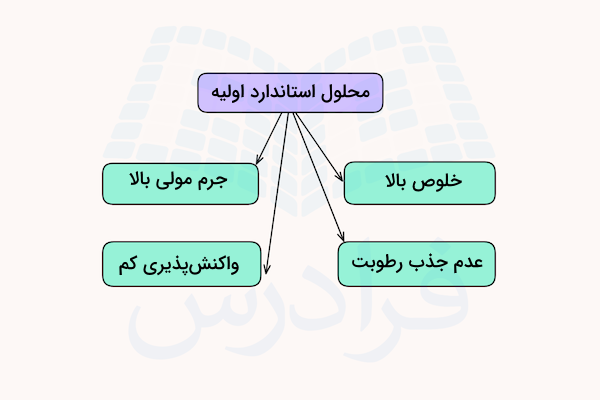
محلول استاندارد اولیه محلولی است که مقدار خلوص و پایداری بسیار بالایی دارد. این محلولها مقدار غلظت بسیار دقیقی دارند که مقدار غلظت مولی ماده حلشونده را در محلول نشان میدهند. خلوص بالای محلول استاندارد اولیه به این معنی است که میتوان مقدار نسبت جرم به حجم این محلولها را با دقت و صحت بسیار بالایی به دست آورد.
مقدار خلوص محلولهای استاندارد اولیه حدودا بالای ۹۹ درصد است. همچنین، این مواد واکنش پذیری کمی دارند و با هوا و آب واکنش نمیدهند. این ویژگیهای محلولهای استاندارد اولیه باعث میشود بتوانیم آنها را برای مدت طولانیتری نگهداری و استفاده کنیم.
به دلیل واکنشپذیری بالای برخی از مواد، از همهی مواد شیمیایی نمیتوان محلول استاندارد اولیه تهیه کرد. برای مثال، سدیم هیدروکسید میتواند کربن دی اکسید هوا را جذب کند و در نتیجه غلظت آن تغییر میکند.
مثال محلول استاندارد اولیه
محلولهای استاندارد اولیه برای استانداردسازی سایر محلولها و محلولهای استاندارد ثانویه استفاده میشوند. در ادامه برخی از محلولهای استاندارد اولیه را معرفی کردهایم.
| ماده استاندارد اولیه | کاربرد |
| سدیم کلرید | استانداردسازی نیترات نقره |
| پودر روی | استانداردسازی محلول EDTA |
| پتاسیم هیدروژن فتالات | استانداردسازی بازها و اسید پرکلریک |
| اسید بنزوئیک | استانداردسازی محلولهای بازی غیرآبی |
| آرسنیک تری اکسید | استانداردسازی سدیم تیوسولفات، ید و پرمنگنات |
| پتاسیم برومات | استانداردسازی سدیم تیوسولفات |
| سدیم کربنات | استانداردسازی اسیدهای قوی |
| اسید سولفانیلیک | استانداردسازی سدیم نیتریت |
سدیم کلرید
سدیم کلرید برای تهیه محلول استاندارد اولیه برای واکنشهای حاوی نیترات نقره استفاده میشود.
پودر روی
از پودر روی برای تهیه محلول استاندارد اولیه برای استانداردسازی اتیلن دی آمین تترا استیک اسید استفاده میشود. حلال این محلول استاندارد معمولا اسید کلریدریک یا سولفوریک اسید است.
پتاسیم هیدروژن فتالات
از محلولتهیه شده از پتاسیم هیدروژن فتالات برای استانداردسازی پرکلریک اسید و استیک اسید استفاده میشود.
محلول استاندارد ثانویه چیست؟
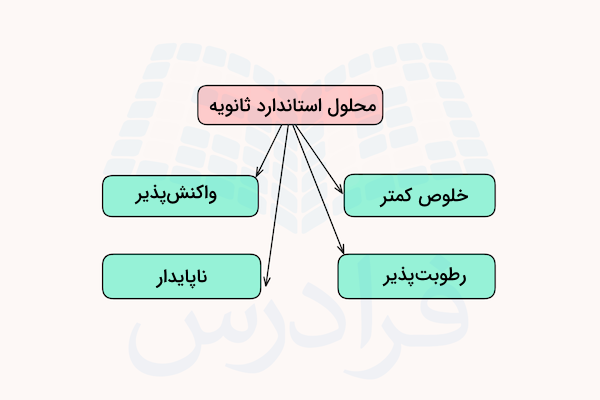
محلولهای استاندارد ثانویه (Secondary Standard) محلولهایی هستند که با استفاده از محلولها استاندارد اولیه استاندارد میشوند. این محلولها به اندازه محلولهای استاندارد اولیه خالص نیستند. همچنین، این محلولها ممکن است مقداری با هوا و آب واکنش دهند. احتمال رطوبت پذیری این مواد وجود دارد و به همین دلیل نیاز است که حتما قبل از استفاده کالیبره شوند.
استاندارد ثانویه را نمیتوان فقط با توزین دقیق تهیه کرد. برای ساختن آن ابتدا یک محلول با غلظت تقریبی آماده میکنیم و سپس با استفاده از استاندارد اولیه، از طریق تیتراسیون، غلظت دقیق آن را اندازهگیری میکنیم.
محلولهای استاندارد ثانویه برای کاربردهای خاص تجزیهای استفاده میشوند. برخی از این کاربردها را در ادامه نام بردهایم.
مثال محلول استاندارد ثانویه
در قسمت قبل آموختیم که محلول استاندارد ثانویه چیست. برخی از نمونههای استاندارد ثانویه را در ادامه معرفی میکنیم.
اسید کلریدریک
اسید کلریدریک مادهای فرار است و هنگام توزین و حتی پس از آن، بخشی از آن به صورت بخار از ظرف محلول خارج میشود. بنابراین، مقدار واقعی اسید کلریدریک در محلول با مقدار واقعی آن متفاوت خواهد بود.
سدیم هیدروکسید
سدیم هیدروکسید مادهای جاذب رطوبت است و به همین دلیل نمیتوان از آن محلول استاندارد اولیه تهیه کرد. علاوه بر این، این ماده با گاز کربن دی اکسید هوا واکنش داده و ترکیبات کربنات تشکیل میدهد و خلوص محلول آن کاهش مییابد. برای تنظیم دقیق غلظت استاندارد سدیم هیدروکسید، از استانداردهای اولیهای مانند پتاسیم هیدروژن فتالات استفاده میشود.
محلول ید
ید نیز مادهای فرار است و میتواند به صورت بخار از ظرف واکنش خارج شود. به همین دلیل این ماده یک استاندارد ثانویه به شمار میآید.
تفاوت محلول استاندارد اولیه و ثانویه
در قسمتهای قبل آموختیم تعریف محلول استاندارد اولیه و محلول استاندارد ثانویه چیست. محلولهای استاندارد اولیه از خلوص بالاتری برخوردارند و پایدارتر هستند. در حالی که محلولهای استاندارد ثانویه میتوانند با جذب رطوبت هوا و واکنش با آن، خلوص و پایداری خود را از دست بدهند. تفاوت محلول استاندارد اولیه و ثانویه را در جدول زیر توضیح دادهایم.
| محلول استاندارد اولیه | محلول استاندارد ثانویه |
| به شدت خالص و پایدار | خلوص کمتر و عموما ناپایدار |
| واکنش ناپذیر | واکنش پذیر |
| وزن مولکولی بالا | وزن مولکولی پایین |
| رطوبت را جذب نمیکند | جاذب رطوبت |
| استفاده مستقیم در تیتراسیون | نیاز به استانداردسازی |
| آمادهسازی با توزین مستقیم ماده | آمادهسازی به وسیله استاندارد اولیه |
خواص محلول استاندارد
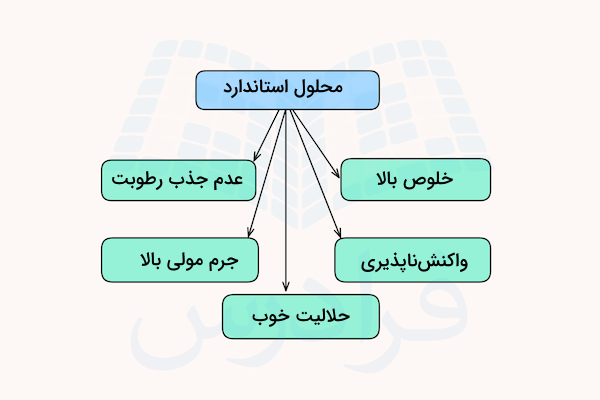
محلولهای استاندارد میتوانند حاوی هر گونه ترکیب حلشونده – حلال در غلظتهای دقیق و مشخص باشند. در این محلولها عموما آب به عنوان حلال استفاده میشود و یک ماده محلول در آب نیز حلشونده این محلولها را تشکیل میدهد. محلولهای استاندارد باید خالص باشند، با آب یا هوا واکنش ندهند، جرم مولی بالایی داشته باشند و خواص جذب رطوبتی نداشته باشند.
محلولهای استاندارد را میتوان به شکلی مستقیم از شرکتهای تولید کننده محصولات شیمیایی خریداری کرد. با این وجود، برخی از مواد را نمیتوان به صورت محلول استاندارد تهیه و استفاده کرد. محلولهای استاندارد باید ویژگیهای زیر را داشته باشند.
خلوص بسیار بالا
محلولهای استاندارد باید از خلوص بالایی برخوردار باشند و هیچ ماده جانبی یا آلودگی و ناخالصی در محلول حضور نداشته باشد. در غیر این صورت، اگر نتوان ناخالصی محلول را حذف کرد، مقدار این ناخالصی باید قابل صرفنظر باشد و اطمینان حاصل کرد که در انجام تیتراسیون یا سایر آنالیزهای تجزیهای خلالی ایجاد نکند.
واکنش ناپذیری با هوا و آب
محلولهای استاندارد نباید با آب یا هوا واکنش بدهند. اگر مادهای با هوا یا آب واکنش دهد، خواص شیمیایی و فیزیکی آن تغییر کرده و به ماده دیگری تبدیل میشود. در این صورت، محلول تهیه شده نمیتواند نتایج دلخواه را در آزمایشهای مختلف تولید کند.
حلالیت
در محلولهای استاندارد، ماده حلشونده باید به خوبی در حلال حل شود. مقدار غلظت این محلولها باید ثابت و مشخص باشد. به همین دلیل، ماده حلشونده نباید به مرور زمان به شکل جامد از محلول خارج شود.

جرم مولی بالا
جرم مولی بالا در تهیه محلولهای استاندارد بسیار مهم است. به این دلیل که در اندازهگیریهای مربوط به ماده مجهول به وسیله محلول استاندارد، مقدار غلظت محلول باید با غلظت ماده مجهول قابل مقایسه باشد. همچنین ممکن است طی آزمایش نیاز به اندازهگیری خواصی مانند وزن مخصوص ماده حلشونده در محلول استاندارد داشته باشیم.
عدم جذب رطوبت
محلولهای استاندارد نباید خواص جذب رطوبت و نمگیری داشته باشند. این بدین معنی است که ماده حلشونده این محلولها در محیط مرطوب نباید آب را جذب کند. به این دلیل که در صورت جذب آب توسط ماده حلشونده، مقدار جرم آن تغییر کرده و در محاسبات غلظت مولار اشتباه پیش میآید.
در عمل، تنها تعداد کمی از مواد شیمیایی مورد استفاده بهعنوان استاندارد اولیه، همه این شرایط را بهطور کامل دارند، اما خلوص بالا شرطی ضروری برای آنهاست. همچنین، ترکیبی که ممکن است برای یک هدف خاص بهعنوان استاندارد اولیه مناسب باشد، ممکن است برای نوعی دیگر از تجزیه بهترین گزینه نباشد.
تهیه محلول استاندارد
برای تهیه محلول استاندارد، باید مقدار دقیق محاسبه شده با محاسبات استوکیومتری از ماده حلشونده را وزن کرد. این توزین باید با ترازوهای دقیق دیجیتال آزمایشگاهی و روی شیشه ساعت تمیز انجام شود تا محاسبات دقیق باشد.
سپس مقدار توزین شده ماده حلشونده در حجم مشخصی از حلال حل میشود. همچنین، مقدار غلظت دقیق محلول استاندارد را میتوان با پارامترهایی مانند سطح pH، وزن ویژه و روشهای طیف سنجی تنظیم کرد.
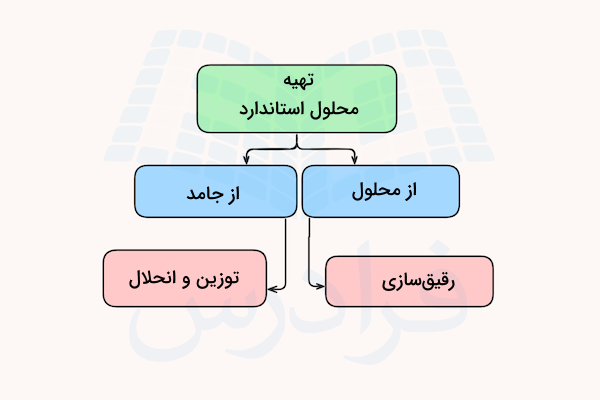
دو روش اصلی برای تهیه یک محلول استاندارد وجود دارد. این روش ها، روش رقیقسازی و روش توزین هستند. در هر دو روش، میتوان غلظت دلخواه را بر اساس تناسب بین مولاریته (Molarity) و حجم محلول استاندارد و محلول مادر (محلول غلیظ اولیه) تعیین کرد. در ادامه، روش مرحله به مرحله تهیه محلول استاندارد را توضیح میدهیم.
روش رقیق سازی
محلولهای استاندارد را میتوان به وسیله رقیقسازی یک محلول مادر (محلول غلیظ) تهیه کرد. این روش شامل افزودن حلال به غلظت و حجم مشخصی از یک محلول است تا مقدار غلظت مولار آن کاهش یافته و به غلظت دلخواه برسیم.
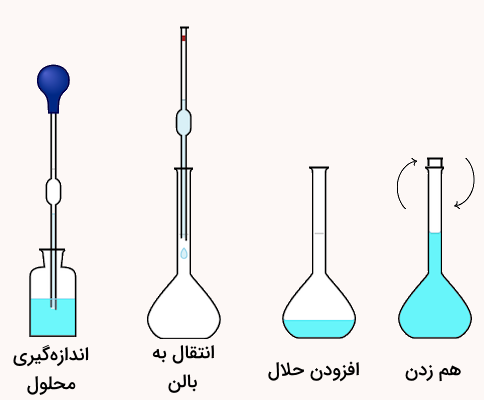
پیشنهاد میکنیم برای درک بهتر محاسبات تهیه محلول استاندارد، فیلم آموزش حل مسائل استوکیومتری و نقش آن در تهیه محلولها و غلظتها فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
در این روش از فرمول زیر استفاده می شود که از طریق فرمول غلظت مولار به دست میآید.
در این فرمول، و غلظت و حجم محلول رقیق و و غلظت و حجم محلول غلیظ هستند. در استفاده از این فرمول، باید دقت شود که واحدهای حجم و غلظت در دو طرف معادله برابر باشند. سپس با به دست آوردن مقدار حجم محلول غلیظ مورد نیاز برای رسیدن به غلظت رقیق شده مشخص، این مقدار با پیپت اندازهگیری شده و به بالن حجمی منتقل میشود.
در نهایت با افزودن حلال تا خط نشانه بالن، میتوان محلول استاندرد با غلظت مشخص را به وسیله رقیقسازی تهیه کرد. اسیدهای آزمایشگاهی مانند اسید کلریدریک (هیدروکلریک)، اسید سولفوریک، و اسید نیتریک همگی از محلولهای غلیظ اولیه (محلولهای مادر) تهیه میشوند، و روش رقیقسازی برای ساخت آنها بهکار میرود. در ادامه برای درک بهتر این روش تهیه محلول استاندارد، به مثال زیر توجه کنید.
مثال
روش تهیه ۵۰ میلیلیتر محلول ۱ مولار اسید سولفوریک از محلول مادر اسید سولفوریک با غلظت ۲ مولار را توضیح دهید.
پاسخ
برای تهیه این محلول، ابتدا حجم اسید سولفوریک غلیظ مورد نیاز را با استفاده از فرمول رقیقسازی به دست میآوریم.
سپس با استفادها از یک پیپت آزمایشگاهی، مقدار ۲ میلیلیتر از محلول اسید سولفوریک ۲ مولار را اندازهگیری کرده و به یک بالن حجمی ۵۰ میلیلیتری منتقل میکنیم. سپس تا رسیدن سطح محدب محلول در لوله بالن به خط نشانه، به آن آب اضافه میکنیم. در نهایت با بستن درب بالن و تکان دادن آن برای یکدست شدن، محلول ما آماده خواهد بود.
روش توزین
یک روش دیگر برای تهیه محلول استاندارد، روش توزین است. این روش برای تهیه محلول استاندارد از مواد جامد کاربرد دارد. در این روش با استفاده از جرم مولی ماده استاندارد، مقدار گرم مورد نیاز برای تهیه محلول با غلظت مشخص آن توزین شده و سپس با حلال مخلوط میشود. پیشنهاد میکنیم برای آشنایی بیشتر با روشهای محلولسازی از جامدات و مایعات، مطلب محلولسازی چیست مجله فرادرس را مطالعه کنید.
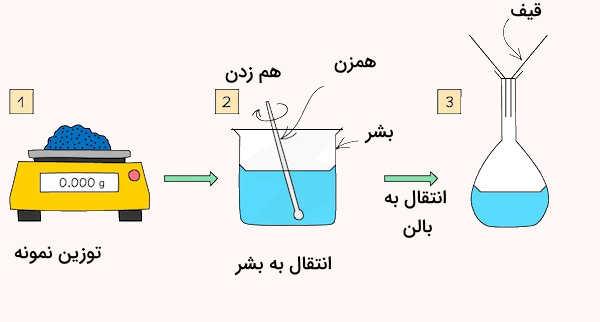
تهیه محلول استاندارد با استفاده از ماده استاندارد جامد، نیاز به مادهای بسیار خالص و بدون الودگی داشته و تجهیزات مانند ترازوی دیجیتال باید به شدت دقیق بوده و کالیبره شوند. در ادامه برای درک بهتر روش تهیه محلول استاندارد به روش توزین، به مثال زیر دقت کنید.
مثال
برای تهیه ۱۰۰ میلیلیتر محلول استاندارد ۱ مولار سدیم هیدروکسید، چه مقدار از ماده سدیم هیدروکسید خشک جامد نیاز است؟ مراحل تهیه این محلول را توضیح دهید.
پاسخ
برای تهیه این محلول نیاز است در قدم اول مقدار جرم مولی سدیم هیدروکسید را به دست آوریم. مقادیر جرم مولی مواد با استفاده از جرم مولی عناصر تشکیل دهنده آنها که در جدول تناوبی عناصر ارائه میشود، قابل محاسبه است. مقدار جرم مولی سدیم هیدروکسید ۴۰ گرم بر مول است.
سپس مقدار مول مورد نیاز تهیه این محلول را با استفاده از غلظت مولار داده شده به دست آورده و به گرم تبدیل میکنیم.
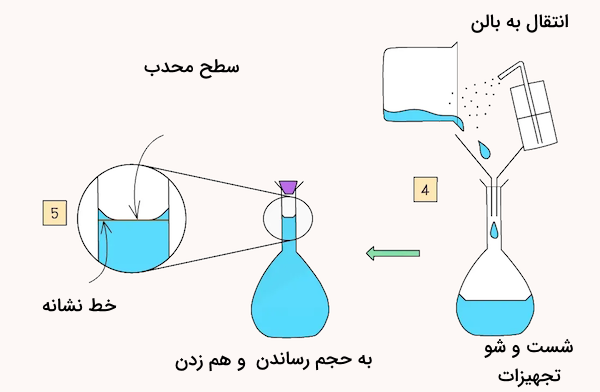
برای تهیه این محلول مقدار ۴ گرم ماده سدیم هیدروکسید را وزن کرده و به یک بشر یا ارلن منتقل میکنیم. سپس مقداری آب به آن اضافه کرده و هم میزنیم تا ماده جامد به خوبی در حلال حل شود. در ادامه این محلول را به یک بالن حجمی ۱۰۰ میلیلیتری منتقل میکنیم. در مرحله بعد، با مقدار مناسبی حلال، شیشه ساعت و بشر و قیف استفاده شده در مرحله قبل را شست و شو داده و این مقادیر حلال را نیز به بالن حجمی منتقل میکنیم.
انجام این مرحله برای از دست نرفتن ماده حلشونده انجام میشود. در نهایت با افزودن حلال تا خط نشانه بالن به محلول و هم زدن آن، ۱۰۰ میلیلیتر محلول استاندارد سدیم هیدروکسید ۱ مولار خواهیم داشت.
استفاده از معرف ها
گاهی در تهیه محلولهای استاندارد نیاز است تا از مواد شیمیایی کمکی مانند معرفها و شناساگرها استفاده کنیم. این مواد میتوانند منبعی ناخواسته از آنالیت (مادهی مورد تجزیه) باشند و در صورتی که به درستی در محاسبات لحاظ نشوند، منجر به خطای سیستماتیک در فرآیند استانداردسازی میشوند. برای کاهش این نوع خطا، در صورت دسترسی، بهتر است از مواد شیمیایی با گرید واکنشگر (reagent grade) استفاده شود. همچنین برای بهبود کیفیت این مواد میتوان آنها را خالصسازی کرد یا آنالیز دقیقی از مقدار ناخالصی و مواد موجود در آنها به دست آورد.
محاسبات تهیه محلول استاندارد
انجام محاسبات مربوط به بهتیه محلول استاندارد به نسبتهای غلظت در یک ماده بستگی دارد. برای انجام این محاسبات، ابتدا نیاز است جرم مولی ماده حلشونده محاسبه شود. سپس مقدار جرم یا حجم مورد نیاز از ماده حلشونده برای دستیابی به محلول استاندارد با غلظت معین، به وسیله محاسبات استوکیومتری به دست میآید.
مهمترین پارامتری که در انجام محاسبات مربوط به محلول استاندارد اندازهگیری میشود، غلظت ماده حلشونده در حلال است. برای این کار ابتدا جرم ماده استاندارد را اندازه گرفته و سپس حجم حلال را تعیین میکنیم. این اندازهگیری باید بر اساس غلظت مولاری که برای محلول در نظر گرفتهایم، انجام شود.
اشتباهات رایج در تهیه محلول استاندارد
در قسمتهای قبل آموختیم محلول استاندارد چیست و چگونه میتوان آن را تهیه کرد. دقت در انجام تمامی مراحل اندازهگیری و تهیه محلولهای استاندارد یکی از مهمترین عوامل صحیح بودن غلظت تهیه شده از آنها است. در آزمایشگاههای شیمی اشتباهاتی مانند توزین ناصحیح، حل نشدن کامل ماده حلشونده، از دست رفتن ماده، حجم ناصحیح و انحلال ناقص از اشتاباهاتی است که میتواند باعث کاهش دقت غلظت محلول استاندارد شود.
توزین ناصحیح
اندازهگیری دقیق ماده حلشونده یکی از عواملی است که منجر به دقت غلظت محلول استاندارد میشود. برای توزین صحیح ماده جامد باید از ترازوهای دیجیتال دقیق تا چند رقم اعشار استفاده شود. این ترازوها باید کالیبره شده و سطح آنها تمیز و خشک باشد. برای توزین صحیح ماده حلشونده، مقدار مورد نظر باید روی کاغذ صافی یا شیشه ساعت تمیز و خشک ریخته شود.
پیش از انتقال ماده جامد به این ظروف ترازو باید با احتساب وزن کاغذ صافی یا شیشه ساعت، صفر شود.
ماده جامد حل نشده
در مرحله هم زدن و انحلال ماده جامد در حلال، باید دقت شود هیچ ماده جامدی به صورت حل نشده داخل محلول باقی نماند. مرحله هم زدن باید با همزن شیشهای تمیز و خشک انجام شود و آلودگی روی ظروف باقی نماند.

از دست رفتن نمونه
از دست رفتن قسمتی از نمونه حتی در مقادیر بسیار کم میتواند باعث پایین آمدن دقت در تهیه محلول استاندارد شود. این از دست رفتن ممکن است ریختن ماده جامد، مایع، محلول استاندارد اولیه یا حلال در هریک از مراحل تهیه محلول باشد.
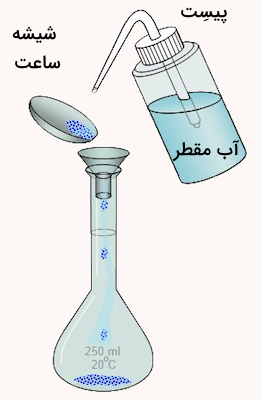
حجم ناصحیح
تشخیص دقیق حجم محلول در زمان اندازهگیری با پیپت و بالن حجمی بسیار مهم است. در لولههای اندازهگیری حجمی آزمایشگاهی، سطح پایینی محدب محلول باید با خط نشانه ظرف مماس باشد. حتی نزدیک بودن این سطح به خط نشانه ولی دقیق نبودن آن باعث بروز خطا در تهیه محلول خواهد شد.
مخلوط شدن ناقص
در آخرین مرحله تهیه محلول و بستن در ظرف بالن حجمی، محلول باید تکان داده شود تا اجزای محلول به خوبی با هم مخلوط شوند. در این مرحله، بالن حجمی باید حداقل ۶ بار وارونه شود تا اجزای محلول به خوبی باهم ترکیب شوند. همچنین باید دقت شود درب بالن به خوبی بسته شده و دچار نشتی نباشد.
کاربرد محلول استاندارد
محلولهای استاندارد کاربردهای بسیار و گوناگونی در مطالعات تجزیهای شیمی دارند. استانداردهای اولیه برای کالیبره کردن محلولهای استاندارد ثانویه استفاده میشوند. این محلولهای استاندارد اولیه و ثانویه هر دو برای اندازهگیریهای صحیح در آنالیز کیفی محلولهایی با غلظت نامعلوم استفاده میشوند.
در ادامه برخی از کاربردهای محلول استاندارد را توضیح دادهایم.
صنعت
در صنعت، محلولهای استاندارد عمدتا برای کنترل کیفیت و رعایت مقررات ایمنی محیط زیست مورد استفاده قرار میگیرند. این محلولها اغلب برای کالیبره کردن دقت و صحت دستگاههای شیمیایی به کار میروند. برای مثال، آنها میتوانند به اطمینان از عملکرد صحیح دستگاههایی که پارامترهایی مانند کالری، خواص الکتروشیمیایی و کدورت را اندازهگیری میکنند، کمک کنند.
همچنین، محلولهای استاندارد برای تشخیص یا در وجود آلایندههای خاص در آب نیز مورد استفاده قرار میگیرند. به همین دلیل، این محلولها در تحلیل آب آشامیدنی و فاضلابها بسیار رایجاند.
تیتراسیون
در تیتراسیونها، غلظت مادهی مورد آنالیز (آنالیت) در محلول را میتوان با استفاده از محلول استاندارد تعیین کرد. این کار از طریق تیتر کردن محلول استاندارد با محلول آنالیت انجام میشود تا نقطهی پایانی (یا نقطهی همارزی) واکنش خنثیسازی مشخص شود. این نقطه پایانی معمولا از طریق یک شناساگر رنگی (اندیکاتور) یا تشکیل رسوب مشخص میشود. با اندازهگیری حجم محلول استاندارد قبل و بعد از تیتراسیون، میتوان غلظت آنالیت را محاسبه کرد.

به عنوان مثال، برای محاسبهی غلظت اسید هیدروکلریک (HCl)، از یک محلول استاندارد با غلظت مشخص، مانند محلول ۰٫۵ مولار سدیم هیدروکسید (NaOH)، استفاده میشود. این محلول بازی با محلول HCl تیتر میشود، و با استفاده از حجم مصرفشده از محلول استاندارد، میتوان غلظت دقیق HCl را محاسبه کرد.
طیف سنجی
استانداردهای داخلی (Internal Standards) در دستگاههای طیف سنجی مانند کروماتوگرافی گازی-طیفسنجی جرمی (GC/MS) و کروماتوگرافی مایع-طیفسنجی جرمی (LC/MS) برای کنترل تغییرات ناشی از تزریق نمونه، آمادهسازی نمونه و سایر اثرات ماتریسی استفاده میشوند. در این روش، نسبت سطح پیک بین استاندارد داخلی و آنالیت (ماده مورد تجزیه) محاسبه میشود تا غلظت آنالیت تعیین گردد.
کالری سنجی
کالریسنجی علمی است که به اندازهگیری تغییرات گرمایی در طول واکنشهای شیمیایی میپردازد. از آنجایی که واکنشهای شیمیایی با تغییر انرژی همراه هستند. اندازهگیری این تغییرات برای درک ویژگیهای واکنش ضروری است.
استفاده از محلول استاندارد در کالریسنجی به دو منظور تعیین غلظت محلول با استفاده از انرژی جذب یا آزادشده و کالیبراسیون دستگاه با استفاده از منحنی جذب گرما استفاده میشود.
مزایای استفاده از محلولهای استاندارد
محلولهای استاندارد هم در تحلیل کیفی و هم در تحلیل کمی مواد شیمیایی کاربرد دارند. آنها یکی از اجزای اصلی در آزمایشهای تیتراسیون هستند، زیرا روشی ساده اما قابل اعتماد برای تعیین غلظتها و شناسایی گونههای شیمیایی فراهم میکنند.
سادگی ابزار و روش
محلولهای استاندارد موجب سادهسازی فرآیندهای آزمایشگاهی میشوند. به عنوان مثال، در تیتراسیون، تنها به بورت و ارلن نیاز است که راهاندازی و استفاده از آنها بسیار آسان است.
هزینه کم
انجام آزمایشهایی که از محلولهای استاندارد استفاده میکنند معمولا نیاز به دستگاههای پیچیده یا گرانقیمت ندارد و با هزینهای پایین قابل انجام هستند.
محدودیت های استفاده از محلول استاندارد
محلولهای استاندارد یکی از مواد بسیار حیاتی در آزمایشگاه شیمی هستند که پایه آنالیزهای تجزیهای بسیاری هستند. با این وجود، استفاده از این محلولها با محدودیتهایی رو به رو است که باید به آنها آگاه بود. این محدودیتها را در ادامه توضیح میدهیم.

مشکلات پایداری
محلولهای استاندارد طی گذر زمان مقدار خلوص و دقت در غلظت خود را از دست میدهند. این مشکل به خصوص در مورد محلولهای استاندار ثانویه مشهود است و این محلولها قبل از هر بار استفاده باید دوباره با یک محلول استاندارد اولیه، استانداردسازی شوند.
محلولهای استاندارد باید در محفظهها و ظروفی محکم و دربسته نگهداری شوند تا دقت و پایداری آنها در طول زمان حفظ شود. با این کار، از تبخیر، آلودگی و گازهای موجود در هوا محافظت میشوند. همچنین، این محلولها باید در محیطی خشک، خنک و به دور از نور مستقیم خورشید نگهداری شوند. شرایط نگهداری دقیق هر محلول بسته به مواد تشکیلدهنده آن ممکن است متفاوت باشد.
خطاهای احتمالی
خطاها و اشتباهات رایج احتمالی در تهیه محلول استاندارد مانند توزین یا اندازهگیری اشتباه حجم، میتواند منجر به اشتباه در تنظیم غلظت محلول استاندارد شود. استفاده از محلول استاندارد با غلظت اشتباه میتواند باعث بروز اشتباه در اندازهگیری پارامترهای هر نمونه درحال بررسی شود.
هزینه و دسترسی
برخی از محلولهای استاندارد اولیه ممکن است هزینه بالایی داشته باشند یا تهیه آنها مشکل باشد.
روش های استانداردسازی
در قسمتهای قبل آموختیم محلول استاندارد چیست و چگونه تهیه میشود. محلولهای استاندارد عموما برای فرآیندهای استانداردسازی در تحلیل کمی مواد و برای کاهش خطاهای آزمایش و دستیابی به نتایج صحیح استفاده میشوند. فرایند استانداردسازی فرآیندی است که در آن غلظت یک محلول با استفاده از واکنش با یک استاندارد اولیه به شکلی دقیق تعیین میشود.
روشهای متفاوتی برای استانداردسازی وجود دارد که مهمترین آنها استاندارد خارجی، استاندارد داخلی و روش افزودن استاندارد هستند. در ادامه این روشها توضیح داده میشوند.
روش استاندارد خارجی
روش استاندارد خارجی (External Standardization Method)، یکی از رایجترین روشهای استانداردسازی در شیمی تجزیه است. در این روش از محلولهایی با غلظت معلوم از آنالیت ( ماده مورد اندازهگیری) استفاده میشود تا یک منحنی کالیبراسیون رسم شود.
در این روش، محلولهای استاندارد به صورت جداگانه از نمونه اصلی تهیه میشوند و به همین دلیل به آن استاندارد خارجی گفته میشود. این روش ساده است و برای آنالیزهای کمی مناسب است. در این روش نیازی به آماده سازی نمونههای پیچیده نیست و برای موادی مناسب است که در آنها آنالیت پاسخی مشخص و تکرارپذیر دارد.
روش استاندارد داخلی
یک سری از استانداردهای داخلی، دارای غلظت ثابتی از مادهای بهنام استاندارد داخلی هستند و در عین حال غلظتهای مختلفی از آنالیت (ماده مورد آنالیز) دارند. استاندارد داخلی باید از نظر شیمیایی به آنالیت شباهت داشته باشد تا هر دو در طول اندازهگیری رفتاری مشابه داشته باشند.
استانداردهای داخلی برای اصلاح خطاهای ناشی از از دست رفتن آنالیت در طی مراحل آمادهسازی نمونه به کار میروند.
روش افزودن استاندارد
در روش افزودن استاندارد (Standard Addition Method)، مقداری مشخص از یک محلول استاندارد با غلظت معلوم به مجموعهای از محلولهایی که شامل آنالیت هستند، بهصورت افزایشی اضافه میشود. هدف اصلی، برطرف کردن اثر ماتریس (Matrix Effect) است. یعنی شرایط محیطی یا ترکیبهای مزاحم موجود در نمونه که ممکن است باعث تغییر پاسخ آنالیت شوند.

یادگیری شیمی تجزیه با فرادرس
برای درک دقیق مفهوم محلول استاندارد، لازم است با مفاهیمی مثل خطاهای اندازهگیری، نمونهبرداری، تعادل شیمیایی و تیتراسیون آشنا شویم. این مفاهیم پایه به آمادهسازی و استفاده صحیح محلولهای استاندارد کمک میکنند. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه محلول استاندارد دسترسی داشته باشید.
محلول استوک چیست؟
یک محلول مادر (Stock Solution) محلولی با غلظت بسیار بالا است. این نوع محلولها کاربرد زیادی دارند زیرا میتوان با رقیقسازی بخشی از آنها، محلولی با غلظت دلخواه تهیه کرد. استفاده از محلولهای مادر باعث صرفهجویی در زمان آمادهسازی مواد شیمیایی میشود و همچنین به حفظ و صرفهجویی در مصرف مواد کمک میکند. به این معنا که برای تهیه یک محلول با غلظت پایین، تنها به مقدار مشخصی از محلول مادر و مقداری حلال برای رقیقسازی نیاز است.
تفاوت محلول استوک و محلول استاندارد
در این مطلب از مجله فرادرس آموختیم محلول استاندارد چیست. این محلول محلولی با غلظت دقیق و مشخص است که برای اندازهگیریهای کمی (مثل تیتراسیون یا کالیبراسیون دستگاهها) استفاده میشود. محلول استوک (مادر)، محلولی با غلظت زیاد است که برای صرفهجویی در زمان و فضای نگهداری تهیه میشود و بعدا با رقیقسازی به غلظت مورد نظر رسانده میشود. تفاوت این محلولها در جدول زیر توضیح داده میشود:
| محلول استاندارد | محلول استوک |
| تعریف: محلولی با غلظت دقیق برای کالیبراسیون | تعریف: محلول غلیظ برای تهیه محلولهای رقیقتر |
| غلظت: دقیق و ثابت | غلظت:بالا و غیرثابت |
| کاربرد: استفاده مستقیم در آزمایشها و اندازهگیریها | کاربرد: رقیقسازی و تهیه محلول |
| تهیه: کالیبراسیون دقیق | تهیه: بدون کالیبراسیون دقیق |
| حجم: حجم لازم برای انجام آزمایش | حجم: مقدار کمی برای رقیقسازی |
| پایداری: بسته به نوع ماده | پایداری: بسته به نوع ماده |
source
