غلظت، مقدار ماده حلشونده را در محلول مشخص میکند. غلظت محلولها میتواند به شیوههای مختلفی مانند تعداد مول حلشونده در لیتر حلال و جرم حلشونده بر حجم حلال بررسی شود. در این مطلب از مجله فرادرس میآموزیم انواع غلظت چیست و روش محاسبه هر یک کدام است.

در ابتدای این مطلب میآموزیم غلظت چیست و انواع غلظت کدامند. سپس در جدولی انواع غلظت را مقایسه کرده و فرمول محاسبه آنها را میآموزیم. پس از آن به شرح توضیح و مثال از انواع غلظت مانند قسمت در میلیون و میلیارد، درصد وزنی و حجمی، مولاریته و … میپردازیم. در نهایت روش اندازهگیری غلظت و رقیقسازی محلولها را بررسی کرده و به نقش غلظت در محاسبات استوکیومتری میپردازیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید انواع غلظت چیست.
انواع غلظت در شیمی
روش های مختلفی برای اندازهگیری کمی غلظت محلول وجود دارد که در ادامه مهمترین موارد آنها نام برده شده است.
- قسمت در میلیون
- قسمت در میلیارد
- درصد جرمی
- درصد حجمی
- درصد جرمی – حجمی
- مولاریته
- مولالیته
- نرمالیته
- فرمالیته
- کسر مولی
- گرم در لیتر
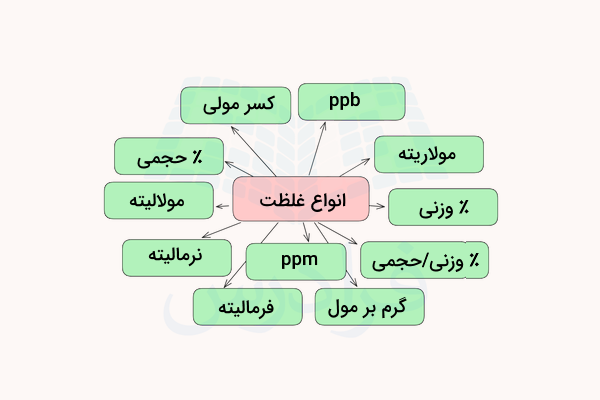
به اندازهگیری مقدار ماده حلشونده که در مقدار مشخصی از حلال حل شده است، غلظت گفته میشود. اگر مقدار ماده حلشونده در حلال زیاد باشد، محلول غلیظ است و اگر مقدار ماده حلشونده در حلال کم باشد، محلول رقیق است. در ادامه هر یک از انواع غلظت توضیح داده میشود.

جدول انواع غلظت
در قسمت قبل آموختیم انواع غلظت چیست و مفهوم غلظت برای اندازهگیری چه کمیتهایی استفاده میشود. در ادامه، انواع غلظت به همراه نماد محاسبه آنها ارائه شده است.
| نوع غلظت | علامت |
| مولاریته | M |
| فرمالیته | F |
| نرمالیته | N |
| مولالیته | m |
| درصد وزنی | ٪ W/W |
| درصد حجمی | ٪ V/V |
| درصد وزنی/حجمی | ٪ W/V |
| قسمت در میلیون | ppm |
| قسمت در میلیارد | ppb |
| کسر مولی | |
| گرم بر لیتر | g/L |
غلظت چیست؟
غلظت به مقدار ماده حلشونده در حجم مشخصی از محلول اشاره دارد و غلظت معمولا در واحدهای مختلفی اندازهگیری و معرفی میشود. برای مثال، مول در لیتر، گرم در لیتر، درصد حجمی و درصد وزنی از انواع روشهای بیان غلظت هستند.
غلظت را میتوان از دو جنبه کمی و کیفی بررسی کرد. از لحاظ کیفی، غلظت یک ایده کلی درباره نسبت ماده حلشونده در حلال را بررسی کرده و محلولها را به دو نوع رقیق و غلیظ تقسیم میکند. از لحاظ کمی، مقدار دقیق ماده حلشونده در محلول مشخص میشود. برای مثال در محلول آب و نمک، نمک ماده حلشونده، حلال آب و محلول، مخلوط همگن آب و نمک است و غلظت میتواند مقادیر دقیق نمک را در این مخلوط مشخص کند.
یادگیری شیمی دهم با فرادرس
برای اینکه بهتر درک کنیم انواع غلظت چیست، ابتدا باید با مفاهیمی چون جرم مولی، جرم مولکولی، مول، محاسبات تبدیل کسرها و ترکیبات یونی آشنا شویم. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس دهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه انواع غلظت دسترسی داشته باشید.
توضیح و فرمول انواع غلظت
در ادامه به بررسی تک به تک تعریف انواع غلظت پرداخته و مثالهایی را برای درک بهتر هر یک از این موارد بررسی خواهیم کرد.
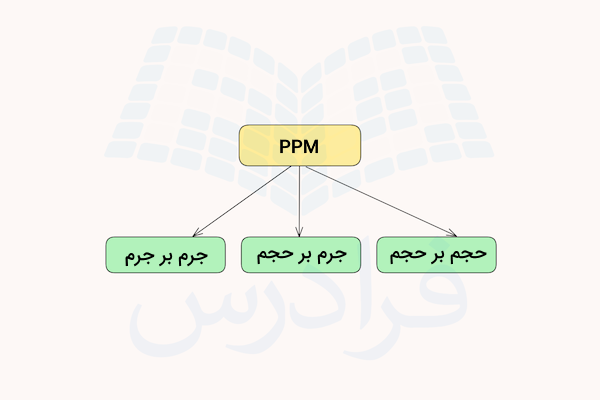
قسمت در میلیون
قسمت در میلیون، یک قسمت جرم یا حجم ماده حلشونده در یک میلیون قسمت جرم یا حجم محلول را مشخص میکند. قسمت در میلیون با حرف انگلیسی ppm نمایش داده میشود که نشاندهنده (Parts Per Millions) به معنی قسمت در میلیون است. واحد اندازهگیری حلشونده و محلول میتواند به شکل زیر باشد.
- محلول و حلشونده بر اساس جرم
- محلول و حلشونده بر اساس حجم
- حلشونده بر اساس جرم و محلول بر اساس حجم
فرمول محاسبه ppm به شکل زیر است.
در این فرمول عبارت (Mass Solute) به معنی جرم ماده حلشونده و عبارت (Mass Solution) به معنی جرم محلول است. این واحد غلظت برای اندازهگیری در زمانی است که مقدار ماده حلشونده بسیار کم باشد. واحد اندازهگیری این غلظت ppm است. یکی از مثالهای اندازهگیری غلظت بر حسب ppm، اندازهگیری مقدار آلودگی هوای شهرها است که مقدار ذرات معلق در هوا بر حسب ppm گزارش میشود.
برای انجام تبدیل واحدهای کاربردی برای محاسبه ppm میتوان از فرمول زیر بهره برد.
برای درک بهتر این واحد اندازهگیری و انواع غلظت، به مثال زیر توجه کنید.
مثال
نمونهای شامل ۳٫۵ میلی گرم سدیم فلوئورید در ۱ لیتر آب است. غلظت فلوئورید را بر حسب ppm در این نمونه به دست آورید.
پاسخ
برای پاسخ به این سوال کافی است میلی گرم ماده حل شونده را بر لیتر حلال تقسیم کنیم تا غلظت بر حسب ppm به دست آید.
قسمت در میلیارد
قسمت در میلیارد مشخص کننده تعداد قسمت ماده حلشونده در یک میلیارد قسمت محلول است. قسمت در میلیارد که با عبارت انگلیسی ppb نمایش داده میشود نیز مانند ppm یکی از روشهای بیان غلظت نمونههایی است که مقدار ماده حلشونده در آنها بسیار کم است. عبارت bbp برگرفته از (Parts Per Billion) به معنی قسمت در میلیارد است. فرمول محاسبه ppb به شکل زیر است.
در این فرمول عبارت (Mass Solute) به معنی جرم ماده حلشونده و عبارت (Mass Solution) به معنی جرم محلول است. واحد اندازهگیری این غلظت ppb است. برای انجام تبدیل واحدهای کاربردی برای محاسبه ppb میتوان از فرمول زیر بهره برد.
برای درک بهتر انواع غلظت و قسمت در میلیارد و قسمت در میلیون، به مثالهای زیر دقت کنید.
مثال ۱
بنابر گزارش سازمان حفاظت محیط زیست، اگر غلظت سرب در آب شهری به ۱۵ برسد، باید اقداماتی برای رفع آن انجام گیرد. مقدار این غلظت بر حسب ppm چقدر است؟ در این غلظت، جرم سرب بر حسب میکروگرم در یک لیوان (۳۰۰ میلیلیتر) چقدر است؟
پاسخ
برای تبدیل غلظت از ppb به ppm کافی است آن را بر ۱۰۰۰ تقسیم کنیم زیرا واحد غلظت ppb هزار واحد از ppm کوچکتر است.
برای محاسبه جرم نمونه در این محلول (آب و سرب) میتوانیم جرم نمونه حلشونده را با استفاده از غلظت به دست آوریم. سپس جرم به دست آورده را به میکروگرم تبدیل کنیم. برای این کار، به شکل زیر عمل میکنیم.
حال این جرم به دست آمده را به میکروگرم تبدیل میکنیم.
مثال ۲
یک نمونه ۵۰ گرمی از فاضلاب صنعتی، حدود ۰٫۴۸ میلی گرم جیوه داشته است. مقدار غلظت جیوه در این نمونه را بر حسب ppm و ppb به دست آورید.
پاسخ
برای پاسخ به این سوال کافی است نسبت جرم حلشونده را به جرم محلول به دست آورده و سپس با ضرب در میلیون و میلیارد، غلظتها بر حسب ppm و ppb به دست میآید.
درصد جرمی
درصد جرمی (درصد وزنی) یکی دیگر از انواع غلظت است که نسبت جرم ماده حلشونده را بر جرم محلول بر حسب درصد بیان میکند. فرمول محاسبه درصد جرمی به شکل زیر است.
در این فرمول، g(Solute) مقدار جرم ماده حلشونده بر حسب گرم و g(solution) جرم محلول بر حسب گرم است. واحد اندازهگیری این غلظت بر حسب درصد است. دقت کنید که اگر صورت مخرج بر حسب میلیگرم یا کیلوگرم بیان شود، مخرج کسر نیز باید همان واحد را داشته باشد. پیشنهاد میکنیم برای آشنایی بیشتر با این واحد اندازهگیری، فیلم آموزش تعیین درصد جرمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
در غیر اینصورت، باید تبدیل واحد به گرم انجام شود. درصد جرمی با نامهای جرم درصدی، درصد وزنی، درصد وزنی/ وزنی و .. نیز شناخته میشود. برای درک بهتر روش محاسبه درصد جرمی به مثالهای زیر دقت کنید.
مثال ۱
یک نمونه ۵ گرمی شامل ۳٫۷۵ گرم گلوکز است. غلظت این ماده بر حسب درصد وزنی چقدر است؟
پاسخ
برای محاسبه درصد جرمی این نمونه کافی است مقدار جرم ماده حلشونده را به ۵ گرم کل نمونه تقسیم کنیم. دقت داشته باشید که واحدهای صورت و مخرج کسر باید از یک نوع باشند و میلیگرم ماده حلشونده باید به گرم تبدیل شود.
مثال ۲
یک شیشه ماده شوینده شامل ۱۳۵ گرم اسید کلریدریک و ۷۵۵ گرم آب است. درصد وزنی اسید کلریدریک در این نمونه چقدر است؟
پاسخ
برای پاسخ به این مثال ابتدا باید حلشونده، محلول و حلال را تشخیص دهیم. در تمامی محلولها، مادهای که مقدار کمتر محلول را تشکیل میدهد ماده حلشونده و مادهای که قسمت بیشتری از محلول را تشکیل میدهد حلال است. دقت داشته باشید که در این سوال، نوشته شده محلول شامل اسید و آب است.
پس جرم محلول برابر با جرم حلشونده (اسید کلریدریک) به علاوه جرم حلال (آب) خواهد بود. روش محاسبه درصد جرمی این نمونه در محلول به شکل زیر خواهد بود.
مثال ۳
اسید کلریدریک غلیظ، محلول آبی ٪ ۳۷٫۲ این ماده است که عموما از آن در آزمایشگاههای مختلف استفاده میشود. دانسیته این محلول برابر با ۱٫۱۹ گرم بر میلیلیتر است. جرم اسید کلریدریک موجود در ۰٫۵ لیتر از این محلول را محاسبه کنید.
پاسخ
برای پاسخ به این سوال، ابتدا حجم محلول را با استفاده از چگالی داده شده به جرم محلول تبدیل میکنیم.
پس جرم نیم لیتر از این محلول برابر با ۵۹۵ گرم خواهد بود. حال با استفاده از درصد جرمی میتوانیم مقدار جرم اسید کلریدریک موجود در این نمونه را به دست آوریم.
پس در ۰٫۵ لیتر از محلول ۳۷٫۲ درصد هیدروکلریک اسید، ۲۲۱ گرم از آن اسید وجود دارد.
مثال ۴
حجم محلول غلیظ اسید کلریدریکی که حاوی ۱۲۵ گرم از این اسید است چه قدر است. چگالی این محلول برابر با ۱٫۱۹ گرم بر لیتر و غلظت آن برابر با ۳۷٫۲ درصد وزنی است.
پاسخ
برای پاسخ به این مثال، ابتدا باید جرم محلول را با استفاده از غلظت اسید به دست آورده و سپس با استفاده از چگالی به حجم آن تبدیل کنیم.
پس حجم این محلول برابر با ۲۸۲٫۵ میلیلیتر است.

درصد حجمی
درصد حجمی یکی دیگر از انواع غلظت است که نسبت حجم ماده حلشونده را به حجم محلول بر حسب درصد بیان میکند. فرمول محاسبه درصد حجمی به شکل زیر است.
در این فرمول، v(Solute) مقدار حجم ماده حلشونده بر حسب لیتر و v(solution) حجم محلول بر حسب لیتر است. واحد اندازهگیری این غلظت بر حسب درصد است. دقت کنید که اگر صورت کسر بر حسب میلیلیتر بیان شود، مخرج کسر نیز باید همان واحد را داشته باشد. در غیر اینصورت، تبدیل واحد لازم برای همواحد شدن صورت و مخرج باید انجام شود. درصد حجمی با نام درصد حجمی/ حجمی یا غلظت حجمی/ حجمی نیز شناخته میشود.
برای درک بهتر محاسبات مربوط به انواع غلظت و درصد حجمی محلول، به مثالهای زیر توجه کنید.
مثال ۱
غلظت محلولی که از انحلال ۳۸۴ میلیلیتر استون در ۷۰۰ میلیلیتر آب تهیه شده است را حساب کنید.
پاسخ
برای پاسخ به این سوال کافی است حجم استون را بر مجموع حجم آب و استون تقسیم کرده و در عدد ۱۰۰ ضرب کنیم تا غلظت بر حسب درصد حجمی به دست آید.
مثال ۲
الکل ایزوپروپانول معمولا با غلظت ۷۰ درصد حجمی به فروش میرود و استفاده میشود. اگر چگالی ایزوپروپیل الکل برابر با ۰٫۷۸۵ گرم بر میلیلیتر باشد، چند گرم ایزوپروپیل الکل در ۳۵۵ میلیلیتر از این محلول وجود دارد؟
پاسخ
برای پاسخ به این سوال کافی است ابتدا حجم ایزوپروپیل الکل موجود در محلول را با استفاده از درصد حجمی آن به دست آورده و سپس جرم آن را با استفاده از چگالی محاسبه کنیم.
پس در ۳۵۵ میلیلیتر از این محلول، ۱۹۵ گرم ایزوپروپیل الکل وجود دارد.
درصد جرمی – حجمی
درصد جرمی حجمی یکی از انواع غلظت است که نسبت جرم ماده حلشونده را بر حجم محلول بر حسب درصد بیان میکند. فرمول محاسبه درصد جرمی حجمی به شکل زیر است.
در این فرمول، Solute (g) مقدار جرم ماده حلشونده بر حسب گرم و V Solution (mL) حجم محلول بر حسب میلیلیتر است. در این فرمول جرم نمونه حلشونده باید برحسب گرم و حجم محلول بر حسب میلیلیتر اندازهگیری و استفاده شود و واحد اندازهگیری آن درصد است. به این واحد اندازهگیری غلظت، درصد وزنی/ حجمی نیز گفته میشود.
برای درک بهتر انواع غلظت و فرمول درصد وزنی/ حجمی به مثالهای زیر دقت کنید.
مثال ۱
در یک محلول، ۱۱۱ میلیلیتر (۱۱۰٫۶۰۵ گرم) حلال و ۵٫۲۴ میلیلیتر (۶٫۰۵۰۸ گرم) ماده حلشونده وجود دارد. مقدار غلظت این نمونه را بر حسب درصد وزنی حجمی محاسبه کنید.
پاسخ
برای پاسخ به این سوال کافی است مقدار میلی گرم ماده حلشونده را بر مجموع حجم حلال و حلشونده تقسیم کنیم.
$$W/V= dfrac{6.0508g}{111+5.24 ml} times 100=5.205 text{%}$$
مولاریته
مولاریته یکی دیگر از انواع غلظت است که مقدار مول ماده حلشونده را در یک لیتر حلال محاسبه میکند. برای پیدا کردن مولاریته یک محلول باید تعداد مول ماده حلشونده را بر حجم محلول تقسیم کنیم. فرمول محاسبه مولاریته به شکل زیر است.
در این فرمول، (Mole(Solute)) به معنی تعداد مول ماده حلشونده و (L(Solution)) به معنی لیتر محلول است. واحد اندازهگیری این غلظت، مولاریته است و با حرف M نمایش داده میشود.
برای درک بهتر این فرمول و انواع غلظت، به مثالهای زیر دقت کنید.
مثال ۱
یک محلول ۱٫۵ لیتری از حل کردن ۰٫۲۵ گرم سدیم کلرید در آب به دست آمده است. مقدار غلظت این محلول را بر حسب مولاریته به دست آورید.
پاسخ
برای پاسخ به این سوال، باید تعداد مول سدیم کلرید را با استفاده از جرم مولی آن به دست آورده و سپس بر لیتر محلول تقسیم کنیم.
مثال ۲
سرکه سفید محلولی از استیک اسید با فرمول شیمیایی در آب است. محلولی ۰٫۵ لیتری از سرکه حاوی ۲۵٫۲ گرم استیک اسید خواهد بود. غلظت مولار سرکه را حساب کنید.
پاسخ
برای پاسخ به این سوال با استفاده از جرم مولی استیک اسید و جرم داده شده، مول آن رابه دست آورده و سپس با تقسیم بر حجم آن، غلظت مولار را به دست میآوریم.

مثال ۳
چه حجمی از محلول ۰٫۸۳۹ مولار سرکه شامل ۷۵٫۶ گرم اسید استیک خواهد بود؟
پاسخ
برای پاسخ به این سوال، تعداد مول اسید استیک را با استفاده از جرم مولی آن به دست آورده و سپس با استفاده از غلظت مولار آن حجم خواسته شده را به دست میآوریم. این محاسبات به شکل زیر است.
مولالیته
مولالیته یکی از انواع غلظت است که مول ماده حلشونده را در جرم حلال اندازهگیری میکند. برای یافتن مولالیته یک محلول باید تعداد مول ماده حلشونده را بر کیوگرم حلال تقسیم کنیم. فرمول محاسبه مولالیته به شکل زیر است.
در فرمول بالا عبارت (Molality) به معنی مولالیته است که با حرف m نیز آن را نمایش میدهند. عبارت (mole (Solute)) مول حلشونده و Kg (Solvent) کیلوگرم حلال است. در مولالیته و اندازهگیری غلظت محلول بر حسب آن، دو نکته مهم مطرح است.
- مولالیته شامل جرم مایعات است و باید به این نکته دقت وشود و از حجم آنها استفاده نشود.
- این واحد اندازهگیری غلظت مانند کسر مولی، به تغییر دما وابسته نیست و با تغییر دما تغییر نمیکند.
برای درک بهتر مولالیته و دیگر انواع غلظت، به مثالهای زیر دقت کنید.
مثال ۱
۰٫۸۸ گرم سدیم کلرید در ۲ لیتر آب حل شده است. مقدار غلظت این محلول را بر حسب مولالیته به دست آورید.
پاسخ
برای به دست آوردن غلظت بر حسب مولالیته، باید مولهای ماده حلشونده را به کیلوگرم حلال تقسیم کنیم. بدین ترتیب، تعداد مول سدیم کلرید را به دست آورده و حجم آب را با استفاده از چگالی آن به جرم تبدیل میکنیم.
حال برای محاسبه مولالیته محلول، مول سدیم کلرید را بر کیلوگرم آب تقسیم میکنیم.
مثال ۲
مقدار مولالیته محلولی که از حل کردن ۱۰ گرم پتاسیم کلرید در ۲۰۰ گرم آب به دست آمده است را محاسبه کنید.
پاسخ
برای پاسخ به این سوال، ابتدا تعداد مول پتاسیم کلرید را با استفاده از جرم مولی آن محاسبه کرده و سپس بر کیلوگرم حلال تقسیم میکنیم. دقت داشته باشید که تبدیل جرم از گرم به کیلوگرم باید انجام شود.
نرمالیته
یکی دیگر از انواع غلظت، نرمالیته است که تعداد گرم اکی والان ماده حلشونده را در ۱ لیتر محلول بیان میکند. برای یافتن نرمالیته یک محلول باید جرم ماده حلشونده بر حسب گرم را بر جرم اکی والان ماده حلشونده در حجم محلول بر حسب لیتر تقسیم کنیم. فرمول محاسبه نرمالیته به شکل زیر است.
در این فرمول، N نماد نیمالیته، M مولاریته، V حجم محلول و n تعداد اکی والان ماده است. تعداد اکی والان ماده را با استفاده از ساختار ماده شیمیایی و معمولا معادله واکنش تفکیک آن به دست میآورند. تعیین اکی والان مواد قوانین مشخصی دارد که به نسبت نوع ماده تعیین میشود. پیشنهاد میکنیم برای درک بهتر اکیوالان و محاسبات مربوط به آن، مطلب اکی والان چیست مجله فردرس را مطالعه کنید. فرمول محاسبه نرمالیته را می توان به روش زیر نیز نوشت و محاسبه کرد:
در این فرمول، m جرم حل شونده، v حجم محلول و Eq جرم اکی والان ماده است. جرم اکی والان ماده برابر با جرم مولی آن تقسیم بر تعداد اکی والانهای ماده است.
برای درک بهتر نرمالیته و ارتباط آن با انواع غلشت، به مثالهای زیر دقت کنید.
مثال ۱
مقدار نرمالیته ۳۱۰ میلیلیتر محلول سدیم هیدروکسیدی که از حل کردن ۰٫۴ گرم سدیم هیدروکسید در آب به دست آمده را محاسبه کنید.
پاسخ
برای پاسخ به این سوال، ابتدا باید تعداد اکی والان این ماده را به دست آوریم. سدیم هیدروکسید یک باز قوی است. یک مول از سدیم هیدروکسید در آب، یک مول یون هیدروکسید و یک مول یون سدیم تولید میکند پس اکی والان ان برابر با ۱ است. حال کافی است تعداد اکی والان، جرم و جرم مولی این ماده را در فرمول نرمالیته بگذاریم.

مثال ۲
اگر ۰٫۳۲۱ گرم سدیم کربنات در ۲۵۰ میلیلیتر آب حل شود، مقدار غلظت نرمال آن چقدر است؟
پاسخ
برای پاسخ به این سوال ابتدا باید تعداد اکی ولان ماده سدیم کربنات را بیابیم. این ماده یک ترکیب یونی است که از ترکیب یک یون کربنات ۲ بار منفی و دو یون سدیم مثبت تشکیل شده است. پس اکی والان آن برابر با ۲ است. حال با جای گذاری جرم، حجم و جرم اکی والان، مقدار نرمالیته محلول به دست میآید.
فرمالیته
فرمالیته یکی از انواع غلظت است که تعداد جرم واحد فرمول ماده حلشونده را در لیتر محلول بیان میکند. برای یافتن فرمالیته یک محلول باید جرم ماده حلشونده بر حسب گرم را بر جرم فرمولی ماده حلشونده بر لیتر حلال تقسیم کنیم. فرمول محاسبه فرمالیته به شکل زیر است.
برای درک بهتر واحد فرمالیته و انواع غلظت، به مثالهای زیر دقت کنید.
مثال ۱
محلولی با حل کردن ۱۱٫۷ گرم سدیم کلرید در ۵۰۰ میلیلیتر محلول تهیه شده است. مقدار غلظت آن را بر حسب فرمالیته به دست آورید. جرم مولی سدیم کلرید ۵۸٫۴۴ گرم بر مول است.
پاسخ
ابتدا تعداد مول سدیم کلرید را به دست آورده و سپس حجم محلول را به لیتر تبدیل کرده و در فرمول فرمالیته جایگذاری میکنیم.
مثال ۲
شیمیدانی با حل کردن ۳۴٫۲ گرم آلومینیوم سولفات در مقدار کافی آب، ۱ لیتر محلول تهیه میکند. مقدار فرمالیته محلول را بیابید. جرم مولی آلومینیوم سولفات برابر با ۳۴۲٫۱۵ گرم بر مول است.
پاسخ
برای پاسخ به این سوال ابتدا تعداد مول آلومینیوم سولفات را با استفاده از جرم مولی آن محاسبه کرده و سپس بر لیتر محلول تقسیم میکنیم.
کسر مولی
کسر مولی یکی از انواع کمتر رایج غلظت است که نسبت مولهای ماده حلشونده را بر مولهای حلشونده و حلال اندازهگیری میکند. برای محاسبه کسر مولی یک محلول باید تعداد مول ماده حلشونده را بر جمع تعداد مول ماده حلشونده و حلال تقسیم کرده و در عدد ۱۰۰ ضرب کنیم. فرمول محسابه کسر مولی به شکل زیر است.
در این فرمول () نشاندهنده عبارت (Mole Fraction) به معنی کسر مولی است. این واحد اندازهگیری غلظت از دمای محلول مستقل است و با تغییر آن تغییر نمیکند.
این واحد اندازهگیری غلظت برای محلولهایی که در آنها دو یا چند ماده مختلف حل شده است بسیار کارآمد است. برای مثال اگر سه ماده a، b و c در یک محلول حل شده باشند، کسر مولی ماده b برابر با تقسیم تعداد مول ماده b بر جمع تعداد مول سه ماده a و b و c خواهد بود.
برای درک بهتر فرمول کسر مولی و انواع غلظت، به مثالهای زیر دقت کنید.
مثال ۱
با توجه به تصویر زیر، مقدار کسر مولی ماده c را پیدا کنید.
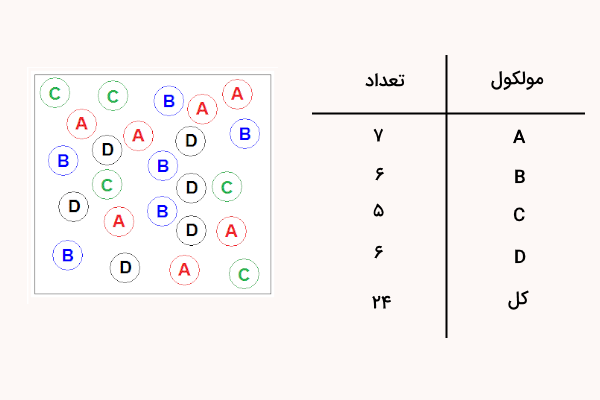
پاسخ
برای پاسخ به این سوال کافی است تعداد مولکولهای ماده c را بر تعداد کل مادهها تقسیم کنیم و در عدد ۱۰۰ ضرب کنیم.
$$mole f.= dfrac{Mole (Solute)}{Mole(total)} times 100= dfrac{5}{24}times 100 =20.83text%$$
مثال ۲
کسر مولی سدیم کلرید در محلول تهیه شده از این ماده با ۵ گرم سدیم کلرید و ۱۰۰ گرم آب چقدر است؟
پاسخ
برای پاسخ به این سوال، ابتدا تعداد مول موجود در این جرمها از سدیم کلرید و آب را محاسبه میکنیم.
$$text{Moles of H_2O} = frac{100.0 text{g}}{18.02 text{g/mol}} = 5.55 text{mol}$$
سپس تعداد مول به دست آمده سدیم کلرید را بر تعداد مول کل تقسیم میکنیم.
گرم بر لیتر
واحد گرم بر لیتر یکی از انواع غلظت است که جرم ماده حلشونده را در لیتر محلول اندازهگیری میکند. فرمول محاسبه این واحد غلظت به شکل زیر است.
برای اندازهگیری غلظت بر اساس این واحد، باید جرم ماده حلشونده را به دست آورده و بر لیتر محلول تقسیم کنیم. این واحد غلظت مقدار قدرت محلول را اندازهگیری میکند. برای مثال، اگر ۱۰ گرم شکر در ۱ لیتر آب حل شده باشد، قدرت این محلول، ۱۰ گرم بر لیتر است.
تغییر واحد بین انواع غلظت
تا اینجا آموختیم انواع غلظت چیست و هر یک چه فرمولی دارند و چگونه اندازهگیری میشوند. در ادامه میآموزیم چگونه میتوانیم واحد یکی از انواع غلظت را به نوع دیگر از آن تبدیل کنیم. غلظت بر حسب مولاریته میتواند به مولالیته و .. تبدیل شود. در ادامه، هر یک از این انواع تبدیل را به شکلی جداگانه میآموزیم.
تبدیل مولاریته به مولالیته
برای تبدیل واحد غلظت مولاریته به مولالیته میتوانیم از فرمول زیر بهره بگیریم.
در این فرمول، M نشاندهنده مولاریته، D دانسیته و MW جرم مولی است. دقت داشته باشید که این فرمول تنها زمانی قابل استفاده است که مولاریته بسیار زیاد نباشد و بین ماده حلشونده و حلال واکنش شیمیایی رخ ندهد.
تبدیل قسمت در میلیون به قسمت در میلیارد
برای تبدیل واحدهای قسمت در میلیون و قسمت در میلیارد به یکدیگر کافی است از روابط زیر بهره ببریم.
تبدیل مولاریته به نرمالیته
برای تبدیل مولاریته به نرمالیته میتوانیم از روابط زیر بهره ببریم.
مثال تبدیل واحد انواع غلظت
در قسمت قبل آموختیم چگونه با استفاده از کسرهای استوکیومتری مناسب میتوانیم واحدهای انواع غلظت را به یکدیگر تبدیل کنیم. در ادامه، برای درک بهتر این محاسبات به مثالهای زیر توجه کنید.
مثال ۱
یک محلول غلیظ آمونیاک ۲۸ درصد وزنی است و چگالی آن برابر با ۰٫۸۹۹ گرم بر میلیلیتر است. مقدار غلظت مولی این محلول را محاسبه کنید.
پاسخ
برای پاسخ به این سوال باید با استفاده از چگالی محلول، وزن آن را محاسبه کرده سپس با استفاده از وزن مولکولی آمونیاک، تعداد مول آن را در محلول پیدا کنیم تا غلظت مولی آن به دست آید.
مثال ۲
بالاترین مقدار یون کلریدی که میتواند در آب آشامیدنی وجود داشته باشد برابر با است. اگر مقدار یون کلرید آب بیش از این اندازه باشد، مزهای شور خواهد داشت. مقدار غلظت مولی این مقدار کلرید را در آب محاسبه کنید.
پاسخ
برای پاسخ به این سوال، با استفاده از واحد میلیگرم بر لیتر ppm و جرم مولی کلر به شکل زیر مقدار مول در لیتر این محلول محاسبه میشود.

مثال ۳
دو محلول ۰٫۵ مولار سدیم کلرید و ۰٫۲۵ مولار استرانسیم کلرید را در نظر بگیرید. کدام یک از این محلولها بر حسب میلیگرم بر میکروگرم غلظت بالاتری خواهد داشت؟
پاسخ
برای پاسخ به این سوال باید غلظت بر حسب میکروگرم بر میلیلیتر این محلولها را با استفاده از جرم مولی آنها و تبدیل واحدهای مناسب به دست آورده و با هم مقایسه کنیم. این محاسبات به شکل زیر است.
پس غلظت میکروگرم بر میلیلیتر استرانسیم کلرید بیشتر از سدیم کلرید خواهد بود.
اندازهگیری غلظت
شیمی تجزیه روش های متعددی را برای اندازهگیری غلظت محلولهای مختلف ارائه میکند. این روشها، انواع مختلفی مانند تیتراسیون، طیف سنجی، کروماتوگرافی و .. هستند. هر یک از این روشها، چالشهای خود را دارند و ممکن است با مشکلاتی چون دقت، تداخل و تهیه ابزار اندازهگیری روبهرو شوند.
رقیقسازی محلولها
رقیقسازی فرآیندی است که در آن غلظت یک محلول با افزودن حلال بیشتر، کم میشود. برای مثال، یک لیوان آبمیوه و یخ با فرآیند ذوب شدن یخها رقیق میشود. رقیقسازی یکی از روشهای رایج در تهیه محلولهای مختلف است. برای تهیه محلول از اسیدها و بازهای غلیظ معمولا این مواد با مقادیر آب مورد نیاز مخلوط میشوند. برای انجام محاسبات رقیقسازی محلولها میتوان از فرمول محاسبه غلظت این محلولها استفاده کرد. برای مثال، مقدار مول مواد که با استفاده از رابطه غلظت مولار به دست میآید را در نظر بگیرید.
اگر دو محلول رقیق و غلیظ از یک ماده داشته باشیم، میتوانیم رابطه بالا را به شکل زیر برای آنها بنویسیم.
از آنجا که نوع ماده طی فرایند رقیقسازی تغییری نمیکند و مقدار ماده حلشونده نیز تغییری نمیکند و فقط حجم حلال تغییر میکند، میتوانیم مقدار مول آنها را برابر در نظر بگیریم.
معادله بالا با نام معادله رقیقسازی شناخته میشود و میتوان آن را به شکل زیر بازنویسی کرد.
در فرمول بالا، عبارات C نمایانگر غلظت محلول هستند و میتوان هر یک از واحدهای انواع غلظت را در آن جایگذاری کرد. تنها نکته حائز اهمیت این است که واحد غلظت و حجم در سمت چپ و راست معادله باید یکسان باشد. (هر دو مولاریته، فرمالیته، لیتر، میلیلیتر و …)

مثال رقیقسازی محلول
در قسمت قبل آموختیم چگونه میتوان از محلولهای مختلف محلول رقیق با انواع مختلف غلظت تهیه کرد. در ادامه برای درک بهتر محاسبات رقیقسازی، به مثالهای زیر دقت کنید.
مثال ۱
اگر ۰٫۸۵۰ لیتر از محلول ۵ مولار نیترات مس (اا) تا حجم ۱٫۸۰ لیتر رقیق شود، غلظت محلول رقیق شده چقدر خواهد بود؟
پاسخ
با توجه به معادله ارائه شده بالا، مقادیر داده شده را در معادله جایگذاری میکنیم تا غلظت محلول رقیق به دست آید.
مثال ۲
چه حجمی از محلول ۰٫۱۲ مولار اسید برومیک باید استفاده شود تا محلول ۱۱ میلیلیتری و با غلظت ۰٫۴۵ مولار از این محلول تهیه کنیم؟
پاسخ
مانند مثال قبل، کافی است مقادیر داده شده را در معادله رقیقسازی جایگذاری کنیم تا مقدار حجم مورد نیاز اسید رقیق به دست آید.
مثال ۳
چه حجمی از محلول ۱٫۵۹ مولار برای تهیه ۵ لیتر محلول ۱ مولار پتاسیم کلرید نیاز است؟
پاسخ
برای پاسخ به این سوال، مقادیر داده شده را در فرمول رقیقسازی جای گذاری کرده و حجم مورد نیاز از محلول غلیظ به دست میآید.
یادگیری محلول سازی با فرادرس
یادگیری انواع غلظت به ما در تهیه محلولها و یادگیری روشهای محلولسازی کمک میکند. برای یادگیری محلولسازی ابتدا باید با مفاهیمی چون محیط آزمایشگاه و قوانین آن و محلولسازی از مایعات و جامدات آشنا شویم. همچنین، شناسایی وسایل آزمایشگاه شیمی به ما در درک این مفاهیم کمک خواهد کرد. پیشنهاد میکنیم برای آشنایی با این مفاهیم، به مجموعه فیلم آموزش محلولسازی در آزمایشگاه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه محلولسازی و انواع غلظت دسترسی داشته باشید.
غلظت در استوکیومتری واکنشها
استوکیومتری واکنشهای شیمیایی مطالعه نسبت ترکیب مواد برای انجام واکنش شیمیایی است. برای انجام محاسبات استوکیومتری باید معادله موازنه شده را بنویسیم تا نسبت صحیح ترکیب مواد مشخص شود. انواع غلظت در محاسبات استوکیومتری استفاده میشود. غلظت مولار یکی از رایجترین انواع غلظت است که در محاسبات استوکیومتری از آن استفاده میشود.
برای درک بهتر نقش غلظت در محاسبات استوکیومتری، واکنش زیر را در نظر بگیرید.
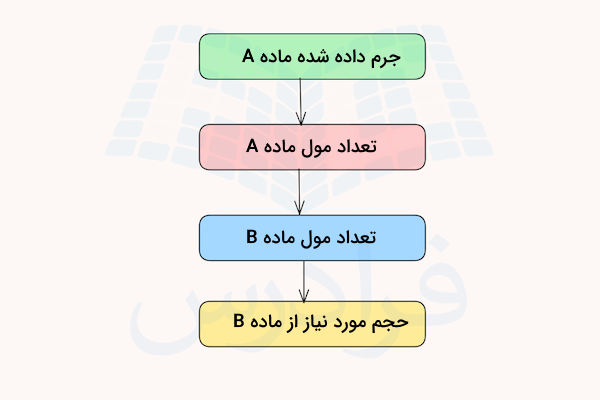
در نظر بگیرید میخواهیم بدانیم چند لیتر از محلول آبی اسید کلریدریک با وزن مشخصی از سدیم هیدروکسید واکنش میدهد. یک راه حل رایج برای حل آن سوال به شکل زیر است.
ابتدا از جرم داده شده سدیم هیدروکسید آغاز کرده و با استفاده از جرم مولی، تعداد مول آن را به دست میآوریم. سپس با استفاده از ضرایب استوکیومتری واکنش موازنه شده، نسبت ترکیب اسید کلریدریک و سدیم هیدروکسید را به دست آورده و بدین ترتیب تعداد مول اسید کلریدریک نیز به دست میآید. در نهایت با استفاده از فرمول مولاریته حجم مورد نیاز از محلول اسید کلریدریک را به دست میآوریم.
یک مسیر کلی برای حل کردن این گونه مسائل در تصویر زیر مشخص شده است.
مثال غلظت در استوکیومتری
برای درک بهتر روش استفاده از انواع غلظت در محاسبات استوکیومتری، به مثالهای زیر دقت کنید.
مثال ۱
چند میلیلیتر از محلول ۲٫۷۵ مولار اسید کلریدریک نیاز است تا با ۱۸۵ گرم سدیم هیدروکسید واکنش دهد؟ معادله موازنه شده این واکنش به شکل زیر است.
پاسخ
برای پاسخ به این سوال، ابتدا تعداد مول سدیم هیدرکسید را با استفاده از جرم مولی آن محاسبه میکنیم.
سپس با استفاده از معادله واکنش موازنه شده، تعداد مول اسید کلریدریک را به دست میآوریم.
در نهایت، با استفاده از تعریف مولاریته، حجم اسید کلردریک ۲٫۷۵ مولار مورد نیاز را به دست میآوریم.
مثال ۲
چند میلیلیتر از محلول ۱٫۰۴ مولار اسید سولفوریک برای واکنش با ۹۸٫۵ گرم کلسیم هیدروکسید طبق واکنش زیر نیاز است؟
پاسخ
ابتدا مول کلسیم هیدروکسید را با استفاده از جرم مولی آن محاسبه میکنیم.
سپس با استفاده از ضرایب استوکیومتری معادله واکنش، تعداد مول اسید سولفوریک را به دست میآوریم.
در مرحله بعدی با استفاده از فرمول مولاریته، حجم مورد نیاز اسید سولفوریک را به دست میآوریم.
در نهایت باید واحد حجم را به میلیلیتر تبدیل کنیم تا میلیلیتر اسید سولفوریک محاسبه شود.
مثال ۳
چه حجمی از سدیم کلرید ۰٫۷۷۹ مولار با ۴۰٫۸ مول از نیترات سرب طبق معادله زیر واکنش میدهد؟
پاسخ
برای پاسخ به این سوال، ابتدا تعداد مول سدیم کلرید را با توجه به نسبت استوکیومتری محاسبه کرده سپس حجم آن را با استفاده از تعریف مولاریته به دست میآوریم.
آزمون انواع غلظت
در این مطلب از مجله فرادرس آموختیم انواع غلظت چیست و روش محاسبه هر یک از این انواع غلظت کدام است. برای تمرین بیشتر این محاسبات، به سوالات زیر پاسخ دهید. همچنین، میتوانید با کلیک بر روی گزینه مشاهده نتیجه آزمون، نمره محاسبه شده آزمون خود را مشاهده کنید.
یک نمونه ۳۵۵ میلیلیتری از یک نوشیدنی شامل ۰٫۱۳۳ مول شکر است. غلظت این نوشیدنی بر حسب مولاریته کدام است؟
برای پاسخ به این سوال کافی است مقدار مول ماده حلشونده (شکر) را بر حجم محلول تقسیم کنیم. باید دقت داشته باشیم، مقدار حجم محلول در این سوال بر حسب میلیلیتر داده شده است و باید به لیتر تبدیل شود. روش حل این سوال به شکل زیر است.
چه وزنی از محلول اسید نیتریک ۶۸ درصد وزنی برای تهیه ۴۰۰ گرم محلول ۱۰ درصد از این محلول نیاز است؟
برای پاسخ به این سوال ابتدا مقدار جرم اسید نیتریک موجود در محلول ۱۰ درصد را محاسبه میکنیم.
پس ۴۰ گرم اسید نیتریک در محلول ۱۰ درصد وزنی آن وجود خواهد داشت. اگر مقدار وزن مورد نیاز از محلول غلیظ را برابر با مجهول x قرار دهیم، معادله زیر را خواهیم داشت که طبق آن، x گرم از محلول ۶۸ درصد برابر با ۴۰ گرم اسید نیتریک خواهد بود.
مقدار سختی آب معمولا بر حسب ppm جرم کلسیم کربنات بیان میشود که همارز با مقدار میلیگرم کلسیم کربنات در هر لیتر آب است. مقدار غلظت مولار یون کلسیم () در نمونه آبی که سختی آن برابر با ۱۷۵ میلی گرم بر لیتر کلسیم کربنات است چقدر است؟
برای پاسخ به این پرسش، مقدار سختی آب را به گرم بر لیتر تبدیل کرده و با استفاده از جرم مولی کلسیم کربنات، تعداد مول کلسیم کربنات را به دست میآوریم. از آن جا که در هر مول کلسیم کربنات یک مول یون کلسیم وجود دارد، مقدار مول کلسیم کربنات با مول کلسیم برابر خواهد بود.
مقدار مولالیته محلولی که از انحلال ۱۲ گرم گلوکز با فرمول شیمیلیی () و ۱۸ گرم اوره با فرمول شیمیایی () در ۱۰۰ گرم آب به دست آمده است را محاسبه کنید. جرم مولی گلوکز ۱۸۰٫۱۶ گرم بر مول و جرم مولی اوره برابر با ۶۰٫۰۶ گرم بر مول است.
۳٫۶۶۲ مول بر کیلوگرم
۴٫۴۰ مول بر کیلوگرم
۳٫۰۴۹ مول بر کیلوگرم
۴٫۵۴۰ مول بر کیلوگرم
برای پاسخ به این سوال، ابتدا تعداد مول گلوکز و اوره را به دست آورده و سپس طبق فرمول محاسبه مولالیته، مجموع مولهای مواد حل شونده را بر کیلوگرم حلال تقسیم میکنیم.
گلوکز:
اوره:
مجموع:
مقدار غلظت بر حسب نرمالیته را برای محلولی که از انحلال ۴٫۹ گرم اسید سولفوریک در ۲۵۰ میلیلیتر آب به دست آمده است را محاسبه کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
مقدار درصد جرمی محلولی که شامل ۱۸ گرم آمونیوم کلرید در ۱۱۲ گرم آب است را محاسبه کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
مقدار کسر مولی اتانول را در نمونهای که شامل ۴۶ گرم اتانول و ۹۰ گرم آب است محاسبه کنید. جرم مولی اتانول برابر با ۴۶٫۰۷ گرم بر مول و جرم مولی آب ۱۸٫۰۲ گرم بر مول است.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
محلولی با غلظت ۰٫۸۵۰ مولار از پتاسیم نیترات تهیه شده است. اگر حلال، آب باشد و حجم محلول ۱ لیتر باشد، غلظت محلول بر حسب درصد جرمی و ppm کدام است؟ جرم مولی پتاسیم نیترات برابر ۱۰۱٫۱ گرم بر مول است.
٪ ۸٫۵۹۴ و ۸۵۹۴۰
٪ ۱۳٫۸ و ۱۳۸۰۰۰
٪ ۱۲٫۱ و ۱۲۰۰۰۰
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چند میلیلیتر از اسید کلریدریک ۱۲ مولار باید رقیق شود تا ۵۰۰ میلیلیتر محلول ۱٫۵ مولار اسید کلریدریک تهیه کنیم؟
۱۲۵ میلیلیتر
۴۱٫۷ میلیلیتر
۶۲٫۵ میلیلیتر
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
محلولی با خنثی کردن ۲۵ میلیلیتر محلول ۰٫۲ مولار اسید سولفوریک با سدیم هیدروکسید تهیه شده است. مقدار کسر مولی سدیم سولفات را با توجه به واکنش زیر به دست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
