سارکومر واحد انقباضی اصلی فیبرهای ماهیچهای در عضلات اسکلتی است. هر سارکومر از فیلامنتهای پروتئینی ساخته شده است که آنها را به دو گروه فیلامنتهای نازک و فیلامنتهای ضخیم تقسیم میکنیم. فیلامنتهای نازک از پروتئينهای اکتین، میوزین و تروپومیوزین تشکیل شده است و در فیلامنت ضخیم نیز پروتئين میوزین وجود دارد. برهمکنش بین میوزین و رشته اکتینی اساس انقباض سارکومر ماهیچهها است، به همین دلیل ما در مطلب از مجله فرادرس ابتدا یاد میگیریم سارکومر چیست و در گامهای بعد به سراغ اجزای ساختاری و فعالیت سارکومرها میرویم. در نهایت نیز نقش سارکومرها را در فعالیتهای مختلف بدن مانند تنفس و گردش خون بررسی میکنیم.

سارکومر چیست؟
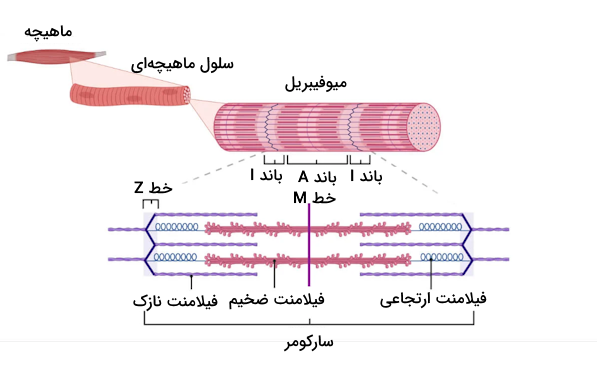
سارکومر کوچکترین واحد انقباضی فیبرهای ماهیچه اسکلتی و قلبی است که در یک میوفیبریل چندین بار تکرار شده است. سارکومر در واقع بخشی از میوفیبریل و مجموعهای سازمانیافته از فیلامنتهای اکتین و میوزین است که از یک خط Z شروع شده و به خط Z دیگری منتهی میشود. سارکومر را به دلیل همین ساختار ویژه و مولکولهای سازنده آن به عنوان واحد انقباضی ماهیچههای مخطط میشناسیم.
دو پروتئين اصلی ساختار سارکومر اکتین و میوزین نام دارند که امکان دارد نام آنها را در مطالب مربوط به اسکلت سلولی دیده باشید، اما میوزین موجود در سارکومر، میوزین نوع ۲ است که تنها در ساختار سارکومرهای ماهیچهای وجود دارد و رشتههای اکتین نیز در ساختار این واحد انقباضی آرایش خاصی دارند که در ادامه با آن آشنا خواهیم شد.
بیومکانیک به متخصصین مختلف این اجازه را میدهد که فعالیت ماهیچهها را از منظر علم فیزیک بررسی کنند. در صورتی که تمایل به یادگیری مبانی این حوزه دارید، توصیه میکنیم از فیلم آموزش مبانی بیومکانیک یک فرادرس استفاده کنید که لینک آن به منظور دسترسی راحت در کادر زیر درج شده است.
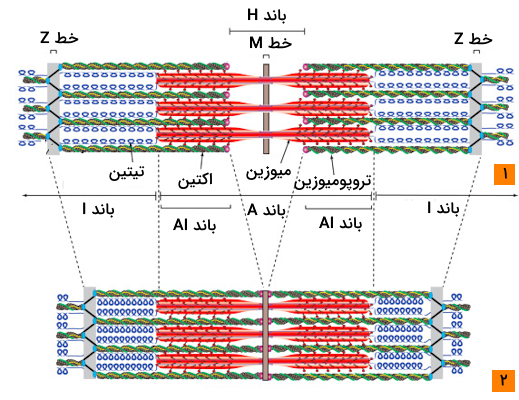
در تصاویر میکروسکوپی سارکومرها متوجه میشویم که در زمان استراحت ماهیچهها در ساختار سارکومر دو باند روشن و تیره وجود دارد. دلیل ایجاد این باندها به پروتئينهای سازنده ساختار سارکومرها باز میگردد؛ در اصل ماهیت ساختاری این دو پروتئين باعث میشود که سارکومر در زیر میکروسکوپ ساختاری مخطط داشته باشد، در ادامه پروتئينهای حاضر در خطوط تیره و روشن را نام میبریم.
- باند روشن: باند روشن یا باند ایزوتروپیک مربوط به ناحیهای هستند که تنها رشتههای اکتین وجود دارند.
- باند تیره: باند تیره مربوط به باند A یا باند آنیزوتروپیک در ساختار سارکومر است که شامل نقاط همپوشان اکتین و میوزین و نقطه میانی سارکومر است که تنها میوزین در آن قسمت وجود دارد.
سارکومرهای نقشی کلیدی در مکانیک ماهیچهها بازی میکنند، در حقیقت انقباض سارکومرها باعث انقباض ماهیچهها و حرکت آنها میشود؛ بنابراین درک نحوه انقباض سارکومرها به ما کمک میکند تا شیوه کار ماهیچههای مخطط بدن را متوجه شویم. در طول انقباض ماهیچه، سارکومرها و بخشهای ساختاری آنها دچار تغییراتی میشوند که در ادامه به آنها اشاره میکنیم.
- طول سارکومر: کاهش
- طول باند I: کاهش
- طول ناحیه H: کاهش یا از بین رفتن
- طول ناحیه A: بدون تغییر
فعالیت سارکومرها علاوه بر آن که به ساختار خاص آنها متکی است، به انرژی و یون کلسیم نیز نیاز دارد. بدون انرژی یا حضور کلسیم در سیتوپلاسم، رشتههای اکتین و میوزین قادر به لغزش و کاهش طول سارکومر نیستند؛ بنابراین میتوکندریهای زیادی در سلولهای ماهیچهای وجود دارند که به طور مداوم ATP مورد نیاز انقباض را تولید میکنند.
مسئولیت ذخیرهسازی یون کلسیم نیز با شبکه سارکوپلاسمی است که با رسیدن پتانسیل عمل یون کلسیم را به درون سیتوپلاسم آزاد میکند و با پایان انقباض این یون را به طور فعال و با صرف انرژی به فضای درونی خود باز میگرداند.
میوفیبریل چیست؟
«میوفیبریل» (Myofibril) یک فیبر ماهیچهای انقباضی در سلولهای ماهیچهای است که ساختاری بسیار ظریف دارد. این ساختار متشکل از فیلامنت یا رشتههای نازک و ضخیمی است که در ساختار سارکومر آنها را بررسی میکنیم.
در ساختار سلولهای ماهیچه مخطط تعداد زیادی میوفیبریل وجود دارد که هر کدام از آنها قطری در حدود ۱ یا ۲ میکرومتر دارند. به کمک تصویر زیر میتوانید دید بهتری نسبت به تفاوت میوفیبریل با سارکومر به دست آورید.
یادگیری اندامهای بدن انسان با فرادرس
بدن انسان از اندامهای مختلفی تشکیل شده است که با وجود وظایف مجزا و تخصصی برای ادامه فعالیت و تامین نیازهای خود به دیگر اندامهای بدن وابسته هستند. به عنوان مثال، ما در این مطلب از مجله فرادرس به این موضوع میپردازیم که سارکومر چیست تا با نحوه انقباض ماهیچههای اسکلتی و قلبی بهتر آشنا شویم، حاصل فعالیت این واحدهای انقباضی، پمپاژ خون به بخشهای مختلف بدن و حرکت ارادی بدن است که دو مورد از اساسیترین فعالیتهای ما هستند. به همین ترتیب میتوانیم به اهمیت اندامهای دیگری مثل ریهها، معده، مغز، قلب و غیره در انجام فعالیتهای حیاتی مختلف اشاره کنیم.
برای یادگیری عملکرد اختصاصی اندامهای مختلف میتوان مسیر یادگیری را از شناخت سلولها و بافتهای سازنده اندام مدنظر شروع کرد یا در ابتدا به سراغ آناتومی و موقعیت اندام به همراه دستگاهی که اندام هدف به آن تعلق دارد، رفت تا به جای تمرکز بر بخشهای سلولی از زاویه دید دیگری موضوع را بررسی کرد. انتخاب مسیر یادگیری با توجه به نیاز افراد مختلف صورت میگیرد اما نکته قابل توجه در پیشروی در مسیر یادگیری استفاده از منابع موثق و به روزی مانند فیلمهای آموزشی است که طبق برنامهریزی آموزشی جامع تهیه شده باشند.
در ادامه تعدادی از فیلمهای آموزشی فرادرس را که برای یادگیری در مورد اندامهای بدن کارآمد هستند، معرفی میکنیم و لینک آنها را ارائه میدهیم.
ساختار سارکومر
هر سارکومری که در ساختار ماهیچه میبینیم به طور کلی از چندین رشته فیلامنت پروتئینی ساخته شده است که قدرت انقباضی آن را تعیین میکنند. در بررسی میکروسکوپی ساختار سارکومر متوجه میشویم که بخشی از آن به صورت نوار یا باندی تیره و بخشی دیگر به صورت نوار یا باند روشن دیده میشود.
این الگوی تیره-روشن به دلیل نحوه سازماندهی میوفیلامنتهای مختلف سارکومر در بخشهای متفاوت ساختار آن است. در ادامه با پروتئینهای اصلی ساختار سارکومر آشنا میشویم، سپس به بخشهای مختلف ساختار سارکومر میپردازیم.
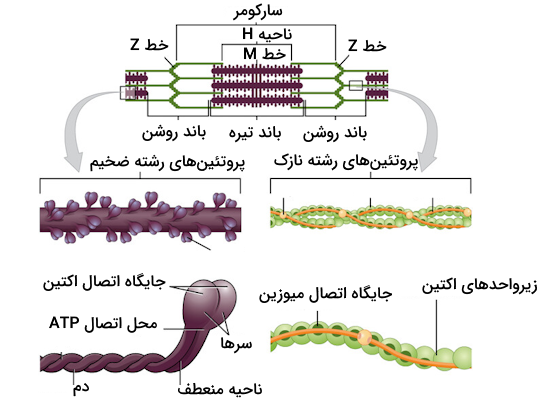
- «رشتههای اکتین» (Actin Filaments): رشتههای اکتین که آنها را با عنوان «رشتههای نازک» (Thin Filaments) نیز میشناسیم، داربستهای سارکومر محسوب میشوند که برای انقباض سارکومر با میوزینها همکاری میکنند.
- «رشتههای میوزین» (Myosin Filaments): این فیلامنتها که آنها را با عنوان «رشتههای ضخیم» (Thick Filaments) نیز میشناسیم، حاوی سرهای میوزینها هستند که در حین انقباض به رشتههای اکتین متصل میشوند و آنها را به سمت مرکز سارکومر میکشند.
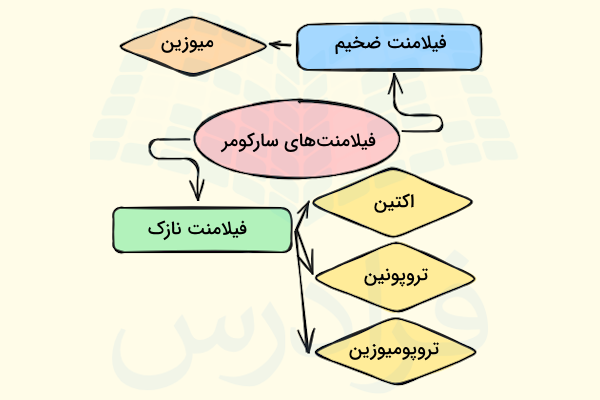
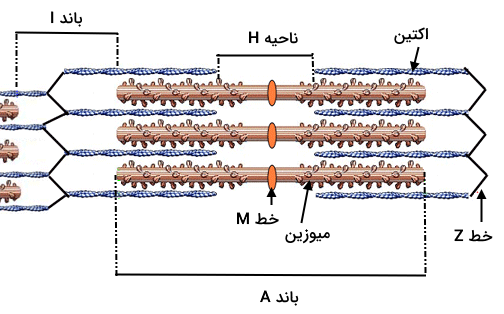
پس از ثبت تصاویر میکروسکوپی از سارکومرها در زمان استراحت متوجه میشویم که ساختار آنها را میتوان به ۵ بخش تقسیم کرد که در ادامه آنها را نام میبریم و توضیحی مختصر برای آشنایی با هر یک ارائه میدهیم.
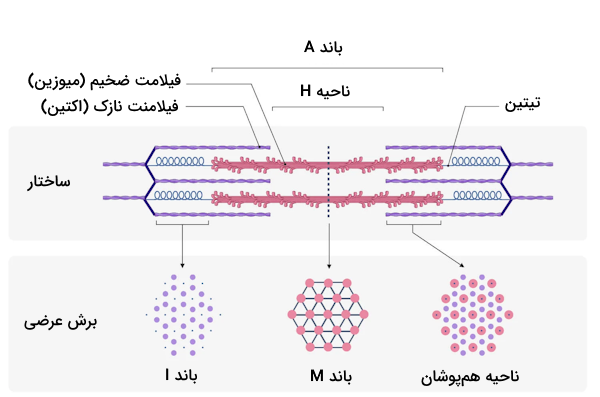
- «باندهای A»: باند A یا باند «آنیزوتروپیک» (Anisotropic) در تصاویر میکروسکوپی به صورت نواری تیره دیده میشود که برای مشخص کردن محدوده آن باید بگوییم تمام طول رشته ضخیم (میوزین) باند A را مشخص میکند، بنابراین در بخشی از باند A شاهد حضور هر دو رشته اکتین و میوزین هستیم، در حالی که در بخش مرکزی تنها رشته ضخیم را میبینیم.
- «باندهای I»: باند I یا باند «ایزوتروپیک» (Isotropic) در تصاویر میکروسکوپی به صورت نواری روشن دیده میشود که تنها حاوی فیلامنتهای نازک یا همان اکتینها است؛ با توجه به این که در دو سمت سارکومر رشتههای اکتین وجود دارد، دو باند I را در اطراف باند A میبینیم.
- «خط Z»: خط Z با قطع کردن باند I، تبدیل به نقطه اتصال بین دو رشته فیلامنت اکتین همسایه میشود. این موضوع باعث میشود که سارکومر را به صورت ساختاری بین دو خط یا دیسک Z تعریف کنیم.
- «خط M»: خط M در بخش میانی سارکومر وجود دارد و وظیفه آن تثبیت آرایش فیلامنتهای میوزین در مرکز سارکومر است. در این قسمت شاهد حضور پروتئینهایی به نام «میومزین» (Myomesin) هستیم.
- «ناحیه H»: ناحیهای که تنها مربوط به رشته ضخیم یا میوزینها است و در مرکز سارکومر قرار دارد. با انقباض سارکومر ناحیه H ناپدید یا از طول آن کاسته میشود.
برای درک بهتر ناحیه متناظر با هر یک از این باندها و خطوط پیشنهاد میدهیم به تصویر زیر توجه کنید که در آن، تمام بخشهای سارکومر نامگذاری شدهاند.
فیلامنتهای نازک
فیلامنتهای نازک یا همان رشتههای اکتین، از سه نوع پروتئین مختلف تشکیل شدهاند که در ادامه آنها را نام میبریم.
- «اکتین» (Actin)
- «تروپونین» (Troponin)
- «تروپومیوزین» (Tropomyosin)
با وجود آن که تشکیل فیلامنتهای نازک حاصل کنار هم قرارگیری این سه نوع پروتئین است، باید گفت که اصلیترین جزء ساختاری این فیلامنتها پروتئینهای اکتین هستند و دو پروتئین دیگر، یعنی تروپونین و تروپومیوزین به عنوان پروتئينهای تنظیمی تعاملات فیلامنتهای نازک و ضخیم فعالیت میکنند؛ به بیان دیگر تروپونین و تروپومیوزین، پروتئینهای تنظیمکننده فرآیند انقباض ماهیچهها هستند.
فیلامنتهای نازک به طور مستقیم به پروتئينهای سازنده خطوط Z متصل هستند که در دو سمت سارکومر وجود دارند. در هنگام انقباض، این دو رشته با حرکت در طول رشته ضخیم، به یکدیگر نزدیک میشوند تا فاصله بین خطوط Z یا طول سارکومر کاهش یابد.
فیلامنتهای نازک در ساختار باند I و بخشی از باند A حضور دارند اما در خط M اثری از فیلامنتهای نازک نیست، بنابراین در حین نامگذاری بخشهای مختلف سارکومر باید به این نکته توجه داشته باشیم که فیلامنتهای نازک در کدام نواحی حضور دارند.
فیلامنتهای ضخیم
فیلامنتهای ضخیم ساختار سارکومر یا همان رشتههای میوزین، از پروتئین میوزین نوع دو ساخته شدهاند که ماهیتی دو قطبی دارد و به رشتههای الاستیک «تیتین» (Titin) متصل میشود تا به کمک اتصال آنها به خط Z به طور غیرمستقیم به خط Z متصل باشد.
فیلامنتهای ضخیم در مرکز سارکومر، میان دو فیلامنت نازک قرار گرفتهاند و نحوه سازماندهی آنها در این ناحیه نیز به صورت یک شبکه ششضلعی است که در تصویر زیر میتوانید آن را ببینید. درون هر فیلامنت ضخیم، تعدادی سر میوزین به سمت بیرون جهتگیری کردهاند که در زمان انقباض عضلانی به فیلامنت نازک (پروتئینهای اکتین) متصل میشوند.
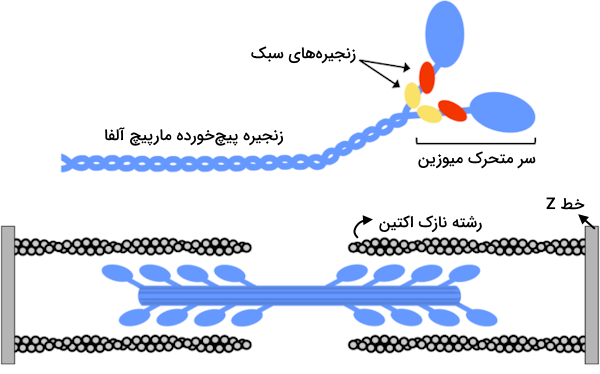
ساختار مولکولی میوزین
میوزینها به طور کلی گروهی از پروتئینهای حرکتی هستند که انواع مختلفی دارند. میوزینی که در ساختار سارکومرها حضور دارد، میوزین نوع دو است که آن را با علامت اختصاری «M۲» نیز نشان میدهیم. میوزین نوع دو دارای دو زنجیره مختلف در ساختار خود است که با توجه به وزن مولکولی هر یک از آنها، در دو گروه مختلف دستهبندی میشوند.
- زنجیره سنگین: در میوزین نوع دو، ۲ زنجیره سنگین وجود دارد که وزن هر کدام در حدود ۲۰۰ کیلودالتون است.
- زنجیره سبک: میوزین نوع دو دارای ۲ جفت زنجیره سبک است که هر کدام وزنی در حدود ۲۰ کیلو دالتون دارند.
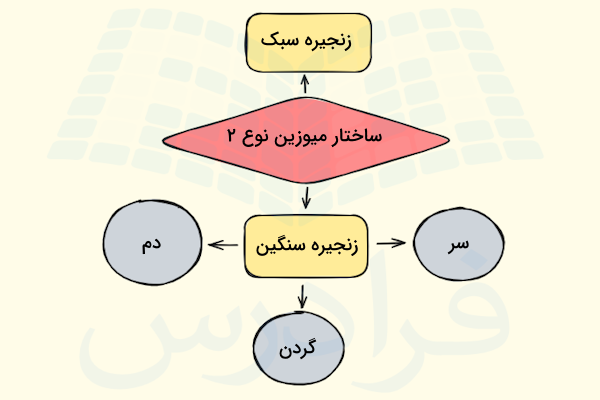
هر زنجیره سنگین دارای یک ناحیه سر کروی و یک دم بلند است که ناحیه دم به صورت مارپیچ آلفا شکل گرفته است. دمهای مارپیچ دو زنجیره سبک به دور یکدیگر میپیچند و یک دایمر به وجود میآورند. از طرف دیگر دو زنجیره سبک به ناحیه گردن متصل میشوند تا ساختار مولکول میوزین دو کامل شود.
بنابراین ساختار زنجیره سنگین پروتئين میوزین به سه بخش یا به بیان تخصصی «دومین» (Domain) تقسیم میشود که در ادامه آنها را معرفی میکنیم و نقش هر کدام را در فعالیت سارکومر توضیح میدهیم.
- «سر» (head): سر میوزین به رشته اکتین متصل میشود و با استفاده از هیدرولیز ATP انرژی موردنیاز برای حرکت روی رشته میوزین را به دست میآورد.
- «گردن» (neck): گردن ناحیه اتصال سر میوزین به دم آن است.
- «دم» (domain): بخش دم در ساختار میوزین دو با دم دیگر میوزینهایی که در تشکیل رشته ضخیم همکاری دارند، ارتباط برقرار میکند.
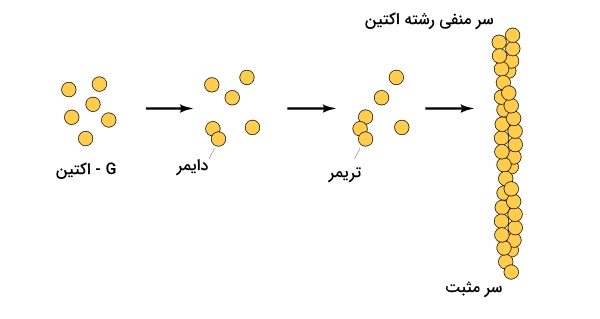
ساختار مولکولی اکتین
اکتین پروتئینی است که به عنوان زیرواحد ساختاری رشتههای سبک در ساختار سارکومرها شناخته میشود. به تک پروتئین اکتین که به صورت مونومر موجود باشد «G-اکتین» (G-actin) میگوییم. قرارگیری تعداد زیادی از این مونومرها باعث ساخت پلیمری میشود که آن را با عنوان «F-اکتین» (F-actin) میشناسیم.
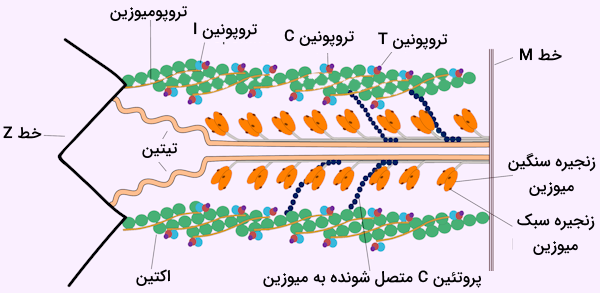
تروپونین و تروپومیوزین
با وجود آن که دو پروتئین اصلی ساختار سارکومرها اکتین و میوزین هستند، اما پروتئینهای دیگری نیز در تشکیل رشتههای نازک ساختار سارکومر نقش دارند. «تروپونین» (Troponin) و «تروپومیوزین» (Tropomyosin) دو پروتئینی هستند که به صورت یک کمپلکس در فیلامنت نازک حضور دارند. تروپونین دارای سه زیر واحد ساختاری است که در ادامه آنها را نام میبریم.
- تروپونین C
- تروپونین I
- تروپونین T
این سه زیر واحد همراه با پروتئین تروپومیوزین کمپلکس تروپونین-تروپومیوزین را میسازند که مسئول تنظیم اتصال پروتئینهای اکتین و میوزین است. این کمپلکس به میزان یون کلسیم حساس است، زیرا روی تروپونین C جایگاهی برای اتصال یون کلسیم وجود دارد که در صورت اتصال این یون باعث تغییر شکل ساختاری ترپونین میشود.
در مورد تروپومیوزینها باید گفت که در آنها پروتئینهایی هستند که در تنظیم فعالیت رشتههای اکتینی فعالیت دارند. این پروتئين ساختاری مارپیچی و پیچخورده دارد و همین ساختار ویژه باعث میشود که بتواند در بین شیارهای موجود در فیلامنت اکتین جا گیرد. تروپومیوزینها در دو گروه طبقهبندی میشوند که در ادامه با آنها آشنا میشویم.
- ایزوفرمهای تروپومیوزین ماهیچهای
- ایزوفرمهای تروپومیوزین غیرعضلانی
ما در این مطلب بر تروپومیوزین ماهیچهای متمرکز هستیم، زیرا این نوع از تروپومیوزین میتواند جایگاه اتصال میوزین به اکتین را اشغال کند و مانع انقباض سارکومرها شود.
فعالیت سارکومر
در تعریف سارکومر گفتیم که سارکومرها واحدهای عملکردی ماهیچههای مخطط هستند، بنابراین فعالیت اصلی سارکومرها تنظیم انقباض ماهیچهها است. زمانی که پیام انقباض توسط نورون به یک فیبر ماهیچهای میرسد، یونهای کلسیم از شبکه سارکوپلاسمی آزاد میشوند تا به میوزین در اتصال به رشته اکتین کمک کند.
سرهای میوزین که در بخش ساختار میوزین با آنها آشنا شدیم، به رشتههای اکتین متصل میشوند و آنها را به سمت مرکز سارکومر میکشند. نزدیک شدن رشتههای اکتینی به یکدیگر باعث کوتاه شدن طول سارکومر میشود. این شرایط را با عنوان «انقباض سارکومر» میشناسیم.
با پایان پتانسیل عمل، یونهای کلسیم به درون شبکه سارکوپلاسمی پمپ میشوند. کاهش غلظت یون کلسیم در سیتوپلاسم باعث جدا شدن سرهای میوزینها از رشتههای اکتین میشود. در این شرایط که آن را با عنوان «وضعیت استراحت» میشناسیم، سارکومر از حالت فشرده خارج شده و طول آن به حالت عادی برمیگردد.
نقش تروپونین و تروپومیوزین
در معرفی ساختار تروپونین و تروپومیوزین گفتیم که کمپلکس تروپونین تروپومیوزین در تنظیم اتصال میوزین به رشته اکتین نقش دارد، در این بخش قصد داریم به طور جزئیتر با فعالیت این کمپلکس آشنا شویم.
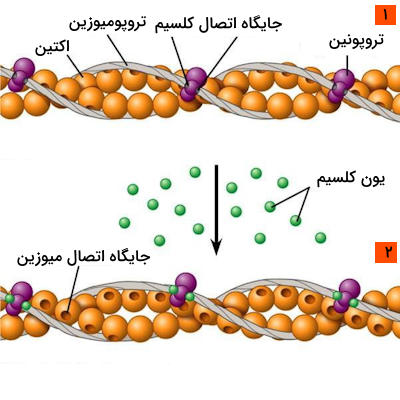
کمپلکس تروپونین تروپومیوزین به غلظت یون کلسیم درون سلول حساس است و با توجه به تغییرات سطح این یون، فعالیت انقباضی سارکومر را تنظیم میکند.
در حالت استراحت سارکومر، تروپومیوزین جایگاه اتصال میوزین به اکتین را اشغال میکند و مانع انقباض سارکومر میشود. با بالا رفتن غلظت یون کلسیم درون سلول، کلسیم به جایگاه خاصی که روی تروپونین C دارد، متصل میشود و باعث تغییر کنفورماسیون این پروتئین میشود.
تغییر ساختار تروپونین باعث جابهجایی تروپومیوزین و خالی شدن جایگاه اتصال میوزین به اکتین میشود، بنابراین میوزین موفق میشود به رشته اکتین متصل شده و فرآیند انقباض را شروع کند.
با پایان فرآیند انقباض، سطح کلسیم درون سلول کاهش مییابد و همین موضوع باعث اتصال دوباره تروپومیوزین به جایگاه اتصال میوزین به اکتین میشود. با مسدود شدن جایگاه میوزین، این پروتئین دیگر نمیتواند تا زمان انقباض بعدی به اکتین متصل شود و سارکومر در حالت استراحت باقی میماند.
نقش شبکه سارکوپلاسمی در انقباض سارکومرها
شبکه سارکوپلاسمی نوعی تخصص یافته از شبکه آندوپلاسمی است که در اطراف هر میوفیبریل حضور دارد و وظیفه آن ذخیره یون کلسیم () است. در ساختار غشای ماهیچهها فرورفتگیهایی وجود دارد که به عمق سلول نفوذ کردهاند و پیام عصبی از طریق آنها به سرعت به شبکه سارکوپلاسمی میرسد تا کلسیم را به سیتوپلاسم سلول آزاد کند. به این فرورفتگیهای غشایی «توبولهای عرضی» (Transverse (T) Tubule) میگوییم.
پیام عصبی باعث دپلاریزاسیون غشای ماهیچهها میشود، حرکت پیام عصبی در طول غشا و رسیدن آن به توبول عرضی باعث میشود که کانالهای کلسیمی موجود در شبکه سارکوپلاسمی باز شوند، افزایش سطح کلسیم سیتوپلاسم باعث شروع فرآیند انقباض سارکومرها میشود.
در مرحله پایانی انقباض سارکومرها کلسیم به داخل شبکه سارکوپلاسمی پمپ میشود و سطح آن در سیتوپلاسم سلول ماهیچهای کاهش مییابد. انتقال کلسیم به درون شبکه سارکوپلاسمی نیاز به صرف انرژی دارد، زیرا کلسیم باید بر خلاف شیب غلظت خود به داخل این اندامک پمپ شود؛ بنابراین پروتئینی که مسئول پمپاژ این یون است، از انرژی حاصل از تجزیه ATP برای انتقال استفاده میکند.
در صورتی که تمایل به کسب اطلاعات کامل در مورد ساختار و فعالیت شبکه سارکوپلاسمی دارید، مطالعه مطلب «شبکه سارکوپلاسمی چیست؟ – به زبان ساده + ساختار و وظیفه» از مجله فرادرس را پیشنهاد میدهیم.
نقش تیتین و نبولین
تیتین یکی از فراوانترین پروتئينهای موجود در بدن است. این پروتئین رشتهای که قابلیت ارتجاع دارد، به حفظ چهارچوب ساختاری و همجواری رشتههای اکتین و میوزین کمک میکند و به این ترتیب مکانیسم انقباض به درستی و بدون بهم خوردن ساختار سارکومر انجام میشود.
پروتئین تیتین دو سر دارد که یکی از آنها به خط Z متصل است و خاصیت فنری یا ارتجاعی دارد. سر دیگر تیتین به پروتئين میوزین متصل است، اما این اتصال به نحوی است که انگار تیتین به میوزن لنگر انداخته است. با بررسی این اتصالات متوجه میشویم که خط M و خط Z به وسیله تیتین به یکدیگر متصل شدهاند.
پروتئین عظیم دیگری که در ساختار سارکومر با آن روبهرو میشویم «نبولین» (Nebulin) نام دارد. به نظر میرسد نقش نبولین سازماندهی رشته نازک است. با این توضیحات میتوان متوجه شد با این که میوزین و اکتین پروتئینهای اصلی ساختار سارکومر هستند اما پروتئینهای متعددی برای حفظ یکپارچگی سارکومر در این واحد انقباضی حضور دارند.
نقش یون کلسیم
یونهای کلسیم نیز در انقباض سارکومرها نقشی کلیدی دارند. تحریک ماهیچه به وسیله پتانسیل عمل باعث آزادسازی یونهای کلسیم میشود تا این یونها به تروپونین C موجود در رشته نازک متصل شوند.
اتصال یون کلسیم به تروپونین C باعث تغییرات ساختاری این پروتئین میشود. نتیجه بازآرایی ساختار تروپونین C این است که جایگاه اتصال میوزین بر روی رشته اکتین نمایان میشود، بنابراین میوزین قادر خواهد بود که به اکتین متصل شده و فرآیند انقباض را آغاز کند.
تامین انرژی انقباض سارکومر
فیلامنتهای سارکومر برای لغزیدن روی یکدیگر نیاز به انرژی دارند و این انرژی از طریق ATP یا آدنوزین تریفسفات تامین میشود. هیدرولیز مولکول ATP باعث میشود که ADP یا آدنوزین دیفسفات، فسفات معدنی و انرژی تولید شود. کاتالیزور این واکنش هیدرولیزی سر میوزین است، بنابراین میتوان گفت که سر میوزین به عنوان یک آنزیم نیز عمل میکند.
تئوری لغزش فیلامنتها
«تئوری لغزش فیلامنتها» (Sliding Filament Theory) بیانگر شیوه تولید نیرو و کاهش طول در حین انقباض فیبر ماهیچهای است. این نظریه فرآیند انقباض ماهیچهها را به سه بخش اصلی تقسیم میکند که در ادامه آنها را نام میبریم.
- «اتصال» (Binding)
- «حرکت» (Movement)
- «جدایی پروتئينها» (Releasing Of Proteins)
تئوری لغزش فیلامنت این سه بخش فرآیند انقباض را در چهار مرحله اصلی توضیح میدهد که به صورت یک چرخه تکرار میشوند و مرحله پنجم نیز به ما نشان میدهد که انقباض سارکومر چطور به پایان میرسد. بنابراین با دنبال کردن مرحله به مرحله این فرآیند میتوانیم متوجه شویم که چطور طول سارکومرها و فیبرهای ماهیچهای تغییر میکند و سپس به حالت اولیه باز میگردند. برای به راه افتادن این چرخه دو عامل ضروری هستند.
- فراهم شدن انرژی مورد نیاز انقباض سارکومرها به شکل ATP
- حضور یون کلسیم در سیتوپلاسم
تا زمانی که غلظت یون کلسیم در سیتوپلاسم بالا باشد، تروپومیوزین جایگاه اتصال میوزین به اکتین را اشغال نخواهد کرد و انقباض سارکومر ادامه خواهد داشت. از طرفی میوزینها برای حرکت روی رشته اکتینی نیاز به انرژی دارند، بنابراین میتوکندریهای سلولهای ماهیچهای باید ATP کافی تولید کرده و در اختیار سارکومرها قرار دهند.
در بخشهای قبلی به خوبی با اجزای ساختاری سارکومرها و فعالیت هر یک از آنها آشنا شدیم، بنابراین در ادامه این بخش تنها به بررسی اتفاقات هر مرحله از تئوری لغزش فیلامنتها میپردازیم.
مرحله اول
در مرحله اول تئوری لغزش فیلامنتها، ماهیچه را در حالت استراحت در نظر میگیریم. برای ایجاد انقباض باید رشتههای اکتین به یکدیگر نزدیک شوند و به همین دلیل میوزینها با ایجاد پل عرضی باید دو رشته اکتین را به سمت یکدیگر بکشند. اما در فیلامنت نازک بجز اکتین دو پروتئين دیگر، یعنی تروپونین و تروپومیوزین نیز وجود دارند که مانع ایجاد پل عرضی میشوند. برای متوقفسازی فعالیت این دو پروتئین، سلولهای ماهیچهای نیاز به یون کلسیم دارند.
مرحله دوم
در این مرحله، سطح کلسیم موجود در سلولهای ماهیچهای بالا میرود و کلسیم به تروپونین متصل میشود؛ نتیجه این اتصال تغییر شکل تروپونین و حرکت تروپومیوزین است. تروپومیوزین در حالت عادی به جایگاه فعال اکتین متصل است، بنابراین با جابهجا شدن آن، میوزین میتواند به اکتین متصل شود و پل عرضی را ایجاد کند.
مرحله سوم
در مرحله سوم شاهد تجزیه مولکول «آدنوزین تریفسفات» (Adenosine Triphosphate | ATP) هستیم که باعث تولید انرژی مورد نیاز میوزینها برای کشیدن رشتههای اکتین به سمت یکدیگر یا مرکز سارکومر میشود. این اتفاق به طور هماهنگ در تمام فیبریلهای موجود در ماهیچه رخ میدهد تا ماهیچه بتواند به درستی منقبض شود.
مرحله چهارم
با اتصال مولکول ATP به سر میوزین، اکتین از سر میوزین جدا میشود و پل عرضی از بین میرود. نکتهای که در این مرحله وجود دارد این است که میوزین تنها زمانی میتواند دوباره به جایگاه اتصال اکتین متصل شود که مولکول ATP تجزیه شود.
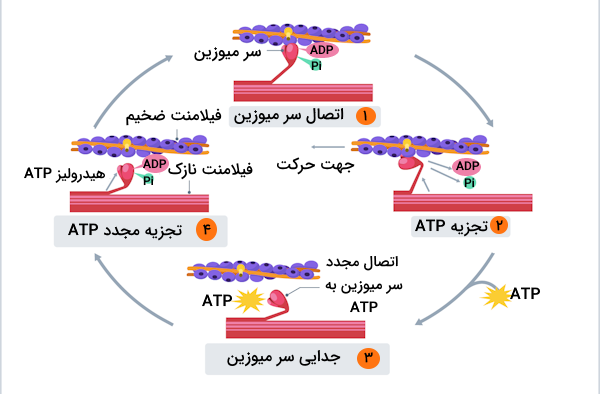
مرحله پنجم
در آخرین مرحله از تئوری لغزش فیلامنتها این نکته مطرح میشود که انقباض عضلات تا زمانی ادامه مییابد که کلسیم و ATP موردنیاز برای این فرآیند تامین شود. زمانی که پیام عصبی که از نورونها به فیبرهای ماهیچهای میرسد، باعث خروج کلسیم از شبکه سارکوپلاسمی شود، کلسیم موردنیاز انقباض تامین فراهم میشود، بنابراین برای کاهش سطح کلسیم باید پیام عصبی متوقف شود و یونهای کلسیم توسط پمپهایی که در عرض غشای شبکه سارکوپلاسمی حضور دارند به داخل این اندامک پمپ شوند.
با کاهش سطح کلسیم، اکتین به حالت استراحت برمیگردد و طول ماهیچه که بر اثر انقباض کاهش یافته بود، افزایش مییابد. به این ترتیب انقباض ماهیچه به پایان میرسد و برای شروع انقباضی دیگر باید تمام این مراحل از اول تکرار شوند.
اهمیت انقباض سارکومرها در فعالیتهای مختلف بدن
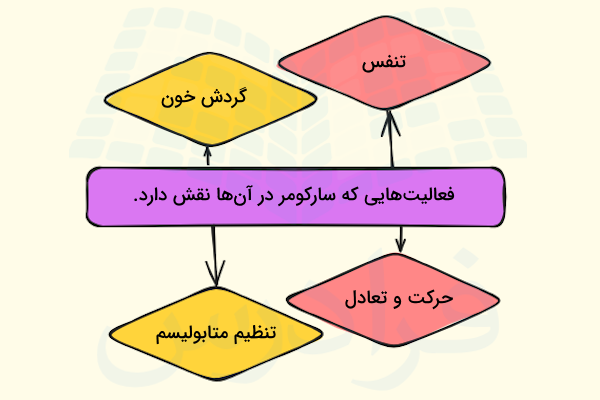
انقباض سارکومرها نقشی فراتر از حرکت ماهیچهها دارد، در حقیقت بسیاری از فعالیتهای فیزیولوژیک بدن که حیات ما به آنها وابسته است، به انقباض سارکومرها وابسته هستند؛ در ادامه تعدادی از آنها را نام میبریم و نقش سارکومرها را در هر یک توضیح میدهیم.
- گردش خون: انقباض سارکومرهای موجود در سلولهای ماهیچه قلبی باعث ایجاد ضربان قلب میشود و ضربان قلب نیز باعث پمپاژ خون و گردش خون در بدن میشود، از طرفی ما به گردش خون برای انتقال اکسیژن و مواد مغذی وابسته هستیم، بنابراین انقباض سارکومرها به سلولهای مختلف بدن کمک میکند تا به مواد موردنیاز خود برای ادامه زندگی دست یابند.
- تنفس: انقباض دیافراگم دلیل اصلی دم و بازدم است، بنابراین انقباض سارکومرهای ماهیچه دیافراگم در فرآیند تنفس نقشی کلیدی دارد.
- حرکت و تعادل: انقباض ماهیچههای اسکلتی به بدن امکان حرکت و حفظ حالت خود را میدهد.
- تنظیم متابولیسم: انقباض ماهیچهها در حفظ دمای بدن و سرعت متابولیسم نیز اثرگذار است.
جمعبندی
در این مطلب از مجله فرادرس یاد گرفتیم که سارکومر چیست و چرا ماهیچههای مخطط مانند ماهیچههای اسکلتی و ماهیچههای قلبی برای انقباضات خود به انقباض سارکومرها وابسته هستند. در حقیقت سارکومرها واحد انقباضی یا عملکردی ماهیچههای مخططی هستند و این قابلیت را به واسطه مولکولهای ساختاری خود به دست آوردهاند. در ساختار سارکومرها دو رشته میبینیم که پروتئینهای مختلفی در تشکیل هر رشته یا فیلامنت همکاری داشتهاند.
- فیلامنتها یا رشتههای نازک: فیلامنتهای نازک توسط پروتئینهای اکتین ساخته میشوند.
- فیلامنتها یا رشتههای ضخیم: در ساختار فیلامنتهای ضخیم شاهد حضور سه پروتئین میوزین، تروپونین و تروپومیوزین هستیم.
برای توضیح شیوه انقباض ماهیچهها از تئوری لغزش فیلامنتها استفاده میشود که با استفاده از چرخهای چهار مرحلهای شیوه حرکت سر مولکول میوزین روی رشته اکتین و نزدیک شدن رشتههای اکتین به مرکز سارکومر را توضیح میدهد. مرحله پنجم این تئوری نیز به ما نشان میدهد که با پایان انقباض ماهیچه چطور سارکومرها به طول طبیعی خود برمیگردند.
source
