آمونیاک یک گاز بیرنگ با فرمول شیمیایی است. این ماده شیمیایی که بویی خاص دارد، از سه اتم هیدروژن و یک اتم نیتروژن تشکیل شده است و یکی از پرکاربردترین و پرمصرفترین مواد موجود در زمین است. این ماده به روشهای طبیعی و صنعتی مانند چرخه هابر – بوش تولید میشود و در محصولاتی مانند کودها و موادشوینده استفاده میشود. در این مطلب از مجله فرادرس میآموزیم آمونیاک چیست، در چه واکنشهایی شرکت میکند و کاربردهای آن کدامند.

در ابتدای این مطلب میآموزیم آمونیاک چیست، سپس با ساختار و خواص فیزیکی و شیمیایی آن آشنا میشویم. در ادامه، حالتهای آمونیاک را بررسی کرده و فرآیندهای تولید آمونیاک را به شکلی کامل میآموزیم. سپس، واکنشهای مهم آمونیاک را نام برده و میآموزیم روشهای تشخیص و اندازهگیری آمونیاک چیست. در ادامه مطلب، کاربردهای آمونیاک را در صنایع مختلف توضیح داده و خطرات و نکات ایمنی کار با آمونیاک را ذکر میکنیم. در نهایت نیز مختصری از تاریخچه کشف آمونیاک را توضیح میدهیم. با مطالعه این مطلب تا انتها میتوانید با این ماده مهم و ویژگیهای آن به شکلی کامل آشنا شوید.
آمونیاک چیست؟
آمونیاک (Ammonia) گازی بیرنگ و با بوی تند و زننده است. این گاز از سه اتم هیدروژن و یک اتم نیتروژن تشکیل شده است. آمونیاک غلیظ مادهای خطرناک و خورنده است. آمونیاک ترکیبی معدنی است که با آب مخلوط شده و ترکیب آمونیوم هیدروکسید تولید میکند.
آمونیاک از هوا سبکتر است. از این ماده به شکل گستردهای در تولید کودها استفاده میشود. همچنین، از آمونیاک در تولید موادی مانند نیتروسلولز و ماده منفجره TNT استفاده میشود. آمونیاک با نامهای هیدروژن نیترید، آمیدوژن، هیدروژن آمین و نیتروژن هیدرید نیز شناخته میشود. در تصویر زیر، مشاهده میکنید شکل مولکول آمونیاک چیست.

ساختار آمونیاک
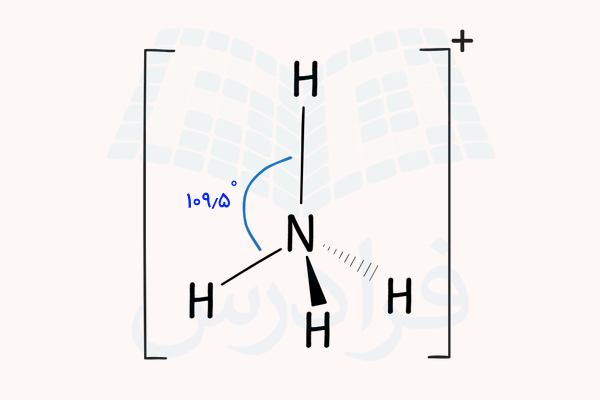
برای اینکه بدانیم ساختار شیمیایی آمونیاک چیست، باید به شکل مولکول آن توجه کنیم. آمونیاک ساختار هرمی مثلثی دارد. زاویه بین پیوندهای این ساختار ۱۰۶٫۷ درجه است که از زاویه نرمال بین پیوندهای یک ماده با هرم مثلثی (۱۰۹٫۵ درجه) کمتر است. اتم نیتروژن مرکزی پنج الکترون در لایه ظرفیت خود دارد که سه الکترون از آنها با سه هیدروژن پیوند داده و یک جفت الکترون به صورت غیر پیوندی روی نیتروژن باقی می ماند.
اثر دافعه جفت الکترون غیر پیوندی بیشتر از دافعه الکترونهای پیوندی است. به همین علت، این الکترونها به پیوندهای نیتروژن – هیدروژن فشار آورده و آنها را از خود دور میکنند. این پدیده باعث کمتر شدن زاویه بین پیوندهای آمونیاک از پیوندهای یک هرم مثلثی عادی میشود.

ساختار سه بعدی آمونیاک و الکترونگاتیوی نیتروژن به مولکول آمونیاک یک ممان دوقطبی میدهد و مولکول را در حالت کلی قطبی میکند. این پدیده باعث میشود آمونیاک به خوبی در آب حل شود. جفت الکترون ناپیوندی به آمونیاک خاصیت بازی میدهد و باعث میشود pH آن برابر با ۱۱٫۶ باشد.
آمونیاک با دریافت یک یون هیدروژن میتواند یون آمونیوم با فرمول شیمیایی بسازد. این یون، ساختار هرم مثلثی عادی دارد. ساختار این یون به شکل زیر است.
یادگیری علوم نهم با فرادرس
در قسمت قبل آموختیم آمونیاک چیست. برای شناخت بهتر آمونیاک و ویژگیهای آن نیاز است تا با مفاهیمی مانند طبقهبندی مواد، تعریف عنصر و جدول تناوبی و انواع چرخهها در محیط زیست آشنا شویم. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه نهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی متوسطه دسترسی داشته باشید.
خواص فیزیکی و شیمیایی آمونیاک
در قسمت قبل آموختیم آمونیاک چیست. این ماده یکی از پرمصرفترین مواد موجود است که در ترکیبات بسیار زیادی یافت میشود و به روشهای متفاوتی در مقیاسهای زیاد تولید میشود.
در ادامه خواص فیزیکی و شیمیایی آمونیاک را بررسی میکنیم.

خواص فیزیکی
در ادامه میآموزیم خواص فیزیکی آمونیاک چیست.
- چگالی آمونیاک برابر با ۰٫۷۶۹ کیلوگرم بر مترمکعب است.
- این گاز بیرنگ است.
- آمونیاک بوی تندی دارد.
- نقطه جوش این گاز ۳۳٫۳۴- درجه سانتیگراد و نقطه ذوب آن ۷۷٫۷۳- درجه سانتیگراد است.
- گرمای نهان تبخیر این ماده ۲۳٫۳ کیلوژول بر مول است.
- انحلال پذیری این ماده در آب برابر با ۳۲۰ گرم در لیتر در دمای اتاق است.
- این ماده در حلالهای آلی و معدنی مانند کلروفرم، اتر، اتانول و متانول حل میشود.
- بوی آمونیاک شبیه به بوی ادرار است.
خواص شیمیایی
در ادامه میآموزیم خواص شیمیایی آمونیاک چیست.
- فرمول شیمیایی آمونیاک است.
- این ماده سادهترین هیدرید موجود در گروه نیتروژن جدول تناوبی است.
- جرم مولی این ماده برابر با ۱۷٫۰۳۱ گرم بر مول است.
- آمونیاک یک باز ضعیف است که با بسیاری از اسیدها و نمکها واکنش میدهد.
- آمونیاک خواص آمفوتری دارد و میتواند در آب دچار خود یونش شود.
- آمونیاک ترکیبی کووالانسی است و پیوندهای آن از نوع پیوند کووالانسی هستند.
- ساختار هندسی آمونیاک هرم مثلثی است و روی اتم نیتروژن آن جفت الکترون غیر پیوندی وجود دارد.
- آمونیاک از همپوشانی اوربیتالهای هیبریدی توسط اتمهای هیدروژن و نیتروژن تشکیل میشود.
- زاویه بین پیوندهای آمونیاک برابر با ۱۰۷٫۳ درجه است.
- آمونیاک یک ماده قطبی است.
- آمونیاک در جالت جامد و مایع، دارای پیوند هیدروژنی است.
- گاز آمونیاک به تنهایی آتشگیر نیست اما اگر با مقادیری از هوا ترکیب شده و جرقهای ایجاد شود، میتواند انفجار ایجاد کند.
حالت های آمونیاک
در قسمت قبل آموختیم خواص فیزیکی و شیمیایی آمونیاک چیست. آمونیاک در دمای اتاق به فرم گاز وجود دارد اما این ماده دو فرم دیگر جامد و مایع را نیز میتواند داشته باشد. همچنین، فرم محلول آمونیاک نیز یکی از رایج ترین فرمهای این ماده است. در ادامه توضیح میدهیم ویژگیهای هر فرم آمونیاک چیست.
آمونیاک جامد
فرم جامد آمونیاک در دماهای پایینتر از ۷۷٫۷۳ درجه سانتیگراد و با ساختار بلوری مکعبی وجود دارد.

آمونیاک مایع
فرم مایع آمونیاک قدرت یونش بالایی دارد. ای ماده در دماهایی پایینتر از ۳۳۴ درجه سانتیگراد به شکل مایع وجود دارد. آمونیاک مایع آنتالپی تبخیر بسیار بالایی دارد و به همین علت میتوان آن را به پیستونهای یخچالی انتقال داد و حمل کرد. البته فرم مایع آمونیاک در دمای اتاق پایدار نیست و تبخیر میشود. فرم مایع آمونیاک معمولا به عنوان حلال یونیزه کننده غیر آبی استفاده میشود.

آمونیاک مایع، قابلیت تولید محلولهای رنگی و رسانایی الکتریسیته به وسیله انحلال ترکیبات بازی را دارد. آمونیاک مایع گستره وسیعی از ترکیبات یونی مانند نیتراتها، نیتریتها، سیانیدها، تیووسیاناتها و کمپلکسهای فلزی را در خود حل میکند.
آمونیاک محلول
آمونیاک به خوبی در آب حل میشود. در یک محلول آبی، آمونیاک میتواند به وسیله تبخیر جداسازی شود. فرم محلول آمونیاک خاصیت بازی دارد و pH آن بین ۱۰ تا ۱۱ است. به محلول آبی آمونیاک، آمونیاک آبدار یا آمونیوم هیدروکسید نیز گفته میشود. بیشترین غلظت آمونیاک حل شده در آب (محلول اشباع آمونیاک) دارای چگالی نسبی ۰٫۸۸۰ است و معمولا با نام آمونیاک ۸۸۰ شناخته میشود.
روش های تولید آمونیاک
آمونیاک از منابع متعدد طبیعی و مصنوعی تولید میشود. منابع طبیعی مواردی مانند تجزیه مواد آلی و تنفس آبزیان هستنند و منابع مصنوعی فرآیندهایی صنعتی مانند فرآیند هابر برای تولید آمونیاک هستند. در ادامه میآموزیم منابع طبیعی و مصنوعی آمونیاک چیست.
منابع طبیعی
آمونیاک به شکلی طبیعی در بدن و محیط اطراف ما وجود دارد. مقادیر بسیار کمی از آمونیاک در باران حضور دارد. ترکیبات آمونیاک مانند آمونیوم کلرید و آمونیوم سولفات در مناطق آتشفشانی یافت شدهاند. آمونیاک در اجرام آسمانی و منظومه شمسی در سیارههای مریخ، مشتری، زحل، اورانوس، نپتون و پلوتون وجود دارد. به ترکیباتی که دارای آمونیاک هستند یا ساختاری شبیه به آن دارند، آمونیاکال (Ammoniacal) گفته میشود.
پیش از جنگ جهانی اول، بیشتر آمونیاک از تقطیر خشک پسماندهای گیاهی و حیوانی نیتروژنی مانند سرگین شتر به دست میآمد. علاوه بر این، از تقطیر زغالسنگ و واکنش نمکهای آمونیوم با بازهای قوی مانند آهک زنده نیز تولید میشد.
در مقیاس آزمایشگاهی، حرارت دادن اوره با کلسیم هیدروکسید یا سدیم هیدروکسید نیز روش رایجی برای تولید آمونیاک است. واکنش شیمیایی این فرآیند به شکل زیر است.
در ساختار بدن
در برخی موجودات، آمونیاک از نیتروژن جو توسط آنزیمهایی به نام نیتروژنازها تولید میشود. این فرآیند کلی به نام تثبیت نیتروژن شناخته میشود. در ادامه توضیح میدهیم نقش آمونیاک در بدن چیست.
آمونیاک برای حیات ضروری است و برای تشکیل اسیدهای آمینه و اسیدهای نوکلئیک که بلوکهای سازنده حیات هستند، مورد نیاز است. اما آمونیاک به خودی خود سمی است و بنابراین طبیعت از حاملهایی برای حمل آمونیاک استفاده میکند. در سلول، گلوتامات این نقش را ایفا میکند و در خون، گلوتامین منبع آمونیاک است.
در انسانها، آمونیاک به سرعت به اوره تبدیل میشود (توسط کبد)، که به طور قابل توجهی کمتر سمی است و به ویژه خاصیت قلیایی کمتری دارد. اوره یک جزء اصلی از وزن خشک ادرار است. بیشتر خزندگان، پرندگان، حشرات و حلزونها فقط اسید اوریک را به عنوان ضایعات نیتروژنی دفع میکنند.
در گیاهان
برخی گیاهان به آمونیاک و دیگر ضایعات نیتروژنی موجود در خاک از طریق مواد فاسد شده وابستهاند، در حالی که گیاهان تثبیتکننده نیتروژن مانند حبوبات از روابط همزیستی با باکتریهای ریزوبیوم برای تولید آمونیاک از نیتروژن جو بهرهمند میشوند.
در جانوران
یونهای آمونیوم یک محصول زائد سمی از متابولیسم در حیوانات هستند. در ماهیها و بیمهرگان آبی، این یونها مستقیما به آب دفع میشوند. در پستانداران، کوسهها و دوزیستان، یونهای آمونیوم در چرخه اوره به اوره تبدیل میشوند که کمتر سمی است و میتوان آن را به طور موثرتری ذخیره کرد. در پرندگان، خزندگان و حلزونهای زمینی، آمونیوم متابولیک به اسید اوریک تبدیل میشود که جامد است و بنابراین میتوان آن را با حداقل از دست دادن آب دفع کرد.
در فضا
آمونیاک در جو سیارات غولپیکر مانند مشتری و زحل و همچنین در فضای بینستارهای شناسایی شده است. این مولکول که نخستین ترکیب چنداتمی کشفشده در فضا بود، در مطالعات ابرهای مولکولی نقش مهمی دارد. گونههای ایزوتوپی مختلف آن نیز در شرایط دمای پایین شناسایی شدهاند. آمونیاک بهعنوان یک ابزار طیفسنجی ارزشمند، برای مطالعه محیط بینستارهای و اندازهگیری دمای آن مورد استفاده قرار میگیرد.
منابع مصنوعی
آمونیاک علاوه بر روش های طبیعی، در آزمایشگاه و صنعت نیز به روش های مصنوعی و با انجام وانشهای شیمیایی تولید میشود. از مهم ترین روش های تولید آمونیاک، روش هابر است. در ادامه توضیح میدهیم روشهای مصنوعی تولید آمونیاک چیست.
اوره
برای تولید آمونیاک در مقیاس آزمایشگاهی، میتوان اوره را با کلسیم هیدروکسید یا سدیم هیدروکسید حرارت داد. معادله این واکنش به شکل زیر است.
چرخه بوش – هابر
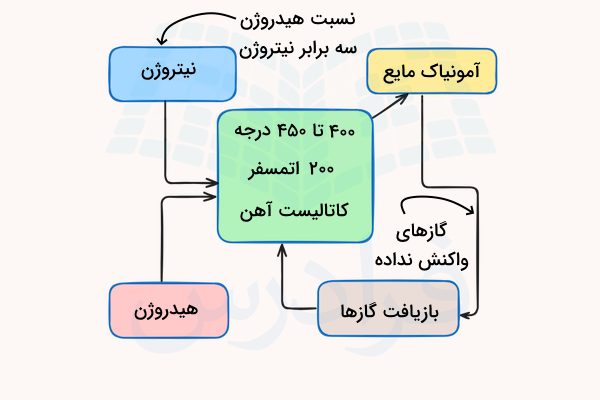
فرآیند هابر، که به آن فرآیند هابر- بوش نیز گفته میشود، روش اصلی صنعتی برای تولید آمونیاک است. این فرآیند از نیتروژن جو () و هیدروژن () برای تولید آمونیاک () استفاده میکند و از فلز آهن به صورت پودر ریز به عنوان کاتالیزگر استفاده میکند. این روش، نیتروژن هوا را با هیدروژن به دست آمده از متان ترکیب میکند. واکنش انجام شده در این فرآیند، برگشتپذیر و گرماده است.
در تصویر زیر مشاهده می کنید روند انجام فرآیند هابر برای تولید آمونیاک چیست.
این واکنش از نظر ترمودینامیکی در دمای اتاق مطلوب است، اما سینتیک واکنش به اندازهای کند است که انجام آن غیرعملی میباشد. در دماهای بالا که کاتالیزورها به اندازه کافی فعال هستند و واکنش به تعادل میرسد، واکنش به سمت واکنشدهندهها (و نه فرآوردهها) پیش میرود. به همین دلیل، اعمال فشار بالا برای انجام واکنش نیاز است.
در حالت کلی، فرآیند هابر برای تولید آمونیاک باید شرایط زیر را داشته باشد.
- دمای واکنش: دمای مناسب برای بیشترین بازدهی واکنش، بین ۴۰۰ تا ۴۵۰ درجه سانتیگراد است. این واکنش گرماده است و برای بازدهی بیشتر آن باید شرایط برگشت واکنش وجود داشته باشد. طبق اصل لوشاتلیه دما باید تا حد ممکن پایین درنظر گرفته شود.
- کاتالیست: این واکنش باید در بسیتر کاتالیزور آهن انجام بگیرد. این واکنش از نظر سینتکی در حالت عادی به شکلی بسیار آهسته انجام میشود و وجود کاتالیزور آهن برای افزایش سرعت آن نیاز است.
- فشار: فشار مناسب برای این واکنش ۲۰۰ اتمسفر است. در واکنش فرآیند هابر ۴ مولکول گازی در سمت واکنشدهندهها و دو مولکول گازی فرآورده داریم. طبق اصل لوشاتلیه، فشار نباید خیلی زیاد شود اما باید بالاترین مقدار ممکن را داشته باشد تا واکنش بازده مناسبی داشته باشد.

فریتز هابر (Fritz Haber) و کارل بوش (Carl Bosch)، دو شیمیدان آلمانی، این فرآیند را در دهه اول قرن بیستم توسعه دادند. کارآیی بالاتر این روش نسبت به فرآیندهای پیش از آن، یک پیشرفت بزرگ در تولید صنعتی آمونیاک بود. فرآیند هابر میتواند با بخار ترکیب شود تا آمونیاک را تنها با سه ماده اولیه شیمیایی آب، گاز طبیعی و نیتروژن جو تبدیل کند. هر دو شیمیدان بهخاطر این دستاوردها جایزه نوبل شیمی را دریافت کردند.
روش الکتروشیمیایی
سنتز الکتروشیمیایی آمونیاک شامل تشکیل نیترید لیتیم از طریق کاهش است که در صورت وجود منبع یون هیدروژن، میتواند به آمونیاک تبدیل شود.
این روش طی فرآیند استفاده از محلولهای لیتیم در اتانول برای تولید آمونیاک و اتانول به عنوان منبع یون هیدروژن کشف شد. مشخص شد که در این روش، اتانول نقشهای دیگری مانند تاثیرگذاری بر تغییرات الکترولیتها و کمک به تشکیل لایهای بین الکترولیت جامد و بهبود کارایی واکنش نیز دارد.
در سال ۱۹۹۴، از رسوب الکترود لیتیوم در تتراهیدروفوران برای تولید آمونیاک در فشارهای معتدل استفاده شد. در سال ۲۰۲۰، یک الکترود بینیاز از حلال برای بهبود انتقال نیتروژن به لیتیوم ساخته شد که کارایی خوبی داشت. در ۲۰۲۱، اتانول با نمک فسفونیوم جایگزین شد و تولید آمونیاک با کارایی ٪۶۹ در فشارهای مختلف انجام شد. در ۲۰۲۲، آمونیاک با استفاده از گاز هیدروژن به عنوان منبع یون هیدروژن در یک الکترولایزر جریان پیوسته با کارایی ٪۶۱ تولید شد.
واکنشهای آمونیاک
در قسمت قبل آموختیم منابع مختلف گاز آمونیک چیست. آمونیاک یکی از پرکاربردترین گازهای موجود در زمین است. این گاز در بسیاری از واکنش های شیمیایی مهم شرکت میکند. در ادامه برخی از واکنشهای گاز آمونیاک را بررسی میکنیم.
تولید آمونیوم هیدروکسید
گاز آمونیاک در صورت انحلال در آب، آمونیوم هیدروکسید تولید میکند. واکنش تعادلی این انحلال به شکل زیر است.
تولید آمونیوم کلرید
گاز آمونیاک با اسید هیدروکلریک واکنش داده و آمونیوم کلرید تولید میکند. معادله این واکنش به شکل زیر است.
تولید نمک آمونیوم
از واکنش گاز آمونیاک با انواع اسیدها، ترکیبات یونی شامل یون آمونیوم به وجود میآید. به این ترکیبات مهم، نمک آمونیوم گفته میشود. معادله واکنش این واکنشها در فرم کلی به صورت زیر نوشته میشود.
تولید آمیدها
با وجود اینکه آمونیاک یک ترکیب بازی است، در برخی از موارد میتواند به عنوان اسیدی بسیار ضعیف عمل کند. این ماده میتواند در این واکنشها، یون آمید تولید کند. برای مثال، لیتیوم در آمونیاک مایع حل شده و محلول آبی رنگ شامل الکترونهای حل شده در محلول لیتیوم آمید را تولید کند. این واکنش به کل زیر نوشته میشود.
خودیونش آمونیاک
آمونیاک مانند آب میتواند در فرآیندی خود را یونیزه کند. در این واکنش یک اسید و باز مزدوج تولید میشود. معادله این واکنش به شکل زیر است.
آمونیاک معمولا به عنوان باز ضعیف عمل میکند. به همین دلیل، میتواند خاصیت بافری داشته باشد. تغییر در pH باعث تولید مقدار کمتر یا بیشتر یونهای آمونیوم و آمید در محلول میشود. در دما و فشار استاندارد، ثابت تفکیک واکنش بالا به شکل زیر است.
بافرها محلول های بسیار کارآمد در تنظیم pH واکنشها هستند. میزان اسیدیته این مواد به راحتی در ترکیب با مواد دیگر تغییر نمیکند. پیشنهاد میکنیم برای یادگیری بیشتر درمورد این محلولها، مطلب «محلول بافر چیست» مجله فرادرس را مطالعه کنید.
سوختن آمونیاک
آمونیاک در شرایط عادی آتش نمیگیرد. تنها اگر مقدار ۱۵ تا ۲۸ درصد آمونياک در هوا مخلوط شده و جرقهای ایجاد شود، واکنش سوختن انجام میشود. شعله سوختن آمونیاک با هوا رنگی زرد – سبز دارد. احتراق زمانی اتفاق میافتد که کلر از آمونیاک عبور داده شده و نیتروژن و هیدروژن کلرید تولید کند. اگر کلر موجود در مقادیر اضافی وجود داشته باشد، ماده منفجر شونده نیتروژن تری کلرید () تولید میشود.
واکنش سوختن آمونیاک با اکسیژن به شکل زیر است و فرآیندی بسیار گرماده است.
فرآیند سوختن آمونیاک بدون وجود یک کاتالیست مانند پلاتین یا اسید کروم (III) فرآیندی مشکل است.

تولید مواد آلی نیتروژن دار
آمونیاک میتواند به شکلی مستقیم یا غیر مستقیم به عنوان پیش ماده تولید موادی آلی نیتروژن دار باشد. آمونیاک به عنوان پیش ماده تولید نیتریک اسید استفاده میشود که منبعی برای تولید ترکیبات آروماتیک با جایگزینی نیتروژن است.
تولید آمین ها
آمینها از واکنش آمونیاک با آلکیلهالیدها یا الکلها به دست میآیند. برای مثال، واکنش زیر یکی از این موارد است.
آمونیاک طی واکنش باز کردن حلقهای میتواند مواد اتانول دی آمین، دی اتانول آمین و تری اتانول آمین تولید کند.
تولید آمید ها
از واکنش آمونیاک با کربوکسیلید اسیدها، آمید تشکیل میشود. برای مثال، واکنش آمونیاک و فرمیک اسید، در حضور گرما، فرمامید تولید میکند.
از واکنش آمونیاک با استرها و انیدریدها نیز آمید تشکیل می دهد. فرم کلی واکنش این فرآیندها به شکل زیر است.
سایر ترکیبات آلی نیتروژن دار تولید شده از آمونیاک مواردی مانند آلپروزولام، اتانول آمین، اتیل کربامات و هگزامتیلن تترا آمین هستند.
تولید مواد معدنی نیتروژن دار
مواد معدنی بسیاری از واکنش آمونیاک با برخی از مواد به وجود میآید. از مهمترین این مواد میتوان به نیتریک اسید اشاره کرد.
تولید اسید نیتریک
اسید نیتریک از طریق فرآیند اوستوالد با اکسیداسیون آمونیاک با هوا روی کاتالیست پلاتین و در دمای ۷۰۰ تا ۸۵۰ درجه سانتیگراد و فشار ۹ اتمسفر تولید میشود. تولید نیتریک اکسید و نیتروژن دی اکسید در این واکنش به عنوان مواد واسطه اتفاق میافتد. فرآیند کلی این واکنش به شکل زیر است.
نیتریک اسید برای تولید کودها، مواد محترقه و بساری از مواد آلی نیتروژن دار استفاده میشود. هیدروژن موجود در آمونیاک میتواند با هزاران اتم جایگزین شود و مواد جدیدی را تولید کند. گاز آمونیاک با سدیم فلزی وارد واکنش شده و سدیم آمید با فرمول شیمیایی () تولید کند.
از واکنش آمونیاک با کلر، مونوکلر آمین تولید میشود. از آمونیاک در تولید بسیاری از مواد دیگر نیز استفاده میشود که در ادامه برخی از آنها نام برده شده اند.
- تولید هیدرازین با استفاده از فرآیند اولین راشیگ و فرآیند پراکسید
- تولید هیدروژن سیانید با استفاده از فرآیند BMA و فرآیند اندرو
- تولید هیدروکسیل آمین و آمونیوم کربنات با استفاده از فرآیند راشینگ
- تولید اوره با استفاده از فرآیند اوره بوش – میزر و سینتز وولر
- تولید آمونیوم پرکلرات، آمونیوم نیترات و آمونیوم بیکربنات
تولید کمپلکسهای فلزی
آمونیاک میتواند به عنوان یک لیگاند برای تولید کمپلکسهای فلزی عمل کند. به دلیل ویژگی ترکیبی این ترکیبات، به کمپلکسهایی که دارای آمونیاک هستند، ترکیبات کوئوردیناسی آمین یا کمپلکس آمین فلزی (Metal Ammine Complexes) گفته میشود.
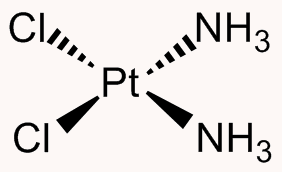
یکی از مهمترین کمپلکسهای دارای آمین، کمپلکس سیس پلاتین است که در داروهای ضد سرطان از آن استفاده میشود. همچنین، کمپلکسهای کروم (III) تولید شده با آمونیاک، زمینه اثبات نظریه ساختار کمپلکسهای کئوردینانسی توسط آلفرد ورنر را پدید آورد.
تشخیص و اندازهگیری آمونیاک
آمونیاک میتواند در ترکیبات و محلولهای بسیاری وجود داشته باشد. برای تشخیص حضور آمونیاک در ترکیبات مختلف و محلولها، روشهای متفاوتی وجود دارد. در ادامه میآموزیم روشهای تشخیص آمونیاک در محلولها و ترکیبات گازی چیست.
آمونیاک در محلول ها
آمونیاک و نمکهای آمونیوم میتوانند حتی در مقادیر بسیار کم نیز شناسایی شوند. برای این کار، به محلولها، محلول نسلر اضافه میشود. این محلول حتی در حضور مقادیر بسیار کم آمونیاک، رنگ زردی به محلول میدهد. مقدار کمی آمونیاک موجود در نمکهای آمونیوم در محلول را میتوان با تقطیر نمکها با سدیم هیدروکسید یا پتاسیم هیدروکسید انجام داد.

در این روش، آمونیاک آزاد شده توسط حجم مشخصی از اسید سولفوریک جذب شده و مقدار اضافی اسید حجم سنجی میشود. همچنین میتوان از جذب آمونیاک توسط اسید کلریدریک استفاده کرد. در این روش، آمونیوم کلرید تولید شده به شکل آمونیوم هزاکلروپلاتین رسوبدهی میشود.
آمونیاک گازی
میلههای گوگردی برای تشخیص وجود نشت آمونیاک گازی در تجهیزات سرمادهی استفاده میشوند. مقادیر بالاتر آمونیاک میتواند با گرم کردن نمکها با سود سوزآور یا کلسیم اکسید شناسایی شود. در تجهیزات آزمایشگاهی، گاز آمونیاک را میتوان با اسید کلریدریک غلیظ یا گاز هیدروژن کلرید شناسایی کرد. در صورت حضور آمونیاک در محیط، ذرات معلق جامد آمونیوم کلرید به وجود میآید.
کاربرد آمونیاک
تا اینجا آموختیم آمونیاک چیست و در چه واکنشهایی حضور دارد. آمونیاک یکی از پرکاربردترین مواد شیمیایی موجود است. آمونیاک سهم عظیمی در تولید مواد غذایی مورد نیاز انسانها و گیاهان را دارد. حدود ۴۵ درصد غذا و کود زمین با کمک آمونیاک تولید میشود.
از نظر زیستی، آمونیاک توسط مواد آبزی به عنوان یک پسماند نیتروژنی تولید میشود. کودهای موجود و با ساختار نیتروژنی مانند اوره و دی آمونیوم فسفات با استفاده از حدود ۷۰ درصد آمونیاک تولید شده در جهان تولید میشوند.

در ادامه میآموزیم کاربردهای گاز آمونیاک چیست.
محلول آمونیاک خانگی
محلول آمونیاک به محلول رقیق شده آمونیاک با آب گفته میشود. این محلولها حاوی ماده آمونیوم هیدروکسید هستند که طی فرآیند انحلال آمونیاک در آب تولید میشود. محلولهای آمونیاک برای پاک کردن بسیاری از سطوح مورد استفاده قرار می گیرند.
محلول آمونیاک خانگی غلظتهای بین ۵ تا ۱۰ درصد وزنی آمونیاک دارند. به دلیل اینکه محلول آمونیاک از فرآیند انحلال گاز آمونیاک در آب به دست میآید، میتواند با تبخیر شدن آب و آمونیوم هیدروکسید از سطح، آلودگیها را پاک کند.
آمونیاک در صنعت
آمونیاک به شکل بسیار گستردهای در بسیاری از صنایع استفاده میشود. از آمونیاک به عنوان پایدار کننده، خنثی کننده یا منبع تولید نیتروژن در فرآیندها و واکنشهای مختلف استفاده میشود. آمونیاک، پس از سولفوریک اسید، فراوانترین ماده شیمیایی از لحاظ میزان تولید است.
در ادامه توضیح می دهیم کاربرد گاز آمونیاک در صنعت چیست. از آمونیاک در صنایع زیر استفاده میشود.
- تصفیه فاضلاب
- چرم
- کائوچو و پلاستیک
- کاغذ
- مواد غذایی
- صنایع نوشیدنی
- سیستمهای سرمایشی و خنککننده
- چاپ
- آرایش و بهداشتی
- تخمیر
آمونیاک در کشاورزی
رایجترین استفاده از آمونیاک در صنایع کشاورزی است. حدود ۹۰ درصد آمونیاک تولید شده در این صنعت استفاده میشود. از آنجا که آمونیاک یک منبع غنی از نیتروژن و سایر اتمها است، برای بهینه کردن سیستمهای تولیدات کشاورزی از آن در کودهای مختلف استفاده میشود.

همچنین، از آمونیاک در تولید کودهای مایعی که شامل موادی مانند آمونیوم نیترات، نمکها، اوره و باقی مواد هستند استفاده میشود. یک کاربرد دیگر آمونیاک در صنایع کشاورزی، استفاده از آن به عنوان ضد قارچ برای برخی از محصولات کشاورزی است.
آمونیاک در شویندههای خانگی
آمونیاک یکی از اصلیترین مواد تشکیل دهنده شویندههای خانگی است. از این ماده به عنوان عامل پاک کننده در این مواد استفاده میشود و برای پاک کردن لکهها یا شیشهها از آن استفاده میشود. همچنین، شویندههای دارای آمونیاک برای پاک کردن سطوح سرامیکی، سینکها و .. استفاده میشوند.
از آمونیاک به عنوان عامل آنتی باکتریال و ضد عفونی کننده نیز استفاده میشود.
فرآیندهای سرمایش
به دلیل خواص بخار شدن آمونیاک در دماهای بسیار پایین، از این گاز در فرآیندهای سرمادهی استفاده میشود. آمونیاک خشک به شکلی گسترده در تجهیزات سرمایشی زمینهای هاکی استفاده میشود. این استفاده به دلیل قیمت پایین آمونیاک و بازده انرژی بالای آن انجام میگیرد.
آمونیاک در ترکیب با هیدروژن و آب در سیستمهای سرمایشی جذبی استفاده میشود. همچنین از این برای سرمایش در رادیاتورهای استفاده شده در ایستگاه فضایی بین المللی و برای تنظیم دمای داخلی و انجام آزمایشات وابسته به دما استفاده میشود. توانایی آمونیاک در فرآیندهای سرمایشی پس از اثبات آسیبزا بودن مواد سرد کننده مانند CFC و HFCها بسیار مورد توجه قرار گرفته است.
نگهداری و ضد عفونی مواد غذایی
در بررسیهای انجام شده مشخص شده است که آمونیاک خشک تا ۹۹٫۹۹٪ میتواند باکتری زئونوز را در سه نوع فرآورده حیوانی از بین ببرد. همچنین از آمونیاک خشک در کاهش آلودگی میکروبی گوشت نیز استفاده میشود. با وجود اثر گذاری آمونیاک روی طعم و بوی گوشت، این گاز به خوبی میتواند باکتری اشرشیا کولی را در گوشت از بین ببرد.
آمونیاک به عنوان سوخت
از زمان های قدیم، از گاز آمونیاک به عنوان سوختی جایگزین برای سوختهای فسیلی و هیدروژن استفاده میشود. همچنین، به دلیل مایع بودن آمونیاک زیر فشار بخار خود و داشتن انرژی چگالی گرانشی و حجمی بالای آن، به عنوان حمل کنندهای مناسب برای گاز هیدروژن استفاده میشود. استفاده از آمونیاک برای انتقال هیدروژن بسیار ارزانتر از انتقال مستقیم هیدروژن برای فرآيندهای مختلف است.

آمونیاک در مقایسه با هیدروژن به عنوان سوخت، راحتتر نگهداری میشود، بازده انرژی بالاتری دارد و میتواند با هزینه بسیار کمتری تولید، نگهداری و حمل شود. چگالی انرژی آمونیاک برابر با ۱۱٫۵ مگاژول بر لیتر است. آمونیاک میتواند دوباره به هیدروژن تبدیل شود و به عنوان سوخت سلولهای سوختی هیدروژنی مورد استفاده قرار گیرد. همچنین میتوان از آن به شکلی مستقیم برای تولید انرژی استفاده کرد.
آمونیاک در رنگ مو
آمونیاک یکی از اجزای بسیاری از رنگ موهای دائمی موجود در بازار است. آمونیاک به دلیل خواص قلیایی، می تواند میزان pH مو را بالا برده و به باز شدن کوتیکولهای مو (لایه بیرونی مو) کمک کند. این فرآیند باعث ورود رنگ به سطوح عمقی مو (کورتکس) شده و مو راحتتر رنگ میگیرد.
رنگهای دارای آمونیاک باعث آسیب تدریجی به کورتکس مو طی استفاده پی در پی میشوند و ساقه مو را خشک و شکننده میکنند. همچنین، به دلیل خورنده بودن آمونیوم هیدروکسیدی که از ترکیب آمونیاک با آب تشکیل میشود، این رنگ موها برای پوست سر و گردن آسیبزا هستند. به علاوه، بخارات آمونیاک برای افرادی که مدام در معرض آن هستند خطرناک است.
تولید مواد شیمیایی
از آمونیاک برای تولید بسیاری از مواد شیمیایی از جمله نیتریک اسید، هیدروژن سیانید، آمونیوم کربنات، فنول، اوره، آمینو اسیدها و بسیاری از مواد دیگر استفاده میشود.
حفاری نفت و معادن
از آمونیاک در متعادلسازی اسیدیته نفت خام استفاده میشود. همچنین، آمونیاک تجهیزات مورد استفاده در این صنعت را در برابر خوردگی محافظت میکند. از آمونیاک در صنایع معدنی برای استخراج بسیاری از فلزات استفاده میشود.
آمونیاک یکی از مهمترین مواد در فرآیندهای پتروشیمی و توسعه آنها است. پیشنهاد میکنیم برای آشنایی بیشتر با این فرآیندها، فیلم آموزش فرآیندهای پتروشیمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
فرآیندهای پرداخت فلزات
در فرآیندهایی که روی فلزات انجام میشود، از آمونیاک تفکیک شده در فرآیندهایی مانند کربونیتریده کردن، نیتریده کردن، لحیم کاری سخت کورهای، بازپخت مواد، جوشکاری هیدروژن اتمی و دیگر فرآیندها استفاده میشود.
تولید مواد غذایی
ترکیبات کربنات و بیکربنات آمونیاک در رقیق سازی خمیرها در تولید مواد غذایی استفاده میشود. کربنات آمونیوم در اثر حرارت فعال میشود و باعث تولید گاز در خمیر میشود. استفاده از این ماده باعث صرفهجویی در وقت شده و یکی از جایگزینهای استفاده از مخمر است. این کاربرد آمونیاک به دلیل بوی آمونیاک و نگرانیها در خوردن محصولات آمونیاک در بسیاری از کشورها استفاده نمیشود.
رنگ کردن چوب
از محلول آمونیاک در رنگ کردن چوبها با استفاده از تانیک اسید استفاده میشود. واکنش تانیک اسید و محلول آمونیاک با یونهای فلزی موجود در ساختار چوبها باعث ایجاد رنگی تیره بر سطح چوب میشود. علاوه بر این، بخار آمونیاک در هنرهای چوبی برای تغییر رنگ چوب بلوط سفید در سبکهای مبلمان کاربرد داشته است.
سایر کاربردها
آمونیاک در کاهش آلایندههای گازی نقش مهمی دارد. این ماده برای جذب دیاکسید گوگرد () حاصل از سوختهای فسیلی به کار میرود و محصول نهایی آن، سولفات آمونیوم، بهعنوان کود کشاورزی استفاده میشود. همچنین، آمونیاک در فناوری کاهش کاتالیستی انتخابی (SCR) برای خنثیسازی آلایندههای نیتروژنی در موتورهای دیزلی کاربرد دارد. علاوه بر این، از آن میتوان برای کاهش اثرات نشت گاز فسژن استفاده کرد.
در دیگر کاربردها، آمونیاک بهعنوان محرک تنفسی در نمکهای استنشاقی استفاده میشود. این ماده همچنین در صنعت نساجی برای پردازش پارچههای نخی و پیششستوشوی پشم به کار میرود. در گذشته، از آمونیاک بهعنوان گاز بالابرنده در بالونها استفاده میشد و امکان مایعسازی و تغییر حجم آن برای تنظیم شناوری وجود داشت.
خطرات آمونیاک و نکات ایمنی
تا اینجا آموختیم منابع و کاربردهای گاز آمونیاک چیست. آمونیاک به مقادیر کمی در مواد غذایی مانند سبزیجات و .. وجود دارد. همچنین، آمونیاک به شکلی طبیعی توسط بدن انسان توسط باکتریهای روده تولید میشود. در محیطهای سربسته مانند خانه ممکن است گاز آمونیاک از برخی از مواد شوینده و رنگها آزاد شود. با این وجود، مقادیر آمونیاک تولید شده از این موارد در صورت استفاده صحیح از این مواد ناچیز بوده و خطر به همراه ندارد.
استفاده ناصحیح از مواد شوینده مانند مخلوط کردن سدیم هیپوکلریت (وایتکس) با محلولهای حاوی آمونیاک میتواند منجر به انتشار آمونیاک و دیگر گازهای سمی شود. در محیطهای صنعتی که طی فرآیندهای آنها آمونیاک تولید میشود، در صورت رعایت نکردن اصول ایمنی ممکن است باعث انتشار بیش از حد گاز آمونیاک و مسمومیت نیروی کار شود. آمونیاک توسط تجزیه مواد آلی و توسط بدن به مقادیر ناچیز اتفاق میافتد و انسانها و حیوانات همواره مقادیر ناچیزی از این گاز را استنشاق میکنند و این مقادیر برای سلامت انسان مضر نیست.
سمیت آمونیاک
محلولهای آمونیاک معمولا برای انسان و سایر پستانداران خطرناک نیستند، زیرا بدن مکانیسمی برای جلوگیری از تجمع آن در خون دارد. آنزیم کاربامویل فسفات سنتتاز آمونیاک را به کاربامویل فسفات تبدیل کرده و سپس وارد چرخه اوره میشود تا در اسیدهای آمینه ادغام شده یا از طریق ادرار دفع گردد. اما ماهیها و دوزیستان فاقد این مکانیسم هستند و آمونیاک را مستقیما از بدن خود دفع میکنند. بااینحال، حتی در غلظتهای کم، آمونیاک برای موجودات آبزی بسیار سمی است و به همین دلیل بهعنوان مادهای خطرناک برای محیطزیست طبقهبندی میشود. همچنین، آمونیاک موجود در هوا در تشکیل ذرات معلق ریز نقش دارد و یکی از ترکیبات موجود در دود تنباکو است.

وجود آمونیاک در محیط به شکل طبیعی باعث در معرض آمونیاک قرار گرفتن و مسمومیت نمیشود اما تماس با گاز یا مایع آمونیاک ممکن است خطراتی را به دنبال داشته باشد. تنفس مقادیر کم از آمونیاک ممکن است باعث سوزش چشم، بینی و گلو شود. مقادیر بالای آمونیاک باعث سوختن و ورم مجاری تنفسی و آسیب به ریهها میشود و میتواند کشنده باشد. بلعیدن محلولهای آمونیاک میتواند باعث ایجاد درد و سوختگی در مسیر دستگاه گوارش شود و سیستم تنفسی، شکم و قلب آسیب ببیند. این روند میتواند خطر مرگ را به دنبال داشته باشد.

محلول های غلیظ آمونیاک در صورت تماس با پوست میتوانند باعث سوختگیای جدی شوند. همچنین، گاز آمونیاک با غلظت بالا نیز ممکن است باعث سوختگی پوست شود. تماس آمونیاک با غلظت بالا با چشم باعث آسیب جدی میشود و میتواند باعث از دست دادن بینایی شود. آمونیاک ماده ای سرطانزا نیست و باعث ایجاد سرطان نمیشود. خطرات آمونیاک برای کودکان مانند اثرات آمونیاک برای بزرگسالان است.
انتشار آمونیاک در محیط
در قسمت قبل آموختیم خطرات کار با آمونیاک چیست. آمونیاک موجود در محیط زیست از فرآیندهای طبیعی و مصنوعی به دست میآید. این ماده در مقادیر کمی توسط فرآیندهای طبیعی در محیط آزاد میشود. برای مثال، تجزیه مواد آلی یکی از منابع تولید طبیعی آمونیاک است.
در صورت ازدیاد فضولات و مواد آلی ممکن است اقدامات محلی برای مهار کردن آمونیاک مانند ایجاد مکان مناسب برای نگهداری حیوانات اهلی مانند گاو و گوسفند انجام شود. منابع غیرطبیعی و غیر کشاورزی انتشار آمونیاک مواردی مانند لجن فاضلاب، تولیدات صنعتی و وسایل نقلیه است. آمونیاک به صورت مولکولی برای مدت طولانی در محیط باقی نمیماند و به سرعت وارد واکنش شده و ترکیبات آمونیاک را تولید میکند.
نگهداری آمونیاک
آمونیاک بیآب، مشابه پروپان، در فشار جو در دمایی کمتر از دمای اتاق میجوشد و برای ذخیرهسازی در حالت مایع به مخازنی با توان تحمل ۲۵۰ psi (۱٫۷ مگاپاسکال) نیاز دارد. این ماده در کاربردهای صنعتی مختلف در مخازن فولاد کربنی یا فولاد ضد زنگ ذخیره میشود. آمونیاک حاوی حداقل ۰٬۲ درصد وزنی آب باعث خوردگی فولاد کربنی نمیشود و مخازن ساختهشده از این جنس میتوانند بیش از ۵۰ سال دوام داشته باشند. همچنین، ترکیبات آمونیومی نباید با بازها تماس پیدا کنند، زیرا میتواند مقادیر خطرناکی از گاز آمونیاک را آزاد کند.

نکات ایمنی
هنگام استفاده از محصولات پاککننده حاوی آمونیاک، دستورالعملهای روی برچسب را دنبال کنید، محیط را بهخوبی تهویه کنید و از لباس مناسب و محافظ چشمی استفاده کنید. قرار گرفتن در معرض آمونیاک میتواند باعث تحریک پوست، چشم و ریهها شود.
هرگز آمونیاک را با سفیدکننده کلردار مخلوط نکنید، زیرا گازهای سمی کلرامین تولید میشود که میتواند مشکلات تنفسی، درد قفسه سینه، حالت تهوع و تحریک مجاری تنفسی ایجاد کند. بلعیدن این محصولات ممکن است موجب سوختگی دهان، گلو و معده و درد شدید شکمی شود.
در چنین مواردی، دستور العمل ایمنی روی برچسب محصول را مطالعه کنید یا با مرکز کنترل مسمومیت تماس بگیرید. آزمایشهای پزشکی میتوانند آمونیاک را در خون یا ادرار تشخیص دهند، اما از آنجایی که این ماده بهطور طبیعی در محیط وجود دارد، نتایج این آزمایشها برای ارزیابی میزان مواجهه موثر نیستند.
یادگیری شیمی عمومی با فرادرس
در این مطلب آموختیم آمونیاک چیست و در چه فرآیندهایی شرکت میکند. برای شناخت دقیق و کاربردی آمونیاک و خواص آن باید با مفاهیمی چون مفهوم پیوند شیمیایی، انواع پیوندهای فلزی و یونی، ترکیبات کوئوردیناسی آشنا شد. همچنین، شناخت خواص گازها و قوانینی چون قانون بویل و قانون شارل میتواند به درک ما از رفتار گازی چون آمونیاک در محیطهای مختلف کمک کند. پیشنهاد میکنیم برای آشنایی بیشتر با این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزش های بیشتری در زمینه شیمی دانشگاهی دسترسی داشته باشید.
تاریخچه
در این مطلب از مجله فرادرس آموختیم آمونیاک چیست و چه کاربردهایی دارد. آمونیاک از دوران باستان شناخته شده و در گذشته به شکل نشادر در کیمیاگری اسلامی و اروپایی کاربرد داشت. یکی از منابع اولیه آن تخمیر ادرار بود که برای شستوشوی لباس، دباغی، رنگرزی و پاککردن زنگ آهن استفاده میشد. در قرن ۱۵، باسیلیوس والنتینوس (Basilius Valentinus) نشان داد که می توان با واکنش قلیاها با نشادر، آمونیاک تولید کرد. در قرون بعد، دانشمندان مختلف آن را جداسازی و بررسی کردند تا اینکه در سال ۱۷۵۶، جوزف بلک (Joseph Black) موفق شد گاز آمونیاک را بهصورت خالص استخراج کند.

با توسعه فرآیند هابر – بوش در اوایل قرن ۲۰، تولید صنعتی آمونیاک از نیتروژن و هیدروژن ممکن شد. این روش ابتدا در جنگ جهانی اول برای ساخت مواد منفجره بهکار رفت و بعدها پایهای برای صنعت کودهای شیمیایی شد. فریتس هابر در سال ۱۹۱۸ جایزه نوبل شیمی را برای این کشف دریافت کرد. پیش از استفاده از گاز طبیعی، هیدروژن موردنیاز این فرآیند از الکترولیز آب یا فرآیند کلر – باز بهدست میآمد.
source

