آنتالپی سوختن مقدار انرژی (گرمایی) است که از واکنش سوختن کامل یک ماده در حضور اکسیژن آزاد میشود. این فرآیند که شامل تبدیل واکنشدهندهها (سوخت و اکسیژن) به فرآوردهها (کربن دی اکسید و آب) است، یک واکنش گرماده است و انرژی شیمیایی آن به شکل گرما و نور آزاد میشود. آنتالپی سوختن یک مفهوم بسیار مهم در مباحث ترموشیمی است. مقدار آنتالپی سوختن به علت گرماده بودن واکنش سوختن، مقداری منفی دارد. این علامت منفی نشاندهنده گرمای آزاد شده است. در این مطلب از مجله فرادرس میآموزیم آنتالپی سوختن چیست و چگونه اندازهگیری میشود.

در ابتدای این مطلب میآموزیم آنتالپی سوختن چیست و برای چه واکنشهایی استفاده میشود. سپس آنتالپی استاندارد سوختن را تعریف کرده و مفهوم آنتالپی را به طور کلی بررسی میکنیم. در ادامه این مطلب، روش محاسبه آنتالپی سوختن را به روش تئوری و عملی بررسی میکنیم. پس از آن، واکنشهای سوختن را توضیح داده و نمودار انرژی را برای آنها بررسی میکنیم. در نهایت، به شرح مفهوم ارزش سوختی پرداخته و کاربردهای آنتالپی سوختن را برمیشماریم. با مطالعه این مطلب تا انتها میتوانید با این مفهوم مهم آشنا شوید.
آنتالپی سوختن چیست؟
آنتالپی سوختن میزان انرژی حرارتی آزاد شده به ازای سوختن یک مول ماده در حضور اکسیژن اضافی است. اکسیژن اضافی در این تعریف به این منظور است که آنتالپی سوختن برای واکنش سوختن کامل اندازهگیری شود نه سوختن ناقص. آنتالپی سوختن مقداری منفی دارد و نشاندهنده اختلاف سطوح انرژی پتانسیل شیمیایی بین واکنشدهندهها و فرآوردهها است.
آنتالپی سوختن با علامت () نمایش داده میشود. علامت دلتا نشاندهنده اندازهگیری تغییرات است و حرف c نشاندهنده عبارت انگلیسی (Combustion) به معنای سوختن است. به علت اینکه واکنش سوختن یک واکنش گرماده است، سطح انرژی فرآوردهها از واکنشدهندهها کمتر است و به همین علت میزان انرژی سوختن مقداری منفی خواهد داشت. مقدار آنتالپی منفی در شیمی همواره نشاندهنده گرماده بودن واکنش است و بالعکس، مثبت بودن میزان آنتالپی یک واکنش، نشاندهنده گرماگیر بودن آن است. در ادامه، برای درک بهتر اینکه آنتالپی سوختن چیست، برخی از واکنشهای سوختن و میزان آنتالپی سوختن آنها را مشاهده میکنید.
واکنش سوختن کربن به شکل زیر است.
واکنش سوختن متان به شکل زیر است.
واکنش سوختن بنزن به شکل زیر است.
همچنین باید توجه داشته باشید که مواد غیرآلی نیز میتوانند با اکسیژن ترکیب شده و اکسید تولید کنند. برای مثال، واکنش ترکیب منیزیم با اکسیژن به شکل زیر است.
این واکنشها معمولا با نام اکسیداسیون شناخته میشوند. در بیشتر متون علمی، واکنش سوختن و آنتالپی سوختن برای واکنش هیدروکربنها (موادی که از کربن و هیدروژن تشکیل شدهاند) با اکسیژن نسبت داده میشود. همچنین، ممکن است به واکنش ترکیب موادی مانند نیتروژن، گوگرد و فسفر با اکسیژن نیز واکنش سوختن گفته شود. آنتالپی سوختن معمولا برای بررسی سنجش مناسب بودن یک ماده برای استفاده شدن به عنوان سوخت ارزیابی میشود.
یادگیری شیمی یازدهم با فرادرس
در قسمت قبل آموختیم آنتالپی سوختن چیست. بررسی آنتالپی واکنشها از مهم ترین مسائل استوکیومتری و ترمودینامیک در شیمی است که در کتاب شیمی پایه یازدهم متوسطه به آن پرداخته شده است. برای درک بهتر اینکه آنتالپی سوختن چیست، نیاز است ابتدا با مفاهیمی مانند گرما و ظرفیت گرمایی ویژه، فرآیندهای گرماگیر و گرماده، آنتالپی پیوند و … آشنا شوید. پیشنهاد میکنیم برای آشنایی بیشتر با این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم پرداخته است.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه آنتالپی سوختن دسترسی داشته باشید.
آنتالپی استاندارد سوختن چیست؟
آنتالپی استاندارد سوختن یا گرمای سوختن میزان تغییر آنتالپی است که به ازای سوختن ۱ مول ماده شیمیایی در حضور اکسیژن اضافه در شرایط استاندارد آزاد میشود. آنتالپی سوختن گاهی با نام «گرمای سوختن» شناخته میشود. آنتالپی استاندارد سوختن با علامت نشان داده میشود. علامت دایره بالای علامت آنتالپی نشاندهنده شرایط استاندارد است.
در آنتالپی استاندارد سوختن، تمامی مواد واکنشدهنده و فرآورده در شرایط استاندارد هستند. در بررسی آنتالپی استاندارد سوختن، حتی اگر یکی از مواد نیز با ضریب استوکیومتری کسری نوشته شود، بازهم ماده سوختی باید تنها ضریب ۱ داشته باشد. به واکنش زیر توجه کنید.
در مثالی دیگر، آنتالپی سوختن اتانول برابر ۱۳۶۶٫۸- کیلوژول بر مول است. این مقدار انرژی، میزان حرارتی است که یک مول از اتانول به شکل کامل در دمای ۲۵ درجه سانتیگراد (۲۹۸ کلوین) و فشار یک اتمسفر میسوزد. معادله این واکنش به شکل زیر نوشته میشود.
آنتالپی استاندارد سوختن بسیاری از مواد اندازهگیری شده و در منابع مختلف در دسترس است. برخی از آنتالپیهای استاندارد سوختن در جدول زیر ارائه شدهاند.
| ماده | واکنش سوختن | آنتالپی استاندارد سوختن (kJ) |
| کربن | ۳۹۳٫۵ – | |
| هیدروژن | ۲۸۵٫۸ – | |
| منیزیم | ۶۰۱٫۶ – | |
| متان | ۸۹۰٫۸ – | |
| اتانول | ۱۳۶۶٫۸ – | |
| ایزواوکتان | ۵۴۶۱ – | |
| گلوکز | ۲۸۱۳ – |
محاسبه آنتالپی سوختن واکنش با آنتالپی استاندارد سوختن
محاسبه آنتالپی سوختن واکنش با آنتالپی استاندارد سوختن با استفاده از کسرهای تبدیل استوکیومتری انجام میشود. برای واکنشهای سوختن میتوان با استفاده از آنتالپی استاندارد سوختن، میزان آنتالپی واکنش را به دست آوریم. برای مثال، میتوانیم میزان حرارت ایجاد شده از سوختن یک لیتر ایزواکتان را با استفاده از آنتالپی استاندارد سوختن آن پیدا کنیم.
برای این کار باید از کسرهای تبدیل استوکیومتری استفاده کنیم. واکنش سوختن ایزواکتان که ماده اصلی بنزین است، به شکل زیر نوشته میشود.
با استفاده از آنتالپی سوختن استاندارد آن که برابر با ۵۴۶۰ کیلوژول بر مول است، میتوانیم میزان آنتالپی سوختن یک لیتر اکتان را به روش زیر محاسبه کنیم.
برای تمرین بیشتر، به مثالهای زیر توجه کنید.
مثال ۱
با سوزاندن ۱۲۵ گرم استیلن چه مقدار گرما آزاد میشود؟ (آنتالپی استاندارد سوختن: ۱۳۰۰- کیلوژول بر مول و جرم مولی: ۲۶٫۰۲ گرم بر مول)
پاسخ
مانند سوال بالا، کسرهای تبدیل استوکیومتری را برای انجام محاسبات مینویسیم.
مثال ۲
از سوزاندن ۱۲۵ گرم گلوکز چه مقدار گرما آزاد میشود؟ (آنتالپی استاندارد سوختن: ۲۸۰۰- کیلوژول بر مول و جرم مولی: ۱۸۰٫۱۸ گرم بر مول)
پاسخ
مانند سوال بالا، کسرهای تبدیل استوکیومتری را برای انجام محاسبات مینویسیم.
مثال ۳
تصویر زیر، نشاندهنده سوختن گازوئیل (بنزین) در یک فرآیند به شدت گرماده است. برای تخمین میزان حرارت ایجاد شده از سوختن یک لیتر گازوئیل میتوانیم میزان آنتالپی استاندارد سوختن آن را برابر با میزان آنتالپی استاندارد سوختن ایزواکتان که بزرگترین جزء سازنده آن است، برابر در نظر بگیریم. با این حساب، اگر میزان چگالی ایزواکتان، ۰٫۶۹۲ گرم بر مول باشد، حرارت ایجاد شده از یک لیتر آن را بر حسب کیلوژول محاسبه کنید.

پاسخ
با شروع از مقادیری که صورت سوال مشخص کرده است و با استفاده از کسرهای تبدیل استوکیومتری و میزان آنتالپی استاندارد ایزواکتان که در جدلو قسمت قبل ارائه شده است (۵۴۶۰- کیلوژول بر مول)، میزان حرارت ایجاد شده از سوختن ۱ لیتر ایزواکتان را به دست میآوریم.
آنتالپی چیست؟
در قسمت قبل آموختیم آنتالپی سوختن چیست. حال به توضیح مفهوم آنتالپی و تغییرات آن میپردازیم. آنتالپی که با علامت () نمایش داده میشود، اندازهگیری انرژی درون یک سیستم است. آنتالپی برابر با جمع انرژی درونی سیستم و فرآورده فشار و حجم آن است. واحد اندازهگیری آنتالپی ژول بر مول یا کیلوژول بر مول است. اندازهگیری آنتالپی به شکل مستقیم و برای هر ماده غیرممکن است اما میتوان میزان تغییرات آنتالپی را برای یک واکنش اندازهگیری کرد.
تغییرات آنتالپی با علامت نمایش داده میشود. تغییرات آنتالپی به مقدار اندازه انرژی آزاد شده یا دریافت شده توسط یک واکنش است که عموما این انرژی به صورت گرما ظاهر میشود.
در واکنشهای سوختن که واکنشهایی گرماده هستند، مقدار آنتالپی واکنش همواره منفی خواهد بود. آنتالپی یک واکنش، تفاوت سطوح انرژی بین مواد واکنشدهنده و فرآورده را مشخص میکند. میزان آنتالپی واکنش در واقع از اختلاف آنتالپی فرآوردهها منهای واکنشدهندهها به دست میآید.
فرآوردهها – واکنشدهندهها = واکنش
آنتالپی فرآوردهها حاصل از تشکیل پیوندهای بین مواد فرآورده است و همواره مقداری منفی دارد. آنتالپی واکنشدهندهها حاصل از شکستن پیوندهای بین مواد واکنشدهندههاست و همواره مقداری مثبت دارد زیرا تشکیل پیوند انرژی آزاد کرده و شکستن پیوند انرژی نیاز دارد.
در واکنشهای سوختن، همواره انرژی فرآوردهها کمتر از واکنشدهندهها است و آنتالپی واکنش منفی است و انرژی آزاد میشود. رابطه بین انرژی درونی یک سیستم، گرما و کار انجام شده در یک سیستم از طریق فرمول زیر تعریف میشود. این فرمول، نشاندهنده قانون اول ترمودینامیک است که بیان میکند در یک سیستم، انرژی نه از بین میرود و نه به وجود میآید بلکه از فرمی به فرم دیگر تبدیل میشود.
در این فرمول، (U) نشاندهنده انرژی درونی، (w) کار و (q) گرما است. نوعی از کار وجود دارد که به وسیله انتقال فشار حاصل از گازهای تولید شده از واکنش به محیط اطراف واکنش انجام میشود. این انرژی میتواند پیستون یا اجسام را به حرکت در بیآورد. این نوع کار همان کاری است که از انتقال انرژی سوختن سوختهای مختلف درون موتور ماشینها و وسایل حمل و نقل اتفاق میافتد. مقداری از این انرژی نیز به عنوان گرمای واکنش سوختن آزاد شده و باعث گرم شدن موتور میشود.
آنتالپی واکنش بجز برای واکنشهای سوختن، برای سایر واکنشها نیز بررسی میشود. همچنین، گاهی مفاهیمی مانند آنتالپی تشکیل و تفکیک نیز بررسی میشوند. پینشهاد میکنیم برای یادگیری بیشتر درباره مفهوم آنتالپی، فیلم آموزش «آنتالپی چیست» فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
واکنش گرماده و گرماگیر
واکنش گرماده واکنشی است که انرژی واکنش را به صورت گرما به محیط اطراف خود منتقل میکند و آنتالپی آن منفی است. واکنش گرماگیر واکنشی است که برای انجام شدن انرژی را از محیط دریافت میکند و آنتالپی واکنش آن مثبت است.
همانطور که در قسمت قبل توضیح دادیم ، واکنشهای شیمیایی میتوانند انرژی را جذب یا منتشر کنند و این تغییر انرژی در فشار ثابت به شکل گرما خواهد بود. این انتقال گرما در واکنشهای شیمیایی با نام تغییرات آنتالپی شناخته میشود. گرما به طور کلی میتواند توسط واکنش جذب یا دفع شود و بدین ترتیب، واکنشهای شیمیایی به دو دسته گرماده و گرماگیر تقسیم میشوند.
روش محاسبه آنتالپی سوختن چیست؟
مقدار انرژی آزاد شده در واکنش سوختن با استفاده از میزان مول مادهای که اکسید شده (سوخت) اندازهگیری میشود. اندازهگیری آنتالپی سوختن میتوان به روش عملی و تئوری انجام گیرد. در روش تجربی یا عملی با استفاده از یک دماسنج و با استفاده از روش گرماسنجی (کالریمتری)، تغییرات دما اندازهگیری میشود. در روش تئوری میتوان آنتالپی سوختن را با استفاده از آنتالپی پیوند یا قانون هس محاسبه کرد. در نمودار زیر، انواع این روشها را مشاهده میکنید.

محاسبه تجربی آنتالپی سوختن
در واکنشهای شیمیایی، آنتالپی سوختن عموما به صورت گرما نشان داده میشود. میزان گرمایی که توسط واکنش نشر میشود (یا جذب میشود) به محیط نیز سرایت میکند. محیط واکنش گاهی میتواند آب باشد، میتواند یک محلول باشد یا حتی هوای اطراف ظرف واکنش باشد. بدین ترتیب میتوان با اندازهگیری میزان دمای ابتدایی و انتهایی واکنش یا محیط آن، به صورت تجربی، تغییرات انرژی درونی و آنتالپی را در آزمایشگاه اندازهگیری کرد.
قانون اول ترمودینامیک بیان میکند که انرژی نمیتواند به وجود بیاید یا از بین برود. بلکه تنها میتواند یک یک فرم انرژی به فرم دیگری تبدیل شود. بنابر این قانون، میتوانیم آنتالپی یک واکنش را به دست آوریم. برای به دست آوردن تجربی آنتالپی سوختن باید تفاوت مفاهیم سامانه و محیط را از هم تشخیص دهیم.
- سامانه: در واکنشهای شیمیایی، سیستم یا سامانه، واکنش شیمیایی در حال انجام شدن است.
- محیط: محیط اطراف یک واکنش شیمیایی به عنوان محیط در نظر گرفته میشود. در واقع سایر اجزای جهان که جزء واکنش شیمیایی نباشد به عنوان محیط در نظر گرفته میشد.
روش کالریمتری یا گرماسنجی یکی از روشهای کارآمد برای محاسبه میزان آنتالپی سوختن است. طی انجام روش گرماسنجی، دما تا حدی بالا رفته و سپس پایین میآید. بهترین روش برای اندازهگیری میزان تغییرات دما در این روش، استفاده از نمودار تغییرات دما بر حسب زمان است. در این نمودار، با رسم خط مماسی بر نمودار، میتوانیم بالاترین دمای واکنش را با به شکل تقریبی به دست آورده و اثر از دست رفتن حرارت را تا حدود زیادی کم کنیم. به شکل زیر توجه کنید.
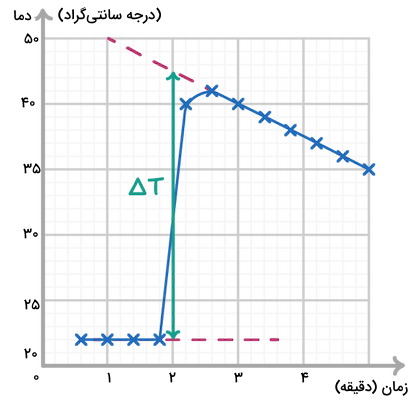
برای رسم این نمودار ابتدا دماهای اندازهگیری شده در واکنش را بر حسب زمان رسم میکنیم و با خطی آنها را به هم متصل میکنیم. سپس خطی برای مشخص کردن دمای اولیه واکنش به شکل افقی رسم میکنیم. پس از آن، خطی مماس بر نمودار در قسمتی که سرد شدن واکنش اتفاق افتاده رسم میکنیم. بعد از آن، خطی از نیمه نمودار رسم میکنیم تا دمای ابتدایی و دمای نهایی (خط مماس) را به یکدیگر وصل کند. بدین ترتیب میتوانیم دمای ابتدایی و دمای انتهایی محتمل آزمایش را داشته باشیم.
گرماسنجی
برای سنجش مستقیم آنتالپی واکنشهای مختلف میتوان از دستگاهی به نام گرماسنج یا کالریمتر استفاده کرد. به این روش، گرماسنجی گفته میشود. گرماسنجها انواع مختلفی دارند که با توجه به شرایط واکنش میتوان آنها را استفاده کرد. یکی از رایجترین وسایل برای اندازهگیری آنتالپی سوختن، گرماسنج بمبی است که سیستمی بسته دارد.
بسته بودن سیستم به این معنی است که گرمای واکنش نمیتواند از سیستم خارج شود و این باعث میشود اندازه گرمای واکنش با میزان دقت بیشتری اندازهگیری شود. همچنین، برای اندازهگیری آنتالپی یا گرمای سوختن در فشار ثابت و برای آزمایشهای سادهتر از نوعی گرماسنج به نام گرماسنج لیوانی استفاده میشود. هر یک از این گرماسنج ها در ادامه توضیح داده شدهاند.
گرماسنج بمبی
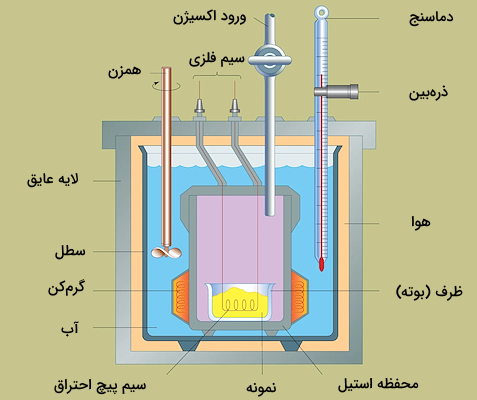
در گرماسنج بمبی، واکنش در محفظهای انجام میشود که با آب احاطه شده است و این آب با دریافت انرژی واکنش، دچار افزایش دما شده و میتوان تغییرات دمای آن را اندازهگیری کرد. با داشتن تغییرات دمای آب و وزن نمونه و ظرفیت گرمایی آن، میتوان گرمای واکنش را اندازهگیری کرد. واکنش در این نوع گرماسنج، در محفظهای فلزی به نام بمب انجام میشود. تغییرات دمای آب اطراف بمب با یک دماسنج اندازهگیری میشود.
همچنین، کل این سیستم با عایقهای مناسب و جریان هوا عایقبندی میشوند تا گرمای واکنش از دست نرود. همچنین، سیمهای فلزی برای ایجاد جریان الکتریسیته و ایجاد جرقه برای انجام واکنش سوختن در بالای این سیستم قرار گرفتهاند. گاز اکسیژن از بالا وارد سیستم می شود و شرایط واکنش سوختن را فراهم میکند. با عبور جریان الکتریسیته، واکنش سوختن آغاز میشود و میتوان تغییرات دما را برای آن اندازهگیری کرد. تصویر یک گرماسنج بمبی در ادامه آورده شده است.
گرماسنج لیوانی
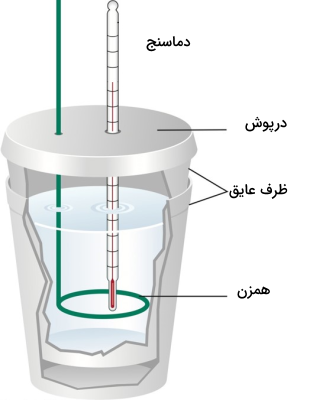
گرماسنج لیوانی از محفظه سادهتری تشکیل شده که محلول واکنش درون آن قرار گرفته و با دماسنج گرمای آن اندازهگیری میشود. همچنین، یک همزن نیز برای همزدن محلول در آن قرار دارد. این روش اندازهگیری بیشتر برای واکنشهایی که در فاز مایع انجام میشوند مناسب است. تصویر یک گرماسنج لیوانی در ادامه آمده است.
استفاده از گرمای واکنش و روش کالری متری
میزان گرمای محاسبه شده با روش کالری متری میزان آنتالپی سوختن واکنش را مشخص نمیکند. برای محاسبه آنتالپی واکنش، باید میزان گرمای واکنش سوختن که با استفاده از روش گرماسنجی به دست آمده است را بر تعداد مول سوخت واکنشدهنده واکنش تقسیم کنیم. بدین ترتیب میتوانیم میزا تقریبی آنتالپی سوختن را داشته باشیم. فرمول محاسبه به این روش در ادامه آورده شده است.
مثال
در یک آزمایش، میزان ۱٫۴۵ گرم از یک سوخت آلی به شکلی کامل با اکسیژن اضافی سوخته است. گرمای تولید شده در این واکنش دمای ۱۰۰ گرم آب موجود در گرماسنج را از ۲۹۳ تا ۳۷۲ کلوین افزایش داده است. روش محاسبه آنتالپی سوختن برای این واکنش چیست؟ مقدار آنتالپی سوختن را محاسبه کنید. (جرم مولی این سوخت برابر با ۵۸ گرم بر مول و ظرفیت گرمایی ویژه آب ۴٫۱۸ ژول بر گرم کلوین است.)
پاسخ
برای محاسبه میزان آنتالپی سوختن برای این واکنش، ابتدا میزان گرمای آزاد شده از واکنش را به دست آورده و سپس آن را بر تعداد مول سوخت مورد نظر تقسیم میکنیم.
پس در قدم اول، میزان گرمای تولید شده را با استفاده از اخلاف دما و میزان ظرفیت گرمایی و جرم آب محاسبه میکنیم.
واحد اندازهگیری آنتالپی معمولا بر حسب کیلوژول بر مول بیان میشود پس مقدار گرمای به دست آمده را به کیلوژول تبدیل میکنیم.
سپس میزان مول سوخت مورد نظر را با استفاده از جرم و جرم مولی آن محاسبه میکنیم.
در نهایت، میزان گرمای به دست امده را بر این تعداد مول تقسیم میکنیم تا میزان آنتالپی سوختن به دست آید.
محاسبه تئوری آنتالپی سوختن
در قسمتهای قبل آموختیم آنتالپی سوختن چیست. آنتالپی سوختن برابر با میزان انرژی است که از سوختن مواد واکنشدهنده و تبدیل آنها به فرآورده تولید میشود و میتواند به صورت نور و گرما باشد. یکی از روشهای محاسبه غیرمستقیم محاسبه آنتالپی سوختن، استفاده از آنتالپی پیوند واکنشدهندهها و فرآوردهها است. در این روش، میزان آنتالپی تشکیل پیوند فرآوردهها از آنتالپی تفکیک پیوند واکنشدهندهها کسر میشود.
همچنین می توان با استفاده از قانون هس و جمع مقادیر آنتالپی مراحل مختلف واکنشهای سوختن، میزان آنتالپی سوختن کلی آنها را به دست آورد. این روشها در ادامه توضیح داده میشوند.
قانون هس
قانون هس بیان میکند که میزان آنتالپی واکنش، صرف نظر از مسیری که طی میکند، مقدار ثابتی دارد. به همین علت به راحتی میتوان با داشتن آنتالپی واکنش سوختن را با داشتن آنتالپی واکنش دهندهها و فرآوردهها محاسبه کرد.
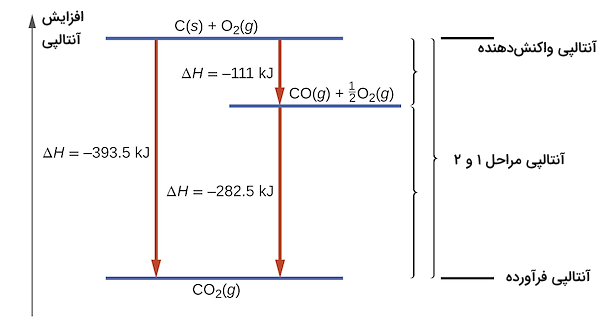
در استفاده از این قانون برای محاسبه آنتالپی سوختن میدانیم که اگر بتوان یک واکنش را به صورت مجموعهای از چند واکنش در نظر گرفت، آنتالپی واکنش برابر با جمع آنتالپی هر یک از مراحل است. در استفاده از این روش باید دقت داشت که اگر یکی از مراحل ضریبی بگیرد و ضرایب استوکیومتری مواد آن در عددی ضرب شوند، آنتالپی واکنش نیز باید در همان عدد ضرب شود. همچنین، آنتالپی واکنشهای رفت و برگشت با هم برابر است و تنها علامت آنها عکس هم است. یعنی اگر واکنشی به شکل عکس نوشته شود، علامت آنتالپی آن باید تغییر کند. در ادامه با مثال واکنش سوختن کربن، این قانون را توضیح خواهیم داد.
واکنش مستقیم سوختن کربن به شکل زیر است.
در واقعیت، این واکنش ممکن است از تریب دو واکنش دو مرحله ای بدست آید. در مرحله اول، کربن با اکسیژن ترکیب شده و کربن مونوکسید تولید میکند. واکنش این مرحله به شکل زیر است.
در مرحله دوم، کربن مونوکسید با اکسیژن ترکیب شده و کربن دی اکسید را ب وجود میآورد. معادله این واکنش به شکل زیر است.
بنابر تئوری قانون هس، آنتالپی سوختن واکنش کلی با جمع آنتالپی دو مرحله برابر خواهد بود. در ادامه، این واکنشها و میزان آنتالپی آنها را جمع میکنیم.
نتیجه این روش محاسبه آنتالپی در نمودار زیر مشخص شده است.
آنتالپی پیوند
در قسمتهای قبل اشاره کردیم که شکستن پیوندها فرآیندی است که گرما مصرف کرده و تشکیل پیوندها فرآیندی است که گرما را آزاد میکند. پس شکستن پیوندها فرآیندی گرماگیر و تشکیل پیوندها فرآیندی گرماده است. به میزان انرژی مصرف شده برای شکستن پیوند آنتالپی پیوند گفته میشود. در تمامی واکنشهای شیمیایی برای پیوندهای شکسته شده و تشکیل شده آنتالپی پیوند وجود خواهد داشت. میزان آنتالپی پیوند برای پیوندهای شکسته شده مثبت و برای پیوندهای تشکیل شده منفی خواهد بود.
میتوان میزان آنتالپی سوختن واکنشها را نیز با استفاده از آنتالپی پیوند واکنشدهندهها و فرآوردههای آن محاسبه کرد. برای این کار باید میزان آنتالپی تشکیل پیوندها را از میزان آنتالپی تفکیک پیوندها کم کنیم.
برای مثال به واکنش زیر دقت کنید.
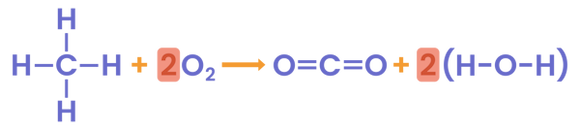
در این واکنش ۴ پیوند کربن-هیدروژن و دو پیوند دوگانه اکسیژن-اکسیژن شکسته میشوند. با پیدا کردن میزان آنتالپی پیوند این پیوندها از مراجع، مقادیر آنها را جمع میکنیم.
همچنین، با توجه به فرآوردههای این واکنش مشاهده میکنیم که دو پیوند دو گانه کربن-اکسیژن تشکیل شدهاند این مقادیر را نیز محاسبه میکنیم.
درنهایت، میزان آنتاپی پیوند فرآوردهها (تشکیل پیوند) را از آنتالپی پیوند واکنشدهندهها (شکستن پیوندها) کم میکنیم و آنتالپی واکنش سوختن به دست میآید.
میزان آنتالپی پیوند بین اتمهای مختلف به طول پیوند و مرتبه پیوندها وابسته است. پیشنهاد میکنیم برای آشنایی بیشتر با این دو پارامتر، مطلب «طول پیوند و مرتبه پیوند در شیمی» مجله فرادرس را مطالعه کنید. لینک این مطلب در ادامه آورده شده است.
واکنش سوختن چیست؟
در قسمتهای قبل آموختیم آنتالپی واکنش سوختن چیست. واکنش سوختن (احتراق) واکنشی است که شامل سوختن یک سوخت مانند زغال سنگ، گاز یا بنزین در اکسیژن است. این واکنش واکنشی گرماده است و عموما با آزاد شدن نور و حرارت قابل توجهی همراه است. از واکنش سوختن برای سیستمهای گرمایش، سوخت خودروها، پخت غذا، تولید الکتریسیته و … استفاده میشود.
در تمامی واکنشهای سوختن و بسیاری از واکنشهای اکسیداسیون، مولکول اکسیژن حتما باید وجود داشته باشد. فرآوردههای سوختن هیدروکربنها همواره کربن دی اکسید و آب هستند. آب تولید شده در این واکنشها میتواند به شکل گاز یا مایع باشد. حالت آب در واکنشهای سوختن به دمای پس از واکنش سوختن بستگی دارد.
واکنش سوختن که نوعی واکنش اکسیداسیون است، بیشتر برای واکنش هیدروکربنها با اکسیژن به کار میرود. واکنش سوختن میتواند به دو فرم اتفاق بیافتد. این دو فرم که سوختن ناقص و کامل هستند در ادامه توضیح داده میشوند.
سوختن ناقص و سوختن کامل
سوختن کامل به واکنش سوختنی گفته میشود که در حضور اکسیژن اضافی انجام شود. سوخت واکنشهای سوختن به طور معمول هیدروکربنها هستند. سوختن هر هیدروکربنی باعث باعث اکسید شدن اتم کربن شده و کربن دی اکسید و آب تولید میکند. یکی از ویژگیهای مهم سوختن کامل این است که گرمای قابل توجهی تولید میکند. برای مثال، واکنش سوختن کامل متان به شکل زیر است.
در شیمی، معمولا منظور از واکنش سوختن، سوختن کامل است. در غیر این صورت عبارت «سوختن ناقص» برای مشخص کردن نوع واکنش سوختن بیان میشود.
واکنش سوختن ناقص، واکنش سوختنی است که در آن سوخت با میزان محدودی (ناکافی) از اکسیژن واکنش دهد. این بدین معنی است که اکسیژن کافی برای اکسید کردن تمامی سوخت وجود ندارد. در عوض، قسمتی از سوخت تبدیل به کربن مونوکسید و آب میشود. اگر میزان اکسیژن در واکنش سوختن بسیار کم باشد، اتمهای کربن اکسید نمیشوند و به عنوان کربن خالص و به فرم دوده آزاد میشوند.
با وجود اینکه واکنش سوختن ناقص نیز یک فرآیند گرماده است، میزان حرارت آزاد شده از این واکنش بسیار کمتر از گرمای سوختن ناقص است و انرژی کمتری دارد. برای مثال، به واکنش سوختن ناقص متان توجه کنید.
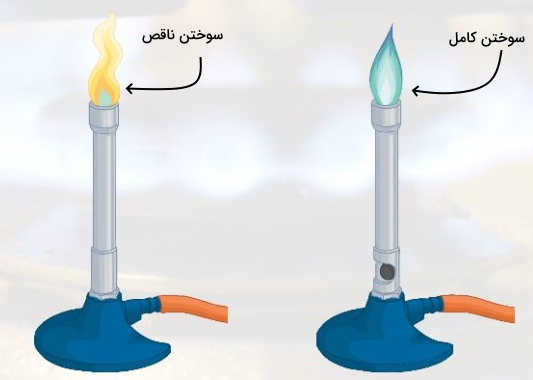
سوختن کامل، اکسیژن بیشتری از سوختن ناقص نیاز دارد. با مقایسه واکنشهای داده شده متوجه میشویم که سوختن کامل برای انجام گرفتن نیاز به دو مول اکسیژن برای هر مول متان دارد و سوختن ناقص تنها با یک مول اکسیژن انجام میشود. یکی از مثالهای بارز سوختن ناقص و کامل را میتوانید در آزمایشگاه و با شعله چراق بونزن مشاهده کنید. با چرخاندن پیچ هوای چراغ بونزن میتوانید اکسیژن در دسترس سوختن را زیاد و کم کنید. شعله آبی نشاندهنده سوختن کامل است و دمای بسیار بالاتری دارد. درحالی که شعله زرد نشاندهنده سوختن ناقص است و در صورتی که ظرفی را روی آن قرار دهید، انتشار دوده را مشاهده خواهید کرد. همچنین، این شعله دمای کمتری خواهد داشت.
نمودار انرژی واکنش سوختن
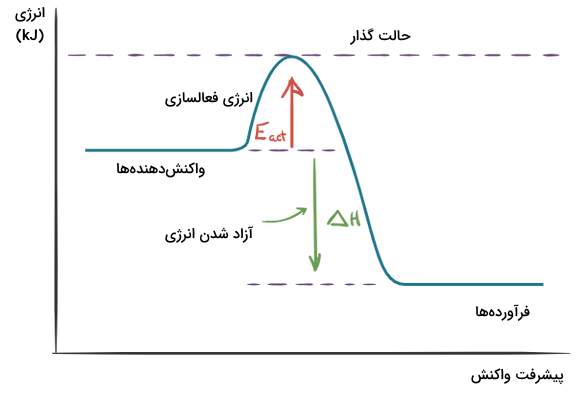
نمودار انرژی واکنش نموداری است که میزان انرژی پتانسیل واکنشدهندهها و فرآوردهها و میزان انرژی فعالسازی (انرژی پتانسیل حالت گذار) را مشخص میکند. میزان آنتالپی واکنش و انرژی فعالسازی واکنش را میتوان از روی نمودار انرژی آن به دست آورد.
در واکنشهای شیمیایی، برخی از پیوندها شکسته میشوند و پیوندهای جدیدی به وجود میآید. در طی انجام شدن این تغییرات، یک مرحله میانه وجود دارد که در آن برخی از پیوندها به شکل جزئی شکسته شده و برخی دیگر به شکل جزئی تشکیل شدهاند. این مرحله میانه، انرژی بیشتری نسبت به انرژی واکنشدهندهها دارد.
این مرحله از واکنشهای شیمیایی بسیار ناپایدار است و با نام حالت گذار شناخته میشود. برای رسیدن واکنش به این مرحله، به یک مقدار انرژی اولیه نیاز است که با نام انرژی فعالسازی شناخته میشود. هر واکنش شیمیایی، انرژی فعالسازی منحصر به فردی دارد. انرژی فعالسازی در واکنشهای سوختن با یک شعله کوچک یا جرقه یا گرما تأمین میشود. برای مثال، به نمودار انرژی سوختن متان توجه کنید.
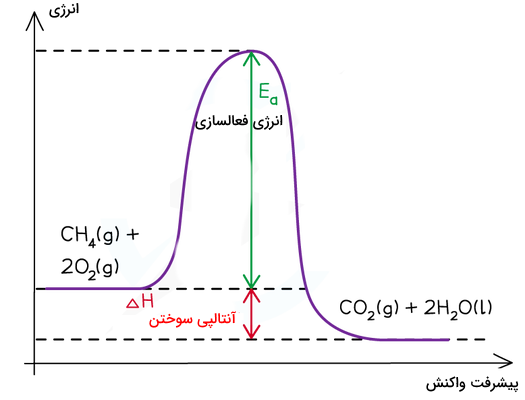
انرژی فعالسازی برابر با اختلاف انرژی میان حالت گذار و سطح انرژی واکنشدهندهها است. همچنین، آنتالپی واکنش برابر با اختلاف سطح انرژی واکنشدهندهها و فرآوردهها است.
در قسمتهای قبلی آموختیم که واکنش سوختن یک واکنش گرماده است و انرژی فرآوردههای آن از واکنشدهندهها کمتر است. در نمودار انرژی این واکنشها، همواره خط مربوط به انرژی واکنشدهندهها بالاتر از سطح انرژی فرآوردهها قرار میگیرد. نمودار کلی مربوط به واکنشهای گرماده را در زیر مشاهده میکنید. نمودار واکنشهای سوختن همراه به شکل زیر است و میتوان از روی اختلاف سطح انرژی واکنشدهندهها و فرآوردهها فهمید مقدار آنتالپی سوختن چیست.
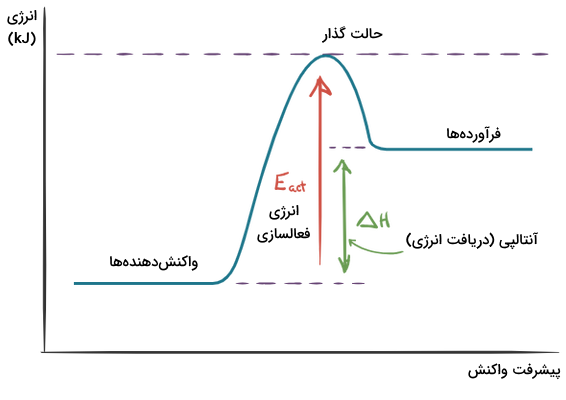
این درحالی است که نمودار واکنشهای گرماگیر برعکس است و سطح انرژی واکنشدهندهها پایین تر از فرآوردهها قرار می گیرد. در ادامه، نمودار مربوط به این واکنشها را مشاهده میکنید.
ارزش سوختی چیست؟
ارزش سوختی میزان حرارت آزاد شده از سوختن یک حجم یا جرم مشخص (معمولا گرم) از ماده ای مشخص در شرایط استاندارد است. از مقایسه میزان ارزش سوختی مواد مختلف میتوان سوخت مناسب برای انواع واکنشهای شیمیایی و وسایل مختلف را انتخاب کرد. برای مثال، ارزش سوختی اتانول ۲۶٫۷ مگاژول بر کیلوگرم و ارزش سوختی اوکتان ۴۴٫۴۲۷ مگاژول بر کیلوگرم است. پس یک کیلوگرم اوکتان در صورت سوختن انرژی تقریبا دو برابر انرژی حاصل از سوختن اتانول آزاد میکند.
ارزش سوختی از تقسیم آنتالپی استاندارد سوختن مواد بر جرم مولی آنها به دست میآید. با دانستن اینکه آنتالپی سوختن واکنش چیست و با تقسیم آنتالپی استاندارد سوختن که واحد آن کیلوژول بر گرم بر جرم مولی که واحد آن گرم بر مول است، میتوان ارزش سوختی را بر حسب کیلوژول بر گرم به دست آورد.
در واقع ارزش سوختی میزان حرارتی است که با انجام شدن واکنش سوختن برای یک سوخت با مقدار مشخص آزاد میشود. دو نوع ارزش سوختی وجود دارد که با نامهای ارزش سوختی پایین (خالص) و ارزش سوختی بالا (کل) شناخته می شوند. در ادامه هریک از این موارد را توضیح میدهیم.
ارزش سوختی پایین
ارزش سوختی پایین اختلاف بین حرارت واکنش سوختن و حرارت حاصل از تبخیر بخار آب حاصل از واکنش سوختن است. ارزش سوختی پایین با استفاده از اطلاعات به دست آمده از اندازهگیری ارزش سوختی بالا اندازهگیری میشود. همچنین، این ارزش سوختی را میتوان با استفاده از آنتالپی استاندارد تشکیل فرآوردهها و واکنشدهندههای واکنش نیز محاسبه کرد.
ارزش سوختی بالا
ارزش سوختی بالا گرمای به دست آمده از سوخت کامل یک ماده است. ارزش سوختی بالا معمولا با بمب کالریمتر اندازهگیری میشود. این ارزش سوختی با واحد اندازهگیری انرژی بر واحد حجم یا جرم سوخت بیان میشود.
مقایسه ارزش سوختی مواد
تصور کنید آنتالپی استاندارد دو ماده را داریم و میخواهیم بدانیم یک گرم از هر کدام چه میزان انرژی آزاد میکند و کدام یک سوخت بهتری است. برای مثال، آنتالپی استاندارد سوختن متان برابر با ۸۹۰٫۳ – کیلوژول بر مول و آنتالپی استاندارد سوختن گاز هیدروژن ۲۸۵٫۸- کیلوژول بر مول است.
برای به دست آوردن ارزش سوختی هریک از این مود، این مقادیر را بر جرم مولی آنها تقسیم میکنیم.
پس یک گرم هیدروژن تقریبا سه برابر ۱ گرم متان انرژی آزاد میکند و انرژی بسیار بالاتری دارد.
یادگیری ترمودینامیک با فرادرس
تا اینجا توضیح دادیم آنتالپی سوختن چیست و چگونه اندازهگیری میشود. آنتالپی واکنشها یکی از مهمترین مسائل مطرح شده در علم ترمودینامیک است. برای یادگیری بیشتر درباره آنتالپی واکنش و مباحث ترمودینامیکی باید با مفاهیمی مانند تعریف کار در ترمودینامیک، انواع کار، انواع انتقال گرما، مقایسه کار و گرما، قوانین ترمودینامیک، آنتالپی و آنتروپی … آشنا شوید. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم به مجموعه فیلم آموزش ترمودینامیک فرادرس مراجعه کنید که با زبانی ساده و کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است میتوانید به آموزشهای بیشتری در زمینه ترمودینامیک دسترسی داشته باشید.
کاربرد آنتالپی سوختن
در این مطلب از مجله فرادرس آموختیم آنتالپی سوختن چیست. آنتالپی سوختن و آنتالپی استاندارد سوختن از مهم ترین مفاهیم مطرح شده در ترمودینامیک هستند. با مقایسه، آزمایش و اندازهگیری آنتالپی سوختن مواد، میتوان در بسیاری از صنایع از آنها به خوبی استفاده کرد. برای مثال، سوختهای مختلف بر اساس آنتالپی سوخت استفاده میشوند. هرچه آنتالپی سوختن مواد بیشتر باشد، انرژی بیشتری آزاد میکنند و از این انرژی را میتوان برای حرکت اجسام، تولید الکتریسیته، تولید وسایل گرمایشی و … استفاده کرد. به همین علت است که سوختهایی مانند بنزین، گازئیل و گاز طبیعی که آنتالپی سوختنن بالایی دارند معمولا به عنوان سوخت استفاده میشوند.
مهمترین فرآورده واکنشهای سوختن انرژی است که آزاد میشود. این انرژی معمولا به صورت نور، گرما یا ترکیبی از هر دو آزاد میشود.
source
