شبه فلزات در جدول تناوبی عناصری هستند که خواصی بین خواص مواد فلزی و نافلزها را دارند. این مواد شامل عناصر بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان، تلوریم، پلونیم و استاتین هستند. برخی از شبه فلزات جدول تناوبی مانند سیلیسیم و ژرمانیوم در ساختار نیمه هادیها بسیار مفید هستند. خواص فیزیکی و شیمیایی این مواد نیمه رسانا، آنها را به مواد ارزشمندی در صنعت الکترونیک تبدیل کرده است. در این مطلب از مجله فرادرس، شبه فلزات در جدول تناوبی را بررسی میکنیم و خواص و کاربرد آنها را توضیح میدهیم.

در ابتدای این مطلب میآموزیم شبه فلرات جدول تناوبی کدامند و در کجای جدول تناوبی قرار گرفتهاند. سپس خواص عمومی این عناصر را بررسی کرده و خواص فیزیکی و شیمیایی آنها مانند هدایت الکتریکی و پیوند شیمیایی را توضیح میدهیم. در بخش بعد، به بررسی تعداد و اسامی شبه فلزات پرداخته و سپس هر یک از شبه فلزات و ویژگیهای آنها را بررسی میکنیم. در نهایت کاربرد شبه فلزات را در صنایع مختلف مانند الکترونیک و کشاورزی بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید با این عناصر مهم در جدول تناوبی آشنا شوید.
معرفی شبه فلزات در جدول تناوبی
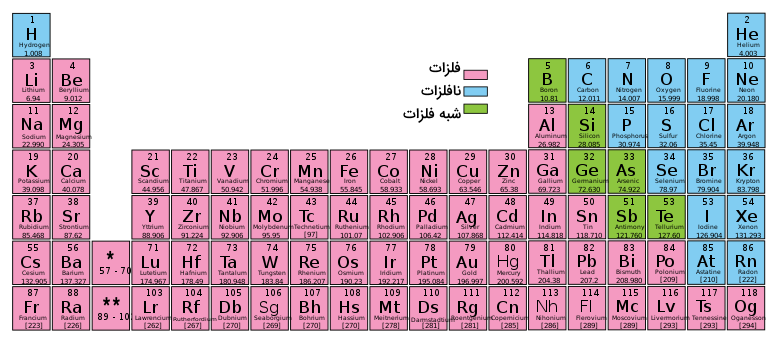
شبه فلز، عنصری است که خواصی بین خواص فلزها و نافلزات دارد. شبه فلزات که با عبارت انگلیسی (Metalloids) شناخته میشوند، گاهی با عبارت «نیمه فلز» بیان میشوند. در جدول تناوبیهای استاندارد، معمولا شبه فلزات را با رنگ خانههای سبز مشخص میکنند. تعداد شبه فلزات در جدول تناوبی ۶ عنصر شناخته شده است و این تعداد در برخی از منابع تا ۱۱ عنصر نیز معرفی شدهاند. اسامی شبه فلزات در جدول تناوبی عبارتند از بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان و تلوریم. برخی پلونیم و استاتین را نیز جزو شبه فلزات میشمارند. همچنین، عناصر کربن، آلومینیوم و سلنیم نیز گاهی شبه فلز شناخته میشوند.
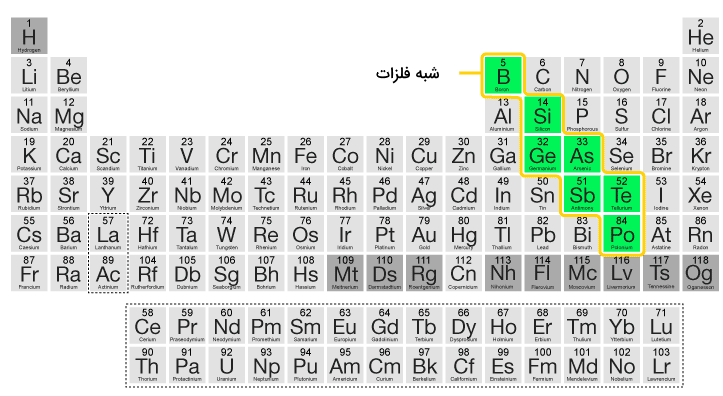
در جدول تناوبی استاندارد، تمامی این ۱۱ عنصر معرفی شده در بلوک p جدول تناوبی قرار دارند (گروههای ۱۳ تا ۱۸ که زیرلایه p آنها در حال پر شدن است). این عناصر از عنصر بور در بالا و سمت چپ شروع شده و تا عنصر استاتین در پایین و سمت راست ادامه مییابند. شکل زیر نشاندهنده محل قرارگیری شبه فلزات در جدول تناوبی است.
برخی از آلوتروپهای مواد میتوانند صرفنظر از خاصیت عنصر اصلی، به عنوان شبه فلز در نظر گرفته شوند. برای مثال عنصر کربن که خود نافلز یا شبه فلز در نظر گرفته میشود از این مواد است. آلوتروپ الماس کاملا نافلز است و آلوتروپ گرافیت خواص شبه فلزی دارد. فسفر، قلع، سلنیم و بیسموت نیز سایر موادی هستند که آلوتروپهای آنها خواص متفاوتی دارند.
شبه فلزات در جدول تناوبی ظاهری شبیه فلزات دارند اما خواص شیمیایی آنها بیشتر شبیه نافلزات است. تمامی شبه فلزات در دمای اتاق جامد هستند. شبه فلزات از فلزات شکنندهتر هستند و رسانایی الکتریکی آنها از فلزات کمتر است.
یادگیری شیمی یازدهم با فرادرس
شناخت خواص مواد شیمیایی و نحوه برهمکنش آنها تنها با شناخت خواص اتمها مانند عدد اتمی و عدد جرمی و آرایش الکترونی و خواص آنها حاصل میشود. با شناخت مواردی مانند خواص دورهای عناصر مانند شعاع اتمی، الکترونگاتیوی، تعداد الکترون ظرفیت و … میتوان این دسته ویژگیها را برای عناصر با تشخیص مکان آنها در جدول تناوبی حدس زد. همچنین، شناخت خواص فیزیکی مواد و دستهبندی آنها بر اساس فلز و نافلز و شبه فلزات در جدول تناوبی، میتوان از بسیاری از ویژگیهای دورهای آنها در صنایع مختلف استفاده کرد. پیشنهاد میکنیم برای آشنایی با این مفاهیم و مباحث به فیلم آموزش دروس پایه یازدهم فرادرس بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه شبه فلزات در جدول تناوبی دسترسی داشته باشید.
مکان قرارگیری شبه فلزات در جدول تناوبی
شبه فلزات در جدول تناوبی بین فلزات و نافلزات قرار گرفتهاند. در جدول تناوبی، عناصر موجود در سمت چپ و بالا بیشتر خواص فلزی دارند و عناصر موجود در سمت راست و پایین جدول خواص نافلزی دارند. شبه فلزات در جدول به شکل خطی مورب از عنصر بور در ابتدای گروه ۱۳ شروع شده و تا عنصر استاتین در سمت راست و پایین جدول (گروه ۱۷) ادامه پیدا میکنند.
مکان قرارگیری شبه فلزات در جدول تناوبی را میتوانید در شکل پایین مشاهده کنید.
همچنین میتوان گفت که شبه فلزات در جدول تناوبی به شکلی قطر قطعه p جدول را تشکیل میدهند. یک ایده دیگر برای مشخص کردن مکان شبه فلزات در جدول تناوبی ساختار پلهای است. در این ساختار این مواد مانند پلهای پایین رونده از بور تا استاتین ادامه مییابند.
شناخت مکان مختلف عناصر در جدول تناوبی و خواص آنها قدمی مهم برای شناخت و یادگیری واکنشهای شیمیایی و دلیل رفتارهای مختلف مواد است. پیشنهاد میکنیم برای یادگیری بهتر جدول تناوبی و نکات آن مطلب «جدول تناوبی چیست» مجله فرادرس که لینک آن در ادامه آمده است را مطالعه کنید.
خواص عمومی شبه فلزات در جدول تناوبی
در قسمتهای قبل اشاره کردیم که شبه فلزات خواصی بین خواص فلزات و نافلزات را دارند. برخی از مهمترین این خواص در ادامه توضیح داده شده است.
- شکل ظاهری شبه فلزات شبیه به فلزات است.
- رسانایی شبه فلزات کمتر از فلزات است.
- شبه فلزات شکنندهتر از فلزات هستند.
- خواص شیمیایی شبه فلزات شبیه نافلزات است.
- الکترونگاتیوی شبه فلزات بین فلزات و نافلزات است.
- انرژی یونش شبه فلزات بین فلزات و نافلزات است.
- واکنشپذیری شبه فلزات به مادهای که با آن واکنش میدهند بستگی دارد.
- شبه فلزات نیمههادی خوبی هستند.
- شبه فلزات درخشش فلزات را دارند اما آلوتروپهای آنها ممکن است ظاهر نافلزات را داشته باشد.
- شبه فلزات عموما جامد هستند.
- شبه فلزات در واکنشهای شیمیایی عموما مانند نافلزات عمل میکنند و میتوانند با فلزات آلیاژ تشکیل دهند.
در ادامه خواص فیزیکی و شیمیایی شبه فلزات را بررسی خواهیم کرد.
خواص فیزیکی شبه فلزات
خواص فیزیکی خواصی هستند که میتوانند بدون تغییر ویژگیهای ماده، مشاهده و اندازهگیری شوند. برای مثال، نقطه انجماد و چگالی، خواصی فیزیکی هستند. خواص فیزیکی شبه فلزات به شرح زیر است.
- شبه فلزات جامد هستند.
- شبه فلزات معمولا سطحی براق دارند.
- شبه فلزات الاستیسیته کمی دارند و شکننده هستند.
- این مواد معمولا نیمههادیهایی هستند و گرما را به میزان متوسطی انتقال میدهند.
در ادامه برخی از خواص فیزیکی مواد مانند خواص ظاهری، نقطه ذوب و جوش، چگالی، هدایت الکتریکی و … را برای شبه فلزات بررسی میکنیم.
خواص ظاهری
شبه فلزات درخشش فلزات را داند . در دمای اتاق جامداتی شکننده هستند. این مواد مانند فلزات براق و درخشان هستند اما به اندازهای شکننده هستند که تکه تکه شوند. برای مثال، سیلیسیم جامدی سخت، شکننده و کریستالی است که درخششی آبی- خاکستری و براق دارد.

دمای ذوب و جوش
شبه فلزات در جدول تناوبی دمای ذوب و نقطه جوشی بین فلزات و نافلزات دارند. برای مثال، سیلیسیم نقطه ذوبی برابر ۱۴۱۰ درجه سانتیگراد دارد و نقطه ذوب بور ۲۰۷۹ درجه سانتیگراد است. در حالی که نقطه ذوب ژرمانیم ۹۳۲٫۳ درجه سانتیگراد است.
این نقاط ذوب پایینتر از نقطه ذوب فلزات و بالاتر از نقطه ذوب نافلزات است. پیشنهاد میکنیم برای آشنایی بیشتر با نقاط ذوب و جوش مواد و روند تغییر آنها در جدول تناوبی، فیلم آموزش روند تغییرات نقطه ذوب و جوش عناصر در جدول تناوبی فرادرس که لینک آن در ادامه آمده است را مشاهده کنید.
چگالی
چگالی شبه فلزات در جدول تناوبی متنوع است اما عموما کمتر از چکالی فلزات و بالاتر از چگالی نافلزات است. برای مثال، چکالی آنتیموان و تلوریم به ترتیب ۶٫۶۹۷ و ۶٫۲۴ گرم بر سانتیمتر مکعب است و چگالی آرسنیک ۵٫۷۲۷ گرم بر سانتیمتر مکعب است.
هدایت الکتریکی
شبه فلزات به خوبی فلزات جریان الکتریسیته را عبور نمیدهند. در واقع، بسیاری از شبه فلزات در جدول تناوبی، به عنوان نیمه هادی شناخته میشوند. میزان هدایت الکتریکی شبه فلزات کمتر از فلزات و بیشتر از نافلزات است. این بدین معنا است که این مواد میتوانند بسته به میزان ناخالصی و اثرات دما به عنوان عایق الکتریسیته استفاده شوند. برای مثال، سیلیسیم و ژرمانیم نیمه هادیهایی با هدایت الکتریکی بین فلزات و نافلزات هستند.
کمتر بودن رسانایی الکتریکی این مواد به این علت است که الکترونهای آنها نسبت به فلزات بیشتر تحث اثر جاذبه هسته است. به همین علت، آزادی حرکت کمتری دارد.
آلوتروپها
آلوتروپ به فرمهای متفاوتی گفته میشود که مواد شیمیایی میتوانند در یک حالت داشته باشند. برای مثال، عنصر کربن در حالت جامد میتواند به فرمهای گرافن، گرافیت و الماس وجود داشته باشد. وجود آلوتروپها به علت شیوههای متفاوتی است که اتمها میتوانند به یکدیگر متصل شوند. آلوتروپها میتوانند خواص فیزیکی و شیمیایی متفاوتی از خود نشان دهند. برای مثال، گرافیت ساختاری نرم و لایهای دارد در حالی که الماس به شدت سخت است.
بسیاری از شبه فلزات آلوتروپهای متفاوتی دارند که میتوانند خواص فیزیکی و شیمیایی متفاوتی داشته باشند. برای مثال، آرسنیک سه آلوتروپ رایج با رنگهای خاکستری، زرد و سیاه دارد که نوع خاکستری آن فراوانتر است.
هدایت گرمایی
شبه فلزات در جدول تناوبی نسبت به نافلزات خیلی بهتر انرژی حرارتی را انتقال میدهند اما کمتر از فلزات گرما را منتقل میکنند. رسانایی حرارتی شبه فلزات بسته به عنصر آنها متفاوت است. برای مقایسه، برخی از شبه فلزات بسیار کم گرما را منتقل میکنند در حالی که برخی دیگر به خوبی حرارت را انتقال میدهند. از این ویژگی شبه فلزات در تولید دستگاههای ترموالکتریک استفاده میشود.
شکنندگی
برعکس بسیاری از فلزات که چکشخوار و منعطف هستند شبه فلزات شکننده هستند. این مواد معمولا با تحت فشار یا نیرو قرار گرفتن، تکه تکه میشوند.
خواص شیمیایی شبه فلزات
خواص شیمیایی خواصی هستند که مشخص میکنند مواد مختلف چگونه با یکدیگر برهمکنش دارند و تغییر میکنند. واکنشهای شیمیایی تنها روشی هستند که میتوان به وسیله آنها خواص شیمیایی مواد را مشخص کرد. واکنشهای شیمیایی مواردی مانند انفجار، سوختن و … است. شبه فلزات عموما خواص شیمیایی مشابه نافلزات دارند. خواص شیمیایی شبه فلزات در جدول تناوبی به شرح زیر است.
- شبه فلزات در صورت اکسید شدن، گاز آزاد میکنند.
- شبه فلزات با فلزات ترکیب میشوند و آلیاژ تشکیل میدهند.
- شبه فلزات آلوتروپهای مختلفی دارند که این مواد میتوانند خواص فلزی یا نافلزی داشته باشند.
- برخی از شبه فلزات در صورت ذوب شدن، منقبض میشوند.
- شبه فلزات میتوانند با هالوژنها واکنشداده و ترکیباتی را تولید کنند.
در ادامه برخی از خواص شیمیایی مانند واکنش پذیری، مرتبه اکسایش، الکترونگاتیوی و … را برای شبه فلزات بررسی میکنیم.
واکنش پذیری با نافلزات
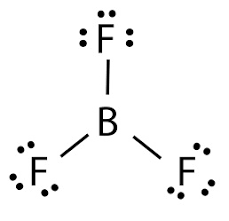
شبه فلزات در جدول تناوبی از نظر شیمیایی واکنشپذیر هستند و میتوانند با از دست دادن و گرفتن الکترون یون تشکیل دهند. آنها با نافلزات، ترکیبات گوناگونی را تشکیل میدهند. برای مثال، سیلیسیم با هالوژنها واکنش داده و سیلیسیم تترا هالید تشکیل میدهد. همچنین، بور نیز با ترکیب شدن با هالوژن فلوئور، ترکیب بور تری فلوئورید تشکیل میدهد.
مرتبه اکسایش
مرتبه اکسایش شبه فلزات میتواند بین اعداد ۳+، ۲+ و ۴- متغیر باشد. برای مثال، عنصر بور در ساختار بور تری فلوئورید، عدد اکسایش ۳+ دارد و سیلیسیم در ساختار سیلیسیم دی اکسید عدد اکسایشی برابر با ۴- دارد. آرسنیک و آنتیموان اعداد اکسایش ۳+ و ۵+ دارند.
پیوند کووالانسی
شبه فلزات پیوندهای کووالانسی تشکیل میدهند اما مانند فلزات معمولا یونهای تک اتمی تولید نمیکنند.
تولید آلیاژ
شبه فلزات میتوانند با سایر فلزات ترکیب شده و آلیاژ تشکیل دهند. آنتیموان با سرب ترکیب میشود و آلیاژ سرب- آنتیموان تشکیل میدهد. از این آلیاژ در تجهیزات نظامی استفاده میشود.

واکنش پذیری با اسیدها
بسیاری از شبه فلزات با شدت با اسیدها واکنش نمیدهند. برای مثال، سیلیسیم، ژرمانیم و پلونیم با بسیاری از اسیدها واکنش میدهند به دلیل اینکه لایهای اکسید روی سطح آنها را میپوشاند. با این وجود، شبه فلزاتی مانند آرسنیک و آنتیموان با اسیدهای اکسنده قوی مانند نیتریک اسید واکنش میدهند. اسید کلریدریک روی این شبه فلزات اثری ندارد.
ساختار شبه فلزات
وجود پیوند کووالانسی کلید ساختار کریستالی در شبه فلزات است. به همین علت، این مواد از لحاظ شیمیایی مانند نافلزات رفتار میکنند. برای مثال، آرسنیک و آنتیموان ساختاری لایهای مانند گرافیت دارند با این تفاوت که ساختار لایههای آنها مانند گرافیت صاف نیست. ساختار تلوریم زنجیرههای مارپیچ تشکیل میدهد. در تصویر زیر، شکل ساختاری این مواد را مشاهده میکنید.
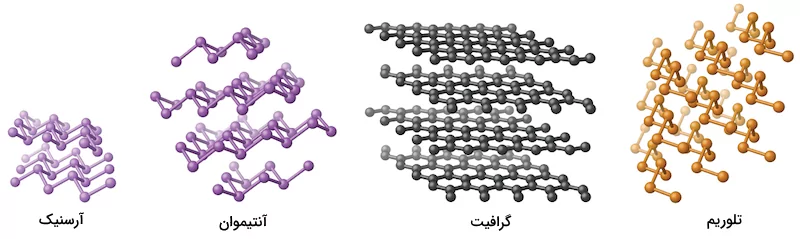
سیلیسیم و ژرمانیوم ساختاری کریستالی شبیه به الماس دارند. در مولکول این عناصر، هر اتم درون ساختار کریستالی با ۴ پیوند مجاور خود پیوند کووالانسی برقرار میکند. این اتمها، گوشههای یک چهاروجهی منتظم را تشکیل میدهند. کریستالهای تکی سیلیسیم و ژرمانیم نسبتا بزرگ هستند.
برای عنصر آرسنیک، آلوتروپهای فراوانی با ساختار لایهای وجود دارد. در این ساختارها، هر اتم آرسنیک با ۳ اتم مجاور خود پیوند کووالانسی تشکیل میدهد. ساختار کریستالی آنتیموان نیز مشابه آرسنیک است. ساختار تلوریم به شکل رشتههای مارپیچ است که در آنها هر اتم تلوریم با دو اتم مجاور خود پیوند کووالانسی برقرار کرده است.
ویژگی های شبه فلزات
در قسمتهای قبل خواص شیمیایی و فیزیکی شبه فلزات در جدول تناوبی را بررسی کردیم. در ادامه، ویژگی این مواد را برشمرده و با آنها بیشتر آشنا میشویم.
- شبه فلزات جامد هستند.
- درخشش این مواد مانند فلزات است.
- این مواد میتوانند جریان الکتریسیته را تا حدود کمتری از فلزات انتقال دهند.
- این مواد از نظر شیمیایی بیشتر شبیه نافلزات هستند و آنیون تشکیل میدهند.
- این مواد حالات اکسایش متعددی دارند و پیوند کووالانسی تشکیل میدهند.
- انرژی یونش این مواد و الکترونگاتیوی آنها مقادیری بین این خاصیتها برای فلزات و نافلزات را دارد.
گروه شبه فلزات در جدول تناوبی کوچکترین گروه عناصر هستند. در حالت کلی ۶ عنصر به عنوان شبه فلز همه جا شناخته شده هستند. این عناصر میتوانند بین ۳ تا ۶ الکترون در لایه ظرفیت خود داشته باشند. این تعداد الکترونهای لایه ظرفیت همان خاصیتی است که خواص شیمیایی این عناصر را تعیین میکند.
بور که در گروه ۱۳ جدول تناوبی قرار دارد و تنها ۳ الکترون ظرفیت دارد، بیشتر خواص فلزی دارد و کاتیون تشکیل میدهد. سایر شبه فلزات الکترون دریافت میکنند و بیشتر خواص نافلزی دارند. در ادامه، خواص هر یک از این مواد را به شکلی جداگانه بررسی میکنیم.
اسامی شبه فلزات در جدول تناوبی
همانطور که در قسمتهای قبل اشاره کردیم، اسامی شبه فلزات در جدول تناوبی شامل عناصر بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان، تلوریم، پلونیم و استاتین هستند. در ادامه خواص هر یک از این عناصر را به شکلی جداگانه بررسی خواهیم کرد.
بور
نماد شیمیایی عنصر بور (B) است و عدد اتمی آن برابر با ۵ است. آرایش الکترونی لایه ظرفیت عنصر بور به شکل است. بور در ترکیبات بسیاری مانند بوریک اسید، سدیم بورات و بور کاربید وجود دارد. همچنین، این عنصر آلوتروپهای متعددی دارد . برای مثال، بور آمورفوس (غیر متبلور) و بور کریستالی از این آلوتروپها هستند. به طور کلی، بور غیر متبلور رنگی قهوهای دارد و بور کریستالی، رنگی نقرهای – مشکی دارد و بسیار سخت است و در دمای اتاق هدایت کننده ضعیف جریان الکتریکی است.
بور یک عنصر بسیار فراوان است که میتوانند تعداد زیاد و متنوعی از ترکیبات را تشکیل دهد. برای مثال، یکی از ترکیباتی که عنصر بور تشکیل میدهد، بورو سیلیکات است که به عنوان شیشههایی که نسبت به حرارت مقاوم هستند استفاده میشود. رشتههای بور به دلیل استحکام بالایی که دارند به عنوان موادی سبک ولی محکم در ساختار هواپیماها، تورهای ماهیگیری و … استفاده میشوند. ترکیب سدیم تترا بورات به شکلی گسترده دز ساختار فایبرگلاس استفاده میشود. این ترکیب در ساختار شویندهها نیز استفاده میشود.
در تصویر زیر، شکل عنصر بور کریستالی را مشاهده میکنید.

عنصر بور دو ایزوتوپ پایدار B-11 و B-10 را دارد که به ترتیب ۸۰٫۴ و ۱۹٫۶ درصد فراوانی دارند. بور خالص بیشتر به عنوان سوخت احتراق به کار میرود اما از این عنصر در ترکیبات مختلف در صنایع بسیاری همچون صنایع پزشکی به عنوان یکی از مواد تشکیل دهنده قطره چشمی و ضدعفونی کنندهها استفاده میشود.
سیلیسیم
سیلیسیم یکی دیگر از شبه فلزات در جدول تناوبی است. این عنصر ظاهری براق و فلز مانند دارد و مانند نافلزات شکننده است. هدایت الکتریکی سیلیسیم مقداری بین فلزات و نافلزات دارد. عدد اتمی سیلیسیم ۱۴ است و نماد شیمیایی آن (Si) است. ساختار سیلیسیم شکننده و کریستالی است و درخششی آبی- خاکستری دارد. ظرفیت این عنصر برابر ۴ است. آرایش الکترونی لایه ظرفیت عنصر سیلیسیم به شکل است.
این عنصر که یک نیمههادی خوب است، در دماهای بالا جریان الکتریکی را به مقدار قابل قبولی از خود عبور میدهد. این عنصر در ساختار ۹۰ درصد پوسته زمین به شکل سیلیکات وجود دارد. سیلیسیم به شکل خالص در زمین تقریبا نایاب است اما در ساختار ماه و غبار کیهانی وجود دارد. از سیلیکات در تولید موادی مانند بتن، سرامیک و ظروف چینی به شکلی عمده استفاده میشود. سیلیسیم در ساختار چیپهای کامپیوتر و سایر وسایل الکترونیکی استفاده میشود. تصویر زیر نشاندهنده کریستالهای سیلیسیم است.

ژرمانیم
ژرمانیم یک جامد براق خاکستری-سفید است. چگالی این عنصر برابر با ۵٫۳۲۳ گرم بر سانتیمتر مکعب است و ساختاری سخت و شکننده دارد. ژرمانیم در دمای اتاق تقریبا واکنش ناپذیر است اما به آرامی در حضور اسید سولفوریک و اسید نیتریک غلیظ واکنش میدهد. این ماده همچنین با سدیم هیدروکسید مذاب واکنش داده و سدیم ژرمانات و گاز هیدروژن تولید میکند. دمای ذوب ژرمانیم ۹۳۸ درجه سانتیگراد است.
این عنصر یک نیمه هادی خوب است و در سطح زمین به شکل خالص یافت نمیشود. ژرمانیم اغلب کریستاله شده و ساختاری الماس مانند به خود میگیرد. این عنصر در فناوریهای مدرن و لوازم الکترونیکی استفاده میشود. همچنین از ژرمانیم در دستگاههای مادون قرمز، انرژی خورشیدی و تعداد زیادی از آلیاژهای مختلف استفاده میشود. تصویر زیر نشان دهنده یک قطعه ژرمانیم است.

عدد اتمی ژرمانیم برابر با ۳۲ است و با نماد شیمیایی (Ge) نشان داده میشود. ساختار ظاهری این ماده شبیه سیلیسیم است. این عنصر که در گروه کربن قرار دارد، خواص شیمیایی مشابه سیلیسیم و قلع دارد. ترکیبات حاوی ژرمانیم که در طبیعت یافت میشوند، در آب حل نمیشوند.
آرسنیک
آرسنیک جامدی خاکستری و درخشان است. چگالی این عنصر برابر با ۵٫۷۲۷ گرم بر سانتیمتر مکعب است و ساختاری شکننده دارد. این عنصر در دمای خشک پایدار است اما در حضور رطوبت هوا، لایهای طلایی-برنزی روی آن را میپوشاند. آرسنیک با سولفوریک اسید و نیتریک اسید واکنش میدهد. همچنین، از واکنش سود با آرسنیک، ترکیب سدیم آرسنات تولدید میشود. آرسنیک در دمای ۶۱۵ درجه سانتیگراد درچار میعان میشود و بخار آن رنگی زرد دارد و بوی سیر میدهد. این عنصر تنها در فشار ۳۸٫۶ اتمسفر و دمای ۸۱۷ درجه سانتیگراد ذوب میشود.
شبه فلز آرسنیک با نافلزها پیوند کووالانسی تشکیل داده و ترکیبات مختلفی را پدید میآورد. از این عنصر در آلیاژهای مختلف، صنعت الکترونیک و آفتکشها استفاده میشود. استفاده از این شبه فلز به علت سمی بودن ان درحال کاهش است. نماد شیمیایی عنصر آرسنیک (As) است و عدد اتمی آن ۳۳ است. این عنصر بیشتر در ترکیب با گوگرد و سایر فلزات یافت میشود اما به صورت کریستال خالص نیز وجود دارد.
از آرسنیک به دلیل خواص آفت زدایی که دارد به عنوان محافظ چوب استفاده میشود. با وجود سمی بودن این عنصر، مقادیر کمی از آرسنیک برای متابولیسم بدن انسان ضروری است. آرسنیک و ترکیبات آن خصوصا تری اسیدهای آرسنیک در صنعت کشاورزی و تولید آفتکشها، محافط چوب، و .. استفاده میشود. از آرسنیک به عنوان متابولیت تنفسی برخی از باکتریها نیز استفاده میشود. برای مثال، از آرسنیک در رژیم غذایی بزها، مرغها و برخی دیگر از گونهها بسیار حائز اهمیت است. در تصویر زیر، شکل آرسنیک را مشاهده میکنید.

آنتیموان
آنتیموان یک جامد سفید – نقرهای است که درخشش زیادی دارد. چگالی آن ۶٫۶۹۷ گرم بر سانتیگراد است و شکلی شکننده دارد. آنتیموان، رسانایی الکتریکی ضعیفی دارد. این شبه فلز در دمای اتاق در حضور رطوبت و بو در هوای خشک، پایدار است. آنتیموان در کنار سرب ، باعث افزایش سختی مخلوط میشود. این عنصر نقش مهمی در صنعت الکترونیک و نیمه هادیها دارد. آنتیموان را با نماد شیمیایی (Sb) نشان میدهند و عدد اتمی آن برابر با ۵۱ است.
حدود نصف آنتیموان موجود در صنایع مختلف در تولید باتریها، گلولهها، آلیاژها، سیمهای رابط و تجهیزات لولهکشی استفاده میشود. از آنتیموان در کنار سایر شبه فلزات میتوان در فناوریهای نیمه هادیها استفاده کرد. از آنتیموان از زمانهای قدیم در داروها و لوازم آرایشی استفاده میشده است.
آنیموان در طبیعت حدود نصف عنصر آرسنیک موجود است. آنتیموان ساختار اتمی مشابه آرسنیک دارد و سه الکترون در لایه ظرفیت آن وجود دارد. این عنصر معمولا با هالوژنهای بسیار واکنشپذیر، پیوند کووالانسی برقرار کرده و ترکیبات مختلفی را میسازد. از تری اکسیدهای آنتیموان در افزودنیهای موجود در مواد کنترلکننده آتش شامل هالوژن استفاده میشود. در دستگاههای نیمه هادی از این عنصر به عنوان آلاینده استفاده میشود. تصویر طیر، نشان دهنده کریستال آنتیموان است.

تلوریم
تلوریم یک جامد براق سفید – نقرهای و کمی سمی است. چگالی این عنصر برابر با ۶٫۲۴ گرم بر سانتیمتر مکعب است و از سایر شبه فلزات شناخته شده، نرمتر است. قطعات بزرگ تلوریم در دمای اتاق پایدار هستند. تلوریم پودری و خالص در حضور رطوبت هوا اکسید میشود. این عنصر با آب در حال جوشیدن واکنش داده و دی اسید و هیدروژن تولید میکند. عدد اتمی تلوریم برابر با ۵۲ است و با نماد شیمیایی (Te) نشان داده میشود.
تلوریم خواصی مانند آنتیموان دارد. این عنصر به شدت با گوگرد واکنش داده و در زمان سوختن شعلهای به رنگ سبز-آبی تولید میکند. تلوریم در صنعت به عنوان مادهای برای افزودن به فولاد استفاده میشود و میتواند با فلزاتی چون آلومینیوم، مس، قلع یا سرب آلیاژ تولید کند.
مانند آنتیموان، تلوریم نیز میتواند سایر فلزات را سخت کند اما همچنین میتواند روند خوردگی فلزات اشاره شده را نیز کاهش دهد. همچنین، تلوریم یک نیمههادی خوب است. این خاصیت تلوریم در حضور نور افزایش مییابد. رایجترین منبع تلوریم زغال سنگ است.
پلونیم
خواص فلزی پلونیوم بیشتر از خواص نافلزی آن است. این عنصر دو آلوتروپ دارد که هردو رسانای الکتریسیته هستند. فرم اکسید شده این عنصر در طبیعت بیشتر وجود دارد. هنوز مشخص نیست که این عنصر چکشخوار است یا شکننده است. بسته به ضریب الاستیسیته آن پیشبینی شده است که بیشتر چکشخوار باشد. این عنصر یک ساختار ساده کریستالی مکعبی دارد و هدایت الکتریکی و مقاومت در برابر شکنندگی کمی دارد.
پلونیوم در ترکیبات هالیدی که دارد، خواص نافلزی از خود نشان میدهد. پلونیوم اولین عنصر رادیواکتیوی بود که کشف شد. تمامی ترکیبات ساخته شده از پلونیوم پرتوزا هستند. از ترکیب پلونیم و برلیم به عنوان منبعی برای نوترون استفاده میشود. به علت پرتوهای آلفایی که این ماده از خود ساطع میکند، میتواند به عنوان منبعی برای تامین حرارت استفاده شود. این عنصر ایزوتوپ پایداری ندارد و تصاویر زیادی از این عنصر ارائه نشده است. تصویر زیر یک صفحه فولادی است که با لایه نازکی از پلونیوم پوشانده شده است.

استاتین
استاتین که در گرو هالوژنها در جدول تناوبی قرار دارد، بیشتر خواص نافلزی دارد اما به دلیل وجود برخی از خواص فلزی در این عنصر، گاها به عنوان شبه فلز شناخته میشود. بسیاری از نویسندهها و دانشمندان از خواص فلزی این عنصر و ساختار کریستالی آن صحبت کردهاند. از آنجا که هالوژنها با افزایش عدد اتمی، به خواص فلزی شان افزوده میشود، پیش بینی شده که استاتین در صورتی که بتواند فازی چگال داشته باشد، فلز خواهد بود.
استاتین در فاز مایع نیز میتواند یک فلز در نظر گرفته شود. این نظر به این علت است که مایعات با آنتالپی تبخیر بالاتر از ۴۲- کیلوژول بر مول، فلز در نظر گرفته میشوند. برخی از عناصر با این خاصیت شامل بور، سیلیسیم، ژرمانیم، آنتیموان، سلنیم و تلوریم هستند. استاتین نیز یک عنصر به شدت پرتوزا است و ایزوتوپ آن نیمه عمری برابر ۸٫۱ ساعت دارد. از ایزوتوپ At- 211 برای درمانهایی مانند رادیوتراپی استفاده میشود. به دلیل پرتوزا بودن و کمیاب بودن این عنصر، تصاویر مشخصی از عنصر به حالت خالص موجود نیست.
کاربرد شبه فلزات در جدول تناوبی
شبه فلزات ویژگیهای فیزیکی و شیمیایی متنوع و مهمی دارند که آنها را به عناصری مهم در صنایع مختلفی مانند صنایع نظامی، الکترونیک و کشاورزی تبدیل کرده است. این عناصر در نیمههادیها، شیشه و سرامیک، آلیاژها، سلولهای فوتوولتایی، پیشگیرندههای شعله آتش، مواد شیمیایی کشاورزی، سیلیکون رابر، و … استفاده میشوند. در ادامه هر یک از این کاربردها را توضیح خواهیم داد.
نیمه هادی ها
در قسمتهای قبلی اشاره کردیم که شبه فلزات خاصیت رسانایی بین نافلزات و فلزات را دارند به همین علت میتوانند در قطعات نیمههادی استفاده شود. سیلیسیم و ژرمانیم از مهمترین عناصری هستند که در تولید نیمه هادیها مورد استفاده قرار میگیرند. این نیمه هادیها در مدارهای مجتمع، چیپهای کامپیوتر و سلولهای خورشیدی به کار برده میشوند. خاصیت نیمه رسانایی این عناصر، نقشی مهم در الکترونیک دارد. نیمه هادیهای سیلیسیم در گوشیهای موبایل، کامپیوترها و بسیاری از دستگاههای دیگر کاربرد دارند.
شیشه و سرامیک
بور، سیلیسیم و آرسنیک به شیشه و سرامیک افزوده میشوند تا به عنوان عوامل شارش و مقاومت این مواد عمل کنند. شیشه بورسیلیکات، مانند پیرکس، در مقابل حرارت و شوک حرارتی بسیار مقاوم است. سیلیسیم و فسفر به لعاب سرامیک و سفال اضافه میشوند.
آلیاژها
شبه فلزاتی مانند سیلیسیم ، بور و آرسنیک به آلیاژها اضافه میشوند تا ویژگیهای آنها را بهبود ببخشند. به مخلوط این عناصر آلیاژ گفته میشود. افزودن آلومینیوم به سیلیسیم باعث افزایش میزان استقامت و قابلیت ریختهگری آن میشود. بور به آلیاژهای فولاد اضافه میشود تا میزان سختی و استقامت آن افزایش یابد. آلیاژهای سرب و آنتیموان در باتری و لحیمکاری استفاده میشود.
سلول های فتوولتایی
سیلیسیم و ژرمانیم در سلولهای خورشیدی که نور خورشید را به الکتریسیته تبدیل میکند، استفاده میشوند. سیلیسیم کریستالی و گالیم آرسنید بیشترین مواد استفاده شده در سلولهای خورشیدی هستند به دلیل اینکه این مواد به خوبی نور را جذب میکنند و گاف نواری مناسبی برای تبدیل نور به انرژی الکتریکی دارند. به سلولهای فتوولتایی، سلول خورشیدی نیز گفته میشود.
بازدارنده شعله
ترکیبات شامل شبه فلزات مانند آنتیموان تری اکسید، ترکیبات بور، آلومینیوم تری هیدرات و … به پلاستیکها، پارچهها و مواد ساختمانی اضافه میشوند تا از آنها در برابر آتش محافظت کنند. این مواد اضافه شده از فرایند احتراق جلوگیری کرده و میزان ایمنی این مواد در برابر آتش را افزایش میدهند.
مواد شیمیایی کشاورزی
آرسنیک در گذشته به عنوان آفتکش استفاده میشد اما به دلیل سمیت بالا و آسیبهای زیست محیطی، استفاده از آن ممنوع شد. سیلیسیم و بور به کودهای شیمیایی اضافه میشوند تا میزان رشد گیاهان و بازده برداشت را افزایش دهند. بور میزان سختی سلولهای گیاهی را افزایش میدهد، گرده افشانی گیاهان میوهدار را افزایش میدهد. میزان ظرفیت گیاهان را در برابر خشکسالی بهتر میکند. سیلیسیم میزان استقامت ساقه را افزایش میدهد و از برخی از دانهها مانند برنج در برابر عوامل بیماری زا محافظت کند.
سیلیکون رابر
در ساختار سیلیکون رابر، سیلیسیم با اکسیژن پلیمری میشود و یک ساختار پلیمری میسازد که زنجیره اصلی آن از سیلیسیم و اکسیژن تشکیل شده و شاخههای متیل دارد. از این ماده در مواد مختلفی مانند درزگیرها، روان کنندهها، عایقها و ظروف غذایی استفاده میشود.

سایر کاربردها
رشتههای بور به شدت سبک هستند و به اندازهای استقامت دارند که میتوان از آنها در تجهیزات فضانوردی استفاده کرد. بور کاربید یک ترکیب به شدت مقاوم است که از آن در زره تانک و تجهیزات حفاظتی استفاده میشود. ترکیبات تلوریوم و سلنیم در تولید پلاستیک، رنگ دانهها، مواد منفجره، روکشها، ضدقارچها و .. استفاده میشود.
یادگیری شیمی عمومی با فرادرس
شناخت اتمهای مختلف جدول تناوبی و ویژگیهای دستهبندی مختلف آنها مانند فلزات، نافلزات و شبه فلزات قدم اول در یادگیری شیمی عمومی و واکنشهای مواد است. با شناخت این ویژگیها و دستهبندیها میتوان به اطلاعات ارزشمندی مانند ایزوتوپها، آرایش الکترونی ، انواع پیوند شیمیایی و … دست یافت. پیشنهاد میکنیم برای آشنایی بیشتر با این مباحث و مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی عمومی دسترسی داشته باشید.
جمعبندی
در این مطلب از مجله فرادرس آموختیم شبه فلزات در جدول تناوبی بین محدوده فلزات و نافلزات قرار دارند. این مواد نسبت به نافلزات رسانایی الکتریکی و حرارتی بالاتری دارند ولی این ویژگیهای آنها به اندازه فلزات بالا نیست. شبه فلزات ظاهری براق و فلز مانند دارند اما شکننده و جامد هستند. ویژگیهای متنوع و متفاوت شبه فلزات، آنها را به عناصری پرکاربرد در صنایع مختلف تبدیل کرده است. این کاربردها مواردی مانند تولید آلیاژ، کاتالیستها، شیشه، سرامیک، مواد جلوگیری کننده از آتش، نیمههادیها و سایر وسایل الکترونیکی هستند.
source