برق کافت آب یا الکترولیز آب (Water Electrolysis)، فرآیندی شامل عبور جریان الکتریکی از آب و تجزیه آن به عناصر تشکیلدهنده آن یعنی هیدروژن و اکسیژن است. این فرآیند بهطور عمده در راستای تولید گازهای هیدروژن و اکسیژن خالص انجام میشود. برق کافت آب، روشی کاربردی در صنایع مختلف مانند صنایع غذایی، متالورژی، نیرورسانی و … است. در این مقاله از مجله فرادرس، قصد داریم فرآیند برق کافت آب را از جوانب مختلف و از نقطهنظر تولید هیدروژن دوستدار محیطزیست مورد ارزیابی قرار داده و نگاهی عمیقتر به روشها و اهداف انجام آن داشته باشیم.

در ابتدای این مطلب با برق کافت آب و اصطلاحات مربوط به آن آشنا شده و فرآیند آن را مرحله به مرحله بررسی میکنیم. سپس اساس فرآیند برق کافت آب را توضیح میدهیم و امکان انجام این فرآیند را از لحاظ ترمودینامیکی بررسی میکنیم. در ادامه الکترولیتهای این فرآیند را معرفی میکنیم و توضیح میدهیم چالشهای فرآیند برق کافت آب چیست. در ادامه انواع سیستمهای برق کافت آب را نام برده و توضیح میدهیم و روشهای افزایش راندمان این فرآیند را بررسی میکنیم. در نهایت نیز کاربردهای این فرآیند و تاریخچه آن را توضیح خواهیم داد. با مطالعه این مطلب تا انتها می توانید به شکلی جامع و کاربردی با فرآیند برق کافت آب آشنا شوید.
فرآیند برق کافت
در حالت کلی، فرآیند استفاده از جریان الکتریکی در جهت تحریک یک واکنش غیر خودبهخودی (Non-Spontaneous Reaction) را الکترولیز یا برقکافت (Electrolysis) میگوییم.
از روش برقکافت میتوانیم برای جداسازی یک ماده به اجزا (عناصر) اصلی آن استفاده کنیم. از طریق این روش تعدادی از عناصر موجود در جهان کشف شدند. در بیان سادهتر میتوانیم بگوییم برقکافت ، «شکافتن» (Splitting) یک مایع با استفاده از جریان الکتریکی مستقیم (DC-Direct Current) است. تصویر زیر نمایشی از فرآیند برقکافت است.

اجزای سازنده آب که شامل هیدروژن و اکسیژن است، جزو عناصر پرکاربرد هستند. بهعنوان مثال هیدروژن بهدست آمده از فرآیند برق کافت آب، بهعنوان منبع سوختی پاک، تجدیدپذیر و کارآمد مورد بهرهبرداری قرار میگیرد. هیدروژن الکترولیتی برای کاربردهای تخصصی که نیاز به هیدروژن با خلوص بالا دارند، بهعنوان مثال، در فرآوری مواد غذایی و تولید نیمه هادیها استفاده میشود.
در حال حاضر تقاضا برای هیدروژن، بهطور مداوم در حال افزایش است و سیستمهای برق کافت آب نیز بهطور قابل توجهی بهبود یافتهاند و انتظار میرود یکی از ابزارهای اصلی برای تولید مقدار زیادی هیدروژن در عصر اقتصاد هیدروژنی آینده (Hydrogen Economy Age) باشند. ولی با وجود پیشرفتهای اخیر در فناوریهای تولید هیدروژن تجدیدپذیر، همچنان نیاز به توسعه روشهایی با کارایی بیشتر برای رقابت اقتصادی با روشهای فعلی تولید هیدروژن از سوختهای فسیلی، وجود دارد. توسعه فنآوریهای تولید هیدروژن تجدیدپذیر، گامی حیاتی در حرکت به سوی آینده پایدار است.
فرآیندهای شامل برقکافت در ادامه نام برده شدهاند:
- پالایش الکتریکی (Electro-Refining): پالایش الکتریکی فرآیندی است که از برقکافت برای افزایش خلوص و کیفیت مس و بسیاری از فلزات دیگر استفاده میکند.
یادگیری شیمی دوازدهم با فرادرس
برق کافت آب یکی از آزمایشهای مفیدی است که به وسیله عبور جریان الکتریسیته از محلول برای انجام واکنش شیمیایی انجام میشود. فرآیندهای برقکافت و الکترولیز از فرآیندهای مهم شیمی برای تولید بسیاری از مواد و حتی برای تولید انرژی هستند. برای یادگیری فرآیند برقکافت باید با مفاهیمی مانند انتقال الکترون انواع سلولهای الکتروشیمیایی، سلولهای گالوانی، عدد اکسایش و واکنشهای الکتروشیمیایی آشنا شوید. پیشنهاد میکنیم برای یادگیری بهتر این مباحث به مجموعه فیلم آموزش دروس پایه دوازدهم بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که که لینک آنها در ادامه اورده شده است، می توانید به آموزشهای بیشتری در زمینه برق کافت آب دسترسی داشته باشید.
برق کافت آب
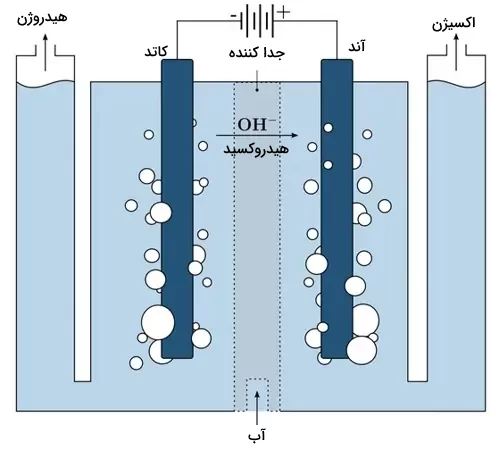
حال میخواهیم با بیانی کاملتر به فرآیند برق کافت آب بپردازیم. برق کافت آب، فرآیند تبدیل آب ()، به یونهای هیدروژن () و هیدروکسید ()، در اثر عبور جریان الکتریکی از آن است. بدینترتیب یونها به سمت الکترودهای مخالف حرکت میکنند و گازهای هیدروژن خالص () و اکسیژن () آزاد میشود.
این فرآیند، یک فرآیند اکسایش-کاهش یا در اصطلاح ردوکس (Redox) است. این واژه برگرفته از عبارت «Oxidation-Reduction« و غیر خودبهخودی است. از آنجاییکه در طی این فرآیند، گرما به شکل الکتریسیته (انرژی الکتریکی) وارد سلول الکترولیتی میشود، گرماگیر است.
آب خالص بهتنهایی جریان الکتریسیته را هدایت نمیکند و برای غلبه بر موانع فعالسازی، به انرژی اضافی نیاز داریم. بنابراین، برقکافت در حضور یک اسید انجام میشود تا با افزایش غلظت یون هیدروژن ()، هدایت الکتریکی بهبود یابد. در ادامه نمونههای چنین الکترولیتهایی را معرفی میکنیم.

آشنایی با اصطلاحات برقکافت
بعد از آشنایی کلی با مفهوم برقکافت و بهویژه برق کافت آب، اصطلاحات مهم تخصصی حیطه برق کافت آب را بررسی خواهیم کرد. این اصطلاحات در محتواهای مرتبط از جمله مقاله حاضر استفاده میشوند.
الکترولایزر یا یونیزه کننده
سیستم برقکافت یا الکترولایزر یا یونیزه کننده آب را میتوانیم بهعنوان تامینکننده برق بین دو الکترود، جهت تجزیه آب به هیدروژن و اکسیژن تعریف کنیم.
الکترولیت
مایع یا جامد غیرفلزی که یونها، اتمها یا مولکولهای باردار الکتریکی را برای حمل بارهای الکتریکی هدایت میکند و در بحث برق کافت آب در این مقاله، الکترولیت مایعی است که با عبور جریان الکتریسیته از آن «شکافته» یا تجزیه میشود.
باتری
باتری وسیلهای است که میتواند انرژی شیمیایی را به انرژی الکتریکی تبدیل کند.
آند و کاتد
در تعریف کلی باتریها و سلولهای الکترولیتی تعاریف زیر برقرار هستند.
- آند ورودی منفی باتری و الکترود با بار مثبت در سلول الکترولیتی است که ذرات باردار منفی را جذب میکند.
- کاتد ورودی مثبت باتری و الکترود با بار منفی در سلول الکترولیتی است که ذرات باردار مثبت را جذب میکند.
برای بررسی این موضوع که در فرآیند برق کافت آب، کدامیک از الکترودها آند یا کاتد، مثبت یا منفی، است، میتوانیم کلمه «PANIC» را بهعنوان رمز بهیاد داشته باشیم. این کلمه مخفف عبارت زیر است.
Positive Anode, Negative Is Cathode
آند مثبت، کاتد منفی است.
اگر مایعی رسانای الکتریسیته باشد، روابط زیر برقرار است.
- کاتدها الکترون میدهند.
- آندها الکترون میگیرند.
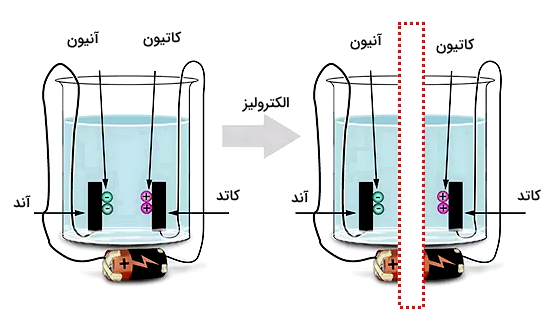
کاتیون ها و آنیون ها
در برسی یونهای مثبت و منفی میتوانیم نکات زیر را برای سهولت یادگیری به خاطر داشته باشیم.
- کاتیون یک اتم با بار مثبت، یا یک یون با بار مثبت است.
- آنیون یک اتم با بار منفی، یا یک یون با بار منفی است.
- کاتیونها به سمت کاتد شناور میشوند (حرکت) میکنند.
- کاتیونها مثبت هستند. در سلول گالوانی کاتد باید منفی باشد.
- آندها منفی هستند. در سلول گالوانی آند باید منفی باشد.
الکترود
در حالت کلی الکترود وسیلهای است که جریان الکتریسیته را هدایت میکند و برای برقراری تماس با قسمت غیرفلزی مدار الکتریکی یا تماس با واسطهای که سیگنال الکتریکی از طریق آن حرکت میکند، استفاده میشود. در فرآیند برق کافت آب الکترودها از ویژگیهای زیر برخوردارند.
- الکترودها بهطور معمول خنثی هستند.
- الکترودها معمولا از مواد بیاثر (واکنش ناپذیر) مانند گرافیت یا پلاتین ساخته میشوند.
اکسایش و کاهش
واکنشهایی که در سلولهای الکتروشیمیایی مانند سیستم فرآیند برق کافت آب اتفاق میافتند، از نوع اکسایش و کاهش هستند. در این واکنشها یک ماده الکترون تولید میکند و ماده دیگر الکترون دریافت میکند. در این فرآیندها باید نکات زیر را بهخاطر داشته باشیم.
- کاتدها الکترون میدهند. یعنی یک الکترون به عنصر نزدیک میدهند و آن عنصر یک الکترون بهدست میآورد.
- آندها الکترونها را از عنصر مجاور میگیرند. یعنی آن عنصر یک الکترون از دست میدهد.
- عنصری که یک الکترون از دست میدهد دچار اکسایش میشود.
- عنصری که گیرنده الکترون است، دچار فرآیند کاهش میشود.
نیم واکنش اکسایش و کاهش
واکنشهای اکسایش و کاهشی که در هر الکترود اتفاق میافتد را نیمواکنش (Half Equation) مینامیم.
بررسی مرحله به مرحله برق کافت آب
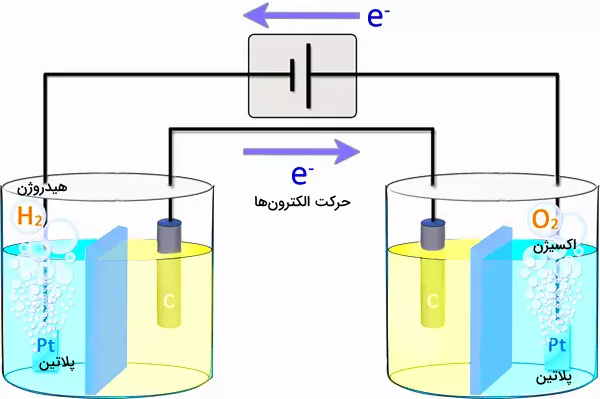
در این قسمت با نگاه سادهتری پدیده برق کافت آب را، قدمبهقدم بررسی خواهیم کرد. برای بررسی پدیده برق کافت آب، شیمیدانان شروع به قرار دادن الکترودها در داخل آب کردند تا ببینند با اتصال باتری جریان مستقیم (Direct-Current Battery) چه اتفاقی میافتد.
برای شبیهسازی این پدیده، دو الکترود را در محلول آب در نظر میگیریم.
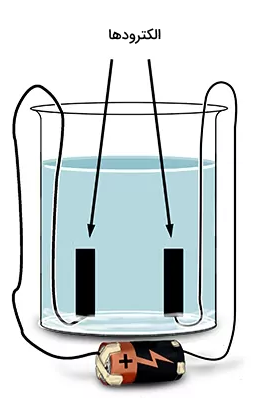
یک جریان مستقیم را که در تصویر بالا توسط یک باتری استاندارد تولید میشود، به دو الکترود وصل میکنیم. الکترودها از جنس گرافیت، بهعنوان یک ماده خنثی انتخاب شده و مایع محلول، آب است. هنگامیکه مدار روشن (برقرار) میشود، مشاهده میکنیم که حبابهایی روی هر دو الکترود تشکیل میشود که نشاندهنده تولید گاز است.

گازهای ایجاد شده را در لوله آزمایش جمعآوری و بررسی میکنیم تا ببینیم این گازهای بیرنگ، چه ماهیتی دارند.

پس از انجام برق کافت آب، گاز درون لولهها با ازمایشهایی بررسی میشوند. ماهیت این گازها هیدروژن و اکسیژن هستند.
جالب توجه است که بررسیها نشان میدهند حجم هیدروژن ایجاد شده، دو برابر اکسیژن است.
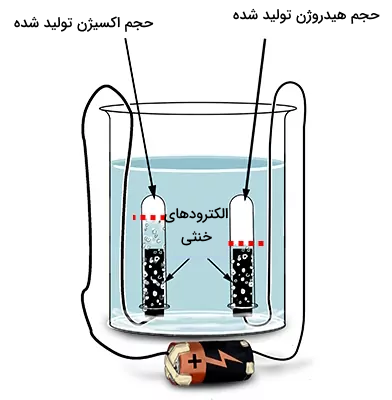
دلیل این امر آن است که در یک مولکول آب، به ازای هر اتم اکسیژن، دو اتم هیدروژن وجود دارد. همانطور که در فرمول نیز نشان داده میشود.
بررسی مرحله به مرحله برق کافت آب و کلرید سدیم
طبق روال بالا و برای یادگیری بهتر، پدیده برق کافت آب و کلرید سدیم (نمک) را نیز مورد بررسی قرار میدهیم. برای این منظور، مانند آزمایش قبل، الکترودها را در آب قرار میدهیم تا بررسی کنیم با اتصال باتری جریان مستقیم چه اتفاقی میافتد.

یک جریان مستقیم را به دو الکترود وصل میکنیم. در این مورد، الکترودها گرافیت که یک ماده غیرفعال است و مایع، آب نمک () است. در اینجا هم مجددا گازها را جمعآوری و آزمایش میکنیم تا بررسی کنیم چه گازی هستند. در اینجا نیز هردو گاز بیرنگ هستند.

لوله آزمایش الکترود مثبت (آند)
برای بررسی گازهای جمعآوری شده میتوانیم روش های مختلفی را بهکار بربریم. بررسی اسیدیته گازهای مجهول یکی از این روشها است. برای اینکار یک کاغذ تورنسل را در مجاورت گاز تولیدشده قرار میدهیم. کاغذ تورنسل آبی، مرطوب، قرمز و سپس سفید میشود. این علامتها که نشانهای از کلر بودن گاز است.

لوله آزمایش الکترود منفی (کاتد)
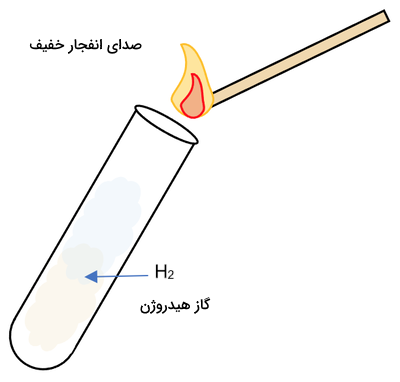
یکی دیگر از روشهای بررسی گاز مجهول، بررسی اشتعالپذیری آن است. برای اینکار میتوانیم شعلهای کوچک را به گاز درون لوله آزمایش نزدیک کنیم. آتل روشن باعث ایجاد صدای انفجار میشود که نشان میدهد گاز داخل لوله هیدروژن است.
اساس برق کافت آب
در قسمتهای قبل با فرآیندهای برق کافت آب و آبنمک آشنا شدیم. در ادامه، این فرآیندها را با جزئیات بیشتری تشریح خواهیم کرد.
- دو الکترود یا صفحه که از یک فلز خنثی مانند پلاتین () یا ایریدیم () ساخته شدهاند، در داخل آب قرار میگیرند.
- یک منبع برق به این صفحات متصل میشود.
- در کاتد، جاییکه الکترونها وارد آب میشوند، بخشی از هیدروژن تولید میشود و در سمت آند، اکسیژن تولید میشود.
- اگر بازده فارادی ایدهآل را در نظر بگیریم، هیدروژن دو برابر اکسیژن تولید میشود.
- مقدار تولید هر دو گاز اکسیژن و هیدروژن، با بار الکتریکی کل هدایت شده توسط محلول متناسب خواهند بود.
- در برخی از سلولها واکنشهای جانبی رخ میدهد و محصولات مختلف با راندمان فارادایی کمتر از حد ایدهآل تشکیل میشوند.
نمایش فرآیند برق کافت آب
در بسیاری از متون علمی نمایش سلول الکتروشیمیایی تهیه شده برای برق کافت آب به شکل زیر است.
درمورد آزمایش برق کافت آب باید موارد زیر را به خاطر بسپاریم.
- از برق کافت آب برای آموزش مفاهیم مهم و اساسی در شیمی استفاده میشود.
- در آزمایشات عملی برق کافت آب، دستیابی به نسبت ایدهآل ۲:۱ برای هیدروژن به اکسیژن دشوار است.
بررسی اثر الکترود و الکترولیتها در برق کافت آب
تصویر زیر آزمایشی را نشان میدهد که شامل چندین سلول برق کافت آب است که بهصورت سری بههم متصل شدهاند تا بهطور همزمان، اثرات مواد مختلف بهعنوان الکترود و الکترولیت را در برق کافت آب به نمایش بگذارند.
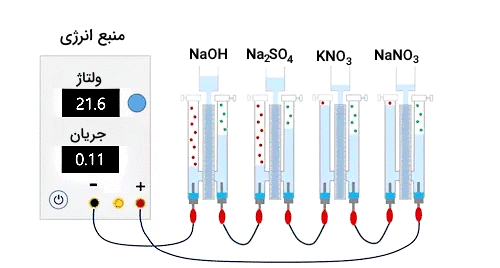
نتایج بررسی
پس از انجام آزمایش ذکر شده، میتوان به نتایج زیر دست یافت.
- حجم اکسیژن، به هنگام استفاده از فولاد ضدزنگ و آندهای گرافیت، که در الکترولیتهای حاوی آنیونهای و خورده میشوند، در مقایسه با آندهایی که در حضور الکترود پلاتین مقاوم هستند، کمتر بود.
- حجم هیدروژن در حضور آنیونهای ، که بهطور کاتالیزوری بر روی کاتدهای فولاد ضد زنگ و گرافیت کاهش مییابد، بهطور قابلتوجهی کمتر از آنهایی بود که با کاتد پلاتین غیرکاتالیزکننده بهدست میآیند.
- پدیدههای بالا، به واکنشهای جانبی نسبت داده میشوند که بخشهایی از الکترونهای در نظر گرفته شده برای برق کافت آب را مصرف میکنند.
- این نمایش میتواند به ما کمک کند تا متوجه شویم نتایج تجربی برق کافت آب میبایست بهدقت تفسیر شوند. زیرا ممکن است شامل مشارکتی از واکنشهای جانبی الکترود باشند.
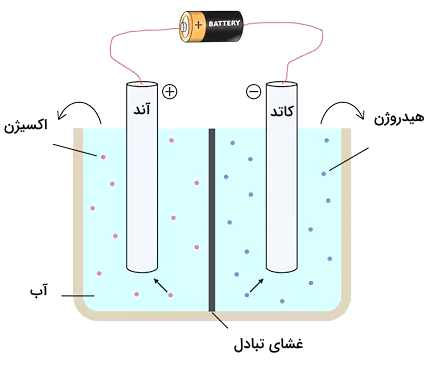
امکان سنجی ترمودینامیکی برق کافت آب
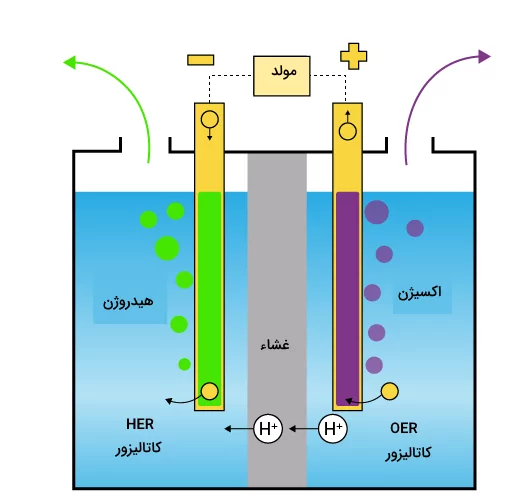
در قسمتهای قبل آموختیم برق کافت آب در یک سلول الکترولیتی متشکل از یک آند با بار مثبت و یک کاتد با بار منفی که معمولا از پلاتین ساخته شده است، رخ میدهد. بهطور کلی، واکنش کلی برق کافت آب را میتوان به دو نیم واکنش نیمسلولی که در کاتد و آند رخ میدهد تقسیم کرد.
- واکنش تکامل هیدروژن (Hydrogen Evolution Reaction) واکنشی است که در آن آب در کاتد برای تولید () کاهش مییابد
- واکنش تکامل اکسیژن (Oxygen Evolution Reaction) واکنشی است که در آن آب در آند اکسید میشود و () تولید میکند.
حال برای بررسی موضوع، به نیمواکنشهای فرآیند برق کافت آب خالص در شرایط خنثی، pH = ۷ و دمای ۲۵ درجه سانتیگراد توجه کنید.
- نیمواکنشها در کاتد به شکل زیر هستند.
- نیمواکنشها در آند به شکل زیر هستند.
- واکنش کلی در برق کافت آب بهصورت زیر خواهد بود.
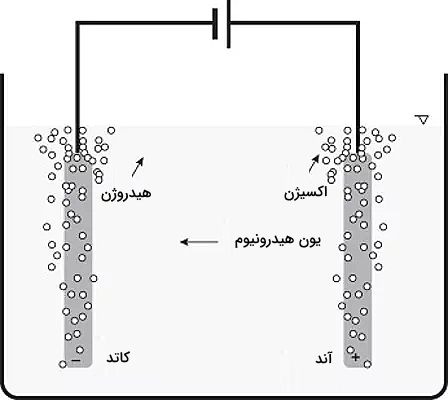
واکنشهای بالا نیز جدا شدن هیدروژن و اکسیژن از آب را نشان میدهد. به ازای هر دو مول آب، دو مول هیدروژن و یک مول اکسیژن آزاد میشود. تعداد مولهای هیدروژن تولید شده دو برابر اکسیژن است. همچنین بارها بین الکترودها و الکترولیت به ترتیب زیر منتقل میشوند.
- به ازای هر مول هیدروژن، ۲ الکترون از کاتد به الکترولیت منتقل میشود.
- به ازای هر مول اکسیژن، ۴ الکترون از الکترولیت به آند منتقل میشود.
در تصویر زیر این انتقالات به خوبی نمایش داده شدهاند.
واکنشهای این انتقالات به شکل زیر است.
الکترولیت برای برق کافت آب
انتخاب الکترولیت مناسب در فرآیند برق کافت آب، بسیار مهم است و در انتخاب آن باید به موارد زیر توجه داشته باشیم.
- اگر یک آنیون الکترولیت، پتانسیل الکترودی استاندارد کمتری نسبت به هیدروکسید داشته باشد، بهجای هیدروکسید اکسید میشود و اکسیژن تولید نخواهد شد.
- در مورد کاتیون، اگر پتانسیل الکترود استاندارد بیشتری نسبت به یون هیدروژن داشته باشد، کاهش مییابد. در این صورت گاز هیدروژن تولید نخواهد شد.
چالش های فرآیند برق کافت آب
در کنار کاربردی بودن فرآیند برق کافت آب، به دلایل زیادی انجام آن آسان نیست. در ادامه بررسی میکنیم چالشهای برق کافت آب چیست.
- پتانسیل سلولی برق کافت آب خالص، منفی بوده و از این رو از نظر ترمودینامیکی نامطلوب است.
- بهدلیل غلظت کم یونها و واسطههای ارتباطی که الکترونها از آن عبور کنند، به یک ولتاژ اضافی (Overvoltage) تا حدود ۰.۶ ولت در هر الکترود نیاز خواهیم داشت.
- در عمل، برقکافت مداوم آب خالص، فقط در ولتاژ خارجی ۲.۴ ولت امکانپذیر است.
- از آنجاییکه برق کافت آب خالص، از نظر ترمودینامیکی غیرممکن است، روشهایی برای امکانپذیر ساختن آن از نظر سینتیکی در حال بررسی است.
- یکی از روشهای مذکور برای امکانپذیری سینتیکی، افزایش رسانایی، با افزایش تعداد یونهای موجود به وسیله افزودن اسید، باز یا نمکهای خنثی است.
- آب، در حد بسیار ضعیفی به یونهای هیدروژن و هیدروکسید تجزیه میشود و میدانیم فرآیند برقکافت ، مستلزم حاملهای بار برای جریان است. بنابراین، آبی با مقدار بسیار کمی یون، رسانای خوبی برای الکتریسیته نیست و درنتیجه برق کافت آب خالص، یک فرآیند بسیار کند خواهد بود.
- یون هیدروژن، با سایر مولکولهای آب در تماس است و بهصورت یون هیدرونیوم وجود دارد. در نتیجه، هر یون هیدروکسیدی که بهسمت آند حرکت میکند، حتی قبل از رسیدن به آند، توسط یون هیدرونیوم خنثی شده و گاز اکسیژن تشکیل میدهد. بهطور مشابه، هر یون هیدروژن موجود توسط یون هیدروکسیل موجود در نزدیکی کاتد خنثی میشود و به هیدروژن کاهش نمییابد. بنابراین، میزان بازدهی در برق کافت آب به هیدروژن و اکسیژن بسیار کمتر خواهد بود.
گفتیم یکی از موانع مهمی که مانع از تقسیم آب میشود، سینتیک واکنشی کند OER و HER، بهدلیل پتانسیلهای زیاد و معیاری از موانع انرژی جنبشی است. بنابراین، کاتالیزور نقش مهمی را در OER و HER ایفا میکند. کاتالیزورهای بسیار موثری در راستای به حداقل رساندن مازاد پتانسیل برای OER و HER، در جهت تولید کارآمد و مورد نیاز است.
آندها و کاتدهای پوشش داده شده با کاتالیزور پلاتین/ایریدیوم میتواند نمونهای از مواد الکترودی در برخی از سیستمهای برقکافت باشد که فعالیت الکتروشیمیایی قابل قبولی را نشان داده و طول عمر را در الکترولیتهای اسیدی بهینه میکنند. نمونهای از این الکترودها را در تصویر میبینیم.

انواع سیستم های برق کافت آب
سلول الکترولیتی مورد استفاده برای برق کافت آب، بهعنوان الکترولایزر (Electrolyzer) یا یونیزهکننده شناخته میشود. بر اساس انتقالدهنده الکترولیت، میتوانیم آن را به سه نوع اصلی طبقهبندی کنیم که در ادامه اورده شده است.
- سیستم برق کافت آب قلیایی (AWE) با الکترولیت مایع
- سیستم برقکافت غشای تبادل پروتون (PEM) یا سیستم برقکافت غشای الکترولیت پلیمری با مونومر اسیدی
- سیستم برقکافت اکسید جامد (SOE)
- سیستم برقکافت بخار با دمای بالا (HT) با یک اکسید جامد بهعنوان الکترولیت
اساس فرآیند کلی در هر سه فناوری یکسان است.این فرآیند برای یک سلول برقکافت اسیدی در شکل زیر نشان داده شده است و این روشها عمدتا بر اساس روش انتقال یون یا نوع الکترولیت انتخابی متفاوت هستند. اصل اساسی در همگی روشها به این صورت است که آب در یک سلول الکتروشیمیایی تغذیه میشود که در آن هیدروژن در الکترود منفی (کاتد) و اکسیژن در الکترود مثبت (آند) بوده و ولتاژی بهاندازه کافی بالا، به سلول اعمال میشود.
نکات مهمی که در این راستا لازم است نظر داشته باشیم، در ادامه آورده شده است.
- سیستمهای یونیزه کننده یا برقکافت قلیایی (AWE) در مقایسه با سایر سیستمها رایجتر هستند و برای دههها بهخوبی بهعنوان یک فناوری صنعتی پذیرفته شدهاند.
- سیستم برقکافت SOE از نظر الکتریکی کارآمدتر است. اما همچنان در حال توسعه هستند.
- سیستمهای PEM کارآمدتر از سیستم AWE هستند. اما هزینه آنها بسیار بالاتر است.
- سیستم قلیایی (AWE) در مقایسه با سایر سیستمها کمترین هزینه را دارند.
در ادامه نگاه کاملتری به هریک از این سیستمها خواهیم داشت.
سیستم برقکافت AWE
تولید هیدروژن با الکترولایزر آب قلیایی برای اولین بار توسط Troostwijk و Diemann در سال ۱۷۸۹ معرفی شد و در حال حاضر یک فناوری بهخوبی شناخته و تثبیت شده است. شکل زیر، تصویری کلی از یک سیستم برق کافت آب قلیایی را نشان میدهد.
این سیستم با داشتن دو الکترود در محلول الکترولیت قلیایی مایع، که عموما هیدروکسید پتاسیم یا سدیم (KOH یا NaOH) است، کار میکند. الکترودها توسط یک دیافراگم، جاییکه انتقال یونهای هیدروکسید () از یک الکترود به الکترود دیگر انجام میشود، از هم جدا میشوند. بنابراین، فرآیند در کاتد، یعنی محل احیا، آغاز میشود که در آنجا دو مولکول از محلول آب قلیایی به یک مولکول هیدروژن () کاهش یافته و دو یون هیدروکسیل () تولید میشود.
هیدروژن تولید شده از سطح کاتد خارج میشود تا به شکل گازی دوباره ترکیب شود و این در حالی است که یونهای هیدروکسیل از طریق دیافراگم متخلخل (Porous Diaphragm) و تحت تاثیر پتانسیل الکتریکی تحمیلی به آند منتقل میشوند. در اینجا نیز مانند فرآیند قبل، واکنش مشابهی رخ میدهد. دو مولکول آب اکسید میشوند و یک مولکول اکسیژن دو اتمی () و چهار اتم هیدروژن را تشکیل میدهند که این نیمواکنشها در قسمت بعدی نشان داده میشوند.
بررسی واکنشهای سیستم AWE
واکنشهای انجام شده در این نوع سیستم را میتوانیم بهقرار زیر در نظر داشته باشیم.
- واکنش کاهش در کاتد
- واکنش اکسایش در آند
همچنین، در این فرآیند باید به نکات زیر توجه داشته باشیم.
- الکترولیز قلیایی معمولا در دماهای پایین، حدود ۳۰ تا ۸۰ درجه سانتیگراد، عمل میکند و همانطور که در تصویر مشاهده میکنیم، از یک محلول آبی بهعنوان الکترولیت استفاده میکند.
- دیافراگم معمولا از آزبست (Asbestos) و الکترودها از نیکل ساخته میشود.
- این دیافراگم در وسط سلول، همان چیزی است که طرف کاتد را از طرف آند جدا میکند و از اختلاط گازهای تولید شده جلوگیری میکند.
- هیدروکسید سدیم یا پتاسیم آبی رقیق که در برقکافت استفاده میشود، یونهای هیدروکسید را برای تشکیل اکسیژن به آند میرساند.
- سیستمهای قلیایی معمولا برای تولید هیدروژن در مقیاسهای بزرگ مورد استفاده قرار میگیرند.
- الکترولیتهای این سیستم به دو نوع تقسیم میشوند. با درصد وزنی ۲۰ تا ۴۰ درصد و و
- هیدروژن و هیدروکسید در کاتد تولید میشوند. سپس هیدروکسید به قسمت آند منتقل میشود و اکسیژن تولید میکند.
- راندمان این نوع سیستمها ۵۰ تا ۶۰ درصد گزارش شده است.
چالش های سیستم برقکافت AWE
برخی از چالشهای این سیستم در ادامه توضیح داده شدهاند.
- خوردگی که چالش اصلی این سیستم است.
- چگالی جریان محدود، فشار عملیاتی کم و راندمان انرژی پایین.
سیستم برقکافت غشای تبادل پروتون (PEM)
برای به حداقل رساندن مشکل خوردگی سیستمهای قلیایی از این سیستم استفاده میشود که در ادامه به برخی از ویژگیهای مختلف آن اشاره میکنیم.
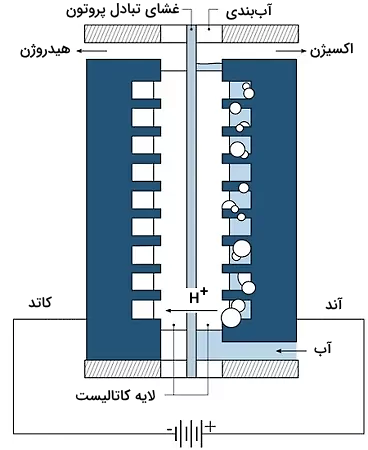
- غشای پلیمری جامد مانند نفیون (Nafion) برای استفاده در فناوری پیل سوختی «PEM» مورد بررسی قرار گرفته است.
- آب دیونیزه شده بسیار خالص برای این فرآیند مورد نیاز است.
- اکسیداسیون آب در قسمت آند با آزادسازی اکسیژن اتفاق میافتد.
- الکترونها و پروتونها از طریق غشاء به قسمت کاتد منتقل شده و سپس گاز هیدروژن در قسمت کاتد تولید میشود.
- هزینه ساخت بالا چالش اصلی این روش است.
بررسی واکنشهای سیستم PEM
واکنشهای انجام شده در این سیستم عبارتند از:
سیستم برقکافت اکسید جامد (SOE)
دونیتز (Dönitz) و اردل (Erdle)، اولین کسانی بودند که سیستم برقکافت اکسید جامد را در دهه ۱۹۸۰ توسعه دادند. این روش بهدلیل فرآیند تبدیل انرژی الکتریکی به انرژی شیمیایی، همراه با راندمان بالای تولید هیدروژن خالص، توجه زیادی را به خود جلب کرده است. این سیستم در فشارها و دماهای بالا عمل میکند. در شکل پایین یک تصویر شماتیک از این سیستم را میبینیم.
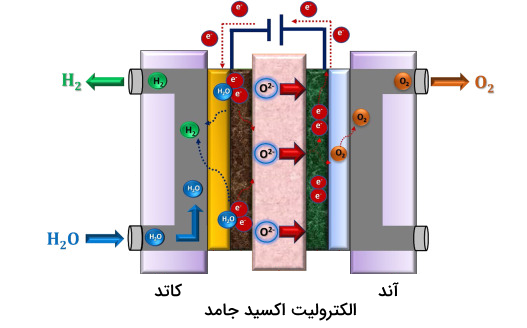
بررسی واکنشهای سیستم SOE
واکنشهای انجام شده در این سیستم، به شکل زیر هستند.
مقایسه سیستمهای برقکافت
در جداول پایین، مقایسه کلی بین سیستمهای مورد بررسی و جنبههای مختلف هریک را نشان میدهد.
مزایای هریک از سیستمها
| SOEL Demonstration | PEMEL / نزدیک به تجاری | AEL / تجاری |
| بازدهی بالا | بالاترین خلوص | هزینه سرمایه کم |
| فشار کم | طراحی فشرده | کاتالیزور ارزان |
| مصرف کم انرژی | نرخ تولید بالا | دوام بالا |
| بدون نیاز به کاتالیزور فلز نجیب | —- | عملکرد پایدار |
معایب هریک از سیستمها
| SOEL Demonstration | PEMEL / نزدیک به تجاری | AEL / تجاری |
| طراحی بزرگ | هزینه بالای قطعات کمیاب | سیستم خورنده |
| دوام کم | محیط اسیدی | کمترین خلوص |
| ناحیه سلولی کوچک | فشار بالا | مصرف انرژی بالا |
| درجه حرارت بالا | —- | —- |
افزایش راندمان برق کافت آب خالص
برای برق کافت آب خالص، معمولا مقدار اضافی انرژی به شکل مازاد پتانسیل جهت غلبه بر موانع فعالسازی مختلف مورد نیاز است. این انرژی اضافی بسیار مهم است. زیرا بدون آن، این فرآیند بسیار کند اتفاق میافتد و گاهی اوقات اصلا اتفاق نمیافتد. خود یونیزاسیون محدود آب نیز دلیلی بر این امر است.
علاوهبراین، هدایت الکتریکی آب خالص حدود یک میلیونم رسانایی الکتریکی آب دریا است. در چنین مواردی میتوان با استفاده از یک الکترولیت مناسب مانند نمک، اسید یا باز همراه با الکتروکاتالیستها، راندمان برقکافت را افزایش داد که میخواهیم نگاهی به این موارد داشته باشیم.
برق کافت آب با استفاده از کاتالیزورهای الکتریکی
الکترو کاتالیزورها موادی هستند که بدون آن که خود در واکنش مصرف شوند، واکنشهای الکتروشیمیایی را تسریع میکنند. مانند کاتالیزور در واکنشهای شیمیایی. کاتالیزورها واکنش را از طریق مسیر متفاوتی با انرژی فعالسازی کمتر انجام میدهند. توانایی کاتالیزور در افزایش واکنشپذیری، در دارا بودن سطح بالا و مراکز فعالسازی بزرگتر است.
عوامل مختلفی موجب افزایش بازده الکترود میشود که در ادامه به برخی از آنها اشاره شده است.
- فعالیت الکترود خنثی مانند پلاتین را میتوان با اصلاح سطح افزایش داد.
- افزایش سطح با نانوذرات یا آلیاژسازی با عناصر بلوک دی (d-block) کاتالیزوری و تغییر حالت الکترونیکی پوشش داده شده با سایر مواد کاتالیزوری برای افزایش بازده برقکافت
- پوشش سطح الکترود با مواد فعال کاتالیزوری، مانند آنزیمها
برق کافت آب در حضور اسیدها (pH کمتر از ۷)
یونهای هیدروژن اضافی از اسید در کاتد کاهش مییابد. در حالیکه آب در آند اکسید میشود. نیمواکنشها در یک محیط اسیدی به شکل زیر هستند.
2O → (g) + 4H+ + 4e–
واکنش خالص بهصورت زیر نوشته میشود.
برقکافت با پتانسیل بسیار کمتر از آب خالص (۲.۴ ولت) انجام میشود.
برق کافت آب در حضور یک باز ( بالاتر از ۷)
یونهای هیدروکسیل اضافی الکترونهای خود را به آند آزاد میکنند، در حالیکه الکترونهای موجود در کاتد، مولکولهای آب را در نزدیکی آن اکسید میکنند. نیمواکنشهای برقکافت در حضور یک باز به شرح زیر است:
واکنش خالص بهصورت زیر نوشته میشود.
همانند برقکافت در محیط اسیدی، برقکافت در محیط بازی نیز به پتانسیل بسیار کمتری نیاز دارد.
برق کافت آب در حضور نمک
نمکها در آب ۱۰۰% به کاتیونها و آنیونها تجزیه میشوند و از این رو غلظت یونی را برای افزایش رسانایی افزایش میدهند. اما کاتیونها و آنیونهای نمک نیز به سمت الکترودها جذب میشوند و از این رو به رقیبی برای تجزیه آب در تولید هیدروژن و اکسیژن تبدیل میشوند. بنابراین انتخاب نمکهایی با یونهای غیر رقابتی ضروری میشود.
- نمکهای حاوی پتانسیل الکترودی استاندارد کمتر از یونهای هیدروژن و هیدروکسید برای برق کافت آب مناسب هستند.
- یونهای عناصر گروه اول و دوم (Li، Na، K، Mg، Ca، Ba و …) پتانسیل استاندارد کمتری نسبت به یونهای هیدروژن دارند و کاهش نمییابند و اجازه میدهند یون هیدروژن از آب به هیدروژن برسد.
- آنیونهای غیرواکنشی مانند یونهای نیترات و سولفات، پتانسیل کاهِ استاندارد کمتری نسبت به یونهای هیدروکسید دارند.
- اکسیداسیون سولفات به پراکسی سولفات، دارای پتانسیل کاهش ۲.۱ است.
- ترکیبات یونی پلیمری جامد و غیرمحلول نفیون (Nafion) به برق کافت آب در کمتر از ۱.۵ ولت کمک میکنند.
بررسی فرآیندهای برق کافت آب و نمک طعام
در این قسمت نگاه کاملتری به فرآیند برقکافت نمک طعام و آب داشته و فرآیندهای آن را مورد تجزیه و تحلیل بیشتر قرار میدهیم.
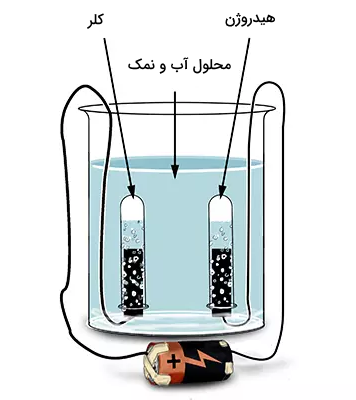
عناصر مشارکتکننده در فرآیند
در ادامه عناصر مشارکت کننده در این فالیند را به شکل مرحله به مرحله به همراه تصویر بررسی میکنیم.
برای یادگیری بیشتر در مورد فرآیندهای الکتروشیمیایی میتوانید فیلم آموزشی الکتروشیمی کاربردی که لینک آن در ادامه آورده شده است را مشاده کنید.
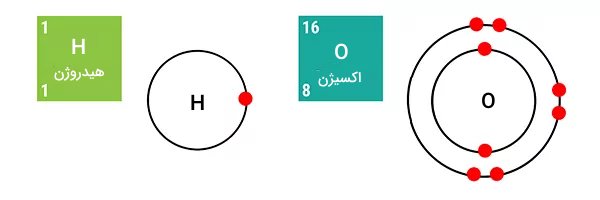
در اولین مرحله و عنصر اکسیژن و هیدروژن که اطلاعات آنها در صویر زیر آمده است در فرآیند شرکت میکنند.
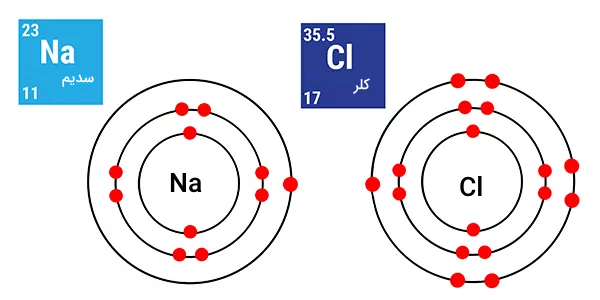
همچنین عناصر سدیم و کلر نیز که ساختار نمک را تشکیل میدهند در تصویر زیر مشخص شدهاند.
مولکولهای مشارکتکننده در فرآیند
فعل و انفعالات در مولکولهای فرآیند، بهشرح تصویر زیر خواهد بود.
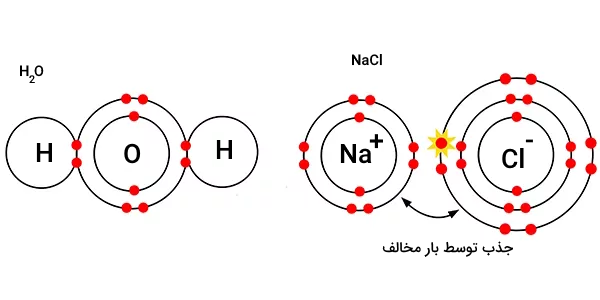
و با حل شدن در یکدیگر، در محلول،فرم یونها به شکل زیر خواهد بود.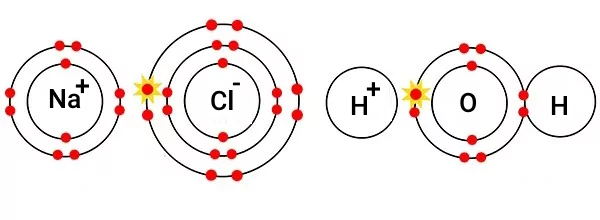
کاتد
در کاتد این فرآیند هیدروژن آزاد میشود.
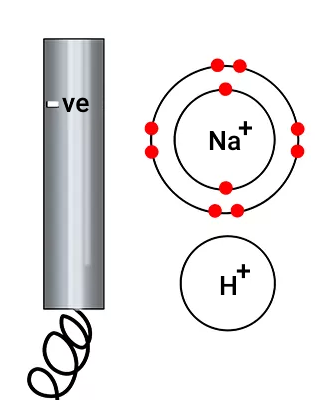
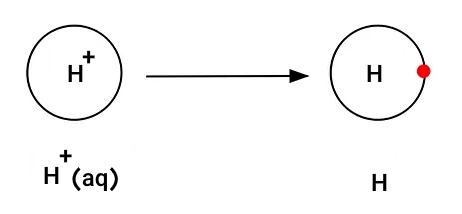
هیدروژن در کاتد تشکیل میشود و سدیم تشکیل نمیشود. زیرا سدیم واکنشپذیرتر از هیدروژن است. بنابراین در کاتد الکترونها به یونهای هیدروژن داده میشوند.
از آنجاییکه هیدروژن همیشه بهصورت جفت، مانند گاز دو اتمی، ظاهر میشود، اکنون دو اتم هیدروژن با هم ترکیب شده و گاز هیدروژن را تشکیل میدهند.
نیمواکنشهای کاتدی
نیمواکنشها در کاتد به شکل زیر هستند.
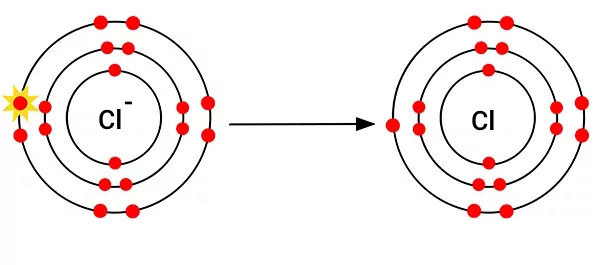
آند
در آند فعل و انفعالات زیر را خواهیم داشت.
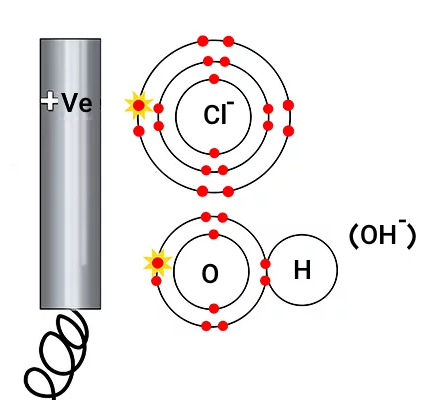
باید دقت داشته باشید که یک هالوژن () در آند تشکیل میشود و هیدروکسید () در آن آزاد نمیشود.
بنابراین در آند الکترونها از کلر خارج میشوند.
اما از آنجاییکه کلر همیشه بهصورت جفت، مانند گازهای دو اتمی، در اطراف گردش میکند، اکنون دو اتم کلر با هم ترکیب شده و گاز کلر را تشکیل میدهند.
نیمواکنشهای آندی
نیمواکنش بهقرار زیر خواهد بود:
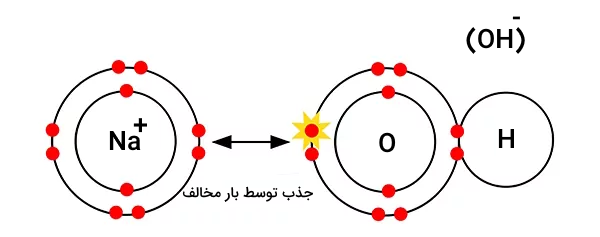
یونهای سدیم و هیدروکسید فقط با هم ترکیب میشوند تا یا () ایجاد کنند.
توجه
در این مطلب از مجله فرادرس، به توضیح انواع واکنشهای اکسایش و کاهش پرداختهایم و مثالها و تمیرینهایی برای این مبحث ارائه کردهایم.
کاربردها
همانطور که در مقدمه اشاره کردیم، فرآیند برق کافت آب، یکی از فرآیندهای پرکاربرد در صنعت است که در ادامه این مطلب از مجله فرادرس به برخی از کاربردهای آن اشاره میکنیم.
- تولید اکسیژن در ایستگاههای فضایی بین المللی
- هیدروژن تولید شده بهعنوان محصول جانبی فرآیند کلر قلیایی، در ساخت مواد شیمیایی ویژه استفاده میشود.
- گاز هیدروژن تولید شده به این روش را میتوان بهعنوان سوخت هیدروژن مورد استفاده قرار داد.
- گاز هیدروژن تولیدی در این روش را میتوان به حالت مخلوط با اکسیژن، برای تولید گاز اکسیهیدروژن استفاده کرد که در جوشکاری و سایر کاربردها استفاده میشود.
- این فرآیند، حدود ۵ درصد از گاز هیدروژن تولید شده در سراسر جهان را تولید میکند.
- برق کافت آب برای تولید آب سنگین مورد استفاده قرار میگیرد.

در ادامه برخی از این کاربردهای را به شکلی کاملتر توضیح میدهیم.
برق کافت آب راهی برای تولید هیدروژن
هیدروژن، جایگزینی برای سوختهای فسیلی است که میتواند راه پاکتری برای تامین انرژی در جهان باشد. انرژی هیدروژنی، شامل استفاده از هیدروژن و ترکیبات حاوی هیدروژن، در راستای تولید انرژی برای مصارف عملی مورد نیاز، با بهرهوری بالا بوده و دارای مزایای زیستمحیطی و اجتماعی زیادی بوده و بهلحاظ اقتصادی نیز دارای مزایای رقابتی است.

چهار منبع اصلی برای تولید هیدروژن عبارتند از:
- گاز طبیعی
- نفت
- زغال سنگ
- برق کافت آب
با این حال، برق کافت آب از طریق جریان الکتریکی عبوری، فناوری کلیدی برای تولید «هیدروژنِ بدون کربن» است.
با استفاده از یک منبع انرژی تجدیدپذیر، برق کافت آب برای تولید هیدروژن در مقیاس بزرگ، بهعنوان یکی از امیدوارکنندهترین گزینهها در گذار به اقتصاد کربن خنثی (Carbon-Neutral Economy) ظاهر میشود. چرا که میدانیم در این فرآیند، آب تحت تاثیر الکتریسیته، بدون انتشار کربن (صفر درصد کربن)، به هیدروژن () و اکسیژن () تجزیه میشود.
آب سنگین
آب سنگین با برقکافت طولانی مدت آب قلیایی تهیه میشود. آب سنگین همان آب معمولی است. با این تفاوت که دو اتم هیدروژن () مولکول آب با دو اتم دوتریوم () (Deuterium Atoms) جایگزین میشوند. به این ترتیب، گاهی برای آب سنگین از نماد بهجای استفاده میشود. از آنجاییکه دو نوترون اضافی دارد، آب سنگین تقریبا ۱۰ درصد سنگینتر از آب معمولی است.
کاربردهای آب سنگین
آب سنگین که با برق کافت آب تحت شرایط خاصی تولید میشود، دارای کاربردهای وسیعی است که به برخی از آنها اشاره میکنیم.
- برای تهیه دوتریوم از آب سنگین استفاده میشود.
- دوتریوم بخشی جداییناپذیر از راکتورهای هستهای آب سنگین است که در آن بهعنوان خنککننده و بهعنوان تعدیلکننده نوترونی استفاده میشود.
- از آن بهعنوان ردیاب برای مطالعه مکانیسم تنفس و فتوسنتز استفاده میشود.
- از در طیفسنجی NMR (رزونانس مغناطیسی هستهای)، برای مشاهده میدانهای مغناطیسی اطراف هسته اتمها استفاده میشود.
- ایزوتوپولوژی (Isotopologues) بسیاری از ترکیبات آلی با کمک اکسید دوتریوم تهیه میشود.
- آب سنگین اغلب بهجای آب معمولی در طیف سنجیIR (مادون قرمز) استفاده میشود.
- بهعنوان تعدیل کننده در راکتور هستهای برای کاهش سرعت نوترونها استفاده میشود. به این صورت که میتواند سرعت حرکت نوترونهای سریع را کاهش دهد و آنها میتوانند بهجای ایزوتوپ ۲۳۸U با ایزوتوپ ۲۳۵U واکنش دهند.
- میزان متابولیسم در انسان و حیوان با کمک مخلوطی از و آب با اکسیژن سنگین آزمایش میشود.
- تریتیوم ()، ماده فعال مورد استفاده در واکنشهای همجوشی هسته ای کنترل شده، زمانی تشکیل میشود که دوتریوم موجود در آب سنگین یک نوترون را جذب کند.
- هیدروژن در فرآیند هابر (Haber Process) برای تولید آمونیاک برای کود و همچنین هیدروکراکینگ برای تبدیل منابع نفتی سنگین به بخشهای سبکتر استفاده میشود.
محصولات برقکافت بر روی آب نمک
در این قسمت میخواهیم به محصولات برق کافت آب نمک و کاربردهای آن اشارهای داشته باشیم.
گاز کلر
برای ضد عفونی کردن آب استخر استفاده میشود و همچنین در صنعت بهعنوان یک واکنشدهنده (Reactant) استفاده میشود.

هیدروژن
بهعنوان سوخت بهخصوص برای موشکها استفاده میشود.
موتورهای اصلی شاتل فضایی از هیدروژن برای سوخت استفاده میکنند. آنها از هیدروژن مایع استفاده میسکنند که با اکسیژن مایع میسوزد که باعث میشود سوخت و اکسید کننده بیشتر و با سرعت بیشتری ترکیب شوند و نیروی رانش بالاتری تولید کنند.
هیدروکسید سدیم
هیدروکسید سدیم باقیمانده را میتوان برای تولید خمیر چوب (Wood Pulp) و سفیدکننده (Bleach) استفاده کرد.
پالپ (Pulp)
چوب به سلولز تبدیل میشود. زیرا همه چیز را به جز سلولز که ماده اصلی خمیر کاغذ و کاغذ است تبدیل میکند.

سفیدکننده
این ماده شیمیایی طی واکنش زیر حاصل میشود.
کلر + هیدروکسید سدیم → هیپوکلریت سدیم + آب

یادگیری الکتروشیمی با فرادرس
برق کافت آب یکی از مباحث مطرح شده در شاخه الکتروشیمی، علم ارتباط الکتریسیته و واکنشهای شیمیایی است. شناخت الکتروشیمی و واکنشها و فرآیندهای آن یکی از مهمترین مفاهیم بنیادی برای فراگیری مباحث پیچیدهتر است. در یادگیری الکتروشیمی با مباحثی مانند الکترولیز محلول آب و نمک، آبکاری و پوشش دهی فلزات، مفاهیم الکترود، پتانسیل الکترود، سری الکتروشیمیایی و قانون کولن آشنا میشوید. پیشنهاد میکنیم برای یادگیری بهتر این مباحث به مجموعه فیلم آموزش دروس دانشگاهی شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزش های بیشتری در زمینه الکتروشیمی دسترسی داشته باشید.
تاریخچه برق کافت آب
در سالهای اخیر، بهدلیل پیشرفتهایی که پیلهای سوختی (FCs) و در کاربردهای مختلف انجام شده، برق کافت آب برای تولید هیدروژن پاک مورد توجه قرار گرفته است. با این حال، برق کافت آب یک فناوری کاملا قدیمی است. این فرآیند بیش از ۲۰۰ سال است که شناخته شده است.
برق کافت آب برای اولین بار در سال ۱۷۸۹ توسط بازرگانان هلندی «Jan Rudolph Deiman» و «Adriaan Paets van Troostwijk» با استفاده از یک ژنراتور الکترواستاتیک برای تولید تخلیه الکترواستاتیک بین دو الکترود طلای غوطهور در آب استفاده شد. پیشرفتهای بعدی توسط یوهان ویلهلم ریتر «Johann Wilhelm Ritter» از فناوری باتری ولتا «Volta’s battery technology» استفاده کرد و اجازه جداسازی گازهای تولیدی را داد.
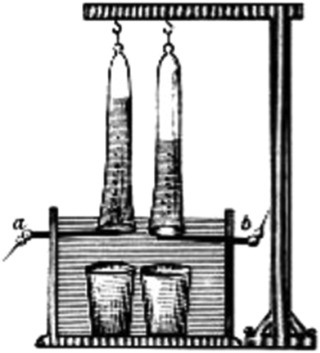
تقریبا یک قرن بعد، در سال ۱۸۸۸، روشی برای سنتز صنعتی هیدروژن و اکسیژن از طریق برقکافت توسط مهندس روسی، «دیمیتری لاچینوف» (Dmitry Lachinov) توسعه یافت و تا سال ۱۹۰۲، بیش از ۴۰۰ برق کافت آب صنعتی در حال بهرهبرداری بوده است. برقکافت های اولیه از محلولهای قلیایی آبی بهعنوان الکترولیت خود استفاده میکردند و این فناوری تا به امروز ادامه دارد.
یک پیشرفت جدیدتر در برق کافت آب، فرآیند غشای تبادل پروتون «Proton Exchange Membrane Process» است که در معرفی سیستمهای برقکافت به آن اشاره کردیم. این سیستم برای اولین بار در اواسط دهه ۱۹۶۰ توسط جنرال الکتریک (General Electric) بهعنوان روشی برای تولید اکسیژن برای برنامه فضایی جمینی (Gemini Space Program) توصیف شد.
سوالات متداول
در این بخش میخواهیم به برخی از سوالات متداول در این حیطه در قالب مرور موارد بررسی شده بپردازیم.
در جریان برق کافت آب چه اتفاقی میافتد؟
در جریان این فریند، آب به گاز اکسیژن و گاز هیدروژن تجزیه میشود. برای انجام این کار، جریان الکتریکی از محلول عبور میکند. کاتد گاز هیدروژن تولید میکند. در حالیکه آند گاز اکسیژن تولید میکند.
از کدام الکترودها در برق کافت آب استفاده میشود؟
از الکترودهای پلاتین
عوامل موثر بر راندمان برقکافت چیست؟
بازده الکترولیز به عوامل زیادی بستگی دارد. برای مثال:
- تعداد کاتیونها و آنیونهای موجود در محلول
- سرعت تحرک (Mobility Rate) یونها برای رسیدن به الکترود
- انرژی فعالسازی مورد نیاز برای انتقال الکترون از الکترود به یونهای الکترولیت
- اثر حباب گاز اطراف الکترود در انتقال الکتریکی بیشتر
نقش الکترولیت در الکترولیز آب چیست؟
الکترولیت غلظت یونی را برای افزایش رسانایی افزایش میدهد. با این حال، کاتیونها و آنیونهای نمک نیز به سمت الکترودها جذب میشوند و از این رو به رقیبی برای تجزیه آب برای تولید هیدروژن و اکسیژن تبدیل میشوند.
انواع مختلف الکترولیزر کدام است؟
بسته به نوع انتقال دهنده الکترولیت، الکترولیزرها را میتوان به سه نوع تقسیم کرد: غشای الکترولیت پلیمری (PEM)، قلیایی و الکترولیز اکسید جامد.
برق کافت آب، کدام نوع واکنش شیمیایی است؟
برق کافت آب یک واکنش تجزیه است که در اثر جریان الکتریکی آب به عناصر تشکیل دهنده خود یعنی هیدروژن و اکسیژن تجزیه میشود.
در هنگامیکه آب برقکافت میشود، گاز آزاد شده در کاتد چیست؟
در طی این فرآیند، یونهای (کاتیونها) به سمت کاتد مهاجرت میکنند و با بهدست آوردن الکترون تخلیه میشوند، فرآیند کاهش، در نتیجه گاز دی هیدروژن آزاد میشود.
همانطور که میتوانیم هیدروژن و اکسیژن را از آب مقطر از طریق فرآیند برقکافت جدا کنیم، آیا میتوانیم دوباره با استفاده از هیدروژن و اکسیژن در فرآیند برقکافت، آب تشکیل بدهیم؟
در طی فرآیند برقکافت ، آب مایع به گاز و گاز تفکیک میشود. در فرآیند برقکافت، آب به دو عنصر متفاوت تبدیل میشود. بنابراین، تغییر شیمیایی رخ میدهد. حال اگر فشار و دما کافی باشد، واکنش معکوس همیشه میتواند رخ دهد تا دوباره آب تشکیل شود که در واقع مکانیزم پشت پرده در سوختن گاز هیدروژن است. گاز مایع با گاز میسوزد و آب تولید میکند. بنابراین میتوانیم با تامین فشار و دمای کافی، دوباره با استفاده از هیدروژن و اکسیژن در فرآیند برق کافت آب تشکیل دهیم.
برای انجام برق کافت آب، اسید سولفوریک به آب اضافه میشود. چگونه با افزودن اسید سولفوریک محلول رسانا تولید میشود؟
آب خالص فقط حاوی مولکول و فاقد یون است و از اینرو نمیتواند یونیزه شود و الکتریسیته را هدایت کند. یعنی حضور یونها برای انجام واکنش برقکافت حیاتی است. هنگامیکه اسید سولفوریک به آن افزوده میشود، یونهای اسید به آب خالص وارد شده و درجه یونیزاسیون در آب اسیدی شده افزایش مییابد و باعث هدایت جریان الکتریسیته میشود.
تصویر زیر نمایشی شماتیکی از دستگاه برق کافت آب است. قسمتهای A، B و C را مشخص کنید.
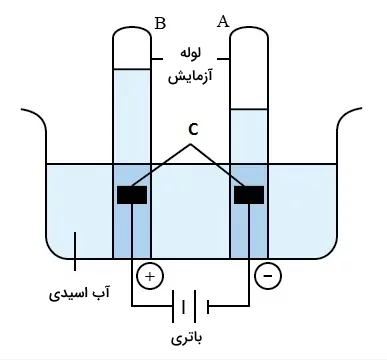
در طول برق کافت آب، گاز هیدروژن در کاتد و گاز اکسیژن در آند جمعآوری میشود. حجم گاز هیدروژن جمعآوری شده در کاتد دو برابر گاز اکسیژن جمعآوری شده در آند است. زیرا آب از دو حجم گاز هیدروژن و یک حجم گاز اکسیژن تشکیل شده است. بنابراین، A گاز هیدروژن و B گاز اکسیژن است. صفحات پلاتین بهعنوان الکترود در برق کافت آب استفاده میشوند. زیرا پلاتین یک الکترود بیاثر است. بنابراین، C صفحه پلاتین است. پس قسمتهای مد نظر به ترتیب عبارتند از:
- A: گاز هیدروژن
- B: گاز اکسیژن
- C: صفحات پلاتینی
واکنش اکسیداسیون شامل اضافه کردن …. یا حذف …. است.
واکنش اکسیداسیون شامل افزودن اکسیژن یا حذف هیدروژن از یک ماده است.
در طی برق کافت آب اسیدی شده با الکترودهای پلاتین، در ….. و در ….. آزاد میشود.
با توجه به نیمواکنشهای کاتد و آند در فرآیند برقکافت ، در کاتد و در آند آزاد میشود.
نسبت هیدروژن و اکسیژن آزاد شده در الکترودها در طی برق کافت آب اسیدی، ….. است.
طبق واکنش الکترولیتی متعادل، به ازای هر دو مولکول آب، دو مولکول گاز و یک مولکول گاز آزاد میشود.
پس نسبت مذکور دو به یک است.
اگر در جریان برق کافت آب اسیدی، ۵.۶ لیتر اکسیژن آزاد شود، حجم هیدروژن آزاد شده در کاتد برابر با چه مقداری خواهد بود؟
میدانیم برق کافت آب یک واکنش تجزیه است که در طی آن، آب تحت تأثیر جریان الکتریکی به عناصر تشکیل دهنده خود یعنی هیدروژن و اکسیژن تجزیه میشود. از طرف دیگر میدانیم که نسبت مولی گازهای هیدروژن و اکسیژن آزاد شده در جریان برق کافت آب دو به یک (۲:۱) است. یعنی به لحاظ تئوری، میزان هیدروژن تولید شده دو برابر میزان اکسیژن تولید شده است. حال با توجه به اطلاعات صورت سوال مبنی بر تولید ۵.۶ لیتر اکسیژن، میتوانیم دو برابر آن را حجم هیدروژن تولید شده بهدست بیاوریم.
آیا برق کافت آب شور خطرناک است؟
بله، برق کافت آب شور خطرناک است. چرا که باعث تولید گاز کلر خواهد شد که گازی سمی است.
برای فرآیند برق کافت آب چه مقدار انرژی لازم است؟
از نظر تئوری، حداقل ۲۳۷ کیلوژول انرژی، برای جداسازی اجزای یک مولکول آب مورد نیاز است.
پتانسیل استاندارد در یک سلول الکترولیتی آب چقدر است؟
پتانسیل استاندارد یک سلول الکترولیتی آب ۱.۲۲۹- ولت در دمای ۲۵ درجه سانتیگراد و pH = ۰ است.
جمعبندی
هیدروژن شکل پاکی از انرژی است که بهتر است جایگزین سیستم انرژی معمولی که وابسته به احتراق سوخت فسیلی است، شود. هیدروژن بههمراه کربن، جزء اصلی سوختهای فسیلی است. از اینرو سوخت فسیلی و زیستتوده یا بیومس (Biomass)، بهعنوان منبع تغذیه اصلی برای تولید هیدروژن در نظر گرفته میشود. برای از بین بردن کربن، آب بهعنوان منبعی برای استخراج هیدروژن، برای ساختن آیندهای پایدار ترجیح داده میشود که در مقاله حاضر علاوه بر بررسی کلی فرآیند برق کافت آب، به این فنآوری از منظر تولید هیدروژن که در مقایسه با فرآیندهای ترموشیمیایی تولید هیدروژن، پایدارتر بوده و از نظر زیستمحیطی بیضرر هستند، پرداخته شده است.
فرآیند تولید هیدروژن از طریق برق کافت آب، وسیلهای برای ذخیره انرژی الکتریکی اضافی تولید شده توسط منابع انرژی تجدیدپذیر (Renewable Energy Sources) است. این گاز هیدروژن ممکن است مستقیما برای تولید نیرو از طریق احتراق یا ترکیب مجدد با اکسیژن در یک پیل سوختی استفاده شود. ممکن است به شبکه گاز طبیعی تزریق شود و ممکن است بهعنوان سوخت حمل و نقل یا بهعنوان یک واسطه شیمیایی استفاده شود. روشهای اصلی تولید هیدروژن از طریق برقکافت، روشهای قلیایی، غشای تبادل پروتون و اکسید جامد هستند که در کنار اساس کار مشابه، هریک روش انجام و مزایا و معایب خود را دارند که در این مقاله نگاهی به آنها داشتهایم.
source