آهنگ واکنش شیمیایی در واقع همان سرعت واکنش شیمیایی است. آهنگ واکنش به سرعت تولید فرآوردهها از واکنشدهندهها گفته میشود. هرچه مولکولهای واکنشدهندهها سریعتر با یکدیگر برخورد کنند، انرژی بیشتری آزاد کرده و آهنگ واکنش سریعتر میشود. عواملی مانند غلظت، فشار، دما، سطح مواد و کاتالیست بر آهنگ واکنش تأثیر میگذارند. واکنشها میتوانند با سرعت زیاد، (واکنش سوختن چوب) یا آهسته (مانند زنگ زدن آهن) انجام شوند. در این مطلب از مجله فرادرس بررسی میکنیم آهنگ واکنش چیست و چه عواملی بر آن تأثیر میگذارد. همچنین مثالهایی را برای درک بهتر قوانین سرعت واکنش مطرح میکنیم.

در ابتدای این مطلب، توضیح میدهیم تعریف آهنگ واکنش چیست و چه فرمولی برای محاسبه آن استفاده میشود. سپس عوامل موثر بر آهنگ واکنش مانند دما و غلظت را نام برده و هریک را بررسی خواهیم کرد. در ادامه روشهای متفاوت اندازهگیری آهنگ واکنش را از طریق محاسبه تغییرات جرم ، حجم، مول و … توضیح میدهیم. پس از آموختن این موارد به فرمول محاسبه آهنگ واکنش پرداخته و تمرینهایی را برای محاسبات آن ارائه میدهیم. پس از یادگیری کامل مسائل مربوط به آهنگ واکنش، سرعت لحظهای واکنش را توضیح داده و قانون سرعت را برای واکنشهای مختلف بررسی میکنیم. در انتها نیز به بررسی آهنگ واکنش در مقیاس مولکولی میپردازیم. با مطالعه این مطلب تا انتها، میتوانید این پارامتر مهم را به همراه تمرینهای کاربردی بیاموزید.
تعریف آهنگ واکنش
واکنشهای شیمیایی در اثر برخورد ذرات واکنشدهنده با یکدیگر، شکستن پیوند بین آنها و تولید پیوندهای جدید برای تولید فرآوردهها انجام میشوند. آهنگ واکنش در واقع سرعت مصرف واکنشدهندهها یا سرعت تولید فرآوردهها است. اندازهگیری آهنگ واکنش میتواند به روشهای متفاوتی انجام شود. برای مثال اندازهگیری تعداد مولهای واکنشدهنده مصرف شده یا فرآورده تولید شده، اندازهگیری تغییر حجم یا تغییر غلظت مواد میتواند از این روشها باشد.
واحد اندازهگیری آهنگ واکنش بر حسب مول یا مولاریته یا هرواحد اندازهگیری شده دیگر در مقیاس زمان (ثانیه، دقیقه، ساعت و …) است. برخی از واکنشهای شیمیایی به سرعت و شدت انجام میشوند در حالی که برخی دیگر از واکنشها پس از گذشت مدت زمان مشخصی انجام میشوند. اندازهگیری آهنگ واکنش در بسیاری از مسائل سینتیکی واکنش برای تشخیصهای مختلف استفاده شده و حائز اهمیت است.
بررسی روابط کمی واکنشهای شیمیایی را سینتیک واکنش میگویند. هسته اصلی سینتیک واکنشهای شیمیایی، نظریه برخورد است که در بخش بعدی توضیح داده خواهد شد.
نظریه برخورد
نظریه برخورد بیان میکند واکنشهای شیمیایی در صورتی انجام میشوند که بین مولکولهای واکنشدهندهها، برخوردی انجام بگیرد که باعث تشکیل پیوندهای جدید و تولید فرآوردهها شود. همچنین این مواد باید میزان انرژی کافی برای واکنش دادن را نیز داشته باشند. در واقع تنها قراردادن مولکولهای واکنش در کنار یکدیگر نمیتواند لزوما منجر به انجام واکنش شود و این مولکولهای باید برخورد موثر و انرژی کافی را داشته باشند تا فرآوردهها تشکیل شوند. میزان آهنگ واکنش اندازهگیری میزان سرعت مصرف واکنشدهندهها برای تولید فرآوردههای جدید است.
برخوردی که منجر به انجام واکنش شیمیایی میشود، برخورد موثر نام دارد. میزان انرژی فعالسازی، انرژی است که مولکولها برای انجام یک برخورد موثر باید به آن برسند. میزان انرژی فعالسازی برای هرواکنش متفاوت است. تصویر زیر مراحل یک برخورد موثر از نزدیک شدن مولکولها به یکدیگر و تشکیل پیوندهای شیمیایی جدید را نشان میدهد.
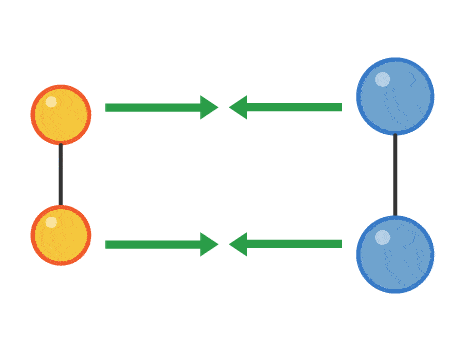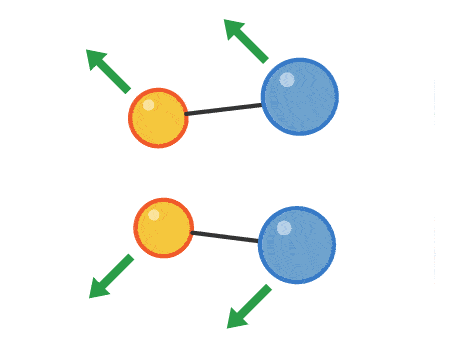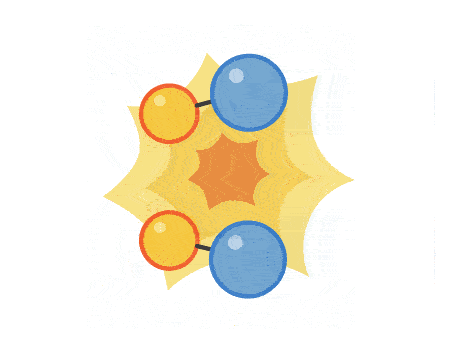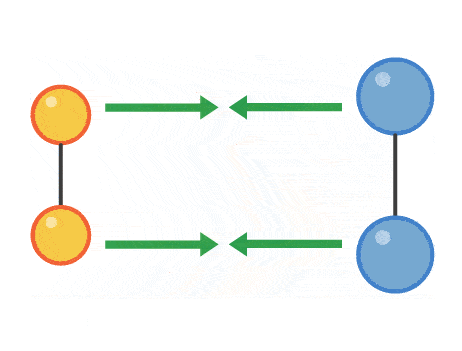
هرچه مولکولها سریعتر با یکدیگر برخورد کنند و انرژی این برخورد بیشتر باشد، آهنگ واکنش سریعتر خواهد بود. عواملی مانند غلظت، فشار، دما، سطح برخورد و افزودن کاتالیست میتواند بر میزان آهنگ واکنش تاثیر بگذارد.
یادگیری آهنگ واکنش با فرادرس
آموختیم که آهنگ واکنش در واقع همان سرعت مصرف واکنش دهندهها یا تولید فرآوردههای واکنش شیمیایی است. با یادگیری عمیق این موضوع میتوانیم از آن در بسیاری از مسائل روزمره زندگی و همچنین در مسائل مختلف سینتیک شیمیایی پدیدهها را پیشبینی و هدایت کنیم. برای یادگیری این مفهوم که آهنگ واکنش چیست، ابتدا باید با مفاهیمی مانند سینتیک واکنشهای شیمیایی، اندازهگیری سرعت واکنش، سرعت متوسط واکنش و … آشنا شوید. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه آهنگ واکنش دسترسی داشته باشید.
فرمول آهنگ واکنش چیست؟
پس از آموختن این موضوع که آهنگ واکنش چیست، باید فرمول محاسبه آهنگ واکنش را بررسی کنیم. آهنگ واکنش یا سرعت واکنشهای شیمیایی میتواند به عنوان زمان مورد نیاز برای ایجاد یک تغییر در غلظت یا مقدار مواد بیان شود. غلظتی که در این تعریف بیان شده است در واقع میزان تغییرات غلظت هریک از مواد واکنشدهنده یا فرآورده به همراه در نظر گرفتن ضریب استوکیومتری آنها است.
برای درک بهتر این موضوع که فرمول محاسبه آهنگ واکنش چیست، به معادله واکنش کلی زیر توجه کنید.
در معادله واکنش بالا، فرمول محاسبه آهنگ واکنش به شکل زیر نوشته میشود.
هر یک از کسرهای نوشته شده در معادله بالا میتوانند به عنوان آهنگ واکنش در نظر گفته شوند. مقادیر مثبت و منفی نشاندهنده این موضوع هستند که غلظت واکنشدهندهها در طول واکنش کاهش مییابد و مقادیر غلظت فرآوردهها طی انجلام واکنش افزایش مییابد.
علامتهای یونانی دلتا نشاندهنده میزان تغییرات و پارامترهایی که در براکت نوشته شده اند نشاندهنده میزان غلظت مولار مواد هستند.پارامتر dt نشان دهنده زمان طی شده یا واحد زمان است.
مثال ۱
معادله واکنش زیر را در نظر بگیرید.
در این معادله واکنش، آهنگ واکنش برابر با است. میزان آهنگ واکنش را برای هریک مواد موجود در واکنش در واحد زمان به دست اورید.
پاسخ
بنابر فرمول محاسبه آهنگ واکنش، میزان سرعت واکنش بالا از روش زیر محاسبه میشود.
بنابراین مقدار آهنگ واکنش برای هریک از مواد موجود در واکنش به شرح زیر است.
مثال ۲
با توجه به معادله واکنش زیر، فرمول محاسبه سرعت را برای هریک از مواد بنویسید.
پاسخ
با توجه به فرمول سرعت، معادله محاسبه سرعت برای این واکنش به شکل زیر خواهد بود.
عوامل موثر بر آهنگ واکنش
حال که آموختیم تعریف آهنگ واکنش چیست، باید بیاموزیم چه عواملی بر آهنگ واکنش اثر میگذارند. به طور کلی به دو طریق میتوان میزان آهنگ واکنش را افزایش داد. این روشها به شرح زیر هستند.
- افزایش تعداد برخوردهای موثر بین موکولها
- افزایش انرژی موکلولها
عواملی مانند دما، غلظت، فشار،کاتالیست، تشعشات الکترومغناطیسی یا نور، حالت فیزیکی و سطح مواد بر انرژی و برخورد مولکولها و آهنگ واکنشهای شیمیایی اثر میگذارد. در ادامه اثر هریک از این عوامل را بررسی میکنیم.
اثر دما
دما یکی از عوامل تاثیرگذار بر آهنگ واکنش است. این اثرگذاری به سینتیک واکنش بستگی دارد. بر اساس تئوری سینتیکی، هرچه دما بالاتر رود، مولکولها با سرعت بیشتری حرکت میکنند. در نتیجه میزان برخوردهای موثر بین مولکولهای مواد افزایش مییابد. در نتیجه مولکولهایی که قبلا به انرژی فعالسازی مناسب رسیدهاند، زودتر به برخورد موثر رسیده و آهنگ واکنش افزایش میابد. هرچند در بررسی اثر دما بر آهنگ واکنش باید به نکات زیر توجه داشته باشیم.
- برخی از واکنشها در اثر افزایش دما کندتر میشوند و آهنگ واکنش آنها کاهش مییابد.
- برخی از واکنشهای شیمیایی به تغییر دما حساس نیستند و تغییر دما اثر بر آهنگ واکنش آنها ندارد.
به طور معمول افزایش دمای یک ماده باعث افزایش حرکت و جنبش ذرات سازنده آن شده و آهنگ واکنش را افزایش میدهد. هرچه دمای واکنش بالاتر برود، احتمال انجام شدن برخورد موثر و انرژی کافی برای انجام واکنش بالاتر میرود.

برای مثال به واکنش اسید کلریدریک و کلسیم کربنات و نموار واکنش آنها توجه کنید.
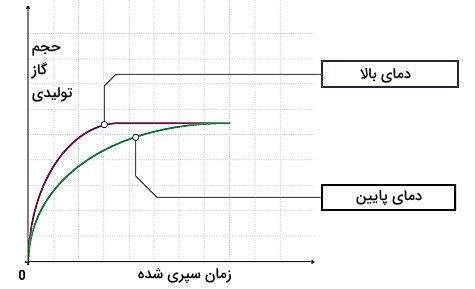
همانطور که در تصویر مشاهده میکنید، افزایش دمای واکنش باعث میشود واکنش در مدت زمان کمتری انجام شود.
اثر غلظت
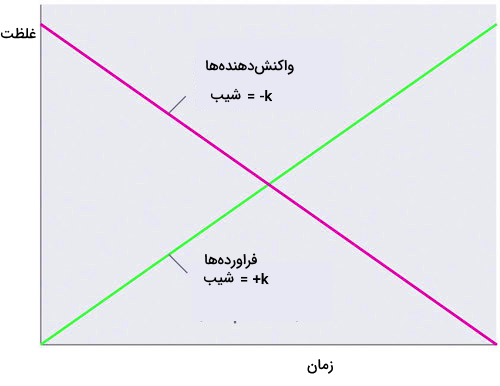
آهنگ واکنشهای شیمیایی به طور مستقیم با غلظت مواد تغییر میکند و این وابستگی آهنگ واکنش به غلظت مواد، به نوع ماده نیز بستگی دارد. آهنگ واکنش با افزایش غلظت افزایش یافته و با کاهش غلظت کاهش مییابد. در واقع افزایش غلظت محلولهای مختلف به معنی افزایش تعداد مولکولهای آنها در یک حجم مشخص است و در نتیجه افزایش تعداد مولکولها احتمال برخورد آنها بیشتر شده و سرعت واکنش افزایش مییابد.
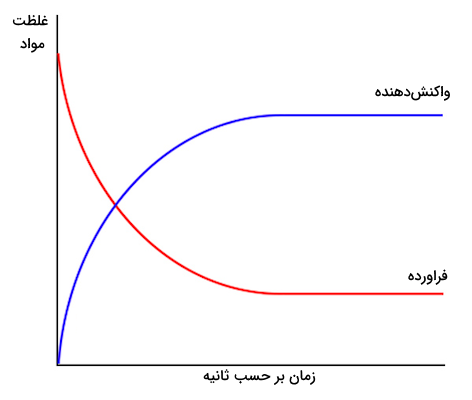
بررسی اثر غلظت و تغییرات آن در اندازهگیری آهنگ واکنشهای شیمیایی بسیار حائز اهمیت است. در بسیاری از فرمولهای محاسبه سرعت واکنشهای شیمیایی از تغییرات غلظت واکنشدهندهها و فرآوردهها استفاده میشود. در واکنشهای شیمیایی، پس از گذشت زمان، میزان غلظت واکنشدهندهها کاهش یافته و غلظت فرآوردهها افزایش مییابد. شکل زیر نشاندهنده نمودار کلی تغییرات غلظت واکنشدهندهها و فرآوردهها طی انجام واکنش بر حسب زمان است.
اثر فشار
تغییر فشار بر آهنگ واکنشها موثر است. این وابستگی فشار و آهنگ واکنشها بیشتر برا واکنشهایی که شامل مواد گازی هستند تعریف میشود. تغییر فشار مواد جامد و مایع تاثیری بر میزان برخوردهای موثر آنها نمیگذارد. در مورد مواد گازی، افزایش فشار باعث افزایش میزان حرکت مولکولهای گاز شده و احتمال برخورد موثر را افزایش میدهد. در نتیجه آهنگ واکنش با افزایش فشار، افزایش مییابد. همچنین کاهش فشار باعث کاهش جنبش مولکولی و کاهش آهنگ واکنش میشود.
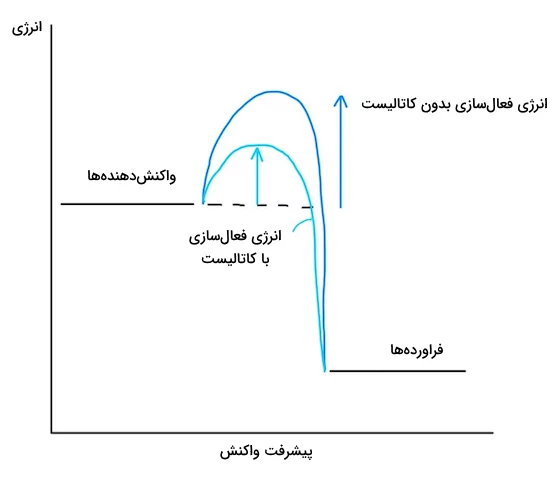
اثر کاتالیست
اثر کاتالیست در واکنشهای شیمیایی، پایین آوردن میزان انرژی فعالسازی واکنشها است. در حضور کاتالیست، میزان انرژی فعالسازی کاهش یافته و مولکولها انرژی کمتری برای رسیدن به برخورد موثر نیاز خواهند داشت در نتیجه حضور کاتالیست باعث افزایش آهنگ واکنش خواهد شد. در واقع کاتالیست راه جدیدی برای تولید فرآوردهها از واکنشدهندهها را ارائه میدهد و ماننند میانبر عمل میکند. کاتالیستها خود در واکنش شیمیایی مصرف نمیشوند.
تصویر زیر نشاندهنده این است که اثر کاتالیست بر انرژی فعالسازی و آهنگ واکنش چیست.
برای درک بهتر درباره اثر کاتالیست روی آهنگ واکنش، باید با مفاهیمی مانند ماهیت کاتالیست، انرژی فعالسازی و سطح و مکانیزم واکنش کاتالیستی آشنا شوید. پیشنهاد میکنیم برای آشنایی بهتر با این مفاهیم، مقاله کاتالیست و واکنشهای کاتالیستی از مجله فرادرس را مطالعه کنید که به شکلی کامل و کاربردی درباره این مفاهیم توضیح میدهد.
اثر نور و امواج الکترومغناطیس
حضور نور یا انواع دیگر امواج الکترومغناطیسی در واکنشهای شیمیایی میتواند باعث افزایش میزان آهنگ واکنش بشود. دلیل این اثربخشی آن است که این امواج حامل انرژی هستند و این انرژی به مولکولها منتقل میشود. درنتیجه میزان انرژی مولکولها و میزان جنبش آنها افزالیش یافته و میزان برخورد موثر بین آنها افزایش مییابد.
اثر حالت فیزیکی و سطح ماده
اگر واکنشدهندهها در حالات مختلف ماده (جامد، مایع، گاز) باشند، میزان آهنگ واکنش به میزان سطح در دسترس واکنشدهندهها محدود میشود. برای مثال اگر یک فلز جامد را با یک واکنشدهنده دیگر در فاز گاز در یک ظرف واکنش قرار دهیم، تنها اتمهای سطح فلز با گاز واکنشخواهند داد. به همین ترتیب هرچه میزان سطح واکنش در این گونه واکنشها بیشتر باشد، میزان آهنگ واکنش افزایش مییابد.
یکی دیگر از مثالهای این اثر، حل شدن مخلوط یک واکنشدهنده جامد پودری یا کریستالی با یک واکنشدهنده مایع است. هم زدن مخلوط باعث میشود سطح در دسترس مولکولهای مایع و گاز افزایش یافته و آهنگ واکنش بیشتر شود. برای درک بهتر این موضوع که اثر سطح بر آهنگ واکنش چیست، به مثال زیر توجه کنید.
معادله واکنش زیر مربوط به واکنش هیدروکلریک اسید و فلز آهن است که گاز هیدروژن آزاد میکند.
در تصویر زیر، در یک لوله آزمایش، پودر آهن و در لوله آزمایش دیگر، میله آهنی قرار گرفته است و به آنها هیدروکلریک اسید اضافه شده است. در تصویر سمت چپ (پودر آهن) مشاهده میکنید که میزان گاز هیدروژن آزاد شده (حبابها) بسیار بیشتر از تصویر سمت راست است. این پدیده نشانگر اثر سطح واکنش در آهنگ واکنش است.

اثر اندازه ذرات
با کاهش اندازه ذرات یک ماده، اندازه سطح در دسترس آن بیشتر خواهد شد. همانطور که در قسمت قبل توضیح دادیم، هرچه سطح در دسترس مواد بیشتر باشد، احتمال برخورد موثر و بیشتر شدن آهنگ واکنش بیشتر است. هرچه اندازه ذرات کوچکتر باشد، آهنگ واکنش بیشتر است.
برای درک بهتر این موضوع، مثال حل کردن قند و شکر را در آب در نظر بگیرید. اندازه ذرات شکر کوچکتر است و اندازه قند بزرگتر است. سرعت حل شدن قند در آب کمتر از شکر است. برای درک بهتر یک مکعب ۲ سانتیمتری را در نظر بگیرید.

سطح هر وجه این مکعب برابر ۴ سانتیمتر مربع و مساحت کلی این مکعب ۲۴ سانتیمتر مربع است. حال اگر این مکعب را به ۸ مکعب ۱ سانتیمتری تبدیل کنیم، هر مکعب ۶ سانتیمتر مربع سطح در دسترس خواهد داشت و کل مکعبها ۴۸ سانتیمتر مربع مساحت خواهد داشت که از مکعب اولیه بیشتر است. پس اگر یک ماده را خرد کرده و به ذرات و قطعات کوچکتری تبدیل کنیم، سطح در دسترس و آهنگ واکنش افزایش مییابد.

اندازهگیری آهنگ واکنش
روشهای متفاوتی برای اندازهگیری آهنگ واکنشهای شیمیایی وجود دارد. روشی که انتخاب میشود به واکنشدهندهها و فرآوردههای واکنش بستگی دارد و اینکه اندازهگیری تغییرات چه پارامتری راحتتر است.
میزان آهنگ متوسط یک واکنش (سرعت گرادیانی) با استفاده از دو روش محاسبه میشود. این دو روش به شرح زیر هستند.
- میزان فرآورده تولید شده در واحد زمان
- میزان واکنش دهنده مصرف شده در واحد زمان
اندازهگیری این تغییرات میتواند با اندازهگیری میزان تغییرات مول مواد، جرم مواد یا حجم مواد انجام بگیرد.
اندازهگیری جرم
تغییر میزان جرم واکنشدهندهها یا فرآوردهها میتواند در طول واکنش شیمیایی انجام شود. این روش در زمانی که یک فرآورده گازی داریم که از محیط واکنش خارج میشود، میتواند کار آمد باشد. واحد اندازهگیری سرعت در این روش گرم بر ثانیه یا گرم بر دقیقه است.
برای مثال از واکنش اسید کلریدریک و فلز روی، کلرید روی و گاز هیدروژن آزاد میشود. گاز هیدروژن ظرف واکنش را ترک کرده و باعث کم شدن جرم کلی واکنش میشود.
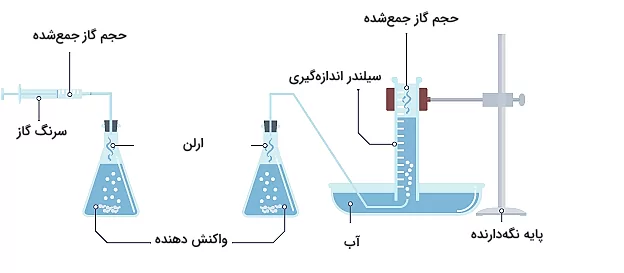
اندازهگیری تغییرات حجم
میزان تغییرات حجم مواد واکنشدهنده یا فرآورده در یک واکنش شیمیایی میتواند اندازهگیری شود. این روش اندازهگیری هنگامی که یکی از مواد فرآورده به فرم گاز است و ظرف واکنش را ترک میکند، میتواند کارآمد باشد. اندازهگیری میزان حجم گاز خارج شده به وسیه یک سرنگ گاز اندازهگیری میشود. همچنین میتوان از وسایل آماده دیگری مانند سیلندر اندازهگیری حجم نیز استفاده کرد. روش این اندازهگیری در تصویر زیر نشان داده شده است.
در این روش اندازهگیری، سرعت بر حسب سانتیمتر مکعب بر ثانیه بیان میشود.
اندازهگیری مول مواد
اندازهگیری میزان مول مواد را میتوان به وسیله واکنش شیمیایی آنها و میزان جرم اندازهگیری شده محاسبه کرد. میزان سرعت متوسط در این روش با استفاده از فرمول شیمیایی زیر برای یک واکنش ساده به فرم زیر به دست میآید. در این روش اندازهگیری سرعت بر حسب مول بر ثانیه اندازهگیری میشود.
برای درک بهتر این موضوع که رابطه تغییر مقدار مواد و آهنگ واکنش چیست، به معادله واکنش زیر دقت کنید.
مقادیر استوکیومتری به دست آمده از این معادله واکنش، برای به دست آوردن آهنگ واکنش نیز به کار میروند. مقدار آهنگ واکنش بر حسب تغییرات تعداد مول مواد در این واکنش به شکل زیر محاسبه میشود.
این معادله را میتوان بدون نوشتن ضریب تبدیل مول نوشته شده، به شکل ساده تر بازنویسی کرد.
آهنگ واکنش را میتوان به عنوان تعداد مول مواد مصرف یا تولید شده در یک بازه زمانی به عنوان آهنگ متوسط تعریف کرد.
اندازهگیری مدت زمان تغییر محلول
در واکنشهایی که در فاز مایع و محلول انجام میشوند میتوان از روشهای دیگری برای اندازهگیری سرعت واکنش یا بررسی عوامل موثر بر تغییر سرعت بهره برد. در این روشها مدت زمانی که طول میکشد تا یک رسوب پدیدار شود یا مایع تغییر رنگ دهد اندازهگیری میشود. هرچند، این روشها خطای زیادی دارند زیرا ممکن است افراد در مورد زمان تشکیل رسوب یا تغییر رنگ مواد اخلاف نظر داشته باشند. در این روش، با قرار دادن یک کاغذ با علامت ضربدر در زیر ارلن آزمایش، مدت زمانی که طول میکشد تا علامت ار بالای ارلن دیگر دیده نشود، میزان آهنگ واکنش را نشان میدهد.

فرمول محاسبه آهنگ واکنش
تا اینجا آموختیم آهنگ واکنش چیست و چه عاملی بر آن تأثیر میگذارد. حال میخواهیم بررسی کنیم فرمول محاسبه آهنگ واکنش چیست و چگونه استفاده میشود. برای فهم بهتر این موضوع، ابتدا واکنش ساده زیر را در نظر بگیرید.
فرمول محاسبه آهنگ واکنش تغییرات مقدار واکنشدهنده مصرف شده یا فرآورده تولید شده دبر حسب مول، گرم، میللیتر و … در واحد زمان است.
فرمول محاسبه آهنگ واکنش بر حسب مول مواد
تا اینجا مشاهده کردیم که آهنگ واکنش را میتوان به عنوان اندازهگیری تغییر یک کمیت در واحد زمان در نظر رفت. در نتیجه آهنگ واکنش را میتوان با واحدهایی مانند گرم بر ثانیه، مترمکعب بر ثانیه یا مول بر ثانیه بیان کرد. مقدار سرعت بر حسب تعداد مول مصرف یا تولید شده در واحد زمان را میتوان از پارامترهای دیگر مانند سرعت بر حسب گرم بر مول و با استفاده از جرم مولی محاسبه کرد. برای درک بهتر این موضوع که واحد مول بر ثانیه آهنگ واکنش چیست، به مثالهای زیر توجه کنید.
مثال ۱
۲۰ گرم از آهک به یک بالن آزمایشگاهی اضافه شده است. این بالن شامل ۲۰۰ سانتیمتر مکعب محلول ۲ مول بر دسیمتر مکعب هیدروکلریک اسید است. مقدار وزن بالن در ابتدای واکنش و بعد از سپری شدن ۲٫۵ دقیقه اندازهگیری شده است. وزن این بالن پس از گذشت این زمان ۶ گرم کاهش یافته است. مقدار سرعت واکنش را بر حسب مول بر ثانیه محاسبه کنید.
پاسخ
برای پاسخ به این پرسش ابتدا باید معادله واکنش را بنویسیم. از ترکیب آهک (کلسیم کربنات) و اسید کلریدریک، کلسیم کربنات، آب و کربن دی اکسید تولید میشود. معادله این واکنش به شکل زیر است.
مقدار وزن کاهش یافته پس از انجام واکنش در واقع جرم کربن دی اکسیدی بوده که از ظرف واکنش خارج شده است. برای محاسبه مقدار مول کربن دی اکسید از جرم مولی کربن دی اکسید که ۴۴ گرم بر مول است استفاده میکنیم.
در قسمت قبل آموختیم که آهنگ واکنش را میتوان بر حسب تعداد مول مصرف یا تولید شده در مدت زمان مشخص محاسبه کرد. پس برای به دست آوردن سرعت بر حسب مول بر ثانیه کافی است مدت زمان ۲٫۵ دقیقه را به ثانیه تبدیل کرده و سپس مقدار مول کربن دی اکسید محاسبه شده را بر آن تقسیم کنیم.
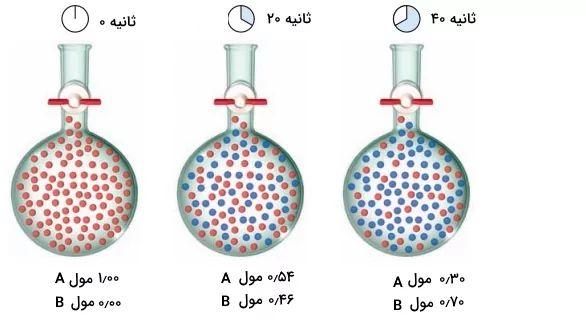
مثال ۲
با توجه به شکل محاسبه کنید آهنگ واکنش متوسط برای واکنشی که در ظرف در حال انجام است، بین زمانهای ۲۰ تا ۴۰ ثانیه چقدر است.
پاسخ
با توجه به فرمول محاسبه آهنگ متوسط واکنش و مقدار مول مصرف شده در زمان تعیین شده، میتوانیم محاسبه کنیم مقدار آهنگ واکنش چیست.
فرمول محاسبه آهنگ واکنش بر حسب غلظت
میزان آهنگ واکنش برای یک واکنش شیمیایی برابر میزان تغییرات غلظت مواد واکنش دهنده یا فرآورده در مدت زمانی مشخص است. این میزان تغییرات، با علامت یونانی دلتا «» نمایش داده میشود. همچنین غلظت مواد با استفاده از علامتهای براکت نمایش داده میشود. برای مثال میزان تغییرات غلظت واکنشدهنده A به شکل زیر نمایش داده میشود.
برای یادگیری بیشتر در مورد غلظت محلولها و مسائل مربوط به آنها میتوانید فیلم آموزشی محلول سازی در آزمایشگاه که لینک آن در ادامه اورده شده است را مشاهده کنید.
آهنگ واکنش برای واکنش ارائه شده به شکل زیر خواهد بود.
علامت منفی پشت غلظتهای مربوط به واکنش دهندهها به این علت است که میزان غلظت واکنشدهندهها با پیشرفت واکنش کاهش مییابد و کمیت سرعت نمیتواند منفی باشد. علامت منفی برای خنثی کردن علامت منفی تغییر غلظت واکنشدهندهها به کار میرود. باید به این نکته توجه داشته باشیم که در محاسبه سرعت واکنشها اثر ضرایب استوکیومتری را نیز لحاظ کنیم.
برای مثال، در واکنش زیر برای محاسبه سرعت واکنش زیر باید ضرایب آن را لحاظ کنیم.
فرمول محاسبه سرعت به شکل زیر خواهد بود.
تمرین محاسبه آهنگ واکنش
در ادامه برای درک بهتر این مفهوم که آهنگ واکنش چیست، به تمرینها و مثالهای زیر توجه کنید.
مثال ۱
اولین مرحله از تولید نیتریک اسید از سوختن آمونیاک آغاز میشود. معادله این واکنش به فرم زیر است.
معادلاتی که آهنگ مصرف واکنشدهندهها و تولید فرآوردهها را به یکدیگر ارتباط میدهد، بنویسید.
پاسخ
با توجه به فرمول سرعت واکنش که تغییرات غلظت یا مول در واحد زمان است و ضرایب استوکیومتری مواد، فرمول خواسته شده نوشته میشود.
مثال ۲
به معادله واکنش زیر توجه کنید و به سوال مطرح شده پاسخ دهید.
جدول زیر مقادیر غلظت مواد موجود در واکنش بالا که در دمای ۵۶ درجه سانتیگراد اندازهگیری شدهاند را نمایش میدهند. مقدار آهنگ واکنش را برای این مواد در بازه زمانی داده شده، حساب کنید.
| زمان بر حسب ثانیه | غلظت مولار | غلظت مولار | غلظت مولار |
| ۲۴۰ | ۰٫۰۳۸۸ | ۰٫۰۳۱۴ | ۰٫۰۰۷۹۲ |
| ۶۰۰ | ۰٫۰۱۹۷ | ۰٫۰۶۹۹ | ۰٫۰۱۷۵ |
پاسخ
با توجه با معادله واکنش داده شده، باید مقادیر اختلاف غلظتهای محاسبه شده بر مدت زمان طی شده تقسیم شده و در کسر ضریب استوکیومتری ضرب شود تا مقادیر سرعت به دست بیاید. فرمول محاسبه آهنگ واکنش به شکل زیر خواهد بود.
به شکل زیر مقادیر سرعت برای هریک از مواد محاسبه میشود. آهنگ واکنش بر حسب غلظت مولار به شکل زیر است.
سرعت واکنش بر حسب غلظت مولار به شکل زیر است.
در نهایت آهنگ واکنش بر حسب غلظت مولار به شکل زیر است.
علت متفاوت بودن ناچیز مقادیر آهنگ واکنش به دست آمده، وجود خطای آزمایش است.
مثال ۳
به واکنش اکسیداسیون آمونیاک دقت کنید.
اگر میزان سرعت تولید نیتروژن در این واکنش ۰٫۲۷ مول بر لیتر ثانیه باشد، آهنگ تولید و مصرف آب و آمونیاک را محاسبه کنید.
پاسخ
با توجه به ضرایب استوکیومتری مواد، آب با ۳ برابر سرعت نیتروژن تولید میشود. پس میزان آهنگ تولید آن به شرح زیر خواهد بود.
همچنین، سرعت مصرف آمونیاک دو برابر آهنگ مصرف گاز نیتروژن است.
مثال ۴
واکنش زیر را درنظر بگیرید.
میزان سرعت مصرف هیدروژن پراکسید در این واکنش برابر ۰٫۰۰۳۲۰ مول بر لیتر بر دقیقه است. با توجه به این مقدار، سرعت تولید آب و اکسیژن را محاسبه کنید.
پاسخ
معادله آهنگ واکنش برای این فرآیند به شکل زیر نوشته میشود.
با توجه به این که سرعت مصرف هیدروژن پراکسید در صورت سوال نوشته شده است، با توجه به ضرایب استوکیومتری، آهنگ تولید دو ماده دیگر به شکل زیر محاسبه میشود.
سرعت لحظه ای واکنش
بیشتر واکنشهای شیمیایی با گذر زمان کند میشوند. در نتیجه، آهنگ واکنشی که در قسمتهای قبل معرفی شد، در مدت زمانهای بسیار طولانی از شروع واکنش، معنی خود را از دست خواهد داد. در نتیجه میزان سرعت واقعی واکنشهای شیمیایی طی مدت زمان طولانی بسیار تغییر خواهد کرد. میزان سرعت لحظهای (دیفرانسیلی) واکنشهای شیمیایی برابر با میزان شیب خط مماس رسم شده در زمانهای مشخص بر منحنی نمودار غلظت بر حسب زمان خواهد بود.
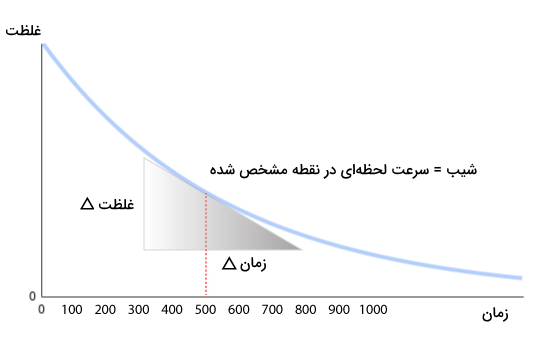
تفاوت بین سرعت لحظهای و سرعت متوسط یک واکنش مانند تفاوت آهنگ لحظهای و متوسط ماشین است. سرعت طی واکنش ممکن است کم و زیاد باشد اما در یک لحظه مشخص سرعت آن با سرعت آن در یک بازه زمانی متفاوت خواهد بود. در سینتیک شیمیایی، تنها بر یک سرعت لحظهای تمرکز خواهیم کرد که آن سرعت واکنش در لحظه ابتدایی شروع واکنش است. آهنگ لحظهای واکنش از اندازهگیری آهنگ واکنش در زمانهای مختلف و سپس برونیابی نمودار سرعت بر حسب زمان به دست میاید.
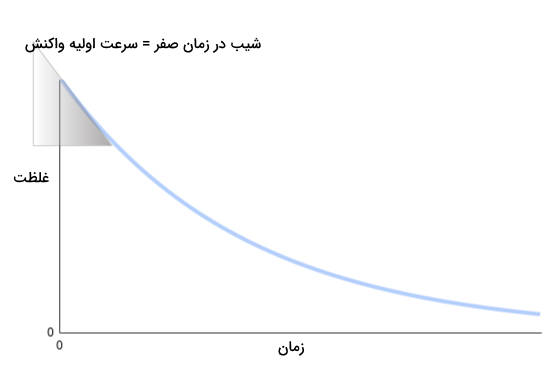
سرعت لحظهای که در ابتدای واکنش اندازهگیری شده باشد، آهنگ اولیه نام دارد. بررسی سرعت اولیه واکنش نقشی مهم در مطالعه سینتیک واکنشها دارد. تصویر زیر نمایانگر آهنگ اولیه لحظهای در نمودار غلظت- زمان است.
مثال
با توجه به شکل و معادله واکنش زیر، مقدار آهنگ واکنش اولیه و مقدار سرعت را در ثانیه ۶۰۰ حساب کنید.
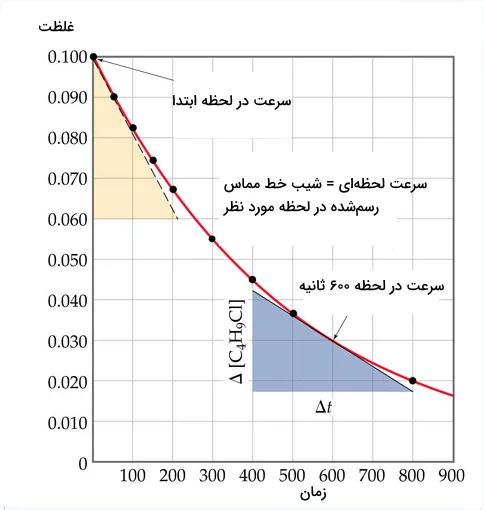
پاسخ
برای اندازهگیری میزان سرعت لحظهای واکنش در لحظه اولیه، باید آهنگ اولیه را با استفاده از شیب نمودار در لحظه اولیه محاسبه کنیم. برای این کار خط مماسی بر نمودار در لحظه t=۰ رسم کرده و شیب آن را به دست میآوریم.
برای محاسبه سرعت در لحظه ۶۰۰ ثانیه نیز باید خط مماسی بر آن رسم کرده و شیب خط را به دست آوریم.
قانون سرعت و ثابت سرعت
یکی از مهمترین مسائلی که در بررسی سرعت واکنش وجود دارد، این است که بدانیم قانون آهنگ واکنش چیست. قانون سرعت مفهومی است که آهنگ واکنش را به ثابت سرعت و غلظت واکنش دهندهها مربوط میکند. ثابت سرعت «k» یک ثابت نسبی برای واکنش است. قانون سرعت کلی با معادله زیر بیان میشود.
در این معادله واکنش «R» مقدار آهنگ واکنش و حروف s و t مراتب واکنش هستند که به صورت تجربی تعیین میشوند. همانطور که مشاهده میکنید، میزان آهنگ واکنش به میزان غلظت واکنشدهندهها وابسته است.
مرتبه واکنش
مرتبه واکنش میزان وابستگی سرعت واکنش را به غلظت واکنشدهندهها مشخص میکند. آهنگ واکنش برای یک واکنش شیمیایی یک ابزار کارآمد برای محاسبه مرتبه واکنشها است. مرتبه واکنش به ما این امکان را میدهد که واکنشهای شیمیایی را به راحتی و درستی دسته بندی کنیم.
در یک واکنش شیمیایی مرتبه هر واکنش دهنده به روش تجربی تعیین شده و میزان مرتبه کلی واکنش جمع مراتب واکنش دهندهها است. برای مثال مرتبه کلی واکنش بالا جمع مقادیر s و t است. قابل توجه است که با اینکه مقادیر مرتبه واکنش از قانون سرعت به دست میآیند اما این مقادیر هیچ رابطهای با ضرایب استوکیومتری مواد ندارند.
واکنشهای شیمیایی میتوانند بر اساس سینتیک واکنشهایشان به دستههای مختلفی تقسیم شوند. واکنشها میتوانند در دسته بندیهای مرتبه صفر، مرتبه اول، مرتبه دوم و مرتبه مختلط (مراتب بالاتر) قرار بگیرند.
واکنش مرتبه صفرم
واکنشهای مرتبه صفر از غلظت واکنشدهندهها مستقل هستند و قانون سرعت آنها تنها شامل ثابت سرعت است. فرمول محاسبه آهنگ این واکنشها به شکل زیر است و واحد ثابت سرعت در این واکنشها مولاریته بر ثانیه است.
به این دلیل به این واکنشها واکنش مرتبه صفرم گفته میشود که مرتبه واکنشدهندهها در این واکنشها صفر بوده و در قانون سرعت حذف میشوند. محاسبه آهنگ واکنش در واکنشهای مرتبه صفرم به شکل زیر است.
همچنین اگر نمودار غلظت بر حسب زمان را برای این واکنشها رسم کنیم، به شکل زیر خواهد بود. در این واکنشها، ثابت سرعت واحدی برابر با سرعت واکنش خواهد داشت.
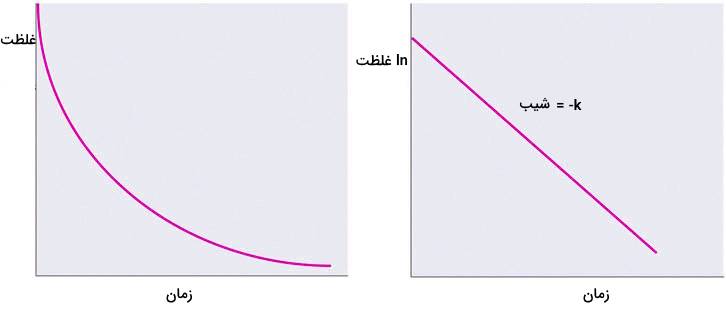
واکنشهای مرتبه اول
در واکنشهای مرتبه اول، آهنگ واکنش ضریبی از غلظت یکی از واکنشدهندهها است. معادله قانون سرعت برای این واکنشها به شکل زیر است.
نمودار غلظت بر حسب زمان در این واکنشها به شکل زیر است. با رسم نمودار لگاریتمی این نمودار، مقدار ثابت سرعت به دست خواهد آمد.
واکنشهای مرتبه دوم
در این واکنشها، آهنگ واکنش با توان دوم غلظت یکی از واکنشدهندهها یا ضرب غلظت دو واکنشدهنده، در ارتباط است. فرمول قانون سرعت برای این واکنشها به شکل زیر است.
مثال ۱
به معادله واکنش زیر دقت کنید.
معادله قانون سرعت این واکنش به شکل زیر نوشته شده است. مرتبه واکنش را برای هریک از مواد به دست آورده و مشخص کنید واکنش مرتبه چندم است.
پاسخ
مرتبه نیتروژن مونوکسید برابر ۲، مرتبه گاز هیدروژن، ۱ و مرتبه کلی واکنش ۳ است.
مثال ۲
واکنش تریگلیسیرید و الکل به شکل زیر است. با توجه به قانون سرعت آن، مرتبه هریک از مواد و مرتبه کلی واکنش را به دست آورید.
پاسخ
مرتبه واکنش برای اتانول برابر با ۱ و برای تریگلیسیرید برابر با صفر است به همین علت سرعت واکنش مستقل از غلظت آن و از مرتبه اول است.

ثابت سرعت
ثابت سرعت پارامتری است که در قانون سرعت سینتیک شیمیایی میزان غلظت مولار مواد واکنشدهنده را به مقدار سرعت ارتباط میدهد. این پارامتر همچنین با عنوان ثابت آهنگ واکنش و ضریب سرعت واکنش نیز شناخته میشود. این پارامتر با حرف انگلسیی «k» نمایش داده میشود. ثابت سرعت به دما و غلظت وابسته است و تنها در شرایطی که دما و فشار ثابت نگه داشته شده باشند، مقدار ثابتی خواهد اشت.
روشهای مختلفی برای نوشتن معادله ثابت سرعت وجود دارد. در ادامه برای یک واکنش کلی با فرم زیر، قانون سرعت و ثابت سرعت را بررسی خواهیم کرد.
قبلا بررسی کردیم که برای همچین واکنشی مقدار آهنگ واکنش چیست. این معادله به شکل زیر نوشته میشود.
با جا به جا کردن مقادیر معادله و تنها کردن پارامتر ثابت سرعت، فرمول آن به شکل زیر نوشته میشود.
در این معادله پارامتر k میزان ثابت سرعت، و مقادیر [A] و [B] میزان غلظت مولار واکنش دهندهها هستند. همچنین مقدایر a و b مرتبههای واکنش هستند که به شکل تجربی تعیین میشوند.
ثابت سرعت معادله آرنیوس
معاله آرنیوس معادلهای است که بیان میکند رابطه دما با آهنگ واکنش چیست. بیا کلی این معادله این است که افزایش دما به اندازه ۱۰ درجه سلسیوس، میزان آهنگ واکنش را تا دو برابر افزایش میدهد. در واکنشهای واقعی این رابطه همواره صحیح نیست و به عوامل مختلفی وابسته است. معادله آرنیوس به شکل زیر است.
در این معادله k مقدار ثابت سرعت، A ثابت نمایی، انرژی فعال سازی، R ثابت جهانی گازها و T دمای مطلق بر حسب درجه کلوین است.
نکته مهم
مقدار ثابت سرعت بر خلاف نامش در واقع مقدار ثابتی ندارد. این پارامتر تنها در صورت ثابت نگه داشتن دما مقدار ثابتی خواهد داشت. این پارامتر با افزودن کاتالیست، تغییر فشار و حتی هم زدن مخلوط واکنش دچار تغییر میشود. همچنین این پارامتر در صورتی که واکنش شامل مولکولهای بزرگ در غلظتهای بالا باشد نیز مقادیر صحیحی را نشان نمیدهد و قابل استفاده نیست.
بررسی آهنگ واکنش در مقیاس مولکولی
یکی از مهمترین دلایل مطالعه سینتیک واکنشهای شیمیایی، استفاده از آنها برای اندازهگیری ویژگیهای سیستم در مقیاسهای ماکروسکوپی است. برای مثال سرعت تغییر غلظت واکنشدهندهها یا فرارودهها با گذر زمان از این ویژگیهای هستند. مطالعه این ویژگیهای برای پیشبینی پیشامدهایی که در مقیاس مولکولی طی یک واکنش شیمیایی اتفاق میافتد استفاده میشود. این تشریح مولکولی درواقع همان مکانیسم واکنش است. مکانیسم واکنش بیان میکند که اتمها، مولکولها و یونها چگونه با یکدیگر واکنشداده و مواد دیگر را تولید میکنند.
برای مثال در سوخت موتورها، ایزواکتان و اکسیژن واکنش میدهند و کربن دی اکسید و آب را تولید میکنند. این واکنش به شکل زیر انجام میشود.
برای انجام شدن این واکنش ۲۵ مولکول اکسیژن و ۲ مولکول ایزواکتان باید با یکدیگر ترکیب شوند تا ۳۴ مولکول فرآورده را تولید کنند. این فرآیند منطقی به نظر نمیرسد و در واقعیت انجام نشدنی است. در واقع این فرآیند از ترکیب چند واکنش شیمیایی کوچکتر و پشت سر هم، واکنشدهندهها را به فرآوردهها تولید میکند. در فرآیندهای این چنینی به واکنشهایی که بین واکنش اول تا آخر اتفاق میافتند، واکنشهای واسطه یا میانی گفته میشود.
بررسی سرعت واکنشهای میانی
برای درک بهتر این موضوع که چگونه واکنشهای واسطه، فرآورده نهایی را تولید میکنند، به واکنش سادهتر کربن مونوکسید و نیتروژن دیاکسید توجه کنید.
از واکنش بالا این برداشت میشود که دو مولکول نیتروژن دی اکسید و کربن مونوکسید با یکدیگر ترکیب شده و نیتروژن مونوکسید و کربن دی اکسید تولید میشود. اما بررسی سینتیکی این واکنش نشان داده که قانون سرعت برای این واکنش به شکل زیر است.
این بیان نشان میدهد که این واکنش از برخورد ساده مولکولهای نیتروژن دی اکسید و کربن مونوکسید اتفاق نمیافتد. در واقع این واکنش از ترکیب واکنشهای زیر اتفاق میافتد. آهنگ واکنش اول خیلی کمتر از واکنش دوم است. به همین علت، سرعت واکنش مستقل از غلظت کربن مونوکسید خواهد بود.
یادگیری شیمی عمومی با فرادرس
دروس شیمی یکی از مهمترین مباحثی هستند که در پایه متوسطه دوم و پایههای بالاتر دانشگاهی تدریس میشوند. در این دروس، مفاهیمی مانند جرم یا ترکیب مواد شیمیایی توضیح داده میشوند و مباحثی مانند کیفیت و نحوه برهمکنش مواد بررسی میشوند. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این موارد میپردازند.
همچنین با مشاده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، می توانید به آموزش های بیشتری در زمینه شیمی دسترسی داشته باشید.
جدول فرمول آهنگ واکنش
در جدول زیر از مجله فرادرس، فرمول محاسبه آهنگ واکنش با استفاده از پارامترهای مختلف آورده شده است.
| پارامتر اندازهگیری شده | فرمول آهنگ واکنش |
| گرم (جرم) مواد | |
| مول مواد | |
| غلظت مواد | |
| حجم مواد | |
| معادله آرنیوس |
source