در این مطلب میآموزیم واکنش برگشت پذیر چیست و روش نوشتن معادلات برای این واکنشها چگونه است. سپس تفاوت واکنشهای برگشتپذیر و برگشتناپذیر را بررسی کرده و روش تشخیص آنها را توضیح میدهیم. پس از آن مثالهایی را برای واکنشهای برگشتپذیر و برگشتناپذیر بررسی میکنیم و میآموزیم تغییر انرژی در واکنشهای برگشتپذیر به چه صورت است. در نهایت واکنشهای تعادلی و اصل لوشاتلیه را برای پیشبینی جهت این واکنشها توضیح میدهیم. با مطالعه این مطلب تا انتها با این مفاهیم به همراه مثالهای آنها آشنا شوید.
واکنش برگشت پذیر چیست؟
برای درک این موضوع که واکنش برگشت پذیر چیست باید به واکنشدهندهها و فرآوردههای آن توجه کنیم. برخی از واکنشها به شکل کامل انجام میشوند بدین صورت که واکنشدهندهها به طور کامل برای تولید فرآوردهها مصرف میشوند و واکنش پس از مصرف همه واکنشدهندهها متوقف میشود. در واکنشهای برگشتپذیر، مولکولهای فرآوردهها با یکدیگر ترکیب شده یا تجزیه میشوند تا مولکولهای واکنشدهنده دوباره تولید شوند. به عبارت دیگر واکنش هم در جهت رفت و هم در جهت برگشت برقرار است. به این دسته واکنشها، واکنشهای برگشتپذیر گفته میشود.
در واکنشهای برگشتپذیر، واکنشدهندهها و فرآوردهها به طور کامل مصرف میشوند. هرکدام از این مواد با روندی تکرارپذیر تولید و مصرف میشوند. در این واکنشها میزان انرژی صرف شده در یک سمت با میزان انرژی تولید شده در سمت دیگر برابر است. برای مثال اگر واکنش گرماگیر باشد، واکنش برگشت آن گرماده است و بالعکس. در واکنشهای برگشتپذیر، اگر با شکستن پیوندهای واکنشدهندهها، پیوندهای جدیدی برای تولید مولکولهای فرآورده تشکیل شود و انرژی آزاد شود، آن انرژی برای شکستن پیوندهای فرآورده و تولید پیوند برای تولید مولکولهای واکنشدهنده صرف میشود.
تا سال 1803، تصور میشد که همه واکنشهای شیمیایی غیرقابل برگشت هستند، تا اینکه شیمیدان فرانسوی، کلود برتوله «Claude Louis Berthollet»، مفهوم واکنشهای برگشتپذیر را معرفی کرد. او ابتدا مشاهده کرد که سدیم کربنات و کلسیم کلرید با هم واکنش داده و کلسیم کربنات و سدیم کلرید تولید میکنند. اما پس از مشاهده تشکیل سدیم کربنات در اطراف لبههای محلولهای نمکی، متوجه شد که مقدار زیادی نمک در آب در حال تبخیر با کلسیم کربنات واکنش داده و سدیم کربنات تشکیل میدهد، که نشاندهنده وقوع واکنش معکوس بود.
اگر یک واکنش برگشتپذیر در یک ظرف بسته انجام بگیرد، به تعادلی پویا میرسد. بدین معنی که پس از گذشت مدت زمان مشخص، سرعت واکنش رفت و سرعت واکنش برگشت با یکدیگر برابر خواهد شد.
معادلات واکنش برای واکنش برگشتپذیر
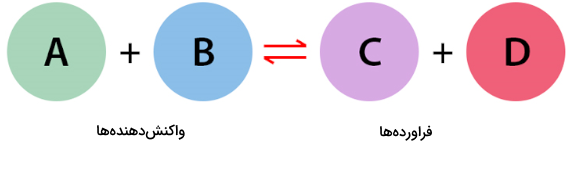
واکنشهای شیمیایی با معادله واکنش شیمیایی نشان داده میشوند که شامل نماد عناصر، ضرایب استوکیومتری، زیروندها و فلش (جهت) واکنش است. واکنشها عموما با یک فلش از جهت واکنشدهندهها به فرآوردهها (چپ به راست) نشان داده میشوند.
برای مشخص کردن یک واکنش برگشتپذیر، نماد «فلش دوطرفه» استفاده میشود. این نماد به معنی این است که یک واکنش از چپ به راست واکنشدهندهها ار به فرآوردهها و واکنش دیگر از راست به چپ، فرآوردهها را به واکنشدهندهها تبدیل میکند.
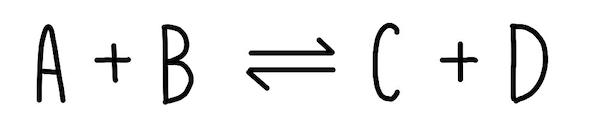
یکی از مثالهای فرآیندهای برگشتپذیر، واکنش هابر برای تولید آمونیاک است. در این واکنش از ترکیب نیتروژن و هیدروژن آمونیاک تولید شده و در جهت برگشت نیز آمونیاک، هیدروژن و نیتروژن را تولید میکند. معادله این واکنش به شکل زیر نوشته میشود.
یادگیری شیمی دهم با فرادرس
واکنشهای شیمیایی از لحاظ سینتیکی به دو دسته برگشتپذیر و برگشتناپذیر تقسیم میشوند. این واکنشها از لحاظ پایداری فرآوردهها با یکدیگر تفاوت دارند. در واکنشهای برگشتپذیر، فرآوردههای واکنش میتوانند با یکدیگر ترکیب شده و دوباره واکنشدهندهها را تولید کنند. برای فهم این موضوع که واکنش برگشت پذیر چیست و تشخیص آن باید با مفاهیمی مانند ساختار اتم، واکنشهای شیمیایی، توزیع الکترون، ساختار لوییس و … آشنا شوید. برای آشناهایی با این مفاهیم پیشنهاد میکنیم به مجموعه فیلم آموزش دروس پایه دهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازند.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در رابطه با واکنشهای برگشتپذیر دسترسی داشته باشید.
واکنش برگشتناپذیر چیست؟
واکنشهای برگشتناپذیر واکنشهایی هستند که پس از ترکیب واکنشدهندهها و اتمام آنها برای تولید فرآورده، واکنش متوقف میشود. این واکنشها به صورت خودبهخود و بدون صرف انرژی اضافه در جهت برگشت انجام نمیشوند. در این واکنشها تمامی واکنشدهندهها به فرآورده تبدیل میشوند و تنها در یک جهت پیش میروند. این واکنشها با یک فلش از جهت چپ به راست «» نشان داده میشوند.
یکی از اصول پایه شیمی این است که واکنشدهندهها با یکدیگر ترکیب شوند و فرآوردهها را به وجود آورند. این واکنشهای تک جهته با نام واکنشهای برگشتناپذیر شناخته میشوند. در این واکنشها مولکولهای مواد فرآورده نمیتوانند به مولکولهای واکنشدهنده تبدیل شوند. واکنشهای برگشتناپذیر مانند فرآیند پخت نان هستند و مواد تشکیلدهنده با یکدیگر ترکیب شده و پخته میشوند اما نان پخته شده را نمیتوان به آرد، اب و سایر ترکیبات تبدیل کرد.
یکی از مثالهای واکنش برگشتناپذیر سوختن است. فرآیندهای سوختن به فرآیند ترکیب مواد با گاز اکسیژن گفته میشود که طی آن نور و حرارت زیادی آزاد میشود و قابل برگشت نیستند. برای مثال در فرآیند سوخت هیدروکربنها، کربن دی اکسید و آب تولید میشود. به دلیل اینکه کربن دی اکسید و آب فرآوردههایی پایدار هستند، با یکدیگر واکنش نمیدهند و نمیتوان از آنها واکنشدهندهها را به وجود آورد. معادله کلی واکنشهای سوختن به شکل زیر است.
سیستم واکنش برگشت پذیر چیست؟
در واکنشهای برگش پذیر، واکنشدهندهها و فرآوردهها به طور کامل مصرف میشوند. اگر یک واکنش برگشتپذیر با دو واکنشدهنده و فرآورده داشته باشیم، میتوان آن را با معادله واکنش زیر نشان داد.
این معادله واکنش در واقع از ترکیب دو واکنش رفت و برگشت تشکیل شده است. این واکنشها در ادامه به صورت جداگانه نوشته شده است.
این دو واکنش به شکلی همزمان در حال انجام هستند. به این معنا که واکنشدهندهها با یکدیگر ترکیب میشوند تا فرآورده را تشکیل دهند و فرآوردهها همزمان با یکدیگر ترکیب میشوند تا واکنشدهندهها را تشکیل دهند. پس از تشکیل فرآوردهها، پیوندهای بین این مواد شکسته شده و مولکولها با یکدیگر ترکیب میشوند. انجام شدن همزمان این واکنشها انرژی لازم را برای شکستن پیوند تمامی مواد فرآورده و واکنشدهنده تولید میکند.
در ادامه مثالی از یک واکنش برای توضیح این که واکنش برگشت پذیر چیست ارائه میدهیم. واکنش تبدیل مولکولهای دی نیتروژن تترا اکسید به مولکولهای نتیروژن دی اکسید یک واکنش برگشتپذیر است. در تصاویر زیر مشاهده میکنید که واکنش برگشتپذیر کلی از ترکیب هر دو واکنش رفت و برگشت تشکیل شده و همهی مولکولهای فرآورده و واکنشدهنده به طور همزمان در واکنش شرکت میکنند. باید توجه داشت که نسبت حضور هریک از این مواد در هر مقطع از واکنش به عوامل مختلفی بستگی دارد.

تشخیص واکنش برگشتناپذیر
اگر یکی از مواد فرآورده بهمحض تولید شدن از محیط واکنش خارج شود، واکنش دیگر نمیتواند در جهت عکس انجام شود. این مسئله باعث میشود که واکنش از نوع برگشتناپذیر باشد. در اصطلاح این واکنشها به سمت کامل شدن پیش میروند. این واکنشها سه نوع فرآورده دارند که با مشاهده آنها میتوان نتیجه گرفت واکنش برگشتناپذیر است. این موارد رسوب انحلال ناپذیر، گاز یا یک ترکیب مولکولی پایدار مانند آب هستند. در ادامه این موارد با مثال توصیح داده شدهاند.
تشکیل رسوب
به مثال زیر توجه کنید. در واکنش زیر، رسوب کلرید نقره تشکیل شده است.
رسوب کلرید نقره تولید شده در این واکنش قابل انحلال نیست و به عبارتی از محیط واکنش خارج شده است و واکنش نمیتواند در جهت برگشت انجام شود.
تولید گاز
در واکنشهایی که گاز به عنوان فرآورده واکنش تولید میشود، احتمال خارج شدن گاز از محیط واکنش بسیار زیاد است و واکنش نمیتواند در جهت برگشت پیش برود. برای مثال به واکنش منیزیم و اسید کلریدریک توجه کنید.
source