ظرفیت اسید و باز اشاره به تعداد یونهای هیدروژن مثبت و هیدروکسید منفی دارد که اسید و باز میتوانند در واکنشها آزاد کنند. طبق تعریف لوری برونستد، اسیدها قابلیت از دست دادن یون هیدروژن و بازها توانایی از دست دادن یون هیدروکسید یا دریافت یون هیدروژن را دارند. در برخی از مطالب علمی به یون هیدروژن مثبت «پروتون» گفته میشود. طبق این تعریف اسیدها انتقال دهنده پروتون و بازها گیرنده پروتون هستند. ظرفیت اسید و باز نسبت به تعداد این یونها میتواند از نوع تکظرفیتی و چندظرفیتی باشد. مطالعه خواص و محسابات مربوط به ظرفیت اسید و باز نقش مهمی در بسیاری از فرایندهای بیولوژیک، صنایع داروسازی، کشاورزی و آب و فاضلاب دارد. در این مطلب از مجله فرادرس به بررسی این خاصیت اسید و باز، کاربردهای آن و محاسبات مربوط به این خاصیت میپردازیم.

در ابتدای این مطلب تعریف ظرفیت اسید و باز را بیان میکنیم. سپس هرنوع از اسید و بازهای تکظرفیتی، دو ظرفیتی و غیره را همراه با واکنشهای تفکیک آنها در آب بررسی میکنیم. طی انحلال اسید و باز در آب، مولکولهای آنها میتوانند تفکیک شوند و عبارت ثابت تفکیک اسید و باز برای آنها تعریف میشود. در ادامه مطلب به توضیح و بررسی ثابت تفکیک برای ظرفیتهای مختلف اسید و باز میپردازیم. یکی از مهمترین مسائل در این مبحث، شناسایی ظرفیت اسید و باز به شکلهای مختلف است. پس از توضیح این روشهای شناسایی به توضیح عمیقتری درباره روش تیتراسیون در این روشها میپردازیم و منحنیهای تیتراسیون را برای هریک بررسی میکنیم. در نهایت روش محاسبه pH این مواد و تفاوت و کاربردهای آنها را توضیح میدهیم. با مطالعه این مطلب تا انتها با این مطالب مهم آشنا شوید و آنها را همراه با مثال و جدول به شکلی عمیق و کاربردی بیاموزید.
ظرفیت اسید و باز چیست؟
در سال ۱۹۲۳ دو شیمیدان به نامهای یوهان برونستد و توماس لوری معنی جدیدی برای اسید و باز ارائه کردند. طبق این تعریف اسیدی بودن و بازی بودن مواد وابسته به یون بود. این دانشمندان بیان کردند که اسیدها موادی هستند که میتوانند یون را از دست بدهند و باز ها را موادی تعریف کردند که میتواند یون را دریافت کنند. برای مثال واکنش شیمیایی زیر را درنظر بگیرید.
در این معادله واکنش، اسید کلریدریک یک یون «یک پروتون» را از دست داده و آنرا به باز آمونیاک میدهد. بنابراین اسید کلریدریک یک اسید لوری برونستد و آمونیاک یک باز لوری برونستد است.
طبق این تعریف به تعداد یونهای که اسید میتواند از دست بدهد یا باز دریافت کند، ظرفیت اسید و باز گفته میشود. در برخی از متون شیمی، به ظرفیت باز، تعداد یونهای هیدروکسید که میتواند از دست بدهد گفته میشود.
برخی از اسیدها و بازها دارای چند یون یا برای از دست دادن هستند. بنابراین اسیدها و بازها میتوانند از نوع تکظرفیتی و چندظرفیتی باشند.

جدول مفاهیم و تعاریف مهم ظرفیت اسید و باز
در این مطلب و مطالب مربوط به ظرفیت اسید و باز با مفاهیم و عبارات مهم و متفاوتی روبهرو خواهید شد. در جدول زیر توضیحات مربوت به این مفاهیم و نکات مهم خلاصه شده است.
| موضوع | اسید و باز تکظرفیتی | اسید و باز چندظرفیتی |
| تعریف | اسید تکظرفیتی تنها یک یون هیدروژن از دست میدهد و باز تکظرفیتی تنها یک یون هیدروژن دریافت میکند. | اسید و بازهایی که بیشتر از یک یون هیدروژن اهدا یا دریافت میکنند. |
| مثال اسیدها | کلریدریک اسید، نیتریک اسید، استیک اسید | سولفوریک اسید، اسید فسفریک، اسید کربنیک |
| مثال بازها | سدیم هیدروکسید، پتاسیم هیدروکسید، آمونیاک | منیزیم هیدروکسید، کلسیم هیدروکسید |
| معادله تفکیک اسید |
|
|
| معادله تفکیک باز |
|
|
| منحنی تیتراسیون | تنها یک نقطه همارزی دارد. | به ازای ظرفیت اسید یا باز چند نقطه همارزی دارد. |
| قدرت اسیدی یا بازی | بسته به میزان تفکیک میتواند از نوع ضعیف یا قوی باشد. | میزان قدرت کلی اسید و باز به ثابت تفکیک کلی آنها بستگی دارد اما همواره ثابت تفکیک اول هر اسید و باز از باقی آنها بزرگتر است. |
| کاربرد | در واکنشهای ساده اسید و باز مانند واکنشهای اسید معده و تیتراسیون کاربرد دارد. | در سیستمهای محلولهای بافری مانند کربنیک اسید در خون و سیستمهای محیط زیستی کاربرد دارد. |
یادگیری ظرفیت اسید و باز با فرادرس
یکی از مهمترین مباحث مطرح شده در شیمی، مبحث اسید و باز است. برای شناسایی و پیشبینی بسیاری از واکنشهای شیمیایی باید با این مواد و واکنشها و کاربردهای آنها آشنا شویم. برای یادگیری مباحثی که در مورد اسیدها و بازها مطرح میشود، نظریههای مختلف مانند آرنیوس، لوری برونستد و لوییس از موضوعات پایه ای و مهم است. از سایر موضوعات مهم این مواد مقایسه قدرتها، ظرفیت اسید و باز،محاسبه pH محلولها و شناساگرها است. برای یادگیری این مباحث پیشنهاد میکنیم به مجموعه آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی این مباحث را توضیح میدهد.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به اموزشهای بیشتری در زمینه ظرفیت اسید و باز دسترسی داشته باشید.
اسید تک ظرفیتی چیست؟
هنگامی که مولکول اسید در محلولهای آبی تفکیک میشود، یک یون از آن جدا میشود. اگر این یون جدا شده تنها یون موجود در ساختار اسید باشد، به آن اسید، اسید تکظرفیتی گفته میشود. برای مثال اسید کلریدریک و نیتریک اسید، از نوع اسید تکظرفیتی هستند. در ادامه معادله واکنش تفکیک این اسیدها در محلول آبی نوشته شده است. طبق این معادلات میتوانید جداشدن یون از این اسیدها را مشاهده کنید.
بجز اسیدهای تکظرفیتی معدنی رایج مانند اسید کلریدریک و اسید نیتریک، اسیدهای تکظرفیتی آلی نیز وجود دارند. معمولا اگر یک گروه کربوکسیلیک در ساختار اسید آلی وجود داشته باشد، اسید تکظرفیتی است. برای مثال استیک اسید، بنزوییک اسید و آمینو اسیدهای ساده مانند گلایسین از اسیدهای آلی تکظرفیتی هستند.
مثال اسید تک ظرفیتی
تمامی اسیدهایی که تنها یک هیدروژن در ساختار خود دارند، اسید تکظرفیتی هستند اما عکس این موضوع صحیح نیست. گاهی وقتها اسیدهای تکظرفیتی وجود دارند که ممکن است دارای بیشتر از یک عدد اتم هیدروژن باشند. مهمترین نکته در مورد اسیدهای یک و چندظرفیتی این است که تمایل آنها به از دست دادن هیدروژن چقدر است. برای مثال اسید استیک دارای ۴ اتم هیدروژن در ساختار خود است اما تنها یکی از آنها را میتواند از دست بدهد بنابراین یک اسید تکظرفیتی است. به واکنش تفکیک استیک اسید که در تصویر زیر مشخص شده است، توجه کنید.
در مثالی دیگر به یون توجه کنید. این یون ۵ اتم هیدروژن دارد اما تنها یکی از آنها را میتواند از دست بدهد. اتم کربن در حالت عادی ۴ پیوند برقرار میکند و متان تولید شده در حالت پایداری قرار دارد و هیدروژن از دست نمیدهد. به معادله واکنش تفکیک این یون توجه کنید.
بسیاری از یونهای حاوی هیدروژن با بار مثبت تمایل به از دست دادن یون را دارند تا بدین گونه به حالت خنثی و پایدار برسند.
اسید چند ظرفیتی چیست؟
اسیدهای چندظرفیتی بیش از یک اتم هیدروژن دارند که این اتمها میتوانند به شکل یونهای از اسید جدا شوند. اگر اسید مورد نظر دو یون پروتون در دسترس داشته باشد، اسید دو ظرفیتی است. اگر سه یون داشته باشد، اسید سه ظرفیتی است و این نام گذاری به همین ترتیب ادامه پیدا میکند.
برای مثال، هیدروژن سولفید و اسید سولفورسیک، اسیدهای دوظرفیتی هستند. اسید فسفریک با فرمول شیمیایی یک اسید سه ظرفیتی است. در بیشتر موارد، اسیدهای چندظرفیتی به طور کامل در آب تفکیک نمیشوند. ثابت تفکیک اسید برای هر یون که جدا میشود، با ثابت تفکیک برای یون هیدروژن دیگر در همان اسید متفاوت است. این پدیده به علت اثر عوامل مختلف که بر کشش بار الکترونی یونها به هسته تاثیر میگذارند، بستگی دارد. برای مثال در فسفریک اسید اولین ثابت تفکیک اسید است و ثابت تفکیک برای هیدروژن دوم برابر با است. این بدان معنا است که انرزی مورد نیاز برای جدا کردن هریک از یونهای اسیدهای چندظرفیتی با یکدیگر متفاوت است.
برای تمامی اسید و بازهای چندظرفیتی همواره ثابت تفکیک اول از دوم و دوم از سوم بیشتر است.
مثال اسید چند ظرفیتی
در جدول زیر چند اسید چند ظرفتی و یونهایی که تولید میکنند مشخص شده است.
| اسید اولیه | فراورده تفکیک اول | فراورده تفکیک دوم | فراورده تفکیک سوم |
|
(هیدروژن سولفید) |
— | ||
|
(سولفوریک اسید) |
— | ||
|
(فسفریک اسید ) |
از دیگر اسیدهای چندظرفیتی میتوان به سولفوروس اسید ، اگزالیک اسید ، کربنیک اسید و مالونیک اسید اشاره کرد.
ثابت تفکیک اسید و باز چند ظرفیتی
در قسمت قبل اشاره کردیم که میزان تفکیک اسیدها و بازها با عباراتی به نام ثابت تفکیک اسید و باز مشخص میشود. در مورد اسیدها و بازهای چندظرفیتی، به تعداد یونهای هیدروژن یا هیدروکسید اسید و باز ثابت تفکیک خواهیم داشت. حال میخواهیم بدانیم ثابت تفکیک کلی این اسیدها و بازها چگونه محاسبه میشود. برای درک این موضوع، معادلات تفکیک هیدروژن سولفید را در آب در نظر بگیرید.
در مرحله اول یک یون هیدروژن از هیدروژن سولفید جدا میشود و معادله آن به صورت زیر خواهد بود.
همانطور که توضیح داده شد، میزان ثابت تفکیک اسید، نسبتی از غلظت یونهای تفکیک شده به غلظت اسید در نقطه تعادل است. بنابراین ثابت تفکیک اول این اسید به شکل زیر محاسبه میشود.
در تفکیک دوم این اسید معادله زیر را خواهیم داشت. معادلهی تفکیک دوم این اسید نیز نوشته شده است.
اگر معادله کلی تفکیک این اسید را بنویسیم و ثابت تفکیک اسید را برای آن محاسبه کنیم، متوجه میشویم که ثابت تفکیک این اسید از ضرب دو ثابت تفکیک اول و دوم به دست میآید.

باز تک ظرفیتی چیست؟
عبارت باز تکظرفیتی اشاره به بازهایی دارد که تنها یک یون هیدروکسید دارند و تنها میتوانند یک یون هیدروژن دریافت کنند. برای مثال هیدروکسیدهای یونی مانند بازهای سدیم هیدروکسید، پتاسیم هیدروکسید و … که تنها یک یون هیدروکسید دارند، بازهای تکظرفیتی هستند. برای مثال معادله واکنش تفکیک باز سدیم هیدروکسید در آب را مشاهده کنید. طبق این معادله واکنش مشخص است که این باز در صورت تفکیک شدن تنها یک یون هیدروکسید آزاد میکند.
مثال باز تکظرفیتی
یون را در نظر بگیرید. این یون با دریافت یک یون هیدروژن هم به حالت خنثی در میآید هم اتم کربن به حالت سیر شده پیوندهای خود میرسد. پیکربندی پایدار اتم کربن همواره با ۴ پیوند صورت میگیرد. به معادله دریافت هیدروژن این باز تکظرفیتی توجه کنید.
یکی دیگر از مهمترین فرایندهای خنثی شدن بازهای تکظرفیتی به وسیله یون هیدروژن، برای یون هیدروکسید انجام میگیرد که در نهایت مولکول آب را تشکیل میدهد.
باز چند ظرفیتی چیست؟
بازهای چندظرفیتی، بازهایی هستند که بیش از یک یون هیدروکسید در ساختار خود دارند. برای مثال کلسیم هیدروکسید با دو یون هیدروکسید یک باز دوظرفیتی محسوب میشود. از مثالهای دیگر بازهای چندظرفیتی میتوان به یون فسفات و یون سولفات اشاره کرد که میتوانند به ترتیب سه و دو یون هیدروژن دریافت کنند.
برخی از فلزات واسطه مانند روی و مس ترکیبات هیدروکسید تشکیل میدهند. این ترکیبات حداقل دو یون هیدروکسید برای از دست دادن دارند. برای مثال به واکنشهای دریافت هیدروژن توسط باز چند ظرفیت کلسیم هیدروکساید که در ادامه نوشته شده است، توجه کنید.
مثال باز چند ظرفیتی
برای درک بهتر مفهوم باز چندظرفیتی به مثالهای زیر دقت کنید.
مثال ۱
آلومینیوم هیدروکسید، سه هیدروکسید در هر مولکول دارد در نتیجه یک باز سه ظرفیتی است. اگر X یک یون چنداتمی باشد، برای واکنش خنثی شدن زیر دو نمونه ممکن برای X را مثال بزنید.
پاسخ
از آنجا که در معادله بالا مقادیر آلومینیوم و X به نسبت یک به یک ترکیب شده اند و از انجا که آلومینیوم با ترکیب ۳ یون هیدروکسید یک یون ۳ بار مثبت تشکیل میدهد. پس یون X باید یک یون چند اتمی (طبق صورت سوال) باید سه بار منفی باشد. از دسته یونهای سه بار منفی چند اتمی میتوان به و برای جایگزینی با X را معرفی کرد. در نتیجه معادله واکنش خنثی شدن با این یونها به شکل زیر تبدیل میشود.
مثال ۲
مثال دیگری از بازهای چندظرفیتی یونهای کربنات هستند. این یونها بجای از دست دادن هیدروکسید، یون هیدروژن دریافت میکنند و بدین صورت باز در نظر گرفته میشوند. مراحل دریافت یون پروتون توسط یون کربنات تا تبدیل شدن به مولکول دی هیدروژن کربنات را بنویسید.
پاسخ
مراحل دریافت یون پروتون توسط یون کربنات تا تبدیل شدن به مولکول دی هیدروژن کربنات، دو واکنش زیر هستند.
دلیل این موضوع که هر یون کربنات دو یون هیدروژن دریافت میکند این است که کربنیک اسید در مراحل بعدی به دی اکسید کربن و آب تجزیه میشود. معادله این واکنش در ادامه نوشته شده است.

مثال ۳
با توجه به مثالهای قبلی، مشخص کنید که ترکیب یک باز چندظرفیتی است؟ همچنین معادله واکنش این ترکیب را با تعداد یونهای هیدروژنی که مشخص میکنید، بنویسید.
پاسخ
در هر مولکول این ترکیب یه سه یون کربنات وجود دارد. در قسمت قبلی آموختیم که هر یون کربنات یک باز دو ظرفیتی است و دو یون هیدروژن میپذیرد. پس جمعا ترکیب مشخص شده میتواند ۶ یون هیدروژن دریافت کند. معادله این واکنش به صورت زیر خواهد بود.
روش شناسایی ظرفیت اسید و باز
یکی از روشهای شناسایی ظرفیت اسید و باز انجام آزمایش تیتراسیون است. این آزمایش نقاط تعادلی اسید و باز که این مواد در آن نقطهها تفکیک میشوند را مشخص میکند. ثابت تفکیک اسید و ثابت تفکیک باز ثابتهای تعادلی هستند که برای واکنشهای تفکیک اسیدها و بازهای ضعیف تعریف شدهاند. به این ثابتهای تعادل ثابت یونش نیز گفته میشود. هرچه مقادیر ثابت تفکیک اسید و باز بزرگتر باشد، آن اسید و باز قویتر هستند.
برای یک اسید ضعیف به شکل کلی، معادله واکنش تفکیک به شکل زیر است.
مقدار ثابت تفکیک اسید برای معادله بالا از ضرب غلظت یونهای تفکیک شده بر غلظت اسید اولیه به دست میآید. معادله ریاضی محاسبه ثابت تفکیک اسید در ادامه نوشته شده است. براکتهای موجود در این معادله نشان دهنده غلظت هستند.
مطابق روش بالا برای تفکیک یک باز در آب، ثابت تفکیک باز تعریف میشود که به روش زیر به دست میآید.
$$BOH rightleftharpoons B^+ + OH^- label{3}$$
$$K_b = dfrac{[B^+][OH^-]}{[BOH]} label{4}$$
عبارت مهم دیگری که در رابطه با تفکیک اسید و باز وجود دارد، لگاریتم منفی ثابت تفکیک اسید و باز است که با عبارتهای و نشان داده میشوند. روش به دست آوردن این پارامترها به شکل زیر است.
با ضرب این پارامترها به ثابت مهمی به نام ثابت تفکیک آب میرسیم که از طریق آن به عبارت مهم pH دست مییابیم که یکی از مهمترین پارامترهای بررسی قدرت اسید و باز است. مقدار ثابت تفکیک آب از ضرب غلظت یونهای هیدرونیوم و هیدروکسید به دست میآید که همواره مقدار ثابت ۱۰ به توان ۱۴- را دارد. این روابط در ادامه نوشته شده اند.

روش تیتراسیون اسید و باز
قبل از این که به تیتراسیون و روش آن بپردازیم، باید مفهوم اسید و باز قوی و ضعیف را توضیح دهیم.
یک اسید قوی اسیدی است که به طور کامل دچار یونش شده و تفکیک میشود. این تفکیک در محلولهای آبی صورت میگیرد. از فرایند تفکیک این اسیدها در آب، یون هیدرونیوم تولید میشود. معادله واکنش تفکیک اسید کلریدریک و تولید یون هیدرونیوم به شکل زیر است.
یک اسید ضعیف به طور کامل در آب تفکیک نمیشود و تنها قسمتی از آن تفکیک میشود. معادله تفکیک اسید استیک در آب به شکل زیر است.
یک باز قوی به طور کامل در آب تفکیک شده و یونهای هیدروکسید تولید میکند. معادله تفکیک باز سدیم هیدروکسید در آب به شکل زیر است.
یک باز ضعیف به طور کامل در آب تفکیک نمیشود و مقدار زیادی از باز در محلول باقی میماند. برای مثال باز ضعیف آمونیوم هیدروکساید در آب به شکل زیر تفکیک میوشد.
پیشتر گفته شد که از تفکیک اسید و باز، باز و اسید مزدوج آنها تشکیل میشود. اسیدهای ضعیف، بازهای مزدوج قوی دارند. بازهای ضعیف اسیدهای مزدوج قوی دارند.
در تیتراسیونهای اسید و باز از شناساگرهای مختلفی مانند متیل اورانژ، فنل فتالئین، برموکروزول گرین و … استفاده میشود.
تیتراسیون چیست؟
تیتراسیون یک تکنیک برای اندازهگیری غلظت محلولهای نامشخص است. همانطور که در سیستم تیتراسیون زیر نشان داده شده است، یک غلظت مشخص از یک محلول (تیترانت) برای اندازهگیری غلظت نامشخص محلول دیگر (آنالیت) استفاده میشود. تیترانت درون یک بورت آزمایشگاهی ریخته میشود تا بتوان حجم مصرف شده آن را کنترل کرد.
اضافه شدن تیترانت به آنالیت تا نقطه پایانی تیتراسیون ادامه پیدا میکند. دانستن میزان تیترانت اضافه شده به آنالیت به ما این امکان را میدهد تا غلظت آنالیت را مشخص کنیم. در بیشتر مواد یک شناساگر مانند فنل فتالئین به محلول آنالیت اضافه میشود تا نقطه پایانی تیتراسیون به خوبی شناسایی شود. تیترانت و آنالیت در آزمایش تیتراسیون یک جفت اسید و باز هستند. واکنش این اسید و باز با چک کردن pH محلول به وسیله یک pH متر اندازهگیری میشود.
در آزمایش تیتراسیون یک مفهوم مهم به نام نقطه همارزی وجود دارد. نقطه همارزی زمانی است که میزان تیترانت اضافه شده برای خنثی کردن تمامی آنالیت کافی بوده است. در نقطه همارزی، مقدار مول باز با مقدار مول اسید برابر شده و محلول تنها حاوی نمک و آب حاصل از واکنش اسید و باز خواهد بود. برای مثال واکنش اسید کلریدریک و سدیم هیدروکساید در نقطه همارزی به شکل زیر خواهد بود.
شناساگر اضافه شده به محلول آنالیت در نقطه پایانی تغییر رنگ میدهد.
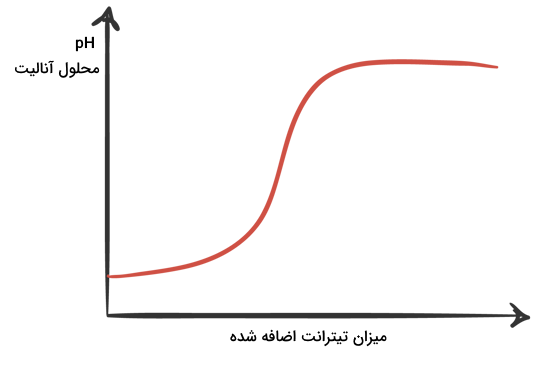
منحنی تیتراسیون چیست؟
منحنی تیتراسیون، نموداری است که بر حسب میزان pH و میزان تیترانت اضافه شده رسم میشود. این نمودار دارای یک یا چند نقطه عطف است که نقطه همارزی را نشان میدهد. در تیتراسیون اسید و بازهای تکظرفیتی این نمودارها تنها یک نقطه همارزی خواهند داشت و در تیتراسیون اسید و باز چندظرفیتی، به تعداد ظرفیت اسید و باز نقاط همارزی خواهیم داشت. تصویر زیر یک نمودار نمونه را برای تیتراسیون یک اسید یا باز تکظرفیتی نشان میدهد.
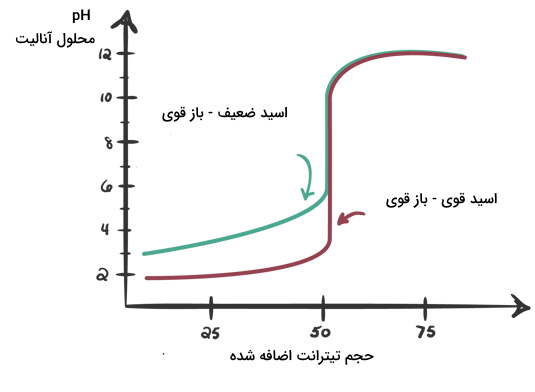
در تیتراسیون یک اسید قوی با یک باز قوی، نقطه همارزی واکنش حتما در pH برابر ۷ رخ میدهد. در این تیتراسیونها، منحنی تیتراسیون شکلی متقارن دارد. در تیتراسیون اسیدهای ضعیف با یک باز قوی یا بالعکس، نمودار تیتراسیون از حالت متقارن خود خارج شده و تغییر میکند. در تصویر زیر مقایسه منحنی تیتراسیون یک اسید قوی و یک اسید ضعیف را با باز قوی مشاهده میکنید.
روش تفکیک اسید و باز چند ظرفیتی
با توجه به این موضوع که اسیدها طی فرایندهای تفکیک شدن، یون هیدروژن خود را از دست میدهند، در فراورده واکنش تفکیک مادهای با بار منفی که شامل مولکول اسید بدون هیدروژن است باقی میماند. به این فراورده واکنش تفکیک، باز مزدوج گفته میشود. هرچند در مورد اسیدهای چندظرفیتی، باز مزدوج تولید شده از تفکیکهای مراحل اولیه، میتواند شامل یون هیدروژن باشد. یعنی این مواد هم میتوانند یک هیدروژن از دست داده و اسید تلقی شوند، هم میتوانند یک هیدروژن پذیرفته و به عنوان باز عمل کنند. در علم شیمی به اینگونه مواد، مواد آمفوتر میگویند و به خاصیتی که دارند خاصیت آمفوتری گفته میشود.
برای مثال به واکنشهای تفکیک اسید چندظرفیتی فسفریک اسید دقت کنید. معادله اولین تفکیک این اسید در ادامه نوشته شده است.
طبق معادله واکنش بالا میتوانید مشاهده کنید که اسید فسفریک با از دست دادن اولین هیدروژن خود، یون تولید کرده است. این یون، باز مزدوج اسید فسفریک است که میتواند در یک مرحله دیگر تفکیک شود و یک هیدروژن دیگر از دست بدهد و هم میتواند طبق معادله بالا در واکنش برگشتی هیدروژن بگیرد و دوباره به اسید فسفریک تبدیل شود.
معادله تفکیک دوم اسید فسفریک به شکل زیر خواهد بود.
طبق معادله بالا مشاهده میکنید که باز مزدوج مرحله قبل، یک هیدروژن از دست داد و به یون تبدیل شده است. این یون، باز مزدوج یون است. به دلیل اینکه یون تولید شده هنوز حاوی یک اتم هیدروژن است، میتواند یک مرحله دیگر تفکیک شود. معادله تفکیک این یون به شکل زیر است.
یون تولید شده از این مرحله است که باز مزدوج یون است. این یون دیگر اتم هیدروژنی برای از دست دادن ندارد و تنها میتواند هیدروژن بگیرد و به عنوان باز عمل کند پس دارای خاصیت آمفوتری نیست. بدین ترتیب مشاهده کردیم که اسید فسفریک یک اسید سه ظرفیتی است که طی سه مرحله تفکیک میشود. در بررسی ظرفیت اسید و باز باید توجه داشت که همهی تفکیکهای انجام شده با انرژی و سرعت یکسانی انجام نمیشوند. در ادامه مطلب این موضوع را بررسی خواهیم کرد.

سرعت مراحل تفکیک اسید و باز چند ظرفیتی
در قسمت قبل بررسی کردیم که تفکیکهای اسید و بار چندظرفیتی چگونه انجام میشوند. حال میخواهیم بدانیم تفاوت سرعت انجام هریک از این تفکیکها به چه شکل است. برای درک این مطلب، مراحل تفکیک اسید فسفریک را بررسی میکنیم. میزان اسیدی بودن اسیدهای چندظرفیتی یک قانون ساده دارد. هر یون جدا شده از یون قبلی خود کمتر اسیدی است. این بدان معنا است که تفکیک و جدا شدن آن سختتر و آهسته تر انجام میشود و به انرژی بیشتری نیاز دارد.
قبلا اشاره کردیم که میزان تفکیک یون از اسیدها با عبارت ثابت تفکیک اسیدی و دریافت یون توسط بازها با ثابت تفکیک بازی مشخص میشود. در ادامه به میزان ثابت تفکیک اسید برای مراحل مختلف تفکیک اسید فسفریک توجه کنید.
بین تفکیک یون اول و دوم، میزان ثابت تفکیک اسید تقریبا صدهزار برابر کوچکتر میشود. به همین ترتیب تفکیک سوم ۱۰ میلیارد بار کوچکتر از تفکیک دوم است. این بدان معنا است که جدا کردن یون آخر از اسیدهای چندظرفیتی (مخصوصا اسیدهای ضعیف) تقریبا غیرممکن است.
باید به این نکته توجه داشته باشید که تعداد هیدروژنهای اسیدها ارتباطی با قدرت خود اسید ندارد. برای مثال اسید کلریدریک که تنها یک هیدروژن دارد از اسید فسفریک که سه هیدروژن دارد ، اسید قویتری است.
گاهی وقتها تصور میشود که هرچه اسید قویتر باشد هر تعداد پروتون خود را میتواند به راحتی و به سرعت از دست بدهد و کاملا تفکیک شود. این مسئله ممکن است همواره درست نباشد. برای مثال به میزان ثابت تفکیک اسیدی برای اسید سولفوریک که یک اسید دو ظرفیتی است توجه کنید. اسید سولفوریک به دلیل ثابت تفکیک اسید مربوط به جداسازی یون هیدروژن اول خود که مقداری بزرگتر از ۱ دارد، یک اسید قوی در نظر گرفته میشود.
اما اگر به ثابت تفکیک این اسید برای دومین یون هیدروژن آن دقت کنیم، قابل توجه است که این مقدار کمتر از یک است و به راحتی انجام نمیشود.
این بدان معنا است که در یک محلول یک مولار اسید سولفوریک تنها ده درصد اسید سولفوریک تفکیک دوم را انجام میدهد. این اسید تنها در حضور یک باز مانند آمونیاک میتواند هردو تفکیکش را انجام دهد. این روند با انجام آزمایش تیتراسیون مشخص خواهد شد.
منحنی تیتراسیون اسید و باز تک ظرفیتی
اسیدها و بازهای تکظرفیتی تنها یک نقطه همارزی دارند. در این نقطه میزان مول استفاده شده برای خنثی کردن اسید مشخص میشود و از روی آن میزان مول اسید مصرف شده و غلظت آن محاسبه میشود. انحنای رسم شده در نمودار نشان دهنده فرایند کامل جداشدن یا دریافت یون هیدروژن برای اسید یا باز است. به منحنی تیتراسیون اسید و باز تکظرفیتی زیر توجه کنید.
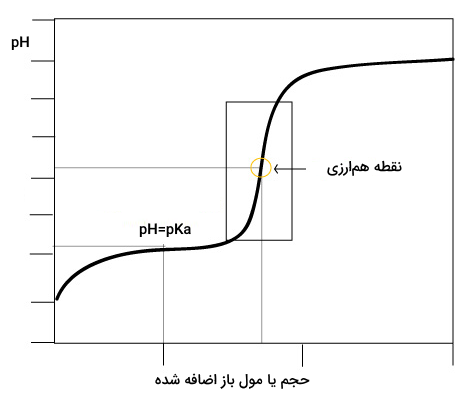
در شکل بالا مشاهده میکنید که برای اسید و باز تکظرفیتی تنها یک نقطه همارزی وجود دارد. این نمودارهای برای اسید و باز چندظرفیتی متفاوت است که در ادامه توضیح داده میشود.
منحنی تیتراسیون اسید و باز چند ظرفیتی
در قسمت قبلی آموختیم که اسیدهای چندظرفیتی با از دست دادن یک پروتون یا یون یک اسید ضعیفتر را شکل میدهند. یکی از مهمترین روشهای اندازهگیری قدرت اسید و باز، انجام آزمایشهای تیتراسیون اسید و باز است. در این آزمایشها یک اسید یا باز به آرامی به دیگری اضافه میشود. در این آزمایشها میزان اسیدیته محلول مورد آزمایش با یک pH متر اندازهگیری شده و گاهی شناساگرهایی برای تشخیص نقطه پایانی تیتراسیون به محلول اضافه میشوند.
در نهایت منحنی pH بر حسب میزان اسید یا باز اضافه شده رسم میشود که از روی منحنیهای آن میتوانیم به قدرت اسیدی مواد حاصل از تفکیک اسید یا باز پیببریم. تصویر زیر یک منحنی تیتراسیون را برای یک اسید دو ظرفیتی که با یک باز قوی تیتر شده را نشان میدهد.
مثال منحنی تیتراسیون
منحنیهای تیتراسیون اسید و باز چندظرفیتی، بسیاری از ویژگیهای اسید یا باز مورد آزمایش را آشکار میکند. این ویژگیها میتوانند مواردی از جمله تعداد ظرفیت اسید یا باز، مقادیر pH و و نقطه همارزی آن باشد. منحنی رسم شده یک شکل هلالی برای هر یون هیدروژن مربوط به ظرفیت اسید و باز را نشان میدهد و ناحیههای بافری و نقطه ای که اسید یا باز کاملا خنثی شده را کاملا تفکیک شده در این منحنیها مشخص میشوند.
در شکل بالا ۴ نقطه مشخص شده هرکدام نشان دهنده یک وضعیت در آزمایش هستند. در نقطه A مقدار ۰٫۵ مول از باز به اسید اضافه شده است. در اولین نقطه عطف نمودار، اسید ما یک عدد از یونهای خود را از دست داده است. نیمه دیگر اسید شامل یک اسید ضعیف و باز مزدوج اسید اصلی است. به محلولهای این چنین که شامل مخلوطی از اسید و باز مزدوج آنها هستند، محلول بافر گرفته میشود.
نقطه B نشان دهنده اولین نقطه همارزی واکنش است. در این نقطه تمامی اسید اولین یون خود را از دست داده است. نقطه C محل از دست دادن دومین یون هیدروژن اسید است. همانطور که میتوانید مشاهده کنید pH این نقطه حدود ۹ و نیم است که حاکی از قدرت اسیدی ناچیز هیدروژن دوم است. نقطه D دومین و آخرین نقطه همارزی واکنش است.
تیتراسیون اسید و بازهای چند ظرفیتی ضعیف
اسیدهای چندظرفیتی ضعیف مانند فسفریک اسید، چالشهایی را در منحنی تیتراسیون رسم شده خود نشان میدهند و نیازمند دقت و بررسی زیادی هستند. از آنجا که این اسیدها و بازها ضعیف هستند، به شکل کامل در فرایند تیتراسیون تفکیک نمیشوند در نتیجه، نقاط همارزی رسم شده برای تیتراسیون این مواد به راحتی قابل تشخیص نیست.
درک و مطالعه منحنی تیتراسیون این مواد به بررسی دقیق ناحیههای بافری نیاز دارد. این نواحی در نمودار نقاطی هستند که مقادیر pH با شیب بسیار کمی تغییر میکند و نشان دهنده یک جفت اسید و باز مزدوج هستند. مقادیر pH در این نقاط نمایانگر اطلاعات مهمی در رفتار این اسید و بازهای چندظرفیتی در محلولهای مختلف هستند.
اگر بخواهیم یک باز ضعیف و یک اسید ضعیف تکظرفیتی را با یکدیگر تیتر کنیم، منحنی تیتراسیون به شکل منحنیهای قبلی نمیشود. این پدیده به این علت است که هیچ یک از آنها به خوبی تفکیک نمیشوند و نمیتوانند یکدیگر را خنثی کنند. به طور کلی از این منحنی تیتراسیون اطلاعات مفیدی به دست نمیآید. یک نمودار منحنی تیتراسیون برای اسید و باز ضعیف در شکل زیر رسم شده است. تنها در نقطه همارزی انحنای کمی وجود دارد که به آن نقطه انحنا یا نقطه عطف گفته میشود.
محاسبه pH اسید و باز چند ظرفیتی
قبلتر اشاره کردیم که میزان قوی یا ضعیف بودن اسیدها و بازها را با کمیت pH اندازهگیری میکنند. مقدار pH محلولهای مختلف را از فرمول زیر که بر حسب میزان غلظت یون هیدروژن است، میتوان اندازهگیری کرد.
براکتهای این معادله نشاندهنده غلظت هستند. میزان pH محلولها میتواند بسته به تکظرفیتی یا چندظرفیتی بودن اسیدها و بازها تحت تاثیر قرار بگیرد. اسید و بازهای چندظرفیتی دارای تعداد بیشتری از یونهای هیدروژن و هیدروکسید در مولکولهای خود هستند. این بدان معنی است که غلظت یونهای هیدروژن یا هیدروکسید از میزان غلظت مولار اسید یا باز بیشتر میشود. اگر مولکول یک اسید دارای تعداد n یون هیدروژن مثبت باشد، غلظت این یون در محلول تفکیک شده اسید n برابر غلظت مولار خود اسید میشود. این رابطه به شکل زیر نشان داده میشود.
عبارت M در اینجا نشان دهنده غلظت مولار اسید است. اگر یک باز چندظرفیتی با ظرفیت پذیرش n یون هیدروژن داشته باشیم، میزان غلظت هیدروکسید آن n برابر غلظت مولار باز میشود. این رابطه به شکل زیر نشان داده میشود.
با دانستن این روابط محاسبه پی اچ اسید و باز چندظرفیتی مشکل نیست. البته باید توجه داشت این روابط تنها برای اسیدها و بازهای چندظرفیتی قوی است که میدانیم یونهای هیدروژن یا هیدروکسید آنها کاملا از مولکول اسید یا باز تفکیک میشوند.

مثال اول محاسبه pH اسید و باز چند ظرفیتی
مقدار pH محلول ۰٫۰۵۴ مولار آبی اسید سولفوریک را محاسبه کنید.
پاسخ
فرمول شیمیایی اسید سولفوریک است. پس از جدا کردن دو یون هیدروژن، یکی از یونهای چند اتمی رایج یعنی یون سولفات باقی میماند. پس نتیجه میگیریم این اسید یک اسید دو ظرفیتی است. پس غلظت یون هیدروژن دو برابر غلظت اسید میشود. طبق معادله زیر خواهیم داشت:
حرف M در معادله بالا، واحد غلظت مولار است. یعنی غلظت یون هیدروژن «۰٫۱۰۸ مولار» خوانده میشود. حال که غلظت یون هیدروژن را داریم، میتوانیم pH آن را محاسبه کنیم.
مثال دوم محاسبه pH اسید و باز چند ظرفیتی
میزان pH محلول ۰٫۰۹۱۵ مولار کلسیم هیدروکسید را محاسبه کنید.
پاسخ
فرمول شیمیایی مولکول کلسیم هیدروکسید به شکل است. پس این باز، یک باز دو ظرفیتی است. مطابق سوال قبل، میزان غلظت یون هیدروکسید دوبرابر میزان غلظت باز میشود. این رابطه به شکل زیر نشان داده میشود.
با این رابطه، میتوانیم غلظت یون هیدروکسید تفکیک شده را در محلول به دست آوریم.
حال میتوانیم pH این محلول را با استفاده از قانون زیر به دست آوریم.
معادله بالا از معادله تفکیک آب و ثابت تفکیک آب به دست آمده است در تمامی محلولهای اسید و باز همواره برقرار است. با جایگذاری مقدار غلظت یون هیدروکسید به دست آمده، میزان pH محلول به دست میآید.
تفاوت اسید و باز چند ظرفیتی و تک ظرفیتی
همانطور که قبلا اشاره شد، اسید و باز تکظرفیتی تنها یک یون هیدروژن یا هیدروکسید دارند که میتواند از ساختار اسید و باز جدا شود. این در حالی است که اسید و باز چندظرفیتی بیش از یک یون هیدروژن یا هیدروکسید جدا شونده دارند. این مسئله باعث بروز تفاوتهایی در خاصیتهای عمومی این اسید و بازها شده است.
اسید و بازهای چندظرفیتی نیاز به ایجاد انتقال یون هیدروژن بیشتری دارند تا بتوانند اسید و باز را خنثی کنند. در این اسید و بازها، غلظت یونهای اصلی نسبت به اسید و باز تکظرفیتی با یک غلظت مشخص، متفاوت خواهد بود.
کاربردهای ظرفیت اسید و باز
اسیدها و بازهای چندظرفیتی یکی از مهمترین مباحث در زمینههای مختلف تئوری و عملی علم شیمی هستند. این اسید و بازها در بسیاری از فرایندهای بیولوژیک حضور دارند و در واکنشهای بسیار مهمی شرکت میکنند. همچنین اسید و بازها در فرایندهای صنعتی و زیست محیطی از اهمیت ویژهای برخوردارند. از آزمایشهای تیتراسیون این اسید و بازها اطلاعات مهمی برای درک فرایندهای بیوشیمیایی و طراحی فرایندهای صنعتی و همچنین کنترل pH در سیستمهای محیط زیستی به دست میآید.
فهم آزمایشها و مسائل مربوط به ظرفیت اسید و باز علاوه بر کمک به درک برخی از فرایندهای شیمیایی و بیوشیمیایی، یک درک عمیق و جامع از واکنشهای اسید و باز به دست میدهد. این واکنشها که در بسیاری از فرایندهای زندگی اطراف ما رخ میدهند، از مهمترین مباحث دانش شیمی و بیوشیمی هستند.

مثال کاربرد ظرفیت اسید و باز
کاربردهای تجزیهای مفاهیم مربوط به ظرفیت اسید و باز در صنایع مختلفی از محیط زیست تا داروسازی کاربرد دارد در ادامه سه مورد از این کاربردها را توصیح میدهیم.
- پایش کیفیت آب: غلظتهای مختلف یونهای کربنات و بیکربنات حاصل از تفکیک اسیدهای چندظرفیتی در آب اندازهگیری میشوند. از تیتراسیون این بازهای مزدوج با اسید قوی، میتوان به اندازهگیری میزان سختی موقت آب دست یافت.
- آنالیز داروها: بسیاری از داروهای مورد استفاده در درمان بیماریهای مختلف، اسیدهای ضعیف چندظرفیتی هستند. تیتراسیون این اسیدها میتوان به غلظت واقعی و دقیق آنها در فرمولاسیون دارو پی برد. این اطلاعات به دست آمده داروسازان را در تعیین دوز و کارایی دارو یاری میکند.
- پایش کیفیت خاک: تیتراسیون اسیدهای چندظرفیتی نقشی بسیاری مهم در مطالعه شیمی خاک دارد. قابلیت خاک در خنثی سازی بارانهای اسیدی یا مواد کشاورزی شیمیایی، رابطهای نزدیک با اسیدهای چندظرفیتی موجود در خاک مانند هیومیک اسید دارد. انجام آزمایشهای تیتراسیون به همراه روشهای تجزیهای و انواع طیف سنجی میتواند اطلاعات مهمی درباره سلامت خاک و ظرفیت آن برای کشاورزی بدهد.
جمعبندی
اسیدها و بازها طبق تعاریف مختلفی بیان میشوند. یکی از مهمترین تعاریف اسید و باز لوری برونستد است که اسید را مادهای بیان میکند که میتواند یون هیدروژن را از دست بدهد و باز را مادهای تعریف میکند که میتواند یون هیدروژن را دریافت کند. اسیدها و بازها طبق این تعریف میتوانند از نوع تکظرفیتی یا چندظرفیتی باشند. اسیدهای تکظرفیتی یک یون هیدروژن و اسیدهای چندظرفیتی چند یون هیدروژن در ساختار خود دارند که قابل جداسازی هستند. به همین ترتیب بازهای تکظرفیتی یک یون هیدروژن و بازهای چندظرفیتی چند یون هیدروژن دریافت میکنند. در برخی از تعاریف ظرفیت باز تعداد یونهای هیدروکسید موجود در ساختار آن بیان شده است. ثابت تفکیک برای مراحل اول تفکیک اسید و باز چندظرفیتی همواره بزرگتر از باقی ثابت تفکیکهای آنها است. بدین معنی که اولین یون هیدروژن جدا شده یا دریافت شده همواره راحتتر از باقی یونها جدا و تفکیک میشود.
از مطالعات و محاسبات مربوط به ظرفیت اسید و باز از جمله استفاده از روش تیتراسیون میتوان به اطلاعات مهمی درباره واکنشهای اسید و باز و کاربرد آنها در صنایع مختلف دست یافت.
source




