در واکنشهای شیمیایی، کاهنده مادهای است که الکترونهای خود را از دست داده و باعث کاهش ماده دیگر میشود. در مقابل، اکسنده مادهای است که با جذب الکترون، باعث اکسید شدن ماده دیگر میشود. در واکنشهای شیمیایی، اکسیداسیون (اکسایش) به معنی از دست دادن الکترون یک ماده (کاهنده) و کاهش به معنی گرفتن الکترون توسط یک ماده (اکسنده) است. در این مطلب از مجله فرادرس به بررسی خواص و تفاوت این دو ماده و نقش آنها در پدیدههای شیمیایی میپردازیم.
آنچه در این مطلب میآموزید:
-
میآموزید مفهوم اکسنده و کاهنده چیست.
-
با اکسایش و کاهش در واکنشهای شیمیایی و روش تشخیص آن آشنا میشوید.
-
عدد اکسایش و روش تعیین آن را میآموزید.
-
با انواع مواد اکسنده و کاهنده آشنا میشوید.
-
قدرت و خطرات مواد اکسنده و کاهنده را درک میکنید.
-
با کاربردهای مواد اکسنده و کاهنده آشنا میشوید.



در ابتدای این مطلب میآموزیم مفهوم اکسنده و کاهنده چیست. سپس روشهای تشخیص اکسنده و کاهنده را آموخته و با مفهوم اکسایش و کاهش آشنا میشویم. در ادامه یاد میگیریم عدد اکسایش جیست و ویژگیهای ماده اکسنده و ماده کاهنده را بررسی میکنیم. پس از آن روش تشخیص این مواد را در واکنشهای شیمیایی بررسی کرده و در نهایت با قدرت، خطرات، نکات ایمنی و کاربرد این مواد آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید اکسنده و کاهنده چیست.
اکسنده و کاهنده چیست؟
یک عامل اکسنده (Oxidizing Agent) یا اکسیدکننده، مادهای است که الکترون دریافت میکند و در یک واکنش شیمیایی احیا (Reduction) میشود. به این ماده پذیرنده الکترون نیز گفته میشود. عامل اکسنده معمولا در یکی از حالتهای اکسایش مرتبه بالاتر قرار دارد، زیرا قرار است الکترون بگیرد و احیا شود. از جمله مثالهای عوامل اکسنده میتوان به هالوژنها، پتاسیم نیترات و اسید نیتریک اشاره کرد.
در مقابل، یک عامل کاهنده (Reducing Agent) یا احیاکننده مادهای است که الکترون از دست میدهد و در یک واکنش شیمیایی اکسید (Oxidation) میشود. عامل کاهنده معمولا در یکی از حالتهای اکسایش پایینتر قرار دارد و دهنده الکترون به شمار میرود. عامل کاهنده در واکنش ردوکس اکسید میشود، زیرا الکترون از دست میدهد.
از جمله مثالهای عوامل کاهنده میتوان به فلزات قلیایی خاکی، اسید فرمیک و ترکیبات سولفیت اشاره کرد. در جدول زیر برخی از رایج ترین مواد اکسنده و کاهنده معرفی شده است.
| مواد اکسنده | مواد کاهنده |
تشخیص تفاوت مواد اکسنده و کاهنده
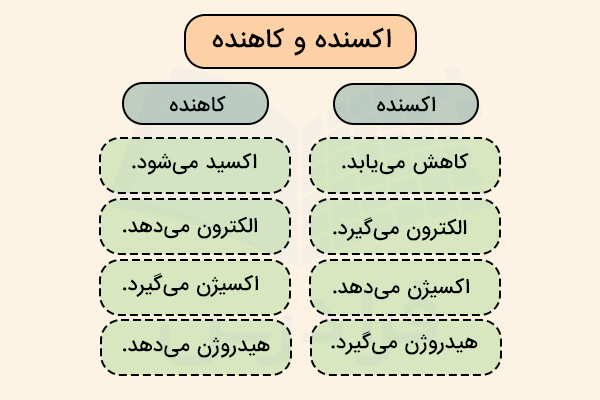
تشخیص تفاوت عامل اکسنده و کاهنده یکی از مسائلی است که همواره برای دانشآموزان با سردرگمی و اشتباه گرفتن این مواد همراه است. برای به خاطر سپردن صحیح این موارد، میتوان به یکی از دو روش زیر عمل کرد. همواره به خاطر داشته باشید که اکسنده باعث اکسید شدن ماده دیگر شده و خود کاهش (گرفتن الکترون) مییابد. کاهنده مادهای است که باعث کاهش یافتن ماده دیگر شده و خود اکسید (از دست دادن اکترون) میشود.
تشخیص از روی حروف فارسی
به عنوان یک عبارت رمز، میتوان به خاطر سپرد که اکسید با حرف (الف) شروع شده و به معنی از دست دادن الکترون است. مادهای که اکسید میشود الکترون از دست میدهد.
از طرفی کاهش، با گرفتن الکترون همراه است. بنابراین مادهای که کاهش مییابد، با گرفتن الکترون همراه است.
نکته: در تشخیص ماده اکسنده و کاهنده همراه بخاطر داشته باشید که:
ماده اکسنده، خودش کاهش مییابد و ماده کاهنده، خودش اکسید میشود.
عبارت رمز انگلیسی OIL RIG
در قسمت قبل آموختیم معادل انگلیسی اکسایش و کاهش به ترتیب کلمات (Oxidation) و (Reduction) هستند. به همین ترتیب، میتواند از عبارت رمز OIL RIG استفاده کرد. این عبارت به مفهوم زیر اشاره دارد:
OIL RIG
.Oxidation Is Loss and Reduction Is Gain of electrons
اکسایش، از دست دادن و کاهش گرفتن الکترون است.
بدین ترتیب میتوان همواره تشخیص داد تفاوت اکسایش و کاهش و اکسنده و کاهنده چیست.
مفهوم اکسایش و کاهش
اکسایش و کاهش، نوعی تمییز بین انتقال الکترون در مواد موجود در واکنشهای شیمیایی است. به وسیله اکسایش و کاهش میتوانیم روند پیشرفت واکنش شیمیایی و پیوندهای از بین رفته و تشکیل شده در این واکنشها را تشخیص دهیم. برخی از واکنشها نیز ممکن است در دستهبندی انواع واکنشهای شیمیایی، در دسته واکنشهای اکسایش و کاهش قرار بگیرند.
اکسایش و کاهش در واکنشهای شیمیایی را میتوان از ۳ نظر بررسی کرد. این موارد به شرح زیر هستند.
- انتقال اکسیژن در واکنش شیمیایی
- انتقال هیدروژن در واکنش شیمیایی
- انتقال الکترون در واکنش شیمیایی
در ادامه هر یک از این موارد را بررسی میکنیم.
انتقال اکسیژن در واکنشهای شیمیایی
بسیاری از واکنشهای اکسایش و کاهش، با حضور اتم اکسیژن انجام میشوند. برای مثال، واکنشهای سوختن که نوعی اکسیداسیون مواد شیمیایی هستند، همواره با عنصر اکسیژن به عنوان واکنشدهنده همراه هستند. به همین دلیل، میتوان این نوع واکنشها را از منظر انتقال اکسیژن بررسی کرد. در این واکنشها،
- اکسایش، دریافت اکسیژن است.
- کاهش، از دست دادن اکسیژن است.
برای مثال، در واکنش استخراج آهن به وسیله کربن مونوکسید توجه کنید.
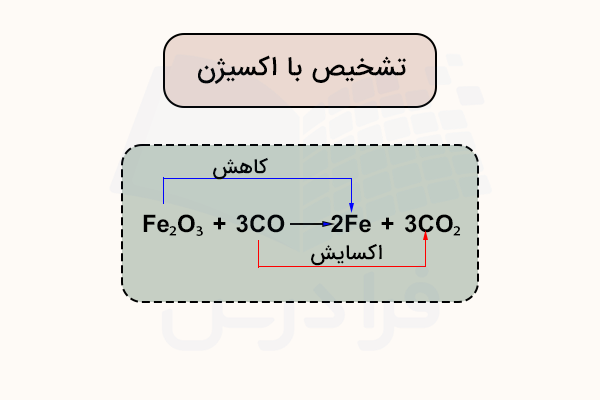
چون فرآیند اکسایش و کاهش بهطور همزمان رخ میدهند، این نوع واکنش را واکنش ردوکس مینامند. عامل اکسنده موادی هستند که باعث اکسید شدن مادهای دیگر میشوند.
اگر تا اینجای مطلب را مطالعه کردهاید، با مفهوم اکسنده و کاهنده و یک روش تشخیص آن آشنا شدهاید. در ادامه این مطلب نیز به بررسی سایر روشها و ویژگی این مواد میپردازیم.
پیشنهاد میکنیم برای مطالعه بیشتر این نوع مطالب و دسترسی همیشگی و رایگان به آنها در موبایل خود، اپلیکیشن رایگان مجله فرادرس را نصب کنید تا همیشه به مطالب مجله فرادرس دسترسی داشته باشید.
برای نصب اپلیکیشن رایگان مجله فرادرس، کلیک کنید.
در مثال بالا، اکسید آهن (III) نقش عامل اکسنده را دارد. عامل کاهنده مادهای است که باعث کاهش مادهای دیگر میشود. در معادله، مونوکسید کربن عامل کاهنده است. بدین ترتیب، از منظر بررسی اتم اکسیژن در واکنشهای اکسایش کاهش،
- عاملهای اکسنده به یک ماده دیگر اکسیژن میدهند.
- عاملهای کاهنده اکسیژن را از یک ماده دیگر میگیرند.
انتقال هیدروژن در واکنشهای شیمیایی
این نوع از واکنشهای اکسایش و کاهش، معمولا در شیمی آلی بررسی میشوند که بررسی انتقال الکترون یا اکسیژن دشوار است. در این نوع واکنشها، تعریف اکسایش و کاهش به شکل زیر است.
- اکسایش از دست دادن هیدروژن است.
- کاهش به دست آوردن هیدروژن است.
برای مثال، طبق واکنش زیر، اتانول اکسایش یافته و با از دست دادن یک هیدروژن، به اتانال تبدیل میشود.
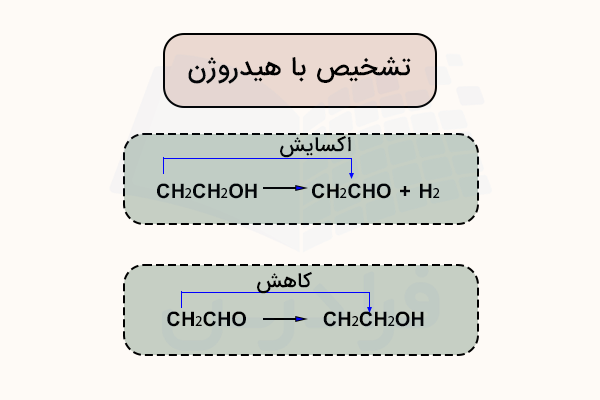
برای جدا کردن هیدروژن از اتانول، وجود یک عامل اکسنده لازم است. یکی از عاملهای اکسنده رایج، محلول دیکرومات پتاسیم (VI) است که با اسید سولفوریک رقیق اسیدی شده باشد. اتانال همچنین میتواند با افزودن هیدروژن دوباره به اتانول کاهش یابد. تعریفهای دقیقتر عاملهای اکسنده و کاهنده در این واکنشها، به صورت زیر است.
- عامل اکسنده مادهای است که به یک ماده دیگر اکسیژن اضافه میکند یا هیدروژن آن را میگیرد.
- عامل کاهنده مادهای است که از یک ماده دیگر اکسیژن را جدا میکند یا به آن هیدروژن میافزاید.
انتقال الکترون در واکنشهای شیمیایی
انتقال الکترون در واکنشهای شیمیایی نیز یکی از روشهای بررسی اکسایش و کاهش مواد است. این کار معمولا با بررسی تغییر عدد اکسایش مواد مختلف انجام میشود. در این واکنشها اکسایش و کاهش به شکل زیر تعریف میشود.
- اکسایش از دست دادن الکترون است.
- کاهش گرفتن الکترون است.
برای مثال، به واکنش بین یون مس و فلز منیزیم در ادامه دقت کنید.
در واکنش بالا، منیزیم با انتقال الکترون به یون مس (II) آن را کاهش میدهد و بار آن را خنثی میکند. بنابراین، منیزیم عامل کاهنده است. میتوان این فرآیند را اینگونه هم بیان کرد که یون مس (II) الکترونها را از منیزیم میگیرد و آن را به یون منیزیم تبدیل میکند. در این حالت یون مس (II) نقش عامل اکسنده را دارد. بنابراین در این واکنشها خواهیم داشت:
- عامل اکسنده از ماده دیگر الکترون میگیرد.
- عامل کاهنده به ماده دیگر الکترون میدهد.
تفاوت اکسایش و کاهش
در قسمت قبل با مفهوم اکسایش و کاهش آشنا شدیم و آموختیم اکسنده و کاهنده در این واکنشها چیست. در ادامه، میآموزیم تفاوت اکسایش و کاهش چیست.
| اکسایش | کاهش |
| از دست دادن الکترون | دریافت الکترون |
| افزایش مرتبه (عدد) اکسایش | کاهش عدد اکسایش |
| از دست دادن هیدروژن | دریافت هیدروژن |
| آزادسازی انرژی | ذخیره (دریافت) انرژی |
| کاهنده دچار اکسایش میشود. | اکسنده دچار کاهش میشود. |
یادگیری شیمی دوازدهم با فرادرس
برای درک بهتر این موضوع که عامل اکسنده و کاهنده چیست، ابتدا باید با مفاهیمی چون نیم واکنش اکسایش و کاهش، موازنه با عدد اکسایش، تیتراسیون اکسایش و کاهش، کاتد و آند و واکنشهای الکتروشیمیایی آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازدهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه اکسنده و کاهنده دسترسی داشته باشید.
عدد اکسایش چیست؟
عدد اکسایش روشی برای در نظر گرفتن بار مثبت و منفی نسبی برای اتمهای ترکیبات مختلف در واکنشهای شیمیایی است. به کمک عدد اکسایش میتوان تشخیص داد که اتم طی واکنش شیمیایی الکترون دریافت کرده یا از دست داده است. بدین روش میتوان کاهش و اکسایش ترکیبات را تشخیص داده و بفهمیم مواد اکسنده و کاهنده در واکنش چیست.
عدد اکسایش به شکل مستقیم بار الکتریکی مواد را در ترکیبات تعیین نمیکند و تنها یک عدد نسبی قراردادی است. برای تعیین عدد اکسایش ترکیبات قوانینی وجود دارد که ددر ادامه آنها را بررسی میکنیم.
- جمع عدد اکسایش اتمهای یک ترکیب همواره برابر با بار کلی ترکیب است.
- جمع عدد اکسایش اتمهای ترکیبات خنثی (بدون بار) برابر با صفر است.
- در ترکیبات عنصری مانند آهن (Fe) و اکسیژن () عدد اکسایش برابر با صفر است.
- عدد اکسایش یونهای تک اتمی مانند یون سولفید () برابر با بار یون است.
- در تمامی ترکیبات فلوئور، عدد اکسایش فلوئور برابر با ۱- است. باقی ترکیبات هالوژن نیز عدد اکسایش ۱- دارند مگر اینکه با اکسیژن ترکیب شوند.
- اکسیژن در تمامی ترکیبات خود بجز پراکسیدها عدد اکسایش ۲- دارد. عدد اکسایش این عنصر در پر اکسیدها برابر با ۱- است.
- هیدروژن در تمامی ترکیبات خود، عدد اکسایش ۱+ دارد مگر اینکه با فلزات ترکیب شده باشد. در این صورت، عدد اکسایش آن برابر با ۱- است.
تشخیص عدد اکسایش
با توجه به نکات ارائه شده در قسمت قبل میتوانیم عدد اکسایش اتمها را در ترکیبات مختلف حدس بزنیم. این نکات به صورت خلاصه در جدول زیر ارائه شده است.
| عناصر | عدد اکسایش |
| فلزات گروه ۱ | همواره ۱+ |
| فلزات گروه ۲ | همواره ۲+ |
| اکسیژن | معمولا ۲- (بجز در پراکسیدها: ۱+ و :۲+) |
| هیدروژن | معمولا ۱+ (بجز در هیدریدهای فلزی) |
| فلوئور | همواره ۱- |
| کلر | معمولا ۱- (بجز در ترکیب با اکسیژن) |
برای مثال، میخواهیم مقدار عدد اکسایش کروم را در ترکیب به دست آوریم. طبق جدول بالا میدانیم که عدد اکسایش کلر بجز در ترکیب با فلوئور و هیدروژن برابر با ۱- است. همچنین، عدد اکسایش کل ترکیب خنثی برابر با صفر است. بنابراین خواهیم داشت:
عدد اکسایش ترکیب = صفر
۰ = (۱-)۳ × عدد اکسایش کروم
عدد اکسایش کروم = ۳+
برای درک بهتر روش تعیین عدد اکسایش ترکیبات مختلف، به مثالهای زیر دقت کنید.
مثال ۱
عدد اکسایش کروم در ترکیب چند است؟
پاسخ
این ترکیب یک یون ۳ بار مثبت است. پس مقدار کلی عدد اکسایش ترکیب باید برابر با ۳+ باشد. همچنین، عدد اکسایش آب نیز برابر با صفر است. بنابراین با در نظر گرفتن این اعداد خواهیم داشت:
۳+ = ۰ + عدد اکسایش کروم
پس عدد اکسایش آن برابر با ۳+ خواهد بود.
مثال ۲
عدد اکسایش مس در ترکیب چند است؟
پاسخ
با توجه به ترکیب متوجه میشویم که این ترکیب یک ترکیب یونی متشکل از یون سولفات ۲- و یون مس ۲+ است. بنابراین، عدد اکسایش مس در این ترکیب برابر با ۲+ است.
مثال ۳
عدد اکسایش تمامی اتمها را در تمامی ترکیبات در واکنش شیمیایی زیر به دست آورید. سپس مواد اکسنده و کاهنده را مشخص کنید.
پاسخ
در سمت واکنش دهندهها، ترکیب سدیم هیدروکسید را داریم. عدد اکسایش سدیم همواره ۱+، اکسیژن ۲- و هیدروژن ۱+ است. همچنین ترکیب دو اتمی کلر یک ترکیب خنثی با عدد اکسایش صفر است.
در سمت فرآوردهها، ترکیب سدیم کلرید یک ترکیب یونی متشکل از سدیم با عدد اکسایش ۱+ و کلر با عدد اکسایش ۱- است. ترکیب سدیم هیپوکلریت متشکل از سدیم با عدد اکسایش ۱+ و اکسیژن با عدد اکسایش ۱- است. کلر در ترکیب با اکسیژن عدد اکسایشی متفاوت از ۱- خواهد داشت. عدد اکسایش این اتم در این ترکیب برابر با ۱+ است.
در نهایت ترکیب آب را داریم که در حالت کلی خنثی است و از اتم هیدروژن با عدد اکسایش ۱+ و اکسیژن با عدد اکسایش ۲- تشکیل شده است. مولکول هم اکسنده و هم کاهنده است زیرا در این واکنش هم الکترون از دست داده و هم الکترون گرفته است.
مقدار عدد اکسایش تمامی ترکیبات به طور خلاصه در جدول زیر ارائه شده است.
| در سمت واکنشدهندهها | در سمت فرآوردهها |
| سدیم: ۱+ | سدیم: ۱+ |
| اکسیژن: ۱- | اکسیژن: ۱- در سدیم هیپوکلریت و ۲- در آب |
| کلر: صفر | کلر: ۱- در سدیم کلرید و ۱+ در سدیم هیپوکلریت |
پیشنهاد میکنیم برای درک بهتر واکنشهای اکسایش کاهش و حل مثالهای مربوط به آن، فیلم آموزش واکنش اکسایش و حل مثالهای المپیاد شیمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
ماده اکسنده چیست؟
ماده اکسنده یا عامل اکسنده (Oxidising Agents) مواد شیمیایی هستند که باعث اکسید شدن سایر مواد در واکنش شیمیایی میشوند. عامل اکسنده با جذب الکترون از ماده دیگر، خودش احیا شده و باعث از دست دادن الکترون و اکسایش ماده دیگر شود. در ادامه، برخی از خواص مواد اکسنده را نام میبریم.
- هالوژنها، اکسیژن و هیدروژن پروکسید از عوامل اکسنده رایج هستند.
- عوامل اکسنده معمولا در بالاترین حالت اکسایش قرار دارند.
- یونها، اتمها و مولکولهایی با تمایل به جذب الکترون بالا، عوامل اکسنده موثری هستند.
- مقدار قدرت عوامل اکسنده با میزان الکترونخواهی آنها افزایش مییابد.
- مواد اکسنده پذیرنده الکترون هستند. این مواد این مواد تمایل قابل توجی به جذب الکترون دارند و طی این فرآیند، خود دچار کاهش میشوند.
مثال ماده اکسنده
مواد بسیار زیادی وجود دارند که توانایی جذب الکترون و اکسید کردن سایر مواد را دارند. از این مواد در مصارف خانگی مختلف و در صنایع مختلف استفاده میشود. از رایجترین مواد اکسنده میتوان به موارد زیر اشاره کرد.
- اکسیژن
- هالوژنها
- هیدروژن پروکسید
- برخی از اسیدها
برخی از مثالهای این مواد به همراه واکنشهای اکسایش و کاهش آنها در ادامه معرفی میشود.
اسید سولفوریک
اسید سولفوریک با استفاده از آزاد کردن یونهای هیدروژن مثبت در محلول میتواند از مواد دیگر الکترون گرفته و باعث از دست داد الکترون و اکسایش آنها شود. برای مثال، به واکنش شیمیایی زیر و نیم واکنشهای اکسایش و کاهش در آن توجه کنید.
اکسیژن
اکسیژن یکی از رایجترین و قویترین مواد اکسید کننده موجود است. برای مثال، زنگ زدن و خوردگی فلزات در محیطهای مختلف به دلیل وجود اکسیژن در اجزای تشکیل دهنده هوا است. برای درک نحوه اکسندگی اکسیژن، به واکنش آن با مس دقت کنید.
هالوژن ها
هالوژنها نسبت به سایر عنناصر جدول تناوبی بیشتر الکترونگاتیو هستند. این بدین معنی است که تمایل آنها در جذب الکترون بسیار زیاد است. در نتیجه این مواد میتوانند در واکنشهای مختلف، الکترون دریافت کرده و احیا شده و باعث اکسید شدن باقی مواد شوند. هالوژنهای ید، برم، کلر و فلوئور از مواد رایج اکسنده هستند. در بین این مواد، فلوئور به دلیل مقدار بسیار بالای الکترونگاتیوی، قویترین عامل اکسنده است.
به واکنش بین نمک خوراکی (سدیم کلرید) و مولکول فلوئور دقت کنید.
هیدروژن پراکسید
هیدروژن پراکسید (آب اکسیژنه) یک اکسنده ملایم است که به عنوان پاک کننده خورنده و عامل سفید کننده استفاده میشود. اکسیژن در این ماده با دریافت الکترون به پراکسید تبدیل شده و کاهش مییابد و باعث اکسایش مواد دیگر میشود. برای مثال، به واکنش آب اکسیژنه و سرب سولفید دقت کنید.
ماده کاهنده چیست؟
ماده کاهنده یا عوامل کاهنده (Reducing Agent)، موادی هستند که تمایل دارند با از دست دادن الکترون، خود دچار اکسایش شده و باعث کاهش مواد دیگر شوند. این مواد الکترونهای خود را از دست داده و با تامین الکترون برای مواد دیگر باعث کاهش آنها میشوند. در ادامه برخی از خواص مواد کاهنده را بررسی میکنیم.
- عناصر گروه اول و دوم جدول تناوبی، از عوامل کاهنده رایج هستند.
- عوامل کاهنده معمولا در پایینترین حالت اکسایش قرار دارند.
- یونها، مولکولها و اتمهایی با الکترونخواهی بسیار پایین به عنوان عوامل کاهنده موثر عمل میکنند.
- مقدار قدرت کاهندگی مواد با افزایش الکترونخواهی مواد، کاهش مییابد.
- عوامل کاهنده، دهنده الکترون هستند. این مواد تمایل دارند که الکترونها را از دست داده و خود دچار اکسایش شوند.
مثال ماده کاهنده
فلزاتی مانند سدیم، آهن، روی و آلومینیوم و نافلزاتی مانند کربن، گوگرد و گاز هیدروژن مثالهایی از مواد کاهنده رایج هستند. برخی از موای که شامل اسیدهای هیدروژنه هستند، مانند اسید کلریدریک، اسید هیدرویدیک، هیدروبرمیک اسید و هیدروژن سولفید نیز به عنوان عوامل کاهنده عمل میکنند.
در ادامه برخی از عوامل کاهنده را به همراه واکنشهای اکسایش – کاهش آنها معرفی میکنیم.
اسیدهای هیدروژن دار
در قسمت قبل اشاره کردیم که اسیدهایی که شامل اتم هیدروژن هستند میتوانند به عنوان عوامل کاهنده عمل کنند. در این مواد، یون مثبت هیدروژن از ماده جدا شده و آنیون موجود به عنوان دهنده الکترون عمل کرده و باعث کاهش ماده دیگر میشود. برای مثال، در واکنش زیر، اسید کلریدریک به عنوان یک عامل کاهنده عمل کرده و باعث کاهش اتم فلوئور میشود.
لیتیوم
لیتیوم نیز یکی دیگر از عوامل کاهنده رایج است. این ماده با تبدیل شدن به یون مثبت تبدیل شده و الکترون آزاد میکند. بدین ترتیب خود اکسایش یافته و باعث کاهش اتم دیگر میشود. برای مثال، به واکنش عنصر لیتیوم با فلوئور دقت کنید.
نمکهای ید
نمکهای ید از عوامل کاهنده با قدرت متوسط هستند. یون یدید در واکنش با موادی که اکسیژن دارند به مولکول دو اتمی ید تبدیل شده و الکترون آزاد میکند و باعث کاهش ماده دیگر میشود. برای مثال، به واکنش یون دی کرومات و یدید در حضور یون هیدروژن دقت کنید.
برخی از قندها
در برخی از قندها به دلیل وجود گروه کتون آزاد یا گروه آلدهید آزاد، به عنوان عوامل کاهنده عمل میکنند. به همین دلیل به این مواد قندهای کاهنده گفته میشود. تمامی مونوساکاریدها، دی ساکاریدها، پلی ساکاریدها و اولیگو ساکاریدها به عنوان عوامل کاهنده عمل میکنند.
فلزات
فلزات خاصیت فلزی داشته و تمایل به از دست دادن الکترون دارند و الکتروپوزتیو هستند. به همین دلیل از بسیاری از فلزات مانند آهن، آلومینیوم و روی به عنوان عوامل کاهنده استفاده میشود.
تشخیص اکسنده و کاهنده در واکنش شیمیایی
برای تشخیص ماده اکسنده و کاهنده، باید مقدار عدد اکسایش اتمها را در ترکیبات به دست آورده و آنها را در سمت مواد واکنش دهنده و فرآورده با هم مقایسه کنیم. برای مقایسه عدد اکسایش نیازی نیست تمامی اتمها به صورت جداگانه بررسی شوند و تنها اتم هایی که ممکن است در ترکیبات مختلف اعداد اکسایش متفاوتی داشته باشند، بررسی میشوند.
برای مثال، اتمهایی مانند اکسیژن، هیدروژن و هالوژنها تقریبا در تمامی ترکیبات (بجز چند مورد استثنا که در قسمت قبل اشاره شد) اعداد اکسایش ثابتی دارند. برای درک بهتر این روش، به واکنش زیر دقت کنید.
اگر بخواهیم ماده اکسنده و کاهنده را در این واکنش تعیین کنیم، باید مقدار اعداد اکسایش اتمها را بررسی کنیم. در سمت واکنشدهندهها ترکیبات کلر در مولکول کلر و سدیم برمید را داریم. عدد اکسایش کلر در مولکول برابر صفر است زیر ترکیبی خنثی است.
عدد اکسایش سدیم در سدیم برمید برابر با ۱+ و برم در این ترکیب ۱- است. در سمت فرآوردههای واکنش، سدیم کلرید و مولکول دو اتمی برم را داریم که مقدار عدد اکسایش سدیم در سدیم کلرید برابر با ۱+ و کلر برابر با ۱- و در دولکول دو اتمی برم، عدد اکسایش برم برابر با صفر است زیرا ترکیبی مولکولی و خنثی است.
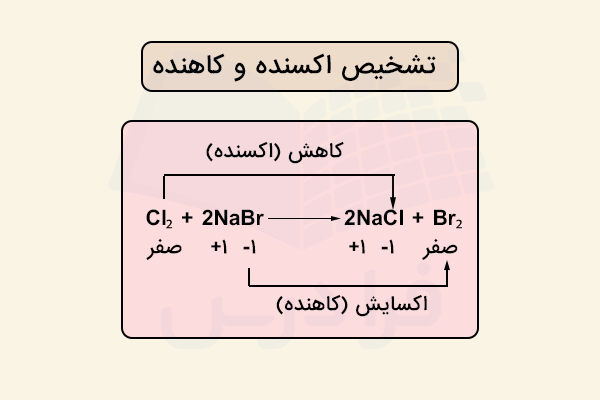
بدین ترتیب مشاهده میکنیم که عدد اکسایش کلر و برم تغییر کرده است. کلر یک الکترون دریافت کرده و کاهش یافته و برم یک الکترون از دست داده و اکسایش یافته است. بدین ترتیب کلر اکسنده و برم کاهنده است.
نیم واکنش اکسایش و کاهش
برای درک بهتر روند تغییر عدد اکسایش، میتوانیم ترکیبات را به صورت یونی نوشته و نیم واکنشهای اکسایش و کاهش آنها را به دست آوریم. برای مثال، در واکنش بالا به صورت یونی خواهیم داشت:
با ساده کردن موارد تکراری، به دو واکنش زیر میرسیم. تعداد الکترونهای نوشته شده در هر یک از این واکنشها برای موازنه کردن واکنش اکسایش و کاهش از نظر مقدار بار الکترونی است.
کاهش:
اکسایش:
برای درک بهتر این روش، به مثال زیر دقت کنید.
مثال
واکنش شیمیایی زیر را به صورت نیمواکنشهای اکسایش و کاهش نوشته و مواد اکسنده و کاهنده را در آن پیدا کنید.
پاسخ
برای نوشتن نیم واکنش اکسایش و کاهش، هر ماده را به صورت جداگانه نوشته و تعداد الکترونهای مورد نیاز برای موازنه شدن واکنش از نظر بار الکتریکی را اضافه میکنیم. بدین ترتیب مشاهده میکنیم که اتم روی با از دست دادن دو الکترون اکسید شده و کاهنده است. همچنین یون آهن (ااا) با دریافت الکترون کاهش یافته و ماده اکسنده است.
اکسایش:
کاهش:
مثال تشخیص اکسنده و کاهنده در واکنش شیمیایی
برای درک بهتر آنچه در قسمت قبل آموختیم، به مثالهای زیر دقت کنید.
مثال ۱
در واکنش زیر، تشخیص دهید عامل اکسنده و کاهنده چیست؟
پاسخ
یون عامل کاهنده است، چون اکسید میشود و یک الکترون از دست میدهد. مقدار اولیه عدد اکسایش آن در برابر با صفر است و در یون برابر ۱- است. در نتیجه اکسایش یافته و عامل کاهنده است.
عامل اکسنده است، زیرا با گرفتن دو الکترون احیا میشود. در ابتدا عدد اکسایش منیزیم در آن برابر با ۴+ بوده و سپس در یون به ۲+ میرسد. یعنی کاهش یافته و عامل اکسنده است.
مثال ۲
در واکنش شیمیایی زیر، اتم هیدروژن اکسنده است یا کاهنده؟
پاسخ
در این واکنش، اتم هیدروژن الکترون از دست میدهد و اکسید میشود بنابراین کاهنده است.
مثال ۳
در واکنش شیمیایی زیر، ماده کاهنده را بیابید.
پاسخ
در این واکنش کاهنده است زیرا ۲ الکترون از دست داده و اکسید شده است. عدد اکسایش اتم گوگرد در یون برابر با ۴+ است و در یون به ۶+ میرسد. برای درک بهتر روش تشخیص ماده اکسنده و کاهنده، به تمرینهای زیر پاسخ دهید.
قدرت مواد اکسنده و کاهنده
قدرت مواد اکسنده و کاهنده را با استفاده از اندازهگیری مقدار پتانسیل استاندارد واکنش کاهش آنها اندازه گیری و مقایسه میکنند. پتانسیل استاندارد مواد، با استفاده از مقایسه با پتانسیل استاندارد کاهش یون هیدروژن در الکترون استاندارد هیدروژن SHE اسنجام میشود. در جدول زیر مقدار پتانسیل استاندارد کاهش برخی از مواد نوشته شده است.
| واکنش کاهش | پتانسیل استاندارد کاهش (ولت) |
| ۱٫۶۷۶- | |
| ۰٫۷۶۱۸- | |
| ۰٫۴۴- | |
| ۰٫۴۲۴- | |
| ۰٫۲۵۷- | |
| ۰٫۰۰ | |
| ۰٫۱۵۹ | |
| ۰٫۷۷۱ | |
| ۱٫۳۹۶ | |
| ۱٫۷۶۳ |
تمامی موادی که مقدار پتانسیل استاندارد کاهش مثبتتر دارند (مواد پایین تر از هیدروژن)، اکسندههای قویتری نسبت به آن هستند. به همین ترتیب، موادی که پتانسیل استاندارد کاهش منفیتر (بالاتر از هیدروژن) دارند، اکسندههایی ضعیفتر و کاهندههای قویتری هستند.
همانطور که مشاهده میکنید، برای فلزات با الکتروپوزتیوی و تمایل به از دست دادن الکترون و کاهندگی، مقادیر پتانسیل استاندارد کاهش منفیتر و برای موادی با قدرت اکسندگی قوی مانند هیدروژن پر اکسید، این مقدار مثبتتر است. پیشنهاد می کنیم برای درک بهتر این مفاهیم، مطلب پتانسیل سلول الکتروشیمیایی مجله فرادرس را مطالعه کنید.
خطرات مواد اکسنده و کاهنده
برخی از مواد اکسنده میتوانند به ساختارهای زیستی مانند لیپیدها، پروتيینها و DNA آسیب وارد کنند. همچنین این مواد میتوانند باعث تسریع تصلب شریان، ارتریت روماتیسمی و پیشرفت آب مروارید چشمی شوند.
کاربرد مواد اکسنده و کاهنده
عاملهای اکسنده و کاهنده در صنایع مختلف اهمیت زیادی دارند. از آنها در فرآیندهایی مانند تصفیه آب، سفید کردن الیاف و ذخیره انرژی (مثل باتریها و بنزین) استفاده میشود. این مواد همچنین در فرآیندهای زیستی مانند متابولیسم و فوتوسنتز نیز نقش اساسی دارند.
برای مثال، جانداران از پذیرندههای الکترون مانند +NAD برای بهدست آوردن انرژی از واکنشهای ردوکس استفاده میکنند. همچنین، تمام واکنشهای احتراق نیز نمونههایی از واکنشهای ردوکس هستند. واکنش احتراق زمانی رخ میدهد که یک ماده با اکسیژن واکنش دهد و گرما تولید کند. یکی از نمونهها، احتراق اکتان است که جزو اصلی بنزین به شمار میرود. واکنش این ماده به صورت زیر است.
سلول الکتروشیمیایی
یکی از مهمترین کاربردهای مواد اکسنده و کاهنده، استفاده از آنها در سلولهای الکتروشیمیایی برای تولید الکتریسیته است. در این سلولها، مواد اکسنده و کاهنده در محلولهایی غنی از یونهایی که مربوط به الکترونهای فلزی هستند قرار دارند. بدین ترتیب، با انتقال الکترون بین این مواد به صورت مداوم، میتوان جریان الکتریسیته تولید کرد. برای مثال، یکی از مهمترین این سلولها، سلول گالوانی مس نیکل است که در آن، واکنش زیر انجام میشود.
در این واکنش، یون مس کاهش یافته و الکترون گرفته است و عامل اکسنده است. به همین ترتیب، فلز مس با از دست دادن الکترون اکسید شده و عامل کاهنده است.
تفاوت عامل کاهنده و آنتی اکسیدان چیست؟
آنتی اکسیدانها موادی هستند که میتوانند باعث توقف واکنشهای زنجیری آلی با استفاده از حذف مواد رادیکالی موجود شوند. آنتی اکسیدانها نیز به دلیل اینکه اکسید میشوند، به عنوان عوامل کاهنده شناخته میشوند. از مواد آنتی اکسیدان میتوان به موادری مانند تیولها، پلی فنولها و آسکوربیک اسید اشاره کرد.
یادگیری الکتروشیمی با فرادرس
برای درک بهتر این موضوع که اکسنده و کاهنده چیست، ابتدا باید با مفاهیمی چون تعریف الکتروشیمی، مفاهیم پایه ترمودینامیکی، نیروی الکتروموتوری، انواع باتریها، آند و کاتد و حفاظت کاتدی آشنا شویم. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراحعه کنید که با زبانی ساده ولی کاربردی به توضیح آنها میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه اکسنده و کاهنده دسترسی داشته باشید.
آزمون مواد اکسنده و کاهنده
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید. در نهایت میتوانید با کلیک بر روی گزینه «دریافت نتیجه آزمون» تعداد پاسخهای صحیح خود را مشاهده کنید.
source
