ثابت یونش اسید، ثابت تعادل واکنش تفکیک اسیدهای در محلول آبی است که با عبارت Ka نمایش داده میشود. این ثابت تعادل تعیین کننده مقدار عددی قدرت اسید در محلول است. ثابت یونش اسید معمولا با واحد مول بر لیتر اندازه گیری میشود و مقادیر آن برای هر اسید در جداول مرجع ارائه میشود. مقدار ثابت تفکیک اسید با تقسیم غلظت فرآوردهها بر واکنش دهندهها در نقطه تعادل واکنش محاسبه میشود. در این مطلب از مجله فرادرس میآموزیم ثابت یونش اسید چیست و چگونه محاسبه میشود.
آنچه در این مطلب میآموزید:
-
میآموزید ثابت یونش اسید چیست و چگونه محاسبه میشود.
-
روش نوشتن معادله تفکیک اسیدهای مختلف را یاد میگیرید.
-
با مفهوم درجه یونش و روش محاسبه ثابت یونش اسید با استفاده از pH آشنا میشوید.
-
ثابت یونش باز و pKa و pKb را میشناسید.
-
با خودیونش آب و محاسبه pH با استفاده از Ka آشنا میشوید.
-
محلولهای بافر و اسیدهای چند ظرفیتی را شناخته و روش محاسبه ثابت یونش آنها را میآموزید.



در ابتدای این مطلب میآموزیم ثابت یونش اسید چیست و واکنش تفکیک اسید چگونه نوشته میشود. در ادامه، روش محاسبه ثابت یونش اسید و مفهوم ثابت یونش باز و رابطه آن با ثابت یونش اسید را میآموزیم. پس از آن، یاد میگیریم خود یونش آب چیست و pH محلول چگونه محاسبه میشود. در نهایت با اسیدها و بازهای چند ظرفیتی آشنا شده و محلولهای بافر را میشناسیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید ثابت یونش اسید چیست.
ثابت یونش اسید چیست؟
مقدار قدرت اسیدهای مختلف با پارامتری به نام ثابت یونش اسید یا ثابت تفکیک اسید اندازهگیری میشود. این پارامتر، در واقع مقدار ثابت تعادل واکنش شیمیایی تفکیک اسید به یونهای سازنده آن در محلول آبی است. به طور کلی، معادله واکنش تفکیک اسید به شکل زیر نوشته میشود.
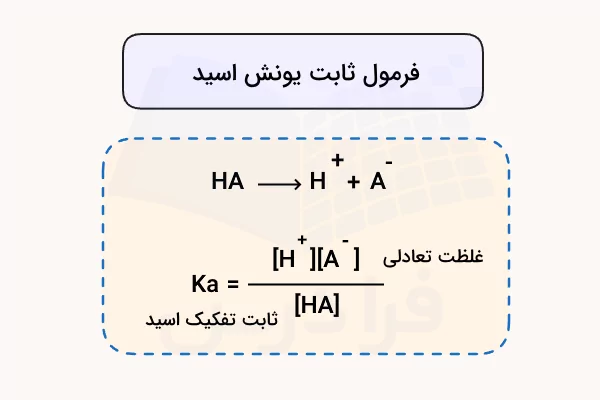
مقدار ثابت یونش اسید برای اسیدی با معادله واکنش تفکیک مطابق بالا، به شکل زیر محاسبه میشود.
از آنجا که مقدار غلظت آب در محلولهای آبی زیاد است، مقدار آن به طور نسبی پیش و پس از تعادل واکنش ثابت باقی میماند. به همین علت، از محاسبه آن در ثابت یونش اسید صرف نظر میشود. قدرت اسید با مقدار عددی ثابت یونش اسید نسبت مستقیم دارد. رابطه قدرت اسید و ثابت یونش اسید به شکل زیر است.
- اسیدهای قوی مقدار ثابت یونش زیادی دارند.
- اسیدهای ضعیف مقدار ثابت یونش کمی دارند.
مقدار زیاد ثابت یونش اسید به معنی بالا بودن غلظت فرآوردههای تفکیک اسید پس از رسیدن به نقطه تعادل است. این بدین معنی است که اسید به مقدار زیادی تفکیک شده است و قدرت زیادی در تولید یون هیدروژن دارد. در مقابل، کم بودن مقدار ثابت یونش اسید به معنی تفکیک ناقص اسید و باقی ماندن غلظت قابل توجهی از اسید اولیه به صورت تفکیک نشده است. بنابراین اسید ضعیف بوده و توانایی زیادی در تولید یون هیدروژن را ندارد.
معمولا مقدار ثابت یونش برای اسیدهای خیلی قوی محاسبه نمیشود. زیرا اسید اولیه به صورت کامل تفکیک شده و غلظت تعادلی آن (مخرج کسر ثابت یونش) برابر با صفر خواهد بود.
مثال ثابت یونش اسید
استیک اسید، یک اسید ضعیف است که مقدار ثابت تفکیک اسید کمی دارد. معادله واکنش تفکیک و معادله و مقدار ثابت یونش استیک اسید به شکل زیر است.
مقدار ثابت تفکیک اسید برخی از اسیدهای رایج آلی و معدنی در جدول زیر ارائه شده است.
| معادله واکنش تفکیک اسید | ثابت یونش اسید |
| خیلی بزرگ | |
یادگیری شیمی دوازدهم با فرادرس
برای درک بهتر این موضوع که ثابت یونش اسید چیست، ابتدا باید با مفاهیمی چون نظریه آرنیوس، تعریف اسید و باز در شیمی، روش تشخیص اسید و باز و رنگ کاغذ pH در محلولهای اسیدی و بازی آشنا شویم. پیشنهاد میکنیم برای یادگیری بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه دوزادهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری درباره ثابت یونش اسید دسترسی داشته باشید.
نوشتن معادله تفکیک اسید
یکی از مهمترین قدمها برای درک این موضوع که ثابت یونش اسید چیست، نوشتن معادله تفکیک اسید در آب به صورت صحیح است. برای نوشتن معادله تفکیک اسید میتوان از یکی از الگوهای زیر استفاده کرد.
همانطور که در واکنشهای بالا مشاهده میکنید، اسیدها در آب حل شده و یون هیدروژن آزاد میکنند. یون هیدروژن به صورت طبیعی در آب پایدار نیست و با یک مولکول آب پیوند برقرار کرده و به یون هیدرونیوم تبدیل میشود.
اگر تا این قسمت از مطلب را مطالعه کردهاید، با ثابت یونش اسید و فرمول آن آشنا شدهاید. در ادامه این مطلب به توضیح سایر مفاهیم مربوط به ثابت یونش اسید میپردازیم.
پیشنهاد میکنیم برای مطالعه بیشتر این نوع مطالب و دسترسی همیشگی و رایگان به آنها در موبایل خود، اپلیکیشن رایگان مجله فرادرس را نصب کنید تا همیشه به مطالب مجله فرادرس دسترسی داشته باشید.
برای نصب اپلیکیشن رایگان مجله فرادرس، کلیک کنید.
با جدا کردن یون هیدروژن از فرمول شیمیایی اسید، یون منفی باقی میماند که باز مزدوج اسید خواهد بود. بدین ترتیب میتوان معادله واکنش تفکیک اسیدهای مختلف را نوشت.
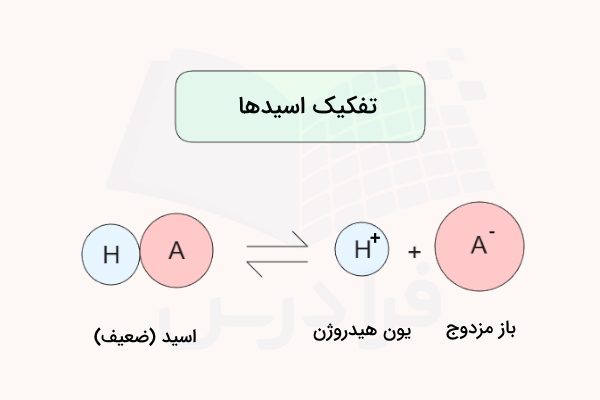
معادله واکنش شیمیایی تفکیک اسیدهای قوی با ثابت یونش بالا معمولا با فلش یک جهته نمایش داده میشوند که به معنی برگشتپذیر نبودن واکنش است. زیرا این اسیدها به شکل کامل در آب تفکیک میشوند. در مقابل، معادله واکنش تفکیک اسیدهای ضعیف با ثابت یونش کم، معمولا با فلش دوطرفه نمایش داده میشود که نشاندهنده برگشتپذیر بودن واکنش تفکیک این اسیدها است.
مثال نوشتن معادله تفکیک اسید
در قسمت قبل آموختیم ثابت یونش اسید چیست و چگونه میتوان معادله تفکیک اسید را با استفاده از یون هیدروژن (هیدرونیوم) و باز مزدوج آن نوشت.
در ادامه نام برخی از اسیدها به همراه فرمول شیمیایی و باز مزدوج آنها ارائه شده است.
| نام اسید (فرمول شیمیایی) | باز مزدوج |
| اسید هیدروکلریک () | |
| اسید سولفوریک () | |
| اسید نیتریک () | |
| اسید فسفریک () | |
| استیک اسید () | |
| کربنیک اسید () | |
| هیدروسیانیک اسید () |
برای درک بهتر آنچه در قسمت قبل آموختید، به مثالهای زیر دقت کنید.
مثال ۱
واکنش تفکیک اسیدهای هیدروژن کلرید و اسید نیتریک را بنویسید.
پاسخ
برای نوشتن معادله تفکیک اسیدهای مختلف باید یک یون هیدروژن مثبت را از فرمول شیمیایی آنها جدا کرده و آنیون باقی مانده را نیز به عنوان باز مزدوج و فرآورده واکنش تفکیک بنویسیم.
مثال ۲
واکنش تفکیک اسیدهای اسید سولفوریک و اسید استیک را بنویسید.
پاسخ
همانند قسمت قبل، یک یون هیدروژن مثبت را از فرمول شیمیایی آنها جدا کرده و آنیون باقی مانده را به عنوان باز مزدوج و فرآورده واکنش تفکیک مینویسیم.
محاسبه ثابت یونش اسید
برای محاسبه ثابت یونش اسید، از فرمول زیر استفاده میکنیم. بدین ترتیب، ثابت یونش اسید با تقسیم غلظت تعادلی فرآوردههای واکنش بر مقدار غلظت اسید اولیه به دست میآید.
برای مثال، به واکنش تفکیک اسید هیدروژن سیانید دقت کنید.
میخواهیم مثدار ثابت یونش این اسید را برای اسیدی با غلظت ۰٫۸ مولار و غلظت فرآوردههای ۰٫۰۰۳۹ مولار محاسبه کنیم. برای این کار، مقادیر داده شده را در معادله ثابت یونش قرار میدهیم.
در جدول زیر، تمامی فرمولهای محاسبه ثابت یونش اسید خلاصه شده است.
| روش محاسبه | فرمول |
| با غلظت اسید و یون هیدروژن | |
| با غلظت اولیه اسید و یون هیدروژن | |
| با استفاده از pH | |
| با استفاده از pKa | |
| با استفاده از درجه یونش |
مثال محاسبه ثابت یونش اسید
برای درک بهتر اینکه ثابت یونش اسید چیست، به مثالهای زیر دقت کنید.
مثال ۱
برای استیک اسید، مقدار ثابت یونش اسید برابر با است. مقدار غلظت یون هیدرونیوم را در محلول ۰٫۳ مولار این اسید محاسبه کنید.
پاسخ
برای محاسبه غلظت یون هیدرونیوم این اسید ابتدا باید معادله واکنش شیمیایی تفکیک آن را بنویسیم.
سپس معادله محاسب ثابت یونش اسید را نوشته و مقدار غلظت یون هیدرونیوم را در آن برابر با مجهول قرار میدهیم.
برای حل این معادله درجه دوم به روش زیر عمل میکنیم.
مثال ۲
مقدار غلظت تعادلی یون هیدرونیوم در محلول بنزوییک اسید ۰٫۴۳ مولار برابر با ۰٫۰۰۵۲ مول بر لیتر است. مقدار ثابت یونش اسید را برای این محلول محاسبه کنید.
پاسخ
برای محاسبه ثابت یونش این اسید باید غلظت اولیه و غلظتهای تعادلی فرآوردههای واکنش تفکیک را در معادله و فرمول محاسبه ثابت یونش قرار دهیم. ابتدا واکنش تعادلی تفکیک این اسید را نوشته سپس مقادیر را در فرمول مربوطه جایگذاری میکنیم.
مثال ۳
مقدار ثابت یونش را برای محلول هیپوکلروس اسید ([HOC]) ۰٫۲ مولار با محاسبه کنید.
پاسخ
مقادیر داده شده را در فرمول محاسبه ثابت یونش اسید میگذاریم. در تعادل مقدار غلظت اولیه اسید به اندازه کاهش مییابد. بنابراین خواهیم داشت:

برای درک بهتر روش محاسبه ثابت یونش اسید، به تمرینهای زیر پاسخ دهید.
پیشنهاد میکنیم برای درک بهتر مفهوم ثابت یونش و روش محاسبه آن، فیلم آموزش ثابت یونش اسید فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مفهوم درجه یونش چیست؟
درجه یونش به معنی نسبت مقدار مادهای که تفکیک شده به مقدار کلی اسید است. این پارامتر معمولا واحد ندارد و میتواند به همراه درصد (با عنوان درصد یونش) بیان شود. مقدار درجه یونش با علامت نمایش داده میشود. درجه یونش یا درصد یونش درواقع همان مقدار یون هیدرونیوم تولید شده حاصل از تفکیک اسید را مشخص میکند.
اگر مقدار اولیه اسید را برابر با ٪۱۰۰ در نظر گرفته و مقدار یون هیدرونیوم تولید شده در نقطه تعادل برابر با درجه یونش باشد، میتوانیم فرمول محاسبه ثابت یونش را به شکل زیر بازنویسی کنیم.

محاسبه ثابت یونش اسید با استفاده از pH
برای محاسبه ثابت یونش با استفاده از مقدار pH محلول اسید، باید مقدار غلظت یون هیدروژن یا هیدرونیوم را با استفاده از آن به دست آوریم. سپس با داشتن غلظت یون هیدروژن و غلظت اولیه اسید میتوان فهمید ثابت یونش اسید چیست.
پیشنهاد میکنیم برای درک بهتر روش محاسبه مقدار pH محلولهای اسیدی و بازی، مطلب محاسبه pH در شیمی مجله فرادرس را مطالعه کنید.
برای مثال، تصور کنید میخواهیم مقدار ثابت یونش محلول ۰٫۲ مولار پروپیونیک اسید با فرمول شیمیایی و pH برابر ۴٫۸۸ را به دست آوریم. ابتدا معادله واکنش تفکیک اسید را مینویسیم.
سپس مقدار غلظت یون هیدرونیوم را با استفاده از pH به دست میآوریم.
این بدین معنی است که غلظت یون هیدرونیوم و باز مزدوج اسید این مقدار است و مقدار غلظت اولیه اسید نیز در تعادل را باید منهای این عدد کنیم. بنابر این ثابت یونش اسید به شکل زیر به دست میآید.
pKa چیست؟
pKa یک کمیت لگاریتمی است که قدرت اسید را نشان میدهد. این پارامتر از ثابت تفکیک اسید (Ka) به دست میآید و رابطه آن با Ka به صورت زیر نمایش داده میشود.
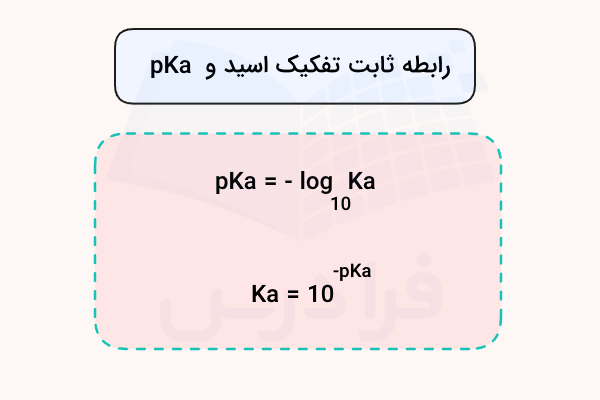
هر چه مقدار pKa کوچکتر باشد، اسید قویتر است و بیشتر تمایل به از دست دادن پروتون دارد. این کمیت به راحتی امکان مقایسه قدرت اسیدهای مختلف را فراهم میکند و در محاسبه pH محلولهای اسیدی ضعیف کاربرد دارد.
ثابت یونش باز چیست؟
بازها نیز مانند اسیدها در آب تفکیک شده و یون هیدروکسید منفی و اسید مزدوج را تولید میکنند. ثابت تعادل واکنش تفکیک باز در محلول آبی با نام ثابت یونش باز یا ثابت تفکیک باز شناخته میشود و مقدار قدرت باز را تعیین میکند. برای یک معادله واکنش تفکیک باز با فرم کلی زیر، ثابت یونش باز به شکل زیر محاسبه میشود.
همانند ثابت تفکیک اسید، مقدار فعالیت آب برابر با ۱ بوده و مقدار غلظت آن تغییر قابل توجهی نمیکند و به همین علت در معادله ثابت تفکیک باز از آن صرف نظر میشود. ثابت تفکیک باز برخی از بازهای رایج در ادامه آورده شده است.
| واکنش تفکیک باز | مقدار ثابت تفکیک باز |
رابطه ثابت یونش اسید و باز چیست؟
ثابت یونش اسید و ثابت یونش باز مزدوج آن اسید باهم رابطهای ساده درند. برای مثال واکنش یونیزاسیون هیدروسانیک اسید را در نظر بگیرید.
مثدار ثابت یونش اسید این واکنش از رابطه زیر به دست میآید.
به همین ترتیب، معادله واکنش باز مزدج آن و مقدار ثابت یونش باز آن از رابطه زیر به دست میایند.
بدین ترتیب، با جمع کردن این معادله واکنشها و ضرب ثابت تعادل این واکنشها خواهیم داشت:
همانطور که مشاهده میکنید، جمع واکنش یونش اسید و باز مزدوج آن برابر با واکنش خود یونش آب بوده و مقدار ثابت یونش آن برابر با ثابت یونش واکنش خود یونش آب خواهد بود.
با لگاریتم منفی گرفتن از این معاله به معادله زیر خواهیم رسید که با استفاده از آن مقدار pH اسیدها و بازها به دست خواهد آمد.
برای درک بهتر این فرمولها، به مثالهای زیر دقت کنید.
مثال ۱
مقدار pKb یون بوترات با فرمول شیمیایی را محاسبه کنید.
(مقدار pKa بوتریک اسید در دمای ۲۵ درجه سانتیگراد برابر با ۴٫۸۳ است.)
پاسخ
با استفاده از رابطه ارائه شده در قسمت قبل میتوانیم مقدار pKb را برای این یون به دست آورریم. خواهیم داشت:
مثال ۲
مقدار ثابت یونش اسید و pKa را برای یون دی متیل آمونیوم با فرمول شیمیایی به دست آورید. مقدار ثابت یونش باز برای دی متیل آمین () در دمای ۲۵ درجه سانتیگراد برابر با است.
پاسخ
با استفاده از رابطه pKb و Kb، مقدار Kb را محاسبه میکنیم و با استفاده از آن میتوانیم ثابت یونش اسید را به دست آوریم.
خودیونش آب چیست؟
آب مقدار غلظت خیلی پایینی از یونهای قابل اندازهگیری هیدرونیوم و هیدروکسید دارد. به این دلیل که آب میتواند به صورت خودبخود دچار یونش شده و تفکیک شود. معادله واکنش خود یونش آب به شکل زیر است.
با وجود اینکه غلظت این یونها در آب زیاد نیست، اما نشاندهنده این است که آب خاصیت هدایت الکتریکی دارد. علت پدیده خودیونش آب، الکترونگاتیوی زیاد اتم اکسیژن و جذب الکترونهای موجود در اتم هیدروژن به وسیله آن است. با جذب این الکترونها، یک اتم هیدروژن دیگر از یک مولکول آب به صورت یون هیدروژن جدا شده و سپس با یک اتم آب دیگر واکنش داده و یون هیدرونیوم تولید میکند.
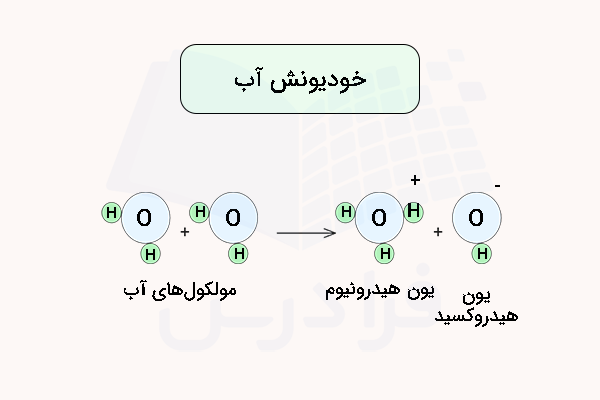
در ۱ لیتر آب خالص در دمای ۲۵ درجه سانتی گراد، تعداد مول هیدرونیوم و هیدروکسید در تعادل هستند. بدین ترتیب، ثابت یونش آب در شرایط تعادلی برابر با بوده و معادله ثابت یونش آن به شکل زیر است.
معمولا به ثابت یونش آب در شرایط تعادلی، Kw گفته میشود. به وسیله این پارامتر میتوان مقدار اسیدیته و pH محلولهای اسیدی را به دست آورد.
محاسبه اسیدیته با استفاده از مقدار ثابت یونش
یکی از پرکاربردترین استفادههای مقدار ثابت یونش اسید، محاسبه pH آن است. برای این کار باید مقدار غلظت یون هیدروژن یا هیدرونیوم را با استفاده از ثابت یونش و معادله تفکیک اسید به دست آوریم. در مواردی که اسید تفکیک شده یک اسید قوی است، مقدار غلظت یون هیدروژن در آن به دلیل تفکیک کامل اسید برابر با غلظت اولیه اسید خواهد بود. اما در مواردی که اسید تفکیک شده از نوع اسید ضعیف است، باید از رابطه ثابت یونش استفاده شود.
برای مثال، تصور کنید میخواهیم مقدار pH اسید ضعیف HOBr را در محلول ۰٫۲ مولار این اسید محاسبه کنیم. ابتدا معادله تفکیک اسید را مینویسیم.
مقدار ثابت تفکیک این اسید برابر با مول بر لیتر است. جدولی تهیه کرده و مقادیر غلظت مواد واکنش دهنده و فرآورده را پیش و پس از رسیدن به تعادل شیمیایی مینویسیم.
| پیش از تعادل | پس از تعادل |
| واکنشدهنده: ۰٫۲ مولار | واکنش دهنده: ۰٬۲ مولار – x |
| : صفر | : x |
| : صفر | : x |
حال با نوشتن معادله محاسبه ثابت یونش و جایگذاری این مقادیر در آن به روابط زیر خواهیم رسید.
حال میتوانیم با جایگذاری مقدار ثابت یونش واکنش، مقدار غلظت یون هیدرونیم (x) را بیابیم. نکته مهم در این محاسبه این است که مقدار غلظت فرآوردههای واکنش در لحظه تعادل با هم تقریبا برابر خواهد بود. بدین ترتیب مقدار مجهول را میابیم.
حال برای یافتن pH محلول اسیدی کافی است از غلظت یون هیدرونیوم در ان، لگاریتم منفی بگیریم.

اسیدها و بازهای چند ظرفیتی
برخی از اسیدها مانند اسید سولفوریک، اسید فسفریک و اسید کربنیک، بیش از یک یون هیدروژن در آب آزاد میکنند. به این اسیدها، اسید چند ظرفیتی گفته میشود. به همین ترتیب، به بازهایی که بیش از یک یون هیدروکسید به ازای هر مولکول باز در آب آزاد میکنند، باز چند ظرفیتی گفته میشود.
برای هر مرحله تفکیک این اسیدها و بازها، یک معادله تفکیک و یک ثابت یونش نوشته میشود. برای مثال واکنش تفکیک و مقدار ثابت یونش اسید سولفوریک به شکل زیر است.
طی هر یک از این واکنشها، یک هیدروژن از مولکول جدا میشود. معمولا مقدار ثابت یونش دوم و سوم اسید به ترتیب کاهش مییابد. در بیشتر موارد، اولین یونش اسیدهای چند ظرفیتی است که بر مقدار اسیدیته و pH محلول اثر میگذارد.
محاسبه ثابت یونش و pH اسید چند ظرفیتی
برای اسیدها و بازهای چند ظرفیتی، به تعداد یونهای هیدروژن یا هیدروکسید آنها واکنش تفکیک و ثابت یونش وجود دارد. برای محاسبه pH محلول این اسیدها و بازها، باید مقدار غلظت یون هیدرونیوم یونش اول، برای استفاده در یونش دوم و یون هیدرونیوم نیز برای استفاده در یونش سوم استفاده شود. اما در نهایت غلظت یون هیدونیوم یونش دوم و سوم معمولا به قدری ناچیز است که بر مقدار pH کلی محلول اثری نمیگذارد.
برای درک بهتر روش محاسبه pH این محلولها با استفاده از ثابت یونش، محلول ۰٫۰۰۷ مولار سیتریک اسید را در نظر بگیرید. مقادیر ثابت یونش این اسید به شکل زیر است.
| معادله واکنش تفکیک | ثابت یونش |
برای محاسبه pH این محلول، ابتدا غلظت یون هیدرونیوم را با استفاده از ثابت یونش اول به دست میآوریم.
سپس از این مقدار در معادله ثابت یونش دوم اسید به شکل زیر استفاده میکنیم.
توجه داشته باشید که اگر مقدار pH را با استفاده از غلظت اولیه هیدرونیوم به دست میآوردیم نیز همین مقدار به دست میآمد.
محلول بافر
محلولهای بافر ترکیبی از محلول یک اسید و باز مزدوج آن یا یک باز و اسید مزدوج آن هستند. این مواد در برابر تغییر pH در صورت افزوده شدن اسید یا باز مقاومت میکنند. برای مثال، خون انسان یک محلول بافر است که pH آن به راحتی تغییر نمیکند. برای به دست آوردن مقدار pH محلول بافر از ثابت یونش اسید استفاده میشود. محاسبات این محلولها به شکل زیر است.
به معادله ی به دست آمده بالا، رابطه هندرسون – هاسلباخ گفته میشود. به همین ترتیب میتوان رابطه زیر را برای بافرهای بازی استفاده کرد.
مثال محاسبه pH محلول بافر
برای درک بهتر این موضوع که رابطه pH محلول بافر و ثابت یونش اسید چیست، به مثال زیر دقت کنید.
مقدار pH پلاسمای خون برابر با ۷٫۴ است. این بافر از ترکیب کربنیک اسید و هیدروژن کربنات تشکیل شده است. چه جرمی از سدیم بی کربنات باید به محلول ۰٫۲۵۰ مولار این محلول اضافه شود تا pH محلول به ۷٫۴ برسد؟
پاسخ
برای پاسخ به این سوال، از فرمولهای ارائه شده در قسمت قبل استفاده میکنیم. مقدار pH نهایی محلول و غلظت اولیه هیدروژن کربنات داده شده است. به روش زیر مقدار غلظت یون کربنیک اسید را به دست میآوریم.
حال با استفاده از روابط استوکیومتری و جرم مولی سدیم کربنات، مقدار جرم سدیم بیکربنات مورد نیاز برای تغییر pH یک لیتر محلول را به دست میآوریم.
آزمون ثابت یونش اسید
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختیم، به سوالات زیر پاسخ دهید. همچنین میتوانید پس از پاسخدهی به تمامی سوالات، با کلیک بر روی گزینه «دریافت نتیجه آزمون»، تعداد پاسخهای صحیح خود را مشاهده کنید.
source
