فصل دوم شیمی پایه یازدهم، مجموعهای از مفاهیم ترمودینامیک و سینتیک در شیمی را توضیح میدهد. در این فصل، مفاهیمی چون فرآیند گرماده و گرماگیر، مسائل ترموشیمی، آنتالپی، آنتروپی، قانون هس و سرعت واکنشهای شیمیایی بررسی میشود. در این مطلب از مجله فرادرس به جمع بندی فصل دوم شیمی یازدهم میپردازیم و مهمترین نکات این فصل را مرور میکنیم.
آنچه در این مطلب میآموزید:
-
با ترموشیمی آشنا شده و با مفاهیم دما، گرما و ظرفیت گرمایی آشنا میشوید.
-
میتوانید مفهوم انرژی فعالسازی و گرمای واکنش را درک کنید.
-
با محاسبه آنتالپی واکنش با استفاده از روشهای مختلف آشنا میشوید.
-
روشهای گرماسنجی و قانون هس را به شکلی کامل یاد میگیرید.
-
قوانین سینتیک و سرعت واکنش را میآموزید.
-
با گروههای عاملی و نقش هریک آشنا میشوید.



در ابتدای این مطلب، مباحث فصل دوم شیمی یازدهم را معرفی کرده و در ادامه، مهمترین مباحث ترموشیمی و سینتیک شیمیایی این فصل را بررسی میکنیم. در بخش ترمودینامیک، مباحثی مانند ظرفیت گرمایی، گرمای واکنش، آنتالپی و قانون هس بررسی میشود. پس از آن به بررسی سینتیک واکنش، آهنگ واکنش، نمودارهای مول – زمان و … میپردازیم. در نهایت، گروههای عاملی و ویژگیهای آنها را میآموزیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل جمع بندی فصل دوم شیمی یازدهم را بیاموزید.
جمع بندی فصل دوم شیمی یازدهم
در جمع بندی فصل دوم شیمی یازدهم، مهمترین اصول و مفاهیم پایه ترموشیمی و سینتیک واکنشهای شیمیایی مطرح میشود. این فصل شامل مفاهیم ترمودینامیکی مانند آنتروپی و آنتالپی و قانون هس است و به بررسی مسائل سینتیک مانند سرعت واکنش میپردازد.
در جدول زیر، خلاصه نکات مهم در جمع بندی فصل دوم شیمی یازدهم ارائه شده است.
| مفهوم | تعریف |
| سامانه و محیط | سامانه شامل اجزای واکنش و محیط هرچیزی بجز اجزای واکنش است. |
| واکنش گرماده و گرماگیر | واکنش گرماده گرما آزاد کرده و گرماگیر گرما میگیرد. |
| گرما | انتقال انرژی گرمایی بین دو دما |
| دما | اندازهگیری انرژی سینتیکی میانگین مولکولهای یک ماده با دماسنج |
| کالریمتر | ابزار اندازهگیری انرژی گرمایی |
| ظرفیت گرمایی | مقدار گرمای جذب یا آزاد شده به ازای تغییر دما |
| ظرفیت گرمایی ویژه | گرمای نیاز برای تغییر دمای یک گرم ماده به اندازه ۱ درجه |
| آنتالپی | کمیت اندازهگیری گرمای سامانه |
| تغییر آنتالپی استاندارد واکنش | آنتالپی فرآورده منهای آنتالپی واکنشدهنده |
| قانون هس | آنتالپی کل برابر جمع آنتالپی مسیر واکنش |
| آهنگ واکنش | سرعت تولید فرآوردهها یا مصرف واکنشدهندهها |
ترموشیمی چیست؟
ترموشیمی (گرماشیمی) شاخهای از ترمودینامیک است که رابطه بین گرما، کار و سایر صورتهای انرژی را در واکنشهای شیمیایی بررسی میکند. ترموشیمی، که یکی از اصلیترین مباحث در جمع بندی فصل دوم شیمی یازدهم است، مطالعه انرژی در سیستم (سامانه)هایی است که در آنها واکنش شیمیایی انجام میشود.
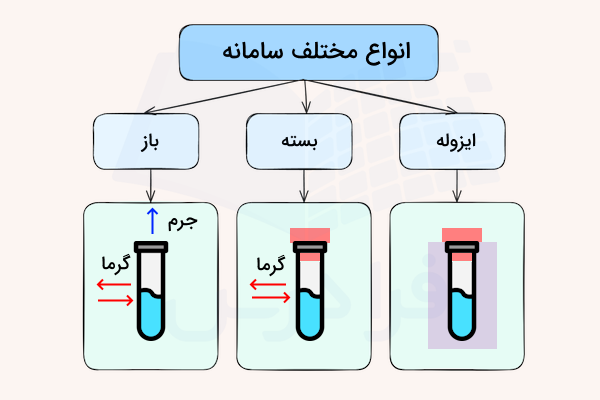
سامانه به ظرف یا محل انجام واکنش گفته میشود و به هرچه اطراف آن قرار دارد، محیط گفته میشود. در ترموشیمی، ۳ نوع سیستم (سامانه) تعریف میشود. این سامانهها، سامانه باز، بسته و ایزوله هستند که در ادامه معرفی شده است.
- سامانه باز: در این سامانه تبادل جرم و انرژی (گرما) با محیط انجام میشود.
- سامانه بسته: در این سامانه تبادل انرژی با محیط انجام میشود اما تبادل جرم با محیط وجود ندارد.
- سامانه ایزوله: در این سامانه هیچ تبادل جرم و انرژی با محیط انجام نمیشود.
در ترموشیمی مفاهیمی مانند انرژی، دما و گرما، ظرفیت گرمایی، انواع فرایندهای ترمودینامیکی، گرمای واکنش و … بررسی میشود که در ادامه به توضیح این موارد میپردازیم.
دما چیست؟
دما اندازهگیری انرژی سینتیکی میانگین مولکولهای یک ماده است که بر حسب درجه و با استفاده از دماسنج اندازهگیری میشود. دما در واقع مشخص میکند که یک جسم تا چه اندازه «سرد» یا «داغ» است.
واحد اندازهگیری دما
دما را با استفاده از دماسنج (ترمومتر) و بر حسب درجه اندازهگیری میکنند. درجه اندازهگیری شده میتواند بر حسب سلسیوس (سانتیگراد)، کلوین یا فارنهایت باشد. در ادامه هر یک از این موارد به همراه روش تبدیل واحد دما مشخص شده است.
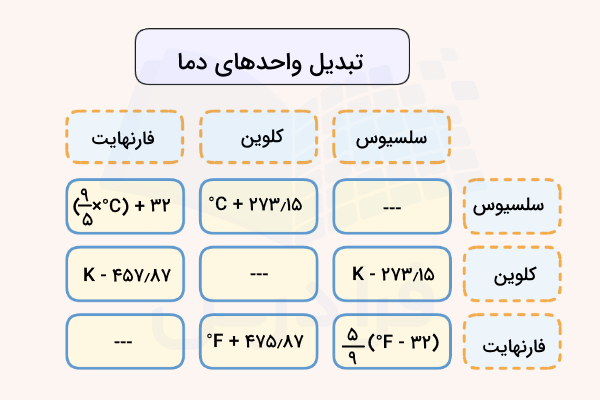
در جدول بالا روشهای تبدیل این واحدها نوشته شده است. ترتیب فرمولهای نوشته شده این واحدهاُ برای تبدیل واحدهای سمت راست به ردیف بالا است. برای مثال، برای تبدیل سلسیوس به کلوین باید درجه سلسیوس را با عدد ۲۷۳٫۱۵ جمع کرد.
گرما چیست؟
گرما، جابجایی انرژی گرمایی بین یک جسم داغ و یک جسم سرد است. درواقع گرما به دلیل اختلاف دما بین دو جسم به وجود میآید. گرما یک فرم دینامیکی انرژی است که انتقال انرژی جنبشی بین مولکولها را نشان میدهد و بر حسب ژول اندازهگیری میشود.
تفاوت دما و گرما
گرما، انتقال انرژی گرمایی بین دو حد مختلف دما است. انتقال انرژی گرمایی همواره از جسم (سامانه)ای با دما (انرژی سینتیکی) بالاتر به جسمی با دمای کمتر انجام میشود. دما و گرما دو مفهوم رایج ترمودینامیک هستند اما نباید با هم اشتباه گرفته شوند. در جدول زیر، تفاوتهای دما و گرما مشخص شده است.
| دما | گرما |
| اندازهگیری داغی و سردی | نوعی انرژی |
| واحد سلسیوس، کلوین، فارنهایت | واحد ژول یا کالری |
| میتواند منفی یا مثبت باشد. | همواره مثبت |
| با گرما افزایش و با سرما کاهش مییابد. | از گرم به سرد جاری میشود. |
| اندازهگیری با دماسنج | اندازهگیری با کالریمتر |
یادگیری شیمی یازدهم با فرادرس
برای یادگیری جمع بندی فصل دوم شیمی یازدهم، باید با مفاهیمی چون انواع فرآیندهای ترمودینامیکی، انواع آنتالپی، اندازهگیری گرمای واکنش، سینتیک شیمیایی و سرعت واکنشهای شیمیایی آشنا شویم. پیشنهاد میکنیم برای یادگیری این مفاهیم، به مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری درباره جمع بندی فصل دوم شیمی یازدهم دسترسی داشته باشید.
مفاهیم و واحدهای ترموشیمی
در ترموشیمی مفاهیم مختلفی مانند آنتالپی، گرمای واکنش، فرآیندهای گرماده و گرماگیر، انرژی و قانون هس بحث و بررسی میشود. در جدول زیر، مفاهیم و واحدهای ترموشیمی آورده شده است.
| مفهوم | تعریف |
| ظرفیت گرمایی | مقدار گرمای جذب یا آزاد شده ماده با تغییر دما به اندازه ۱ درجه |
| ظرفیت گرمایی ویژه | مقدار گرمای مورد نیاز برای تغییر دمای یک گرم ماده به اندازه ۱ درجه |
| واکنش گرماده | واکنشی که با انجام شدن گرما آزاد میکند. |
| واکنش گرماگیر | واکنشی که برای انجام شدن نیاز به جذب گرما دارد. |
| گرماسنجی | اندازهگیری گرمای واکنش به وسیله کالریمتر |
| آنتالپی | کمیتی که مقدار انرژی کل واکنش را تعریف میکند. |
| آنتالپی سوختن | تغییرات آنتالپی در صورت سوختن ۱ مول ماده |
| آنتالپی تشکیل | تغییرات آنتالپی تشکیل یک مول ماده |
| آنتالپی پیوند | تغییرات آنتاپی شکستن ۱ مول پیوند |
| قانون هس | برابر بودن تغییر آنتالپی کل واکنش با جمع آنتالپی هر مسیر آن |
| ارزش سوختی | تغییر آنتالپی واکنش سوختن ۱ گرم سوخت |
در ادامه هر یک از این مفاهیم را بررسی میکنیم.
ظرفیت گرمایی مواد
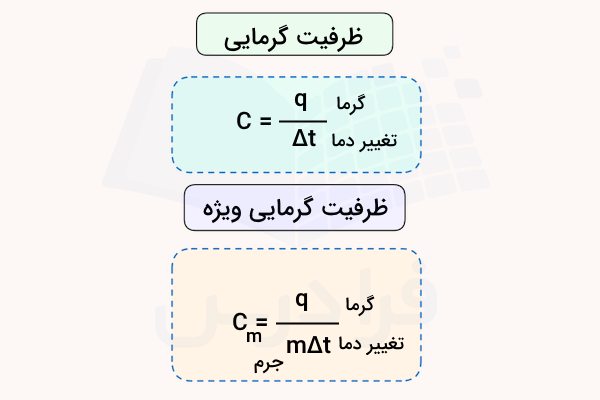
ظرفیت گرمایی یک ماده مقدار گرمای جذب شده یا آزاد شده از آن با تغییر دما به اندازه یک درجه سانتیگراد یا یک درجه کلوین است. این پارامتر با استفاده از رابطه زیر محاسبه میشود.
در این فرمول، C ظرفیت گرمایی ماده، q گرما و مقدار تفاوت دما است. واحد اندازهگیری ظرفیت گرمایی، ژول بر درجه سانتیگراد است. مقدار ظرفیت گرمایی ممکن است وابسته به جرم ماده نیز باشد. از این رو، پارامتری به نام ظرفیت گرمایی ویژه (گرمای ویژه) تعریف میشود که در آن جرم ماده (m) بر حسب گرم نیز در فرمول آن لحاظ میشود.
فرآیندهای گرماده و گرماگیر
واکنشها از لحاظ ترمودینامیکی میتوانند به دو دسته گرماده و گرماگیر تقسیم شوند. فرآیندهای گرماده با انجام واکنش شیمیایی گرما را از سامانه به محیط منتقل میکنند. فرآیندهای گرماگیر برای انجام واکنش شیمیایی، نیاز به دریافت گرما از محیط به سامانه را دارند.
به بیان دیگر، در فرآیند گرماده، سطح انرژی فرآوردهها از واکنشدهندهها بیشتر و در فرآیندهای گرماگیر، سطح انرژی واکنشدهنده کمتر از فرآورده است. در تصویر زیر، تفاوتها و نمودار انرژی این مواد معرفی شده است.
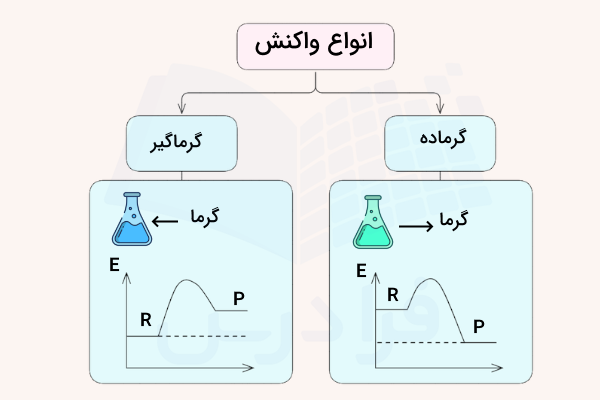
در این تصویر نمودار انرژی (E) بر حسب پیشرفت واکنش برای هر یک از واکنشها رسم شده است. همانطور که مشاهده میکنید انرژی واکنشدهندهها (R) در واکنش گیرماگیر کمتر از انرژی فرآوردهها (P) است. در مقابل در واکنش گرماده انرژی فرآوردهها کمتر از واکنشدهندهها است.
پیشنهاد میکنیم برای درک بهتر این واکنشها و روش تشخیص آنها، مطلب تشخیص واکنش گرماده و گرماگیر مجله فرادرس را مطالعه کنید.
انرژی فعالسازی
انرژی فعالسازی حداقل میزان انرژی اولیهای است که در واکنشهای مختلف برای شروع واکنش باید به سامانه داده شود. انرژی فعالسازی در واکنشهای گرماده کم و در واکنشهای گرماگیر زیاد است. برای انجام برخی از واکنشها با انرژی فعالسازی زیاد، از کاتالیزگر استفاده میشود. کاتالیزگرها میتوانند بدون مصرف شدن در واکنش، میزان انرژی فعالسازی را کاهش داده و به افزایش سرعت واکنش شیمیایی کمک کنند.
گرمای واکنش
از دیگر مباحث مهم در جمع بندی فصل دوم شیمی یازدهم، گرمای واکنش است. گرمای واکنش، مقدار انرژی گرمایی است که طی واکنش شیمیایی مصرف یا تولید میشود. انرژی گرمایی، نوعی از انرژی سینتیکی است که به حرکتهای تصادفی اتمها و مولکولها مربوط میشود. گرمای واکنش را میتوان با استفاده از روشهای مختلف گرماسنجی (کالریمتری) اندازهگیری کرد.
تا اینجای مطلب با تعریف ترموشیمی و مهمترین مباحث آن مانند ظرفیت گرمایی و تفاوت دما و گرما آشنا شدید. در ادامه این مطلب نیز، سایر مفاهیم مهم در فصل دوم شیمی یازدهم را به همین ترتیب آوردهایم.
پیشنهاد میکنیم برای مطالعه بیشتر اینگونه مطالب و دسترسی دائمی به آنها در موبایل خود، اپلیکیشن رایگان مجله فرادرس را نصب کنید.
برای نصب اپلیکیشن رایگان مجله فرادرس، کلیک کنید.
مقدار گرمای واکنش برای واکنشهای گرماده با علامت منفی و برای واکنشهای گرماگیر با علامت مثبت نمایش داده میشود. این روش نمایش به این علت است که در واکنشهای گرماده انرژی آزاد شده (به همراه فرآوردهها) و در واکنشهای گرماگیر انرژی به همراه واکنشدهندهها دریافت میشود. روشهای مختلفی برای نمایش گرمای واکنش در نوشتار معادله واکنش شیمیایی وجود دارد که در ادامه توضیح داده شده است.
- گرمای واکنش را میتوان با مقدار عددی انرژی به همراه واکنشدهنده یا فراورده ( بسته به نوع واکنش) نوشت.
- گرمای واکنش را میتوان جداگانه با نوشتن عبارت و مقدار و علامت مناسب آن در کنار معادله واکنش مشخص کرد.
- واکنشهای گرماگیر را میتوان با قرار دادن یک علامت و بدون مقدار آن یا به وسیله نوشتن انرژی مورد نیاز بر روی پیکان جهت واکنش مشخص کرد.
مثالهایی از این نوع نمایش در ادامه آورده شده است.
گرماسنجی
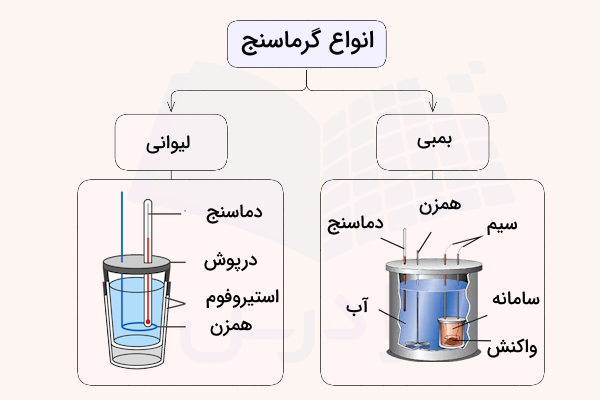
گرماسنجی، اندازهگیری تغییرات دما و انرژی گرمایی جابجا شده در واکنشهای شیمیایی به وسیله ابزارهای مختلف است. به ابزار اندازهگیری انرژی گرمایی در واکنشهای شیمیایی، کالریمتر (گرماسنج) گفته میشود. رایجترین ابزارهای گرماسنجی، گرماسنج بمبی و لیوانی هستند. این ابزارها، محفظهای با سامانه بسته دارند که یک دماسنج، تغییرات دمای واکنش را در آن را اندازهگیری میکند.
انرژی با واحد کالری اندازهگیری میشود. یک کالری مقدار انرژی مورد نیاز برای افزایش دمای یک گرم آب به اندازه یک درجه سانتیگراد یا یک درجه کلوین است. از طرفی واحد SI اندازهگیری پارامترهای گرما، کار و انرژی، ژول است. این واحد مقدار انرژی مورد نیاز برای جابجایی بک جسم به اندازه ۱ متر با نیروی ۱ نیوتون است. رابطه ژول و کالری به شکل زیر است.
۱ کالری = ۴٫۱۸۴ ژول
گرماسنج بمبی
این گرماسنج، مقدار گرمای واکنش را در حجم ثابت اندازه میگیرد و میتواند شامل مواد گازی باشد. دماسنج درون آب و درون ظرف گرماسنج قرار دارد. واکنش شیمیایی در قسمتی ایزوله شده در تماس با آب انجام شده و گرمای واکنش با توجه به ظرفیت گرمایی آب و جرم آن اندازهگیری میشود.
گرماسنج لیوانی
گرماسنج لیوانی برای اندارهگیری تغییرات آنتالپی در فشار ثابت است. در این گرماسنج دو ظرف عایق درون هم قرار گرفته و سیستم بسته و ایزوله است. دماسنج دمای واکنش انجام شده درون لیوان را اندازه میگیرد. شکل این دو گرماسنج در تصویر زیر مشخص شده است.
آنتالپی و انواع آن
آنتالپی (محتوای گرمایی) کمیتی است که مقدار گرما (انرژی) کل سیستم را تعریف میکند و با حرف H نمایش داده میشود. این کمیت یکی از مهمترین مباحث در جمع بندی فصل دوم شیمی یازدهم است. طبق قانون اول ترمودینامیک، آنتالپی یک سیستم وابسته به انرژی درونی، فشار و حجم آن است و با استفاده از فرمول زیر محاسبه میشود.
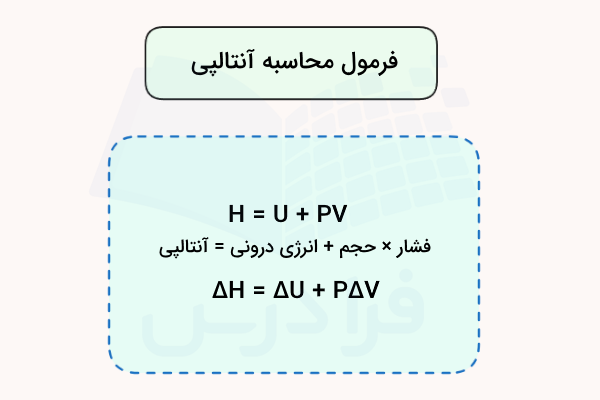
بنابراین، آنتالپی نیز یک تابع حالت است و تنها تغییرات آن طی واکنش شیمیایی میتواند اندازهگیری شود. بنابراین، در فشار ثابت، تغییرات آنتالپی با استفاده از فرمول زیر محاسبه میشود و تغییرات انرژی درونی و تغییر حجم در آن لحاظ میشود.
آنتالپی واکنش شیمیایی
آنتالپی واکنش تغییرات آنتالپی طی انجام بک واکنش شیمیایی است که از تفاوت آنتالپی فرآوردهها و واکنشدهندهها به دست میآید. مقدار آنتالپی برای واکنشهای گرماگیر مثبت و برای واکنشهای گرماده منفی است. مقدار آنتالپی در شرایط استاندارد معمولا برابر با مقدار گرمای واکنش است. پیشنهاد میکنیم برای درک بهتر نحوه محاسبه آنتالپی واکنش، فیلم آموزش آنتالپی فرادرس که لینک آن در ادامهاورده شده است را مشاهده کنید.
فرمول محاسبه آنتالپی واکنش در ادامه آورده شده است. این مقدار آنتالپی میتواند با استفاده از آنتالپی تشکیل یا آنتالپی پیوند به دست بیاید. اگر آنتالپی در شرایط استاندارد اندازهگیری شود، به آن آنتالپی استاندارد گفته میشود و با علامت نمایش داده میشود.

انواع آنتالپی
واکنشهای شیمیایی مختلف میتوانند آنتالپیهای مختلف داشته باشند. برای مثال،آنتالپی سوختن یک واکنش، تغییرات آنتالپی واکنش سوختن و آنتالپی تشکیل، تغییرات آنتالپی تشکیل یک ماده شیمیایی است. در ادامه برخی از مهمترین انواع آنتالپی را معرفی میکنیم.
- آنتالپی استاندارد سوختن: تغییرات آنتاللپی به ازای سوختن ۱ مول از ماده با اکسیژن اضافی در شرایط استاندارد.
- آنتالپی استاندارد تشکیل: تغییرات آنتالپی به اضای تشکیل ۱ مول ماده در پایدارترین حالت و در شرایط استاندارد.
- آنتالپی پیوند: آنتالپی پیوند یا آنتالپی تجزیه، انرژی مورد نیار برای شکستن یک مول از یک پیوند در حالت گازی و تولید اتمهای تک است.
آنتالپی استاندراد سوختن
آنتالپی استاندارد سوختن () مقدار تغییرات آنتالپی است که در صورت سوختن ۱ مول ماده به شکل کامل و در حضور اکسیژن اضافی در شرایط استاندراد اتفاق میافتد. برای مثال، آنتالپی استاندراد سوختن ۱ مول متان در شرایط استاندارد برابر با ۸۹۰٫۳۶- کیلوژول بر مول است.
واکنش سوختن یکی از مهمترین واکنشهایی است که در ترموشیمی بررسی میشود. واکنش سوختن واکنشی است که در آن یک ماده قابل احتراق با اکسیژن هوا ترکیب شده و ترکیبات آلی و آب تولید میکند. این واکنش، واکنشی گرماده است و میتواند انرژی قابل توجهی را به صورت نور و گرما آزاد کند. طی واکنش سوختن، واکنشدهنده دچار اکسیداسیون میشود.
برای مثال، انفجار مواد محترقه، سوختن چوب، سوختن سوختهایی مانند بنزین و نفت و … نمونههایی از واکنش سوختن هستند. ترکیبات آلی (دارای کربن) از ترکیباتی هستند که طی واکنش سوختن، کربن دیاکسید و آب و مقادیر قابل توجهی گرما آزاد میکنند.
آنتالپی استاندراد تشکیل
آنتالپی استاندارد تشکیل () مقدار تغییرات آنتالپی است که مربوط به واکنش تشکیل یک مول ترکیب از اتمها و عناصر سازنده آن در شرایط استاندارد ( فشار ۱ اتمسفر و و دمای ثابت) است. با استفاده از این آنتالپی میتوان آنتالپی استاندارد واکنش را به دست آورد. برای این کار، آنتالپی استاندارد تشکلیل فرآوردهها به دست آمده و جمع آنتالپی استاندارد تشکیل واکنشدهندهها از آن کم میشود.

آنتالپی پیوند
آنتالپی پیوند (انرژی شکستن پیوند) مقدار انرژی مورد نیاز برای شکستن یک مول از یک پیوند کووالانسی مشخص در یک مولکول گازی است. نتیجهی این فرآیند، تولید اتمهای تکی گازی است. در واقع اگر واکنش شکستن یک پیوند و تولید دو اتم گازی یک مولکول را بنویسیم، آنتالپی این واکنش برابر با آنتالپی پیوند خواهد بود.
آنتالپی پیوند همواره مقداری مثبت دارد و گرماگیر است زیرا شکستن پیوند نیاز به دریافت انرژی دارد.
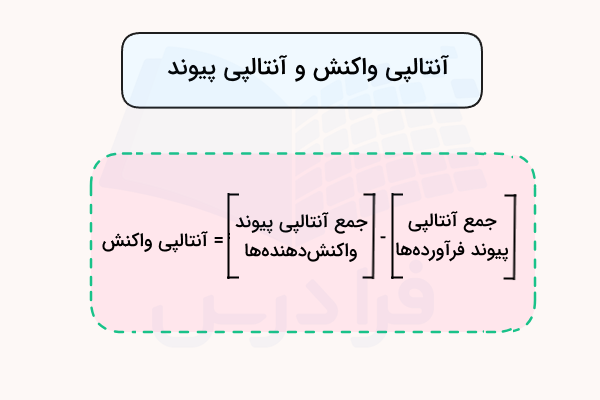
مقدار شکستن پیوند هر اتم درگیر در پیوند با یک اتم دیگر، مقدار متفاوتی دارد. همچنین، تعداد پیوندهای موجود در هر مولکول نیز بر مقدار آنتالپی پیوند اثرگذار است. به همین علت، پارامتری به نام میانگین انرژی پیوند برای هر پیوند در نظر گرفته شده و با توجه به آن میتوان مقدار آنتالپی واکنش را به دست آورد. برای این کار، آنتالپی پیوند فرآورده ها از مقدار آنتالپی پیوند واکنشدهنده ها کم میشود.
مثال محاسبه آنتالپی واکنش
برای درک بهتر آنچه در این قسمت آموختیم، به مثال زیر توجه کنید. در این واکنش، مقدار آنتالپی پیوند مواد واکنشدهنده و فرآورده داده شده است. با توجه به این مقادیر، آنتالپی واکنش را محاسبه کنید.
| نوع آنتالپی | مقدار آنتالپی |
| آنتالپی پیوند H-O | ۴۶۰ کیلوژول بر مول |
| آنتالپی پیوند H-H | ۴۳۶٫۴ کیلوژول بر مول |
| آنتالپی پیوند O=O | ۴۹۸٫۷ کیلوژول بر مول |
پاسخ:
در سمت واکنشدهندهها، ۴ پیوند O-H شکسته شده و در سمت فرآوردهها، ۲ پیوند H-H و ۱ پیوند O=O تشکیل میشود. برای محاسبه آنتالپی واکنش باید مقدار مجموع آنتالپی پیوند فرآورده ها را از واکنشدهنده ها کم کنیم. بدین ترتیب خواهیم داشت:
واکنشدهندهها:
فرآوردهها:
قانون هس
در بخش ترمودینامیک جمع بندی فصل دوم شیمی یازدهم، قانون هس را بررسی میکنیم. قانون هس بیان میکند که تغییرات آنتالپی یک واکنش کلی برابر با جمع تغییرات آنتالپی هر یک از مراحل آن است. بنابراین، تغییرات آنتالپی کل، وابسته به مسیر طی شدن واکنشهای مختلف نیست. برای مثال، نتغییر آنتالپی واکنش تولید آب با جمع تغییرات آنتالپی واکنش تشکیل هیدروژن و اکسیژن برابر است. این مفهوم در تصویر زیر مشخص شده است.
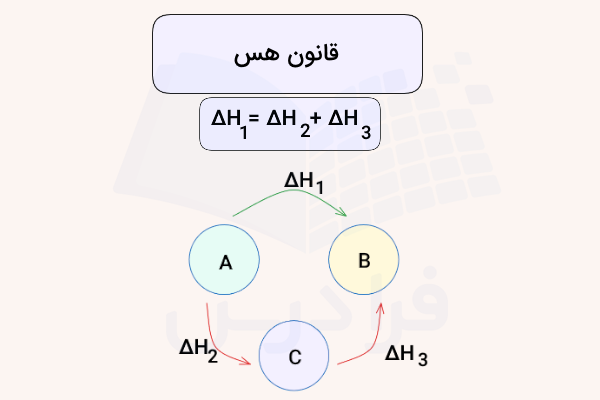
همانطور که در شکل بالا مشاهده میکنید، فرآورده B میتواند مستقیما از واکنشدهنده A تولید شده، یا با ۲ واکنش از تبدیل A به C و سپس B تولید شود. قانون هس بیان میکند که جمع آنتالپی مسیر دوم با آنتابپی مسیر اول برابر است. در ادامه مهمترین قوانین را در جمع آنتالپی واکنشهای مختلف طبق قانون هس توضیح میدهیم.
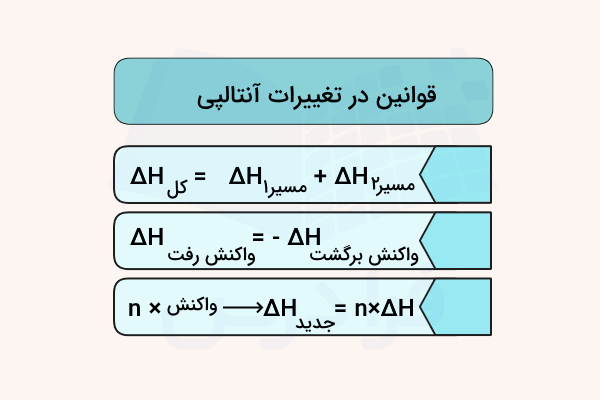
- جمعپذیری تغییرات آنتالپی: آنتالپی یک واکنش چند مرحلهای برابر با جمع آنتالپی مراحل است.
- برگشتپذیری واکنش شیمیایی: آنتالپی مسیر برگشت یک واکنش برابر یا همان مقدار آنتالپی واکنش، ولی با علامت مخالف است.
- ضربپذیری واکنش شیمیایی: هنگامی که ضرایب یک واکنش شیمیایی در یک عدد ضرب میشوند، آنتالپی واکنش نیز با همان ضریب تغییر میکند.
این قوانین در تصویر زیر مشخص شدهاند.
مثال قانون هس
برای درک بهتر روش استفاده قانون هس برای محاسبه گرمای یک واکنش شیمیایی، به مثالی که در ادامه آورده شده است توجه کنید.
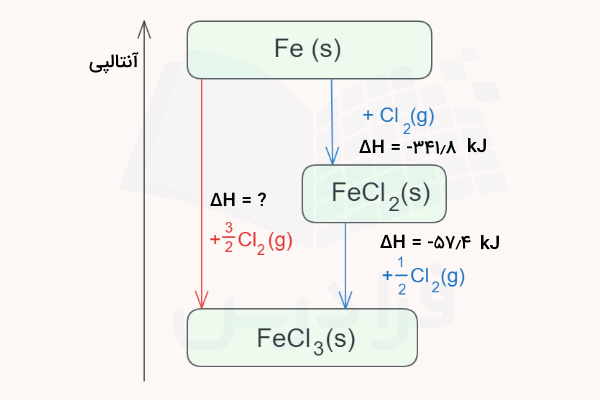
پاسخ:
برای پاسخ به این سوال ابتدا واکنش کلی که میخواهیم به آن برسیم و واکنشهایی که داریم را به همراه مقدار آنتالپی آنها مینویسیم.
حال با جمع کردن این دو واکنش و مقادیر آنتالپی آنها میتوانیم آنتالپی واکنش کلی را بیابیم.
پیشنهاد میکنیم برای درک بهتر این روش محاسبه و سایر معادلات شیمی یازدهم، مطلب فرمولهای شیمی یازدهم در یک نگاه را مطالعه کنید.
ارزش سوختی چیست؟
ارزش سوختی مقدار تغییر آنتالپی واکنش سوختن در ازای سوختن ۱ گرم ماده است. برای مثال، هنگامی که ۱ گرم متان میسوزد، ۵۰ کیلوژول انرژی آزاد میشود. بنابراین ارزش سوختی متان برابر با ۵۰ کیلوژول بر گرم است. هرچه مقدار ارزش سوختی سوختهای مختلف بیشتر باشد، کارایی آن سوخت برای تولید انرژی و استفاده در کاربردهای مختلف بیشتر است.
مواد غذایی نیز ارزش سوختی دارند و طی واکنتش های سوختن با اکسیژن ترکیب شده و در بدن انرژی آزاد میکنند. چربیها بیشترین انرژی سوختی و کربوهیدراتها کمترین ارزش سوختی را دارند. در گازهای مختلف، گاز هیدروژن بیتشرین انرژی را طی سوختن آزاد کرده و بیشترین ارزش سوختی (۱۵۰ کیلوژول بر گرم) را دارد. محاسبه ارزش سوختی مواد بر حسب گرم یکی از مطالب مهم در جمع بندی فصل دوم شیمی یازدهم است.
سینتیک چیست؟
سینتیک در شیمی مطالعه سرعت واکنشهای شیمیایی است. این علم شامل بررسی آهنگ واکنش شیمیایی، درک مکانیسم واکنش و حالتهای گذار و طراحی مدلهای محاسباتی برای پیشبینی و توصیف یک واکنش شیمیایی است. سرعت واکنش شیمیایی معمولا بر حسب واحدی بر ثانیه بیان میشود با این حال بسیاری از واکنشهای شیمیایی ممکن است ساعتها تا روزها برای انجام شدن به زمان نیاز داشته باشند.
سینتیک واکنش، اثر عوامل مختلف را بر سرعت واکنش بررسی کرده و دادههای کمی مربوط به آنها را تامین میکند.
قوانین سرعت و ثابت سرعت
دادههای تجربی به دست آمده به وسیله آزمایشهای مختلف منجر به تدوین قوانین سرعت و ثابت سرعت واکنش شده است. به کمک این قوانین میتوان سرعت واکنشهای مرتبه صفر، مرتبه اول و مرتبه دوم را محاسبه کرد. طبق این قوانین، سرعت واکنشهای مختلف به شکل زیر محاسبه میشود.
- واکنش مرتبه صفر: سرعت مستقل از غلظت و R=K
- واکنش مرتبه اول: سرعت وابسته به غلظت یک واکنشدهنده و R = K[A]
- واکنش مرتبه دوم: سرعت واکنش وابسته به مربع غلظت یک واکنشدهنده یا وابسته به غلظت دو واکنشدهنده. یا
در ادامه این بخش از جمع بندی فصل دوم شیمی یازدهم، مباحث سینتیک شیمیایی را بررسی میکنیم.
آهنگ واکنش
سرعت یا آهنگ واکنش شیمیایی، مقدار سرعت تولید فرآوردهها یا مصرف واکنشدهندهها را در واحد زمان اندازهگیری میکند. این پارامتر به وسیله پایش و اندازهگیری تغییرات غلظت مواد در واحد زمان انجام میگیرد. برای محاسبه آهنگ واکنش باید مقدار تغییرات غلظت یک واکنشدهنده یا یک فرآورده را بر مدت زمان مصرف شده تقسیم کرد. همچنین، ضریب استوکیومتری ماده نیز باید در محاسبه سرعت لحاظ شود.
فرمول عمومی معادله سرعت واکنش برای یک واکنش عمومی به شکل زیر است.
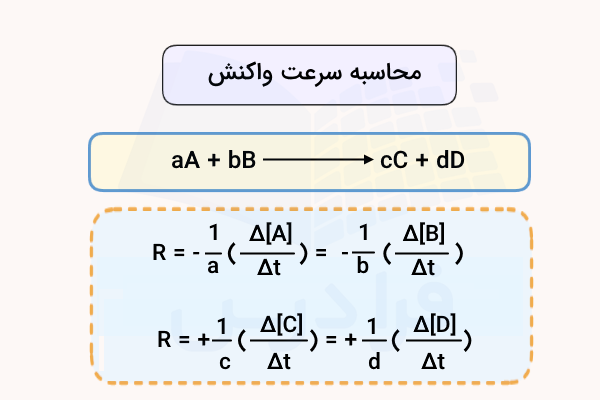
در این فرمول مقدار سرعت برای واکنشدهندههای A و B منفی است. زیرا این مواد طی واکنش مصرف شده و مقدار غلظت آنها کاهش مییابد. برای مثبت بودن مقدار سرعت واکنش به دست آمده از تغییرات غلظت این مواد، باید ضریب منفی داشته باشند.
سرعت متوسط واکنش
سرعت متوسط واکنش در یک مدت زمان مشخص با استفاده از غلظت واکنشدهندهها یا فرآوردههای واکنش محاسبه میشود. محاسبه سرعت متوسط واکنش با استفاده از تفریق غلظت یک ماده در ابتدای واکنش از غلظت همان ماده در انتهای واکنش به دست میآید.
برای به دست آوردن سرعت متوسط واکنش معمولا از نمودار غلظت – زمان یا نمودار مول – زمان استفاده میشود. نمودار غلظت زمان با استفاده از اندازهگیری غلظت مواد در زمانهای مشخص انجام واکنش رسم میشود. برای مثال، نمودار زیر، نمودار غلظت زمان واکنش ترکیب استیل سالیسیلیک اسید و آب برای تولید سالیسیلیک اسید و استیک اسید رسم شده است. به این واکنش، واکنش هیدرولیز آسپرین گفته میشود.
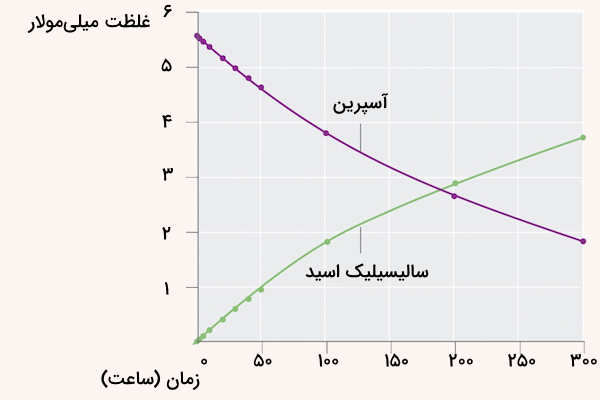
برای مثال، سرعت متوسط این واکنش در ۲ ساعت اول با کم کردن غلظت یکی مواد (سالیسیلیک اسید یا آسپرین) در زمان ۰ از زمان ۲، تقسیم بر ۲ ساعت به دست میآید. سرعت متوسط واکنش را میتوان با پایش تغییرات مول بر حسب زمان نیز به دست آورد.
نمودار مول – زمان
نمودار مول زمان، تغییرات تعداد مول مواد واکنشدهنده و فرآورده را بر حسب زمان نشان میدهد. این مقدار مول میتواند با استفاده از غلظت مولار به دست آمده یا با استفاده از جرم و جرم مولی مواد محاسبه شود. به دست آوردن سرعت واکنش با استفاده از نمودار مول – زمان برای واکنشدهندههایی که یک یا چند ماده شرکت کننده در واکنش در فاز جامد هستند مفید است.
نمودار مول – زمان و محاسبه سرعت با استفاده از آن در شکل زیر نمایش داده شده است.

عوامل موثر بر سرعت واکنش
سینتیک شیمیایی پیشبینی میکند که سرعت یک واکنش شیمیایی میتواند با عواملی که بر انرژی سینتیکی واکنشدهندهها اثر میگذارند، تغییر کند. به بیان دیگر، عواملی که میتوانند بر برخورد ذرات واکنشدهنده و انجام شدن واکنش اثر بگذارند، سرعت واکنش را تحت تاثیر قرار میدهند. این عوامل موثر بر سرعت واکنش به شرح زیر هستند.
- غلظت واکنشدهندهها: افزایش غلظت واکنشدهندهها باعث افزایش سرعت واکنش میشود.
- دما: افزایش دما تا حد مشخصی سرعت واکنش را افزایش میدهد.
- حضور کاتالیزگر: حضور کاتالیزگر سرعت واکنش را افزایش میدهد.
- حالت فیزیکی واکنشدهنده: هم فاز بودن واکنشدهندهها میتواند سرعت واکنش را افزایش دهد.
- فشار: در فاز گازی، افزایش فشار باعث افزایش سرعت واکنش میشود.
گروه عاملی
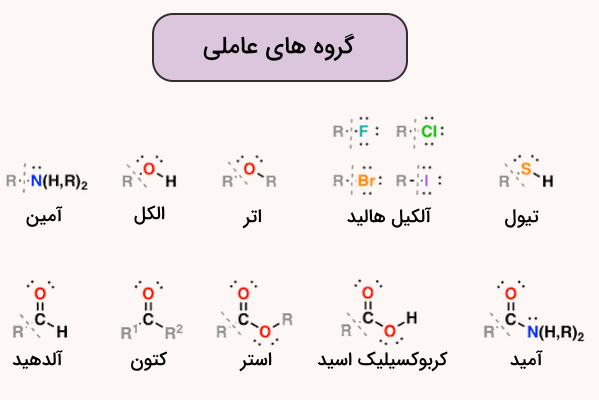
گروههای عاملی گروههای ویژهای از اتمها هستند که به مولکولهای آلی متصل شده و خواص ویژهای به آنها میبخشند. بررسی این گروهها و خواص آن ها یکی از بخشهای مهم در جمع بندی فصل دوم شیمی یازدهم است. این ویژگیها، صرف نظر از نوع مولکول آلی، برای هر گروه عاملی منحصر به فرد است. برای مثال، گروههایی با نام الکل، آلکن، آلکین، آمین، کربوکسیلیک اسید، آلدهید، کتون، استر، اتر، هیدروکسیل و … از انواع مختلف گروه عاملی هستند.
مهمترین گروههای عاملی به همراه نام و ساختار شیمیایی آنها در ادامه این مطلب از ممجله فرادرس معرفی شدهاند.
کربونیل
یکی از رایجترین اجزای تشکیل دهنده ترکیبات آلی، گروه کربونیل است. این گروه، از اتصال یک اتم کربن به یک اکسیژن با پیوند دوگانه تشکیل میشود. اما سایر اتمهای متصل به کربن با پیوند یگانه نیز نقشی مهم در تعیین کردن خواص مواد دارند. اگر یکی از این اتمها هیدروژن و دیگری کربن باشد، ترکیب مورد نظر یک آلدهید خواهد بود. اگر هر دو اتم متصل به کربن، کربن باشند، ترکیب مورد نظر کتون خواهد بود.
با وجود اینکه گروه کربونیل یکی از اجزای بسیاری از گروههای عاملی است، خود یک گروه عاملی محسوب نمیشود. در ادامه ترکیبات آلدهید و کتون را بررسی خواهیم کرد.
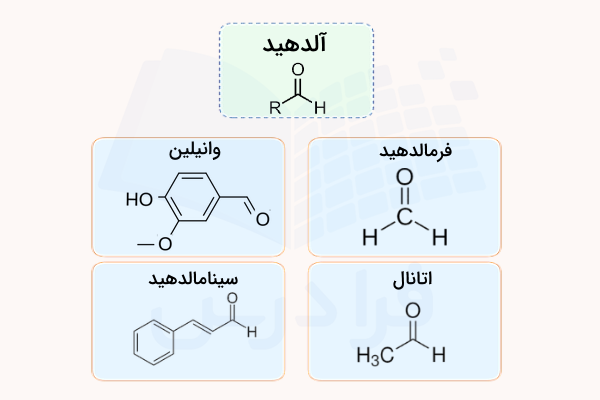
آلدهید
گروه عاملی آلدهید، گروهی است که از یک گروه کربونیل و یک اتم هیدروژن تشکیل شده است. به دلیل کوچک بودن اتم هیدروژن نسبت به سایر اجزای این گروه، بار مثبت جزئی روی کربن باعث میشود بسیار فعال بوده وبه راحتی به سایر ترکیبات متصل شود. بسیاری از ترکیبات آلدهید دارای بو و طعم خاص هستند. برای مثال، طعم دارچین به دلیل وجود ترکیب آلدهیدی سینامالدهید در این ماده است.
همچنین، وانیلین نیز یک ترکیب آلدهیدی موجود در عصاره وانیل است. یک نوع خاص آلدهید، ترکیبی است که در آن یک گروه کربونیل به دو اتم هیدروژن متصل شده و فرمالدهید نام دارد. از این ماده به عنوان نگهدارنده بافتها و ضدعفونی کننده استفاده میشود. ساختار آلدهیدهای مختلف را در تصویر زیر مشاهده میکنید.
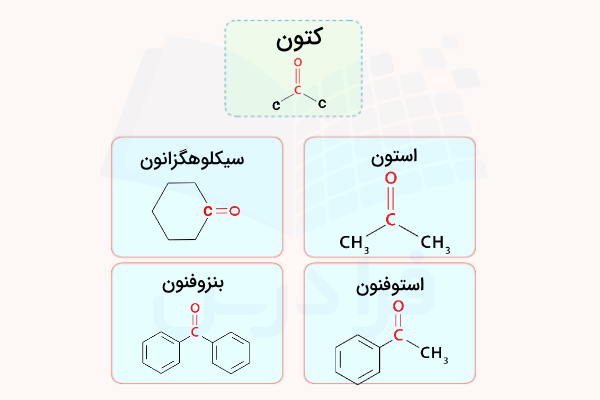
کتون
گروه عاملی کتون دارای یک گروه کربونیل است که کربن آن با دو پیوند یگانه به دو گروه آلی متصل شده است. کتونها در بسیاری از واکنشهای آلدهیدها شرکت میکنند اما کمتر از آنها واکنش پذیر هستند. ساده ترین ترکیب کتون، استون است که به یک گروه متیل متصل شده است. استون یکی از مهم ترین حلالها است و کاربردهای فراوانی دارد. متیل اتیل کتون نیز یکی دیگر از کتونهای پرکاربرد است که در بسیاری از واکنشها شرکت میکند. در تصویر زیر، چند مورد از کتونهای رایج نمایش داده شدهاند.
هیدروکسیل
هیدروکسیل نیز یکی دیگر از گروههای کلی است که در بسیاری از گروههای عاملی وجود دارد. گروه هیدروکسیل از اتصال یک اکسیژن و هیدروژن با پیوند یگانه تشکیل میشود. الکلها ترکیباتی هستند که دارای گروه هیدروکسید هستند. الکل خود یک گروه عاملی حساب میشود و بسیاری از ترکیبات مانند متانول و اتانول جزو این دسته از مواد هستند.
پیوند هیدروژن – اکسیژن گروه هیدروکسیل قطبی است و میتواند پیوند هیدروژنی تشکیل دهد. ترکیبات دارای گروه هیدروکسیل، مقدار حلالیت آب را افزایش میدهد. این ترکیبات اسیدهای ضعیفی هستند که میتوانند به عنوان باز لوییس نیز عمل کنند. از ترکیب این گروه با کتون، کربوکسیلیک اسیدها به دست میآیند.
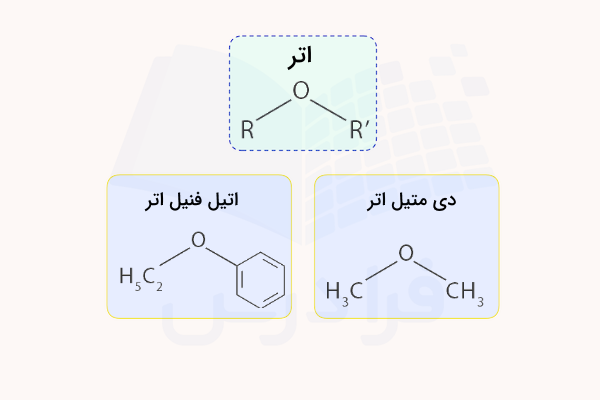
اتر
گروه عاملی اتر، از اتصال یک اتم اکسیژن به دو ترکیب آلی تشکیل میشود. در گروه عاملی اتر، اتم اکسیژن با دو پیوند یگانه به دو اتم کربن متصل میشود. از مثالهای ترکیبات اتری میتوان به دی اتیل اتر، تترا هیدروفوران و دی اکسان اشاره کرد که از حلالهای مهم آلی در آزمایشگاه شیمی هستند. اترها میتوانند به عنوان دهنده پیوند هیدروژنی عمل کنند و نقطه ذوب آنها پایینتر از الکلهایی با همان وزن مولکولی است. در تصویر زیر ساختار و مثالهایی از ترکیبات اتری ارائه شده است.
source
