گاز هلیوم، حالت طبیعی و پایدار موجود در طبیعت از عنصر هلیوم است. عنصر هلیوم، اولین عضو از خانواده گازهای نجیب در جدول تناوبی و دومین عنصر در جدول پس از هیدروژن است. عدد اتمی هلیوم-۲ و عدد جرمی آن ۴ است. بدین ترتیب این عنصر ۲ الکترون، ۲ نوترون و ۲ پروتون دارد. از گاز هلیوم در بسیاری از فرآیندهای صنعتی، پزشکی، تفریحی و … استفاده میشود. در این مطلب از مجله فرادرس میآموزیم گاز هلیوم چیست و چه کاربردهایی دارد.
آنچه در این مطلب میآموزید:
-
میآموزید گاز هلیوم و فرمول شیمیایی آن چیست.
-
با خواص فیزیکی و شیمیایی گاز هلیوم آشنا میشوید.
-
ساختار اتمی و شیمیایی هلیوم و حالتهای مختلف آن را درک میکنید.
-
با ایزوتوپهای اتم هلیوم و ویژگیهای آنها آشنا میشوید.
-
ترکیبات حاوی هلیوم را شناخته و با منابع آن آشنا میشوید.
-
کاربردها، خطرات و تاریخچه گار هلیوم را میشناسید.



در ابتدای این مطلب میآموزیم گاز هلیوم چیست و چه ویژگیهایی دارد. در ادامه، ساختار اتمی گاز هلیوم را بررسی کرده و ایزوتوپهای آن را میشناسیم. سپس با هلیوم مایع آشنا شده و ترکیبات هلیوم را بررسی میکنیم. پس از آن با منابع و تولید گاز هلیوم آشنا شده و کاربردهای آن را معرفی میکنیم. در نهایت با خطرات و تاریخچه گاز هلیوم آشنا میشویم. با مطالعه این مطلب تا انتها به شکلی کامل میآموزید گاز هلیوم چیست.
گاز هلیوم چیست؟
گاز هلیوم، به عنصر تک اتمی هلیوم اشاره دارد که یکی از عناصر گروه گازهای نجیب است. هلیوم، دومین عنصر فراوان موجود در جهان، پس از هیدروژن است. هلیوم گازی بدون رنگ، بدون بو و بدون مزه است. نقطه جوش آن بسیار پایین است و مولکولی تک اتمی است. اتم هلیوم بسیار کوچک و سبک است و کمترین واکنشپذیری و اکتیویته را بین تمامی عناصر دارد.
این بدین معنی است که گاز هلیوم با سایر عناصر واکنش نداده و یون تشکیل نمیدهد. به همین علت هیچ ماده معدنی یا آلی طبیعی شامل هلیوم در طبیعت وجود ندارد. این گاز اولین بار در مطالعاتی که در رابطه با خورشید انجام میشد کشف شد و نام آن با توجه به یک واژه یونانی مربوط به خورشید (Helios) انتخاب شده است. این عنصر دارای ۲ الکترون، ۲ پروتون و ۲ نوترون است. بدین ترتیب عدد اتمی هلیوم برابر ۲ و عدد جرمی هلیوم برابر ۴ است. ساختار اتم هلیوم در تصویر زیر نمایش داده شده است.
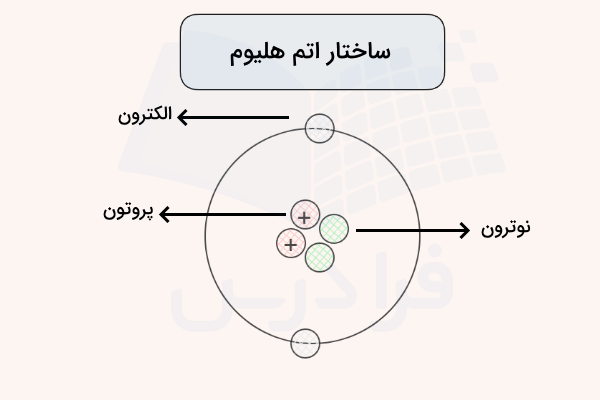
یادگیری شیمی دبیرستان با فرادرس
برای درک بهتر این موضوع که گاز هلیوم چیست، نیاز است ابتدا با مفاهیمی چون اجزای تشکیل دهنده هوا، استوکیومتری و گازها، عناصر و گروههای جدول تناوبی آشنا شویم. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه گاز هلیوم دسترسی داشته باشید.
فرمول گاز هلیوم
گاز هلیوم، یک گاز تک اتمی است که با فرمول شیمیایی He نمایش داده میشود. این ماده با عناصر و اتمهای دیگر واکنش و پیوند شیمیایی برقرار نمیکند. فرمول گاز هلیوم و سایر اطلاعات ساختاری آن، در تصویر زیر مشخص شده است.
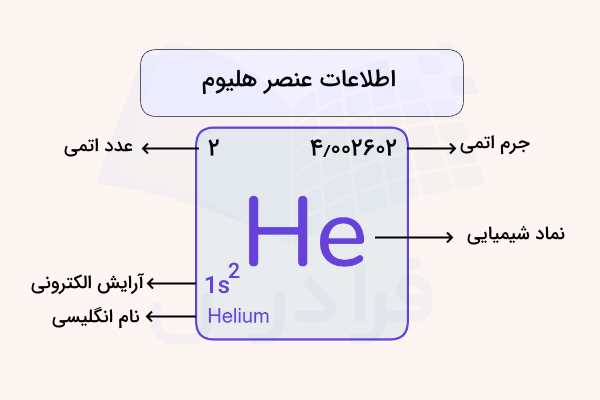
ویژگی گاز هلیوم چیست؟
هلیوم یکی از عناصر گاز نجیب است و بیاثرترین گاز موجود در جهان است. این اتم تنها دو الکترون، دو پروتون و دو نوترون دارد و به دلیل ساختار شیمیایی و آرایش الکترونی آن است که از پایداری و واکنشناپذیری بالایی برخوردار است. این گاز نیز مانند سایر عناصر موجود در جهان، ویژگیهای فیزیکی و شیمیایی منحصر به فردی دارد که در ادامه معرفی خواهد شد.
خواص فیزیکی هلیوم
خواص فیزیکی گاز هلیوم، خواصی است که بدون انجام دادن واکنش شیمیایی قابل اندازهگیری باشد. خواصی مانند بیرنگ و بدونبو بودن، نقطه ذوب و جوش پایین و …. از ویژگیهای فیزیکی این گاز است. در ادامه، میآموزیم خواص فیزیکی گاز هلیوم چیست.
- این گاز بدون رنگ، بدون بو و بدون مزه است.
- گاز هلیوم از هوا سبکتر است و چگالی بسیار کمی (۰٫۰۰۰۰۲ گرم بر سانتیمترمکعب) دارد.
- نقطه جوش گاز هلیوم-۴٫۲ کلوین است و یک گاز طبیعی است.
- این عنصر در دمای اتاق همواره به صورت گاز است.
- میزان رسانایی حرارتی این ماده، ۰٫۱۵ ژول بر مترثانیهکلوین است.
- دمای ذوب هلیوم-۲۷۲٫۲- درجه سانتیگراد است.
- دمای جوش هلیوم-۲۶۸٫۹۲۸- درجه سانتی گراد است.
- مقدار حلالیت این گاز در آب در دمای صفر درجه سانتیگراد ۰٫۹۷ میلیلیتر در ۱۰۰ میلیلیتر آب است.
- در دمای ۲۹ درجه سنتی گراد، ویسکوزیته هلیوم برابر با ۱٫۹۵۳ است.
خواص شیمیایی هلیوم
خواص شیمیایی گاز هلیوم مربوط به ساختار الکترونی و شیمیایی این گاز است و مهمترین آنها واکنشپذیر نبودن آن و مقدار بالای انرژی یونش آن است. در ادامه میآموزیم برخی از خواص شیمیایی گاز هلیوم چیست.
- این گاز تنها دو الکترون در زیرلایه s دارد و آرایش الکترونی آن به شکل و بسیار پایدار است.
- این عنصر ۷ ایزوتوپ دارد که ۲ مورد از آنها در ئایدار هستند.
- مقدار الکترونخواهی این عنصر برابر صفر است و بیاثرترین گاز و عنصر موجود است.
- مقدار یونیزاسیون اول گاز هلیوم برابر ۲۳۷۲٫۳ کیلوژول بر مول و یونش دوم آن ۵۲۵۰٫۳ کیلوژول بر مول است.
- جرم اتمی این عنصر برابر با ۴٫۰۰۳ و حجم اتمی آن ۲۷٫۲ سانتیمترمکعب بر مول است.
- شعاع اتمی این عنصر برابر با ۳۱ پیکومتر است.
- این اتم در حالت پایه بجز عدد اکسایش صفر، حالت اکسایش دیگری را نمیپذیرد.
حالت فیزیکی هلیوم
عنصر هلیوم به صورت طبیعی در فاز گازی یافت میشود. هلیوم پس از نئون، بیاثر ترین گاز نجیب است. مقدار جرم اتمی، رسانایی حرارتی و گرمای ویژه آن از هیدروژن بیشتر است. به دلیل اندازه کوچک اتم هلیوم، مقدار نفوذ و پخش شدن آن در جامدات ۳ برابر از هوا و ۶۵ درصد از هیدروژن بیشتر است. این گاز واکنشناپذیر است و به صورت تک اتمی در طبیعت وجود دارد و مقدار انحلال آن در آب کمتر از گازهای دیگر است.
این اتم در زمین بیشتر در حالت گاز و در فضای میان ستارهای بیشتر به صورت پلاسما وجود دارد. حالت مایع و جامد آن متشکل از دو ایزوتوپ هلیوم است که بسیار ناپایدار است و تنها در شرایط آزمایشگاهی قابل تولید است. در ادامه این موارد را بررسی خواهیم کرد.
پلاسما
هلیوم در جهان معمولا به صورت پلاسما نیز وجود دارد. پلاسما حالتی است که الکترونهای اتم به هسته آن پایبند نیستند و مقدار هدایت الکتریکی بسیار زیادی دارد و تحت اثر میدانهای الکتریکی و مغناطیسی به شدت تغییر میکند.
جامد و مایع
هلیوم تنها عنصری است که نمیتوان آن را با پایین آوردن دما در فشارهای معمولی به حالت جامد تبدیل کرد. دو ایزوتوپ هلیوم-۴ و هلیوم-۳ با افزایش ۳۰ درصدی فشار میتوانند کاهش حجم داشته باشند. مقدار ننقطهی ذوب هلیوم بسیار پایین است و تنها تحت فشار زیاد جامد میشود. دو فرم هلیوم مایع نیز با علامتهای و وجود دارد.
هلیوم در دمای صفر مطق به حالت مایع باقی میماند. اما در فشارهای بسیار بالا میتواند آن را به فاز جامد تبدیل کرد. هلیوم جامد دمایی بین ۱ تا ۱٫۵ کلوین ( از ۲۷۲- تا ۴۵۷- درجه سانتیگراد) نیاز دارد. همچنین فشاری ۲٫۵ مگاپاسکال برای جامد شدن هلیوم نیاز است. معمولا تشخیص هلیوم جامد از مایع بسیار سخت است زیرا ضریب شکست هر دو فاز تقریبا برابر است. هلیوم جامد ساختاری کریستالی و دمای ذوبی بالا دارد اما به شدت قابل متراکمسازی است.
ساختار اتمی هلیوم
در قسمتهای قبل آموختیم گاز هلیوم چیست. گاز هلیوم اولین گاز نجیب است که از دو نوترون و دو پروتون در هسته و دو الکترون در اولین لایه الکترونی اطراف هسته تشکیل شده است. ساختار اتمی گاز هلیوم در تصویر زیر مشخص شده است.
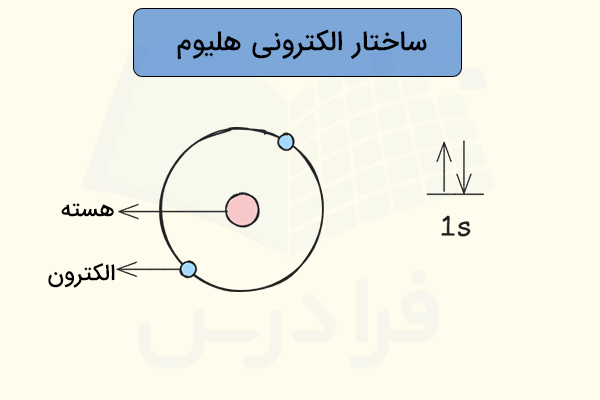
همانطور که مشاهده میکنید، دو الکترون اتم هلیوم، در اولین لایه الکترونی این اتم جای گرفتهاند. بدین ترتیب، فاصله این الکترونها تا هسته اتم بسیار ناچیز است و به همین دلیل، اثر جاذبه هسته اتم روی این الکترونها بسیار زیاد است. به همین دلیل، جدا کردن الکترون از این اتم تقریبا غیر ممکن خواهد بود.
همچنین، اوربیتال زیرلایه 1s در اتم هلیوم بهطور کامل با دو الکترون پر شده است. با وجود اینکه سایر گازهای نجیب آرایش الکترونی ۸ تایی دارند و هلیوم با وجود ۲ الکترون نمیتواند به آرایش الکترونی هشتایی برسد، اما از پایداری بسیار بالایی برخوردار است.
ایزوتوپهای هلیوم
هلیوم بین ۸ تا ۹ ایزوتوپ شناخته شده دارد اما تنها ۲ مورد از آنها پایدار هستند. هلیوم-۳ و هلیوم-۴ فرمهای پایدار ایزوتوپهای هلیوم هستند. مقدار فراوانی ایزوتوپ هلیوم-۳ بسیار کمتر از هلیوم-۴ است. این ایزوتوپ در مقادیر بسیار کمی در فرآیند واپاشی بتای اتم تریتیوم به وجود میآید. مواد فراسیارهای نیز مقداری کمی هلیوم-۳ دارند. هلیوم-۴ در فرآیند واپاشی آلفای مواد رادیواکتیو سنگینتر در زمین تولید میشوند. این ایزوتوپ پایدارتر است زیرا نوکلئونهای آن در لایههای آرایشی کامل دارند.
۸ ایزوتوپ هلیوم از هلیوم-۳ تا ایزوتوپ هلیوم-۱۰ هستند. بجز دو مورد اشاره شده تمامی ایزوتوپهای اتم هلیوم ناپایدار و پرتوزا هستند. پیشنهاد میکنیم برای آشنایی بیشتر با این ایزوتوپها مطلب رادیو ایزوتوپ مجله فرادرس را مطالعه کنید.
هلیوم مایع
هلیوم مایع زمانی تشکیل میشود که دما کمتر از ۴٫۳۳ کلوین باشد. این مایع مقدار ویسکوزیته بسیار کمی دارد و چگالی آن یک هشتم آب است. هر دو هلیوم-I و ۲ سیالات کوانتومی هستند که خواص اتمی را در مقیاس ماکروسکوپیک نشان میدهند زیرا نقطه جوش هلیوم بسیار نزدیک به صفر مطلق است. در دمای ۲٫۲۷۴ کلوین، هلیوم-I به هلیوم-II تبدیل میشود. خواص هلیوم-II بسیار خاص است و به عنوان یک ابرشاره شناخته میشود. ابرشاره، یک حالت مکانیک کوانتومی ماده است.
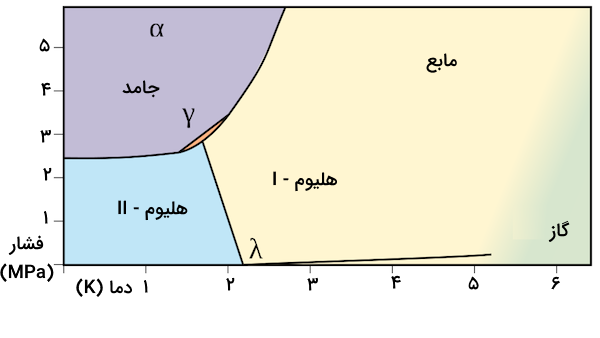
هلیوم-II هدایت گرمایی ۳۰۰ برابر بیشتر از نقره و چندصد برابر بیشتراز مس دارد. هدایت و ویسکوزیته هلیوم-II از قوانین فیزیک کلاسیک تبعیت نمیکند. با کاهش دما، حجم هلیوم-II افزایش مییابد. این مایع نمیجوشد و مستقیما به گاز تبدیل میشود. همچنین، این مایع یک اثر خزش را از خود نشان میدهد و میتواند بر خلاف جاذبه روی سطح بخزد. در صورت باز بودن درب ظرف هلیوم-II، از دیوارههای ظرف بالا میخزد تا دمایی بالاتر را پیدا کرده و تبخیر شود. همچنین، این مایع اثر آبشاری را نیز از خود نشان میدهد و مانند یک فواره به شکل مداوم میتواند جریان پیدا کند.

ترکیب مخلوط هلیوم-۳ و هلیوم-۴ در دماهای پایینتر از ۰٫۸ کلوین، به دو لایه مجزا تقسیم میشود. یکی از لایهها از هلیوم-۳ خالص تشکیل شده و لایه دیگر از هلیوم-۳ و مقداری هلیوم-۴ تشکیل شده است. حتی در دماهای بسیار پایین نیز مقداری هلیوم-۴ داخل این لایه وجود خواهد داشت. پیشنهاد میکنیم برای آشنایی بیشتر با خواص هلیوم مایع و مواد مشابه آن، فیلم آموزش مکانیک کوانتومی ۱ فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
ترکیبات هلیوم
هلیوم تنها دو الکترون در اولین لایه الکترونی خود دارد به همین دلیل در شرایط عادی، از نظر شیمیایی غیرفعال است و ترکیبی تشکیل نمیدهد. این ماده در شرایط عادی یک عایق الکتریسیته است مگر اینکه دچار یونش شود. گاز هلیوم مانند سایر گازهای نجیب، سطوح انرژی فوق پایداری دارد که به آن اجازه میدهد در یک تخلیه التریکی با ولتاژ پایینتر از پتانسیل یونیزاسیون خود، یونیزه باقی بماند.
هلیوم میتواند بدین ترتیب، ترکیبات ناپایدار را تشکیل دهد که به آنها برانگیختهپار یا «اکسمر» (Excimer) گفته میشود. این ترکیبات با اتمهایی مانند تنگستن، ید، فلوئور، گوگرد و فسفر تشکیل میشود. این ترکیبات تنها در شرایطی مانند تخلیه تابشی، بمباران الکترونی یا پلاسمای کاهش یافته انجام میشود.
ترکیبات مولکولی مانند هلیوم نئون ()، جیوه دکاهلیوم () و تنگستن دیهلیوم () و ترکیبات یونی مانند ، ، و به این روش تولید شدهاند. یون در حالت پایه خود پایدار اما به شدت واکنشپذیر است. به صورتی که این یون قویترین اسید برونستد- لوری شناخته شده تا به امروز است. به همین دلیل این یونها را به صورت تکی و واکنش نداده، تنها در شرایط ایزوله میتوان مطالعه کرد.
روش ذکر شده برای تولید ترکیب دی هلیوم با فرمول شیمیایی نیز استفاده شده است. این ترکیب باند طیفی بسیار بزرگی دارد. همچنین، ترکیب جیوه هلیوم نیز ترکیبی است که تنها با استفاده از نیروهای قطبی میتوان اتمهای آن را در کنار هم نگه داشت. ترکیبات واندروالسی هلیوم را نیز میتوان با استفاده از هلیوم کریوژنیک و اتمهای برخی دیگر از مواد تولید کرد. برای مثال، لیتیوم هلیوم و دی هلیوم از این موارد هستند.
منابع هلیوم
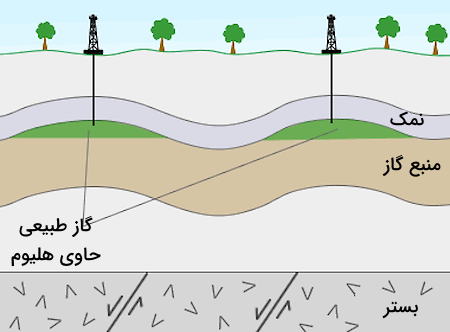
در قسمتهای قبل آموختیم گاز هلیوم چیست و ترکیبات آن کدامند. هلیوم، یکی از گازهایی است که به صورت طبیعی در جهان وجود دارد. این عنصر دومین عنصر فراوان جهان است. مقادیر بسیار زیادی از این عنصر در فرآیندهای شکافت تولید کننده انرژی در ستارگان تولید میشود. خورشید و سیاره مشتری، غنیترین منابع گاز هلیوم هستند. تنها ۰٫۰۰۰۴ درصد اتمسفر زمین از هلیوم تشکیل شده است. به همین دلیل در گذشته، از عنصر هلیوم در مصارف بسیار کمی استفاده میشد.
این بدین معنی است که به ازای هر دویست هزار مولکول هوا، تنها یک مولکول هلیوم وجود دارد. اما امروزه با کشف شدن معادن غنی از هلیوم در تگزاس، روسیه، لهستان، الجزیره، چین و کانادا، هلیوم را به عنصر در دسترستری تبدیل کرده است. هلیوم را از مایع سازی هوا نیز میتوان به دست آورد اما مقدار حجم هلیوم به دست آمده از این روش به صرفه نیست. از هر ۹۰۰ تن مکعب هوا حدود ۳٫۱۷ مترمکعب هلیوم به دست میآید.
خطر اتمام ذخایر هلیوم
هلیوم مایع را میتوان پس از تبخیر به دام انداخته و تصفیه کرد و دوباره به مصرف رساند یا به مایع تبدیل کرد. اما زیرساختهای لازم برای بازیافت هلیوم بسیار کم هستند و با آزاد شدن هلیوم در اتمسفر و به دام نیافتادن آن، به سمت بالا حرکت کرده و در نهایت، در فضا گم میشود. به همین علت، گاز هلیوم یکی از عناصر غیر قابل بازیافت است.
منابع گاز طبیعی حاوی هلیوم در سراسر جهان محدود بوده و رو به پایان هستند. به همین دلیل، قیمت گاز هلیوم در سالهای اخیر در سراسر دنیا افزایشی قابل توجه داشته است.
اقدامات برای حفاظت از ذخایر هلیوم
در قسمتهای قبل آموختیم که منابع گاز هلیوم رو به پایان هستند و با توجه به کاربردهای پزشکی و حیاتی این گاز در بسیاری از موارد، نیاز است تا میزان مصرف آن کاهش یابد و زمینههای بازیافت هلیوم فراهم شود. همچنین نیاز است در کاربردها و مواقعی که خطر آتشگرفتن وجود ندارد، گاز هلیوم با گاز هیدروژن جایگزین شود.
همچنین کاهش مصارف غیر ضروری از گاز هلیوم مانند کاربردهای تفریحی در سراسر دنیا میتواند به کاهش سرعت مصرف این گاز کمیاب کمک کند.
تولید هلیوم
گاز هلیوم از مواد معدنی و به وسیله واپاشی پرتوزا تولید میشود. این گاز از پسماندهای گاز طبیعی که معمولا شامل ۱۰ درصد هلیوم هستند استخراج میشود. این منابع گاز طبیعی، تنها منبع برای تولید و استخراج صنعتی گاز هلیوم هستند. کل منابع موجود گاز هلیوم در جهان حدودا ۲۵٫۲ میلیارد مترمکعب است.
در فرآیند استخراج و تولید گاز هلیوم، گاز طبیعی استخراج شده ابتدا به وسیله فرآیندهای شیمیایی خالصسازی میشود. در این خالصسازی از شویندههای قلیایی برای جدا کردن کربن دی اکسید و هیدروژن سولفید استفاده میشود. سپس گاز باقیمانده تا دمای ۲۰۰- درجه سانتی گراد سرد میشود و تمامی مواد موجود در گاز بجز هلیوم مایع شده و جداسازی میشوند.
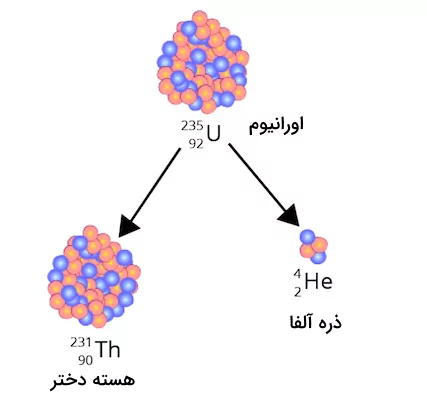
دلیل اینکه این گازهای طبیعی شامل گاز هلیوم هستند این است که این گازها احتمالا حاصل از فرآیند واپاشی اورانیوم و توریم در سنگهای گرانیتی زیر زمین تشکیل شدهاند.
کاربردهای گاز هلیوم چیست؟
در قسمتهای قبل آموختیم گاز هلیوم چیست و چه خواص و ویژگیهایی دارد. در کاربردهای گاز هلیوم احتمالا اولین چیزی که به ذهن خطور میکند، استفاده از آن در بادکنکهای هلیومی تزئینی است. با این حال، گاز هلیوم در بسیاری از صنایع مانند غواصی و پزشکی استفادههای بسیاری دارد. خواص ویژه این گاز مانند نقطه جوش پایین، چگالی پایین، حلالیت کم، هدایت گرمایی بالا و بیاثر بودن را میتوان در مصارف بسیاری استفاده کرد. یکی از مهمترین کاربردهای این گاز، استفاده به عنوان فوقسردکننده در دستگاههای MRI و NMR است. در ادامه برخی از مهمترین کاربردهای گاز هلیوم را معرفی میکنیم.
صنعت
۲۰ درصد هلیوم تولید شده به صورت سالانه، برای فرآیندهای جوشکاری و در صنعت استفاده میشود. هلیوم از قسمتهای حرارت دیده فلزاتی مانند آلومینیوم و تیتانیوم در برابر هوا محافظت میکند. گاز هلیوم در دماهای بسیار پایین (حتی دمایی که در آن هیدروژن نیز به مایع تبدیل میشود) به صورت گاز باقی میماند. به همین علت، از این گاز به عنوان پیشران برای هدایت هیدروژن مایع به موتور موشکها استفاده میشود. به دلیل بیاثر بودن این گاز، از آن به عنوان سرد کننده نیروگاههای هسته ای نیز استفاده میشود.
از گاز هلیوم در فرآیندهای تولید ژرمانیوم و کریستال سیلیکون کاربرد دارد. همچنین از این گاز به عنوان گاز حامل در دستگاههای HPLC استفاده میشود.
کنترل شرایط آزمایش
یکی از کاربردهای مهم گاز هلیوم، استفاده از آن برای پایدار کردن شرایط آزمایش در مواردی مانند رشد کریستالهای ژرمانیوم و سیلیسیم در تولید ژرمانیوم و تیتانیوم و در کروماتوگرافی گازی است. این گاز به دلایل بیاثر بودن، طبیعت ترمودینامیکی خوب آن، سرعت صدای بالا در آن و ظرفیت گرمایی بالا در تونلهای باد فراصوت و تسهیلات ضربهای استفاده میشود.
غواصی
ترکیب هلیوم و اکسیژن، در مخازن استفاده شده برای تنفس زیر آب (غواصی) استفاده میشود. به دلیل چگالی پایین این گاز، هلیوم به جاری شدن راحتتر اکسیژن به ششها کمک میکند.
تفریحی
به دلیل سبکتر بودن گاز هلیوم از هوا و بیخطر بودن آن نسبت به گازهایی مانند اکسیژن، از آن به عنوان گاز پرکننده بالنها برای مصارف سرگرمی و تفریحی استفاده میشود. در ادامه کاربردهای تفریحی این گاز را توضیح میدهیم.
بادکنک هلیومی
یکی از رایجترین و معروفترین ویژگیهای گاز هلیوم، سبکتر بودن آن نسبت به هوا است. به همین علت، یکی از کاربردهای رایج و روزمره آن، پر کردن بادکنک با گاز هلیوم است. بادکنکهای هلیومی که در سرتاسر جهان استفاده میشود، یکی از مصارف تفریحی این گاز است. همچنین از این گاز برای پر کردن بالنها و استفاده در ورزشگاهها و استادیومها و مراکز تفریحی نیز کاربرد دارد.
هلیوم تقریبا ۹۲ درصد از قدرت بلند کردن اجسام توسط گاز هیدروژن را دارد. با این وجود این گاز نسبت به گاز هیدروژن انتخاب مطمئنتر و کمخطرتری است. به دلیل بیاثر بودن و واکنشپذیر نبودن این گاز، خطر انفجار و آتش گرفتن برای آن وجود ندارد.
تغییر صدا
یکی دیگر از کاربردهای روزمره گاز هلیوم، استفاده از آن برای تغییر صدا است. افراد با تنفس گاز هلیوم درون بادکنکها، میتوانند تا چند ثانیه با صدای تغییر داده شده صحبت کنند. این پدیده به علت سرعت صدا در گاز هلیوم است. سرعت صدا در گاز هلیوم تقریبا ۳ برابر سرعت امواج صدا در هوا است. به همین علت، با تنفس گاز هلیوم، مقدار فرکانس رزونانسی گستره صدای انسان افزایش مییابد. به همین دلیل، صدای تولید شده توسط تارهای صوتی، با فرکانس بالاتر (صدای زیر (نازک)) شنیده میشود. در مقابل، تنفس گازهایی مانند گوگرد یا زنون باعث بمتر شدن صدا میشود.
با این وجود، تکرار این عمل میتواند خطرناک باشد. تنفس هلیوم میتواند باعث از بین رفتن هوشیاری و آمبولی گاز شریانی مغزی شود که میتواند در صورت اتفاق افتادن مداوم، به کوری کامل یا حتی مرگ (در مدت طولانی و مقادیر خیلی زیاد) بیانجامد. این پدیده زمانی اتفاق میافتد که رگهای خونی درون شش پاره شده و اجازه میدهند که گاز به عروق ریوی و پس از آن، مغز، دسترسی پیدا کند.
پزشکی
گاز هلیوم یکی از پرکاربردترین گازهای موجود در فرآیندهای مختلف و در صنایع متفاوت است. هلیوم مایع، خواص کریوژنیک (مایع فوق سرد) را دارد و برای فریز کردن مواد بیولوژیکی و زیستی برای مدت زمان طولانی استفاده میشود. همچنین از هلیوم برای خنک نگه داشتن مگنتهای ابررسانای دستگاههای MRI نیز استفاده میشود.
از خواص کریوژنیک هلیوم در دستگاههای دیگری مانند NMR و برخورد دهنده هاردونی بزرگ (Large Hadron Collider) نیز استفاده میشود. هلیوم در پمپ قلبی ریوی در طول جراحی قلب استفاده میشود. از لیزرهای هلیوم – نئون در عملهای بینایی و چشم استفاده میشود. از گاز هلیوم در مواد کمک کننده به تنفس در مواردی مانند آسم و آمفیزم کمک میکند.
سایر کاربردها
در قسمتهای قبل آموختیم کاربردهای گاز هلیوم چیست. در ادامه برخی دیگر از کاربردهای رایج این گاز را معرفی میکنیم.
- از گاز هلیوم برای سالم نگه داشتن اسناد نادر و مهم نیز استفاده میشود.
- از گاز هلیوم برای شناسایی برخی از نشتیها استفاده میشود زیرا خود هلیوم با سایر گازها واکنش نمیدهد.
- از گاز هلیوم میتوان در کیسه هوای ماشینها استفاده کرد زیرا با سرعت بسیار بیشتری از بسیاری از گازها پخش میشود.
- در بسیاری از دستگاههای بارکدخوان از لیزر هلیوم نئون استفاده شده است.
- از قابلیت سبک بودن و حملکنندگی گاز هلیوم در بالنها، کشتیهای هوایی، بالنهای هواشناسی و … استفاده میشود.

خطرات گاز هلیوم چیست؟
در قسمت قبل آموختیم کاربردهای گاز هلیوم چیست. هلیوم طبیعی در شرایط عادی غیرسمی است و هیچ نقش زیستی در بدن ندارد و به مقادیر ناچیزی در بدن انسان یافت میشود. اما تنفس هلیوم به مقادیر زیاد میتواند برای بدن بسیار خطرناک باشد. زیرا این گاز یکی از گازهای خفه کننده است که میتواند جایگزین اکسیژن خون شده و غلظت اکسیژن خون را کاهش دهد. تنفس گاز داخل سیلندرهای هلیوم یا حتی محتوای گاز بادکنکهای هلیومی میتواند بسیار خطرناک بوده و حتی باعث مرگ شود.
همچنین، هلیوم مایع که یک مایع کریوژنیک (فوق سرد) است که میتواند خطرات بسیاری داشته باشد. این مواد به دلیل دمای بسیار پایین میتوانند باعث از بین رفتن بافت پوست و سختگی، سوختن مجرای گوارشی، انفجار در صورت نبودن شیر کاهش فشار و خفگی شود.
یادگیری شیمی عمومی با فرادرس
برای درک بهتر این موضوع که گاز هلیوم چیست، ابتدا باید با مفاهیمی چون ایزوتوپ، انواع طیفسنجی، انرژی یونش، انواع پیوند و قوانین گازها آشنا شویم. پیشنهاد میکنیم برای یادگیری و شناخت بهتر این مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه گاز هلیوم دسترسی داشته باشید.
تاریخچه گاز هلیوم
در این مطلب از مجله فرادرس آموختیم گاز هلیوم چیست. گاز هلیوم ابتدا در سال ۱۸۶۸ توسط ستارهشناس فرانسوی به نام «جنسن» (Jenssen) کشف شد. او گاز هلیوم را در مطالعه کروموسفر خورشید طی یک خورشیدگرفتی کشف کرد. او برای تبدیل نور تابیده شده به طیف، از یک طیفسنج استفاده کرد که در آن هر رنگ، نشاندهنده یک گاز بود. او متوجه وجود نوری زردرنگ شد که باید مربوط به عنصری میبود که قبلا کشف و مشاهده نشده بود.
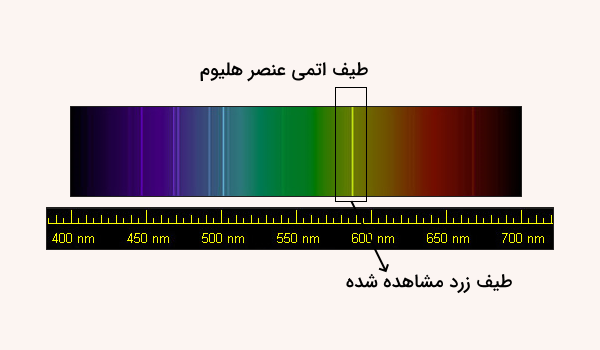
در سال ۱۸۹۵ وجود گاز هلیوم در زمین، توسط «ویلیام رمزی» (William Ramsay) اثبات شد. او با حرارت دادن یک سنگ معدنی به نام کلویت، استخراج و آزاد شدن یک گاز نجیب را مشاهده کرد. این هلیوم مشاهده شده در آزمایش رمزی در واقع فرآورده جانبی عناصر پرتوزا است. در نهایت دانشمندانی به نام «نورمن لاکر» (Norman Lockyer) و «ادوارد رانکلد» (Edward Frankland)، هلیوم را به عنوان یک عنصر ثبت کردن و نام آن را (Helios) گذاشتند.
source
