اسید تک پروتون دار اسیدی است که تنها یک پروتون یا یون هیدروژن () را به ازای هر مولکول اسید، در محلول آبی آزاد میکند. در مقابل اسید تک پروتون دار اسیدهای چند پروتونه قرار دارند که در محلول بیش از یک یون هیدروژن () (پروتون) آزاد میکنند. اسیدهای چند پرونه به ترتیب با توجه به مقدار یونهای هیدروژنی که میتوانند آزاد کنند به چند دسته دو پروتونه، سه پروتونه و … دستهبندی میشوند. تعداد یونهای آزاد شده توسط اسید با عنوان ظرفیت اسید نیز شناخته میشود. در این مطلب از مجله فرادرس میآموزیم اسید تک پروتون دار چیست و چه ویژگیهایی دارد.
آنچه در این مطلب میآموزید:
-
میآموزید اسید تک پروتون دار چیست و چرا این نام را دارد.
-
با انواع و مثالهای اسید تک پروتون دار آشنا میشوید.
-
میتوانید معادله تفکیک اسید تک پروتون دار را در آب بنویسید.
-
با روش محاسبه ثابت تفکیک اسید و درجه یونش این اسیدها آشنا میشوید.
-
میتوانید غلظت و منحنی تیتراسیون اسید تک پروتون دار را تشخیص دهید.
-
با کاربرد این اسیدها و تفاوت آنها با باز تک پروتون دار آشنا میشوید.



در ابتدای این مطلب میآموزیم اسید تک پروتون دار چیست و چه تفاوتی با اسید چندپروتونه دارد. سپس معادله تفکیک این اسیدها و ثابت یونش و قدرت آنها را بررسی میکنیم. در ادامه انواع اسیدهای تک پروتون دار را شناخته و با pH این اسیدها آشنا میشویم. پس از آن، تیتراسیون و منحنی تیتراسیون این اسیدها را بررسی کرده و کاربرد آنها را میآموزیم. در نهایت، با باز تک پروتون دار آشنا شده و میآموزیم تفاوت آن با اسید تک پروتون دار چیست. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید اسید تک پروتون دار چیست.
اسید تک پروتون دار چیست؟
اسید تک پروتون دار (تک پروتونه)، با عنوان اسید مونوپروتیک (Monoprotic Acid)، اسید تک ظرفیتی و اسید تکبازی نیز شناخته میشود. این اسید در محلولهای آبی تنها یک یون هیدروژن () را آزاد میکند. برای مثال، اسیدهایی مانند اسید کلریدریک و اسید استیک از نوع اسید تک پروتون دار هستند.
معادله تفکیک اسید تک پروتون دار مشابه زیر است.
هر اسیدی که تنها یک هیدروژن در ساختار شیمیایی خود داشته باشد، اسید تک پروتون دار است. همچنین، برخی از اسیدها با بیش از یک اتم هیدروژن نیز میتوانند اسید تک پروتون دار باشند. استیک اسید یکی از مثالهای این نوع اسیدهای تک پروتون دار است. تنها وجود هیدروژن در ساختار مولکول نمیتواند نشان دهنده تعداد پوتون یا ظرفیت اسید باشد. بلکه این اتمهای هیدروژن باید بتوانند در محلول آبی به صورت یون هیدروژن () آزاد شوند.
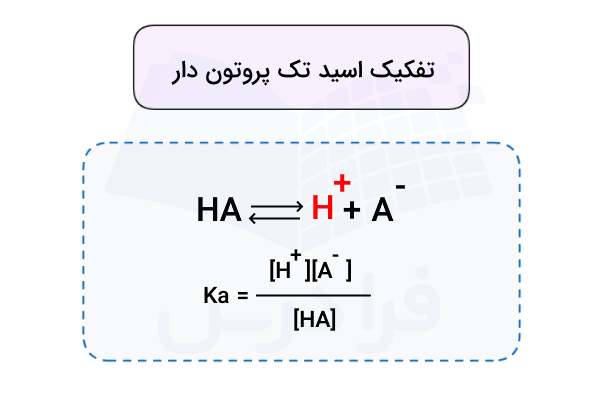
تک پروتون دار به چه مفهوم است؟
کلمه پروتون در عبارت تک پروتون دار، اشاره به یون هیدروژن () یک بار مثبت دارد که با نام پروتون نیز شناخته میشود. این نامگذاری بدین دلیل است که اتم هیدروژن تنها از یک پروتون و یک الکترون تشکیل شده است و با از دست دادن یک الکترون آن، تنها پروتون باقی میماند. یون هیدروژن () عامل تعیین کننده خاصیت اسیدی، قدرت اسید و واکنشهایی است ک اسیدها میتوانند در آن شرکت کنند.
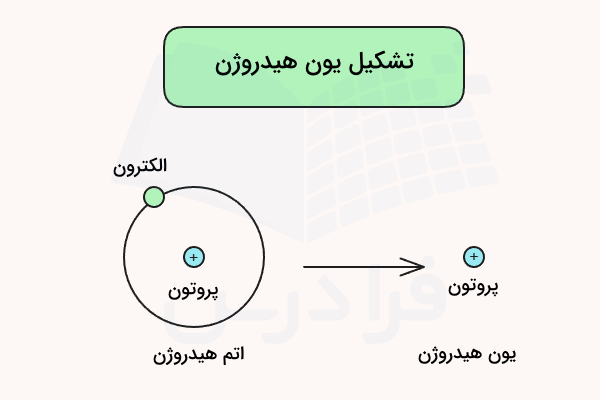
اسیدهای تک پروتون دار تنها یک هیدروژن در ساختار خود دارند که میتواند در محلولهای آبی از ساختار اسید جدا شده و در محلول آزاد شود. طبق نظریهی برونستد – لوری، اسیدها دهندهی پروتون و بازها گیرندهی پروتون هستند. بنابراین، اسید تک پروتون دار اسیدی است که میتواند به عنوان دهندهی پروتون شناخته شود.
یادگیری شیمی دوازدهم با فرادرس
برای درک بهتر این موضوع که اسید تک پروتون دار چیست، ابتدا باید با مفاهیمی چون نظریه آرنیوس، تعریف اسید و باز، نظریه برونستد لوری و اسید لوییس آشنا شویم. همچنین، شناخت روش تشخیص اسید و باز و واکنش تعادلی نیز به ما در درک این مفهموم کمک میکند. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجوعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به شکل کاملتری بیاموزید اسید تک پروتون دار چیست.
مثال اسید تک پروتون دار
اسیدهای تک پروتون دار گسترده وسیعی از اسیدها را با قدرتهای مختلف از اسید قوی تا اسید ضعیف شامل میشوند. رایجترین مثالهای اسید تک پروتون دار اسیدهای معدنی مانند هیدروکلریک اسید و اسید نیتریک هستند. اسیدهای آلی تک پروتون دار مواردی هستند که تنها یک گروه کربوکسیلیک اسید در ساختار خود دارند و گاهی با عنوان مونوکربوکسیلیک اسید شناخته میشوند. برخی از مثالهای اسیدهای آلی تک پروتون دار مواردی مانند فرمیک اسید، استیک اسید و بنزوییک اسید هستند.
در جدول زیر، تعدادی از اسیدهای تک پروتون دار و باز مزدوج آنها معرفی شده است.
| اسید تک پروتون دار | باز مزدوج |
| اسید کلریدریک: | |
| اسید نیتریک: | |
| اسید هیدروفلوریک: | |
| اسید هیدروبرمیک: | |
| اسید استیک: | |
| پرکلریک اسید: | |
| کلریک اسید: | |
| نیتروس اسید: |
تفاوت اسید تک پروتون دار و اسید چند پروتون دار
تفاوت اصلی بین اسیدهای تک پروتون دار و چند پروتون دار در تعداد پروتون هایی است که هنگام یونش آزاد میکنند. اسیدهای تک پروتون دار تنها یک پروتون از دست میدهند و در نتیجه فقط یک واکنش یونش و یک مقدار ثابت تعادل اسیدی دارند.
در مقابل، اسیدهای چند پروتون دار میتوانند دو یا چند پروتون آزاد کنند و در نتیجه چند مرحله یونش پیاپی دارند که هر مرحله دارای ثابت تعادل جداگانه است. این تفاوت باعث میشود که رفتار شیمیایی و قدرت اسیدی آنها متفاوت باشد. به طوری که در اسیدهای چند پروتون دار، هر مرحله یونش نسبت به مرحله قبل ضعیفتر است و در تحلیلهای شیمیایی مانند تیتراسیون باید هر مرحله به طور جداگانه مورد بررسی قرار گیرد.
معادله تفکیک اسید تک پروتون دار
تمامی اسیدهای تک پروتون دار حداقل یک هیدروژن در ساختار شیمیایی خود دارند. به همین دلیل فرمول شیمیایی عمومی آنها به شکل HA نوشته میشود. این اسیدها در آب یون هیدروژن () را آزاد کرده و به یون محلول تبدیل میشوند. بنابراین معادله تفکیک اسید تک پروتون دار به شکل زیر است.
در محلولهای آبی، یون هیدروژن () پایدار نیست و با اتصال به یک مولکول آب، به یون هیدرونیوم () تبدیل میشود.
بدین ترتیب معادله تفکیک این اسیدها معمولا به شکل زیر نمایش داده میشود.
معادله تفکیک برخی از اسیدهای تک پروتون دار در ادامه نمایش داده شده است.
- معادله تفکیک اسید کلریدریک
- معادله تفکیک اسید نیتریک
- معادله تفکیک استیک اسید
- معادله تفکیک هیدروفلوئوریک اسید
- معادله تفکیک هیدروبرمیک اسید
مثال معادله تفکیک اسید تک پروتونه
برای نوشتن معادله تفکیک اسید پروتون دار کافی است یکی از فرآوردههای واکنش را یون هیدروژن () یا هیدرونیوم () در نظر گرفته و یون باقیمانده پس از جداسازی یون هیدوژن را به عنوان باز مزدوج و فرآورده دوم بنویسیم. برای درک بهتر این روش، به مثالهای زیر دقت کنید.
مثال ۱
معادله واکنش تفکیک سیانیک اسید با فرمول شیمیایی HCNO را بنویسید.
پاسخ
یون هیدروژن () را از ساختار شیمیایی ماده جدا کرده و آنیون باقی مانده را نیز به عنوان باز مزدوج مینویسیم.
مثال ۲
معادله واکنش تفکیک تری فلوئورواتانول با فرمول شیمیایی را بنویسید.
پاسخ
یون هیدروژن را از ساختار شیمیایی ماده جدا کرده و آنیون باقی مانده را نیز به عنوان باز مزدوج مینویسیم.
ثابت تفکیک اسید تک پروتون دار
ثابت تفکیک اسید، که با Ka نشان داده میشود، و ثابت یونش باز، که با Kb نشان داده میشود، ثابتهای تعادلی برای یونش اسیدها و بازهای ضعیف هستند. هر چه مقدار Ka یا Kb بزرگتر باشد، به ترتیب نشاندهنده اسید یا باز قویتری است که یونش کاملتری دارد.
بنابر معادله تفکیک اسید در آب، کمیتی به نام ثابت تفکیک اسید برای اسیدها و ثابت تفکیک باز برای بازها، مقدار تفکیک و قدرت این مواد را تعیین میکند. برای یک اسید تک پروتون دار با معادله تفکیک زیر، ثابت تفکیک اسید به شکل زیر محاسبه میشود.
برای مثال، ثابت یونش تفکیک اسید کلریدریک در آب به شکل زیر نوشته میشود.
پیشنهاد میکنیم برای درک بهتر این کمیت و کاربرد آن در تعیین قدرت اسید، مطلب فرق ثابت تعادل و ثابت یونش مجله فرادرس را مطالعه کنید.
درجه یونش و درصد یونش
همچنین، کمیت دیگری برای تعیین قدرت اسید وجود دارد که با نام درجه یونش شناخته میشود. این کمیت، نسبت غلظت یونهای تفکیک شده را نسبت به مقدار غلظت اولیه اسید تعیین میکند و با استفاده از رابطه زیر به دست میآید.
در این رابطه، c مقدار غلظت اولیه اسید را تعیین میکند. این عبارت میتواند بر حسب درصد نیز بیان شود و در آن صورت به آن درصد یونش نیز گفته میشود.
رابطه ثابت تفکیک اسید و درجه یونش
درجه یونش تعیین میکند که هر ماده در واکنش تفکیک تا چه اندازه تفکیک میشود. بنابراین اگر مقدار غلظت اولیه اسید برابر با C در نظر گرفته شود، مقادیر نهایی تعادلی تفکیک شده مواد به شکل زیر خواهد بود.
| مقدار اولیه | غلظت تعادلی (پس از تفکیک) |
| واکنشدهنده: C | واکنشدهنده: |
| فرآورده: x | فرآورده: |
بنابراین برای واکنش تعادلی تفکیک اسید تک پروتون دار زیر، میتوان مقدار ثابت تفکیک اسید را بر حسب درجه یونش بازنویسی کرد.
و با ساده کردن معادله بالا به رابطه زیر خواهیم رسید:
توجه داشته باشید که اسیدها و بازهای قوی به شکل کامل در آب تفکیک شده و مقدار درجه یونش برای آنها برابر با ۱ یا ۱۰۰ درصد است. پیشنهاد میکنیم برای درک بهتر این مفاهیم و فرمولها، فیلم آموزش ثابت یونش فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال محاسبه ثابت یونش اسید تک پروتونه
برای درک بهتر مفاهیم قسمت قبل، به مثالهای زیر دقت کنید.
مثال ۱
یک اسید تک پروتون دار با غلظت ۱ مولار، ۰٫۰۱ درصد یونیزه شده است. مقدار ثابت یونش را برای این اسید محاسبه کنید.
پاسخ
مقدار درصد یونش داده شده در صورت سوال بدین معنی است که غلظت یونهای تفکیک شده در تعادل برابر ۰٫۰۱ غلظت اولیه اسید است. همچنین، غلظت نهایی اسید در تعادل مقدار ۰٫۰۱ غلظت اولیه کم میشود. بنابراین با درنظر گرفتن c به عنوان غلظت اولیه اسید و به عنوان درجه یونش، معادله ثابت تفکیک اسید به شکل زیر نوشته میشود.
با جایگذاری مقدار غلظت اولیه (۱ مولار) و درجه یونش (یک صدم درصد)، مقدار ثابت تفکیک اسید محاسبه میشود.
مثال ۲
یک محلول ۰٫۰۵ مولار فرمیک اسید به مقدار ۲ درصد یونیزه شده است. مقدار ثابت تفکیک این اسید را بیابید.
پاسخ
مانند قسمت قبل، معادله تفکیک اسید را بر حسب درجه یونش و غلظت اولیه اسید مینویسیم.
با جایگذاری مقدار غلظت اولیه (۰٫۰۵ مولار) و درجه یونش (۲ درصد)، مقدار ثابت تفکیک اسید محاسبه میشود.
قدرت اسید تک پروتون دار
<p>قدرت انواع اسیدهای مختلف با توجه به میزان تفکیک آنها در محلولهای آبی تعیین میشود. قدرت اسیدهای تک پروتون دار بهطور مستقیم بر pH محلول آنها تاثیر میگذارد. اسیدهای تک پروتون دار قوی بهطور کامل یونش پیدا میکنند و غلظت یون بیشتری تولید میکنند که منجر به مقادیر پایینتر pH میشود. این pH پایین میتواند بهطور قابل توجهی واکنشهای شیمیایی، بهویژه واکنشهایی که شامل بازها یا اسیدهای دیگر هستند، را تحت تاثیر قرار دهد.
مقدار قدرت اسید با پارامتر دیگری که لگاریتم منفی ثابت تفکیک اسید (pKa) است نیز نمایش داده میشود. مقدار pka برای اسیدهای تک پروتون دار به شکل زیر محاسبه میشود.
هرچه مقدار pKa برای اسیدی کوچکتر باشد، آن اسید قویتر است. اسیدهای تک پروتون دار قوی بهدلیل رفتار قابل پیشبینی در تیتراسیونها استفاده میشوند، در حالی که اسیدهای ضعیفتر نیاز به اندازهگیری و کنترل دقیقتر برای دستیابی به شرایط واکنش مطلوب دارند.
انواع اسید تک پروتون دار
اسیدهای تک پروتون دار را میتوان بسته به مقدار تفکیک آنها در محلولهای آبی به دو دسته قوی و ضعیف تقسیم کرد. اسیدهای تک پروتون دار قوی به شکل کامل در آب تفکیک شده و مقدار ثابت یونش بزرگی دارند. این اسیدها، درجه یونش برابر ۱ و درصدی یونش برابر ٪۱۰۰ دارند. برخی از اسیدهای تک پروتون دار قوی و فرمول شیمیایی آنها در ادامه معرفی شده است.
| اسید تک پروتون دار قوی | فرمول شیمیایی |
| اسید کلریدریک | |
| اسید هیدروبرمیک | |
| اسید هیدرویدیک | |
| اسید نیتریک | |
| اسید پرکلریک | |
| اسید کلریک |
در مقابل، اسیدهای تک پروتون دار ضعیف، به طور کامل در آب تفکیک نمیشوند. در واکنش تفکیک تعادلی این اسیدها، مقداری از اسید اولیه به صورت تفکیک نشده وجود دارد. به همین دلیل این اسیدهای ثابت یونش کوچک، درجه یونش کمتر از ۱ و درصد یونش کمتر از ٪۱۰۰ دارند.
در ادامه نام و فرمول شیمیایی برخی از اسیدهای تک پروتون دار ضعیف معرفی شده است.
| اسید تک پروتون دار ضعیف | فرمول شیمیایی |
| اگزالیک اسید | |
| یون هیدروژن سولفات | |
| پیتروس اسید | |
| هیدروفولوئوریک اسید | |
| بنزوییک اسید | |
| استیک اسید | |
| فرمیک اسید |
بسیاری از یونهای هیدروژن دار با بار مثبت، میتوانند اسید باشند زیرا بار مثبت میتواند با جدا شدن به وسیله یون هیدروژن () از اتم جدا شود. یون آمونیوم () یکی از مثالهای این یونها است.
pH اسید تک پروتون دار
در قسمتهای قبل آموختیم اسید تک پروتون دار چیست. این اسیدها در آب یک یون هیدروژن () (پروتون) آزاد کرده و به شکل زیر تفکیک میشوند.
غلظت یونهای هیدروژن در این معادله، تعیین کننده مقدار pH محلول است. میزان یونیزه شدن اسید توسط ثابت تفکیک اسید مشخص میشود که به صورت زیر تعریف میشود.
pKa چیست؟
برای مقایسه قدرت اسیدها به شکل راحتتر، از لگاریتم منفی Ka استفاده میکنند که با نماد pKa شناخته میشود.
عدد کوچک pKa نشاندهنده اسید قویتر و عدد بزرگ pKa نشاندهنده اسید ضعیفتر است.رابطه pH محلول با pKa و نسبت غلظت باز مزدوج به اسید دستنخورده توسط معادله هندرسون-هاسلباخ داده میشود.
در این معادله () غلظت اسید دست نخورده و () غلظت باز مزدوج است. زمانی که نصف اسید تفکیک شده باشد، مقدار pH و pKa برابر میشود زیرا غلظت اسید و باز مزدوج برابر خواهد بود. از آنجا که اسیدهای تک پروتون دار در محلول آبی تنها یک یون هیدروژن آزاد میکنند، در اسیدهای قوی که به شکل کامل در آب تفکیک میشود، میتوان غلظت یون هیدروژن () را با غلظت اولیه اسید برابر در نظر گرفته و بدین ترتیب محاسبات pH آسان میشود. در غیر این صورت، غلظت یون هیدروژن را باید با استفاده از ثابت تفکیک اسید به دست آورد.
بنابراین، pH یک اسید تکپروتونه به غلظت کل اسید و ثابت تفکیک آن (Ka یا pKa) بستگی دارد. برای اسیدهای قوی تقریبا تمام مولکولها یونیزه میشوند و pH بسیار پایین است، در حالی که برای اسیدهای ضعیف فقط بخشی از مولکولها یونیزه میشوند و pH بالاتر خواهد بود.
مثال محاسبه pH اسید تک پروتونه
برای درک بهتر این موضوع که روش محاسبه pH محلول اسید تک پروتون دار چیست، به مثالهای زیر دقت کنید.
مثال ۱
مقدار pH محلول ۴۳۳ مولار هیدروبرمیک اسید را بیابید.
پاسخ
هیدروبرمیک اسید یک اسید قوی است که به شکل کامل در آب تفکیک میشود. بنابراین میتوان مقدار غلظت یون هیدروژن () را در آن برابر با غلظت اسید در نظر گرفت و آن را در معادله محاسبه pH قرار داد.
مثال ۲
مقدار pH محلول ۰٫۱ مولار استیک اسید را بیابید. ()
پاسخ
استیک اسید یک اسید تک پروتون دار ضعیف است. بنابراین برای محاسبه pH ان باید معادله تفکیک اسید را نوشته و مقدار غلظت یون هیدروژن () را با استفاده از فرمول ثابت تفکیک اسید بیابیم.
مقدار غلظت یون هیدروژن () و باز مزدوج آن در واکنش بالا در زمان تعادل، برابر خواهد بود. همچنین، این مقدار از غلظت اولیه اسید در زمان تعادل کم میشود. بنابراین با مجهول قرار دادن غلظت یون هیدروژن و جایگذاری آن در معادله بالا، خواهیم داشت:
حال غلظت یون هیدروژن () را در معادله محاسبه pH قرار میدهیم.
yle=”text-align: center;”>
yle=”text-align: center;”>
تیتراسیون اسید تک پروتون دار
<a href=”https://blog.faradars.org/%D8%AA%DB%8C%D8%AA%D8%B1%D8%A7%D8%B3%DB%8C%D9%88%D9%86/”>تیتراسیون روشی است که در آن از یک محلول با غلظت معلوم برای تعیین غلظت محلولی دیگر با غلظت نامعلوم استفاده میشود. تیتراسیون روش بسیار موثری برای تشخیص اسید تک پروتون دار است. با تیتراسیون یک باز با اسید تک پروتون دار، واکنش خنثی شدن اسید – باز اتفاق افتاده و میتوان مقدار غلظت ماده را با استفاده از آن به دست آورد.
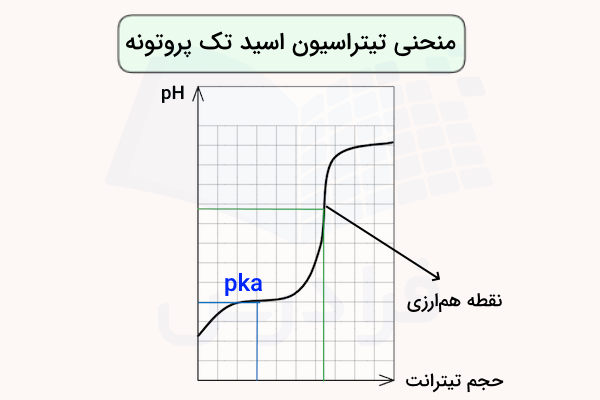
نکته مهم در نمودار منحنی تیتراسیون اسید تک پروتون دار این است که این اسیدها تنها دارای یک نقطه هم ارزی هستند. بدین ترتیب اگر نمودار تیتراسیون اسیدی مشابه تصویر بالا باشد، میتوان نتیجه گرفت که آن اسید که اسید تک پروتون دار است.
نقطه همارزی در واقع مقدار استوکیومتری است که در آن، مقدار اسید و باز افزودهشده به محلول دقیقا برابر یا معادل یکدیگر است.
مثال نمودار تیتراسیون اسید تک پروتونه
در نمودار زیر، محلولی از سدیم هیدروکسید (NaOH) به محلولی از هیدروژن کلرید (HCl) افزوده میشود. نقطه همارزی، نقطهای است که در آن پروتون اسیدی موجود در هیدروژن کلرید (اتم هیدروژنی که به کلر متصل است) دقیقا با مقدار معادل یون هیدروکسید (OH) حاصل از سدیم هیدروکسید واکنش میدهد. در این حالت، هیچ پروتون اسیدی یا یون هیدروکسید اضافی در محلول باقی نمیماند.
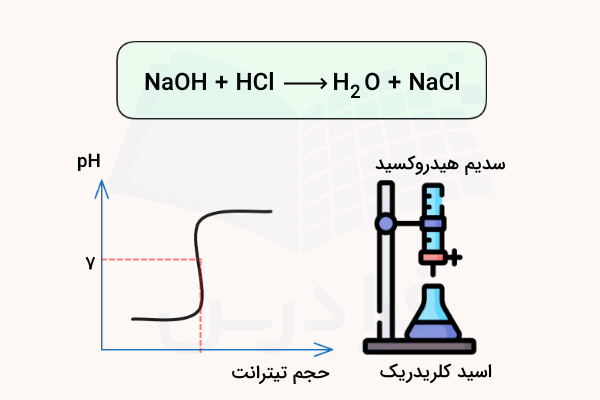
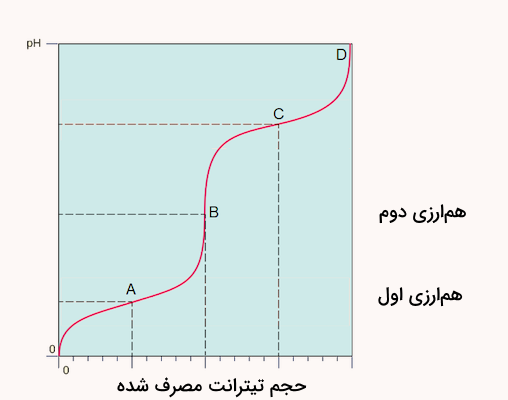
تعداد نقاط همارزی در منحنی تیتراسیون با تعداد پروتونهایی که یک اسید میتواند اهدا کند برابر است. بنابراین نمودار تیتراسیون اسیدهای دو و سه پروتون دار مشابه زیر خواهند بود.
کاربرد اسید تک پروتون دار چیست؟
اسیدهای تک پروتون دار نقش مهمی در سیستمهای بافری دارند و به حفظ pH پایدار در محیطهای بیولوژیکی کمک میکنند. برای مثال، وقتی اسید یا باز به سیستم وارد میشود، وجود یک اسید تک پروتون دار باعث خنثی شدن سریع میشود زیرا پروتونها آزاد میشوند و pH را تثبیت میکنند.
این موضوع برای بسیاری از واکنشهای بیوشیمیایی که نیازمند pH مشخص برای عملکرد صحیح هستند، بسیار اهمیت دارد. آشنایی با عملکرد اسیدهای تک پروتون دار در سیستمهای بافری به درک بهتر اثرات آنها در زیستشناسی و شیمی کمک میکند.
باز تک پروتون دار چیست؟
بازهایی که در محلول آبی تنها یک یون هیدروکسید آزاد میکنند، با نام باز تک پروتون دار شناخته میشوند. این نام گذاری بدین علت است که این بازها تنها میتوانند یک یون هیدروژن () (پروتون) دریافت کنند. بازهایی با قابلیت آزاد کردن بیش از یک یون هیدروکسید، باز چند پروتونه یا چند ظرفیتی شناخته میشوند.
تعداد یونهای هیدروکسید قابل یونش موجود در ساختار باز، با عنوان اسیدیته باز شناخته میشود و بازها بر این اساس میتوانند به عنوان باز تک اسیدی، دو اسیدی و سه اسیدی دستهبندی شوند. تعدادی از بازهای تک پروتون دار و اسید مزدوج آنها در جدول زیر معرفی شده است.
| بار تک پروتون دار | اسید مزدوج |
| آمونیاک: | |
| متیل آمین: | |
| پیریدین: | |
| هیدروکسید: | |
| اتیل آمین: | |
| سدیم هیدروکسید: | |
| پتاسیم هیدروکسید: | |
| لیتیم هیدروکسید: |
مثال و تمرین اسید تک پروتون دار
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید. همچنین، پس از پاسخدهی به تمام سوالات آزمون میتوانید با کلیک بر روی گزینه «دریافت نتیجه آزمون»، تعداد پاسخهای صحیح خود را مشاهده کنید.
۱. کدام یک از ترکیبات زیر یک اسید تک پروتون دار است؟
فرمیک اسید با فرمول شیمیایی تنها اسید تک پروتون دار بین گزینههای موجود است.
کدام گزینه معادله صحیح تفکیک اسید سیانیک (HCNO) است؟
۳. مقدار ثابت تفکیک استیک اسید ۰٫۱ مولار با درجه یونش را محاسبه کنید.
با توجه به رابطه ثابت تفکیک اسید بر حسب درجه یونش و غلظت اولیه اسید، مقادیر را جایگذاری میکنیم.
۴. مقدار pH اسید فرمیک ۰٫۰۵ مولار را با ثابت تفکیک اسید برابر را محاسبه کنید.
از آنجا که مقدار درجه یونش مشخص نشده است، مقدار آن را برابر ۱ در نظر گرفته و تصور میکنیم مقدار غلظت یون هیدروژن () با یون برابر است. در نتیجه، میتوان مقدار غلظت یون هیدروژن () را با استفاده از رابطه زیر به دست آورد.
سپس مقدار غلظت یون هیدروژن () را در فرمول محاسبه pH قرار میدهیم.
۵. کدام یک از موارد زیر یک اسید تک پروتون دار قوی است؟
اسید کلریدریک
اسید هیدروفلوئوریک
۶. مقدار درجه یونش یک اسید مونوپروتیک ضعیف با غلظت ۱ مولار برابر با ۰٫۰۱ درصد است. مقدار اسیدیته این اسید را بدست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
۷. برای یک اسید تک پروتون دار ضعیف، مقدار درجه یونش برابر با ۵ درصد و مقدار غلظت برابر با ۰٫۱ مولار است. مقدار ثابت تفکیک را برای این اسید محاسبه کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
۸. کدام یک از موارد زیر یک اسید تک پروتون دار نیست؟
۹. کدام یک از موارد زیر معادله تفکیک فلوئورواستیک اسید را به شکل صحیح نشان میدهد؟
۱۰. مقدار pH اسید کلریدریک ۰٫۰۱ مولار را به دست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
نتیجه آزمون در مجله فرادرس
امتیاز: ۰ از ۰
این آموزش را به خوبی یاد گرفتهاید.
source
