شعاع اتمی عناصر معیاری برای توصیف اندازه اتم است. اندازه شعاع اتمی عناصر در جدول تناوبی، در هر دوره از چپ به راست کاهش یافته و در هر گروه از بالا به پایین افزایش مییابد. افزایش شعاع اتمی در هر گروه به دلیل افزایش لایه الکترونی و کاهش آن در هر ردیف به دلیل افزایش بار موثر هسته و کاهش اثر پوششی الکترون درونی است. در این مطلب از مجله فرادرس میآموزیم روند تغییر شعاع اتمی در جدول تناوبی چیست.
آنچه در این مطلب میآموزید:
-
میآموزید تغییرات شعاع اتمی در گروهها و ردیفهای جدول تناوبی چگونه است.
-
با تغییرات شعاع اتمی فلزات واسطه آشنا میشوید.
-
موارد استثنا در روندهای تغییر شعاع اتمی در جدول تناوبی را میشناسید.
-
با تعریف و انواع شعاع اتمی آشنا میشوید.
-
میتوانید تفاوت شعاع اتمی و شعاع یونی و روند تغییر آن ها را درک کنید.
-
با روندهای تناوبی و رابطه آنها با شعاع اتمی آشنا میشوید.



در ابتدای این مطلب میآموزیم تغییرات شعاع اتمی در جدول تناوبی چگونه است و موارد استثنا در این تغییرات کدام عناصر هستند. سپس به بررسی مفهوم شعاع اتمی و انواع آن میپردازیم. در ادامه عوامل موثر بر شعاع اتمی را بررسی کرده و تغییرات شعاع اتمی کاتیون و آنیون را میآموزیم. در نهایت مقایسه شعاع اتمی را آموخته و رابطه شعاع اتمی را با سایر خواص دورهای یاد میگیریم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید شعاع اتمی در جدول تناوبی چیست.
تغییرات شعاع اتمی در جدول تناوبی
شعاع اتمی معیاری نسبی برای اندازهگیری ابعاد اتمهای عناصر است. شعاع اتمی در هر دوره جدول تناوبی از چپ به راست کاهش مییابد. در مقابل، در هر گروه جدول تناوبی از بالا به پایین، شعاع اتمی افزایش مییابد. درواقع شعاع اتمی را نمیتوان با تقریب دقیقی اندازهگیری کرد زیرا برهمکنشهای الکترواستاتیک بین هسته و الکترون اتمها در هر پیوند شیمیایی متفاوت است.
با این وجود، با مشاهده جدول تناوبی و مقایسه شعاع اتمی تقریبی عناصر در جدول تناوبی، میتوانیم یک تغییر دورهای را برای شعاع اتمی مشاهده کنیم. در هر ردیف جدول تناوبی، تعداد مشخصی لایه الکترونی اطراف هسته اتم قرار گرفتهاند. با حرکت در هر گروه جدول تناوبی از بالا به پایین، یک لایه الکترونی به اتم افزوده میشود. اثر حجم این لایه الکترونی اضافه شده به اندازهای زیاد است که بر اثر جاذبه هسته اتم غلبه کرده و باعث بزرگتر بودن شعاع اتمی شده است.
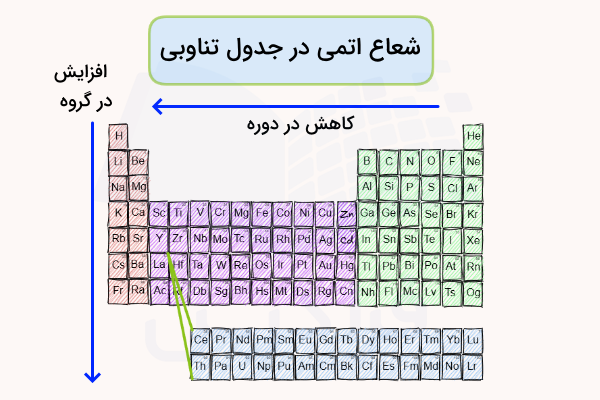
در مقابل، در هر ردیف جدول تناوبی، با حرکت از چپ به راست، تعداد مشخصی پروتون به هسته اتم و تعداد مشخصی الکترون به الکترونهای اتم افزوده میشود. اتمهای موجود در هر لایه جدول تناوبی تعداد برابری لایه الکترونی دارند. در نتیجه هسته اتم میتواند با قدرت بیشتر الکترونها را به خود جذب کند. در ادامه هر یک از این موارد را بررسی میکنیم.
شعاع اتمی در هر گروه جدول تناوبی
در هر گروه جدول تناوبی، با حرکت از بالا به پایین، یک لایه به لایههای الکترونی اتمها افزوده میشود. این لایههای الکترونی در واقع همان عدد کوانتومی اصلی در آرایش الکترونی عناصر و سطوح انرژی کوانتومی هستند که شعاع اتمی را مشخص میکنند. در مجموع ۷ ردیف در جدول تناوبی و ۷ لایه الکترونی برای عناصر کشف شده وجود دارد. برای مثال، در گروه فلزات قلیایی، اتم هیدروژن یک لایه الکترونی، اتم لیتیوم دو لایه الکترونی و اتم سدیم سه لایه الکترونی دارد. این آرایش در تصویر زیر مشخص شده است.
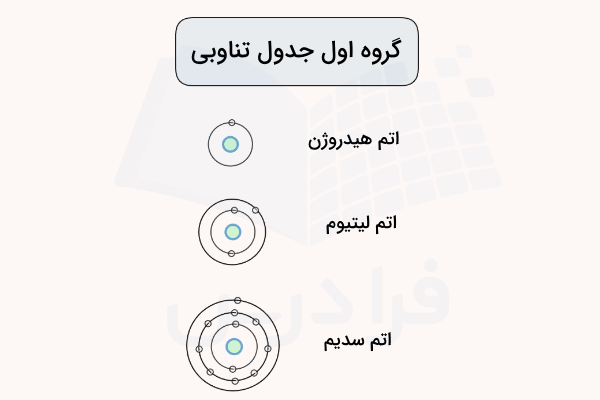
این لایههای الکترونی افزوده شده در فاصله بیشتری نسبت به هسته اتم قرار دارند و تعدادی الکترون را نیز درون خود جای دادهاند. به همین دلیل، اثر جاذبه هسته اتم بر الکترونهای لایه ظرفیت نیز کمتر بوده و شعاع اتمی هر اتم نسبت به اتم بالاتر خود در جدل تناوبی بیشتر خواهد بود.
شعاع اتمی در هر ردیف جدول تناوبی
در هر ریف جدول تناوبی با حرکت از چپ به راست شعاع اتمی به طور کلی کاهش مییابد. این پدیده به این علت است که بار هسته به دلیل افزایش پروتونها افزایش یافته اما الکترونهای افزوده شده به همان لایه ظرفیت اتم قبلی افزوده میشوند. برای مثال، به آرایش الکترونها و پروتونهای دو اتم لیتیوم و برلیم توجه کنید.
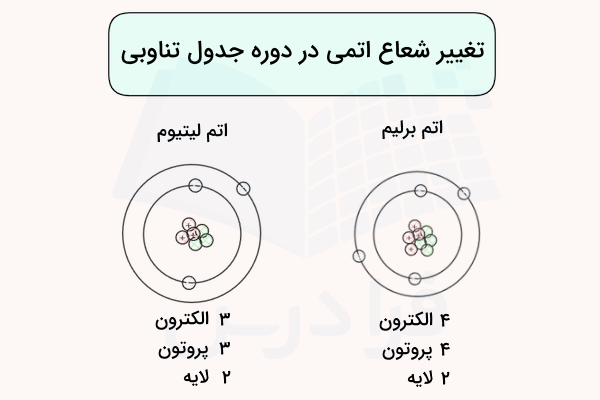
این افزایش بار مثبت هسته اتم الکترونها را بیشتر به سمت خود جذب کرده در مجموع مقدار اندازه کلی اتم را کاهش میدهد. این افزایش بار هسته و اثر جاذبه آن به اندازهای زیاد است که میتواند با نیروی دافعه بین الکترونهای افزوده شده مقابله کند.
شعاع اتمی فلزات واسطه
فلزات واسطه (بجز چند مورد استثنا) تقریبا شعاع اتمی برابری دارند. این پدیده به دلیل آرایش الکترونی این عناصر است. در فلزات واسطه، الکترونها، زیرلایه درونی و اوربیتالهای d را پر میکنند. به همین دلیل، اثر جاذبه هسته بر الکترونهای ظرفیت مقادیر ناچیزی تغییر میکند.
دانلود PDF با کیفیت جدول تناوبی
در ادامه این مطلب، لینکهای دانلود عکس و PDF جدول تناوبی عناصر با کیفیت بالا قرار گرفته است. میتوانید با کلیک بر روی لینکهای زیر فایل PDF جدول تناوبی عناصر و عکس جدول تناوبی عناصر را دانلود کنید.
فایل PDF جدول تناوبی فارسی به همراه تقلبنامه جدول تناوبی از لینکهای زیر قابل دانلود هستند. برای دانلود این فایلها، روی آنها کلیک کنید.
موارد استثنا در شعاع اتمی
در برخی از موارد، تعدادی از اتمها از این قانون تبیعت نمیکنند. برای مثال، شعاع اتمی اکسیژن مقداری از شعاع اتمی نیتروژن بزرگتر است. همچنین، شعاع اتمی گازهای نجیب از شعاع اتمی هالوژنها بزرگتر است. در ادامه برخی از موارد استثنا در روند تغییر شعاع اتمی در جدول تناوبی را توضیح میدهیم.
| نوع استثنا | دلیل |
| گروه ۲ و گروه ۱۳ | اثر پوششی ضعیف الکترونها در زیرلایه S و p و d |
| فلزات واسطه | اثر پوششی ضعیف الکترونها در اوربیتالهای d |
| فشردگی لانتانیدها | اثر پوششی ضعیف الکترونهای زیرلایه f |
| جفتهای ناهمسان | اثر پوششی ضعیف الکترونهای زیرلایه d |
شعاع اتمی گروه ۲ و گروه ۱۳
طبق مطالبی که در بخشهای پیشین آموختیم، انتظار میرود شعاع اتمی از گروه ۲ تا گروه ۱۳ جدول تناوبی کاهش یابد. با این حال، در مقایسهی واقعی مشاهده میشود که شعاع اتمی عناصر گروه ۱۳ اندکی بزرگتر از مقدار پیشبینیشده است.
این پدیده بهویژه در عناصر سنگینتر گروه ۱۳ (مانند گالیم و ایندیم) مشاهده میشود. علت آن وجود الکترونهای درونی در زیرلایههای d و f است که باعث افزایش اثر پوششی میشوند. این الکترونها بار مثبت هسته را تا حدی پوشش میدهند و در نتیجه، بار موثر هسته بر الکترونهای لایه ظرفیت کاهش مییابد.
در اثر این کاهش جاذبه موثر، الکترونهای اوربیتالهای p با نیروی کمتری به سمت هسته جذب میشوند و در نتیجه، شعاع اتمی عناصر گروه ۱۳ نسبت به عناصر گروه ۲ کمی افزایش پیدا میکند یا کاهش آن کمتر از حد انتظار است.
عناصر فلزات واسطه
شعاع اتمی فلزات واسطه در یک ردیف تقریبا ثابت است یا اختلاف بسیار کمی دارند. این پدیده به این دلیل است که الکترونهای افزوده شده در یک ردیف برای این عناصر، اوربیتالهای زیر لایه درونی d را پر میکنند.
بنابراین، افزایش تعداد پروتونها در هسته با اثر پوششی جزئی الکترونهای d تا حدی خنثی میشود. از آنجا که این الکترونها توانایی چندانی در پوشش بار مثبت هسته ندارند، بار موثر هسته بر الکترونهای ظرفیت افزایش مییابد. در نتیجه، الکترونهای لایه ظرفیت، بار موثر هسته بیشتری را تجربه کرده و اندازه شعاع اتمی افزایش نمییابد.
جفتهای ناهمسان
در جدول تناوبی عناصر، بین برخی از عناصر جدول تناوبی اختلافاتی بیقاعده در شعاع اتمی وجود دارد که در ادامه آنها را بررسی میکنیم.
گالیم و آلومینیوم
عناصر گالیم (Ga) و آلومینیوم (Al) با وجود اینکه دو عنصر متوالی در یک گروه جدول تناوبی هستند، شعاع اتمی تقریبا برابری دارند. دلیل این موضوع این است که در اتم گالیم، ۱۰ الکترون موجود در زیرلایه 3d اثر زیادی در در پوشش الکترونی ندارند و میزان بار موثر هسته برای الکترونهای ظرفیت این اتم به حدی زیاد است که مقدار شعاع اتمی از مقداری که انتظار میرود کمتر باشد.
همین موضوع باعث میشود شعاع اتمی گالیم از مقدار مورد انتظار کوچکتر باشد. در ادامه آرایش الکترونی اتمهای گالیم و آلومینیوم ارائه شده است.
آرایش الکترونی آلومینیوم:
آرایش الکترونی گالیم:
به این دلیل، ترتیب افزایش شعاع اتمی در گروه ۱۳ جدول تناوبی به شکل زیر است.
B < Ga < Al < In < Tl
پیشنهاد میکنیم برای آشنایی بیشتر با خواص و ویژگیهای عناصر هر یک از گروههای جدول تناوبی، مطلب گروههای جدول تناوبی مجله فرادرس را مطالعه کنید.
اسکاندیم، ایتریم و لانتانیدها
هنگامی که در جدول تناوبی از عنصر ایتریم (Y) به سمت لانتانیدها حرکت میکنیم، شعاع اتمی تقریبا تغییری نمیکند. این پدیده به علت اثر فشردگی لانتانیدها است. اثر فشردگی لانتانیدها به آرایش الکترونی این عناصر و ارتباط آن با شعاع اتمی اشاره دارد. در این عناصر، الکترونهای موجود در اوربیتالهای 5s و 5p در اوربیتال 4f نفوذ میکنند. با این حال، الکترونهای 4f به دلیل شکل فضایی خاص خود، قدرت پوششدهی کمی بر بار مثبت هسته دارند.
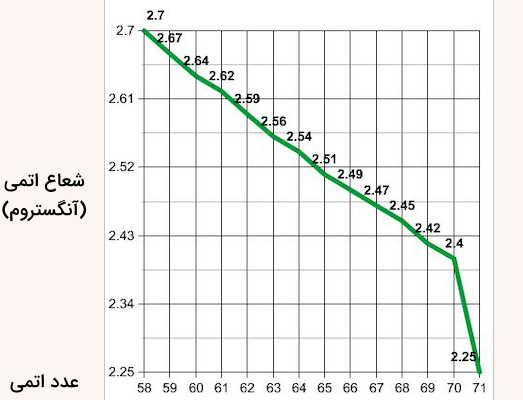
با افزایش عدد اتمی و تعداد پروتونها، بار موثر هسته به طور محسوسی افزایش مییابد، اما شعاع اتمی کاهش زیادی نشان نمیدهد و نسبتا ثابت باقی میماند. این پدیده در تمام لانتانیدها از عدد اتمی ۵۸ تا ۷۱ مشاهده میشود. نمودار زیر، مقدار شعاع اتمی بر حسب آنگستروم را برای عناصر لانتانید با عدد اتمی ۵۸ تا ۷۱ نمایش میدهد.
ردیف دوم و سوم قطعه عناصر p
عناصر p در جدول تناوبی عناصری هستند که در آنها الکترونهای لایه ظرفیت زیرلایه p را پر میکنند. این عناصر، عناصر گروه ۱۳ تا ۱۸ جدول تناوبی را شامل میشوند. در ردیف دوم و سوم جدول تناوبی، تغییرات شعاع اتمی در میان عناصر قطعه p نسبتا اندک است. دلیل این موضوع آن است که در این ردیفها زیرلایههای d و f هنوز پر نشدهاند. بنابراین اثر پوششی اضافی ناشی از این زیرلایهها وجود ندارد و تغییر شعاع اتمی کمتر از مقدار پیشبینیشده خواهد بود.
شعاع اتمی چیست
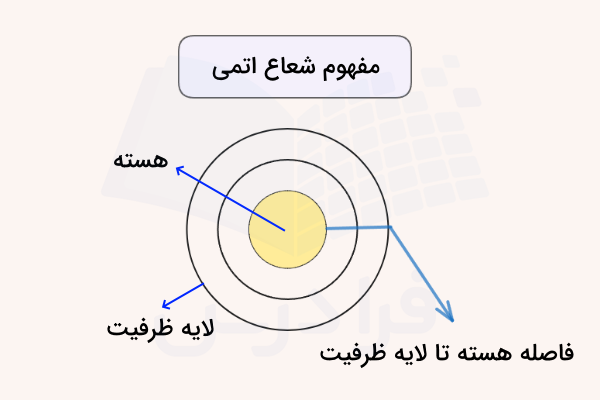
شعاع اتمی در جدول تناوبی معیاری برای اندازهگیری اندازه اتم است. در واقع شعاع اتمی فاصله هسته اتم را تا آخرین لایه الکترونی مشخص میکند. دانشمندان شعاع اتمی را به روشهای متفاوتی تعیین میکنند اما اندازهگیری دقیق شعاع اتمی کاری دشوار است. زیرا طبق اصل عدم قطعیت هایزنبرگ، نمیتوان مکان دقیق الکترونها را در اطراف هسته تعیین کرد. علاوه بر این، اتمها بسته به نوع پیوند شیمیایی و نیروهای الکترواستاتیکی میان هسته و الکترونها، میتوانند شعاعهای متفاوتی داشته باشند.
شعاع اتمی معمولا با واحدهایی مانند پیکومتر ( متر) و آنگستروم ( متر) اندازهگیری میشود. برای مثال، فاصله هستههای دو اتم هیدروژن در مولکول دو اتمی هیدروژن برابر با ۷۴ پیکومتر است. در نتیجه، شعاع اتمی هیدروژن برابر با ۳۷ پیکومتر خواهد بود. در تصویر زیر، تعریف شعاع اتمی مشخص شده است.
انواع شعاع اتمی
در قسمتهای قبل آموختیم شعاع اتمی در جدول تناوبی چیست و چگونه تغییر میکند. شعاع اتمی را نمیتوان به شکل مستقیم به به راحتی اندازهگیری کرد زیرا مکان دقیق قرارگیری الکترونها در اتمها قطعی و مشخص نیست. به همین دلیل، اندازه شعاع اتمی با توجه به پیوندی که اتم با اتمهای مجاور خود برقرار کرده تعیین میشود.
بر اساس این روش، شعاع اتمی را در دستهبندیهای مختلفی بررسی میکنند که شامل موارد زیر است.
- شعاع کووالانسی
- شعاع یونی
- شعاع فلزی
- شعاع واندوالسی
در ادامه هر یک از این انواع را توضیح میدهیم. پیشنهاد می کنیم برای درک بهتر مفهوم شعاع اتمی و تغییرات ان در جدول تناوبی، فیلم آموزش تغییرات شعاع اتمی در جدول تناوبی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
شعاع کووالانسی
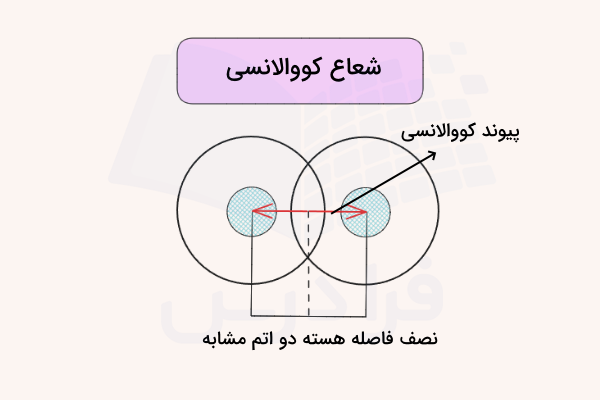
شعاع کووالانسی فاصله بین هسته تا آخرین لایه الکترونی اتمهایی است که با هم پیوند کووالانسی برقرار کردهاند. در پیوند کووالانسی، الکترونها به اشتراک گذاشته میشود. اگر دو اتم درگیر در پیوند از یک نوع باشند، شعاع کووالانسی را میتوان برابر با نصف فاصله اتمهای درگیر در پیوند در نظر گرفت. تصویر شعاع کووالانسی در تصویر زیر مشخص شده است.
شعاع واندروالسی
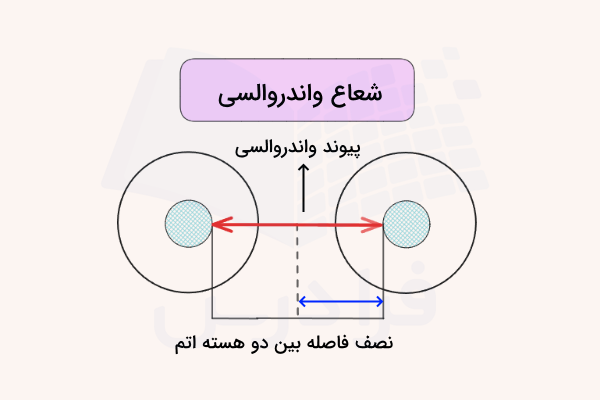
شعاع واندروالسی فاصله بین هسته و لایهی آخر الکترونی اتمهایی است که در پیوند واندروالسی با هم شرکت دارند. پیوند واندروالسی یکی از نیروهای جاذبه بین مولکولی است که مولکولها را در یک ترکیب به هم متصل نگه میدارد.
اگر اتمهای درگیر مشابه باشند، شعاع واندوالسی برابر با نصف فاصله بین دو هسته در نظر گرفته میشود.
شعاع یونی
شعاع یونی فاصله بین هسته و لایهی الکترونی خارجی یونهایی است که در پیوند یونی شرکت دارند. تعیین شعاع یونی نسبتا دشوار است، زیرا کاتیون و آنیون شعاعهای متفاوتی دارند و نمیتوان فاصله بین آنها را به سادگی نصف کرد. برای تعیین شعاع یونی، روشهای تجربی متنوعی به کار گرفته میشود.
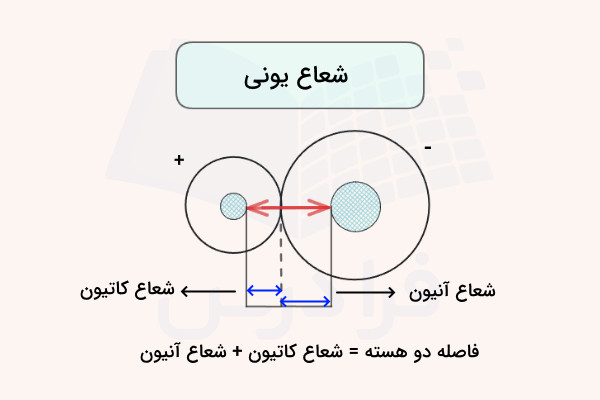
شعاع فلزی
شعاع فلزی فاصله بین هسته و لایهی ظرفیت اتمهایی است که در یک ساختار کریستالی فلزی با هم پیوند فلزی برقرار کردهاند. در واقع، شعاع فلزی برابر با نصف فاصله بین دو اتم مشابه در شبکهی کریستالی در نظر گرفته میشود.

عوامل موثر بر شعاع اتمی در جدول تناوبی
همانطور که پیشتر آموختیم، شعاع اتمی در جدول تناوبی در هر ردیف از چپ به راست کاهش و در هر گروه از بالا به پایین افزایش مییابد.
- در هر گروه جدول تناوبی، با حرکت از بالا به پایین، یک لایه الکترونی به اتم اضافه میشود و در نتیجه شعاع اتمی افزایش مییابد.
- در هر ردیف جدول تناوبی، با افزایش عدد اتمی، تعداد پروتونها و الکترونها افزایش مییابد، اما تعداد لایههای الکترونی ثابت است.
- اثر جاذبه هسته بر الکترونها باعث کاهش شعاع اتمی میشود.
در واقع، اندازه شعاع اتمی نتیجهی مجموعهای از عوامل و نیروها مانند افزایش لایههای الکترونی، بار موثر هسته و اثر پوششی الکترونهای درونی است. هر یک از این عوامل در ادامه بررسی میشود.
اثر لایه الکترونی
در هر گروه جدول تناوبی با حرکت از بالا به پایین شعاع اتمی افزایش مییابد. (بجز مورد استثنا مانند گالیم). یکی از مهمترین عوامل این پدیده، افزوده شدن یک لایه الکترونی جدید به اتم، نسبت به عنصر قبل از آن است. برای مثال، به آرایش الکترونی ۴ عنصر اول گروه فلزات قلیایی توجه کنید.
همانطور که مشاهده میکنید، اتم لیتیوم در ردیف دوم، ۲ لایه الکترونی، اتم سدیم در ردیف سوم،۳ لایه الکترونی، پتاسیم ۴ لایه الکترونی و … دارند. اثر افزوده شدن این لایه الکترونی بر شعاع اتمی تاثیر زیادی گذاشته و باعث افزایش آن میشود. همچنین در عناصری مانند فلزات قلیایی و قلیایی خاکی، الکترونهای از دست رفته برای تولید کاتیون از همین لایهها جدا شده و باعث کاهش قابل توجه شعاع یون تولید شده نسبت به اتم اصلی میشوند.
اثر بار موثر هسته
بار موثر هسته مقدار نیروی جاذبهای است که الکترونها از سمت هسته اتم و پروتونها احساس میکنند. مقدار بار موثر هسته در هر ردیف جدول تناوبی از چپ به راست افزایش مییابد. زیرا الکترونهای افزوده شده به همان لایه الکترونی اتم قبلی خود افزوده میشوند. مقدار بار موثر هسته اتم با استفاده از قانون اسلاتر محاسبه میشود. این قانون و معادله آن نشان میدهد چگونه ساختار هسته اتم میتواند با استفاده از نیروهای الکترواستاتیکی ابعداد کل اتم را تحت تاثیر قرار دهد.
مقدار بار موثر هسته اتم از رابطه زیر به دست میآید.
در این رابطه Z مقدار عدد اتمی اتم و S مقدار ثابت پوششی ست که با توجه به نیروهای دافعه الکترون – الکترون تعیین میشود. مقدار بار موثر هسته با اثر پوششی الکترون درونی رابطهای عکس دارد. هرچه بار موثر هسته بیشتر باشد مقدار اثر پوششی الکترونها کمتر خواهد بود.
اثر پوشش الکترون درونی
اثر پوششی الکترونهای درونی پدیدهای است که در آن الکترونهای لایههای داخلی اتم مانند یک سپر یا پوشش، اثر جاذبهی هسته بر الکترونهای لایههای بیرونی و لایهی ظرفیت را کاهش میدهند. هرچه اثر پوششی الکترونهای درونی بیشتر باشد، شعاع اتمی افزایش مییابد. دلیل این امر آن است که الکترونهای افزودهشده، دافعهی بیشتری نسبت به یکدیگر ایجاد کرده و در نتیجه فاصلهی میان لایههای الکترونی افزایش پیدا میکند.
علاوه بر این، کاهش جاذبهی هسته بر الکترونهای لایهی ظرفیت نیز باعث میشود این الکترونها در فاصلهی دورتری از هسته قرار گیرند. با حرکت از بالا به پایین در هر گروه جدول تناوبی، مقدار اثر پوششی افزایش یافته و در نتیجه شعاع اتمی نیز بیشتر میشود. این پدیده رابطهای معکوس با انرژی یونش دارد. به این معنا که هرچه اثر پوششی افزایش یابد، انرژی یونش کاهش یافته و جدا کردن الکترون از اتم آسانتر خواهد بود.
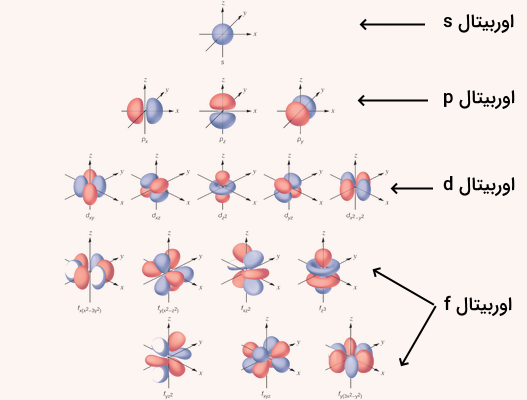
هر یک از اوربیتالهای الکترونی میزان متفاوتی از اثر پوششی را ایجاد میکنند. ترتیب شدت اثر پوششی اوربیتالها به صورت زیر است:
به این ترتیب، اوربیتال s بیشترین اثر پوششی و اوربیتال f کمترین اثر پوششی را دارد. این تفاوت در مقدار اثر پوششی به علت شکل فضایی اوربیتالها است. شکل هندسی اوربیتالهای مختلف در تصویر زیر نشان داده شده است.
مقایسه شعاع اتمی در جدول تناوبی
برای مقایسه شعاع اتمی دو اتم، باید تعداد لایههای الکترونی، بار موثر هسته و اثر پوششی الکترونهای درونی را در نظر گرفت. به عنوان مثال، شعاع اتمی سدیم (Na) از شعاع اتمی لیتیوم (Li) بزرگتر است، زیرا سدیم در ردیف سوم جدول تناوبی قرار دارد و دارای سه لایه الکترونی است، در حالی که لیتیوم در ردیف دوم قرار داشته و فقط دو لایه الکترونی دارد.
لایهی اضافی در سدیم باعث افزایش فاصله الکترونهای ظرفیت از هسته و در نتیجه شعاع اتمی بزرگتر میشود. همچنین، بار موثر هسته در هر دو اتم افزایش یافته اما اثر افزوده شدن لایههای جدید بر شعاع غالب است، بنابراین سدیم شعاعی بیشتر از لیتیوم دارد.
کوچکترین و بزرگ ترین شعاع اتمی در جدول تناوبی
کوچکترین شعاع اتمی در جدول تناوبی مربوط به اتم هلیوم است، در حالی که بزرگترین شعاع اتمی مربوط به اتم فلزات قلیایی پایین جدول میباشد. همانطور که در بخشهای قبل آموختیم، روند تغییر شعاع اتمی در جدول تناوبی به این شکل است که در هر گروه از بالا به پایین شعاع اتمی افزایش و در هر ردیف از چپ به راست شعاع اتمی کاهش مییابد.
این تغییرات نتیجهی ترکیبی از عوامل مانند بار موثر هسته، دافعه الکترونها و اثر پوششی الکترونهای درونی است. بنابراین، عناصر موجود در سمت چپ و پایین جدول تناوبی بزرگترین شعاع اتمی و عناصر موجود در سمت راست و بالای جدول تناوبی کوچکترین شعاع اتمی را دارند.
تفاوت شعاع اتمی و شعاع یونی
همانطور که در بخشهای قبل آموختیم، شعاع یونی با توجه به پیوند یونی بین یک کاتیون و یک آنیون تعیین میشود. اندازهگیری شعاع یونی دشوار است، زیرا به انتقال کامل الکترونها از یک اتم به اتم دیگر بستگی دارد و این فرآیند پیچیده است.
در مقابل، شعاع اتمی را میتوان با استفاده از نصف فاصله بین هستههای دو اتم مشابه درگیر در پیوند کووالانسی یا فلزی به دست آورد.
- کاتیونها با از دست دادن الکترون تشکیل میشوند و شعاع آنها کوچکتر از اتم اصلی است، زیرا کاهش تعداد الکترونها باعث افزایش بار موثر هسته بر الکترونهای باقیمانده میشود.
- آنیونها با گرفتن الکترون تشکیل میشوند و شعاع آنها بزرگتر از اتم اصلی است، زیرا اضافه شدن الکترونها باعث افزایش دافعهی بین الکترونها و کاهش اثر جاذبه هسته میشود.
در ادامه، هر یک از این موارد را بهطور جزئیتر بررسی میکنیم.
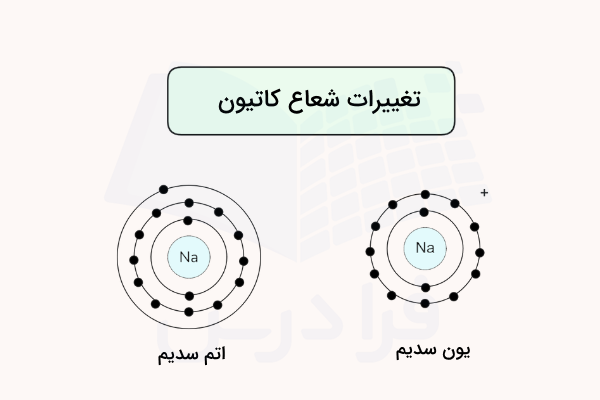
تغییرات شعاع اتمی کاتیون
کاتیون (یون مثبت) با انتقال کامل یک الکترون از مدار الکترونهای یک اتم تشکیل میشود. در واقع با تشکیل کاتیون تعداد الکترونهای اتم کاهش یافته و از تعداد پروتونهای آن کمتر میشود. این انتقال الکترون میتواند با حذف یک لایه الکترونی به شکل کامل (برای مثال کاتیون فلزات قلیایی یا قلیایی خاکی) انجام شود. فلزات معمولا توانایی تشکیل کاتیون را دارند.
همچنین الکترون ممکن است از لایه ظرفیت موجود اتم جدا شود. در هر دو صورت، مقدار جاذبه هسته اتم بر الکترونهای باقی مانده قویتر میشود و الکترونها با قدرت بیشتری به سمت هسته اتم کشیده میشوند. در نتیجه، شعاع اتمی کاهش مییابد. این پدیده در تصویر زیر نمایش داده شده است.
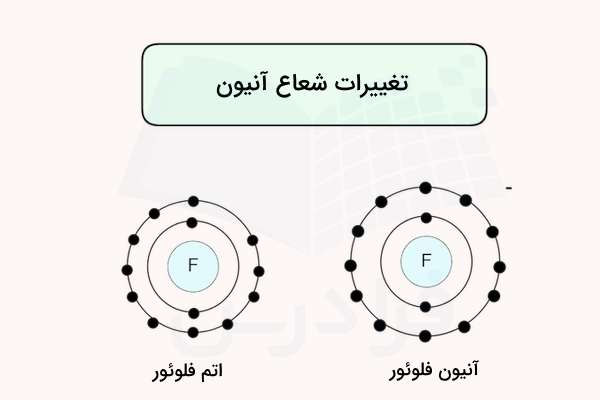
تغییرات شعاع اتمی آنیون
آنیون (یون منفی) با افزوده شدن الکترون به اتم تشکیل میشود. نافلزات معمولا آنیون تشکیل میدهند. الکترون افزوده شده در آخرین لایه الکترونی (لایه ظرفیت اتم) قرار میگیرد. بدین ترتیب، اثر جاذبه هسته اتم بر الکترونها در مجموع کاهش مییابد و الکترونها با قدرت کمتری به هسته اتم جذب میشوند.
همچنین، مقدار دافعه الکترون – الکترون در یون تشکیل شده نسبت به اتم اولیه افزایش مییابد. در نتیجه، شعاع اتمی افزایش مییابد به همین دلیل، شعاع آنیون همواره نسبت به شعاع اتم اصلی بزرگتر است. این پدیده در تصویر زیر نمایش داده شده است.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر شعاع اتمی در جدول تناوبی، ابتدا باید با مفاهیمی چون جدول تناوبی عناصر، فلزات و نافلزات و شبه فلزات در جدول تناوبی، واکنشپذیری عنصرها و آرایش الکترونی عناصر آشنا شویم. پیشنهاد میکنیم برای یادگیری بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شعاع اتمی در جدول تناوبی دسترسی داشته باشید.
رابطه سایر روندهای تناوبی و شعاع اتمی
در جدوا تناوبی عناصر، برخ یاز خواص اتمها مانند شعاع اتمی، الکترونگاتیوی و الکترونپوزتوییو، انرژی یونش، الکترونخواهی و … به صورت دورهای در ردیفها و گروهها تغییرر میکنند. بسیاری از این خواص بر هر اثر گذاشته و باهم مرتبط هستند.
قانونی به نام قانون دورهای عناصر، این روند تکرار خواص فیزیکی و شیمیایی عناصر را به هنگام طبقهبندی آنها بر اساس افزایش عدد اتمی نشان میدهد. در ادامه، ارتباط این خواص با شعاع اتمی را توضیح میدهیم.
الکترونگاتیوی و شعاع اتمی در جدول تناوبی
الکترونگاتیوی و شعاع اتمی در جدول تناوبی رابطه عکس دارند. الکترونگاتیوی یکی از خصلتهای عناصر است که تعیین میکند اتم تا چه میزان تمایل به جذب الکترونها به سمت هسته خود را دارد. الکترونگاتیوی عناصر فلزی بسیار کم و الکترونگاتیوی عناصر غیرفلزی بسیار زیاد است. به عبارتی، الکترونگاتیوی با حرکت در هر دوره جدول تناوبی از چپ به راست افزایش (کاهش شعاع اتمی) و در هر گروه جدول تناوبی از بالا به پایین کاهش (افزایش شعاع اتمی) مییابد.
در واقع هرچه توانایی اتم برای جذب الکترونها کمتر باشد، الکترونها میتوانند در فاصله بیشتری نسبت به هسته اتم قرار بگیرند و بدین ترتیب، شعاع اتمی افزایش مییابد. عکس این موضوع نیز به همین ترتیب بر کاهش شعاع اتمی اثر میگذارد.
انرژی یونش و شعاع اتمی در جدول تناوبی
شعاع اتمی و انرژی یونش رابطهای مستقیم دارند. انرژی یونش مقدار انرژی مورد نیاز برای جدا کردن یک الکترون از اتم در حالت خنثی و گازی است. هرچه انرژی یونش کمتر باشد، جدا کردن الکترون از اتم و تشکیل کاتیون راحتتر است. به همین ترتیب، هرچه انرژی یونش بیشتر باشد، جدا کردن الکترون و تشکیل کاتیون سختتر است.
در اتمهایی که شعاع اتمی بیشتری دارند (سمت چپ جدول تناوبی)، جدا کردن الکترون از اتم آسانتر ست زیرا الکترونهای ظرفیت کمتر تحت اثر نیروی جاذبه هسته اتم هستند. در مقابل، در اتمهایی که شعاع اتمی کوچکتری دارند، الکترونهای ظرفیت به هسته اتم نزدیکتر بوده و قدرت جاذبه بیشتری را احساس میکنند. بدین ترتیب جدا کردن این الکترونها از اتم سختتر خواهد بود. رابطه شعاع اتمی و انرژی یونش با معادله زیر مشخص میشود.
در این رابطه، شعاع اتمی، عدد کوانتومی اصلی لایه ظرفیت و شعاع اتمی است.
الکترون خواهی و شعاع اتمی در جدول تناوبی
الکترونخواهی و شعاع اتمی، رابطهای معکوس دارند. الکترونخواهی توانایی یک اتم برای دریافت الکترون است. این پارامتر مقدار کوانتیده انرژی است که در اثر افزودن یک الکترون به اتم گازی و خنثی اتفاق میافتد. با افزایش شعاع اتمی، افزودن الکترون به اتم سختتر بوده و الکترونخواهی کاهش مییابد. در مقابل، هرچه شعاع اتمی کاهش یابد، مقدار الکترونخواهی اتم افزایش یافته و راحتتر میتوان به آن الکترون افزود.
هرچه فاصله الکترونهای منفی با هستهی مثبت اتم بیشتر باشد، مقدار جاذبه بین آنها کمتر و تمایل آن به دریافت الکترون کمتر خواهد بود. این ویژگی با الکترونگاتیوی متفاوت است. الکترونگاتیوی تمایل ذاتی اتم برای جذب الکترون است اما الکترونخواهی مقدار انرژی تغییر کرده در اثر افزودن یک الکترون به اتم است.
رابطه شعاع اتمی و طول پیوند
در این مطلب از مجله فرادرس آموختیم روند تغییر شعاع اتمی در جدل تناوبی چگونه است. مقدار طول پیوند در مولکولها به طور تقریبی با جمع شعاع اتمی عناصر برابر است. این مقدار با توجه به مرتبه پیوند و اثرات هیبریداسیون تغییر میکند. به طور کلی، هرچه شعاع اتمی بزرگتر باشد، فاصله هستهها در پیوند نیز بیشتر شده و طول پیوند افزایش مییابد. به عنوان مثال، در یک پیوند کووالانسی بین دو اتم مشابه، طول پیوند تقریبا برابر با دو برابر شعاع کووالانسی هر اتم است.
در پیوندهای بین اتمهای متفاوت نیز، طول پیوند تقریبا مجموع شعاعهای اتمی دو اتم را نشان میدهد. بنابراین، روند تغییرات شعاع اتمی در جدول تناوبی به طور مستقیم بر طول پیوندهای شیمیایی تاثیر میگذارد و اتمهای با شعاع کوچکتر معمولا پیوندهای کوتاهتر و قویتری تشکیل میدهند، در حالی که اتمهای با شعاع بزرگتر، پیوندهای طولانیتر و ضعیفتری ایجاد میکنند.
source
