بازده درصدی مقدار نسبت بازده عملی به بازده نظری واکنش را نشان میدهد. این پارامتر، جرم فرآورده به دست آمده از واکنش واقعی انجام شده را بر مقدار جرم فرآورده محاسبه شده تئوری بر حسب درصد به دست میآورد. به کمک بازده درصدی میتوان با تغییر پارامترهای تاثیرگذار بر واکنش، بیشترین مقدار فرآورده را به وسیله واکنشدهندههای موجود تولید کرد. در این مطلب از مجله فرادرس میآموزیم بازده درصدی چیست، چگونه محاسبه میشود و چه کاربردهایی دارد.
آنچه در این مطلب میآموزید:
-
میآموزید بازده درصدی چیست و چگونه محاسبه میشود.
-
با فرمول بازده درصدی و مفاهیم بازده عملی و نظری آشنا میشوید.
-
میتوانید در مسائل استوکیومتری، واکنش دهنده محدودکننده و اضافی را تعیین کنید.
-
عوامل تاثیرگذار بر بازده واکنش شیمیایی را میشناسید.
-
با کاربردهای بازده درصدی در صنایع مختلف آشنا میشوید.
-
با حل تمرینهای مختلف میتوانید به خوبی روش محاسبه بازده درصدی را بیاموزید.

در ابتدای این مطلب میآموزیم بازده درصدی چیست و فرمول آن کدام است. سپس با روش محاسبه این پارامتر آشنا شده و روش یافتن واکنشدهنده محدودکننده و اضافی را میآموزیم. در ادامه، عوامل تاثیرگذار بر این پارامتر و کاربردهای این پارامتر در صنایع مختلف را یاد میگیریم. در نهایت با حل تمرینهایی میتوانیم به خوبی بر مسائل بازده درصدی مسلط شویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید بازده درصدی چیست.
بازده درصدی چیست؟
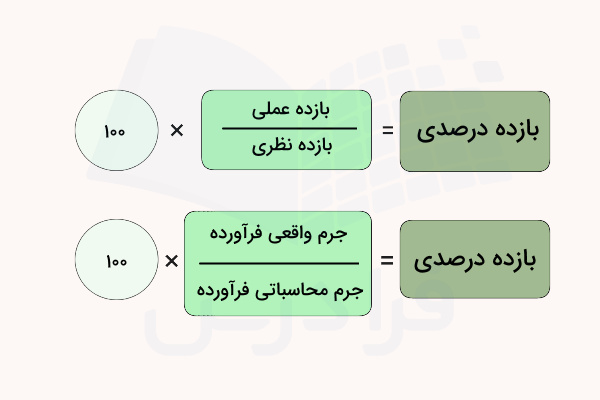
«بازده درصدی» (Percent Yield) ، نسبت مقدار «بازده عملی» (Actual Yield) را به «بازده نظری» (Theoretical Yield) واکنش بر حسب درصد بیان میکند. عبارت بازده عملی، مقدار فرآورده واقعی تولید شده در یک واکنش شیمیایی است. مفهوم بازده نظری، مقدار فرآورده تولید شده طی محاسبات بر حسب واکنشدهنده محدودکننده است.
به بیان دیگر، بازده نظری مقدار فرآوردهای است که در صورت ایدهآل بودن شرایط واکنش و بر حسب محاسبات روی کاغذ به دست میآوریم. این مقدار فرآورده بسته به مقدار واکنشدهندهها و واکنشدهنده محدودکننده تعیین میشود. در مقابل بازده عملی مقدار فرآوردهای است که طی انجام واکنش شیمیایی جداسازی شده و وزن میشود و همواره مقدار آن از محاسبات کمتر است زیرا هیچ واکنشی با بازده ۱۰۰ درصد انجام نمیشود.
نقش بازده در واکنشهای شیمیایی تعیین نسبت این دو بازده و مقدار بهینه بودن واکنش شیمیایی است.
فرمول بازده درصدی چیست؟
فرمول محاسبه بازده درصدی، تقسیم مقدار بازده عملی بر بازده نظری ضرب در عدد ۱۰۰ است. مقدار بازده عملی و نظری معمولا بر حسب گرم فرآورده تولید شده بیان میشوند. فرمول محاسبه بازده درصدی در ادامه نوشته شده است.
بازده درصدی = بازده عملی ÷ بازده نظری × ۱۰۰
برای مثال، تصور کنید یک واکنش شیمیایی بازده نظری ۱۰ گرم و بازده عملی ۸ گرم را دارد. طبق محاسبات زیر، مقدار بازده آن برابر با ٪۸۰ است.
این بدین معنی است که مقدار فرآوردهای که باید طبق محاسبات انجام شده به دست میآمده ۱۰ گرم بوده اما مقدار فرآوردهای که پس از انجام واکنش شیمیایی وزن شده، ۸ گرم بوده است.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر اینکه مفهوم بازده درصدی چیست، ابتدا باید با مفاهیمی چون واکنش شیمیایی، کسرهای تبدیل استوکیومتری، انواع بازده و موازنه واکنش شیمیایی آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم و مسائل، به مجموعه فیلم آموزش دروس پایه یازدهم فرادرس بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه بازده درصدی دسترسی داشته باشید.
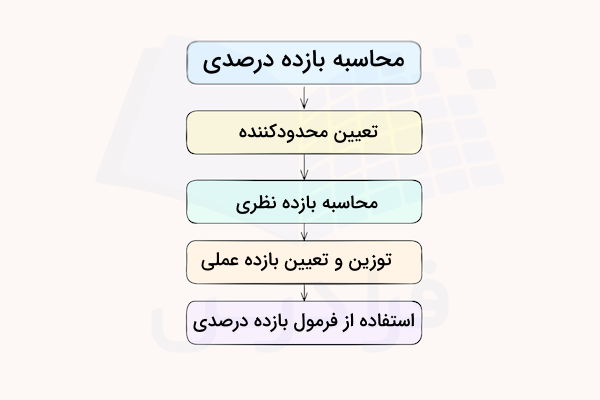
روش محاسبه بازده درصدی
برای محاسبه بازده درصدی یک واکنش باید چند قدم اصلی را انجام دهیم.
- محاسبه بازده نظری: برای محاسبه بازده نظری از محاسبات استوکیومتری برای به دست آوردن جرم یا حجم فرآورده تولید شده استفاده میشود. مقدار فرآورده در این مرحله باید با استفاده از مول ماده محدودکننده محاسبه شود.
- محاسبه بازده عملی: برای محاسبه بازده عملی از جداسازی و اندازهگیری مقدار فرآورده تولید شده در واکنش واقعی استفاده میشود.
- محاسبه بازده درصدی: با تقسیم مقادیر به دست آمده بازده عملی و نظری و ضرب در عدد ۱۰۰، مقدار بازده درصدی به دست میآید.
در ادامه برای درک بهتر روش محاسبه بازده درصدی، به مثالهای زیر دقت کنید.
مثال ۱
با توجه به واکنش شیمیایی زیر، بازده واکنش را با ۵ مول هیدروژن و مقدار اضافی اکسیژن محاسبه کنید. مقدار آب تولید شده ۳۶ گرم است.
پاسخ
برای محاسبه بازده درصدی، ابتدا بازده نظری را با استفاده از هیدروژن محاسبه میکنیم. برای این کار با استفاده از روابط استوکیومتری، مقدار گرم آب تولید شده را به وسیله مول هیدروژن، نسبت مولی هیدروژن و آب (۱:۱) و جرم مولی آب به دست میآوریم.
در قدم دوم باید مقدار بازده عملی را به دست آوریم. مقدار بازده عملی توسط صورت سوال برابر با ۳۶ گرم آب تعیین شده است. در نهایت با استفاده از فرمول بازده درصدی و تقسیم بازده عملی بر بازده نظری، مقدار بازده محاسبه میشود.
مثال ۲
مقدار بازده واکنش در صورتی که ۱۰٫۶۸ گرم گوگرد با واکنش دادن ۱۲٫۶ گرم دی هیدروژن سولفید و ۱۴٫۶ گرم گوگرد دی اکسید طی واکنش زیر تولید شده باشد را محاسبه کنید.
پاسخ
برای محاسبه بازده در واکنش زیر ابتدا باید واکنشدهنده محدودکننده و اضافی را به دست آوریم زیرا در صورت سوال جرم هر دو واکنشدهنده ذکر شده است. برای این کار، ابتدا مقدار مول هر دو واکنشدهنده را با استفاده از جرم مولی آنها به دست آورده و با استفاده از نسبت مولی آنها با فرآورده، مقدار فرآورده تولید شده حاصل از جرم هر یک را به دست میآوریم.
پس دی هیدروژن سولفید واکنشدهنده محدودکننده است و مقدار جرم گوگرد تولید شده از آن را محاسبه میکنیم.
در نهایت با تقسیم مقدار جرم گوگرد تولید شده واقعی (بازه نظری) بر این مقدار، بازده واکنش به دست میآید.

مثال ۳
یک شیمیدان مقدار ۳۰٫۵ گرم روی را با نیتریک اسید اضافی واکنش میدهد تا ۶۵٫۲ گرم روی نیترات طی واکنش زیر به دست آید. مقدار بازده درصدی این واکنش چقدر است؟
پاسخ
برای به دست آوردن مقدار بازده واکنش، ابتدا بازده نظری واکنش را با استفاده از مقادیر داده شده به دست میآوریم. مقدار بازده نظری، مقدار فرآورده تولید شده حاصل از ۳۰٫۵ گرم روی است. با استفاده از جرم مولی روی، ضرایب استوکیومتری و جرم مولی نیترات روی، بازده نظری به دست میآید.
مقدار بازده نظری این واکنش برابر با ۸۸٫۳ گرم است. حال برای محاسبه بازده درصدی، ۶۵٫۲ گرم روی نیترات (بازده عملی) را بر این مقدار تقسیم کرده و در عدد ۱۰۰ ضرب میکنیم.
واکنش دهنده محدودکننده و اضافی
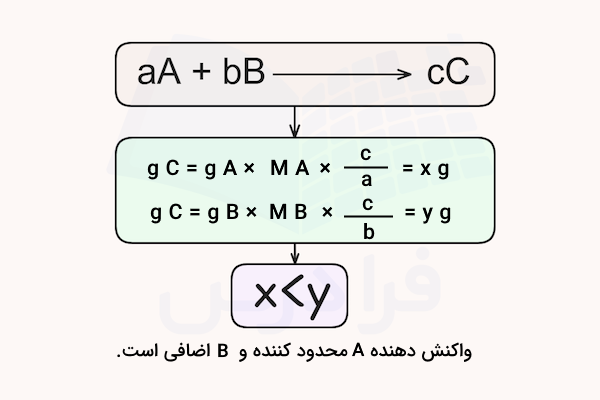
در بیشتر موارد، واکنشدهندهها در نسبتهای مولی حضور دارند که با نسبت ضرایب در معادله موازنهشده واکنش یکسان نیست. در نتیجه، یک یا چند واکنشدهنده به طور کامل مصرف نمیشوند و در پایان واکنش مقداری از آنها باقی میماند.
در چنین شرایطی، مقدار محصولی که میتوان به دست آورد تنها توسط مقدار یکی از واکنشدهندهها محدود میشود. واکنشدهندهای که میزان محصول حاصل را محدود میکند «واکنشدهنده محدودکننده» نامیده میشود. واکنشدهندهای که پس از کامل شدن واکنش همچنان باقی میماند، «واکنشدهنده اضافی» است.
تعیین واکنش دهنده محدودکننده و اضافی
برای محاسبه و تشخیص اینکه کدام واکنشدهنده محدودکننده و کدام اضافی است، باید مقدار مول فرآورده حاصل از هریک از واکنشدهندهها را محاسبه کنیم. برای این کار از جرم مولی واکنشدهندهها و نسبت مولی آنها با فرآوردهها (ضرایب استوکیومتری) بهره میگیریم.
باید دقت داشته باشیم که مراحل محاسبه فرآورده و محاسبات استوکیومتری در شیمی همواره باید با استفاده از معادله شیمیایی موازنه شده انجام گیرد. پیشنهاد میکنیم برای درک بهتر این محاسبات و روش موازنه واکنش، فیلم آموزش استوکیومتری در واکنش شیمیایی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مقدار جرم یا مول واکنشدهندههای واکنش معمولا در صورت سوال داده میشود. در غیر این صورت، اگر تنها جرم یا مول یکی از واکنشدهندهها ارائه شده باشد، بدین معنی است که واکنش با فرض کامل بودن و عدم حضور محدودکننده انجام میشود. برای درک بهتر این موارد، به مثال زیر دقت کنید.
مثال
واکنش زیر را در نظر بگیرید.
اگر در این واکنش، ۵۰ گرم آرسنیک و ۵۰ گرم اکسیژن وجود داشته باشد، کدام واکنشدهنده محدودکننده و کدام اضافی است؟ (جرم مولی گاز اکسیژن، ۳۲ گرم بر مول و جرم آرسنیک، ۷۴٫۹۲ گرم بر مول است.)
پاسخ
برای محاسبه واکنشدهنده محدودکننده و اضافی، مقدار مول تولید شده از هر یک را به صورت جداگانه به دست میآوریم.
با توجه به محاسبات بالا، آرسنیک واکنشدهنده محدودکننده و اکسیژن اضافی است. همچنین، میتوانیم مقدار جرم باقی مانده از اکسیژن را با استفاده از محاسبات استوکیومتری و مول فرآورده حاصل از ۵۰ گرم آرسنیک به دست آوریم. این محاسبات به شکل زیر است.
از آنجا که مقدار ۱۶ گرم اکسیژن در واکنش مصرف میشود، ۳۴ گرم از آن پس از انجام واکنش به صورت دست نخورده باقی میماند. پیشنهاد میکنیم برای درک بهتر محاسبه مقدار فرآورده در واکنشهای شیمیایی، مطلب حل مسائل استوکیومتری مجله فرادرس را مطالعه کنید.
عوامل تاثیرگذار بر بازده درصدی
در قسمتهای قبل آموختیم که بازده درصدی باید همواره مقداری کمتر از ۱۰۰ داشته باشد. این بدین دلیل است که هیچ واکنشی در شرایط واقعی آزمایشگاه با بازده ۱۰۰ درصد انجام نمیشود و عوامل مختلفی میتوانند بر مقدار فرآورده تولید شده از واکنش تاثیر بگذارند. در ادامه این عوامل را بررسی میکنیم.

مصرف نشدن کامل واکنشدهنده ها
اگر تمامی واکنشدهندههای موجود به شکل کامل مصرف نشوند، بازده درصدی واکنش کاهش مییابد. این پدیده میتواند به دلیل شرایط مختلف موجود در واکنش مانند دما، فشار یا محیط نامناسب یا کم بودن مقدار واکنشدهنده (محدودکننده) باشد.
واکنش های جانبی
در بعضی از واکنشها، در کنار واکنش اصلی، واکنشهایی جانبی نیز اتفاق میافتد. برای مثال ممکن است یکی از واکنشدهندهها با هوا یا رطوبت واکنش داده و مقداری از آن مصرف شود. در نتیجه، واکنشدهنده کمتری برای تولید فرآورده وجود خواهد داشت و بازده واکنش کاهش مییابد.
از دست رفتن فرآورده
برخی از فرآوردههای واکنش ممکن است طی انجام واکنش ریخته شوند یا به دیواره ظرف بچسبند. همچنین، برخی از مواد میتوانند طی انجام واکنش تجزیه شوند. تمامی این موارد میتوانند باعث کاهش مقدار فرآورده و کاهش بازده درصدی واکنش شوند.
خطاهای آزمایشگاهی
انجام اشتباهات محاسباتی در انجام واکنش یا بروز خطا در اندازه گیری، توزین و … میتواند منجر به کاهش بازده درصدی شود. اگر در یک واکنش مقدار بازده را بیش از ۱۰۰ درصد به دست آورید نیز ممکن است خطای محاسباتی شکل گرفته باشد. همچنین در برخی از واکنشها که فرآورده دارای آب و رطوبت جذب شده یا ناخالصی باشد نیز ممکن است مقدار بازده درصدی بیش از ۱۰۰ درصد به دست آید.
کاربرد بازده درصدی
بازده درصدی کاربردهای بسیاری در آزمایشگاه و تولیدات مختلف دارد. برای مثال، صنایع مختلف، علوم محیط زیست و تحقیقات مختلف از بازده درصدی برای محاسبه مقدار بازده فرآیندهای خود و بهبود این فرآیندها استفاده میکنند.
در ادامه این مطلب از مجله فرادرس، برخی از این کاربردها را توضیح میدهیم.
صنایع تولیدی
در صنایع مختلف، بازده درصدی برای بهینهسازی واکنشهای شیمیایی و افزایش بازده فرآوردههای تولیدی، یک پارامتر کلیدی است. برای مثال، از بازده درصدی برای بهینه سازی سنتز مواد موثره دارویی استفاده میشود. همچنین، از این پارامتر در بهینهسازی تولید سوخت، مواد شیمیایی و فرآوردههای نفتی در پتروشیمی استفاده میشود.
محیط زیست
بازده درصدی در محاسبات مربوط به علم محیط زیست مانند مقدار آلایندههای تولید شده و … کاربرد دارد. برای مثال، صنایع مختلف میتوانند با بهینهسازی مقدار بازده فرآیندهای خود، مقدار آلایندههای تولیدشده از فرآیندهای شیمیایی را کاهش دهند.
همچنین، بهبود بازده درصدی واکنشها در مقیاس صنعتی میتواند مقدار اثرات مخرب بر محیط زیست را از طریق کاهش انرژی مورد نیاز، کاهش دهد.

آزمون بازده درصدی
برای درک بهتر مسائل مربوط به محاسبه بازده درصدی، به سوالات زیر پاسخ دهید. در انتها میتوانید با کلیک بر روی گزینه «دریافت نتیجه آزمون»، تعداد پاسخهای صحیح خود را مشاهده کنید.
در یک واکنش، ۲٫۰۵ گرم آمونیاک طی واکنش زیر از ۱۶٫۵ گرم نیتروژن تولید شده است. مقدار بازده درصدی واکنش چقدر است؟
ابتدا بازده نظری واکنش را با استفاده از جرم داده شده برای نیتروژن به شکل زیر محاسبه میکنیم.
سپس بازده درصدی را با تقسیم بازده عملی به بازده نظری به دست میآوریم.
در یک واکنش به شکل زیر، ۱۰ مول نیتروژن و ۱۰ مول هیدروژن وارد واکنش شده و ۱۶ مول آمونیاک تولید شده است. واکنشدهنده محدودکننده و بازده نظری را به دست آورید.
۳۹ گرم و هیدروژن
۱۶۲٫۲ گرم و نیتروژن
۴۹٫۴ گرم و نیتروژن
۱۱۳٫۴ گرم و هیدروژن
برای محاسبه بازده نظری این واکنش ابتدا باید واکنشدهنده محدودکننده را پیدا کنیم. به دلیل اینکه در این سوال مقادیر واکنشدهنده مستقیما بر حسب مول داده شده است، میتوانیم مستقیما با دقت به نسبت مولی مواد، محدودکننده را بیابیم. با توجه به واکنش با مصرف هر مول نیتروژن، ۳ مول هیدروژن باید مصرف شود تا ۲ مول آمونیاک تولید شود.
پس با داشتن ۱۰ مول نیتروژن به ۳۰ مول هیدروژن نیاز داریم و هیدروژن در این واکنش محدودکننده است. با استفاده از مول هیدروژن، بازده نظری را به دست میآوریم.
در واکنش تولید آب، اگر ۴ گرم هیدروژن با ۳۲ گرم اکسیژن واکنش دهد و ۳۲ گرم آب تولید شود، بازده درصدی واکنش چقدر است؟
برای حل این سوال ابتدا واکنشدهنده محدودکننده را تعیین میکنیم.
پس هیدروژن محدودکننده است. حال با استفاده از مول هیدروژن بازده نظری را به دست آورده و در فرمول بازده درصدی قرار میدهیم تا مقدار آن تعیین شود.
در واکنش سوختن منیزیم اگر ۱۲ گرم منیزیم در حضور اکسیژن بسوزد و ۱۸ گرم اکسید منیزیم تولید شود، بازده درصدی آن چقدر است؟
ابتدا بازده نظری را با استفاده از جرم منیزیم به دست میآوریم. سپس از فرمول بازده درصدی استفاده میکنیم.
در واکنش تجزیه کلسیم کربنات، ۱۰۰ گرم از این ماده حرارت داده شده و ۳۶ گرم کربن دی اکسید جمعآوری میشود. بازده درصدی این واکنش را حساب کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
در واکنش کلرینه کردن آلومینیوم مطابق زیر، ۱۳٫۵ گرم آلومینیوم با ۷۱ گرم کلر واکنش میدهد و ۶۰ گرم آلومینیوم کلرید به دست میآید. بازده درصدی این واکنش را حساب کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
در واکنش اکسیداسیون آهن، ۵۰ گرم آهن با ۲۰ گرم اکسیژن واکنش میدهد و ۵۰ گرم اکسید آهن به دست میآید. واکنشدهنده محدودکننده و بازده درصدی را مشخص کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
در واکنش اکسیداسیون مس ۳۰ گرم مس با ۱۰ گرم اکسیژن واکنش داده و ۳۵ گرم اکسید مس تولید میشود. بازده درصدی را حساب کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
در واکنش سنتز سولفید روی، ۲۰ گرم روی با ۵ گرم گوگرد واکنش میدهد و ۱۲ گرم سولفید روی به دست میآید. بازده درصدی چقدر است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
در واکنش زیر، ۵۰ گرم پتاسیم پرکلرات حرارت داده میشود و ۱۸ گرم اکسیژن جمع آوری میشود. بازده درصدی واکنش را به دست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
