شیمی دوازدهم یکی از مهمترین دروس مقطع متوسطه دوم در رشتههای ریاضی و تجربی است و در کنکور نیز از مباحث پراهمیت به شمار میرود. در این پایه، مباحثی مانند اسیدها و بازها، انتقال الکترون و الکتروشیمی، انواع مواد و تعادل شیمیایی مورد بررسی قرار میگیرد. حل تمرینها و مسائل بخش «خود را بیازمایید» از شیمی دوازدهم، یکی از مهمترین گامها در درک بهتر مفاهیم این درس است. در این مطلب از مجله فرادرس به بررسی سوالات بخش خود را بیازمایید این کتاب و شرح پاسخ آنها میپردازیم.
آنچه در این مطلب میآموزید:
-
روش پاسخدهی به تمام سوالات خود را بیازمایید شیمی دوازدهم را میآموزید.
-
با نکات مهم و مفاهیم ارائه شده در شیمی این پایه آشنا میشوید.
-
واکنشها و نیمواکنشهای اکسایش – کاهش، عدد اکسایش و موازنه آنها را میآموزید.
-
دلایل و کاربرد محاسبه pH، ثابت تعادل و عوامل موثر بر تعادل را میآموزید.
-
اصول سینتیک شیمیایی و عوامل موثر بر سرعت واکنشها را بررسی میکنید.
-
یاد میگیرید آرایش الکترونی عناصر و تغییرات خواص آنها را پیشبینی کنید.

در این مطلب به بررسی و پاسخ تمامی سوالات خود را بیازمایید شیمی دوازدهم پرداخته و مطالب و آموزشهای مهم در هر بخش را توضیح میدهیم. سپس، سوالات خود را بیازمایید به تفکیک صفحه مشخص شده و پاسخ آنها نوشته شده است. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل سوالات خود را بیازمایید شیمی دوازدهم را تمرین کرده و یاد بگیرید.
خود را بیازمایید شیمی دوازدهم
در کتاب شیمی پایه دوازدهم به مسائل مهمی مانند ساختار مواد صابونی و اسیدها و بازها، محاسبه pH، ثابت تعادل، فرآیند یونش و مباحث الکتروشیمی مانند واکنشهای اکسایش – کاهش و موازنه آنها پرداخته میشود. در ادامه با بررسی مسائل خود را بیازمایید شیمی دوازدهم و پاسخ به آنها، به شکلی کامل با این مباحث آشنا میشویم.
خود را بیازمایید شیمی دوازدهم صفحه ۲
نمودار زیر توزیع جمعیت جهان را بر اساس امید به زندگی آنها در دورههای زمانی گوناگون نشان میدهد.

- با توجه به نمودار، جدول زیر را برای گستره سنی ۴۰ تا ۵۰ سالگی کامل کنید.
- در دوره زمانی ۱۳۴۵ تا ۱۳۵۰، امید به زندگی برای بیشتر مردم جهان حدود چند سال است؟
- در دوره زمانی ۱۳۷۰ تا ۱۳۷۵ امید به زندگی برای بیشتر مردم جهان در حدود چند سال است؟
- با گذشت زمان، امید به زندگی در سطح جهان افزایش یافته است یا کاهش؟ توضیح دهید.
- امروزه امید به زندگی برای بیشتر مردم جهان در حدود چند سال است؟
پاسخ
با توجه به نمودار و یافتن اطلاعات داده شده، میتوانیم پاسخ سوالات را بیابیم. پاسخ قسمت آ به شکل زیر است.
| دوره زمانی | درصد جمعیت |
| ۱۳۳۰ تا ۱۳۳۵ | حدود ٪ ۳۰ |
| ۱۳۶۵ تا ۱۳۷۰ | حدود ٪ ۵ |
| ۱۳۹۰ تا ۱۳۹۵ | حدود ٪ ۲ |
در دورههای جدیدتر، درصد جمعیت در بازه ۴۰ تا ۵۰ سال بسیار کاهش یافته چون بیشتر مردم از این سن عبور کردهاند و به گروههای سنی بالاتر وارد شدهاند.
برای پاسخ به باقی سوالات نیز به نمودار استناد میکنیم. بر اساس نمودار، در دوره زمانی ۱۳۴۵ تا ۱۳۵۰، اکثر جمعیت در بازه میانگین ۵۵ سال هستند که با رنگ آبی مشخص شده است. در بازه زمانی ۱۳۷۰ تا ۱۳۷۵، بیشترین جمعیت در بازه ۶۰ تا ۷۰ سال (بنفش) هستند.
امید به زندگی در این نمودار با گذشت زمان در سطح جهانی افزایش یافته است. در دورههای قدیمیتر بیشتر مردم در بازههای زیر ۶۰ سال بودهاند ولی در دورههای پایانی این نمودار بخش زیادی از جمعیت به سنین ۷۰ تا ۸۰ سال و حتی بالای ۸۰ سال رسیدهاند. در آخرین ستون (۱۳۹۵ تا ۱۳۹۰)، بیشتر جمعیت در بازه ۷۰ تا ۸۰ سال (نارنجی) قرار دارند پس امروزه امید به زندگی حدود ۷۵ سال است.
خود را بیازمایید شیمی دوازدهم صفحه ۴
جدول زیر را کامل کنید و در هر مورد دلیل انتخاب خود را توضیح دهید.
| نام ماده | فرمول شیمیایی | محلول در آب یا هگزان |
| اتیلن گلیکول (ضدیخ) | آب | |
| نمک خوراکی | آب | |
| بنزین | هگزان | |
| اوره | آب | |
| روغن زیتون | هگزان | |
| وازلین | هگزان |
پاسخ
برای کامل کردن این جدول، باید بدانیم که هر ماده قطبی است یا ناقطبی، زیرا آب یک حلال قطبی است و مواد قطبی یا یونی را بهتر در خود حل میکند و هگزان یک حلال ناقطبی است و مواد ناقطبی را بهتر در خود حل میکند.
موادی مانند ضدیخ (گلیکول اتیلن)، نمک و اوره در آب حل میشوند چون این مواد دارای ساختار قطبی یا یونی هستند و میتوانند با مولکولهای قطبی آب پیوند برقرار کنند. در مقابل، وازلین، بنزین و روغن زیتون در هگزان حل میشوند چون همگی ناقطبی هستند و در حلال ناقطبی مانند هگزان بهخوبی حل میگردند.
ضدیخ به دلیل داشتن گروه هیدروکسید، نمک به دلیل یونی بودن و اوره به دلیل پیوند هیدروژنی به راحتی در آب حل میشوند. پیشنهاد میکنیم برای درک بهتر این موضوع، مطلب انحلالپذیری مواد در آب را مطالعه کنید.
یادگیری شیمی دوازدهم با فرادرس
برای پاسخ صحیح به سوالات خود را بیازمایید شیمی دوازدهم نیاز است ابتدا با مفاهیمی چون تعادل شیمیایی، خواص صابونی مواد، الکتروشیمی و سلولهای الکترولیتی و … آشنا شویم. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازدهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه جواب خود را بیازمایید شیمی دوازدهم دسترسی داشته باشید.
خود را بیازمایید شیمی دوازدهم صفحه ۷
در این سوال در مورد خواص مواد در مخلوطها و نوع مخلوطهای همگن و ناهمگن سوال پرسیده میشود. در ادامه، پاسخ خود را بیازمایید شیمی دوازدهم صفحه ۷ را بررسی میکنیم.
سوال ۱
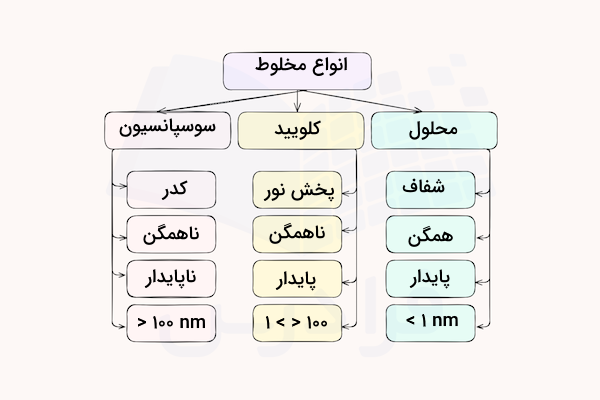
در جدول زیر برخی ویژگیهای کلوئید با مخلوطهای دیگر مقایسه شده است. آن را کامل کنید.
| ویژگی/ نوع مخلوط | سوسپانسیون | کلوئید | محلول |
| رفتار در برابر نور | نور را پخش میکند. | پخش نور (اثر تیندال) | عبور نور (شفاف) |
| همگن بودن | ناهمگن | ناهمگن | همگن |
| پایداری | ناپایدار (تهنشینی) | پایدار (تهنشین نمیشود.) | پایدار |
| ذرههای سازنده | ذرههای نسبتا ریز ماده | ذرههایی مولکولی یا یونی با اندازه متوسط | یون یا مولکول بسیار ریز |
پاسخ
با توجه به توضیحات زیر جدول را کامل میکنیم.
- پخش نور: در سوسپانسیون و کلوئید، نور پخش میشود، اما در محلول نور بهراحتی از میان آن عبور میکند و محلول شفاف به نظر میرسد. ذرات ریز کلوییدی نور را پراکنده میکنند و اثر تیندال را از خود نشان میدهند.
- همگن بودن و پایداری: سوسپانسیون ناهمگن است و ذرات بزرگی دارد که ته نشین میشوند. کلوئید ظاهری همگن دارد اما میتواند با سپری شدن زمان تهنشین شود. محلول کاملا همگن است و پس از گذشت زمان، پایدار باقی میماند.
- اندازه ذرات: ذرات سوسپانسیون نسبت به محلول و کلوئید بزرگتر هستند و بیش از ۱۰۰ نانومتر قطر دارند. اندزه ذرات کلویید بین ۱ تا ۱۰۰ نانومتر است و اندازه ذرات محلول کمتر از ۱ نانومتر است. در کتاب شیمی دوازدهم برای سوسپانیون اندازه ذرات زیر ذکر شده است. با این حال این ذرات ریز از ذرات کلویید و محلول درشتتر هستند.
سوال ۲
درباره جمله زیر گفتوگو کنید. رفتار کلوئیدها را میتوان رفتاری بین سوسپانسیون و محلولها در نظر گرفت.
پاسخ
این جمله صحیح است. کلوییدها اندازه ذراتی بین محلولها و سوسپانسیونها را دارند. این مخلوطها ظاهری همگن مانند محلول را دارند و میتوانند با گذشت زمان یا با افزودن برخی از مواد، مانند سوسپانسیونها تهنشین شوند. ذرات این مواد مانند سوسپانسیونها نور را از خود عبور میدهند و میتوانند کاملا کدر نباشند. ذرات موجود در کلوییدها را مانند محلولها نمیتوان با فیلتراسیون جداسازی کرد.
خود را بیازمایید شیمی دوازدهم صفحه ۹
دانشآموزی برای مقایسه قدرت پاککنندگی دو نوع صابون، کاوشی انجام داد. او از دو نوع صابون برای پاک کردن لکه چربی یکسان از روی دو نوع پارچه استفاده و نتایج آزمایش خود را در جدول زیر یادداشت کرد. با توجه به جدول به پرسشها پاسخ دهید.
| نوع صابون و نوع پارچه | دما (درجه سانتیگراد) | درصد لکه باقیمانده |
| صابون بدون آنزیم – نخی | ۳۰ | ۲۵ |
| صابون بدون آنزیم – نخی | ۴۰ | ۱۵ |
| صابون آنزیمدار – نخی | ۳۰ | ۱۰ |
| صابون آنزیمدار – نخی | ۴۰ | ۰ |
| صابون آنزیمدار – پلی استر | ۴۰ | ۱۵ |
سوالات آ، ب و پ:
- دما چه اثری بر قدرت پاککنندگی صابون دارد؟
- قدرت پاککنندگی صابون با افزودن آنزیم چه تغییری میکند؟
- آیا میزان چسبندگی لکههای چربی روی پارچههای گوناگون یکسان است؟ از کدام داده جدول چنین نتیجهای به دست میآید؟
پاسخ
با توجه به دادههای جدول به سوالات پاسخ میدهیم.
- با افزایش دما، مولکولهای آب و صابون فعالتر میشوند و توانایی حل کردن و جدا کردن چربیها افزایش مییابد. بنابراین، قدرت پاککنندگی صابون با افزایش دما بیشتر میشود.
- افزودن آنزیمها باعث تجزیه بهتر لکهها و چربیها میشود و در نتیجه قدرت پاککنندگی صابون افزایش مییابد.
- خیر، میزان چسبندگی چربیها روی پارچههای مختلف یکسان نیست. بعضی پارچهها چربی را بیشتر جذب کرده و نگه میدارند. این مورد را میتوان از تفاوت درصد لکه باقیمانده روی پارچه نخی و پلیاستر در دمای ۴۰ درجه نتیجه گرفت.
خود را بیازمایید شیمی دوازدهم صفحه ۱۱
شکل زیر فرمول ساختاری و مدل فضا پرکن را برای نوعی پاککننده غیرصابونی نشان میدهد. با توجه به آن به پرسشها پاسخ دهید.
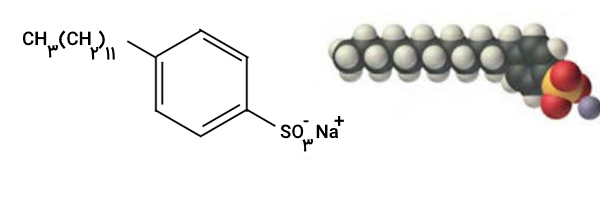
- بخشهای آب دوست و آبگریز آن را مشخص کنید.
- شباهتها و تفاوتهای این ماده را با صابون بنویسید.
- توضیح دهید که چگونه این ماده لکههای چربی را هنگام شستوشو با آب از بین میبرد.
پاسخ
قسمت کربنی (آلی) روی حلقه قسمت آبگریز و قسمت یونی آن قسمت آبدوست این شوینده است.
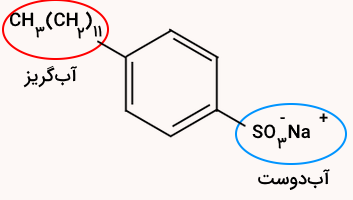
هردوی این مولکولها دارای بخش آبدوست (قطبی) و آبگریز (غیرقطبی) هستند و هردو برای پاک کردن چربی و لکهها استفاده میشوند. صابون معمولا از ترکیب چربی با برخی از مواد به صورت طبیعی تولید میشوند در حالی که پاک کنندههای غیر صابونی محصول سنتزی هستند که معمولا دارای گروه سولفونات هستند. صابون در آب سخت بهراحتی رسوب میدهد (تشکیل کف صابون نامحلول با یونهای کلسیم و منیزیم)، اما بسیاری از پاککنندههای غیرصابونی در آب سخت نیز کارایی خوبی دارند و رسوب نمیدهند.
مولکول پاککننده غیرصابونی دارای دو بخش است. بخش چربیدوست (غیرقطبی) که با مولکولهای چربی ترکیب میشود و به داخل لکه نفوذ میکند و بخش آبدوست (قطبی یا یونی) که در آب حل میشود و باعث میشود مولکولهای چربی به کمک مولکول پاککننده از سطح پارچه جدا شده و در آب پخش شوند. بدین صورت این ماده لکههای چربی را هنگام شستوشو با آب از بین میبرد.
خود را بیازمایید شیمی دوازدهم صفحه ۱۶
این خود را بیازمایید در کتاب شیمی دوازدهم به طرح سوال از اسید و باز آرنیوس و تمرین نوشتن معادله واکنش اسیدها و بازها با آب میپردازد. در ادامه قسمتهای مختلف جواب خود را بیازمایید شیمی دوازدهم صفحه ۱۶ را بررسی میکنیم.
سوال ۱
برخی اکسیدها با آب واکنش میدهند. با توجه به شکل زیر مشخص کنید اکسیدی که وارد آب میشود، اسید آرنیوس است یا باز آرنیوس؟ چرا؟
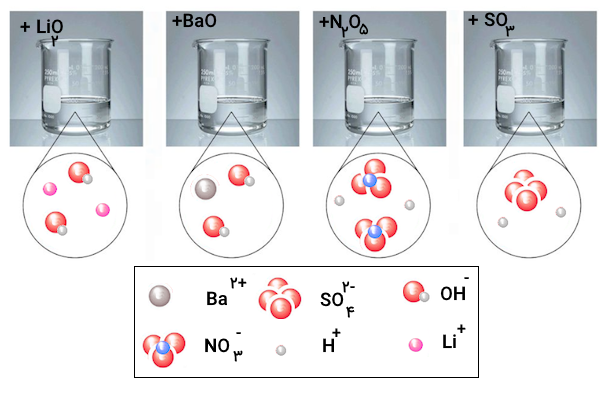
پاسخ
اسید آرنیوس اسیدی است که در آب یون هیدروژن آزاد میکند و باز آرنیوس مادهای است که در آب یون هیدروکسید آزاد میکند. با توجه به تصاویر، تصویر اول و دوم از سمت چپ در آب یون هیدروکسید آزاد کرده و باز آرنیوس هستند. همچنین، دو تصویر سمت راست در آب یون هیدروژن آزاد کرده و اسید آرنیوس هستند.
سوال ۲
معادله شیمیایی واكنش هر یک از این اكسیدها را با آب بنویسید و موازنه كنید.
پاسخ
تصویر اول از سمت چپ:
تصویر دوم از سمت چپ:
تصویر سوم از سمت چپ:
تصویر چهارم از سمت چپ:
سوال ۳
جدول زیر را كامل كنید.
| نام ترکیب شیمیایی | فرمول شیمیایی | نوع اکسید | رنگ کاغذ pH در محلول |
| گوگرد تری اکسید | اسیدی | قرمز | |
| کربن دی اکسید | اسیدی | قرمز | |
| کلسیم اکسید | بازی | آبی | |
| سدیم اکسید | بازی | آبی |
پاسخ
برای نوشتن فرمول شیمیایی مواد باید نام عناصر شیمیایی آنها را نوشته و تعداد عناصر را به صورت زیروند در جلوی نماد شیمیایی عناصر قرار دهیم. عبارات «مونو، دی، تری، تترا و …» نمایانگر تعداد عناصر هستند. بنابراین ترکیب گوگرد تری اکسید یک گوگرد و ۳ اکسیژن خواهد داشت و نشاندهنده یک کربن و دو (دی) اکسیژن است. همچنین، ترکیبات یونی با نوشتن ابتدا نام کاتیون و سپس آنیون به همراه پسوند «-ید» نوشته میشوند.
اکسیدهای فلزی مانند کلسیم و سدیم اکسید بازی هستند و رنگ کاغذ لیتموس را به قرمز تغییر میدهند. در مقابل، اکسیدهای غیرفلزی اسیدی هستند و رنگ کاغذ لیتموس را به آبی تغییر میدهند.
خود را بیازمایید شیمی دوازدهم صفحه ۱۷
در این سوال، نحوه انحلال ترکیبات یونی و مولکولی در آب بررسی میشود.
سوال ۱
با توجه به شکل زیر، معادله انحلال یونی سدیم کلرید را بنویسید.
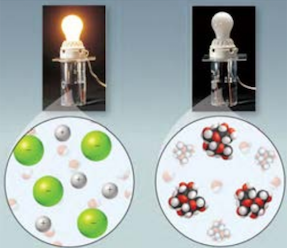
پاسخ
معادله انحلال یونی سدیم کلرید به شکل زیر است.
سوال ۲
در معادله انحلال هر یک از ترکیبهای یونی زیر، جاهای خالی را پر کنید.
پاسخ
معادله انحلال یونی معادله شیمیایی است که جدا شدن یونهای ترکیب یونی در آب را نمایش میدهد. برای نوشتن آن باید یونها را به صورت جداگانه به همراه تعداد آنها به صورت ضریب استوکیومتری قبل از نماد یون بنویسیم. در حالت عکس برای نوشتن فرآورده، ابتدا کاتیون سپس تعداد آن به صورت زیروند در جلوی نماد کاتیون و سپس آنیون به همین ترتیب نوشته میشود.
خود را بیازمایید شیمی دوازدهم صفحه ۱۹
در این سوال به معادله تفکیک اسید و باز در آب و محاسبه درصد یونش پرداخته میشود. درصد یونش اسید و باز، غلظت یونهای حاصل از تفکیک آنها را نسبت به غلظت ماده تفکیک نشده مشخص میکند.
سوال ۱
اسید نیتریک، یک اسید قوی است. در محلول ۰٫۲ مولار این اسید، غلظت یونهای هیدرونیوم و نیترات را با دلیل پیشبینی کنید.
پاسخ
اسید نیتریک یک اسید قوی است و به شکل کامل در آب تفکیک میشود. یعنی تمامی اسید نیتریک اولیه، طبقه معادله واکنش زیر به یونهای هیدرونیوم و نیترات تبدیل میشوند.
بنابراین، از تفکیک ۰٫۲ مول اسید نیتریک، ۰٫۲ مول یون نیترات و ۰٫۲ مول یون هیدرونیوم تولید میشود.
سوال ۲
اگر در محلول ۰٫۱ مولار استیک اسید ()، غلظت یون هیدرونیوم برابر با مول بر لیتر باشد، معادله یونش استیک اسید را نوشته و درصد یونش آن را حساب کنید.
پاسخ
استیک اسید یک اسید ضعیف است و در آب به صورت ناقص تفکیک میشود. معادله یونش این اسید در آب به شکل زیر است.
برای محاسبه درصد یونش، از فرمول درصد یونش به شکل زیر استفاده کرده و مقادیر غلظت اولیه استیک اسید و یون هیدرونیوم را در آن قرار میدهیم تا درصد یونش محاسبه شود.
درصد یونش استیک اسید = غلظت یونهای تفکیک شده ÷ غلظت اولیه ماده × ۱۰۰
پیشنهاد میکنیم برای یادگیری بیشتر در مورد فرمول درصد یونش و سایر مفاهیم شیمی دوازدهم، مطلب فرمول های شیمی دوازدهم در یک نگاه مجله فرادرس را مطالعه کنید.
خود را بیازمایید شیمی دوازدهم صفحه ۲۴
در این سوال به بررسی تفکیک اسید و باز در آب و محاسبه ثابت یونش آنها پرداخته میشود. ثابت یونش اسید و باز، نسبت حاصلضرب غلظت تعادلی یونهای موجود در محلول را به غلظت تعادلی اسید یا باز نشان میدهد.
سوال ۱
شکلهای زیر واکنش دو قطعه نوار منیزیم یکسان را با محلول دو اسید متفاوت در دما و غلظت یکسان نشان میدهد.

به سوالات زیر پاسخ دهید.
- سرعت کدام واکنش بیشتر است و چرا؟
- غلظت یون هیدرونیوم در محلول کدام اسید بیشتر است و چرا؟
- اگر ثابت یونش یک اسید و دیگری باشد، ثابت یونش این دو اسید را با یکدیگر مقایسه کنید و پاسخ خود را توضیح دهید.
پاسخ
پاسخ سوالات بالا به شکل زیر است.
- سرعت واکنشی که حبابهای بیشتری تولید میکند (الف)، بالاتر است. زیرا سرعت واکنش به تعداد یونهای هیدروژن و قدرت اسید بستگی دارد در نتیجه در ظرف الف که حباب بیشتری تولید کرده سرعت بیشتر است.
- غلظت یون هیدرونیوم در محلولی که اسید قوی تری دارد (الف) بیشتر است.
- هرچه اسید قویتر باشد، ثابت یونش آن نیز بیشتر است پس نسبت به مقدار بیشتری خواهد داشت.
پیشنهاد میکنیم برای درک بهتر فرمول ثابت یونش و مفاهیم مربوط به آن، فیلم آموزش ثابت یونش شیمی (دوازدهم) فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
سوال ۲
باران اسیدی حاوی اسید نیتریک و اسید سولفوریک است در حالی که باران معمولی حاوی کربنیک اسید است. با مراجعه به جدول صفحه ۲۳، توضیح دهید در کدام باران غلظت یون هیدرونیوم بیشتر است؟ چرا؟ (ثابت یونش کربنیک اسید را در نظر بگیرید.
پاسخ
غلظت یون هیدرونیوم در باران اسیدی بیشتر است. زیرا اسید نیتریک و اسید سولفوریک اسیدهایی قوی هستد و در آب تقریبا به طور کامل یونش پیدا میکنند و یون هیدرونیوم زیادی تولید میکنند. در مقابل، کربنیک اسید یک اسید ضعیف است و به صورت جزئی تفکیک شده و یون هیدرونیوم زیادی تولید نمیکند. ضعیف بودن کربنیک اسید را با توجه به مقدار بسیار کم ثابت یونش آن نتیجه میگیریم.
خود را بیازمایید شیمی دوازدهم صفحه ۲۸
این سوال به نحوه محاسبه pH، غلظت یون هیدروکسید و هیدرونیوم و ثابت یونش اسید و باز میپردازد. در ادامه قسمتهای مختلف پاسخ خود را بیازمایید شیمی دوازدهم صفحه ۲۸ را بررسی میکنیم.
سوال ۱
در دما و غلظت یکسان، pH کدام محلول زیر کمتر است؟ چرا؟
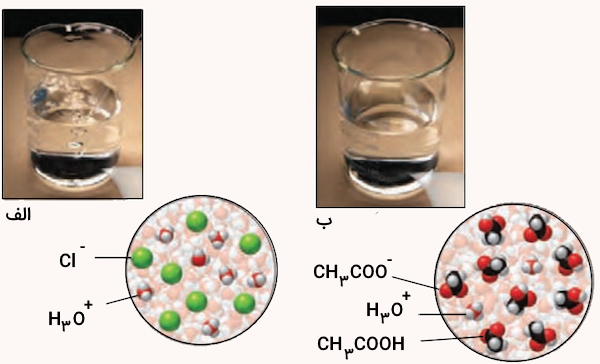
پاسخ
با توجه به یونهای آزاد شده از هر محلول میتوانیم دریابیم که محلول سمت چپ (الف) محلول اسید کلریدریک قوی و محلول سمت راست محلول استیک اسید ضعیف است. زیرا در محلول الف تنها یونهای کلر و هیدرونیوم وجود دارند اما در محلول سمت راست علاوه بر یونهای هیدرونیوم و استات، استیک اسید تفکیک نشده نیز وجود دارد.
در نتیجه مقدار پی اچ محلول اسید کلریدریک که اسید قوی است بسیار پایینتر (اسیدیتر) از محلول استیک اسید است.
سوال ۲
جدول زیر را کامل کنید.
| نام محلول | غلظت محلول | pH | درصد یونش | ||
| هیدروکلریک اسید | ۰٫۰۰۴ | ۰٫۰۰۴ | ۲٫۴ | ۱۰۰ | |
| هیدروفلوئوریک اسید | ۰٫۰۰۴ | ۴ | ۲٫۵ | ||
| اسید نیتریک | ۳٫۷ | ||||
| نمونهای از آب یک دریاچه | — | ۸٫۵۲ | — |
پاسخ
اسید کلریدریک یک اسید قوی است و به شکل کامل در آب تفکیک میشود. در نتیجه غلظت یون هیدروژن آن نیز برابر با ۰٫۰۰۴ خواهد بود. با استفاده از این غلظت و فرمول محاسبه pH و ثابت یونش آب، مقدار pH و غلظت هیدروکسید را به دست میآوریم. درصد یونش این اسید به دلیل قوی بودن آن برابر با عدد ۱۰۰ است.
مقدار غلظت یون هیدروژن اسید فلوئوریدریک را با استفاده از درصد یونش به دست آورده وسپس با آن مقدار pH و غلظت یون هیدروکسید را محاسبه میکنیم.
اسید نیتریک یک اسید قوی است و غلظت هیدروژن و محلول اولیه آن برابر و درصد یونش آن برابر ۱۰۰ است. پس کافی است غلظت هیدرونیوم و هیدروکسید را با استفاده از pH به روش زیر محاسبه کنیم.
به روشی مشابه، مقدار غلظت یونهای هیدروژن و هیدروکسید آب دریاچه را محاسبه میکنیم.
خود را بیازمایید شیمی دوازدهم صفحه ۲۹
خودرا بیازمایید این صفحه به رسانایی الکتریکی محلولهای بازی در آب میپردازد. در ادامه این دو سوال را بررسی میکنیم.
سوال ۱
شکلهای زیر رسانایی الکتریکی دو محلول بازی را در شرایط یکسان نشان میدهند. با توجه به آنها به پرسشها پاسخ دهید.
- کدام محلول نشاندهنده باز ضعیفتری است؟ چرا؟
- پیشبینی کنید کدام محلول میتواند به عنوان لولهبازکن استفاده شود؟ چرا؟

پاسخ
محلول سمت چپ که با استفاده از آن لامپ توسط مدار الکتروشیمیایی روشن شده است، رسانایی قویتری دارد و محلول سمت راست به دلیل کمنور بودن لامپ آن در مدار، رسانایی ضعیفتری دارد. این بدین معنی است که تعداد یونهای آزاد در محلول سمت راست کمتر بوده و به همین دلیل، این محلول باز ضعیفتری است و به شکل ناقص در آب دچار یونش شده است.
همچنین، محلول سمت چپ که باز قویتری است، میتواند به عنوان لوله بازکن استفاده شود.
سوال ۲
اگر در ۱۰۰ میلیلیتر از یک محلول، ۰٫۰۲ مول از پتاسیم هیدروکسید وجود داشته باشد، غلظت یون هیدروکسید را در این محلول محاسبه کنید و حساب کنید pHسنج دیجیتال چه عددی را برای این محلول نشان میدهد.
پاسخ
از آنجا که پتاسیم هیدروکسید یک باز قوی است، به شکل کامل در آب دچار یونش میشود. در نتیجه، مقدار غلظت یون هیدروکسید در محلول با غلظت اولیه پتاسیم هیدروکسید برابر است. در این سوال باید دقت داشته باشیم که حجم محلول بر حسب میلیلیتر بیان شده و هر لیتر ۱۰۰۰ میلیلیتر است. پس غلظت یون هیدروکسید در محلول برابر با ۰٫۲ مول بر لیتر خواهد بود.
حال برای به دست آوردن مقدار pH محلول، از غلظت هیدروکسید استفاده میکنیم.
خود را بیازمایید شیمی دوازدهم صفحه ۳۲
این سوال شامل ۳ قسمت است و به محاسبه pH و غلظت یون هیدرونیوم و خواص کلی اسیدها و بازها میپردازد. در ادامه این سوالها را بررسی میکنیم.
سوال ۱
pH شیره معده را حساب کنید. (غلظت یون هیدرونیوم در آن حدود ۰٫۰۳ مول بر لیتر است.)
پاسخ
برای محاسبه pH محلول کافی است از غلظت یون هیدرونیوم استفاده کرده و از آن لگاریتم منفی بگیریم.
سوال ۲
در زمان استراحت، pH معده برابر با ۳٫۷ است. غلظت یون هیدرونیوم را در این حالت حساب کنید.
پاسخ
با استفاده از فرمول زیر، pH را با استفاده از غلظت یون هیدرونیوم به دست میآوریم.
سوال ۳
با توجه به ویژگی و كاربرد سدیم هیدروژن كربنات (جوش شیرین) مطابق جدول زیر به سوالات پاسخ دهید.
| شماره ضد اسید | ماده موثر |
| ۱ | و |
| ۲ | و |
| ۳ |
- پیشبینی کنید که محلول سدیم هیدروژن کربنات در آب چه خاصیتی دارد؟ چرا؟
- توضیح دهید چرا برای افزایش قدرت پاک کردن چربیها، به شویندهها جوش شیرین میافزایند.
پاسخ
پاسخ سوالات به صورت زیر است.
- چون این ماده در جدول به عنوان ماده ضد اسید معرفی شده است، یعنی به عنوان ماده موثر در خنثی کردن اسیدها کاربرد دارد و باز است. این ماده بازی ضعیف است و در آب مقادیری یون هیدروکسید تولید میکند.
- جوش شیرین محیط قلیایی ایجاد میکند که باعث میشود چربیها و روغنها به راحتی تجزیه و شکسته شوند. در محیط قلیایی، چربیها به صابونها تبدیل میشوند که قابل شستشو با آب هستند. همچنین جوش شیرین به نرم شدن آب کمک میکند و باعث میشود شوینده بهتر عمل کند.
خود را بیازمایید شیمی دوازدهم صفحه ۴۲
این سوال به اکسایش و کاهش فلزات در محلول اسیدها و واکنش آنها میپردازد. در ادامه به قسمتهای مختلف این سوال پاسخ میدهیم.
سوال ۱
اغلب فلزها در واکنش با محلول اسیدها، گاز هیدروژن و نمک تولید میکنند. با توجه به شکل زیر که نمایی از این واکنش را نشان میدهد، به پرسشها پاسخ دهید.
- کدام گونه اکسایش و کدام گونه کاهش یافته است؟ چرا؟
- نیم واکنشهای اکسایش و کاهش را نوشته و موازنه کنید.
- نیم واکنشها را با هم جمع کنید تا با حذف الکترونها، معادله واکنش به دست آید.
- با خط زدن واژه نادرست در هر مورد، عبارت داده شده را کامل کنید.
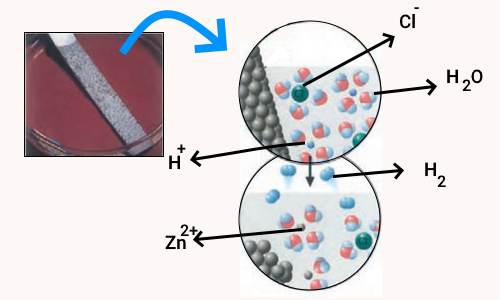
پاسخ
در این شکل، فلز روی اکسایش یافته و از عنصر فلزی به یون تبدیل شده است. در مقابل، هیدروژن از یون به حالت گازی هیدروژن () تبدیل شده و کاهش یافته است. نیم واکنشهای اکسایش و کاهش این مواد به شکل زیر است.
جمع واکنشها و حذف الکترون و واکنش نهایی به شکل زیر است.
واژههای درست متن این قسمت سوال در ادامه با متن پررنگ مشخص شده است.
در این واکنش، اتمهای روی الکترون از دست میدهند و اکسایش مییابند و سبب کاهش یونهای هیدروژن میشوند. از این رو، اتمهای روی نقش کاهنده دارند. درحالی که یونهای هیدروژن الکترون به دست میآورند و کاهش مییابند و سبب اکسایش اتمهای روی میشوند، از این رو یونهای هیدروژن نقش اکسنده دارند.
سوال ۲
در هر یک از واکنشهای زیر، گونههای اکسنده و کاهنده را مشخص کنید.
-
-
پاسخ
ماده اکسنده و کاهنده در هر مورد در ادامه مشخص شده است.
- کاهنده: ، اکسنده:
- کاهنده: ، اکسنده:
- کاهنده: ، اکسنده:
خود را بیازمایید شیمی دوازدهم صفحه ۴۳
جدول زیر، دادههایی را از قرار دادن برخی تیغههای فلزی درون محلول مس (اا) سولفات در دمای ۲۰ درجه سانتیگراد نشان میدهد.
| نام و نماد شیمیایی فلز | دمای مخلوط واکنش پس از مدتی (درجه سانتیگراد) |
| آهن (Fe) | ۲۳ |
| طلا (Au) | ۲۰ |
| روی (Zn) | ۲۶ |
| مس (Cu) | ۲۰ |
با توجه به دادههای جدول به سوالات زیر پاسخ دهید.
- تغییر دمای مخلوط واکنش، نشاندهنده چیست؟
- هریک از واکنشها را کامل کرده و گونههای اکسنده و کاهنده را مشخص کنید.
- با توجه به تغییر دمای سامانه، کدام فلز تمایل بیشتری به از دست دادن الکترون دارد؟ چرا؟
- فلزهای Au، Fe، Zn و Cu را بر اساس قدرت کاهندگی مرتب کنید.
- پیشبینی کنید هرگاه تیغه مس درون محلول روی سولفات قرار گیرد، آیا واکنشی انجام میشود؟ چرا؟
پاسخ
پاسخ پرسشها به شکل زیر است.
- الف: تغییر دما نشانه انجام واکنش شیمیایی است. افزایش دما نشاندهنده واکنش گرمازا اکسایش – کاهش است که انرژی آزاد میکند.
- کاهنده: آهن (Fe)، اکسنده: یون مس،
- کاهنده: روی، اکسنده: یون مس،
- روی (Zn) با بیشترین افزایش دما (۲۶ درجه) نشان میدهد تمایل بیشتری به اکسایش و از دست دادن الکترون دارد. زیرا Zn فلز فعالتر است و آسانتر اکسایش میشود.
-
- خیر، واکنش انجام نمیشود. زیرا مس نسبت به روی کاهنده ضعیفتری است و نمیتواند روی را اکسایش دهد. بنابراین تبادل الکترونی رخ نمیدهد.
خود را بیازمایید شیمی دوازدهم صفحه ۴۶
شکل زیر سلول گالوانی مس – نقره (Cu-Ag) را نشان میدهد. با توجه به آن به پرسشها پاسخ دهید.
- علامت الکترودهای مس و نقره را مشخص کنید.
- نیم واکنشهای انجام شده در آند و کاتد را بنویسید.
- با انجام این واکنش، جرم الکترودها چه تغییری میکند؟ توضیح دهید.
- جهت حرکت یونها را از دیواره متخلخل مشخص کنید.

پاسخ
پاسخ سوالات به شکل زیر است.
- آند (الکترون منفی) مس و کاتد (الکترود مثبت) نقره است.
- نیم واکنشها به شکل زیر هستند.
آند:
کاتد:
- جرم الکترود مس (آند) کاهش مییابد چون مس به یون مس تبدیل شده و وارد محلول میشود. جرم الکترود نقره (کاتد) افزایش مییابد چون یونهای نقره الکترون میگیرند و روی الکترود نقره رسوب میکنند.
- در آند (مس در محلول سولفات مس) یونهای مثبت مس وارد محلول میشوند و بار مثبت محلول افزایش مییابد، بنابراین آنیونهای سولفات از دیواره متخلخل به سمت آند حرکت میکنند. در کاتد که یونهای نقره کاهش مییابند و رسوب میکنند، بار مثبت محلول کم میشود، پس کاتیونها از سمت آند به سمت کاتد از میان دیواره متخلخل حرکت میکنند.
خود را بیازمایید شیمی دوازدهم صفحه ۴۸
با استفاده از جدول زیر مشخص کنید در سلول گالوانی ساخته شده از نقره و منیزیم:
- کدام الکترود آند و کدام کاتد خواهد بود؟ چرا؟
- نیم واکنشهای انجام شده را بنویسید و واکنش کلی سلول را به دست آورید.
| نیم واکنش کاهش | پتانسیل استاندارد (ولت) |
| ۰٫۸ + | |
| ۰٫۳۴ + | |
| ۰٫۰۰ | |
| ۰٫۴۴ – | |
| ۲٫۳۷ – |
پاسخ
- آند منیزیم است زیرا منیزیم فلزی فعالتر است و راحتتر اکسایش مییابد (الکترون از دست میدهد). کاتد نقره است زیرا نقره فلزی کمتر فعال است و یونهای نقره در محلول کاهش مییابند.
- نیم واکنشها و واکنش کلی به شکل زیر هستند.
خود را بیازمایید شیمی دوازدهم صفحه ۵۱
در هر یک از روشهای زیر، مراحل تبدیل انرژی شیمیایی موجود در یک سوخت به انرژی الکتریکی نشان داده شده است. با توجه به آن به پرسشها پاسخ دهید.
- در کدام روش اتلاف انرژی به شکل گرما بیشتر است؟ چرا؟
- کدام روش کارایی بالاتری دارد؟ توضیح دهید.
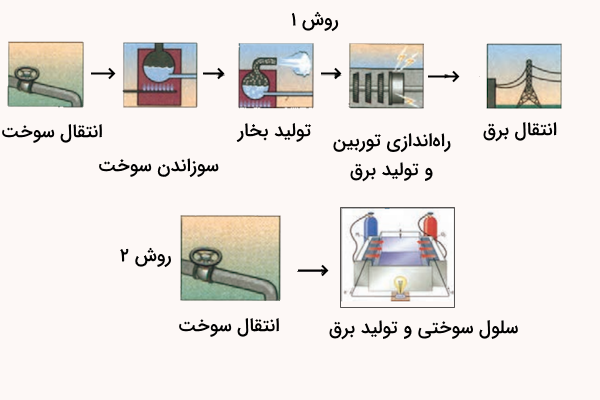
پاسخ
در روش اول، اتلاف انرژی بیشتر است. در این روش، سوخت ابتدا سوزانده میشود و انرژی شیمیایی به انرژی گرمایی تبدیل میشود، سپس بخار تولید و توربین حرکت میکند و برق تولید میشود. این فرآیند چند مرحلهای است و در هر مرحله بخشی از انرژی به صورت گرما از دست میرود. روش دوم بهصورت مستقیم انرژی شیمیایی سوخت را به برق تبدیل میکند و اتلاف گرمایی کمتری دارد.
روش دوم کارایی بالاتری دارد. زیرا در سلول سوختی تبدیل انرژی بهصورت مستقیم انجام میشود و مرحله میانی تولید گرما و بخار و حرکت مکانیکی وجود ندارد، بنابراین اتلاف انرژی کمتر است و کارایی بالاتری دارد.
خود را بیازمایید شیمی دوازدهم صفحه ۵۳
در این سوال، واکنشهای اکسایش کاهش و تغییر عدد اکسایش مواد در این واکنشها بررسی میشود. در ادامه به توضیح پاسخ این سوالات میپردازیم.
سوال ۱
در هر مورد با تعیین عدد اکسایش مشخص کنید که آن اتم اکسایش یا کاهش یافته است؟
-
-
-
پاسخ
برای تشخیص اینکه هر عنصر اکسایش یا کاهش یافته است، ابتدا باید عدد اکسایش (عدد اکسیداسیون) آنها را در سمت واکنشدهنده و فرآورده مشخص کنیم و سپس تغییر آن را بررسی کنیم:
- در این واکنش عدد اکسایش مس از ۲+ به صفر تغییر کرده است و کاهش یافته است.
- بار یون کروم ادر این واکنش از ۲+ به ۳+ تغییر کرده است و اکسایش یافته است.
- در این واکنش عدد اکسیش کربن از صفر ۲+ به تغییر کرده و اکسایش یافته است.
- نیتروژن در این واکنش از یون ۳- به نیتروژن خنثی با عدد اکسایش صفر تغییر کرده و اکسایش یافته است.
سوال ۲
در هر یک از واکنشهای زیر با محاسبه تغییر عدد اکسایش، گونه کاهنده و اکسنده را تعیین کنید.
-
پاسخ
برای تعیین گونه اکسنده و کاهنده، ابتدا عدد اکسایش (اکسیداسیون) هر عنصر را در سمت واکنشدهنده و فرآورده مشخص میکنیم. سپس تغییرات آنها را بررسی میکنیم.
در واکنش آ، عدد اکسایش آهن از +۳ در ترکیب به صفر در آهن فلزی تغییر کرده و کاهش یافته است. عدد اکسایش آلومینیوم نیز از صفر در آلومینیوم فلزی به +۳ در ترکیب تغییر کرده و اکسایش یافته است. (نکته: عدد اکسایش اکسیژن در این ترکیبات برابر با ۲- است.) بنابراین آلومینیوم کاهنده و آهن در اکسید آهن، اکسنده است.
در واکنش ب، عدد اکسایش کربن از ۲+ به ۴+ تغییر کرده و اکسید شده و عدد اکسایش عنصر اکسیژن از صفر در ترکیب دو اتمی اکسیژن به ۲- در کربن دی اکسید تغییر کرده و کاهش یافته است. پس کربن مونوکسید کاهنده و گاز اکسیژن اکسنده است.

خود را بیازمایید شیمی دوازدهم صفحه ۵۴
نیم واكنشهای انجام شده در سلول الكترولیتی هنگام برقكافت آب به صورت زیر است:
- با وارد كردن نماد الكترون در هر نیم واكنش مشخص كنید كدام نیم واكنش، آندی و كدام كاتدی است؟
- هر یک از نیم واكنشها را موازنه كنید و معادله كلی واكنش را بهدست آورید.
- پیشبینی كنید كاغذ pH در محلول پیرامون آند و كاتد به چه رنگی درمیآید؟ چرا؟
پاسخ
پاسخ قسمتهای مختلف این سوال به شکل زیر است.
الف
چون الکترون آزاد میشود (از دست میرود)، این واکنش اکسایش است و در آند رخ میدهد.
چون الکترون دریافت میشود، این واکنش کاهش است و در کاتد انجام میشود.
ب
برای موازنه با عدد اکسایش، دو نیمواکنش را با توجه به تعداد الکترونها با هم جمع میکنیم. برای این کار، ابتدا الکترونها را برابر میکنیم.
پ
در هنگام برقکافت آب، در آند واکنش اکسایش انجام میشود که باعث تولید یون هیدروژن شده و محیط اطراف آند اسیدی میشود، بنابراین کاغذ pH در این ناحیه به رنگ قرمز تغییر میکند. در مقابل، در کاتد واکنش کاهش رخ میدهد که منجر به تولید یون هیدروکسید شده و محیط اطراف کاتد قلیایی میشود، بنابراین رنگ کاغذ pH در این محل به آبی تغییر مییابد.
خود را بیازمایید شیمی دوازدهم صفحه ۵۵
شكل زیر مراحل تهیه فلز منیزیم را از آب دریا نشان میدهد. جاهای خالی را پر كرده و درباره این روش در كلاس گفتوگو كنید.
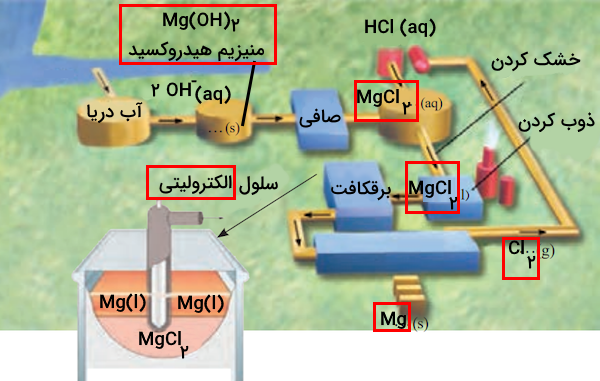
پاسخ
ابتدا با افزودن محلول سدیم هیدروکسید به آب دریا، رسوب منیزیم هیدروکسید تولید میشود. سپس این رسوب با اسید کلریدریک واکنش داده و محلول منیزیم کلرید به دست میآید. محلول منیزیم کلرید پس از خشک کردن به شکل منیزیم کلرید جامد درمیآید. سپس این جامد را در محله ذوب کردن به شکل منیزیم کلرید مذاب در میآورند. کلرید منیزیم مذاب وارد سلول الکترولیز شده و در اینجا طی برقکافت به فلز منیزیم و گاز کلر تجزیه میشود.
خود را بیازمایید شیمی دوازدهم صفحه ۵۹
شکل زیر بخشی از یک ورقە آهنی را نشان میدهد که با لایه نازکی از قلع پوشیده شده است. به این نوع آهن، حلبی میگویند. از ورقههای حلبی برای ساختن قوطیهای روغن نباتی و کنسرو استفاده میشود. با مراجعه به جدول پتانسیل استاندارد مواد، به سوالات پاسخ دهید.

- در صورتی که سطح این نوع آهن به دلیل خراش آسیب ببیند، کدام یک از فلزات قلع یا آهن دچار خوردگی خواهد شد و کدام فلز در برابر خوردگی محافظت خواهد شد؟
- نیمواکنشهای مربوط به فرآیند اکسایش و کاهش را برای این پدیده بنویسید.
- توضیح دهید چرا برخلاف حلبی، نمیتوان از آهن گالوانیزه (آهنی که با لایهای از روی پوشیده شده) برای ساخت ظروف بستهبندی مواد غذایی استفاده کرد.
پاسخ
پاسخ سوالات خود را بیازمایید شیمی دوازدهم صفحه ۵۹ به شکل زیر است.
- وقتی در پوشش حلبی (آهن با لایه نازک قلع) خراش ایجاد میشود، آهن (Fe) در معرض هوا و رطوبت قرار میگیرد. از آنجا که پتانسیل استاندارد کاهش آهن از قلع پایینتر است، آهن به عنوان آند رفتار کرده و خورده میشود و قلع بهعنوان کاتد باقی مانده و محافظت میشود.
- نیمواکنشهای اکسایش و کاهش به شکل زیرند.
اکسایش:
کاهش:
- در آهن گالوانیزه، آهن با لایهای از روی (Zn) پوشیده میشود. در صورت ایجاد خراش، روی بهعنوان فلز فعالتر خودش خورده میشود و آهن را محافظت میکند. اما هنگام خورده شدن روی، یونهای روی آزاد میشوند که میتوانند وارد ماده غذایی شوند و به سلامت مصرفکننده آسیب بزنند یا طعم و کیفیت غذا را تغییر دهند. در مقابل، قلع نسبتا سمی نیست و حتی اگر اندکی از آن وارد ماده غذایی شود، به سلامتی انسان آسیبی نمیزند و طعم و بو را تغییر نمیدهد.
خود را بیازمایید شیمی دوازدهم صفحه ۶۰
شكل زیر آبكاری یک قاشق فولادی را با فلز نقره نشان میدهد. با توجه به آن به سوالات پاسخ دهید.
- قاشق فولادی به کدام قطب باتری متصل است؟
- نیمواکنش کاتدی را بنویسید.
- چرا الکترولیت را محلولی از نمک نقره انتخاب کردهاند؟
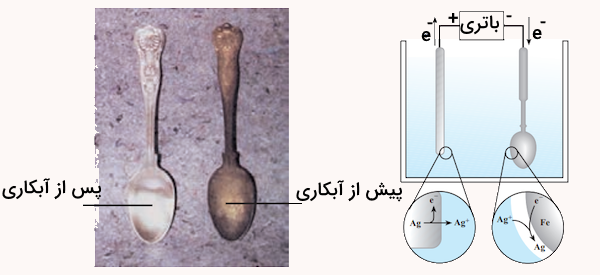
پاسخ
قاشق فولادی که قرار است با لایهای از نقره آبکاری شود، باید به قطب منفی (کاتد) باتری متصل شود. دلیلش این است که یونهای نقره از محلول به سطح قاشق (کاتد) رفته و روی آن رسوب میکنند.
نیمواکنش کاتدی که در آن یونهای نقره کاهش یافته و به صورت فلز نقره روی قاشق رسوب میکنند، به شکل زیر است:
برای آبکاری نقره، الکترولیت را از محلول حاوی نمک نقره انتخاب کردهاند، چون باید یونهای نقره در محلول وجود داشته باشند تا بتوانند به سمت قاشق (کاتد) حرکت کنند و با گرفتن الکترون، به نقره فلزی تبدیل شده و روی سطح قاشق رسوب کنند. بدون محلول حاوی یون نقره، رسوبگذاری نقره امکانپذیر نیست.
خود را بیازمایید شیمی دوازدهم صفحه ۶۹
خاک رس مخلوطی از مواد گوناگون است. جدول زیر درصد جرمی مواد سازنده نوعی خاک رس را نشان میدهد که از یک معدن طلا استخراج شده است.
| ماده | درصد جرمی |
| ۴۶٫۲۰ | |
| ۳۷٫۷۴ | |
| ۱۳٫۳۲ | |
| ۱٫۲۴ | |
| ۰٫۹۶ | |
| ۰٫۴۴ | |
| و مواد دیگر | ۰٫۱ |
در ادامه به توضیح پاسخ خود را بیازمایید شیمی دوازدهم فصل ۳ میپردازیم.
سوال ۱
با توجه به دادههای جدول به پرسشهای زیر پاسخ دهید.
- نام شیمیایی هر یک از مواد موجود در این نوع خاک را بنویسید.
- سرخ فام بودن این نوع خاک رس را به وجود کدام ماده نسبت میدهید؟
- پیشبینی کنید هنگام پختن سفالینههای تهیه شده از این نوع خاک رس، از جرم كدام ماده به مقدار بیشتری کاسته میشود؟ چرا؟
پاسخ
نام مواد شیمیایی موجود در جدول از بالا به پایین به ترتیب عبارتند از سلیلس یا سیلیسیم دی اکسید، آلومینا یا اکسید آلومینیوم، آب، اکسید سدیم، اکسید آهن (ااا)، منیزیم اکسید و طلا
سرخ فام بودن این خاک به دلیل وجود ماده اکسید آهن (ااا) یعنی است. این ماده رنگ قرمز یا قهوهای مایل به قرمز دارد و حتی در مقادیر کم نیز میتواند رنگ ظاهری خاک را تغییر دهد. مادهای که بیشترین کاهش جرم در هنگام پخت سفالینه را دارد، آب است. زیرا آب در دمای بالای کوره پخت، تبخیر میشود و جرم آن از خاک کاسته میشود.
سوال ۲
اگر اجزای این مخلوط نخست جداسازی شده سپس خالصسازی شوند، پیشبینی کنید ساختار ذرهای هریک از این اجزا در حالت خالص و جامد (به جز ) با کدام الگوی زیر همخوانی دارد؟ چرا؟
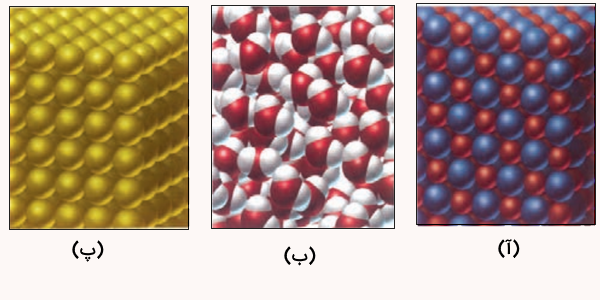
پاسخ
تصویر آ، ساختار یک ترکیب یونی، تصویر ب، ساختار یک ترکیب مولکولی و تصویر پ، ساختار یک مولکول عنصری را نمایش میدهد. بنابراین، مواد موجود در این خاک به شکل زیر میتوانند در دستهبندی این سه تصویر قرار بگیرند.
- تصویر آ: اکسید آلومینیوم، اکسید سدیم، اکسید آهن و اکسید منیزیم
- تصویر ب: آب
- تصویر پ: طلا و سایر مواد عنصری
خود را بیازمایید شیمی دوازدهم صفحه ۷۱
این سوال به بررسی ساختار جامدهای کووالانسی و خواص آنها میپردازد. در ادامه به بررسی سوالات این بخش میپردازیم.
سوال ۱
گرافیت و الماس، از جمله دگر شکلهای طبیعی کربن بوده که جزو جامدهای کووالانسی هستند. با توجه به ساختارهای زیر به پرسشها پاسخ دهید.
- کدام ساختار، جامد کووالانسی با چینش دو بعدی اتمها و کدام یک جامد کووالانسی با چینش سه بعدی اتمها را نشان میدهد؟
- با توجه به اینکه گرافیت موجود در مغز مداد بر روی کاغذ اثر به جا میگذارد، کدام ساختار با این ویژگی همخوانی دارد؟ چرا؟
- چرا در ساخت متهها و ابزار برش شیشه از الماس استفاده میشود؟
- کدام چگالی از بین ۲٫۲۷ یا ۳٫۵۱ گرم بر سانتیمتر مکعب را میتوان به گرافیت نسبت داد؟ چرا؟
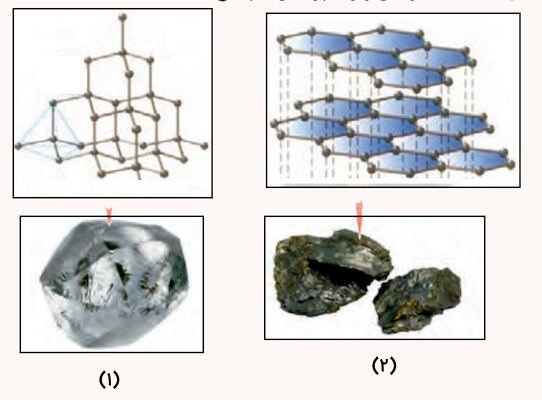
پاسخ
پاسخ سوالات به شکل زیر است.
شکل شماره ۱ ساختار سه بعدی جامد کووالانسی الماس را نشان میدهد. شکل ب ساختاری دو بعدی از مولکولهای شش ضلعی گرافیت را نمایش میدهد.
ساختار شکل ۲ با ساختار گرافیت همخوانی دارد. زیرا در گرافیت، لایههای دوبعدی اتمهای کربن بهوسیلهی نیروهای ضعیف واندروالسی بههم متصلاند. این نیروهای ضعیف باعث میشود لایهها بهراحتی روی هم بلغزند و هنگام کشیده شدن گرافیت روی کاغذ، بخشی از لایهها جدا شده و روی سطح باقی بمانند. در نتیجه، اثر مداد روی کاغذ ظاهر میشود.
الماس ساختاری شبکهای سهبعدی کووالانسی بسیار سخت دارد که هر اتم کربن با چهار پیوند کووالانسی محکم به اطراف متصل است. این ساختار، الماس را به سختترین ماده طبیعی تبدیل کرده و در نتیجه مقاومت بالایی در برابر خراش، فشار و سایش دارد و برای برش مواد سخت مانند شیشه، سنگ و فلزات بسیار مناسب است.
چگالی ۲٫۲۷ گرم بر سانتیمتر مکعب مربوط به گرافیت است. زیرا ساختار آن دارای لایههای مولکولی با فضایی بین آنها است و این پدیده باعث کمتر بودن چگالی گرافیت نسبت به الماس میشود.
سوال ۲
با توجه به جدول زیر، به پرسشها پاسخ دهید.
- اگر سیلیسیم خالص ساختاری همانند الماس داشته باشد، پیشبینی کنید نقطه ذوب الماس بالاتر است یا سیلیسیم؟ چرا؟
- اگر آنتالپی پیوند Si-O بیشتر از پیوند Si-Si و ساختار با مشابه باشد، توضیح دهید چرا سیلیسیم در طبیعت به حالت خالص یافت نشده و به طور عمده به شکل سیلیس یافت میشود؟
| پیوند | میانگین آنتالپی (کیلوژول بر مول) |
| Si – Si | ۲۲۶ |
| C – C | ۳۴۸ |
پاسخ
نقطه ذوب الماس بالاتر است زیرا در الماس، اتمهای کربن با ۴ پیوند کووالانسی بسیار قوی به هم متصل هستند. در ساختار سیلیسیم به دلیل ضعیفتر بودن پیوند بین اتمهای سیلیسیم با توجه به آنتالپی پیوند بر اساس جدول، پیوندهایی ضعیفتر دارند. در نتیجه، نقطه ذوب الماس از سیلیسیم بالاتر است.
پیوند Si-O از نظر انرژی، قویتر و پایدارتر از پیوند Si-Si است. بنابراین، در حضور اکسیژن (که در طبیعت فراوان است)، اتمهای سیلیسیم بهراحتی با اکسیژن واکنش داده و ساختار پایدارتری به نام دی اکسید سیلیسیم (سیلیس) تشکیل میدهند. به همین دلیل، سیلیسیم در طبیعت به حالت خالص وجود ندارد و بهطور عمده بهصورت ترکیباتی مانند سیلیس در سنگها و مواد معدنی یافت میشود.
خود را بیازمایید شیمی دوازدهم صفحه ۷۴
در این قسمت، ساختار جامدات کووالانسی و مولکولی و تفاوتها و ویژگیهای آنها بررسی میشود. در ادامه به توضیح پاسخ این سوالات میپردازیم.
سوال ۱
با خط زدن واژه نادرست در هر مورد، عبارت زیر را کامل کنید.
در ساختار یک جامد (کووالانسی / مولکولی)، میان (همه / شمار معینی از) اتمها، پیوند اشتراکی وجود دارد. به همین دلیل، چنین موادی نقطه ذوب (بالایی / پایینی) دارند و دیرگداز هستند.
پاسخ
در ساختار یک جامد کووالانسی، میان همه اتمها، پیوند اشتراکی وجود دارد. به همین دلیل، چنین موادی نقطه ذوب بالایی دارند و دیرگداز هستند.
سوال ۲
واژههای شیمیایی رایج مانند ماده مولکول، فرمول مولکوی و نیروهای بین مولکولی را برای توضیف کدام مواد زیر میتوان در نظر گرفت؟ چرا؟
، ، ، ، گرافیت،
پاسخ
در ساختار ماده مولکولی، مولکولهای مشخص با فرمول واضح وجود دارد و نیروی بین مولکولی واندروالسی برای توصیف خواص فیزیکی آن استفاده میشود. در ادامه هر یک از مواد را به صورت جداگانه بررسی میکنیم.
- گاز کلر : این مولکول یک ترکیب کووالانسی مولکولی است و میتوان این واژهها را برای آن استفاده کرد.
- گرافیت: گرافیت یک جامد مولکولی با ساختاری شامل پیوندهای کووالانسی و واندروالسی است و میتوان این واژهها را برای بیان آن استفاده کرد.
- هیدروژن فلوئورید : ترکیب یونی است و نمیتوان از این واژهها استفاده کرد.
- سدیم کلرید : ترکیب یونی است و نمیتوان از این واژهها استفاده کرد.
- سیلیسیم دی اکسید : ترکیب مولکولی است و میتوان استفاده کرد.
- هگزان : ترکیب مولکولی است و میتوان استفاده کرد.
خود را بیازمایید شیمی دوازدهم صفحه ۷۶
سوال ۱
شکل زیر نقشه پتانسیل مولکولهای کربونیل سولفید (SCO) و اتین () را نشان میدهد. با توجه به آنها، گشتاور دو قطبی کدام مولکول برابر با صفر است؟ چرا؟
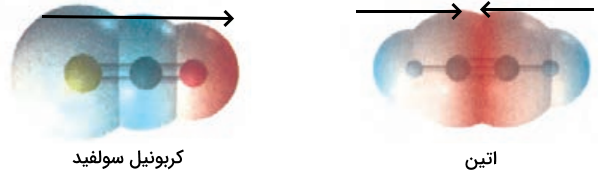
پاسخ
گشتاور دو قطبی مولکول اتن برابر صفر است چون توزیع بار الکتریکی در آن متقارن است و دو قطب مخالف هم را خنثی میکنند. اما در کربونیل سولفید توزیع بار نامتقارن است و گشتاور دو قطبی دارد.
سوال ۲
با توجه به نقشه پتانسیل مولکولهای آمونیاک و گوگرد تریاکسید به پرسشها پاسخ دهید:
- با بیان دلیل، هر یک از اتمها را در نقشههای بالا با و نشاندار کنید.
- کدام مولکول قطبی و کدام ناقطبی است؟ چرا؟
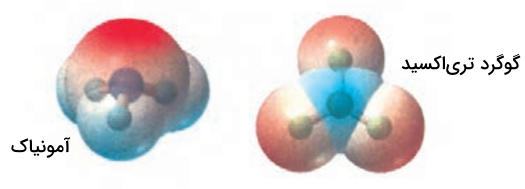
پاسخ
پاسخ سوالات به شکل زیر است.
در نقشه پتانسیل، اتمهایی که بار الکترونی بیشتری دارند با علامت منفی و اتمهایی با بار کمتر با علامت مثبت نشان داده میشوند.
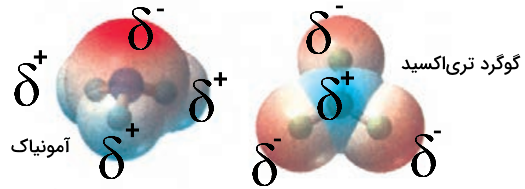
آمونیاک مولکول قطبی است چون شکل و توزیع بار آن نامتقارن است. گوگرد تریاکسید ناقطبی است چون توزیع بار الکترونی آن متقارن است و گشتاور دو قطبی ندارد.
سوال ۳
با توجه به شکلهای زیر، با دلیل پیشبینی کنید کدام مایع، کلروفرم () و کدام یک کربن تتراکلرید () است؟

پاسخ
باریکه مایع کلروفرم در میدان الکتریکی منحرف میشود چون قطبی است و باریکه مایع کربن تتراکلرید که ناقطبی است، منحرف نمیشود. پس تصویر سمت راست مربوط به کربن تترا کلرید و تصویر سمت چپ مربوط به کلروفرم است.
خود را بیازمایید شیمی دوازدهم صفحه ۸۲
سوال ۱
در هر مورد، با خط زدن واژه نادرست، هر یک از عبارتهای زیر را کامل کنید.
- آنتالپی فروپاشی، گرمای (آزاد / مصرف) شده در فشار ثابت برای فروپاشی یک (مول / گرم) از شبکه یونی و تبدیل آن به (اتمهای / یونهای) گازی سازنده است.
- هر چه (بار / چگالی بار) یونهای سازنده یک جامد یونی بیشتر باشد، شبکه آن (آسانتر / دشوارتر) فروپاشیده میشود.
پاسخ
آنتالپی فروپاشی، گرمای مصرف شده در فشار ثابت برای فروپاشی یک مول از شبکه یونی و تبدیل آن به یونهای گازی سازنده است. هر چه بار یونهای سازنده یک جامد یونی بیشتر باشد، شبکه آن دشوارتر فروپاشیده میشود.
سوال ۲
با توجه به دادههای متن درس، پیشبینی کنید کدام آنتالپی فروپاشی شبکه را میتوان به نسبت داد؟ چرا؟
- ۷۱۷ کیلوژول بر مول
- ۶۴۹ کیلوژول بر مول
- ۱۰۳۷ کیلوژول بر مول
پاسخ
آنتالپی فروپاشی شبکه برای KCl حدود ۷۱۷ کیلوژول بر مول است چون یونهای آن بار تک دارند و اندازه متوسطی دارند. این باعث میشود نیروی جاذبه بین یونها متوسط باشد و انرژی لازم برای فروپاشی شبکه نیز در این حد باشد. مقادیر بالاتر مربوط به یونهای با بار بیشتر یا اندازه کوچکتر (مانند سدیم کلرید) است که انرژی بیشتری نیاز دارند.
سوال ۳
با توجه به نمودار زیر به پرسشها پاسخ دهید:
- با افزایش شعاع کاتیون فلزهای قلیایی، آنتالپی فروپاشی شبکه چه تغییری میکند؟ توضیح دهید.
- با افزایش شعاع آنیون هالید، آنتالپی فروپاشی شبکه چه تغییری میکند؟ توضیح دهید.

پاسخ
با افزایش شعاع کاتیون فلزهای قلیایی، آنتالپی فروپاشی شبکه کاهش مییابد چون فاصله بین یونها بیشتر شده و نیروی جاذبه ضعیفتر میشود. همچنین، با افزایش شعاع آنیون هالید، آنتالپی فروپاشی شبکه کاهش مییابد چون یونها از هم دورتر شده و نیروی جاذبه کمتر میشود.
سوال ۴
با توجه به جدول زیر که آنتالپی فروپاشی شبکه را برای برخی ترکیبهای یونی نشان میدهد، به پرسشها پاسخ دهید:
- درباره درستی این جمله گفتوگو کنید: «آنتالپی فروپاشی شبکه هم با بار الکتریکی کاتیون و هم با بار الکتریکی آنیون، رابطه مستقیم دارد.»
- آیا میتوان میان آنتالپی فروپاشی شبکه و نقطه ذوب جامدهای یونی رابطهای در نظر گرفت؟ توضیح دهید.
| کاتیون / آنیون | ||
| ۹۲۶ | ۲۴۸۸ | |
| ۲۹۶۵ | ۳۷۹۸ |
پاسخ
جمله درست است چون هرچه بار یونها بیشتر باشد، نیروی جاذبه بین آنها قویتر و آنتالپی فروپاشی شبکه بیشتر میشود. همچنین میان آنتالپی فروپاشی شبکه و نقطه ذوب جامدهای یونی رابطهای مستقیم وجود دارد.
هرچه آنتالپی فروپاشی شبکه بالاتر باشد، نیروهای نگهدارنده قویتر و نقطه ذوب جامد یونی بالاتر است.
خود را بیازمایید شیمی دوازدهم صفحه ۸۶
شکل زیر پیشرفت واکنش فلز روی با محلول منگنات وانادیم (V) را نشان میدهد. با توجه به شکل، به پرسشهای داده شده پاسخ دهید.
- آرایش الکترونی اتم وانادیم (V، عدد اتمی ۲۳) را بنویسید.
- آرایش الکترونی وانادیم را در حالتهای اکسایش (II) و (III) بنویسید.
- توضیح دهید چرا در هر مرحله رنگ محلول متفاوت از دیگری است؟
- در این واکنش، وانادیم کدام نقش را دارد؟ (اکسنده یا کاهنده) چرا؟

پاسخ
آرایش الکترونی اتم وانادیم به حالت خنثی به شکل زیر است.
آرایش الکترونی وانادیم را در حالتهای اکسایش (II) و (III) به شکل زیر است.
رنگ محلولها متفاوت است چون تغییر حالت اکسایش وانادیم باعث تغییر در ساختار الکترونی و در نتیجه جذب نور متفاوت میشود. وانادیم در این واکنش نقش کاهنده دارد چون الکترون از دست میدهد و حالت اکسایش آن افزایش مییابد. در ادامه قسمتهای مختلف پاسخ خود را بیازمایید شیمی دوازدهم فصل ۴ را بررسی میکنیم.
خود را بیازمایید شیمی دوازدهم صفحه ۹۴
سوالهای این بخش به شرح زیر است. در ادامه قسمتهای مختلف پاسخ خود را بیازمایید شیمی دوازدهم صفحه ۹۴ را بررسی میکنیم.
سوال ۱
نمودار زیر غلظت برخی از آلایندهها را در نمونهای از هوای یک شهر نشان میدهد.
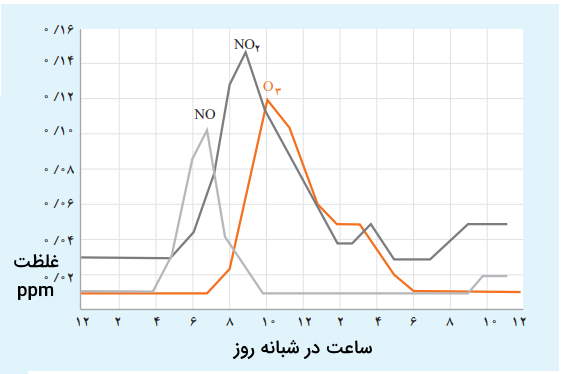
- مقدار این آلایندهها بین چه ساعاتی از شبانهروز به بیشترین حد خود میرسد؟
- چرا هوای آلوده به رنگ قهوهای روشن دیده میشود؟
- چرا با کاهش مقدار گاز ، گاز رو به افزایش است؟
پاسخ
بین ۷ تا ۱۰ صبح مقدار این آلایندهها به بیشترین حد خود میرسد. رنگ قهوهای روشن هوای آلوده معمولا به دلیل حضور گاز دی اکسید نیتروژن است. با کاهش مقدار گاز ، گاز رو به افزایش است، زیرا گاز اوزون طبق واکنشهای زیر تولید میشود.
سوال ۲
در شیمی ۱ آموختید که آلایندههای زیر در خروجی اگزوز خودروها وجود دارند.
، ، ،
- دلیل وجود هیدروکربنها در گازهای خروجی چیست؟
- پیدایش گازهای کربن مونوکسید، گوگرد دی اکسید و نیتروژن مونوکسید را با نوشتن معادله شیمیایی موازنه شده توجیه کنید.
پاسخ
هیدروکربنها به دلیل سوخت ناقص بنزین یا گازوییل در موتور ایجاد میشوند. معادله واکنش سوخت نبرخی از سوختها به شکل زیر این مواد را تولید میکند.
خود را بیازمایید شیمی دوازدهم صفحه ۹۵
هر یک از شکلهای زیر رفتار یک نمونه ماده را در برابر پرتوهای مرئی نشان میدهد، با توجه به آنها به پرسشهای زیر پاسخ دهید.
- کدام نمونه ماده طول موجهای بیشتری از پرتوهای مرئی را جذب کرده است؟
- آیا ساختار این دو ماده یکسان است؟ چرا؟
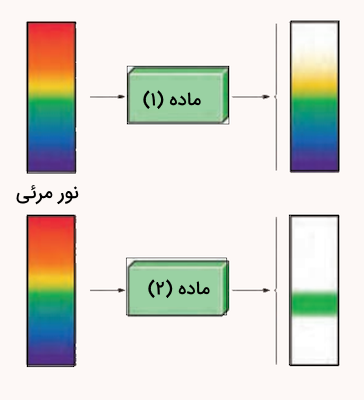
پاسخ
ماده شماره ۲ طول موج بیشتری از پرتو را جذب کرده است زیرا طول موج کمتری (فقط محدوده سبز) را از خود نشر داده است. خیر ساختار این دوماه یکسان نیست زیرا طیف نشری متفاوتی را از خود نشان دادهاند.
خود را بیازمایید شیمی دوازدهم صفحه ۹۸
با توجه به نمودارهای زیر به پرسشها پاسخ دهید.
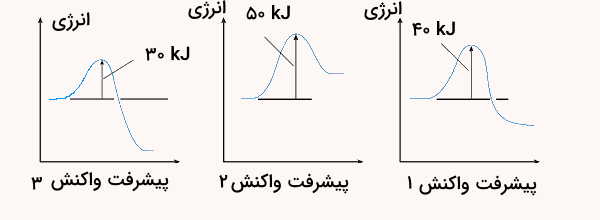
- گرماده یا گرماگیر بودن هر یک از واکنشها را مشخص کنید و پاسخ خود را توضیح دهید.
- کدام واکنش در شرایط یکسان سریعتر انجام میشود؟ چرا؟
- پ) فسفر سفید برخلاف گاز هیدروژن، در هوا و در دمای اتاق میسوزد. با توجه به این واقعیت، کدام نمودار به کدام واکنش مربوط است؟ چرا؟

پاسخ
پاسخ سوالات به شرح زیر است.
- نمودارهای ۱ و ۳ گرماده و نمودار ۲ گرماگیر هستند. زیرا در نمودار ۱ و ۳ انرژی فرآوردهها از واکنش دهندهها کمتر است و پایدارترند و در نمودار ۲ انرژی واکنش دهندهها بیشتر است و باید برای انجام واکنش گرما بگیرد.
- واکنش شماره ۳ در شرایط یکسان زودتر انجام میشود زیرا دارای انرژی فعالسازی کمتری (۳۰ کیلوژول) نسبت به دو واکنش دیگر است.
- نمودار سمت چپ میتواند مربوط به سوختن فسفر سفید باشد زیرا انرژی فعالسازی آن بسیار کم است.
خود را بیازمایید شیمی دوازدهم صفحه ۱۰۲
در این قسمت مبدل های کاتالیستی و عملکرد آنها بررسی میشود. در ادامه سوالات این بخش را توضیح میدهیم.
سوال ۱
با وجود مبدل کاتالیستی، در گازهای خروجی از اگزوز خودروها به هنگام روشن و گرم شدن خودرو، به ویژه در روزهای سرد زمستان، گازهای ، NO و CO بیشتری مشاهده میشود. دلیل این پدیده را توضیح دهید. چه راهکاری برای برطرف کردن این مشکل پیشنهاد میکنید؟
پاسخ
در روزهای سرد و هنگام گرم شدن اولیه خودرو، مبدل کاتالیستی هنوز به دمای لازم برای فعال شدن کامل واکنشها نرسیده است و به همین دلیل گازهای آلاینده مانند ، NO و CO به طور کامل تبدیل نمیشوند و مقدار بیشتری از آنها در گازهای خروجی دیده میشود.
برای رفع این مشکل، خودرو باید سریعتر به دمای کاری مناسب برسد که این کار با استفاده از سیستمهای پیشگرمکننده یا طراحی مبدلهایی که سریعتر گرم میشوند امکانپذیر است.
سوال ۲
درباره درستی جملههای زیر گفتوگو کنید.
- کاتالیزگر اغلب اختصاصی و انتخابی عمل میکند.
- در حضور کاتالیزگر نباید واکنشهای ناخواسته دیگری انجام شود.
- کاتالیزگر در شرایط انجام واکنش باید پایداری شیمیایی و گرمایی مناسبی داشته باشد.
پاسخ
جمله اول درست است چون کاتالیزگرها معمولا فقط روی واکنش یا ترکیب خاصی اثر میگذارند و واکنش را به سمت محصول دلخواه هدایت میکنند. جمله دوم صحیح نیست. زیرا گاهی کاتالیزگرها ممکن است واکنشهای جانبی را نیز تسریع کنند اما هدف این است که واکنشهای ناخواسته حداقل شود.
جمله سوم نیز صحیح است زیرا کاتالیزگر باید در شرایط واکنش خراب نشود و بتواند به صورت مکرر بدون تغییر عمل کند.

خود را بیازمایید شیمی دوازدهم صفحه ۱۰۳
با توجه به معادله واکنش تعادلی تولید گاز آمونیاک و عبارت ثابت تعادل آن، به پرسشها پاسخ دهید.
توضیح دهید چگونه میتوان از روی معادله یک واکنش، عبارت ثابت تعادل را برای آن نوشت؟
جدول زیر، غلظت تعادلی گونهها را در دمای معینی برای این واکنش نشان میدهد. با محاسبه K مشخص کنید میزان پیشرفت واکنش در این دما کم است یا زیاد؟ چرا؟
| پارامتر | مقدار |
| ۰٫۰۲ | |
| ۰٫۵ | |
| ۰٫۴ | |
| K | ؟ |
پاسخ
عبارت ثابت تعادل با استفاده از حاصلضرب غلظت فراوردهها به توان ضرایبشان تقسیم بر حاصلضرب غلظت واکنشگرها به توان ضرایبشان به دست میآید.
با توجه به داده های جدول، مقدار ثابت تعادل را به دست میآوریم.
خود را بیازمایید شیمی دوازدهم صفحه ۱۰۵
واکنش تعادلی زیر در سامانهای با حجم و دمای ثابت برقرار است. با هر یک از تغییرهای زیر تعادل در چه جهتی جابهجا میشود؟ چرا؟
- خارج کردن مقداری گاز آمونیاک از سامانه
- وارد کردن مقداری گاز هیدروژن در سامانه
پاسخ
با خارج کردن مقداری گاز آمونیاک از سامانه، واکنش طبق اصل لوشاتلیه به سمت فرآوردهها حرکت جابهجا میشود تا آمونیاک خارج شده را با استفاده از تولید توسط واکنشدهندهها جبران کند.
با وارد کردن مقداری گاز هیدروژن در سامانه، واکنش در جهت مصرف واکنش دهندهها به سمت فرآوردههاا جابهجا میشود تا مقدار هیدروژن اضافه شده را جبران کند.
خود را بیازمایید شیمی دوازدهم صفحه ۱۰۷
در این قسمت، اصل لوشاتلیه و اثر تغییر فشار در سامانههای تعادلی شامل مواد گازی بررسی میشود. در ادامه سوالهای این صفحه را بررسی میکنیم.
سوال ۱
اگر در سامانهای به شکل رو به رو، پیستون بیرون کشیده شود تا در دمای ثابت، حجم آن افزایش یابد، به سوالات زیر پاسخ دهید.
- پیشبینی کنید تعادل در کدام جهت جابهجا میشود؟ چرا؟
- با این تغییر، شمار مولهای آمونیاک چه تغییری میکند؟

پاسخ
چون این سامانه شامل مواد گازی است، طبق اصل لوشاتلیه و قانون گاز ایدهآل، با افزایش حجم آن فشار کاهش مییابد و تعادل به سمت جبران کاهش فشار یعنی سمتی که فرآوردههای گازی بیشتری تولید میشود،(از فرآورده به واکنش دهنده) پیش میرود.
به دلیل اینکه تعادل در جهت مصرف فرآورده و تولید واکنشدهنده پیش میرود، تعداد مولهای آمونیاک کاهش مییابد.
سوال ۲
با خط زدن واژه نادرست در هر مورد عبارت زیر را کامل کنید.
هنگامی که در دمای ثابت، فشار بر یک تعادل گازی (افزایش / کاهش) مییابد، واکنش در جهت شمار مولهای گازی (بیشتر / کمتر) پیش میرود تا به تعادل (جدید / آغازی) برسد.
پاسخ
افزایش، کمتر، جدید
سوال ۳
پیشبینی کنید در دمای ثابت با افزایش فشار بر سامانه تعادلی زیر:
- شمار مولهای هر یک از مواد شرکتکننده چه تغییری میکند؟ چرا؟
- غلظت مولی هر یک از مواد شرکتکننده چه تغییری میکند؟ چرا؟
پاسخ
شمار مولهای هر یک از مواد شرکتکننده تغییری نمیکند. زیرا مجموع شمار مولهای گازی در طرف واکنشدهندهها و فرآوردهها برابر است. بنابراین با افزایش فشار، واکنش از نظر لوشاتلیه در جهت خاصی جابهجا نمیشود، چون هیچکدام باعث کاهش فشار نمیشود.
غلظت مولی هر یک از مواد شرکتکننده، افزایش مییابد. زیرا با افزایش فشار در حجم ثابت، گازها فشردهتر میشوند و تعداد مولها در حجم معین بیشتر شده، در نتیجه غلظت مولی (mol/L) تمام مواد گازی افزایش مییابد.
خود را بیازمایید شیمی دوازدهم صفحه ۱۱۰
این سوال به واکنش هابر و سایر واکنشهای تعادلی میپردازد. در ادامه قسمتهای مختلف پاسخ خود را بیازمایید شیمی دوازدهم صفحه ۱۱۰ را بررسی میکنیم.
سوال ۱
با توجه به شکل زیر که نمایی از فناوری تولید آمونیاک به روش هابر را نشان میدهد، به پرسشها پاسخ دهید.
- در مورد روش کار هابر در این فناوری با یکدیگر گفتوگو کنید.
- اگر نقطه جوش آمونیاک، نیتروژن و هیدروژن بهترتیب ۳۳-، ۱۹۶- و ۲۵۳- درجه سلسیوس باشد، کدام دما (۴۰- یا ۲۰۰-) را برای سردکننده مناسب میدانید؟ توضیح دهید.

پاسخ
پاسخ سوالات به شکل زیر است.
- در روش هابر، نیتروژن و هیدروژن در دمای بالا، فشار زیاد و با کاتالیزور آهن واکنش میدهند و آمونیاک تولید میشود. آمونیاک را با سرد کردن جدا میکنند.
- دمای ۴۰- درجه سانتیگراد مناسبتر است زیرا فقط آمونیاک جدا میشود و گازهای دیگر مانند نیتروژن و هیدروژن به صورت گاز باقی میمانند.
سوال ۲
نمودار زیر تغییر غلظت فراورده را برای واکنش تعادلی در دو شرایط متفاوت نشان میدهد.
- این واکنش گرماده است یا گرماگیر؟ چرا؟
- فشار از بزرگتر است یا کوچکتر؟ پاسخ خود را توضیح دهید.
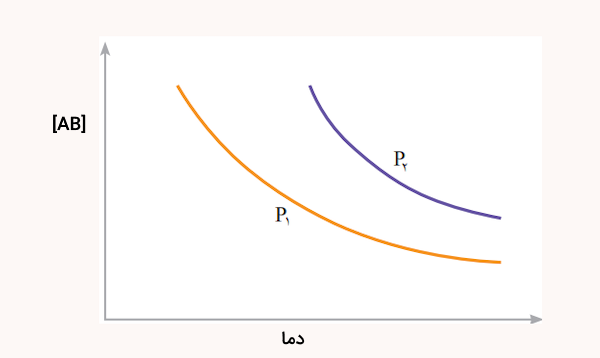
پاسخ
این واکنش گرماده است زیرا با افزایش دما، غلظت فرآورده AB کاهش یافته است. یعنی واکنش در جهت عکس پیش رفته است. همچنین، فشار فشار از بزرگتر است. زیرا افزایش فشار در این واکنش باعث جابهجایی تعادل به سمت فرآورده شده و فشار فرآورده بیشتری را نسبت به تولید کرده است.
یادگیری شیمی دبیرستان با فرادرس
در این مطلب از مجله فرادرس، با پاسخ خود را بیازمایید شیمی دوازدهم و روش حل آنها آشنا شدید. برای درک بهتر این پاسخها باید با فرمولهای شیمی دهم و مسائلی مانند درصد جرمی، انواع غلظت، محلولسازی و … آشنا شوید. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه دروس شیمی دوازدهم دسترسی داشته باشید.
خود را بیازمایید شیمی دوازدهم صفحه ۱۱۴
در نمودار زیر جاهای خالی را با نوشتن نام یا فرمول ماده شیمیایی پر کنید.
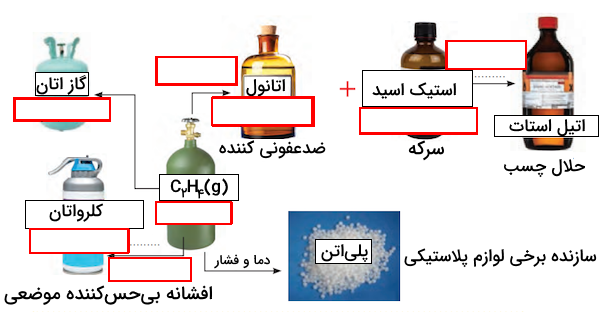
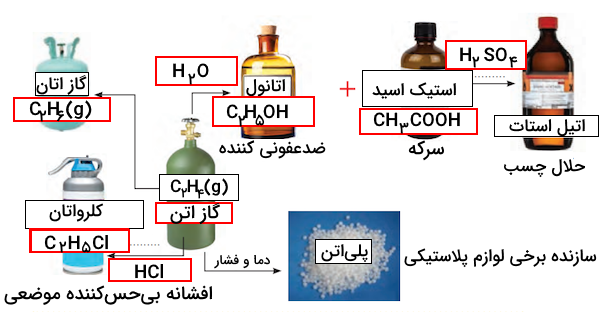
پاسخ
فرمول و نام شیمیایی مواد در پاسخ خود را بیازمایید شیمی دوازدهم صفحه ۱۱۴ به شکل زیر است.
خود را بیازمایید شیمی دوازدهم صفحه ۱۱۶
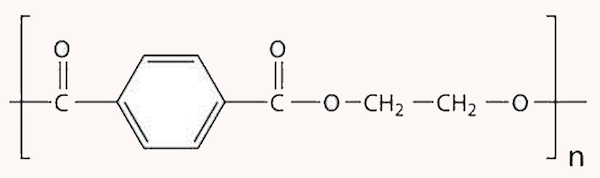
فرمول ساختاری پلیمر سازنده بطری آب به شکل زیر است. با توجه به آن، به پرسشها پاسخ دهید:
- این پلیمر از کدام دسته پلیمرهاست؟ چرا؟
- ساختار مونومرهای سازنده این پلیمر را رسم کنید.
پاسخ
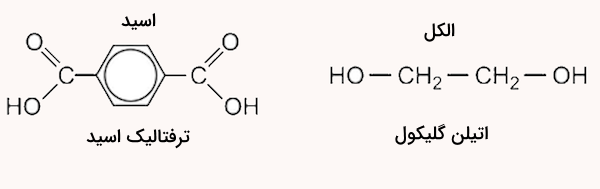
این پلیمر یک پلی استر است زیرا دارای یک اسید و یک الکل است. این پلیمر از دو مونومر ترفتالیک اسید و اتیلن گلیکول تشکیل شده است. این مواد در تصویر زیر مشخص شدهاند.
source
