مول در شیمی یک واحد اندازهگیری است که اندازه واحدهای بزرگی مانند گرم را به ذرات کوچکی مانند اتمها، مولکولها و یونها مربوط میکند. یک مول برابر با عدد آووگادرو () ذره است. این ذرات میتوانند اتم، یون یا مولکول باشند. مول یکی از واحدهای پرکاربرد در محاسبات استوکیومتری در شیمی است و اساس درک واکنشهای شیمیایی را تشکیل میدهد. در این مطلب از مجله فرادرس به توضیح واحد مول در شیمی پرداخته و کاربرد آن را در محاسبات استوکیومتری توضیح میدهیم.
آنچه در این مطلب میآموزید:
-
با مفهوم مول در شیمی و کاربردهای آن آشنا میشوید.
-
میآموزید فرمولهای پرکاربرد محاسبات مول در استوکیومتری کدامند.
-
ارتباط مول و جرم مولی را درک میکنید.
-
با حل مثال و تمرین، روش استفاده از مول در محاسبات استوکیومتری را یاد میگیرید.
-
با سایر کاربردهای مول در شیمی آشنا میشوید.
-
می توانید با حل تمرینها و آزمون پایان درس، یادگیری خود را محک بزنید.

آنچه در ابتدای این مطلب میآموزیم، مفهوم مول در شیمی و کاربردهای آن است. سپس ارتباط مول و جرم مولی را توضیح میدهیم و فرمول و محاسبات مربوط به مول را درک میکنیم. سپس جایگاه مول در محاسبات استوکیومتری مانند محاسبات جرم – جرم و جرم – مول را درک کرده و سایر کاربردهای مول در شیمی را یاد میگیریم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با مفهوم مول و محاسبات آن در شیمی آشنا شوید.
مول در شیمی چیست؟
مول در شیمی یک واحد اندازهگیری SI برای تعداد عدد ذره است. این مقدار ذره عدد آووگادرو نام دارد. مول در شیمی به عنوان واحدی برای تمامی ذرات استفاده میشود. در گذشته این واحد بر اساس تعداد اتمهای موجود در یک نمونه از ایزوتوپ کربن-۱۲ تعریف میشد.
در تعریف اولیه، مول به مقدار هر چیزی گفته میشد که تعداد ذرات آن برابر با تعداد ذرات موجود در ۱۲٫۰۰۰ گرم از اتم کربن-۱۲ باشد. این تعداد ذرات همان عدد آووگادرو است. یک مول اتم کربن یعنی اتم کربن. طبیعتا نوشتن واژه «مول» بسیار سادهتر از نوشتن این عدد در هر بار اشاره به چنین عدد بزرگی است. به همین دلیل، این واحد خاص ابداع شد.

یادگیری شیمی دهم با فرادرس
برای درک بهتر مفهوم و کاربرد مول در شیمی نیاز است ابتدا با مفاهیمی چون جرم اتمی میانگین، یکای جرم اتمی، محاسبات تبدیل کسرها، جرم مولی و … آشنا شوید. پیشنهاد میکنیم برای یادگیری این مفاهیم به مجموعه فیلم آموزش دروس پایه دهم فرادرس بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده میتوانید به آموزشهای بیشتری در زمینه مول در شیمی دسترسی داشته باشید.
کاربرد مول در شیمی
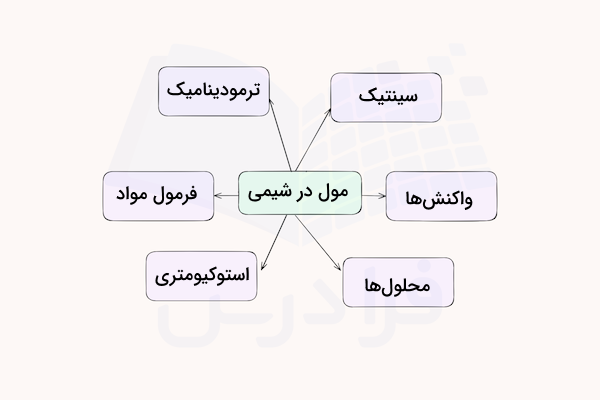
مول یک روش منسجم برای تبدیل بین تعداد اتمها یا مولکولها و گرم در اختیار ما قرار میدهد. این واحد در واقع ابزاری کاربردی برای انجام محاسبات شیمیایی است. در واقع، مفهوم مول پلی میان دنیای میکروسکوپی اتمها و مولکولها و دنیای ماکروسکوپی و قابل مشاهده فراهم میکند.
مفهوم مول در شیمی یکی از پایههای اساسی برای درک کاربردهای عملی و نظری در این علم است. این مفهوم نقش مهمی در محاسبات مربوط به اتمها، مولکولها و واکنشهای شیمیایی دارد و بهطور گستردهای در استوکیومتری، معادلات شیمیایی و آزمایشها در آزمایشگاه استفاده میشود. از این مفهوم میتوان در مباحث استوکیومتری، تعیین و درک فرمول مولکولی، ترمودینامیک و سینتیک استفاده کرد.
استوکیومتری
مفهوم مول در استوکیومتری نقشی اساسی دارد. استوکیومتری شاخه ای از شیمی است که به روابط کمی بین مواد واکنشدهنده و فرآورده در واکنشهای شیمیایی میپردازد. در این محاسبات کمی میتوان با استفاده از مول معادله واکنشهای شیمیایی را موازنه کرد، واکنشدهنده محدودکننده را تعیین کرد و بازده نظری را به دست آورد.
فرمول مولکولی و ترکیب ماده
مول یکی از مهمترین مفاهیم در درک ساختار شیمیایی مواد است. در واقع، فرمول مولکولی مواد شیمیایی نشان میدهد در هر مول مولکول از یک ترکیب، چند مول از هر اتم وجود دارد. برای مثال در ترکیب اسید سولفوریک با فرمول شیمیایی ، ۱ مول از ماده شامل موارد زیر است.
- ۲ مول اتم هیدروژن
- ۱ مول اتم گوگرد
- ۴ مول اتم اکسیژن
مول در واکنش شیمیایی
مفهوم مول یکی از کلیدهای درک واکنشهای شیمیایی است. هر واکنش شیمیایی از واکنشدهندهها، فرآوردهها و ضرایب استوکیومتری تشکیل شده است. ضرایب استوکیومتری به شکل اعدادی در سمت چپ فرمولهای مولکولی مواد نمایش داده میشوند و در واقع مشخص کننده نسبت مولی ترکیبات در واکنش شیمیایی هستند. برای مثال به واکنش شیمیایی زیر دقت کنید.
این واکنش شیمیایی از واکنشدهندههای هیدروژن و اکسیژن و فراورده آب تشکیل شده است. همانطور که مشاهده میکنید، در این واکنش ۲ مول هیدروژن باید با ۱ مول اکسیژن وارد واکنش شده و ۲ مول آب تولید کند.
ترمودینامیک
در ترمودینامیک، از واحد مول برای ارتباط دادن تغییرات انرژی با مقدار ماده استفاده میشود. برای مثال، ظرفیت گرمایی مولی نشاندهنده مقدار گرمایی است که برای افزایش دمای یک مول از ماده به اندازه یک درجه سلسیوس (یا یک کلوین) لازم است.

سینتیک شیمیایی
در سینتیک شیمیایی از واحد مول برای بیان سرعت واکنشهای شیمیایی (سرعت تولید فرآوردهها) استفاده میشود. سرعت واکنش معمولا بر حسب مقدار مول ماده مصرف یا تولید شده در واحد زمان بیان میشود.
شیمی محلول ها
یکی از مهمترین واحدهای اندازهگیری غلظت محلولها، مولاریته است. مولاریته مقدار مولهای ماده حل شونده را در هر لیتر محلول مشخص میکند و فرمول آن به شکل زیر است.
مولاریته = تعداد مول ماده حل شونده ÷ لیتر محلول
فرمول محاسبات در استوکیومتری با مول
مول در شیمی یکی از مهمترین واحدهای اندازهگیری است که اساس محاسبات استوکیومتری و درک واکنشهای شیمیایی را تشکیل میدهد. انجام محاسبات مربوط به مول با داشتن فرمولهای مربوط به آن راحتتر خواهد بود.
در جدول زیر، فرمولها و محاسبات مربوط به مول در استوکیومتری شیمی ارائه شده است.
| نوع محاسبه | فرمول |
| تبدیل گرم به مول | مول = جرم بر حسب گرم ÷ جرم مولی |
| تبدیل مول به گرم | گرم = مول × جرم مولی |
| تبدیل مول به تعداد ذرات | تعداد ذرات = مول × عدد آووگادرو |
| تبدیل تعداد ذرات به مول | مول = تعداد ذرات ÷ عدد آووگادرو |
| تبدیل حجم گاز به مول | مول = حجم گاز ÷ ۲۲٫۴ |
| تبدیل مول به حجم گاز | حجم گاز = مول × ۲۲٫۴ |
| تبدیل مول به لیتر محلول | لیتر محلول = مول ÷ مولاریته |
| تبدیل لیتر محلول به مول | مول = لیتر محلول × مولاریته |
محاسبات و حل مسائل استوکیومتری با استفاده از کسرهای تبدیل یکی از رایجترین نوع سوالات در امتحانات نهایی شیمی و کنکور است. پیشنهاد میکنیم برای یادگیری بهتر این روش محاسبات، فیلم آموزش حل مسائل استوکیومتری با روش تستی و کنکوری فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
مثال و تمرین از فرمول محاسبات با مول
برای درک بهتر این فرمولها، به مثالهای زیر دقت کنید.
مثال ۱
چند مولکول در ۲٫۷۶ مول از آب وجود دارد؟ تعداد اتمهای موجود در این مقدار مول آب را نیز محاسبه کنید.
پاسخ
برای پاسخ به این سوال کافی است تعداد مول آب را در عدد آووگادرو ضرب کنیم تا تعداد مولکولهای آن به دست آید.
همچنین برای محاسبه تعداد اتمهای موجود در این مقدار مول کافی است تعداد مولکولهای به دست آمده را در اتمها آن (سه اتم که شامل ۲ هیدروژن و یک اکسیژن است)، ضرب کنیم.
مثال ۲
چند مول آب در ۲۴۰ گرم آب وجود دارد؟
پاسخ
برای پاسخ به این سوال ابتدا جرم مولی آب را محاسبه کرده و سپس جرم آب را بر جرم مولی آن تقسیم میکنیم تا تعداد مول آن به دست آید.
ارتباط مول و جرم مولی
جرمهای اتمی که بر حسب واحد جرم اتمی (amu) بیان میشوند، میانگین جرم ایزوتوپهای یک عنصر را نسبت به جرم اتم کربن-۱۲ نشان میدهند. در مقابل، جرمهای مولکولی (مولی) مجموع جرمهای اتمی اتمهای موجود در یک مولکول هستند. با استفاده از این جرمها، شیمیدانان میتوانند جرم مولی یک ترکیب را محاسبه کنند. یعنی جرم یک مول از آن ماده که بر حسب گرم بر مول (g/mol) بیان میشود.
جرم مولی یک ترکیب، جرمی است که یک مول از آن ماده دارد و بر حسب گرم بر مول (g/mol) بیان میشود. برای محاسبه آن، باید جرمهای اتمی هر عنصر موجود در فرمول مولکولی ترکیب را با در نظر گرفتن تعداد اتمهای هر عنصر با هم جمع کرد. جرم مولی بهعنوان یک ضریب تبدیل بین جرم و تعداد مول عمل میکند و به شیمیدانان امکان میدهد مقدار ماده را از روی جرم، یا برعکس، محاسبه کنند.
همچنین، جرم میانگین یک یون تکاتمی برابر است با جرم میانگین اتم همان عنصر، چرا که جرم الکترونها بسیار ناچیز است و در اغلب محاسبات قابل صرفنظر کردن است. برای مثال، جرم مولی مولکول آب به شکل زیر محاسبه میشود.
- جرم اتمی هیدروژن: (amu) ۱٫۰۰۷۹۴
- جرم اتمی اکسیژن: (amu) ۱۵٫۹۹۹۴
جرم مولی آب = (۲ × جرم اتمی هیدروژن) + جرم اتمی اکسیژن = ۱۸٫۰۱۵۲۸ گرم بر مول
مول در محاسبات استوکیومتری
در قسمتهای قبل آموختیم که واحد مول یکی از واحدهای مهم در محاسبات استوکیومتری برای محاسبه نسبت واکنش مواد و ارتباط کمی واکنشدهندهها و فرآوردهها استفاده میشود. همچنین، موازنه واکنشهای شیمیایی، محاسبه بازده و واکنشدهنده محدودکننده نیز از کاربردهای مول در استوکیومتری شیمی هستند. در ادامه این محاسبات و روش های آنها را توضیح میدهیم.
اولین قدم در بررسی و انجام واکنشهای شیمیایی، موازنه کردن آن است. در واقع اگر محاسبات را بر اساس معادله واکنش شیمیایی موازنه نشده انجام دهیم، کل محاسبات اشتباه خواهد بود. پیشنهاد میکنیم برای درک بهتر روش موازنه واکنشها، مطلب موازنه واکنش شیمیایی مجله فرادرس را مطالعه کنید.
محاسبات مول – مول
در محاسبات استوکیومتری برای به دست آوردن مقدار مول مادهای مجهول کافی است از ضرایب استوکیومتری ماده استفاده کنیم. برای مثال مشاهده کردیم که در واکنش تشکیل آب، ۲ مول هیدوژن با ۱ مول اکسیژن واکنش داده و ۲ مول آب تولید میکند.
اگر بخواهیم مقدار مول اکسیژن واکنشدهنده با ۱۷٫۶ مول هیدروژن را به دست آوریم، کافی است از نسبت این ضرایب استوکیومتری به شکل زیر استفاده کنیم.
برای درک بهتر این روش، به مثالهای زیر دقت کنید.
مثال ۱
به واکنش زیر دقت کنید. اگر ۱۵۴ مول اکسیژن وارد واکنش شود، چند مول کربن دی اکسید تولید میشود؟
پاسخ
برای پاسخ به این سوال باید از نسبت ضرایب استوکیومتری استفاده کنیم. هر ۱۳ مول اکسیژن در این واکنش ۸ مول کربن دی اکسید تولید میکند. پس برای محاسبه تعداد مول کربن دی اکسید به روش زیر عمل میکنیم.
مثال ۲
در واکنش زیر، چند مول آب با ۱۵۴ مول اکسیژن واکنش میدهد؟
پاسخ
مانند مثال قبل، از نسبت ضرایب استوکیومتری آب و اکسیژن استفاده میکنیم.

محاسبات مول – حجم گاز
قانون آووگادرو بیان میکند که در دمای و فشار یکسان، مقدارهای مساوی از گازها حجم یکسانی را اشغال میکنند. برای مثال، حجم ۱ مول گاز هیدروژن برابر با حجم ۱ مول گاز متان است. در دما و فشار استاندارد، حجم اشغالشده توسط یک مول از هر گازی برابر با ۲۲٫۴ لیتر است.
این مقدار، «حجم مولی گاز در شرایط دمای و فشار استاندارد» یا (STP) نامیده میشود. این مقدار حجم مولی را میتوان برای محاسبه مول یا حجم گاز آزاد شده در واکنشها و محاسبات استوکیومتری مربوط به آن استفاده کرد. برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
حجم گاز اکسیژن تولید شده در شرایط استاندارد واکنش سوختن ۵ مول گاز پروپان را حساب کنید.
پاسخ
برای پاسخ به این سوال از مول داده شده شروع کرده و با استفاده از نسبت مولی اکسیژن و پروپان و ضریب گاز تولید شده در شرایط استاندارد، حجم گاز را به دست میآوریم.
مثال ۲
واکنش تجزیه پتاسیم کلرات مطابق معادله واکنش زیر پتاسیم کلرید و گاز اکسیژن تولید میکند. اگر ۱۲ مول پتاسیم کلرات تجزیه شود، حجم گاز تولید شده چند لیتر خواهد بود؟
پاسخ
مانند مثال قبل از نسبت های مولی و حجم گاز در شرایط استاندارد استفاده میکنیم.
محاسبات مول – جرم
محاسبات مول-مول تنها نوع محاسبهای نیستند که میتوان با استفاده از معادلات شیمیایی موازنهشده انجام داد. همانطور که قبلا اشاره کردیم، جرم مولی را میتوان با استفاده از فرمول شیمیایی به دست آورد و از آن به عنوان یک کسر تبدیل استوکیومتری استفاده کرد. به این صورت که با داشتن تعداد معینی مول از یک ماده، جرم ماده دیگری را با استفاده از جرم مولی آن و نسبت مولی این مواد محاسبه میکنیم. عکس این محاسبات نیز قابل انجام است.
برای مثال در واکنش زیر، ۲ مول آلومینیوم با ۳ مول کلر وارد واکنش شده و ۲ مول آلومینیوم کلرید تولید میکند.
با داشتن جرم مولی کلر و تعداد مول آن میتوانیم جرم آلومینیوم کلرید تولید شده را به دست آوریم. این محاسبات به شکل زیر است.
برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
در واکنش شیمیایی زیر، چند مول اسید کلریدریک از واکنش با ۲۴۹ گرم آلومینیوم کلرید تولید میشود؟ جرم مولی آلومینیوم کلرید برابر با ۱۳۳٫۳۳ گرم بر مول است.
پاسخ
برای محاسبه مقدار مول اسید کلریدریک مانند بالا از جرم مولی و نسبتهای مولی استفاده میکنیم.
مثال ۲
با توجه به واکنش زیر محسابه کنید چند گرم آمونیاک در نتیجه واکنش مقدار کافی نیتروژن با ۳۳٫۹ مول هیدروژن تولید میشود. جرم مولی آمونیاک برابر با ۱۷٫۰۳ گرم بر مول است.
پاسخ
مانند مثال قبل از نسبت های مولی و جرم مولی آمونیاک استفاده میکنیم.

محاسبات جرم – جرم
در قسمت قبل آموختیم چگونه مفهوم مول در شیمی را به جرم یک ماده در محاسبات استوکیومتری تبدیل کنیم. با روشی مشابه میتوانیم مقدار جرم یک ماده مجهول را نیز با استفاده از جرم مادهای دیگر، مفهوم مول و جرم مولی به دست آوریم.
برای این کار پیش از استفاده از واکنش شیمیایی موازنهشده، ابتدا باید مقدار جرم را به مول تبدیل کرد. سپس، با استفاده از ضرایب واکنش شیمیایی موازنهشده میتوان آن را به تعداد مول مادهای دیگر تبدیل کرد و در نهایت این مقدار مول را به جرم تبدیل نمود. برای مثال واکنش شیمیایی زیر را در نظر بگیرید.
اگر در این واکنش ۴۵٫۳ گرم گوگرد دی اکسید داشته باشیم، به راحتی میتوانیم با مفهوم جرم مولی و نسبتهای استوکیومتری، جرم گوگرد تری اکسید را محاسبه کنیم. برای این محاسبات باید از ۲ جرم مولی دو ماده استفاده کنیم. این محاسبات به شکل زیر است.
برای درک بهتر این محاسبات به مثالهای زیر دقت کنید.
مثال ۱
به واکنش زیر دقت کنید. در این واکنش چند گرم منیزیم از واکنش با ۸۶٫۴ گرم پتاسیم تولید میشود؟
پاسخ
برای پاسخ به این سوال ار جرم منیزیم داده شده شروع کرده سپس با استفاده از جرم مولی منیزیم، نسبت استوکیومتری منیزیم و پتاسیم و در نهایت جرم مولی پتاسیم، جرم آن را به دست میآوریم.
مثال ۲
در واکنش زیر چند گرم گاز هیدروژن از واکنش اسید کلریدریک با ۱۲۲ گرم روی به دست میآید؟
پاسخ
مانند سوال قبل عمل کرده و محاسبات زیر را انجام میدهیم.
محاسبه بازده
در تمام محاسبات قبلی که با استفاده از معادلههای شیمیایی موازنهشده انجام دادیم، دو فرض ساده در نظر گرفته شده بود:
- واکنش دقیقا همانطور که نوشته شده انجام شود.
- واگنش به شکل کامل پیش برود و همه واکنشدهندهها مصرف شوند.
اما در واقعیت، همیشه همه چیز به این سادگی نیست. گاهی واکنشهای جانبی اتفاق میافتند و واکنش را پیچیدهتر میکنند. مثلا هنگام سوختن واقعی بعضی ترکیبهای کربندار مثل متان، علاوه بر گاز دیاکسید کربن، مقداری گاز کربن مونوکسید هم تولید میشود. با این حال تا زمانی که مشخص نشده باشد، این واکنشهای جانبی را نادیده میگیریم.
بازده نظری و عملی
فرض دوم یعنی اینکه واکنش کامل انجام میشود، در عمل همیشه درست نیست. بسیاری از واکنشها به دلایل مختلف به طور کامل پیش نمیروند. وقتی ما مقدار محصول را بر اساس فرض مصرف کامل مواد اولیه حساب میکنیم، در واقع به عددی به نام بازده نظری رسیدهایم. این عدد مقدار محصولی را نشان میدهد که طبق محاسبات تئوری باید تولید شود.
اما در واقع مقدار محصول کمتر از چیزی است که انتظار داریم. این مقدار واقعی محصول را بازده عملی مینامند. بازده واقعی همیشه کمتر یا مساوی بازده نظری است و اگر بیشتر باشد، در جایی اشتباهی رخ داده است. هر دو نوع بازده نظری و بازده عملی میتوانند با واحد گرم یا مول بیان شوند. علاوه بر این، در شیمی معمولا از مفهومی به نام درصد بازده (بازده درصدی) هم استفاده میشود که از تقسیم بازده عملی به نظری ضرب در ۱۰۰ به دست میآید.

برای درک بهتر محاسبه بازده به مثالهای زیر دقت کنید.
مثال ۱
مقدار ۳۰٫۵ گرم روی با نیتریک اسید واکنش داده و ۶۵٫۲ گرم زینک نیترات به دست میآید. مقدار بازده نظری، عملی و درصد بازده را محاسبه کنید.
پاسخ
برای به دست آوردن بازده نظری ابتدا مقدار جرم روی نیترات به دست آمده از ۳۰٫۵ گرم روی را مانند محاسبات جرم – جرم به دست میآوریم.
در نتیجه بازده نظری برابر با ۸۸٫۳ گرم است. بازده عملی همان ۶۵٫۲ گرمی است که در صورت سوال داده شده است. برای محاسبه درصد بازده به شکل زیر عمل میکنیم.
مثال ۲
در یک واکنش سنتز، ۲٫۰۵ گرم آمونیاک از ۱۶٫۵ گرم گاز نیتروژن به دست آمده است. مقدار بازده نظری و درصد بازده را به دست آورید.
پاسخ
بازده عملی، همان ۲٫۰۵ گرمی است که در صورت سوال داده شده است. برای محاسبه بازده نظری به شکل زیر عمل میکنیم.
برای محاسبه درصد بازده، بازده عملی را بر بازده نظری تقسیم کرده و در ۱۰۰ ضرب میکنیم.
محاسبه واکنشدهنده محدودکننده
در واکنشهای شیمیایی معمولا فرض میکنیم همه مواد اولیه به اندازه کافی و در نسبت درست وجود دارند تا واکنش کامل انجام شود. اما این فرض همیشه درست نیست. گاهی یکی از مواد زودتر تمام میشود و واکنش متوقف میشود، چون دیگر امکان تولید محصول بیشتر وجود ندارد.
برای تشخیص اینکه کدام ماده محدودکننده است، باید از یک محاسبه مول – جرم یا جرم – جرم استفاده کنیم. هر کدام از واکنشدهندهها که مقدار کمتری از محصول را تولید کند، همان ماده محدودکننده خواهد بود. برای این کار، باید فرض کنیم هر یک از واکنشدهندهها به طور کامل واکنش میدهد و بعد مقدار محصول نهایی را (بر حسب مول یا گرم) حساب کنیم. مادهای که مقدار کمتری از آن محصول را بدهد، ماده محدودکننده است.
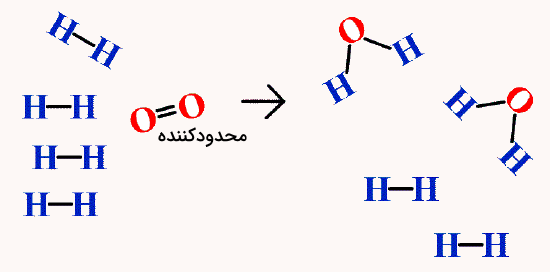
برای درک بهتر نقش مول در شیمی در محاسبه محدودکننده، به مثالهای زیر دقت کنید.
مثال ۱
اگر در واکنش زیر، ۵۰ گرم آرسنیک و ۵۰ گرم اکسیژن وارد واکنش شوند، کدام ماده محدودکننده است؟ چه مقدار واکنشدهنده اضافی باقی میماند؟
پاسخ
برای پاسخ به این سوال، ابتدا مقدار آرسنیک اکسید تولید شده در نتیجه ۵۰ گرم از هریک از واکنشدهندهها را محاسبه میکنیم. مادهای که فرآورده کمتری تولید کند، محدودکننده است.
پس در این واکنش آرسنیک محدودکننده و اکسیژن واکنشدهنده اضافی است. برای محاسبه مقدار اکسیژن باقیمانده باید محاسبه کنیم چه مقدار اکسیژن در نتیجه واکنش با آرسنیک مصرف میشود. اختلاف جرم اولیه اکسیژن و مقدار مصرف شده آن، مقدار باقیمانده آن را مشخص میکند.
پس ۳۴ گرم اکسیژن به صورت واکنش نداده باقی میماند.
مثال ۲
۵ گرم روبیدیم با ۳٫۴۴ گرم منیزیم کلرید وارد واکنش زیر میشود.
چه جرمی از منیزیم تولید میشود و چند گرم از واکنشدهندهها باقی میماند؟
پاسخ
برای پاسخ به این سوال ابتدا جرم منیزیم تولید شده از هر دو واکنشدهنده را به دست میآوریم.
پس روبیدیم واکنشدهنده محدودکننده و منیزیم کلرید واکنشدهنده اضافی است. جرم مصرفی منیزیم کلرید را با استفاده از جرم روبیدیم به دست میآوریم سپس آن را از مقدار اولیه منیزیم کلرید کم میکنیم تا مقدار واکنشدهنده باقیمانده محاسبه شود.
سایر کاربردهای مول در شیمی
در قسمتهای قبل آموختیم کاربرد مول در محاسبات استوکیومتری، سینتیکی و ترمودینامیکی شیمی چگونه است. در ادامه، به توضیح برخی دیگر از کاربردهای واحد مول در شیمی میپردازیم. از این واحد در مکانیک کوانتومی، شیمی تجزیه، بیوشیمی و علم مواد استفاده میشود.
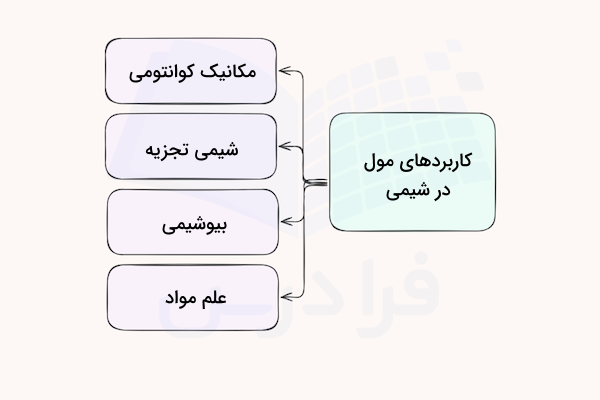
مکانیک کوانتومی
در مکانیک کوانتومی، از مفهوم مول برای توصیف رفتار ذرات در سطوح اتمی و زیراتمی استفاده میشود. برای نمونه، مول در محاسبه جرم میانگین ذرات تکی (ایزوله) کاربرد دارد که این امر برای درک ویژگیهای کوانتومی آنها ضروری است.
شیمی تجزیه
در شیمی تجزیه از مفهوم مول در بیان نتایج آزمایشها و آنالیز مواد استفاده میشود. برای مثال در شیمی تجزیه مقدار یک ماده خاص در یک نمونه محلول بر حسب مولاریته یا مول در گرم گزارش میشود. استفاده از مول در این آنالیزها امکان مقایسه دقیق بین نمونهها را فراهم میکند و به اعتبار و تکرارپذیری روشهای تحلیلی کمک میکند.
بیوشیمی
در بیوشیمی، از واحد مول برای اندازهگیری مقدار بیومولکولها مانند پروتئینها، اسیدهای نوکلئیک و کربوهیدراتها استفاده میشود. این امر به دانشمندان کمک میکند تا استوکیومتری واکنشهای زیستی را درک کنند، غلظت مولکولها در سلول را تعیین کنند و برهمکنشهای بین آنها را مطالعه نمایند.
علم مواد
در علم مواد، مفهوم مول برای محاسبه غلظت نقصها، ناخالصیها و … در مواد استفاده میشود. این واحد اندازهگیری در علم مواد برای درک و تنظیم خواص مواد در کاربردهای مختلف، مانند الکترونیک، کاتالیز و سازههای مهندسی یک واحد مهم به شمار میرود.

یادگیری شیمی دبیرستان با فرادرس
یادگیری و مفهوم مول در شیمی، پایه و اساس درک بسیاری از محاسبات و پدیدههای شیمیایی است. برای درک بهتر مفهوم مول در شیمی و محاسبات مربوط به آن نیاز است با مفاهیمی چون غلظت محلولها، روش تهیه محلولها، موازنه واکنشهای شیمیایی به روش وارسی، انواع واکنشهای شیمیایی و .. آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی دبیرستان دسترسی داشته باشید.
آزمون مول در شیمی
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید. پس از پاسخدهی به تمام سوالات میتوانید با کلیک بر روی گزینه «دریافت نتیجه آزمون» نمره خود را مشاهده کنید.
چند مولکول مس سولفید از واکنش با ۹۰۴۴ اتم هیدروژن طبق واکنش زیر تولید میشود؟
با توجه به معادله واکنش نوشته شده، هر ۲ اتم هیدروژن در هیدروژن سولفید ۱ مولکول سولفید مس تولید میکند.
در مولکول پنیسیلین، چند مول از آن وجود دارد؟
برای به دست آوردن تعداد مول این ماده کافی است تعداد مولکولهای آن را بر عدد آووگادرو تقسیم کنیم.
با توجه به واکنش شیمیایی زیر، چند مول سدیم سولفات در نتیجه واکنش ۱٫۲۲ مول اکسیژن تولید میشود؟
با توجه به واکنش شیمیایی، هر ۳ مول اکسیژن، ۲ مول سدیم سولفات تولید میکند. با استفاده از این نسبتهای مولی میتوانیم تعداد مول سدیم سولفات تولید شده را به دست آوریم.
چه جرمی از کربن دی اکسید در نتیجه واکنش سوختن ۱ مول متان تولید میشود؟
با توجه به معادله شیمیایی، ۱ مول متان دقیقا برابر با ۱ مول کربن دی اکسید آزاد میکند. از آنجا که هر مول کربن دی اکسید جرمی برابر با ۴۴٫۰۱ گرم دارد، جرم کربن دی اکسید تولید شده ۴۴٫۰۱ گرم خواهد بود.
چه جرمی از ماده اکسید آهن (ااا) نیاز است تا ۳۲۴ گرم اکسید آلومینیوم در واکنش زیر تولید شود؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
اگر مقدار ۲٫۶۷۵ گرم از ماده در واکنش ۲٫۳۳۹ گرم سیلیسیم اکسید با هیدروژن فلوئورید تولید شود، بازده عملی و نظری به ترتیب چه مقدار هستند؟
۲٫۳۴ گرم و ۲٫۶۷۵ گرم
۶٫۰۸ گرم و ۲٫۳۳۹ گرم
۳ گرم و ۲٫۳۳۹ گرم
۴٫۰۵ گرم و ۲٫۶۷۵ گرم
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
شیمیدانی ۱٫۰۰۶ گرم سدیم هیدروژن کربنات را طی واکنش زیر تجزیه میکند و ۰٫۳۳۴ گرم سدیم بیکربنات به دست میآورد. مقدار بازده نظری را محاسبه کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
استیلن طی واکنش زیر از ۷٫۰۸ گرم کربن و ۴٫۹۲ گرم هیدروژن تولید شده است. مقدار باقیمانده واکنشدهنده اضافی را به دست آورید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
در یک واکنش خنثی شدن، ۱۸٫۰۶ گرم پتاسیم هیدروکسید با ۱۳٫۴۳ گرم اسید نیتریک واکنش میدهد. محاسبه کنید به ترتیب چه جرمی از آب در این واکنش تولید میشود و چه مقدار واکنشدهنده اضافی باقی میماند.
۵٫۶۲ گرم و ۴ گرم
۲٫۱۵ گرم و ۱٫۴ گرم
۳٫۸۴ گرم و ۶٫۱۲ گرم
۶٫۸۴ گرم و ۸٫۹ گرم
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چند لیتر گاز اکسیژن نیاز است تا به شکلی کامل با ۴ مول گاز اکسیژن در واکنش زیر واکنش دهد؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
