اکتین و میوزین دو پروتئین بسیار مهم در سلولهای ما هستند که در همه انواع سلولهای ماهیچهای و غیرماهیچهای بدن وجود دارند اما مهمترین فعالیت آنها را در سلولهای ماهیچهای میبینیم. این دو پروتئین که در شکلگیری ساختارهای انقباضی ماهیچهها حضور دارند، مسئول انقباض ماهیچهها هستند و به همین دلیل آنها را به عنوان ماهیچههای انقباضی نیز میشناسیم.
آنچه در این مطلب میآموزید:
-
با مونومر و پلیمر اکتین در سلولهای ماهیچهای و غیرماهیچهای آشنا میشوید.
-
فعالیتهای متنوع میوزینها و ساختار مولکولی آنها را یاد میگیرید.
-
با ساختار سارکومرها و نحوه سازماندهی اکتین و میوزین در سارکومر آشنا میشوید.
-
نقش اکتین و میوزین در سارکومرهای ماهیچه قلبی را متوجه میشوید.
-
با نظریه رشتههای لغزان و مراحل آن آشنا میشوید تا روند انقباض ماهیچه را بیاموزید.
-
وظایف اکتین و میوزین در سلولهای غیرماهیچهای مانند نقش آنها در سیتوکینز را یاد میگیرید.

در این مطلب از مجله فرادرس قصد آشنایی کامل با ساختار و انواع فعالیتهای اکتین و میوزین را داریم، بنابراین در ابتدا با ساختار مولکولی این دو پروتئین آشنا میشویم و در گام بعد نقش آنها در ماهیچهها به خصوص ماهیچههای قلبی را بررسی میکنیم زیرا بدون حضور اکتین و میوزین قلب ما نمیتواند بتپد. در بخشهای انتهایی این مطلب به نقشهای دیگر اکتین و میوزین در همه انواع سلولهای بدن میپردازیم زیرا این دو پروتئین در سلولهای غیرماهیچهای نیز حضور دارند و فعالیتهای متنوعی را به پیش میبرند.
اکتین و میوزین
«اکتین» (Actin) و «میوزین» (Myosin) دو پروتئین بسیار مهم هستند که در تمام انواع بافتهای ماهیچهای وجود دارند. همکاری این دو پروتئین اساس فرآیند انقباض ماهیچهها است، یعنی فعالیتهایی مانند حرکات بدن، ضربان قلب، نفس کشیدن، دیدن، شنیدن، قورت دادن غذا و غیره وابسته به حضور و فعالیت این دو پروتئین در ماهیچههای اسکلتی، قلبی و صاف است.
برای شناخت بهتر اکتین و میوزین به عنوان دو پروتئین باید اطلاعات خود در مورد بیوشیمی پروتئینها را افزایش دهیم که به ما اطلاعات قابل اتکایی در مورد ساختار و عملکردهای مختلف پروتئینها میدهد، برای یادگیری بهتر این موضوع پیشنهاد میدهیم از فیلم آموزش بیوشیمی عمومی بخش پروتئین ها و آمینواسیدها فرادرس استفاده کنید که لینک آن در کادر زیر درج شده است.
اکتین و میوزین در ماهیچههای مخطط در ساختارهایی به نام سارکومر سازماندهی میشوند و به این ترتیب سارکومر را به عنوان واحدهای انقباضی ماهیچههای مخطط میشناسیم. کنار هم قرارگیری اکتین و میوزین و همکاری آنها با یکدیگر در ماهیچههای صاف متفاوت از ماهیچههای مخطط است اما انقباض این ماهیچهها نیز وابسته به فعالیت این دو پروتئین انقباضی است.
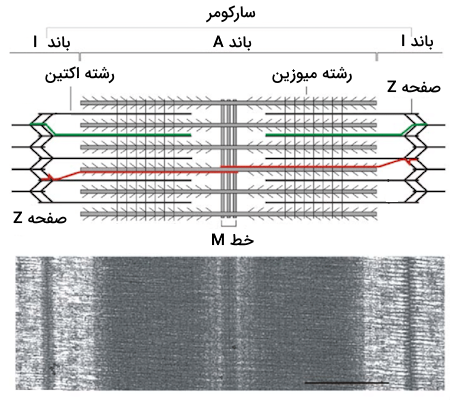
بررسی ساختار اکتین و میوزین به ما نشان میدهد که این دو پروتئین از لحاظ ساختاری تفاوتهای زیادی با یکدیگر دارند، به عنوان مثال اکتین رشتهای نازک است که در حین بررسی سارکومر زیر میکروسکوپ نوار روشن را میسازد، اما پروتئین میوزین ضخامت زیادی دارد و نوار تیره را ایجاد میکند. در تصویر زیر میتوانید نوارهای روشن و تیره ساختار سارکومر را ببینید.
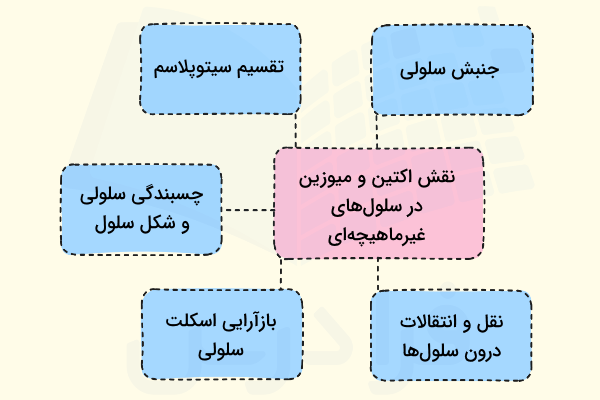
با وجود آن که نقش اکتین و میوزین در سلولهای ماهیچهای بیش از دیگر فعالیتهای آنها مورد توجه است، باید به یاد داشت که این دو پروتئین در سلولهای غیرماهیچهای نیز وظایف مهمی بر عهده دارند که در ادامه به تعدادی از آنها اشاره میکنیم.
- جنبش سلولی: حضور و فعالیت رشتههای اکتین و میوزین برای مواردی مانند خزیدن سلولها و مهاجرت سلولی ضروری است.
- تقسیم سیتوپلاسم: اکتین و میوزین در تشکیل حلقه انقباضی همکاری دارند که تشکیل آن برای تقسیم سیتوپلاسم بین دو سلول دختری ضروری است.
- چسبندگی سلولی و شکل سلول: رشتههای اکتین اغلب با همکاری میوزین باعث چسبیدن سلولها به سطحهای مختلف میشوند، این دو پروتئین ميتوانند به سلولها در حفظ شکل خود نیز کمک کنند.
- بازآرایی اسکلت سلولی: فرآیندهایی مانند آندوسیتوز و پیامرسانی سلولی نیازمند بازآرایی اسکلت سلولی هستند، بنابراین اکتین و میوزین در این فرآیندها نیز همکاری دارند.
- نقل و انتقالات درون سلولی: مولکولها و اندامکهای مختلفی که در درون سلول جابهجا میشوند به کمک رشتههای اکتین و میوزین نیاز دارند. در حقیقت میوزینها به عنوان موتورهای مولکولی عمل میکنند و بارهای مختلف را در طول رشتههای اکتین که مانند ریل قطار هستند، جابهجا میکنند.
تفاوت اکتین و میوزین
با بررسی ساختار ماهیچهها متوجه میشویم دو پروتئین اکتین و میوزین در تمام انواع بافتهای ماهیچهای حضور دارند و با همکاری یکدیگر باعث انقباض ماهیچهها میشوند، اما این دو پروتئین که تا اینجای مطلب در مورد آنها اطلاعاتی کامل کسب کردیم، با یکدیگر تفاوتهای بسیار مهمی دارند که مهمترین آنها را میتوان این موضوع دانست که اکتین در ساختار سارکومرها سازنده «رشتههای نازک» (Thin Filaments) است، در حالی که میوزین در تشکیل «رشتههای ضخیم» (Thick Filaments) نقش دارد.
دیگر تفاوتهای اکتین و میوزین را میتوان با معیار قرار دادن مواردی مانند ساختار، جایگاه قرارگیری هر پروتئین، تعداد هر پروتئین در ساختار سارکومر و غیره بررسی کرد که در ادامه به کمک یک جدول تمام این تفاوتها را مطرح میکنیم.
| اکتین | میوزین |
| سازنده رشتهای نازک و کوتاه | سازنده رشتهای ضخیم و بلند |
| پروتئینها تنظیمی: تروپونین و تروپومیوزین | پروتئین تنظیمی: مرومیوزین |
| محل قرارگیری: باندهای A و I ساختار سارکومر | محل قرارگیری: باند A ساختار سارکومر |
| عدم همکاری در تشکیل پل عرضی | تشکیلدهنده پل عرضی |
| رشته اکتین سطحی صاف دارد. | رشته میوزین سطحی زبر دارد. |
| تعداد رشتههای اکتین بسیار زیاد است. | به ازای هر ۶ رشته اکتین، یک رشته میوزین وجود دارد. |
| حضور در باندهای روشن سارکومر | حضور در باندهای تیره سارکومر |
| یکی از سرهای رشته اکتین آزاد است. | هر دو سر رشته میوزین آزاد است. |
شناخت ساختار و فعالیتهای مولکولهای زیستی با فرادرس
انواع مختلف سلولهای زنده از پروکاریوتها گرفته تا یوکاریوتهای جانوری و گیاهی از مولکولهای مختلفی تشکیل شدهاند که گروهی از آنها در ایجاد ساختار سلول با یکدیگر همکاری دارند و گروهی دیگر فعالیتهای متابولیسمی یا کاتابولیسمی سلول را بر عهده گرفتهاند. تمام این مولکولهای متنوع زیستی را میتوان در چهار گروه اصلی دستهبندی کرد که با عناوین لیپیدها، کربوهیدراتها، اسیدهای نوکلئیک و پروتئینها شناخته میشوند.
شناخت خصوصیات این دستهها و مولکولهایی که در هر گروه طبقهبندی شدهاند به ما در درک بسیاری از فرآیندهای زیستی کمک میکند، در حقیقت مطالعه این مولکولها در یکی از زیرشاخههای زیستشناسی به نام «بیوشیمی» (Biochemistry) انجام میشود و داشتن اطلاعات کامل در زمینه بیوشیمی میتواند مسیر یادگیری فیزیولوژی سلولها، اندامها و دستگاهها را ساده کند. یکی از بهترین راههای یادگیری بیوشیمی استفاده از فیلمهای آموزشی است، بنابراین در ادامه تعدادی از کاملترین فیلمهای آموزشی فرادرس را که به بررسی بیوشیمی پرداختهاند به شما معرفی میکنیم.
اکتین چیست؟
اکتین فراوانترین پروتئین در بیشتر انواع سلولهای یوکاریوتی است و نقشی اساسی در تشکیل اسکلت سلولی دارد، این پروتئین در انقباض ماهیچهها و حرکت سلولها نیز مشارکت دارد. در طول تکامل توالی ژنتیکی اکتین دچار تغییراتی بسیار اندک شده است، بنابراین اکتین در گروه پروتئینهای حفاظت شده قرار میگیرد. پروتئینهای همولوگ اکتین را میتوان حتی در پروکاریوتها و آرکیها نیز دید، این پروتئینها قادر به تولید رشتههای مارپیچی یا خطی هستند، بنابراین در پروکاریوتها نیز میتوانیم اکتین را به صورت پلیمر ببینیم.
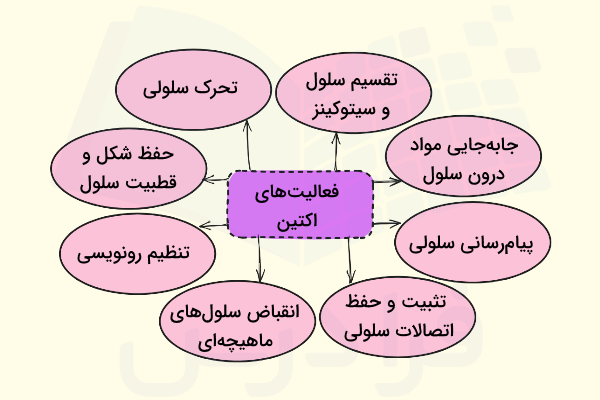
نکته مهم دیگری که در مورد اکتین باید بدانیم این است که بیش از هر پروتئین دیگری در برهمکنشهای پروتئین با پروتئین شرکت میکند، این ویژگی خاص اکتین در کنار ساختار مونومری و پلیمری آن که در ادامه به آن میپردازیم، باعث میشود که اکتین بتواند در بسیاری از فعالیتهای سلول نقشی مهم داشته باشد. در ادامه چهار مورد از این فعالیتهای سلولی که وابسته به حضور اکتین هستند را معرفی میکنیم.
- «تحرک سلولی» (Cell Motility)
- حفظ شکل و قطبیت سلول
- تنظیم رونویسی
- انقباض سلولهای ماهیچهای
- تقسیم سلول و سیتوکینز
- جابهجایی وزیکولها و اندامکها درون سلول
- پیامرسانی سلولی
- تثبیت و حفظ اتصالات سلولی
در مورد ساختار پروتئین اکتین باید بدانیم که در اصل اکتین خانوادهای از پروتئینهای کروی است که چندین فعالیت، از قبیل ساخت میکروفیلامنتهای اسکلت سلولی و رشته نازک موجود در فیبریلهای ماهیچهای نقش دارند. با این توضیحات میتوان متوجه شد که اکتین زیرواحد مونومری دو رشته مختلف در سلولها است.
- ریز رشتهها یا «میکروفیلامنتها» (Microfilaments): یکی از سه جزء اصلی ساختار اسکلت سلولی
- رشتههای نازک یا «فیلامنتهای نازک» (Thin Filaments): بخشی از ساختار انقباضی سلولهای ماهیچهای
اکتین را میتوان به دو صورت مونومر یا پلیمر در سلولها دید، در ادامه با عنوانهای مربوط به هر فرم آشنا میشویم.
- «اکتین کروی» (Globular Actin | G-actin): فرم آزاد اکتین را با عنوان اکتین کروی میشناسیم که به صورت مونومر در سلول وجود دارد.
- «اکتین رشتهای» (Filamentous Actin | F-actin): اکتین رشتهای نام فرم پلیمر شده اکتین است که از کنار هم قرارگیری زیر واحدهای اکتین کروی ساخته شده است. اکتین رشتهای را به صورت رشته خطی میتوان در سلولها مشاهده کرد.
اکتین مونومری ساختاری کروی دارد که شامل دو لوب است که با یک شکاف عمیق از یکدیگر جدا شدهاند. در بخش پایینی این شکاف ناحیهای وجود دارد که میتواند به یون منیزیوم و یک مولکول ATP متصل شود. دلیل اتصال این مولکول ATP به این موضوع برمیگردد که برای پایدار ماندن هر مونومر اکتین، باید آن مونومر به ATP یا ADP متصل باشد؛ زیرا در صورت عدم اتصال این مولکولها، اکتین به سرعت دناتوره شده و ساختار مولکولی خود را از دست میدهد.
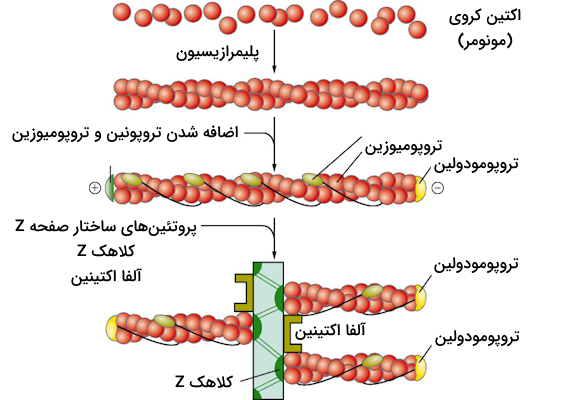
ساخت F-اکتین از مونومرهای G-اکتین
در در شرایط مختلفی مولکولهای G-اکتین میتوانند به یکدیگر بپیوندند و رشتههای بلندتری را ایجاد کنند که همانطور که پیشتر گفتیم با نام اکتین رشتهای یا F-اکتین شناخته میشوند. رشتههای F-اکتین بهطور معمول از دو رشته مارپیچی اکتین تشکیل شدهاند که به طور یکدیگر پیچیدهاند و قطری در حدود ۷ الی ۹ نانومتر دارند.
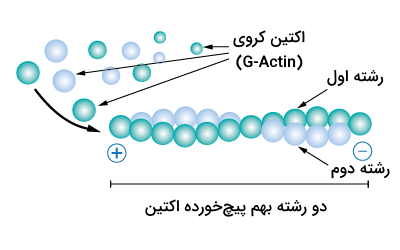
در زمان تشکیل رشتههای F-اکتین تمام مولکولهای G-اکتین در یک جهت قرار میگیرند، نکته دیگری که در مورد اکتین رشتهای باید بدانیم این است که جهت شکاف G-اکتین انتهایی در هر دو سوی رشته باعث میشود که هر رشته F-اکتین دارای دو جهت زیر باشد.
- انتهای منفی: در انتهای منفی اکتین رشتهای، مولکول G-اکتین وجود دارد که شکاف اتصال به ATP به سمت بیرون قرار دارد.
- انتهای مثبت: در انتهای مثبت اکتین رشتهای، شکاف اتصال به ATP مولکول G-اکتین به سمت داخل رشته است و با اکتین مجاور در تماس است، بنابراین نمیتوان به این شکاف دسترسی داشت.
نحوه رشد رشته F-اکتین به این صورت است که به طور معمول زیرواحدهای جدید که با هدف طویل شدن رشته به آن میپیوندند، به انتهای مثبت اضافه میشوند و برای کوتاه شدن رشته نیز مونومرها از انتهای منفی رشته F-اکتین جدا میشوند.
میوزین چیست؟
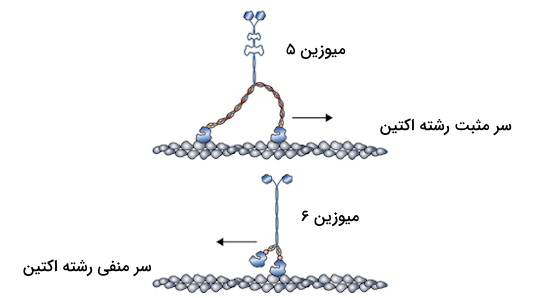
میوزینها خانوادهای از پروتئینهای حرکتی هستند که مهمترین نقش آنها در انقباض ماهیچهها است اما در فعالیتهای دیگری که مربوط به تحرک سلولهای یوکاریوتی است نیز ایفای نقش میکنند. به عنوان مثال فرآیندهایی که مربوط به انتقال مولکولها، وزیکولها و اندامکهای سلولی درون سلولها هستند میبینیم که میوزینهای مختلف در حال فعالیت هستند. انواع مختلفی میوزین تاکنون کشف و بررسی شدهاند؛ به بیان دقیقتر، ۲۴ نوع میوزین شناخته شدهاند که از بین آنها ۶ نوعی که در ادامه نام میبریم بیش از بقیه شناخته شدهاند.
- «میوزین یک» (Myosin I)
- «میوزین دو» (Myosin II)
- «میوزین پنج» (Myosin V)
- «میوزین شش» (Myosin VI)
- «میوزین هفت» (Myosin VII)
- «میوزین ده» (Myosin X)
از بین این شش میوزن نیز میوزین نوع یک و میوزین نوع دو بیشتر هدف مطالعات تحقیقاتی بودهاند، زیرا میوزین نوع یک مسئول انتقال وزیکولها و مولکولهای مختلف درون سلول است و میوزین نوع دو با شرکت در ساختار سارکومر، مسئول انقباض ماهیچهها است. برای شناخت بهتر فعالیت میوزین، به خصوص میوزین نوع ۲ که مسئول انقباض ماهیچهها است، در ادامه بخشی را به معرفی ساختار مولکولی میوزین اختصاص میدهیم.
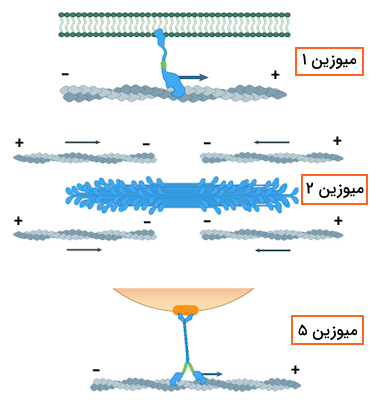
ساختار مولکولی میوزین
اکثر پروتئینهایی که در خانواده میوزینها قرار دارند، به ویژه میوزین نوع دو که هدف اصلی ما در این مطلب است، دارای ساختاری خاص هستند که میتوان آن را به سه بخش یا «دومین» (Domain) اصلی تقسیم کرد.
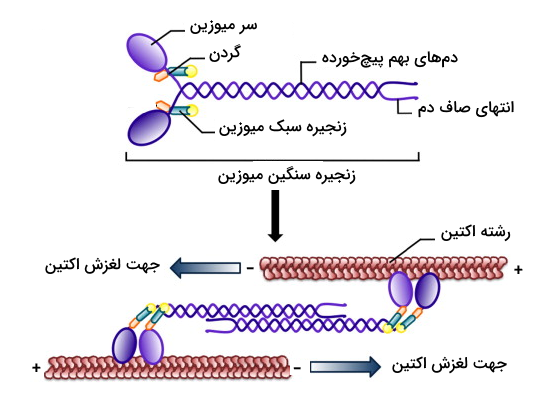
- «سر» (Head): ناحیه سر توانایی هیدرولیز ATP و تامین انرژی مورد نیاز برای حرکت را دارد، این ناحیه میتواند به رشتههای اکتین متصل شود و آنها را به سمت مرکز سارکومر بکشد.
- «گردن» (Neck): گردن محل اتصال زنجیرههای سبک میوزین به زنجیره سنگین است. این زنجیرههای سبک که در تنظیم فعالیت میوزین نقش دارند، به این دلیل به ناحیه گردن متصل میشوند که گردن به عنوان نوعی اهرم مکانیکی عمل میکند و نیروی تولید شده توسط سر را به حرکتی موثر تبدیل میکند.
- «دم» (Tail): در میوزینهایی که مسئول جابهجایی مولکولها در سلول هستند، دم میوزین به «مولکولهای بار» (Cargo Molecules) متصل میشود اما در سارکومر میتوان گفت که میوزینها برای تشکیل رشته ضخیم از طریق دم خود ساختارهای دیمر یا پلیمر را میسازند.
امکان تجزیه ATP توسط سر میوزین نقش بسیار مهمی در انقباضات ماهیچهای دارد زیرا با تجزیه ATP به ADP و Pi یا همان فسفات معدنی، میوزین در وضعیتی قرار میگیرید که آمادگی اتصال به جایگاه اتصال میوزین به اکتین را دارد. تجزیه ATP باعث آزادسازی انرژی مورد نیاز برای حرکت سر میوزین نیز میشود بنابراین به این مرحله از انقباض سارکومرها «مرحله قدرت» میگوییم که در طی آن فسفات معدنی آزاد میشود و به دنبال آن ساختار میوزین تغییر میکند.
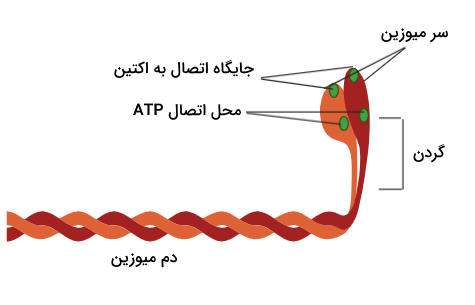
تغییر ساختار میوزین باعث میشود که میوزین رشته اکتین را به سمت مرکز سارکومر بکشد، اما با آزاد شدن مولکول ADP میوزین در وضعیتی به نام «وضعیت سفتی» (Rigor State) میشود. برای خارج شدن میوزین از وضعیت سفتی، یک مولکول ATP به سر میوزین متصل میشود و به این ترتیب میوزین از اکتین جدا میشود، در ادامه این مولکول ATP هیدرولیز شده و انرژی مورد نیاز برای اتصال مجدد میوزین به اکتین فراهم میشود.
میوزین نوع ۲
میوزین نوع ۲ را میتوان شناخته شدهترین نوع میوزین دانست، زیرا این مولکول مسئول ایجاد انقباضات عضلانی در سلولهای ماهیچهای اغلب جانوران است. در بررسی ساختار میوزین نوع دو متوجه میشویم که این پروتئین از دو زنجیره سنگین و چهار زنجیره سبک تشکیل شده است. زنجیرههای سنگین میوزین نوع دو ساختارهای اصلی میوزین یعنی سر، گردن و دم را میسازند. با توجه به این که گفتیم دو زنجیره سنگین در ساختار میوزین نوع دو وجود دارد به نکات زیر توجه داشته باشید.
- میوزین نوع دو دارای دو سر است.
- دمهای هر زنجیره سنگین به دور یکدیگر میپیچند.
- ناحیه گردن بین سر و دم قرار دارد و باعث میشود سر و دم نسبت به یکدیگر زاویه داشته باشند.
در مورد زنجیرههای سبک میوزین باید گفت که ۲ زنجیره سبک برای هر سر وجود دارد، بنابراین در مجموع ۴ زنجیره سبک در ساختار یک مولکول میوزین نوع دو وجود دارد که به گردن میوزین متصل هستند.
اکتین و میوزین در ماهیچه قلبی
تا اینجا متوجه شدیم اکتین و میوزین به عنوان دو پروتئین انقباضی چه ویژگیهای ساختاری و عملکردی دارند. در این بخش قصد داریم به نقش این دو پروتئین در سلولهای ماهیچه قلبی بپردازیم، زیرا فعالیت انقباضی سارکومرهای ماهیچه قلبی این اجازه را به عضله قلب میدهد که با تپش خود خون را به تمام بدن پمپ کند.
اکتین و میوزین در قلب به همراه تعدادی پروتئین ساختاری را میسازند که آن را با نام «سارکومر» (Sarcomere) میشناسیم. سارکومرها واحدهای عملکردی انقباض عضلات مخطط، یعنی ماهیچه قلب و ماهیچههای اسکلتی هستند. عملکرد این دو پروتئین را به طور خلاصه میتوان به این صورت توصیف کرد که میوزین میتواند با صرف انرژی به رشته اکتین متصل شود و روی رشته اکتین بلغزد، لغزش میوزین باعث میشود که رشتههای اکتین که در دو سمت سارکومر وجود دارند به سمت مرکز سارکومر کشیده شوند و به این ترتیب شاهد کوتاه شدن سارکومر هستیم.
کوتاه شدن سارکومرها نیز باعث منقبض شدن قلب و در نهایت پمپ شدن خون از قلب به بخشهای مختلف بدن میشود؛ بنابراین فرآیند لغزش میوزین بر روی رشتههای اکتین برای فعالیت منظم قلب و تداوم گردش خون در بدن ضروری است. برای یادگیری بهتر این روند انقباضی و نقش هر یک از این دو پروتئین در ادامه با ساختار سارکومر و نقش اکتین و میوزین در تشکیل و فعالیت سارکومرها آشنا میشویم.
ساختار اکتین و میوزین در سارکومر
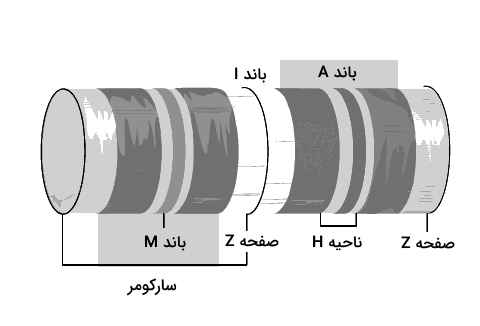
سارکومرها واحدهای انقباضی ماهیچههای مخطط هستند که طول آنها در حدود ۲ الی ۳ میکرومتر است و میتوان آنها را به کمک میکروسکوپهای الکترونی مشاهده کرد. در بررسی ساختار سارکومر با استفاده از میکروسکوپ با باندها و خطوط مختلفی روبهرو میشویم که رشتههای اکتین و میوزین در شکلگیری آنها نقش داشتهاند، بنابراین در ادامه به طور خلاصه به معرفی باندها و خطوط ساختاری سارکومرهای ماهیچهای میپردازیم.
- صفحه Z یا دیسک Z: صفحه Z رشتههای اکتین دو سارکومر مجاور را از یکدیگر جدا میکند، بنابراین میتوان آن را مرز بین دو سارکومر دانست. با توجه به این تعریف میتوان گفت که سارکومر فاصله بین دو صفحه Z است.
- باند A: این باند که آن را با نام «باند آنیزوتروپیک» (Anisotropic Band) نیز میشناسیم، محلی است که رشته ضخیم میوزین به طور کامل در آن قرار دارد و بخش از آن نیز مربوط به ناحیه همپوشانی اکتین و میوزین است. این ناحیه در زیر میکروسکوپ به صورت نواری تیره دیده میشود.
- باند I: این باند که آن را با نام «باند ایزوتروپ» (Isotropic Band) نیز میشناسیم، فقط شامل رشتههای نازک اکتین است. باند I در زیر میکروسکوپ به صورت نوار روشن دیده میشود.
- خط M: خط M در مرکز سارکومر قرار دارد و حاوی پروتئینی به نام «میومیوزین» (Myomesin) است که به تثبیت ساختار رشته ضخیم کمک میکند.
- ناحیه H: این ناحیه بین خط M و صفحه Z قرار دارد و تنها حاوی میوزین است و در آن هیچ همپوشانی بین اکتین و میوزین وجود ندارد. نکتهای که در مورد ناحیه H وجود دارد این است که در حین انقباض ماهیچه، ناحیه H بسیار کوتاه میشود و حتی میتوان گفت که محو میشود.
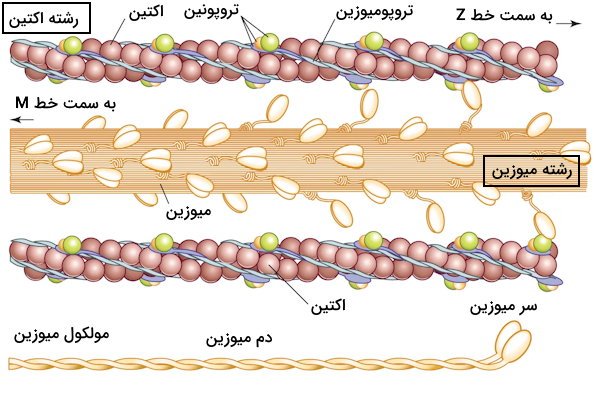
حالا که با بخشهای مختلف سارکومر در تصاویر میکروسکوپی آشنا شدیم، زمان آن فرا رسیده که به این موضوع بپردازیم که اکتین و میوزین برای تشکیل این ساختار چگونه سازماندهی میشوند. هر سارکومر دارای دو دسته رشته اکتین است که جهتگیری آنها مختلف یکدیگر است و با رشتههای میوزین در ارتباط هستند. دو دسته رشته اکتین به نحوی سازمان یافتهاند که انتهای مثبت آنها به صفحههای Z که در دو طرف سارکومر قرار دارند لنگر میاندازند.
رشتههای میوزین در وسط این دستههای اکتین قرار میگیرند و به نحوی گسترش مییابند که از هر دو طرف با رشتههای اکتین ارتباط برقرار کنند. در تصویر زیر میتوانید برهمکنش رشتههای اکتین و میوزین با یکدیگر را بهتر متوجه شوید.
در صورتی که علاقهمند به کسب اطلاعات کامل در مورد سارکومر، نحوه سازماندهی اکتین و میوزین در ساختار آن و پروتئینهای تنظیمی فعالیت سارکومرها دارید، پیشنهاد میدهیم مطلب «سارکومر چیست؟ – توضیح ساختار و شکل به زبان ساده» از مجله فرادرس را مطالعه کنید.
نظریه رشته های لغزان
تا اینجا به طور کامل با رشتههای اکتین و میوزین آشنا شدیم و یاد گرفتیم چطور در ساختار سارکومرهای سلولهای ماهیچه مخطط سازماندهی میشوند اما برای بررسی عملکرد این دو پروتئین انقباضی باید به شیوه همکاری آنها درحین انقباض عضلات بپردازیم. در حقیقت در طی انقباض ماهیچهها، رشتههای اکتین و میوزین بر روی یکدیگر میلغزند و طول سارکومر را کاهش میدهند. شروع انقباض ماهیچههای اسکلتی وابسته به رسیدن پتانسیل عمل از سوی نورونهای سیستم عصبی است اما در سلولهای ماهیچه قلبی میتوانند خود به خود تحریک و منقبض شوند.
ادامه روند انقباض این دو نوع ماهیچه مشابه یکدیگر است، بنابراین میتوانیم روند انقباض را در مراحل زیر توضیح دهیم.
- باز شدن کانالهای کلسیمی
- در دسترس قرار گرفتن جایگاه اتصال میوزین به رشته اکتین
- اتصال سر میوزین به یکی از جایگاههای اتصال موجود روی رشته اکتین
- هیدرولیز ATP
- کشیده شدن رشته اکتین به سمت مرکز سارکومر توسط میوزین
- شکسته شدن پل عرضی میان اکتین و میوزین
- اتصال سر میوزین به جایگاه اتصال متفاوتی روی رشته اکتین
- تکرار چرخه
هر یک از این مراحل جزئیات خاصی دارند که در ادامه آنها را توضیح میدهیم اما پیش از آن میتوانید با استفاده از تصویر متحرک زیر دیدی جامع نسبت به روند رسیدن پتانسیل عمل به سلول ماهیچه، آزاد شدن کلسیم از شبکه سارکوپلاسمی، کنار رفتن پروتئینهای تنظیمی و اتصال سر میوزین به رشته اکتین و در نهایت انقباض سارکومر به دست آورید. در این تصویر واژههای «Actin»، «Myosin»، «Troponin» و «Tropomyosin» به ترتیب به پروتئینهای «تروپونین»، «میوزین»، «اکتین» و «تروپومیوزین» اشاره دارند و منظور از واژه «Binding Sites» نیز «جایگاههای اتصال سر میوزین به رشته اکتین» است.

باز شدن کانالهای کلسیمی شبکه سارکوپلاسمی
در سلولهای ماهیچهای اندامکی تخصص یافته به نام شبکه سارکوپلاسمی وجود دارد که محل ذخیره کلسیم است. با تحریک سلول ماهیچه کانالهای کلسیمی موجود روی غشا شبکه سارکوپلاسمی باز میشوند و یونهای کلسیم ذخیره شده در این اندامک از آن خارج شده و وارد سیتوپلاسم میشوند؛ بنابراین باز شدن کانالهای کلسیمی غلظت یون کلسیم در سیتوپلاسم را افزایش میدهد.
در دسترس قرار گرفتن جایگاه اتصال میوزین به رشته اکتین
در ساختار سارکومر دو پروتئین تنظیمی به نامهای «تروپونین» (Troponin) و «تروپومیوزین» (Tropomyosin) وجود دارند که با پوشاندن جایگاه اتصال میوزین به اکتین، مانع تشکیل پل عرضی بین اکتین و میوزین در زمانی هستند که غلظت یون کلسیم پایین است. با افزایش غلظت یون کلسیم در سارکوپلاسم یا همان سیتوپلاسم سلولهای ماهیچهای، شاهد کنار رفتن این پروتئینهای تنظیمی از روی اکتین هستیم، زیرا کلسیم میتواند به تروپونین متصل شود و از طریق این اتصال باعث تغییر ساختار فضایی تروپومیوزین شود.
تغییر شکل تروپومیوزین نیز باعث میشود که این پروتئین از روی رشته اکتین بلند شده و جایگاه اتصال میوزین به اکتین را در دسترس میوزین قرار دهد. با این توضیحات میتوان متوجه شد که دلیل آزادسازی کلسیم از شبکه سارکوپلاسمی اثر تنظیمی آن بر اتصال تروپونین و تروپومیوزین به رشته اکتین است.
اتصال سر میوزین به یکی از جایگاههای اتصال
سرهای میوزین به جایگاههای اتصال موجود روی رشتههای اکتین متصل میشوند و به این ترتیب «پلهای عرضی» (Cross-Bridges) را بین رشته ضخیم و رشته نازک تشکیل میدهند.
هیدرولیز ATP
در این مرحله آنزیم «ATP هیدرولاز» (ATP Hydrolase) در نتیجه آزادسازی یون کلسیم فعال میشود و مولکول ATP را به ADP و Pi تجزیه میکند، در طی این واکنش انرژی آزاد میشود که برای حرکت سر میوزین نیاز است.
کشیده شدن اکتین توسط میوزین
در این مرحله که با عنوان «مرحله قدرت» (Power Stroke) شناخته میشود، انرژی حاصل از تجزیه ATP باعث تغییر زاویه سر میوزین میشود، نتیجه این تغییر زاویه نیز کشیده شدن رشته اکتین به سمت مرکز سارکومر است. کشیدن شدن رشتههای اکتین باعث کوتاه شدن طول سارکومر و انقباض ماهیچه میشود.
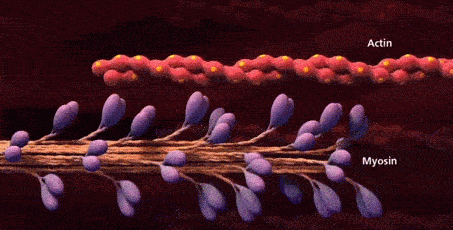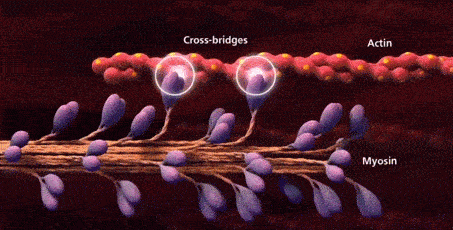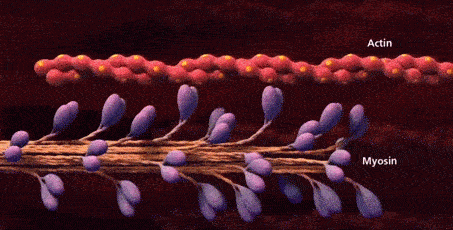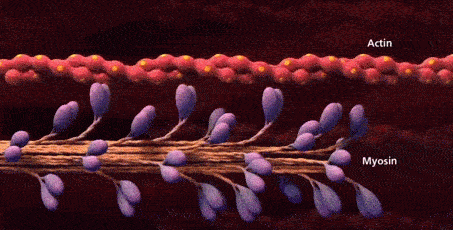
شکسته شدن پل عرضی
با اتصال مولکول ATP به سر میوزین، میوزین از رشته اکتین جدا میشود، بنابراین میتوان گفت که اتصال ATP باعث شکسته شدن پل عرضی میشود.
اتصال مجدد سر میوزین به جایگاه اتصال
مولکول ATP جدید توسط ATP هیدرولاز تجزیه میشود تا دوباره سر میوزین به رشته اکتین متصل شود و آن را به سمت مرکز سارکومر بکشد.
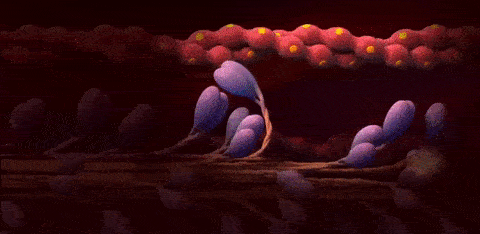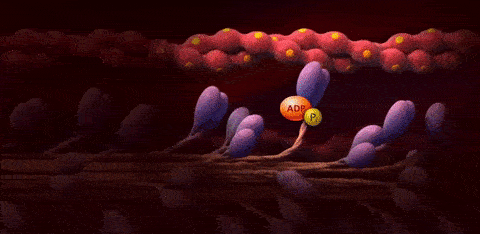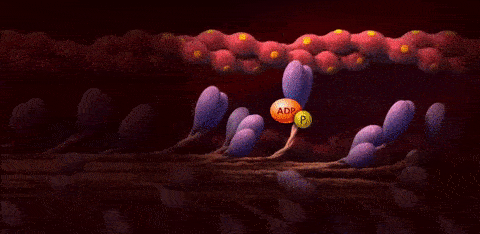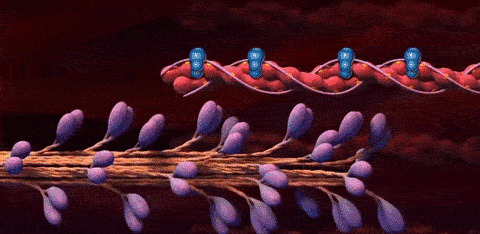
تکرار چرخه
این چرخه میتواند تا ۱۰۰ بار بر ثانیه تکرار شود. یعنی سر میوزین در عرض یک ثانیه میتواند صد بار به اکتین متصل شده و آن را به سمت مرکز سارکومر بکشد.
یادگیری زیست شناسی سلولی و مولکولی
زیست شناسی سلولی و مولکولی که یکی از مهمترین زیرشاخههای زیست شناسی است، به مطالعه انواع مختلف سلولها میپردازد. این مطالعات را میتوان از جنبههای مختلف انجام داد به عنوان مثال میتوان دستهبندیهای سلولی مختلف را شناخت و با ماهیت پروکاریوتها و یوکاریوتها آشنا شد یا به بررسی ساختار سلول و مولکولهای سازنده سلولها مشغول شد.
مطالعات سلولی با توجه به پیچیدگیهای ساختار و فعالیت سلولها چالشهای مختلفی دارند و یادگیری مباحث مربوط به آنها دشوار به نظر میرسد اما با استفاده از فیلمهای آموزشی میتوان به تصویرسازیهای علمی از سلولها و مولکولها دسترسی داشت، زیرا اساتید با تجربه برای بهبود کیفیت تدریس خود از تمام ابزارهای موجود استفاده میکنند. در ادامه تعدادی از فیلمهای آموزشی که به کمک آنها میتوانید مباحث مختلف سلولی و مولکولی را یاد بگیرید، معرفی میکنیم.
اکتین و میوزین در سلول های غیرماهیچهای
رشتههای اکتین و میوزین یا به بیان دیگر رشتههای اکتومیوزین نه تنها در انقباض ماهیچهها نقش دارند، بلکه در سلولهای غیرعضلانی نیز نقشهای مهمی بر عهده دارند. این دو پروتئین در تشکیل «دستههای انقباضی» (Contractile Bundles) در سلولهای غیرعضلانی نقش دارند. این دستههای انقباضی در مقایسه با ساختار بسیار سازمان یافته سارکومرها، کوچکتر و نامنظمتر هستند و توسط پروتئینهایی که در ادامه نام میبریم به یکدیگر متصل میشوند.
- «فاسین» (Fascin)
- «فیلامین» (Filamin)
- «فیمبرین» (Fimbrin)
تشکیل دستههای انقباضی و قدرت انقباض آنها تحت تاثیر فسفریلاسیون قرار دارد ولی مکانیسم عملکرد آنها مشابه فیبرهای عضلانی است، یعنی هیدرولیز مولکولی ATP توسط سر میوزین، نیروی مورد نیاز برای انقباض رشتههای اکتین را فراهم میکند.
در سلولهای اپیتلیال دستههای اکتومیوزینی به اتصالات چسبنده که یکی از انواع اتصالات سلولی هستند، متصل شده و به شکل کمربندی چسبنده در نزدیکی غشای پلاسمایی حضور دارند. این کمربندها در انقباضات راسی سلولهای اپیتلیال قطبی شده نقش دارند.
دستههای اکتومیوزینی در سلولهای در حال تقسیم نیز عملکردی بسیار مهم دارند. برای فرآیند سیتوپلاسم در سلولهای جانوری که به عنوان فرآیند سیتوکینز نیز شناخته میشود باید در مرکز سیتوپلاسم حلقه انقباضی تشکیل شود که سیتوپلاسم دو سلول دختری را تفکیک میکند. دستههای اکتومیوزینی توسط حلقه سپتین در ناحیه شیار تقسیم به کار گرفته می شوند تا حلقه انقباضی را تشکیل دهند، بنابراین میتوان گفت که اکتین و میوزین در سیتوکینز نیز نقشی بسیار مهم دارند.
در صورتی که تمایل به کسب اطلاعات بیشتر در مورد روند تقسیم سیتوپلاسم در سلولهای جانوری و گیاهی دارید، مطالعه مطلب «تقسیم سیتوپلاسم در یاخته گیاهی و جانوری – به زبان ساده + انواع و مراحل» از مجله فرادرس را پیشنهاد میدهیم.
جمعبندی
در این مطلب با دو پروتئین بسیار مهم آشنا شدیم که با توجه به نقش حیاتی آنها در انقباض ماهیچهها با عنوان پروتئینهای انقباضی از آنها یاد میشود. اکتین و میوزین دو پروتئینی هستند که علاوه بر حضور در ساختار سارکومر در فعالیتهای زیستی دیگری نیز نقش دارند و در حقیقت اکتینها و میوزینها دو خانواده پروتئینی هستند که پروتئینهای متعددی در هر خانواده وجود دارند. اهمیت فعالیت اکتین و میوزین به حدی بالا است که بدون فعالیت دقیق و هماهنگ این دو پروتئين، فرآیندهایی مانند ضربان قلب، حرکت اندامها، تنفس و حتی بلع غذا ممکن نخواهد بود.
در مورد نقش گسترده اکتین و میوزین در سلولهای غیرماهیچهای نیز باید گفت که فعالیتهایی مانند تحرک سلولی، حفظ شکل سلول، تقسیم سلولی و غیره یا با اختلالات زیادی مواجه خواهند شد یا به طور کامل متوقف میشوند. این وسعت عملکرد نشان میدهد که درک ساختار و عملکرد این دو پروتئین نه تنها برای شناخت فیزیولوژی ماهیچهها، بلکه برای فهم بسیاری از فرآیندهای سلولی حیاتی ضروری است.
source
