درصد جرمی یک روش بیان غلظت محلول است که مقدار ماده حلشونده را در یک محلول بر حسب جرم بیان میکند. روش به دست آوردن این واحد غلظت، تقسیم جرم ماده حلشونده به جرم محلول و سپس ضرب آن در عدد ۱۰۰ است. از درصد جرمی برای بیان غلظت بسیاری از محلولها و محاسبات استوکیومتری استفاده میشود. در این مطلب از مجله فرادرس میآموزیم درصد جرمی چیست و چگونه محاسبه میشود.
آنچه در این مطلب میآموزید:
-
مفهوم غلظت محلول و واحدهای اندازهگیری آن را مرور میکنید.
-
میتوانید از درصد جرمی در محاسبات استوکیومتری استفاده کنید.
-
با روش تبدیل درصد جرمی به سایر واحدهای غلظت آشنا میشوید.
-
میتوانید مفهوم درصد جرمی را به کمک تمرینهای کاربردی به خوبی بیاموزید.
-
با مفهوم ترکیب درصد و تفاوت آن با درصد جرمی محلول آشنا میشوید.

در ابتدای این مطلب میآموزیم درصد جرمی و فرمول محاسبه آن چیست. سپس غلظت و سایر روشهای بیان آن را میآموزیم. پس از آن با روش استفاده از درصد جرمی در محاسبات آشنا میشویم. در ادامه روش تبدیل درصد جرمی را میآموزیم. در نهایت با آزمونی آموختههای خود را از این واحد میسنجیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید درصد جرمی چیست.
درصد جرمی چیست؟
درصد وزنی مقدار ماده حلشونده موجود در یک مقدار مشخص از محلول را بیان میکند. این روش یکی از راههای نمایش غلظت یک مادهی حلشونده، مشابه مولاریته، مولالیته و نرمالیته است. این فرمول به ما درصد جرمی ماده حلشونده در محلول را نشان میدهد.
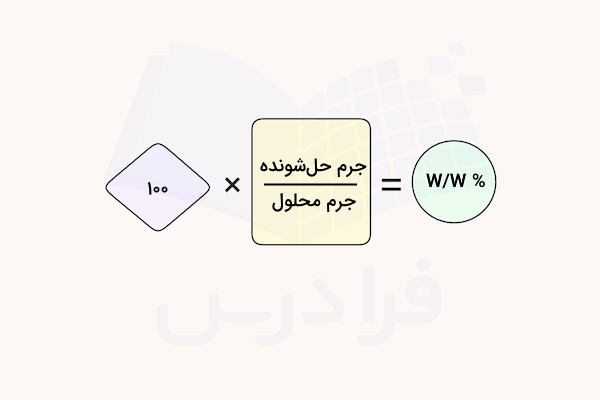
درصد جرمی = جرم ماده حلشونده ÷ جرم کل محلول × ۱۰۰
این روش بیان غلظت، یک واحد اندازهگیری بدون بعد است و تنها به صورت درصد بیان میشود.
اگر بگوییم یک محلول سدیم کلرید (نمک طعام) ٪۱۰ جرمی از این ماده را در خود حل کرده است بدین معنی است که در هر ۱۰۰ گرم از این محلول، ۱۰ گرم نمک حل شده است. درصد جرمی در محاسبات شیمیایی، کنترل کیفیت مواد، و حتی در برچسبگذاری محصولات غذایی کاربرد فراوانی دارد.

فرمول درصد جرمی
فرمول محاسبه درصد جرمی، نسبت جرم ماده حلشونده به جرم کل محلول (جرم حلال + جرم حلشونده) ضرب در عدد ۱۰۰ است. این محاسبات به شکل ریاضی به صورت زیر نمایش داده میشود.
در این فرمول، مفهوم نمادهای نوشته شده به شکل زیر است:
- W/W: نماد درصد جرمی
- m: نماد جرم
- Solute: به معنی حلشونده
- Solution: به معنی محلول
باید دقت داشت که واحد جرم در صورت و مخرج در این فرمول باید یکسان باشد (برای مثال هر دو بر حسب گرم یا کیلوگرم و …). توجه داشته باشید که در این فرمول جرم محلول (و نه جرم حلال) در مخرج کسر قرار میگیرد. برای محلولهای رقیق (کمتر از حدود ٪۵ غلظت)، جرم مادهی حلشونده سهم زیادی از جرم کل محلول ندارد، بنابراین میتوان جرم محلول را تقریبا برابر با جرم حلال در نظر گرفت.
برای درک بهتر این فرمول، به مثالهای زیر دقت کنید.
مثال ۱
یک نمونه ۵ گرمی از محلولی حاوی ۳٫۷۵ میلی گرم گلوکز است. مقدار درصد جرمی گلوکز در این محلول چقدر است؟
پاسخ
برای محاسبه درصد جرمی گلوکز در نمونه باید جرم گلوکز را بر جرم کل نمونه تقسیم گرده و در عدد ۱۰۰ صرب کنیم.
$$text{% glucose} = frac{3.75;text{mg glucose}times frac{1,g}{1000,mg}}{5.0,g,text{Solution}} = 0.075%$$
دقت داشته باشید که واحد جرم صورت و مخرج باید یکسان باشد به همین منظور، میلیگرم ماده گلوکز را به گرم تبدیل میکنیم.
مثال ۲
دکستروز یکی از نامهای دی گلوکز با فرمول شیمیایی است. محلولی از دکستروز به وزن ۲۰۰ گرم حاوی ۱۵٫۸ گرم دکستروز است. مقدار درصد جرمی این محلول را محاسبه کنید.
پاسخ
برای پاسخ به این سوال کافی است مقدار جرم دکستروز را بر جرم کل محلول تقسیم کرده و در عدد ۱۰۰ ضرب کنیم.
یادگیری شیمی دهم با فرادرس
برای یادگیری این موضوع که درصد جرمی چیست ابتدا باید با مفاهیمی چون نیروهای بین مولکولی، انحلالپذیری، غلظت مولی، روشهای بیان غلظت و کسر مولی آشنا شوید. پیشنهاد میکنیم برای درک این مفاهیم، به مجموعه فیلم آموزش دروس پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی این مسائل را توضیح میدهد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه درصد جرمی دسترسی داشته باشید.
غلظت چیست؟
غلظت یک روش برای بیان نسبت مقدار ماده حلشونده در یک محلول است. محلولها از دو جزء حلال و حلشونده تشکیل میشوند. حلشونده میتواند هر یک از حالتهای مایع یا جامد را داشته باشد. بسته به مقدار ماده حلشونده در حلال، محول میتواند غلیظ یا رقیق باشد.
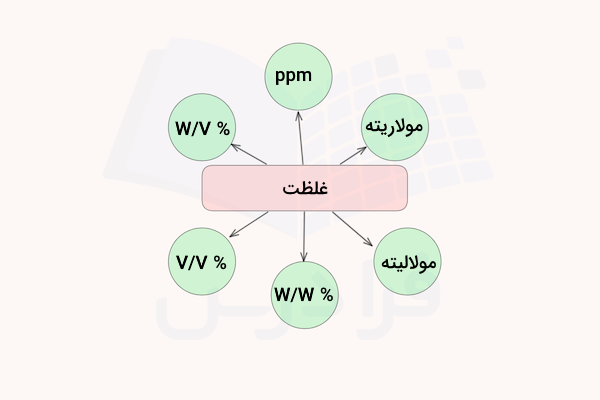
برای مثال، وقتی میگوییم محلول ٪۵ درصد استیک اسید داریم، غلظت آن را بیان کردهایم و این محلول نسبت به محلول ٪۱۰ استیک اسید، رقیقتر خواهد بود. عبارات رقیق و غلیظ، در واقع بیان کیفی یک محلول هستند و مقدار دقیق ماده حلشونده را در محلول بیان نمیکنند. برای بیان دقیق مقدار ماده حلشونده در محلول از روشهای بیان غلظت مانند درصد جرمی، درصد حجمی، مولاریته و … استفاده میشود.
سایر روش های بیان غلظت
در قسمت قبل آموختیم درصد جرمی چیست. درصد جرمی (درصد وزنی) یکی از روشهای بیان غلظت است. این روش بیان غلظت بیشتر برای محلولهایی که حاوی ماده حلشونده جامد محلول در حلال مایع هستند به کار میروند. همچنین، برخی دیگر از روشهای بیان غلظت رایج دیگر نیز هستند که شناخت آنها به ما در درک بهتر اینکه درصد جرمی چیست و چگونه میتوان از آن در محاسبات استفاده کرد کمک میکند.
در ادامه برخی از این روشهای بیان غلظت را معرفی میکنیم. این واحدها، درصد حجمی، درصد وزنی حجمی، قسمت در میلیون (ppm)، مولاریته و مولالیته هستند. پیشنهاد می کنیم برای آشنایی بیشتر با این واحدهای غلظت، مطلب غلظت محلولها و واحدهای آنها از مجله فرادرس را مطالعه کنید.
درصد حجمی
درصد حجمی بیان میکند که چه حجمی از ماده حلشونده در محلول وجود دارد. فرمول محاسبه این واحد، حجم حلشونده بر حجم محلول ضرب در عدد ۱۰۰ است. درصد حجمی را با علامت ٪V/V نمایش میدهند و به آن درصد حجمی – حجمی و غلظت حجمی نیز گفته میشود.
درصد حجمی = حجم ماده حلشونده ÷ حجم محلول × ۱۰۰
برای مثال اگر محلولی با اضافه کردن ۴۰ میلیلیتر اتانول به حجم کافی آب برای تهیه ۲۴۰ میلیلیتر محلول تهیه شود، غلظت آن بر حسب درصد حجمی به شکل زیر محاسبه میشود. در این واحد نیز مانند درصد جرمی، واحد صورت و مخرج کسر باید یکسان باشد.
در این فرمول، مفهوم نمادهای نوشته شده به شکل زیر است:
- Percent by Volume: نماد درصد حجمی (V/V)
- Volume of Solute: به معنی حجم حلشونده
- Volume of Solution: به معنی حجم محلول
باید توجه داشت که برخلاف جرم، نمیتوان با جمعکردن حجمهای حلشونده و حلال ، حجم نهایی محلول را بهدست آورد. هنگام افزودن حلشونده و حلال به یکدیگر، جرم حفظ میشود اما حجم همیشه حفظ نمیشود. دلیل این امر پدیدهای به نام کاهش حجم در اثر برهمکنشهای بینمولکولی بین اجزای مخلوط است.

درصد وزنی – حجمی
درصد وزنی حجمی واحدی است که گرم ماده حلشونده را در میلیلیتر محلول بر حسب درصد مشخص میکند. فرمول محاسبه این واحد، تقسیم جرم ماده حلشونده بر حسب گرم بر حجم محلول بر حسب میلیلیتر ضرب در عدد ۱۰۰ است. درصد وزنی – حجمی را با علامت ٪W/V نمایش میدهند.
درصد وزنی – حجمی = وزن ماده حلشونده (گرم) ÷ حجم محلول (میلیلیتر) × ۱۰۰
برای مثال، اگر محلولی با حل کردن ۱۰ گرم سدیم کلرید در آب کافی برای تهیه ۱۵۰ میلیلیتر محلول تهیه شود، غلظت آن بر حسب درصد وزنی- حجمی به شکل زیر محاسبه میشود.
در این فرمول، مفهوم نمادهای نوشته شده به شکل زیر است:
- Mass-volume concentration: نماد درصد جرمی – حجمی
- m: نماد جرم
- Mass Solute: به معنی جرم حلشونده
- Volume Solution: به معنی حجم محلول
پیشنهاد میکنیم برای آشنایی بیشتر با این واحدهای غلظت و روش استفاده از آنها در محاسبات استوکیومتری، فیلم آموزش استوکیومتری در واکنش شیمیایی فرادرس که لینک آن در ادامه اورده شده است را مشاهده کنید.
قسمت در میلیون
قسمت در میلیون، مقدار ماده حلشونده را در یک میلیون قسمت محلول نمایش میدهد. این واحد که بیشتر با نام ppm شناخته میشود، با تقسیم جرم ماده حلشونده بر محلول ضرب در ۱ میلیون محاسبه شده و برای اندازهگیری غلظتهای بسیار پایین مواد استفاده میشود. همچنین، محاسبه غلظت مواد بر حسب میلیگرم ماده حلشونده بر لیتر محلول نیز برابر با همان غلظت بر حسب ppm است.
فرمول محاسبه این غلظت به شکل زیر است.
در این فرمول، مفهوم نمادهای نوشته شده به شکل زیر است:
- Mass of Solute: به معنی جرم حلشونده
- Mass of Solution: به معنی جرم محلول
برای مثال، محلولی با غلظت ۱۵ ppm حاوی ۱۵ قسمت ماده حلشونده در یک میلیون قسمت محلول است. به عبارت دیگر ۱۵ میلی گرم ماده حلشونده در ۱ لیتر از محلول وجود خواهد داشت.

مولاریته
مولاریته یکی از رایجترین واحدهای غلظت است که در بسیاری از محاسبات و آزمایشگاههای شیمی از آن استفاده میشود. این واحد غلظت تعداد مولهای ماده حلشونده را در لیتر محلول مشخص میکند و فرمول محاسبه آن به شکل زیر است.
در این فرمول m مولاریته، n تعداد مول و V حجم محلول بر حسب لیتر است. تعداد مولهای ماده حلشونده را میتوان به وسیله جرم مولی مواد و با استفاده از جرم ماده حل شونده به شکل زیر به دست آورد.
در این فرمول n تعداد مول، m جرم ماده حلشونده و M جرم مولی آن است.
مولالیته
مولالیته تعداد مولهای ماده حلشونده را در کیلوگرم حلال مشخص میکند. فرمول محاسبه این واحد غلظت به شکل زیر است.
استفاده از درصد جرمی در محاسبات
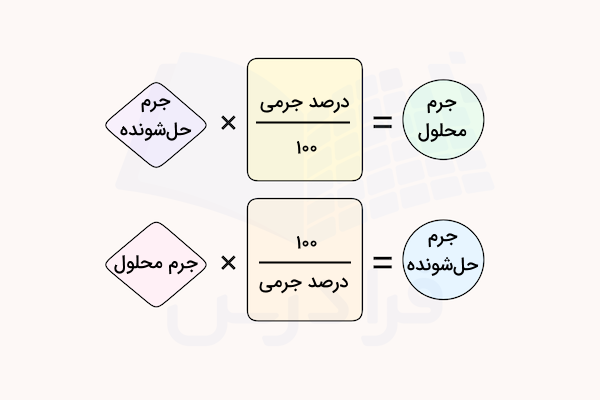
گاهی در برخی از مسائل و برای انجام مراحل محلولسازی نیاز است که محلولی با درصد جرمی مشخصی تهیه کنید و باید مقدار جرم ماده حلشونده مورد نیاز را به دست آوردید. برای این کار میتوان از فرمول محاسبه درصد جرمی به عنوان یک ضریب تبدیل استفاده کرد.
برای اینکار کافی است برای تبدیل گرم محلول به گرم ماده حلشونده، جرم محلول را در کسر ضرب کرده و برای تبدیل گرم ماده حلشونده به گرم محلول، جرم حلشونده را در ضرب کنید.
برای درک بهتر این روش، به مثال های زیر دقت کنید.
مثال ۱
فرض کنید میخواهیم ۳۰۰۰ گرم محلول سدیم کلرید ٪۵ جرمی تهیه کنیم. مقدار جرم ماده حلشونده مورد نیاز چقدر است؟
پاسخ
برای پاسخ به این سوال باید جرم محلول را در کسر تبدیل ضرب کنیم تا جرم ماده حلشونده مورد نیاز به دست آید.
پس برای این کار نیاز است ۱۵۰ گرم سدیم کلرید را به ۲۸۵۰ گرم آب اظافه کنیم تا در مجموع ۳۰۰۰ گرم محلول ٪۵ درصد وزنی سدیم کلرید داشته باشیم.
مثال ۲
چند گرم هیدروژن پراکسید (آب اکسیژنه) برای تولید ۶ کیلوگرم محلول ٪۳ جرمی آب اکسیژنه نیاز است؟
پاسخ
مانند سوال قبل کافی است جرم محلول را در ضرب کنیم تا جرم ماده حلشونده به دست آید.
تبدیل درصد جرمی به سایر واحدهای غلظت
در قسمتهای قبلی آموختیم درصد جرمی چیست و چگونه محاسبه میشود. برای محاسبه درصد جرمی محلولهای مختلف، کافی است جرم ماده جل شونده را به جرم محلول تقسیم کرده و در عدد ۱۰۰ ضرب کنیم. در آزمایشگاه شیمی و پروسههای محلولسازی گاهی نیاز است واحدهای اندازهگیری غلظت را برای انجام محاسبات مختلف به یکدیگر تبدیل کنیم. برای انجام اینکار باید از فرمولهای محاسبات غلظت و واحدهایی مانند چگالی، جرم مولی و … استفاده کنیم.
در ادامه روش تبدیل واحد درصد جرمی را به برخی دیگر از واحدهای بیان غلظت تمرین میکنیم.
تبدیل درصد جرمی به مولاریته
برای تبدیل درصد جرمی به واحد مولاریته باید از چگالی محلول و جرم مولی ماده حلشونده استفاده کنیم. فرمول انجام این محاسبات به شکل زیر است.
در این فرمول، M نماد مولاریته، چگالی محلول و M در مخرج کسر جرم مولی ماده حلشونده است. برای مثال، اگر یک محلول ۳۷٫۲ درصد جرمی سدیم کلرید با چگالی ۱٫۱۹ گرم بر میلیلیتر و جرم مولی ۳۶٫۴۵ گرم بر مول داشته باشیم، مولاریته آن به شکل زیر محاسبه میشود.
برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.

مثال ۱
یک محلول آبی اسید نیتریک دارای غلظت ٪۲۵ درصد وزنی و چگالی ۱٫۰۱ گرم بر میلیلیتر است. اگر جرم مولی اسید نیتریک برابر با ۶۳٫۰۱ گرم بر مول باشد، مولاریته محلول را به دست آورید.
پاسخ
برای پاسخ به این سوال مانند قسمت قبل از چگالی و جرم مولی استفاده کرده و مولاریته محلول را به دست میآوریم.
مثال ۲
یک محلول آمونیاک دارای چگالی ۰٫۹۷ گرم بر میلیلیتر و غلظت ٪۱۰ جرمی لست. اگر جرم مولی آمونیاک برابر با ۱۷٫۰۳ گرم بر مول باشد، مولاریته آن را حساب کنید.
پاسخ
برای پاسخ به این سوال مانند قسمت قبل از چگالی و جرم مولی استفاده کرده و مولاریته محلول را به دست میآوریم.

تبدیل درصد جرمی به ppm
در قسمتهای قبل آموختیم فرمول محاسبه ppm جرم ماده حلشونده بر جرم محلول ضرب در یک میلیون است. پس برای تبدیل درصد جرمی به ppm کافی است از فرمول محاسبه زیر استفاده کنیم.
برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
محلولی حاوی ٪۲ جرمی سدیم کلرید است. غلظت آن را به ppm حساب کنید.
پاسخ
برای پاسخ به این سوال، کافی است غلظت بر حسب درصد جرمی را در عدد ۱۰۰۰۰ ضرب کنیم.
مثال ۲
یک محلول ضدعفونی کننده حاوی ٪۰٫۱۵ وزنی هیدروژن پراکسید است. غلظت آن را بر حسب ppm حساب کنید.
پاسخ
برای پاسخ به این سوال مانند قسمت قبل عمل میکنیم.
تبدیل درصد جرمی به درصد حجمی
یکی دیگر از تبدیلهای کاربردی بین واحدهای اندازهگیری غلظت، تبدیل درصد جرمی به درصد حجمی برای استفاده در محاسبات استوکیومتری است. برای اینکار باید جرم ماده حلشونده و محلول را داشته باشیم و با استفاده از چگالی ماده حلشونده و چگالی محلول، جرم آنها را به حجم تبدیل کنیم.
در نهایت با تقسیم حجم ماده حلشونده به حجم محلول ضرب در عدد ۱۰۰، غلظت آن را بر حسب درصد حجمی به دست میآوریم.
برای مثال تصور کنید محلولی دارای ٪۳۰ درصد جرمی اتانول با چگالی محلول ۰٫۹۷۵ گرم بر میلیلیتر و چگالی اتانول ۰٫۷۸۹ میلیلیتر است. برای به دست آوردن درصد حجمی اتانول، به شکل زیر عمل میکنیم.
برای درک بهتر این محاسبات، به مثال های زیر دقت کنید.
مثال ۱
محلولی شامل ٪۱۰ جرمی متانول با چگالی محلول ۰٫۹۴۵ گرم بر میلیلیتر و چگالی متانول ۰٫۷۹۲ گرم بر میلیلیتر است. غلظت محلول را بر حسب درصد حجمی به دست آورید.
پاسخ
برای پاسخ به این سوال، از فرمول قسمت قبل استفاده کرده و با استفاده از چگالی محلول و ماده حلشونده، حجم آنها را به دست آورده و در فرمول غلظت بر حسب درصد حجمی جایگذاری میکنیم.
مثال ۲
محلولی دارای ٪۵۰ جرمی گلیسرین است. چگالی محلول برابر با ۱٫۱۵ گرم بر میلیلیتر و چگالی گلیسرین برابر با ۱٫۲۶ گرم بر میلیلیتر است. درصد حجمی این محلول را محاسبه کنید.
پاسخ
برای پاسخ به این سوال، مانند قسمت قبل عمل میکنیم. محاسبات برای پاسخ به این سوال به شکل زیر است.

یادگیری محلول سازی با فرادرس
در این مطلب آموختیم درصد جرمی چیست. درصد جرمی یکی از روشهای بیان غلظت محلول است. برای درک بهتر درصد جرمی و محلولسازی و غلظت محلول نیاز است با مفاهیمی چون حل مسائل استوکیومتری، کسرهای تبدیل استوکیومتری و اسیدهای تجاری آشنا شویم. همچنین، شناخت مفاهیمی چون تیتراسیون اسید باز و انحلالپذیری به درک ما از درصد جرمی کمک خواهد کرد. پیشنهاد میکنیم برای درک بهتر این مفاهیم و مسائل، به مجموعه فیلم آموزش محلولسازی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه درصد جرمی و محلولسازی دسترسی داشته باشید.
ترکیب درصد چیست؟
ترکیب درصد یکی از مفاهیم شیمی است که مقدار درصد عناصر را در یک ترکیب شیمیایی بر حسب درصد بیان میکند. این مفهوم که گاهی با عبارت «درصد جرمی عناصر» بیان میشود، ممکن است با درصد جرمی محلول اشتباه گرفته شود.
در ادامه، برای درک بهتر تفاوت این دو مفهوم، آنها را توضیح میدهیم.
- درصد جرمی محلول: نسبت جرم ماده حلشونده به جرم محلول بر حسب درصد
- ترکیب درصد (درصد جرمی عنصر): نسبت جرم مولی عنصر به جرم مولی ترکیب شیمیایی بر حسب درصد
برای محاسبه ترکیب درصد مواد، باید جرم مولی عناصر تشکیل دهنده را به صورت جداگانه بر جرم مولی ترکیب شیمیایی، ترکیب درصد اجزا به دست میآید. برای مثال، در اسید کلریدریک که از هیدروژن و کلر تشکیل شده است، ترکیب درصد اجزا از طریق زیر به دست میآید.
برای درک بهتر این محاسبات، به مثال زیر دقت کنید.
مثال
درصد جرمی کربن را در بوتان با فرمول شیمیایی محاسبه کنید.
پاسخ
برای پاسخ به این سوال، با تقسیم جرم مولی کربن بر جرم مولی بوتان و ضرب در عدد ۱۰۰، ترکیب درصد (درصد جرمی) کربن در بوتان به دست میآید. عبارت (Molar mass) در فرمول زیر بیانگر جرم مولی است.

آزمون درصد جرمی
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به تمرینهای زیر پاسخ دهید. همچنین، پس از پاسخدهی به تمامی سوالات میتوانید با کلیک بر روی گزینه دریافت نتیجه آزمون، نمره خود را مشاهده کنید.
مقدار درصد جرمی محلولی که با حل کردن ۵ گرم سدیم کلرید در ۹۵ گرم آب به دست آمده است، چقدر است؟
محاسبات برای پاسخ به این سوال به شکل زیر است.
یک محلول ۱۰ درصد اسید کلریدریک وزنی برابر با ۲۵۰ گرم دارد. مقدار اسید کلریدریک موجود در این محلول چند گرم است؟
محاسبات برای پاسخ به این سوال به شکل زیر است.
اگر ۲۰۰ گرم محلول ۱۲ درصد جرمی سدیم هیدروکسید داشته باشیم، چند گرم آب در این محلول وجود دارد؟
محاسبات برای پاسخ به این سوال به شکل زیر است.
محلولی حاوی ۱۸ گرم گلوکز و ۸۲ گرم آب است. مقدار درصد جرمی گلوکز را محاسبه کنید.
محاسبات برای پاسخ به این سوال به شکل زیر است.
محلولی با غلظت ۰٫۰۰۲۵ درصد وزنی داریم. مقدار غلظت این محلول بر حسب ppm چقدر است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
اگر ۵۰ میلیلیتر محلول سولفوریک اسید با چگالی ۱٫۲ گرم بر میلیلیتر که حاوی ۱۲ گرم سولفوریک اسید است داشته باشیم، درصد جرمی این محلول را محاسبه کنید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
یک محلول ٪۵ جرمی سدیم کلرید چگالی برابر با ۱٫۰۲ گرم بر میلیلیتر دارد. چه جرمی از سدیم کلرید در ۲۰۰ میلیلیتر از این محلول وجود خواهد داشت؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
یک محلول ۶ درصد جرمی پتاسیم کلرید حاوی ۶ گرم پتاسیم کلرید در ۱۰۰ گرم از این محلول است. مقدار غلظت این محلول را بر حسب مولاریته محاسبه کنید. جرم مولی پتاسیم کلرید برابر با ۷۴٫۵۵ گرم بر مول است.
۰٫۸۵۶ مول بر کیلوگرم
۰٫۰۶۰۰ مول بر گیلوگرم
۱٫۸ مول بر کیلوگرم
۰٫۲۴ مول بر کیلوگرم
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چند گرم سدیم هیدروکسید باید به ۹۰ گرم آب اضافه شود تا بتوانیم محلول ۱۲ درصد جرمی سدیم هیدروکسید داشته باشیم؟ مقدار جرم سدیم هیدروکسید را براربر با x در نظر بگیرید.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
میخواهیم ۲۵۰ گرم محلول ۰٫۱ مولال سدیم نیترات تهیه کنیم. مقدار درصد جرمی این محلول را محاسبه گنید. مقدار درصد جرمی این محلول بابر با ۸۵ گرم بر مول است.
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
