پیوند کووالانسی که از همپوشانی جانبی (پهلو به پهلو) اوربیتالهای p نیمهپر اتمها تشکیل میشود، پیوند پای نام دارد. این پیوندها با نماد نشان داده میشوند و از پیوند سیگما ضعیفتر هستند. هر پیوند کووالانسی دوگانه یک پیوند پای و هر پیوند کووالانسی سهگانه دو پیوند پای دارد. در این مطلب از مجله فرادرس میآموزیم این پیوند چیست و چه ویژگیهایی دارد.
آنچه در این مطلب میآموزید:
-
میآموزید پیوند پای چیست و در چه مولکولهایی تشکیل میشود.
-
با تفاوتهای پیوند پای و پیوند سیگما به طور کامل آشنا میشوید.
-
فرآیند تشکیل پیوند پای و اثر آن بر طول پیوند را درک میکنید.
-
میآموزید اوربیتال ضدپیوندی پای استار چیست و چه شکل هندسی دارد.
-
با پیوندهای مرتبه بالاتر مانند پیوند دلتا آشنا میشوید.
-
میآموزید پیوند پای در چه مواردی میتواند به تنهایی و بدون پیوند سیگما وجود داشته باشد.

در ابتدای این مطلب میآموزیم مفهوم پیوندهای پای چیست، چگونه تشکیل میشوند و چه تفاوتی با پیوند سیگما دارند. سپس ویژگیها و مثالهای این پیوند را بررسی کرده و مکانیسم تشکیل آن را توضیح میدهیم. در ادامه، قدرت این پیوند و اثر آن را بر طول پیوند بررسی کرده و مفهوم پیوندهای پای استار را میآموزیم. در نهایت با پیوند دلتا آشنا شده و موارد استثنا در پیوندهای پای را توضیح میدهیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید پیوند پای چیست.
پیوند پای چیست؟
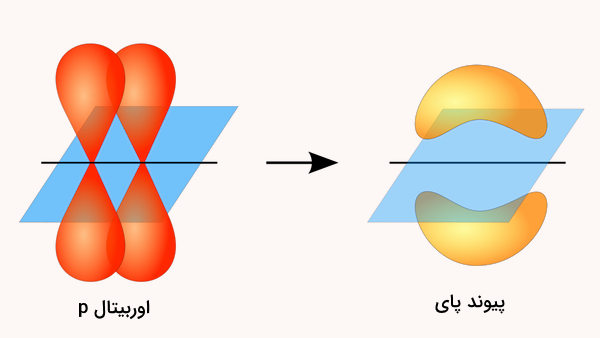
پیوند پای یک نوع پیوند کووالانسی است و از همپوشانی جانبی اوربیتالهای نیمه پر p در اتمها تشکیل میشود. این نوع پیوند در پیوندهای کووالانسی دوگانه و سهگانه یافت میشود. این پیوند کووالانسی از پیوند کووالانسی سیگما (همپوشانی سر به سر) ضعیفتر است زیرا درجه همپوشانی در این نوع پیوند کمتر است. الکترونهایی که در این پیوندها قرار دارند گاهی با نام «الکترون پای» شناخته میشوند.
به یاد داشته باشید که پیوندهای کووالانسی از همپوشانی اوربیتالهای اتمی شکل میگیرند. اوربیتالهایی که در واقع فضاهایی هستند که احتمال حضور الکترونها در آنها بیشتر است. چند نوع مجموعه اوربیتال اتمی s، p، d و f وجود دارد. هر یک از این مجموعهها تعداد متفاوتی اوربیتال دارند، در سطوح انرژی مختلفی وجود دارند و شکلهای متفاوتی نیز دارند. بر اساس مفاهیم مکانیک کوانتومی، اوربیتالهای p بهدلیل ساختار موازی و جانبی خود، شکنندهتر هستند. ماهیت همپوشانی جانبی اوربیتالهای p، دلیل اصلی ضعف و ناپایداری نسبی پیوندهای پای است.
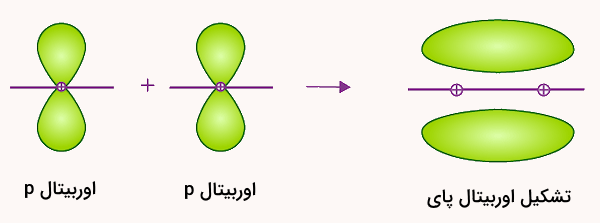
زمانی که دو مولکول با هم پیوند برقرار میکنند، معمولا اوربیتالهای آنها با هم ترکیب میشوند و اوربیتالهای هیبریدی مانند ، و را تشکیل میدهند. هر پیوند پای بهصورت دو ابر الکترونی نمایش داده میشود که هر کدام از یکی از لوبهای اوربیتالهای p حاصل میشود. این دو ابر، در مجموع، دو الکترون اشتراکی بین دو اتم را در خود جای میدهند. چگالی الکترونی حاصل از این پیوند در دو طرف محور بین هستههای اتمها قرار دارد.
همپوشانی اوربیتال چیست؟
در قسمت قبل آموختیم پیوند پای چیست و چگونه از همپوشانی اوربیتالهای p تشکیل میشود. دو اتم به هم نزدیک میشوند و اوربیتالهایشان با هم تداخل پیدا میکند و یک اوربیتال هیبریدی جدید شکل میگیرد. اوربیتالی که الکترونهای پیوندی در آن قرار دارند را همپوشانی اوربیتال مینامند. اوربیتال هیبریدی نسبت به اوربیتالهای اتمی پایدارتر است و انرژی کمتری دارد. این تداخل بین اوربیتالها همپوشانی نامیده میشود.
اندازه اتمها و تعداد الکترونهای ظرفیت آنها روی میزان همپوشانی تاثیر میگذارد. هرچه همپوشانی بیشتر باشد پیوند بین اتمها قویتر خواهد بود. اتمها با هم واکنش میدهند و اوربیتالهایشان همپوشانی پیدا میکند تا به حالت انرژی پایینتری برسند که در آن الکترونهای ظرفیت با اسپین مخالف کنار هم قرار گرفته و پیوند کووالانسی تشکیل میدهند.
تفاوت پیوند پای و پیوند سیگما
در قسمت قبل آموختیم پیوند پای چیست. این پیوندها و پیوند سیگما هر دو از انواع پیوندهای کووالانسی هستند که از همپوشانی اوربیتالهای الکترونی اتمهای درگیر در پیوند به وجود میآیند. پیوند سیگما قویتر است و از همپوشانی سر به سر اوربیتالها به وجود میآید.
در حالی که پیوندهای پای ضعیفتر هستند و از همپوشانی جانبی اوربیتالها به وجود میآیند. در جدول زیر، تفاوتهای این پیوندها و پیوند سیگما را توضیح دادهایم.
| پیوند پای | پیوند سیگما |
| همپوشانی جانبی | همپوشانی سر به سر |
| قدرت پیوند کمتر | قدرت پیوند زیاد |
| همپوشانی اوربیتالهای خالص و غیر هیبریدی | همپوشانی اوربیتالهای خالص یا هیبریدی |
| همیشه همراه با پیوند سیگما | حضور به حالت تکی و همراه با پای |
| عدم چرخش حول پیوند | چرخش آزاد حول پیوند |
| واکنشپذیری کمتر | واکنشپذیری بیشتر |
| عدم تاثیر بر شکل مولکول | تاثیر مستقیم بر شکل مولکول |
| مثال: اتن | مثال: اتان |
یادگیری شیمی دانشگاهی با فرادرس
پیوندهای پای از مهمترین پیوندهای کووالانسی هستند که در کنار پیوند سیگما، مولکولهای سیرنشده را تشکیل میدهند. برای درک بهتر مفهوم این پیوند نیاز است با مفاهیمی چون اوربیتالها و همپوشانی آنها، آرایش الکترونی، انرژی ذرات و اوربیتال مولکولی آشنا شویم. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه پیوندهای کووالانسی دسترسی داشته باشید.
ویژگی پیوند پای
در قسمتهای قبل آموختیم تعریف پیوند پای چیست. این پیوندها همواره در پیوندهای دوگانه و سهگانه یافت میشوند و به تنهایی نسبت به پیوندهای سیگما ضعیفتر هستند. اما ترکیب پیوند سیگما و این پیوند از پیوند سیگما به تنهایی قدرت بیشتری دارد.
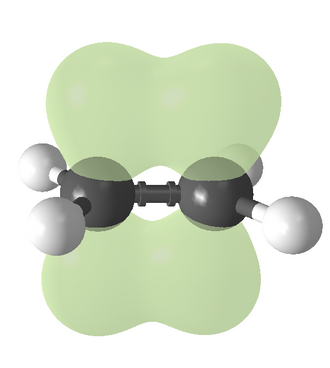
اجزای مولکولیای که توسط یک پیوند پای به هم متصل شدهاند، نمیتوانند بدون شکستن این پیوند به دور آن بچرخند، زیرا چرخش موجب از بین رفتن آرایش موازی اوربیتالهای p تشکیلدهنده این پیوند میشوند.
در ادامه، ویژگیهای این پیوندها را نام میبریم.
- این پیوند روی محور اوربیتال و به دلیل همپوشانی اوربیتالهای اتمی تشکیل میشود.
- این پیوند به دلیل ساختار موازی و درجه همپوشانی کمتر، شکننده و ناپایدار است.
- این نوع پیوند تنها پس از تشکیل پیوند سیگما به وجود میآید و به تنهایی وجود ندارد.
- پیوندهای پای در مولکولهای اشباع نشده مانند آلکنها و آلکینها حضور دارند و در مولکولهای آلی اشباع شده وجود ندارند.
- این پیوندها میتوانند پیوندهای دو یا سهگانه ایجاد کنند اما به تنهایی نمیتوانند پیوند یگانه تشکیل دهند.
- این پیوند نقشی تعیین کننده در طول پیوند دارد.
- از نظر واکنش پذیری نسبت به پیوند سیگما کمتر فعال است.
- این پیوند به صورت دو ابر الکترونی نمایش داده میشود که هر کدام از یکی از لوبهای اوربیتالهای p حاصل میشود.
پیشنهاد میکنیم برای درک بهتر پیوند کووالانسی و ویژگیهای انواع این پیوندها، فیلم آموزش پیوند شیمیایی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال پیوند پای
در قسمتهای قبل آموختیم پیوند پای چیست و چه ویژگیهایی دارد. در ادامه، حضور این پیوند را در برخی از مولکولهای سیرنشده بررسی میکنیم.
مولکول اتن
مولکول اتن از ۴ اتم هیدروژن و ۲ اتم کربن تشکیل شده است. کربنها با پیوند دوگانه به هم متصل شدهاند و پیوند بین اتمهای کربن و هیدروژن از نوع یگانه است. هر اتم کربن در این مولکول، هیبریدی شده است. در نتیجه، در این مولکول ۴ پیوند سیگما بین اتمهای کربن و هیدروژن و ۱ پیوند سیگما بین اتمهای کربن و یک پیوند پای بین اتمهای کربن وجود دارد.
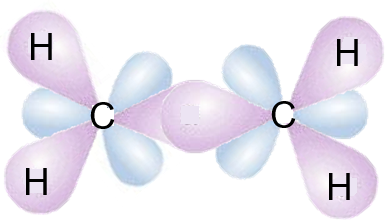
چهارمین الکترون ظرفیت در اتم کربن، در اوربیتال p قرار دارد. با همپوشانی جانبی اوبیتالهای p در دو اتم کربن، یک پیوند پای شکل میگیرد.
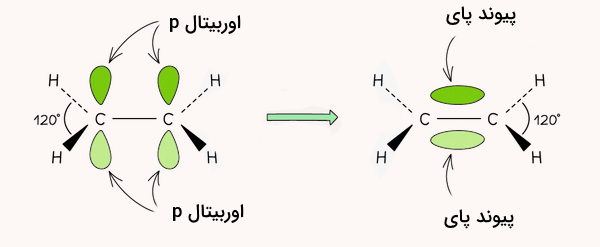
پیشنهاد میکنیم برای درک بهتر نحوه تشکیل این اوربیتالها و اوربیتالهای هیبریدی، مطلب هیبریداسیون و اوربیتالهای هیبریدی مجله فرادرس را مطالعه کنید.
مولکول اتین
در ملوکول اتین، اتمهای کربن با هم پیوند سهگانه برقرار کردهاند و دارای هیبریداسیون sp هستند. همچنین، هر اتم کربن با یک اتم هیدروژن نیز پیوند سیگما برقرار کرده است. در نتیجه، ۲ پیوند سیگما بین اتمهای کربن و هیدروژن و یک پیوند سیگما بین اتمهای کربن قرار دارد.
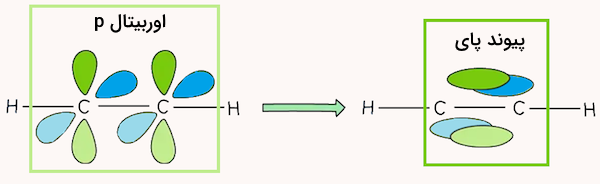
هر اتم کربن دارای ۲ اوربیتال p غیر هیبریدی است که از پهلو به هم نزدیک شده و پیوندهای پای تشکیل میدهند. در نتیجه بین آنها ۲ پیوند پای قرار دارد. در مجموع، در مولکول اتین ۳ پیوند سیگما و ۲ پیوند پای وجود دارد.
مولکول نیتروژن
مولکول نیتروژن از اتصال دو اتم نیتروژن به وسیله پیوند کووالانسی سهگانه تشکیل میشود. آرایش الکترونی نیتروژن به شکل زیر است.
همانطور که مشاهده میکنید، این اتم دارای اوربیتال p نیمهپر است. با نزدیک شدن ۲ اتم نیتروژن به هم، ۲ اوربیتال p به صورت جانبی و یک اوربیتال p به صورت سر به سر همپوشانی میکنند. بدین ترتیب، این مولکول دارای یک پیوند سهگانه شامل ۲ پیوند از نوع پای و یک پیوند سیگما خواهد بود.
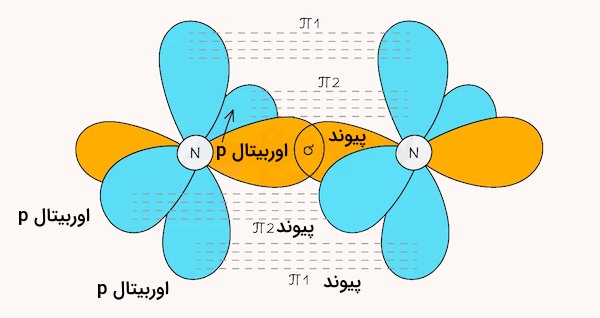
مولکول هیدروژن سیانید
مولکول هیدروژن سیانید با فرمول شیمیایی از یک اتم هیدروژن، یک اتم کربن و یک اتم نیتروژن تشکیل شده است. هیدروژن که دارای یک الکترون در اوربیتال 1s است با همپوشانی سر به سر با یکی از ۴ اوربیتال p اتم کربن، یک پیوند یگانه سیگما تشکیل میدهد.
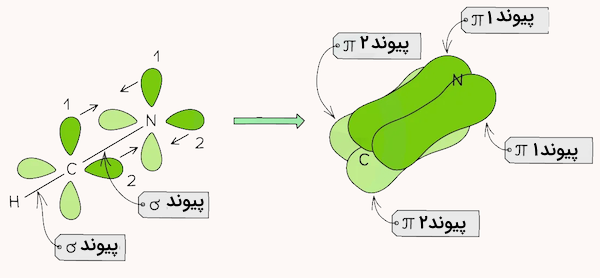
اتم کربن دادی ۳ اوربیتال p دیگر و اتم نیتروژن نیز دارای ۵ اوربیتال p است. یکی از اوربیتالهای p اتم کربن با یکی از اوربیتالهای p اتم نیتروژن پیوند سیگما تشکیل داده و دو اوربیتال p دیگر با همپوشانی جانبی، ۲ پیوند از نوع پای تشکیل میدهند. هیبریداسیون اتمهای کربن و نیتروژن در این مولکول از نوع sp است. در مجموع، این مولکول ۲ پیوند از نوع پای و دو پیوند سیگما دارد.
مثال تشخیص تعداد پیوندهای پای
برای درک بهتر روش تشخیص پیوندهای پای، تعداد پیوندهای پای و سیگما را در مولکول زیر با فرمول شیمیایی مشخص کنید.
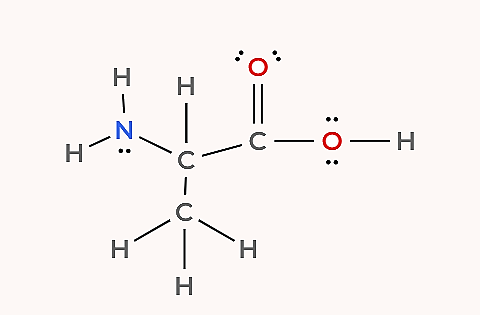
پاسخ
این مثال، نمودار لوییس کامل مولکول را در اختیار قرار میدهد و کافی است تعداد پیوندهای یگانه، دوگانه و سهگانه در ساختار شمارش شود. در این مولکول، ۱۱ پیوند یگانه و ۱ پیوند دوگانه وجود دارد و هیچ پیوند سهگانهای وجود ندارد.
با توجه به اینکه هر پیوند یگانه شامل یک پیوند سیگما است و هر پیوند دوگانه از یک پیوند سیگما و یک پیوند پای تشکیل شده، میتوان نتیجه گرفت که مجموع پیوندهای سیگما در این مولکول ۱۲ عدد (۱۱ سیگما از پیوندهای یگانه و ۱ سیگما از پیوند دوگانه) و تعداد پیوندهای پای برابر با ۱ است.
تشکیل پیوند پای
تعریف این پیوندها به یک پیوند شیمیایی کووالانسی اشاره دارد که از همپوشانی جانبی اوربیتالهای اتمهای مختلف بهوجود میآید. این پیوند بهطور خاص به اوربیتالهای p مربوط است، چون آرایش آنها بهصورت موازی است. در برخی موارد، اوربیتالهای d نیز میتوانند در تشکیل این پیوند نقش داشته باشند. اگر الکترونها بهطور قابلتوجهی روی پیوند محوری اوربیتالهای p تأثیر بگذارند، پیوندهای پای شکل میگیرند.
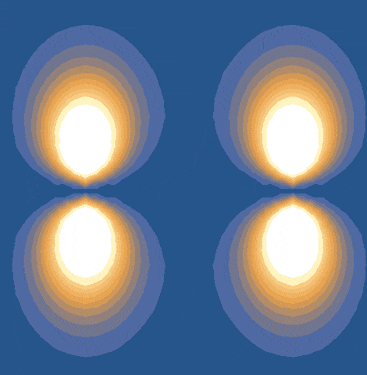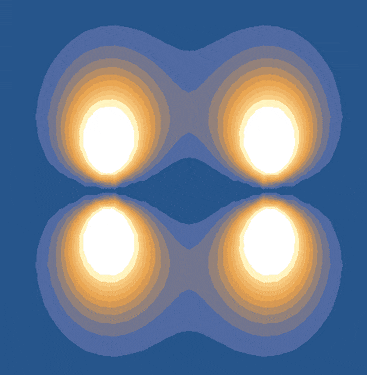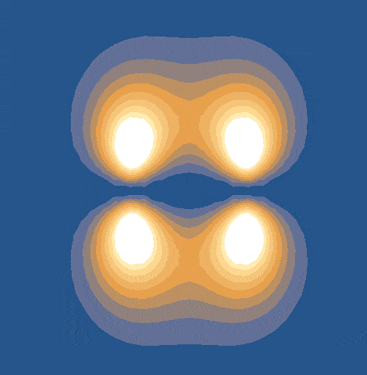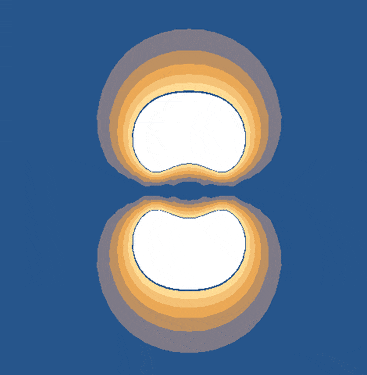
ضعف پیوندهای پای زمانی رخ میدهد که همپوشانی جانبی اوربیتالها ناقص باشد. اما اگر اوربیتالهای p بهطور کامل و موازی بر هم منطبق شوند، پیوندهای پای قویتر خواهند بود. این شرایط زمانی برقرار است که تمام اتمهای مولکول در یک صفحه قرار داشته باشند. به همین دلیل، اتمهایی که در پیوندهای پای شرکت دارند، نمیتوانند آزادانه به دور یکدیگر بچرخند.
قدرت پیوند پای
استحکام پیوندهای پای با استفاده از روشهای مکانیک کوانتومی اندازهگیری میشود و معمولا در مقایسه با پیوند سیگما کمتر است. پیوند سیگما برخلاف پیوندهای پای شکننده نیست و نسبت به این پیوند استحکام بیشتری دارد. برای مثال، پیوند یگانه بین دو اتم کربن قویتر از پیوند دوگانه بین آنهاست، زیرا پیوند یگانه شامل فقط یک پیوند سیگما است، در حالی که پیوند دوگانه از یک پیوند سیگما و یک پیوند از نوع پای تشکیل شده است.
از نظر قدرت پیوند، پیوند سیگما موجب کاهش پایداری نمیشود، در حالی که پیوندهای پای بهدلیل ساختار ضعیفتر خود، پایداری کمتری دارند. در نهایت، پیوندهای پای بهدلیل میزان کمتر همپوشانی اوربیتالها در ساختار اتمی خود، از استحکام کمتری برخوردار هستند و همین موضوع باعث ضعف نسبی آنها در مقایسه با پیوند سیگما میشود.
اثر پیوندهای پای بر طول پیوند
پیوندهای پای موجود در پیوندهای دوگانه و سهگانه باعث کوتاهتر شدن پیوند و طول مولکول میشود. در قسمتهای قبل آموختیم که قدرت پیوندهای پای از پیوند سیگما کمتر است اما ترکیب پیوندهای پای و پیوند سیگما در پیوندهای دوگانه و سهگانه قدرت بیشتری از پیوند سیگما به صورت تکی دارد.
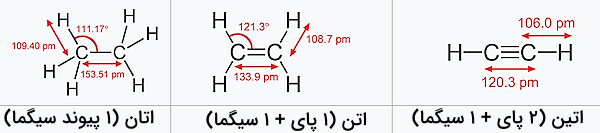
این پدیده باعث کوتاهتر شدن طول پیوند میشود. برای مثال، در مولکول اتان که تنها پیوندهای سیگما دارد، طول پیوند کربن – کربن برابر با ۱۵۴ پیکومتر است. این درحالی است که طول پیوند کربن – کربن در مولکول اتن با پیوند دوگانه برابر با ۱۳۴ پیکومتر و در مولکول اتین با پیوند سهگانه ۱۲۰ پیکومتر است. این اندازهها ثابت میکند که ترکیب پیوندهای پای و سیگما در مولکول باعث کاهش طول پیوند میشود.
اوربیتال ضدپیوندی پای
اوربیتال ضد پیوندی پای که با علامت نمایش داده میشود، حاصل برهمنهی ناهماهنگ دو اوربیتال p است. بر خلاف پیوندهای پای که باعث پایداری مولکول میشوند، پیوندهای پای استار باعث ناثباتی و افزایش انرژی مولکول میشود. برای مثال، در ملوکول اتن که دارای هیبریداسیون است، یک اوربیتال p خالص باقیمانده دارد که عمود بر صفحه مولکول قرار دارد.
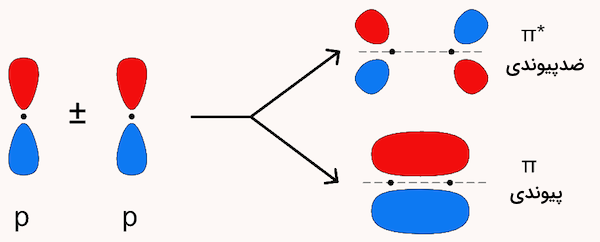
این دو اوربیتال p به صورت جانبی همپوشانی کرده و دو اوربیتال مولکولی پای و پای استار را به وجود میآورند. در مولکولهای دو اتمی همنوع، اوربیتالهای مولکولی پیوندی پای تنها یک صفحهی گرهی دارند که از میان اتمهای پیوندی عبور میکند و هیچ صفحهی گرهی بین این دو اتم وجود ندارد. در مقابل، اوربیتال مولکولی ضدپیوندی پای، با داشتن یک صفحهی گرهی اضافی بین این دو اتم تعریف میشود.
پیوند دلتا چیست؟
پیوند دلتا زمانی ایجاد میشود که چهار لوب از یک اوربیتال الکترونی با چهار لوب از اوربیتال الکترونی دیگر همپوشانی داشته باشند. از میان صفحات گرهای این اوربیتالها، تنها دو صفحه از هر دو اتم عبور میکند. حرف دلتا () در نام این پیوند به اوربیتالهای d اشاره دارد، زیرا وقتی که از راستای محور پیوند به آن نگاه میکنیم، تقارن و شکل این پیوند مشابه اوربیتالهای d چهار لوبی است.

در اتمهای بزرگتر، اوربیتالهای d پرشده انرژی کافی برای شرکت در پیوندها دارند و پیوندهای دلتا معمولا در ترکیبات آلیفلزی مشاهده میشوند. برخی ترکیبات روتنیوم و مولیبدن دارای پیوند چهارگانه هستند که تنها با حضور پیوند دلتا قابل توجیه است. همچنین در مولکول استیلن میتوان با تحریک الکترونها از اوربیتالهای غیرپیوندی کمانرژیتر، پیوند دلتا بین دو اتم کربن ایجاد کرد، زیرا تقارن اوربیتال ضدپیوندی پای مشابه تقارن پیوند دلتا است.
پیوندها با مراتب بالاتر
شیمیدانها به صورت تئوری حدس زدهند که پیوندهایی با مراتب بالاتر (پیوندهای فی و گاما) که حاصل از همپوشانی اوربیتالهای f و g هستند هم امکان وجود دارند. در این تئوری به نظر میرسد که همپوشانی اوربیتالهای اتمی بیش ار چیزی باشد که در پیوندهای سیگما و پای مشاهده میشود.
با این وجود تاکنون هیچ شواهد آزمایشگاهی مبنی بر مشاهده این نوع پیوندها در ترکیبات شیمیایی وجود نداشته است.
موارد استثنا در پیوندهای پای
در این مطلب از مجله فرادرس آموختیم مفهوم پیوندهای پای چیست. در قسمتهای قبل اشاره کردیم که پیوندهای پای به تنهایی وجود خارجی ندارد و همواره پس از تشکیل پیوند سیگما بین دو اتم و با همپوشانی جانبی اوربیتالهای p تشکیل میشود. با این حال، در برخی از کمپلکسهای فلزی، برهمکنشهای پای بین یک اتم فلز و اوربیتال ضد پیوندی پای آلکین یا آلکن، منجر به تشکیل پیوندهای پای میشود، بدون اینکه هیچ پیوند سیگمایی شکل گرفته باشد.
برای مثال میتوان به ترکیباتی مانند دی آیرون هگزا کربونیل و دی بوران اشاره کرد. در این ترکیبات، پیوند مرکزی فقط از پیوندهای پای تشکیل شده است، زیرا یک اوربیتال ضد پیوندی سیگما همزمان با پیوند سیگما وجود دارد که اثر آن را خنثی میکند. از این ترکیبات به عنوان مدلهای محاسباتی برای بررسی پیوندهای پای استفاده شده و مشخص شده است که برای دستیابی به بیشترین همپوشانی اوربیتالها، فاصلهی پیوندی در آنها بسیار کمتر از حد انتظار است.
source
