در شیمی، پیوند سیگما که با علامت نشان داده میشود، نوعی از پیوند شیمیایی کووالانسی است. این پیوند، قویترین نوع پیوند کووالانسی است که در اثر نزدیک شدن پرانرژیترین اوربیتالهای اتم و همپوشانی آنها تشکیل میشود. پس از تشکیل این پیوند، دانسیته الکترونی بین دو هسته اتم درگیر پیوند افزایش مییابد. در این مطلب از مجله فرادرس میآموزیم پیوند سیگما چیست و چگونه شکل میگیرد.
آنچه در این مطلب میآموزید:
-
میآموزید پیوند سیگما چیست و چگونه تشکیل میشود.
-
ویژگیهای پیوند سیگما و نقش آن در مرتبه و زاویه پیوند را یاد میگیرید.
-
انواع پیوند سیگما حاصل از همپوشانی اوربیتالهای مختلف را تشخیص میدهید.
-
سازوکار تشکیل پیوند سیگما و انرژی پیوند را درک میکنید.
-
میآموزید پیوند پای چیست و چه تفاوت و ارتباطی با پیوند سیگما دارد.
-
با اوربیتالهای مولکولی و ضدپیوندی سیگما و پای آشنا میشوید.

در ابتدای این مطلب میآموزیم پیوند سیگما چیست و در چه موادی وجود دارد. سپس به بررسی ویژگیها و انواع آن میپردازیم. در ادامه، روش تشکیل این پیوند و تفاوتهای آن با پیوند پای را توضیح میدهیم. در نهایت میآموزیم اوربیتالهای پیوندی و ضدپیوندی کدامند و چه ارتباطی با نظریه اوربیتال مولکولی دارند. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با این پیوند آشنا شوید.
پیوند سیگما چیست؟
پیوند سیگما، قویترین نوع پیوند کووالانسی (پیوند اشتراکی گسترده) است که از به اشتراکگذاری الکترونها توسط دو هسته اتمهای پیوند تشکیل میشود. این پیوند، زمانی تشکیل میشود که اوربیتالهای اتمی، از انتها به انتها (یا در اصطلاحی دیگر، سر به سر) به هم نزدیک شوند. این پیوند میتواند از دو اوربیتال s، دو اوربیتال p، یک اوربیتال s و یک اوربیتال p یا یک اوربیتال هیبریدی sp تشکیل شود.
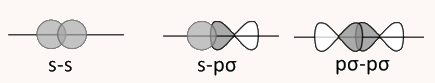
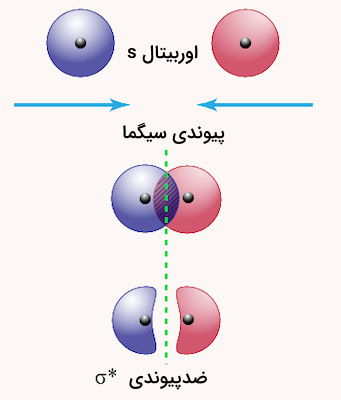
الکترونهای موجود در پیوند سیگما میتوانند در هر فضایی در این پیوند حضور داشته باشند. این پیوند متقارن است و میتواند به راحتی حول محور خود بچرخد. برای مثال، تصویر زیر یک این پیوند را بین دو اوربیتال s را نمایش میدهد. این پیوند دارای تقارن استوانهای است. بدین معنی که اگر در هر نقطهای از طول پیوند، یک برش عرضی ایجاد کنیم، شکلی دایرهای به دست میآید.

مثال پیوند سیگما
برای درک بهتر این پیوند، به روش تشکیل پیوند در مولکول هیدروژن دقت کنید. هر اتم هیدروژن در مولکول دو اتمی هیدروژن، یک پروتون و یک الکترون دارد. هنگامی که میگوییم دو هسته اتم هیدروژن باهم الکترون به اشتراک می گذارند، به معنی این است که دو اوربیتال کروی s همپوشانی میکنند. این دو اوربیتال در تصویر زیر با رنگ خاکستری مشخص شدهاند.
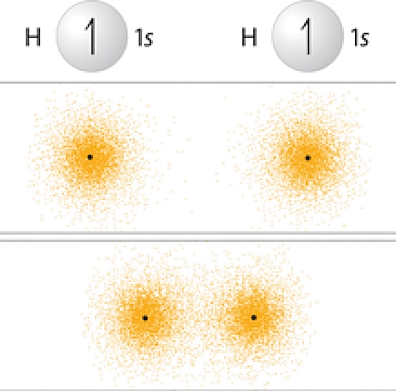
در این پیوند، دو الکترون جذب بارهای مثبت هر دو هسته اتمهای هیدروژن میشوند و آنها را با پایداری بالایی به هم متصل نگه میدارند. اگر این هستهها فاصله زیادی از هم داشته باشند، این دو اوربیتال s نمیتوانند با هم همپوشانی داشته باشند در نتیجه پیوند کووالانسی شکل نمیگیرد.
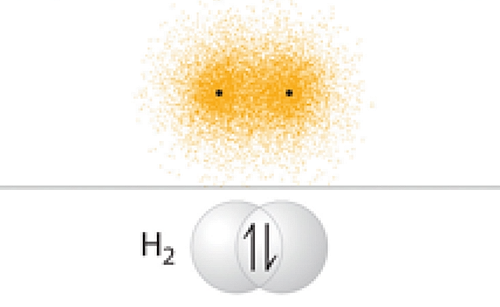
با نزدیک شدن این اتمها به هم، همپوشانی آغاز شده و پیوندی بین آنها شکل میگیرد که پیوند سیگما نام دارد. این فرآیند باعث کاهش انرژی پتانسیل سیستم شده و امکان برقراری برهمکنشهای الکترواستاتیکی بین هسته یکی از اتمها و الکترون اتم دیگر فراهم میشود.
یادگیری شیمی دانشگاهی با فرادس
برای درک بهتر اینکه مفهوم پیوند سیگما چیست، نیاز است ابتدا با مفاهیمی چون پیوند کووالانسی، اوربیتالهای مولکولی و انواع ترکیبات شیمیایی آشنا شویم. همچنین، شناخت هیبریداسیون و ساختارهای لوییس به درک ما از این مفهوم کمک میکند. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه پیوند سیگما دسترسی داشته باشید.
ویژگی های پیوند سیگما
در قسمت قبل آموختیم پیوند سیگما در شیمی چیست. این نوع پیوند در اثر همپوشانی اوربیتالهای اتمی در راستای محور بین هستهها تشکیل میشود. این نوع پیوند ویژگیهای منحصر به فردی دارد که در ادامه معرفی میکنیم.
- همپوشانی سر به سر اوربیتالهای هیبریدی، این پیوند را تشکیل میدهد.
- پیوندهای سیگما به شدت قوی هستند و پایداری بالایی دارند.
- در اثر نزدیک شدن دو اتم یا مولکول، ابتدا این پیوند تشکیل میشود.
- این پیوند با علامت «» نمایش داده میشود.
- تمامی پیوندهای یگانه به فرم سیگما هستند.
- پیوندهای دوگانه و سه گانه دارای یک پیوند از نوع سیگما هستند.
پیوند سیگما یکی از مهمترین پیوندهای شیمیایی کووالانسی است که شکل مولکولها و ترکیبات پیچیده را به وسیله هیبریداسیون مشخص میکند. در واقع از مفهوم این پیوند و ویژگیهای آن در مقدمات شناسایی بسیاری از مواد استفاده میشود. پیشنهاد میکنیم برای درک بهتر این موضوع، فیلم آموزش تشکیل پیوند در ترکیبات کوئوردینانسیون در شیمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
انواع پیوند سیگما
در قسمت قبل آموختیم پیوند سیگما چیست. این پیوند از همپوشانی مستقیم و همفاز (با فاز یکسان) اوربیتالهای اتمی در راستای محور بین دو هسته اتم به وجود میآیند و از قویترین انواع پیوند کووالانسی هستند. الکترونهایی که در این پیوند شرکت میکنند معمولا با نام الکترون سیگما شناخته میشوند. به طور کلی، تمامی پیوندهای یگانه، از نوع سیگما هستند.
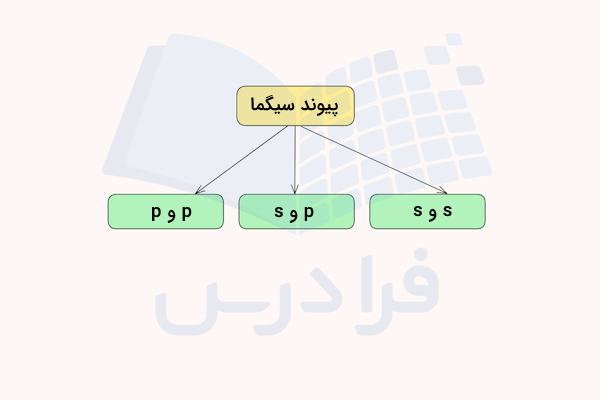
این پیوندها میتوانند از همپوشانی اوربیتالهای s و s، اوربیتالهای s و p یا همپوشانی اوربیتالهای p و p به وجود بیایند. در ادامه، هریک از این انواع پیوند سیگما را توضیح میدهیم.
همپوشانی دو اوربیتال s
این نوع پیوند از همپوشانی دو اوربیتال s کروی شکل تشکیل میشود. این همپوشانی سر به سر بوده و در راستای محور بین دو هسته اتم ها شکل میگیرد. در این نوع پیوند، اوربیتالهای s باید نیمه پر باشند.
هر اوربیتال s دو الکترون را در خود جای میدهد و نیمهپر بودن آن بدین معنی است که در هر اوربیتال s باید تنها ۱ الکترون وجود داشته باشد. تصویر زیر نشاندهنده همپوشانی دو اوربیتال s است.
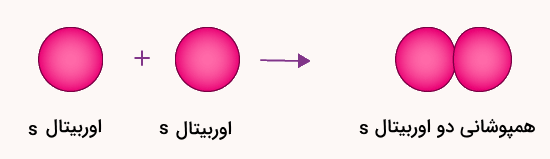
این نوع از پیوند سیگما در تشکیل و شکل هندسی ساختار بسیاری از ترکیبات آلی مانند آلکانها و آلکنها دیده میشود. همچنین، بسیاری از واکنشهای آلی مانند واکنشهای افزایشی با وجود این اوربیتالها و پیوندها توجیه میشوند. پیشنهاد میکنیم برای آشنایی بیشتر با این واکنشها، مطلب واکنش افزایشی مجله فرادرس را مطالعه کنید.
همپوشانی اوربیتال s و p
در قسمت قبل آموختیم نحوه تشکیل پیوندهای سیگما از دو اوربیتال s چیست. در تشکیل این پیوند از دو اوربیتال s و p یک اوربیتال نیمهپر s و یک اوربیتال نیمهپر p در راستای پیوند بین اتمها به هم نزدیک میشوند. با همپوشانی این اوربیتالها، این پیوند تشکیل میشود. تشکیل این پیوند را در تصویر زیر نمایش میدهیم.
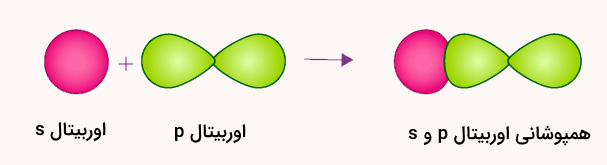
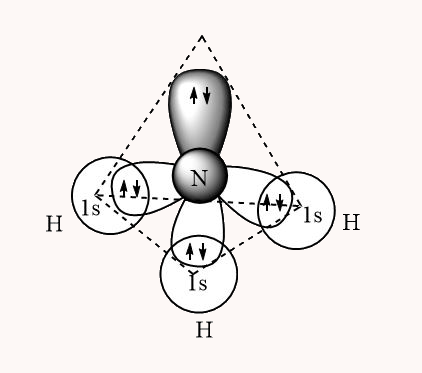
این نوع همپوشانی سر به سر است و حتما از سر اوربیتال p به s انجام میشود. این نوع پیوند در مولکولهایی مانند آمونیاک رخ میدهد. یک مولکول آمونیاک با فرمول شیمیایی ، سه پیوند از نوع سیگمای sp دارد که از همپوشانی اوربیتالهای 2p در راستای محورهای مختصات x، y و z تشکیل میشود. این اوربیتالها که متعلق به اتم نیتروژن هستند، با اوربیتالهای s اتمهای هیدروژن همپوشانی میکنند.
شکل پیوند سیگما حاصل از همپوشانی یک اوربیتال s و p در مولکول هیدروژن فلوئورید (HF)، را در تصویر زیر نمایش میدهیم.

همپوشانی دو اوربیتال p
دو اوربیتال p نیز میتوانند همپوشانی کرده و پیوند سیگما تشکیل دهند. شرط تشکیل این نوع پیوند این است که این اوربیتالها نیمهپر بوده و به شکل سر به سر همپوشانی کنند. تشکیل این پیوند در راستای محور بین دو هسته خواهد بود. در تصویر زیر این نوع پیوند نشان داده میشود.
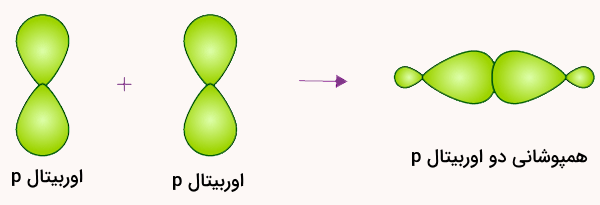
این نوع پیوند در مولکولهایی مانند کلر اتفاق میافتد. در این مولکول، دو اوربیتال 3p در راستای محور مختصات z با هم همپوشانی میکنند. همپوشانی سر به سر دو اوربیتال p در این نوع پیوندها ضروری است. در غیر اینصورت پیوند تشکیل شده از نوع سیگما نخواهد بود. شکل این پیوند حاصل از همپوشانی دو اوربیتال p در مولکول فلوئور () را در تصویر زیر مشاهده میکنید.
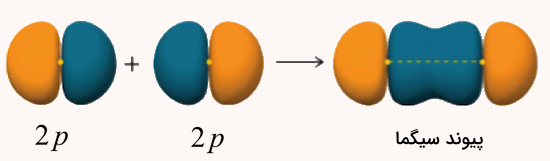
تشکیل پیوند سیگما
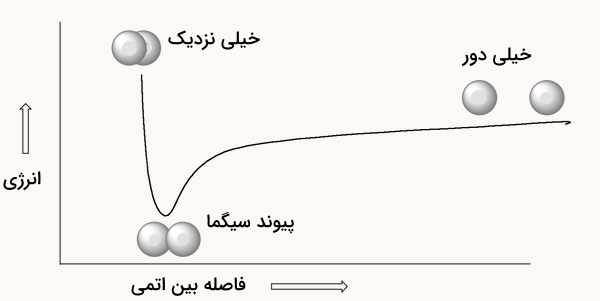
در قسمت قبلی، پیوند سیگمای ایجاد شده بین دو اتم هیدروژن را بررسی کردیم. با نزدیک شدن این اتمها به یکدیگر، در ابتدا، نیروی دافعهی بین دو هسته کمتر از نیروی جاذبهای است که بین الکترونها و هستهها وجود دارد، بنابراین پیوند همچنان پایدار باقی میماند. اما وقتی هستهها بیش از حد به یکدیگر نزدیک میشوند، نیروی دافعهی بین آنها آنقدر زیاد است که بر نیروی جاذبه غلبه میکند و انرژی پتانسیل سیستم بهسرعت افزایش مییابد.
در این حالت، یعنی زمانی که هستهها بیش از حد نزدیک شدهاند، وضعیت ناپایدار و دارای انرژی بالایی بهوجود میآید. بین این دو حالت (بسیار دور یا بسیار نزدیک)، یک فاصلهی مشخص و بهینه بین دو هسته وجود دارد که در آن انرژی پتانسیل به حداقل میرسد. این بدان معناست که مجموع نیروهای جاذبه و دافعه در این نقطه بیشترین نیروی جاذبهی خالص را ایجاد میکنند. به این فاصلهی بهینه بین هستهها، طول پیوند سیگما میگویند. به نمودار انرژی پتانسیل بین دو اتم هیدروژن دقت کنید.
پیوند پای چیست؟
پیوند پای که با علامت نمایش داده میشود، نوعی دیگر از پیوند کووالانسی است که از همپوشانی اوربیتالهای الکترونی p به صورت پهلو به پهلو تشکیل میشود. این پیوند به صورت عمود بر محور بین دو هسته اتم تشکیل میشود. طی تشکیل این نوع پیوند، محورهای اوربیتالهای اتمی با هم موازی هستند و به همین دلیل پیوند پای تشکیل شده عمود بر این محور خواهد بود. تشکیل این نوع پیوند را در تصویر زیر نشان دادهایم.
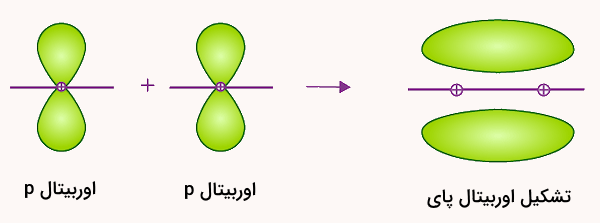
پیوندهای پای معمولا ضعیفتر از پیوند سیگما هستند. این پدیده به این علت است که درجه همپوشانی در این نوع پیوندها کمتر از پیوند سیگما است. در حالت کلی، پیوندهای دوگانه از یک پیوند سیگما و یک پیوند پای و پیوندهای سهگانه از دو پیوند پای و یک پیوند سیگما تشکیل میشوند. نکته قابل توجه این است که ترکیبی از پیوندهای پای و سیگما همواره قویتر از یک پیوند سیگما به شکل تکی است.
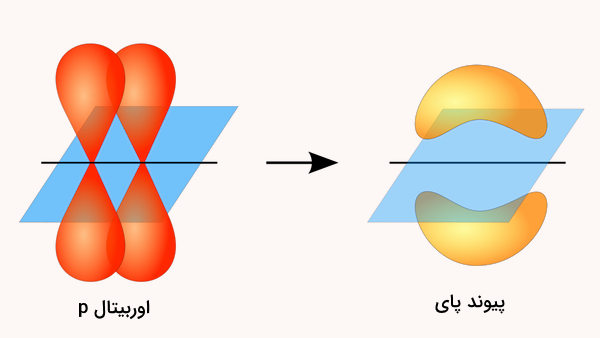
بر خلاف پیوند سیگما که امکان چرخش آزاد حول محور بین دو هسته را فراهم میکند، تشکیل پیوند پای باعث جلوگیری از چرخش پیوند میشود. اگر بخواهیم اتمی را حول پیوند دوگانه بچرخانیم، ابتدا پیوند پای باید شکسته شود. این بدین علت است که پیوند پای از هپوشانی پهلو به پهلوی اوربیتالهای p تشکیل میشود و این همپوشانی در صورت چرخش از بین میورد.
تفاوت پیوند سیگما و پای
تفاوتهای کلیدی پیوند سیگما و پیوند پای را در جدول زیر توضیح دادهایم.
| پیوند سیگما | پیوند پای |
| همپوشانی اوربیتال خالص یا هیبریدی | همپوشانی اوربیتال غیرهیبریدی |
| پیوند قوی و انرژی پیوند بالا | قدرت پیوند پایینتر |
| تشکیل به صورت تکی | تشکیل همراه پیوند سیگما |
| تاثیر مستقیم بر شکل مولکول | بدون تاثیر بر شکل مولکول |
| چرخش حول پیوند مجاز | چرخش حول پیوند غیرمجاز |
| تشکیل در راستای محور بین اتمها | تشکیل عمود بر محور بین اتمها |
| اولین پیوند تشکیلشده در مولکول | تشکیل پس از پیوند سیگما |
| واکنشپذیری زیاد | واکنشپذیری کم |
اوربیتالهای پیوندی و ضدپیوندی
اوربیتال ضدپیوندی سیگما را با علامت نمایش میدهند. الکترونهایی که مدت زمان بیشتری در فاصله بین دو هسته اتم درگیر در پیوند حضور دارند، در اوربیتالهای پیوندی جای میگیرند. از طرف دیگر، الکترونهایی که مدت زمان بیشتری در خارج فاصله بین دو هسته اتم قرار میگیرند، در اوربیتالهای ضدپیوندی قرار میگیرند. دلیل این موضوع این است که در اوربیتالهای پیوندی، تراکم الکترونی بین هستهها افزایش مییابد، در حالی که در اوربیتالهای ضدپیوندی، این تراکم کاهش پیدا میکند.
قرار گرفتن الکترون در یک اوربیتال پیوندی باعث پایدارتر شدن مولکول میشود، زیرا الکترون در بین دو هسته قرار دارد و آنها را به یکدیگر نزدیک میکند. برعکس، قرار گرفتن الکترون در اوربیتال ضدپیوندی به کاهش پایداری مولکول میانجامد. الکترونها بر اساس سطح انرژی اوربیتالها جایگیری میکنند. اول اوربیتالهای با انرژی پایینتر، سپس اوربیتالهای با انرژی بالاتر پر میشوند. اگر نتیجه این پر شدنها، مرتبه پیوند برابر صفر باشد، به این معنی است که مولکول بهقدری ناپایدار است که نمیتواند وجود داشته باشد.
نظریه اوربیتال مولکولی و اوربیتال ضدپیوندی
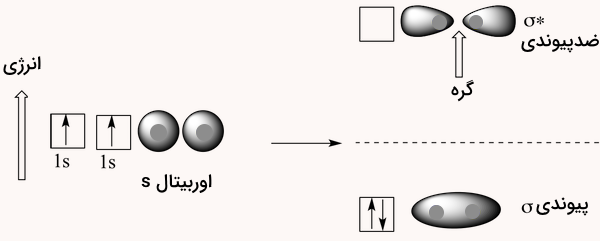
در نظریه پیوند والانس، گفتیم که دو اوربیتال 1s از هر اتم با هم همپوشانی میکنند و این امکان را فراهم میکنند که دو الکترون به اشتراک گذاشته شوند و یک پیوند کووالانسی شکل بگیرد. طبق نظریه اوربیتال مولکولی، دو اوربیتال 1s اتمی، بهصورت ریاضی با یکدیگر ترکیب شده و دو اوربیتال جدید بهوجود میآورند. یک اوربیتال اتمی (مانند 1s در اتم هیدروژن) ناحیهای از فضا را اطراف یک اتم نشان میدهد که احتمال حضور الکترون در آن زیاد است.
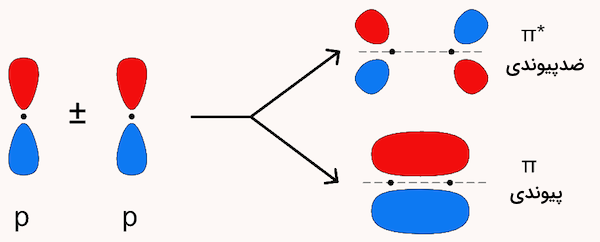
در مقابل، یک اوربیتال مولکولی ناحیهای از فضا را اطراف دو یا چند اتم توصیف میکند که الکترونها ممکن است در آن حضور داشته باشند. بر اساس اصول ریاضی، هنگام ترکیب اوربیتالها، تعداد اوربیتالهای اولیه برابر با تعداد اوربیتالهای نهایی خواهد بود. به همین ترتیب، وقتی دو اوربیتال 1s اتمی در مولکول هیدروژن ترکیب میشوند، نتیجهی آن دو اوربیتال سیگما خواهد بود. یکی از این اوربیتالها پیوندی و دیگری ضدپیوندی است. به تصویر زیر دقت کنید.
اوربیتال مولکولی پیوند سیگما
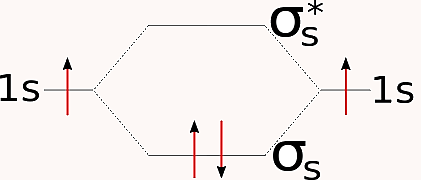
طبق نظریه اوربیتال مولکولی، یکی از اوربیتالهای سیگما که حاصل ترکیب دو اوربیتال 1s است، انرژی کمتری نسبت به هرکدام از اوربیتالهای اتمی جداگانه دارد. به این اوربیتال، اوربیتال مولکولی پیوندی میگویند. اوربیتال دوم، که با نماد () شناخته میشود، دارای انرژی بیشتری از اوربیتالهای 1s اولیه است و به آن اوربیتال مولکولی ضدپیوندی میگویند.
اوربیتال سیگمای پیوندی که در حالت پایه مولکول هر دو الکترون را در خود جای میدهد، شکل تخممرغی دارد، هستههای دو اتم را در بر میگیرد، و احتمال حضور الکترون در ناحیه بین دو هسته در آن بالاست. در مقابل، اوربیتال ضدپیوندی سیگما استار () شکل دو قطرهای دارد. در آن، تراکم الکترونی در نزدیکی هر هسته بیشتر است و در وسط دو هسته یک گره وجود دارد. یعنی ناحیهای که احتمال حضور الکترون صفر است.
اوربیتال مولکولی پیوند پای
در قسمتهای قبل آموختیم که پیوند پای از همپوشانی جانبی اوربیتالهای p شکل میگیرد و عامل تشکیل پیوندهای دو یا سهگانه است. پیوند پای نیز مانند پیوند سیگما دارای دو اوربیتال پیوندی و ضدپیوندی است.
اوربیتال مولکولی ضدپیوندی نسبت به اوربیتال مولکولی پیوندی انرژی بالاتری دارد و ناپایدارتر است. این بدان معناست که در پایدارترین حالت انرژی (حالت پایه)، هر دو الکترون در اوربیتال پیوندی پای قرار میگیرند و اوربیتال ضدپیوندی پای استار خالی باقی میماند. به تصویر زیر دقت کنید.
اهمیت پیوند سیگما
پیوند سیگما قوی ترین نوع پیوند کووالانسی است که در تمامی پیوندهای یگانه کووالانسی شکل میگیرد. این پیوند، اساس تشکیل ترکیبات شیمیایی بسیار زیادی است. همچنین، پیوند سیگما به مولکول اجازه می دهد که اتمهای دو سر پیوند آزادانه حول محور پیوند بچرخند. این چرخش آزاد، نقش تعیین کنندهای در شکل مولکول دارد.
نوع اوربیتال شرکتکننده در سیگما تعیینکنندهی زاویه پیوند و شکل کلی مولکول است. این نوع اوربیتالها تعیین میکنند که زاویه بین پیوندها چهقدر باشد. برای مثال، به رابطه زاویه پیوند و هیبریداسیون مولکول دقت کنید.
| نوع هیبریداسیون پیوند سیگما | شکل مولکول و زاویه پیوندی |
| خطی و ۱۸۰ درجه | |
| مثلث مسطح و ۱۲۰ درجه | |
| هرمی مثلثی و ۱۰۹٫۵ درجه |
مثال تشخیص پیوند سیگما
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختهاید، به مثالهای زیر دقت کنید.
مثال ۱
در مولکول بنزن چند پیوند پای و سیگما وجود دارد؟
پاسخ
مولکول بنزن یک ترکیب آروماتیک حلقوی است که از ۶ اتم کربن و ۶ اتم هیدروژن تشکیل میشود. فرمول شیمیایی این ترکیب به شکل است. این ترکیب دارای ۳ پیوند یگانه بین اتمهای کربن، ۲ پیوند دوگانه بین اتمهای کربن و ۶ پیوند یگانه بین اتمهای کربن و هیدروژن است.
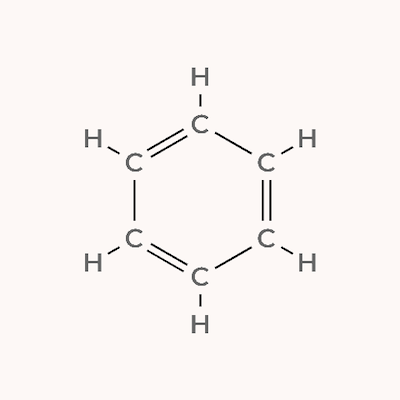
هر پیوند یگانه از یک پیوند سیگما و هر پیوند دوگانه از یک پیوند پای و یک پیوند سیگما تشکیل میشود. پس مولکول بنزن دارای ۳ پیوند پای و ۱۲ پیوند سیگما است.
مثال ۲
در مولکول اتین با فرمول ساختاری زیر، چند پیوند پای سیگما وجود دارد؟
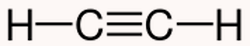
پاسخ
در این مولکول یک پیوند سهگانه حاوی دو پیوند پای و یک پیوند سیگما و دو پیوند یگانه حاوی پیوند سیگما وجود دارد. پس در مجموع این مولکول دارای ۲ پیوند پای و ۳ پیوند سیگما است.
مثال ۳
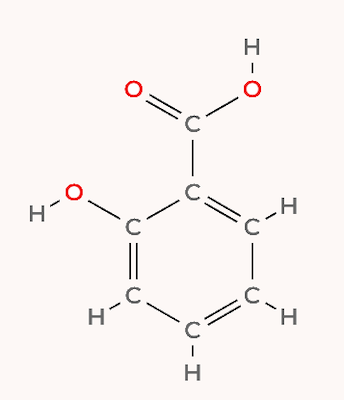
مشخص کنید چند پیوند پای و سیگما در مولکول سالیسیلیک اسید وجود دارد؟
پاسخ
مولکول سالیسیلیک اسید از ۴ پیوند دوگانه و ۱۲ پیوند یگانه تشکیل میشود. پس این مولکول در مجموع ۴ پیوند پای و ۱۶ پیوند سیگما دارد.
source
