استوکیومتری در محلول ها یکی از مهمترین دستههای مسائل استوکیومتری و تحلیل تجزیهای مواد در شیمی است. استوکیومتری در محلول ها به جنبههای کمی واکنشهای شیمیایی که در فاز محلول یا آبی انجام میشود، میپردازد. مقدار غلظت محلول، وزن ماده حلشونده و نوع حلال از مهمترین پارامترهای این محاسبات هستند. در این مطلب از مجله فرادرس میآموزیم مفهوم استوکیومتری در محلول ها چیست و محاسبات آن چگونه است.
آنچه در این مطلب میآموزید:
-
روشهای بیان غلظت محلولهای مختلف مانند مولاریته را به شکل کامل میآموزید.
-
میتوانید از محاسبات استوکیومتری برای واکنشها در محلولها استفاده کنید.
-
با محاسبات استوکیومتری در تیتراسیون آشنا میشوید.
-
روش محاسبه حجم گاز تولید شده در شرایط STP در واکنشها را به شکلی کامل میآموزید.
-
میتوانید جرم، حجم و غلظت ماده مجهول را در واکنشهای فاز محلول محاسبه کنید.
-
سازوکار اثر غلظت را بر خواص محلول درک میکنید.

در ابتدای این مطلب با انواع سوالات استوکیومتری در محلول ها آشنا میشویم. سپس به توضیح مفاهیم پایه استوکیومتری در محلول ها پرداخته و مراحل محاسبات مربوط به آنها را میآموزیم. در ادامه، انواع محاسبات استوکیومتری در محلول ها را بر اساس حجم، غلظت، گاز تولید شده و جرم ماده مجهول در واکنشهای محلولها همراه با مثال بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با استوکیومتری در محلول ها آشنا شوید.
استوکیومتری در محلول ها
استوکیومتری، مطالعه کمی مقادیر نسبی مواد واکنشدهنده و فرآورده در واکنشهای شیمیایی است. مقادیر کمی مواد واکنشدهنده و فرآورده (مانند جرم، غلظت، حجم) در واکنشهای شیمیایی که در فاز محلول اتفاق میافتند، به طور نسبی در استوکیومتری محلولها بررسی میشوند.
محلولها و محلولهای آبی، بستری بسیار رایج برای انجام واکنشهای شیمیایی هستند و شناخت و یادگیری استوکیومتری در محلول ها برای پیشبینی مقادیر واکنشدهنده و فرآورده در این واکنشها ضروری است.

انواع مسائل استوکیومتری در محلول ها
در حل مسائل استوکیومتری ممکن است یکی از حالت زیر پیش بیاید و با توجه به واکنش شیمیایی بین مواد و مقادیر ارائه شده ماده معلوم، مقدار ماده مجهول خواسته شود. در ادامه، انواع مسائل استوکیومتری در محلول ها را دسته بندی میکند. این دسته بندی بر اساس معادله واکنش کلی زیر تنظیم شده است.
- تبدیل حجم ماده A به حجم ماده B:
- تبدیل جرم ماده A به حجم ماده B
- تبدیل حجم ماده A به جرم ماده B
- تبدیل جرم ماده A به جرم ماده B
- تبدیل غلظت ماده B به غلظت ماده A
- تبدیل حجم گاز تولید شده C به حجم محلول B
- تبدیل حجم ماده B به غلظت A (تیتراسیون)
یادگیری شیمیدهم با فرادرس
برای درک بهتر استوکیومتری در محلول ها و انجام دقیق محاسبات آن، نیاز است ابتدا با مفاهیمی چون جرم مولی، محاسبات تبدیل کسرها، انواع ترکیبات شیمیایی و انحلالپذیری آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه دهم فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه استوکیومتری در محلول ها دسترسی داشته باشید.
مفاهیم پایه استوکیومتری محلولها
برای حل مسائل استوکیومتری در محلول ها نیاز است تا با برخی از مفاهیم پایه محلولها در شیمی اشنا شویم. در ادامه این موارد را توضیح میدهیم.
معادله واکنش شیمیایی در فاز محلول
هر واکنش شیمیایی را در شیمی با یک معادله واکنش شیمیایی نمایش میدهند. در معادله واکنش شیمیایی، مواد واکنشدهنده و فرآورده به همراه حالت آنها و ضرایب استوکیومتری مشخص میشوند. برای مثال به معادله واکنش زیر دقت کنید.
این معادله واکنش مربوط به واکنش کلسیم کربنات جامد و محلول اسید کلریدریک است. فاز مواد شیمیایی موجود در واکنش به شکل زیر نمایش داده میشود.
- عبارت (s) برای نمایش دادن حالت جامد به کار میرود.
- عبارت (aq) برای نمایش دادن حالت محلول به کار میرود.
- عیارت (g) برای نمایش دادن حالت گاز به کار میرود.
- عبارت (l) برای نمایش دادن حالت مایع به کار میرود.
حلشونده و حلال
هر محلول از انحلال ماده حلشونده در حلال تشکیل میشود. ماده حلشونده قسمت کوچکتر محلول را تشکیل میدهد و با عبارت انگلیسی (Solute) و حلال که قسمت بزرگتر محلول را تشکیل میدهد با عبارت (Solvent) نمایش داده میشود. همچنین، محلول را در برخی از فرمولها با عبارت انگلیسی (Solution) نمایش میدهند.
جرم مولی
جرم مولی معادل جرم یک مول از یک ماده بر حسب گرم است. این پارامتر با حرف انگلیسی (M) نمایش داده میشود و واحد آن گرم بر مول است. جرم مولی مواد مختلف را میتوان با استفاده از جدول تناوبی عناصر به دست آورد.
غلظت محلول
غلظت محلول، نسبت مقدار ماده حلشونده را به کل محلول مشخص میکند. بسته به اندازهگیری انجام شده این پارامتر میتواند با واحدهای مختلفی مانند مولاریته، درصد وزنی، درصد حجمی و … بیان شود. در ادامه برخی از مهمترین و رایجترین روشهای بیان غلظت را معرفی میکنیم.
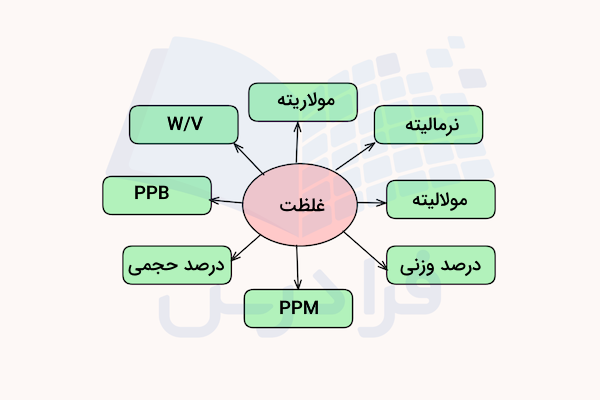
مولاریته
مولاریته یک محلول نسبت تعداد مولهای ماده حلشونده را در لیتر محلول مشخص میکند. فرمول محاسبه مولاریته به شکل زیر است.
در این فرمول، n نشان دهنده تعداد مول و V حجم محلول است.
محاسبه غلظت مولار
در محاسبه غلظت مولار محلولها، میتوانیم از جرم، جرم مولی و نسبت مولی مواد و حجم محلول استفاده کنیم. تصور کنید ۳۵۵ میلیلیتر از محلولی حاوی ۰٫۱۳۳ مول ساکاروز داریم و میخواهیم غلظت مولار آن را محاسبه کنیم.
برای این کار کافی است تعداد مول ماده حلشونده را بر لیتر محلول تقسیم کنیم.
درصد وزنی
درصد وزنی یکی دیگر از روشهای بیان غلظت است که نسبت جرم ماده حلشونده را بر جرم محلول بر حسب درصد بیان میکند. فرمول محاسبه درصد وزنی به شکل زیر است.
$$text{ww%} = frac{m_text{solute}}{m_text{solution}} times 100$$
در مسائلی که غلظت محلول بر حسب درصد وزنی بیان میشود، میتوان با استفاده از جرم مولی و نسبت مولی، جرم ماده مجهول را به دست آورد.
درصد حجمی
درصد وزنی یک روش بیان غلظت است که نسبت حجم ماده حلشونده را بر حجم محلول بر حسب درصد بیان میکند. فرمول محاسبه درصد حجمی به شکل زیر است.
درصد وزنی حجمی
درصد حجمی وزنی یکی از روشهای بیان غلظت است که نسبت جرم ماده حلشونده را بر حجم محلول بر حسب درصد بیان میکند. فرمول محاسبه درصد وزنی حجمی به شکل زیر است.
در مسائل استوکیومتری در محلول ها که از درصد وزنی حجمی برای بیان غلظت استفاده شده است، میتوان با استفاده از جرم مولی، نسبت مولی و چگالی به اطلاعات ماده مجهول دست یافت.
نسبت مولی
نسبت مولی، مقدار نسبت مول مواد مختلف را در یک واکنش شیمیایی مشخص میکند. این نسبتها با استفاده از ضرایب استوکیومتری که پیش از نماد هر ترکیب شمیایی در معادله واکنش شیمیایی نوشته شده، مشخص میشود. برای درک بهتر این مفهوم، به معادله واکنش شیمیایی زیر دقت کنید.
حروف انگلیسی کوچک، ضرایب استوکیومتری هستند. a مول از ماده A با b مول از ماده B واکنش داده و c مول از ماده C و d مول از ماده D را تولید میکند. ضرایب استوکیومتری واکنش با استفاده از روشهای تجربی و همچنین، موازنه واکنشهای شیمیایی مشخص میشود. در حل مسائل استوکیومتری در محلولها باید همواره دقت داشته باشیم معادله واکنش شیمیایی موازنه شده باشد.

مراحل محاسبات استوکیومتری در محلول ها
برای حل مسائل استوکیومتری در محلول ها، نیاز است همراه چند مرحله کلی را به یاد داشته باشیم و انجام دهیم. این مراحل شامل نوشتن و موازنه واکنش شیمیایی، تبدیل واحدهای مورد نیاز، استفاده از نسبتهای مولی و تبدیل مول مواد به واحدهای مورد نیاز است. در ادامه، هریک از این مراحل را توضیح میدهیم.

پیشنهاد میکنیم برای درک بهتر این محاسبات و مراحل، فیلم آموزش حل مسائل استوکیومتری فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
۱. موازنه واکنش شیمیایی
در اولین مرحله انجام محاسبات استوکیومتری محلولها، باید معادله واکنش شیمیایی را نوشته و آن را موازنه کنیم. برای نوشتن معادله واکنش، باید نماد شیمیایی ترکیبات واکنش را نوشته و واکنشدهندهها را در سمت چپ معادله و فرآوردهها را در سمت راست معادله قرار دهیم. برای مثال به واکنش زیر توجه کنید.
در این واکنش، یک عدد عنصر سدیم و دو عنصر کلر در سمت واکنشدهندهها و یک سدیم و یک کلر در سمت فرآوردهها وجود دارد. پس از آن باید بررسی کنیم تعداد تمامی عناصر در هر دو سمت معادله برابر باشد. برای این کار میتوانیم از موازنه استفاده کنیم. در اولین مرحله، تعداد عناصر را با توجه به ضرایب استوکیومتری آنها میشماریم.
سپس برای برابر شدن تعداد آنها در هر دو سمت معادله ضرایب ترکیبات شیمیایی را در عد مناسب ضرب میکنیم. در نهایت اگر ضریب استوکیومتری کسری در معادله واکنش داشتیم، کل ضرایب را در مخرج کسر ضرب میکنیم.
پیشنهاد میکنیم برای آشنایی بیشتر با این روش موازنه، مطلب موازنه به روش وارسی مجله فرادرس را مطالعه کنید.
۲. تبدیل واحدهای مورد نیاز
در انجام محاسبات استوکیومتری محلولها گاهی نیاز است برخی از واحدهای داده شده را به واحدهای دیگر تبدیل کنیم. برای مثال، تبدیل مول به گرم و تبدیل میلیلیتر به لیتر از رایجترین تبدیل واحدها در مسائل استوکیومتری هستند.
برای تبدیل واحدهای میلیگرم و میلیلیتر به گرم و لیتر نیاز است تا محاسبات زیر را انجام دهیم.
برای تبدیل گرم بر مول و بالعکس باید از مفهوم جرم مولی کمک بگیریم. جرم مولی تمامی عناصر را میتوانیم با استفاده از جدول تناوبی عناصر پیدا کنیم. سپس برای محاسبه جرم مولی ترکیبات شیمیایی کافی است تا جرم مولی تمامی عناصر تشکیلدهنده آنها را با هم جمع کنیم. برای مثال، جرم مولی سدیم کلرید به شکل زیر است.
برای تبدیل گرم ماده به مول آن و بالعکس با استفاده از جرم مولی به روش زیر عمل میکنیم.
برای تبدیل واحد گرم به لیتر و بالعکس از مفهوم مولاریته کمک میگیریم. محاسبات این تبدیل واحد به شکل زیر است.
۳. استفاده از نسبت مولی
نسبت مولی مواد موجود در واکنشهای شیمیایی با استفاده از ضرایب استوکیومتری معادله واکنش موازنه شده آنها تعیین میشود. برای مثال، به واکنش زیر توجه کنید.
در این واکنش، ۲ مول سدیم با ۱ مول کلر واکنش داده و ۲ مول سدیم کلرید تولید میکند. باید دقت کنیم در به دست آوردن نسبت مولی مواد، باید تنها ضرایب استوکیومتری ترکیبات شیمیایی را در نظر بگیریم و نه تعداد عناصر را. بدین ترتیب اگر برای مثال ۲ گرم سدیم داشته باشیم، با توجه به نسبت مولی آنها، میتوان محاسبه کرد که این مقدار سدیم با چند گرم کلر واکنش میدهد.
۴. تبدیل مول ماده به جرم، حجم یا مولاریته
همانطور که در قسمت قبل دیدیم، میتوان از نسبتهای مولی استفاده کرد و مول ماده مجهول را به جرم، حجم یا مولاریته آنها تبدیل کرد. در قسمتهای بعد هریک از روشهای حل مسائل استوکیومتری در محلول ها را به صورت جداگانه بررسی خواهیم کرد.

محاسبه حجم ماده مجهول
در مسائل استوکیومتری در محلول ها ممکن است حجم ماده مورد نیاز برای واکنش با مقدار مشخصی از ماده دیگر خواسته شود. اطلاعات داده شده در مسئله میتواند شامل حجم، جرم یا غلظت ماده دیگر باشد. در ادامه این نوع مسائل را بررسی خواهیم کرد.
برای به دست آوردن مقدار لیتر یک ماده مجهول با استفاده از مول یا جرم ماده معلوم در یک واکنش شیمیایی، از محاسبات زیر بهره میبریم. در اولین قدم سعی میکنیم مقدار مول ماده معلوم را به دست آوریم. برای این کار نیاز است تا با استفاده از کسرهای تبدیل استوکیومتری مناسب به مقدار مول ماده برسیم. برای مثال روش محاسبه مول از جرم، غلظت و حجم ماده را در ادامه توضیح میدهیم.
| پارامتر داده شده | روش محاسبه مول |
| جرم ماده | تقسیم جرم بر جرم مولی ماده |
| حجم ماده | ضرب حجم ماده در غلظت مولار آن |
| غلظت ماده | ضرب غلظت ماده در حجم آن |
| حجم گاز استاندارد | تقسیم حجم بر ۲۲٫۴ |
فرمول محاسبه مول ماده با استفاده از غلظت، حجم و جرم آن به شکل زیر است.
در این فرمول n نماد تعداد مول، M نماد مولاریته، m نماد جرم، نماد جرم مولی و نماد حجم گاز است.
سپس مراحل زیر را برای محاسبه حجم ماده مجهول انجام میدهیم:
- تعداد مول ماده مجهول را با استفاده از ضرایب استوکیومتری و مول ماده معلوم به دست میآوریم.
- با استفاده از مفهوم غلظت، حجم ماده مجهول را به دست میآوریم.
مثال ۱
برای مثال، واکنش شیمیایی زیر را در نظر بگیرید.
میخواهیم محاسبه کنیم چه حجمی از کلسیم کلرید ۰٫۵۵۵ مولار با ۱٫۲۵ مول نیترات نقره واکنش میدهد.
پاسخ
در اولین مرحله، موازنه بودن واکنش شیمیایی را بررسی میکنیم. سپس با استفاده از نسبت مولی کلسیم کلرید و نیترات نقره و فرمول مولاریته، حجم کلسیم کلرید مورد نیاز را محاسبه میکنیم.
برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۲
با توجه به معادله واکنش شیمیایی زیر، چه حجمی از محلول ۰٫۰۹۹۵ مولار نیترات آلومینیوم با ۳٫۶۶ گرم نقره واکنش میدهد؟
پاسخ
معادله واکنش موازنه شده است. از گرم ماده معلوم محاسبات را شروع کرده و با استفاده از جرم مولی نقره، سپس نسبت مولی نقره و نیترات آلومینیوم، سپس مولاریته نیترات آلومینیوم، مقدار لیتر آن محاسبه میکنیم.
مثال ۳
چه حجمی از محلول ۰٫۵۱۲ مولار سدیم هیدروکسید با ۱۷٫۹ گرم اسید اگزالیک طبق معادله واکنش زیر واکنش میدهد؟
پاسخ
برای پاسخ به این پرسش با شروع از گرم اسید اگزالیک، استفاده از جرم مولی آن، نسبت مولی مواد و مولاریته سدیم هیدروکسید، حجم آن را به دست میآوریم.
محاسبه غلظت ماده مجهول
در برخی از مسائل، نیاز است تا با استفاده از حجمها و غلظتهای داده شده یک ماده، مقدار غلظت ماده دیگر را در واکنش شیمیایی به دست آوریم. اطلاعات داده شده در مسئله میتواند شامل حجم، جرم یا غلظت ماده دیگر باشد برای این کار نیاز است تا محاسبات زیر را دنبال کنیم.
در اولین قدم سعی میکنیم تعداد مول ماده را با استفاده از ضرایب تبدیل مناسب و نسبت مولی مواد به دست آوریم سپس با تقسیم تعداد مول ماده بر لیتر یا میلیلیتر مجهول میتوانیم غلظت مولار آن را بیابیم. برای محاسبه تعداد مول ماده از روی حجم، غلظت، جرم یا حجم گاز استاندارد مشابه قسمت قبل عمل میکنیم. برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
یک دانشآموز مقدار دقیقی از محلول کلرید آهن (III) را به اندازه ۱۰٫۰۰ میلیلیتر اندازهگیری میکند. او سپس محلول استاندارد اگزالات سدیم با غلظت ۰٫۱۰۷۴ مولار را به آن اضافه میکند تا تمام یونهای آهن (III) به صورت رسوب اگزالات آهن (III) تهنشین شوند. دانشآموز مشاهده میکند که برای کامل شدن واکنش، دقیقا ۹٫۰۴ میلیلیتر از محلول اگزالات سدیم مصرف شده است.
با توجه به معادله واکنش بین این دو ماده، غلظت محلول اولیه کلرید آهن (III) را محاسبه کنید.
پاسخ
برای پاسخ به این سوال، ابتدا تعداد مول ماده معلوم را به دست آورده و با استفاده از نسبت مولی ماده خواسته شده با این ماده، مول ماده مجهول را به دست میآوریم. سپس با تقسیم تعداد مول ماده بر لیتر محلول، غلظت مولار آن به دست میآید.
مثال ۲
دانشآموزی مقدار ۲۵ میلیلیتر محلول اسید فسفریک را طبق معادله زیر با ۰٫۰۹۸۷ مولار پتاسیم هیدروکسید تیتر میکند. او از ۵۴٫۰۶ میلیلیتر پتاسیم هیدروکسید برای کامل شدن واکنش استفاده میکند. مقدار غلظت اسید فسفریک استفاده شده را به دست آورید.
پاسخ
در این مسئله، حجم و غلظت پتاسیم هیدروکسید به ما داده شده است. برای محاسبه غلظت اسید سولفوریک از این اطلاعات برای به دست آوردن تعداد مول پتاسیم هیدروکسید و تبدیل آن به تعداد مول اسید سولفوریک استفاده کرده و سپس با تقسیم آن بر حجم محلول بر حسب لیتر، غلظت اسید به دست میآید.

محاسبه حجم گاز در استوکیومتری در محلول ها
در برخی از مسائل نیاز است تا با استفاده از قانون گاز ایدهآل حجم گاز تولید شده یا مصرف شده را در یک واکنش شیمیایی در فاز محلول به دست آوریم. برای این کار از ضرایب تبدیل زیر بهره میبریم. طبق قانون گاز ایدهآل، یک مول از گاز ایدهآل در فشار استاندارد و دمای اتاق، حجمی برابر با ۲۲٫۴ لیتر دارد.
در اینگونه مسائل با محاسبه تعداد مول گاز در واکنش شیمیایی و قانون گاز ایدهآل میتوانیم حجم گاز را پیدا کنیم. محاسبه تعداد مول گاز تولید شده مشابه قسمتهای قبلی و با استفاده از ضرایب استوکیومتری و حجم، غلظت یا جرم داده شده در صورت سوال است. برای درک بهتر محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
چند لیتر کربن دی اکسید در شرایط استاندارد از واکنش ۱۲۵ میلیلیتر محلول ۲٫۲۵ مولار اسیدکلریدریک طی واکنش زیر تولید میشود؟
پاسخ
برای پاسخ به این سوال ابتدا تعداد مول کربن دی اکسید تولید شده را با استفاده از حجم و مولاریته اسید کلریدریک و طی محاسبات استوکیومتری زیر به دست میآوریم. سپس با استفاده از قانون گاز ایدهآل، آن را به لیتر کربن دی اکسید تبدیل میکنیم.
مثال ۲
اگر ۳۵۵ میلیلیتر گاز هیدروژن در دمای ۲۵ درجه سانتی گراد و فشار استاندارد از واکنش روی با محلول ۳ مولار اسید کلریدریک به دست آمده باشد، حجم اسید کلریدریک مورد نیاز را بر حسب میلیلیتر حساب کنید.
پاسخ
در این سوال، حجم گاز به ما داده شده است و حجم اسید استفاده شده خواسته شده است. برای پاسخ به این سوال با استفاده از حجم گاز و قانون گاز ایدهآل تعداد مول گاز را به دست آورده و با ضرایب استوکیومتری تعداد مول اسید مصرف شده را پیدا میکنیم. سپس با استفاده از غلظت اسید، میتوانیم حجم آن را بیابیم.
محاسبه جرم ماده مجهول
برای محاسبه جرم مجهول در مسائل استوکیومتری در محلول ها، باید مانند قسمتهای قبل ابتدا تعداد مول ماده مجهول را بیابیم. محاسبه تعداد مول مجهول با استفاده از مفاهیم غلظت، جرم، حجم گاز و ضرایب استوکیومتری و با استفاده از نسبت مولی مواد مانند قسمتهای قبل محاسبه میشود.
سپس برای به دست آوردن جرم ماده میتوانیم از مفهوم جرم مولی استفاده کرده و گرم ماده خواسته شده را محاسبه کنیم. برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
طلا با استفاده از محلول آبی سیانید از سنگ معدن آن استخراج میشود که باعث تولید یون میشود. سپس این یون با پودر روی وارد واکنش شده و طلای جامد به دست میآید. معادله این واکنش به شکل زیر است.
چه جرمی از طلا را میتوان از واکنش ۴۰۰ لیتر محلول مولار به دست آورد؟
پاسخ
برای پاسخ به این سوال، ابتدا با استفاده از حجم و غلظت داده شده برای یون نقره سیانید، تعداد مول آن را به دست آورده سپس با استفاده از نسبت مولی و جرم مولی نقره، جرم آن را بر حسب گرم به دست میآوریم.
مثال ۲
چه جرمی از باریم سولفات در نتیجه واکنش ۷۵ میلیلیتر محلول ۰٫۱ مولار باریم کلرید با اسید سولفوریک طی واکنش زیر تولید میشود؟
پاسخ
برای پاسخ به این سوال، مانند قسمت قبل، با استفاده از غلظت و حجم باریم کلرید و نسبت مولی و جرم مولی اسید سولفوریک، جرم آن را بر حسب گرم مییابیم.
مثال ۳
چه جرمی از کلرید نقره در واکنش ۳٫۵ گرم سدیم کلرید با نیترات نقره طی واکنش زیر تولید میشود؟
پاسخ
برای پاسخ به این سوال کافی است با استفاده از جرم مولی سدیم کلرید و کلرید نقره و نسبت مولی آنها، مقدار جرم کلرید نقره را بیابیم. این محاسبات به شکل زیر است.
مسائل تیتراسیون
تیتراسیون یکی از روشهای واکنش مواد مختلف باهم است که توسط آن میتوان غلظت و حجم مواد مورد نیاز برای شرکت در واکنشهای شیمیایی را به دست آورد. در این آزمایش، محلول آماده شده حاوی نمونه در یک ظرف مناسب زیر بورت حاوی محلول استاندارد از قبل تهیه شده قرار می گیرد. سپس با افزودن تدریجی حجم مشخصی از محلول استاندارد، نقطه انجام واکنش با کمک معرف یا تشکیل رسوب مشخص میشود.

بدین ترتیب، در مسائل تیتراسیون، حجم و غلظت یکی از محلولها داده شده و حجم یا غلظت محلول دیگر خواسته میشود. برای درک بهتر اینگونه سوالات در استوکیومتری در محلول ها، به مثالهای زیر دقت کنید.
مثال ۱
چه حجمی از محلول ۰٫۲۵ مولار سدیم هیدروکسید نیاز است تا ۳۵ میلیلیتر محلول ۰٫۱ مولار اسید سولفوریک طی واکنش خنثیسازی زیر خنثی شود؟
پاسخ
با شروع از غلظت و حجم محلول اسید سولفوریک و نسبت استوکیومتری آن با سدیم هیدروکسید، مقدار حجم این ماده را مییابیم.
مثال ۲
یک نمونه ۲۵ میلیلیتری از محلول اسید کلریدریک با محلول ۰٫۱۵ مولار سدیم هیدروکسید تیتر شده است. اگر مقدار باز مصرف شده ۳۳٫۳ میلیلیتر باشد، مقدار مولاریته اسید را محاسبه کنید.
پاسخ
برای یافتن غلظت این ماده، با استفاده از حجم و غلظت سدیم هیدروکسید و حجم اسید کلریدریک مصرف شده میتوانیم غلظت آن را به شکل زیر محاسبه کنیم.
یادگیری محلول سازی با فرادرس
برای درک بهتر مفاهیم استوکیومتری در محلول ها نیاز است ابتدا با مفاهیمی چون روشهای محلولسازی، نمکهای معدنی، اسیدهای آلی، انواع واکنشهای شیمیایی و تهیه محلول بافر آشنا شویم. پیشنهاد میکنیم برای آشنایی بیشتر با الن مفاهیم، به مجموعه فیلم آموزش محلول سازی در آزمایشگاه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه استوکیومتری در محلول ها دسترسی داشته باشید.
مثال استوکیومتری در محلول ها
در این مطلب از مجله فرادرس، روش حل مسائل استوکیومتری در محلول ها را آموختیم. در ادامه برای درک بهتر مسائل استوکیومتری در محلول ها مثالهایی را ارائه کردهایم. با دقت و تمرین این روشهای پاسخ و استفاده صحیح از کسرهای تبدیل استوکیومتری به خوبی میتوانید مسائل استوکیومتری در محلولها را پاسخ دهید.
مثال ۱
منیزیم با اسید کلریدریک واکنش داده و گاز هیدروژن و منیزیم کلرید تولید میکند. چند لیتر از محلول اسید کلریدریک ۰٫۷۵ مولار طبق واکنش زیر با ۱۲٫۲۵ گرم منیزیم واکنش میدهد؟
پاسخ
در این سوال، با استفاده از جرم داده شده، جرم مولی، نسبت مولی و غلظت ماده، حجم آن را پیدا میکنیم. این محاسبات به شکل زیر است.
مثال ۲
واکنش شیمیایی زیر را در نظر بگیرید و به سوالات پاسخ دهید.
- چند گرم یدید سرب (اا) در واکنش با ۲۵ میلیلیتر محلول سدیم یدید ۲ مولار تولید میشود؟
- چند میلیلیتر از محلول نیترات سرب (اا) با ۲۵ میلیلیتر از محلول ۱٫۵ مولار سدیم یدید واکنش میدهد؟
- مقدار غلظت ۲۰ میلیلیتر سدیم یدید که به شکل کامل با ۶۶۰ میلیلیتر محلول سرب (اا) نیترات ۰٫۷۵۰ مولار واکنش میدهد چقدر است؟
پاسخ
برای پاسخ به قسمت اول سوال، با استفاده از غلظت، نسبت استوکیومتری و جرم مولی، جرم یدید سرب را مییابیم. این محاسبات به شکل زیر است.
برای پاسخ به قسمت دوم سوال، با استفاده از نسبت مولی و غلظت های داده شده، مقدار حجم را طبق محاسبات زیر مییابیم.
برای پاسخ به قسمت سوم سوال، با استفاده از حجم، غلظت و نسبت مولی، غلظت ماده طبق محاسبات زیر به دست میآید.

مثال ۳
واکنش شیمیایی زیر را در نظر بگیرید و به پرسشها پاسخ دهید.
- چند گرم آلومینیوم هیدروکسید طی واکنش با ۵۵ میلیلیتر از محلول پتاسیم هیدروکسید ۱٫۵ مولار تولید میشود؟
- چند میلیلیتر از محلول ۰٫۲۵۰ مولار آلومینیوم سولفات با ۱۰ میلیلیتر محلول ۳ مولار پتاسیم هیدروکسید واکنش میدهد؟
- مقدار مولاریته ۴۰ میلیلیتر محلول پتاسیم هیدروکسید که به شکل کامل با ۲۰ میلیلیتر محلول ۰٫۵ مولار آلومینویم سولفات واکنش میدهد چقدر است؟
پاسخ
برای پاسخ به قسمت اول سوال، به شکل زیر عمل میکنیم.
برای پاسخ به قسمت دوم سوال، از نسبت مولی و غلظت بهره میگیریم. محاسبات این بخش به شکل زیر است.
برای پاسخ به قسمت سوم سوال، از غلظت، نسبت مولی و حجم استفاده میکنیم.
مثال ۴
اکسید مس (اا) با اسید کلریدریک واکنش داده و کلرید مس (اا) و آب تولید میکند. معادله این واکنش شیمیایی را نوشته و حجم محلول ۴٫۵ مولاری که با ۳۳ گرم اکسید مس (اا) واکنش میدهد را محاسبه کنید.
پاسخ
برای نوشتن معادله واکنش شیمیایی، نماد شیمیایی مواد را نوشته و آنها را موازنه میکنیم. ۱ مول اکسید مس با ۲ مول اسید کلریدریک واکنش داده و یک مول کلرید مس و یک مول آب تولید میکند.
سپس برای محاسبه حجم محلول، از جرم اکسید مس، جرم مولی آن، نسبتهای مولی و غلظت اسید استفاده میکنیم. این محاسبات به شکل زیر است.
مثال ۵
چه حجمی از گاز نیتروژن دی اکسید در فشار استاندارد و دمای ۲۵ درجه سانتیگراد نیاز است تا ۰٫۱۵ لیتر محلول ۰٫۵ مولار اسید نیتریک طی واکنش زیر تولید شود؟
پاسخ
در این سوال، حجم گاز در شرایط استاندارد خواسته شده است. محاسبات این سوال به شکل زیر است.
مثال ۶
واکنش ۳۴٫۴ میلیلیتر اسید کلریدریک با ۰٫۷۲۰ لیتر گاز هیدروژن در شرایط استاندارد به شکل زیر است.
مقدار غلظت اسید کلریدریک را محاسبه کنید.
پاسخ
در این سوال، حجم گاز در شرایط استاندارد داده شده است. با استفاده از نسبت مولی و حجم محلول، مقدار غلظت آن به شکل زیر محاسبه میشود.

آزمون استوکیومتری در محلول ها
در ادامه برای تمرین بیشتر به سوالات زیر پاسخ دهید. در انتها میتوانید با کلیک روی گزینه دریافت نتیجه آزمون، نمره خود را مشاهده کنید.
چه حجمی از محلول ۰٫۳ مولار اسید سولفوریک برای واکنش کامل با ۱۵۰ میلیلیتر محلول ۰٫۲ مولار پتاسیم هیدروکسید لازم است؟
۱۰۰ میلیلیتر
محاسبات این سوال به شکل زیر است.
چه حجمی از محلول ۰٫۲ مولار اسید فسفریک برای واکنش کامل با ۱۰۰ میلیلیتر محلول ۰٫۱ مولار سدیم هیدروکسید لازم است؟
محاسبات این سوال به شکل زیر است.
چه حجمی از محلول ۰٫۸ مولار اسید کلریدریک لازم است تا مقدار ۴ گرم کلسیم کربنات را طی واکنش زیر در خود حل کند؟
۱۶۰ میلیلیتر
۲۰۰ میلیلیتر
محاسبات این سوال به شکل زیر است.
با توجه به واکنش زیر، چه حجمی از محلول نیترات طلا ۰٫۵ مولار با ۲۲۴ گرم آهن واکنش میدهد؟
محاسبات این سوال به شکل زیر است.
آب دریا حدود ۰.۵۰ مولار محلول NaCl دارد. برای تولید گاز کلر ، یک شرکت آب دریا را تبخیر میکند، NaCl را ذوب میکند و برق از آن عبور میدهد. واکنش به صورت زیر است.
چه مقدار آب دریا برای پر کردن یک تانکر با حجم ۱۱۲۰۰۰۰ لیتر گاز کلر در شرایط استاندارد نیاز است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
اگر ۳۶.۰ میلیلیتر اسید فسفریک () با ۸۰.۰ میلیلیتر محلول ۰.۵۰۰ مولار هیدروکسید سدیم () واکنش دهد، غلظت اسید فسفریک چقدر است؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چه حجمی از محلول ۰٫۱۵۰ مولار اسید نیتریک برای واکنش با ۲۵ میلیلیتر محلول ۰٫۱ مولار باریم هیدروکسید طبق واکنش زیر نیاز است؟
۳۳٫۳۳ میلیلیتر
۱۶٫۶۷ میلیلیتر
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چند گرم کلرید نقره در واکنش زیر با ۵۰ میلیلیتر محلول ۰٫۲ مولار نیترات نقره رسوب میدهد؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چه حجمی از محلول ۰٫۲۵۰ مولار اسید سولفوریک در واکنش زیر با ۱۵۰ میلیلیتر محلول ۳ مولار سدیم هیدروکسید واکنش میدهد؟
۱۸۰ میلیلیتر
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
چند گرم سدیم کلرید در واکنش ۱۰۰ میلیلیتر محلول ۰٫۵ مولار اسید کلریدریک با سدیم هیدروکسید اضافه تولید میشود؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
source
