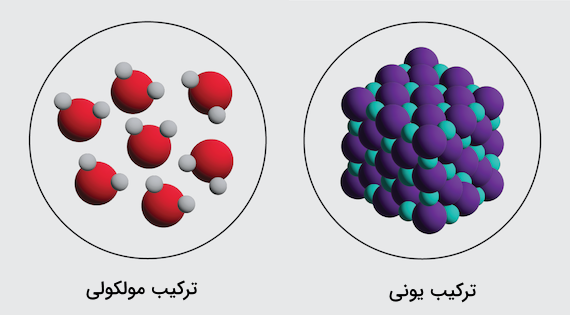
ترکیب مولکولی ترکیبی است که از اتصال مولکولهای مختلف تشکیل شده باشد. مولکولها گروههایی از اتمها هستند که به وسیله پیوندهای شیمیایی به هم متصل شدهاند. این مولکولها خنثی هستند، تعداد پروتون و الکترون برابری دارند و در اغلب مواقع با پیوندهای کووالانسی به هم متصل شدهاند. در این مطلب از مجله فرادرس میآموزیم ترکیب مولکولی چیست و چه تفاوتهایی با ترکیب یونی دارد.
آنچه در این مطلب میآموزید:
-
با مفاهیم ترکیب مولکولی و ترکیب یونی آشنا میشوید.
-
تفاوتهای اساسی ترکیب یونی و ترکیب مولکولی را به همراه مثال میآموزید.
-
با ویژگیها و عناصر تشکیل دهنده ترکیبات مولکولی آشنا میشوید.
-
میآموزید چگونه به وسیله اختلاف الکترونگاتیوی، نوع پیوند را تشخیص دهید.
-
با شیوههای نمایش ترکیبات مولکولی و تفاوت این روشها آشنا میشوید.
-
روشها و تفاوتهای نامگذاری ترکیبات مولکولی و یونی را فرامیگیرید.

در ابتدای این مطلب میآموزیم ترکیب مولکولی چیست و ویژگیهای این ترکیبات را بررسی میکنیم. سپس توضیح میدهیم تفاوت ترکیب مولکولی و ترکیب یونی چیست. در ادامه، روشهای تشخیص ترکیب مولکولی و ترکیب یونی را آموخته و روشهای نمایش این ترکیبات را توضیح میدهیم. در نهایت میآموزیم قوانین نامگذاری ترکیبات مولکولی و یونی چیست. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با ترکیب مولکولی و ویژگیهای آن آشنا شوید.
ترکیب مولکولی چیست؟
ترکیبات مولکولی موادی هستند که از اتصال مولکولهای مختلف به وسیله پیوند کووالانسی تشکیل شدهاند. این ترکیبات از اتصال دو یا تعداد بیشتر عناصر غیرفلزی تشکیل میشوند. در این ترکیبات، پیوندهای کووالانسی مسئول اتصال اتمها به یکدیگر است. در پیوند کووالانسی، الکترون بین اتمها به اشتراک گذاشته میشود.
در پیوندهای کووالانسی، الکترونهای ظرفیت اتمهای مختلف بین اتمها به اشتراک گذاشته میشود تا بتوانند به یک آرایش الکترونی پایدار برسند. در ترکیبات مولکولی اتمهای تشکیلدهنده ترکیب شیمیایی، دارای الکترونگاتیوی برابری هستند و به همین دلیل، نمیتوانند یون تشکیل دهند. به دلیل برابر یا نزدیک بودن قدرت الکترونگاتیوی اتمها در این ترکیبات، همواره پیوند کووالانسی بین این اتمها تشکیل میشود.
مثال ترکیب مولکولی
ترکیبات مولکولی بسیار فراواناند و به ازای هر اتم صدها ترکیب مولکولی مختلف وجود دارد. در ادامه، برخی از ترکیبات مولکولی را به همراه فرمول شیمیایی آنها ارائه کردهایم.
| ترکیب مولکولی | فرمول شیمیایی |
| آب | |
| کربن دی اکسید | |
| متان | |
| کربن مونوکسید | |
| آمونیاک | |
| اکسیژن | |
| نیتروژن | |
| کلر | |
| هیدروژن کلرید | |
| گوگرد دی اکسید | |
| هیدروژن سولفید | |
| استیک اسید | |
| فرمالدهید | |
| اتانول | |
| شکر (ساکارز) | |
| گلوکز | |
| اتان |
یادگیری شیمی نهم با فرادرس
در قسمت قبل آموختیم ترکیب مولکولی چیست. برای درک بهتر مفهوم ترکیب مولکولی، نیاز است با مفاهیمی مانند انواع ماده، اجزای سازنده ترکیبات و پیوندهای کووالانسی آشنا شویم. با شناخت عنصرها و رفتار اتمها، میتوان فهمید چگونه اتمهای نافلز با اشتراکگذاری الکترونها، مولکولهایی پایدار میسازند. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس پایه نهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه ترکیب مولکولی دسترسی داشته باشید.
ویژگی ترکیب مولکولی چیست؟
در قسمت قبل آموختیم ترکیب موکلولی چیست. همانطور که اتم سادهترین واحد دارای خواص شیمیایی یک عنصر است، مولکول نیز سادهترین واحدی است که خواص شیمیایی اصلی یک ترکیب کووالانسی را دارد. بنابراین، از اصطلاح ترکیب مولکولی برای توصیف موادی استفاده میشود که در آنها اتمها با پیوند کووالانسی به هم متصل شدهاند، تا این ترکیبات از ترکیبات یونی متمایز شوند.
در ادامه، برخی از خواص این مواد را بررسی میکنیم.
- نیروهای بینمولکولی در ترکیبات مولکولی ضعیف است.
- در ترکیبات مولکولی، الکترونهای ظرفیت بین اتمها به اشتراک گذاشته میشوند و بین اتمها منتقل نمیشوند.
- بسیاری از ترکیبات مولکولی، به خصوص ترکیباتی که دارای کربن و هیدروژن هستند، به راحتی میسوزند.
- بسیاری از ترکیبات مولکولی به راحتی در آب حل نمیشوند زیرا قطبی نیستند.
- ترکیبات مولکولی الکترونهایی که آزادانه در مولکول حرکت کنند را ندارند. به همین دلیل، این مواد جریان الکتریکی را از خود عبور نمیدهند.
- در ترکیبات مولکولی معمولا پیوند بین مولکولها و اتمها به راحتی شکسته میشود به همین دلیل این مواد معمولا نقطه ذوب پایینی دارند و معمولا در دمای اتاق به فرم مایع یا گاز وجود دارند.
عناصر تشکیل دهنده ترکیب مولکولی
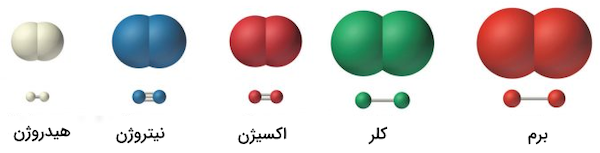
برخی از عناصر در طبیعت به صورت مولکولهای دو اتمی با عناصر یکسان دیده میشوند که در آنها دو اتم از طریق یک یا چند پیوند کووالانسی به یکدیگر متصل هستند. برای مثال میتوان به ترکیبات مولکولی اکسیژن، نیتروژن، هیدروژن و ترکیبات مولکولی هالوژنی مانند کلر و برم اشاره کرد. تصویر زیر نشاندهنده این ترکیبات مولکولی است. به این ترکیبات، ترکیبات مولکولی جورهسته نیز گفته میشود.
در مقابل، تعداد کمی از عناصر به صورت مولکولهای چند اتمی یکسان وجود دارند. برای مثال، فسفر با ساختاری ۴ وجهی از ۴ اتم، و گوگرد به شکل حلقه هشت اتمی وجود دارند. تصویر زیر نشاندهنده این ترکیبات مولکولی است.

باقی ترکیبات مولکولی، از به اشتراک گذاری الکترون بین عناصر مختلف تشکیل شده و ترکیبات شیمیایی را تشکیل میدهند. برای مثال، آب، کربن دی اکسید، آمونیاک و … ترکیبات مولکولی هستند که از عناصر مختلف تشکیل شدهاند. به این ترکیبات، ترکیبات مولکولی ناجورهسته نیز گفته میشود.
تفاوت ترکیب مولکولی و ترکیب یونی
در قسمت قبل آموختیم ترکیب مولکولی چیست و ویژگیهای آن کدام است. ترکیب مولکولی ترکیبی است که از اتصال اتمها با پیوند کووالانسی تشکیل میشود. در مقابل، ترکیب یونی ترکیبی است که از اتصال یونها به وسیله پیوند یونی تشکیل میشود. ترکیبات مولکولی و ترکیبات یونی را میتوان با مقایسه خواص فیزیکی آنها تشخیص داد.
ترکیبات یونی در دمای اتاق، معمولا جامد هستند، دمای ذوب و جوش بسیار بالایی دارند و به عنوان هادیهای الکتریکی عمل میکنند. از طرف دیگر، ترکیبات مولکولی، دمای ذوب و جوش پایینتری دارند و معمولا به خوبی جریان الکتریکی را در حالت جامد یا مایع از خود عبور نمیدهند. این ترکیبات در دمای اتاق معمولا به فرم گاز یا جامد با دمای ذوب پایین هستند.
تفاوت ترکیب مولکولی و ترکیب یونی را در جدول زیر توضیح دادهایم.
| ترکیب مولکولی | ترکیب یونی |
| ترکیبات یونی از اتصال یونها با بار مثبت و منفی به وسیله پیوند یونی تشکیل شدهاند. | ترکیبات مولکولی از اتصال مولکولها تشکیل شدهاند که این مولکولها گروهی از اتمهای متصل به هم هستند. |
| تشکیل از واکنش فلز و نافلز با انتقال الکترون از فلز به نافلز | تشکیل از واکنش نافلزات |
| نیروهای الکترواستاتیکی قوی بین بار مثبت و منفی | نیروهای بین اتمی کووالانسی و نیروهای بینمولکولی ضعیف |
| دمای ذوب و جوش بسیار بالا | دمای ذوب و جوش پایین |
| هادی جریان الکتریکی در حالت جامد مذاب یا محلول | جریان الکتریکی را از خود عبور نمیدهند. |
| آنتالپی تبخیر و ذوب بالا | آنتالپی ذوب و تبخیر پایین |
ترکیب یونی چیست؟
ترکیباتی که از اتصال یونهای مثبت (کاتیون) و منفی (آنیون) به وسیله پیوند یونی تشکیل میشوند، ترکیب یونی نام دارند. در این ترکیبات، یک اتم الکترونهای خود را طی فرآیند انتقال الکترون به اتم دیگر منتقل کرده و پیوند یونی تشکیل میدهد.
هنگامی که یک اتم الکترون خود را از دست میدهد یا یک الکترون اضافی دریافت میکند، به یون تبدیل میشود. یونهای مثبت کاتیون و یونهای منفی، آنیون نام دارند. در پی این انتقال الکترون، یونهای دارای بار مخالف، با نیروی جاذبه الکترواستاتیکی به هم جذب میشوند و پیوند یونی تشکیل میدهند. این پیوند باعث ایجاد ترکیب یونی میشود.
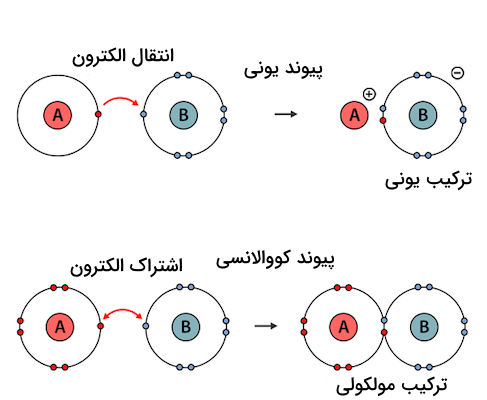
ترکیبات یونی معمولا زمانی تشکیل میشوند که یک فلز با یک نافلز واکنش دهد. فلز الکترون از دست میدهد و به کاتیون تبدیل میشود. در حالی که نافلز الکترون دریافت میکند و به آنیون تبدیل میشود. در نتیجه، این دو یون با بارهای مخالف یکدیگر را جذب کرده و یک ترکیب خنثی به نام ترکیب یونی تشکیل میدهند.
پیشنهاد میکنیم برای درک بهتر یونهای مثبت و منفی و نحوه شکلگیری آنها، فیلم آموزش کاتیون و آنیون فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
برای مثال، به تشکیل پیوند بین فلز سدیم و نافلز کلر دقت کنید. طی این فرآیند، یک الکترون از سدیم به کلر منتقل شده و سدیم به یون سدیم یک بار مثبت و کلر به یون کلر یک بار منفی تبدیل میشوند. با تشکیل پیوند بین این دو یون، ترکیب یونی سدیم کلرید (نمک طعام) به دست میآید.
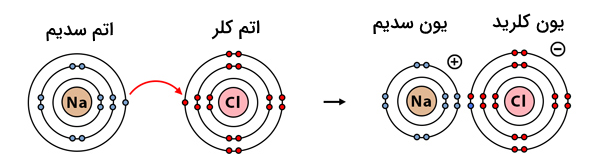
ویژگی ترکیب یونی
ویژگیهای ترکیبات یونی به دلیل ساختار مستحکم اتمهای آنها است. ترکیبات یونی در حالت جامد معمولا ساختاری بلوری دارند و سخت و شکنندهاند. این بدین معنی است که یونها به صورت منظم و تکرارشونده کنار هم قرار میگیرند. ترکیب نهایی از لحاظ بار الکتریکی خنثی است زیرا در این ترکیبات تعداد بارهای مثبت و منفی برابر است. برای مثال، به ساختار بلوری ترکیب یونی سدیم کلرید دقت کنید.

این ترکیبات به دلیل قدرت بالای پیوند یونی، نقطه ذوب و جوش بالایی دارند و در حالت مذاب و محلول جریان الکتریکی را از خود عبور میدهند. در ترکیب یونی در حالت جامد، یونها نمیتوانند آزادانه حرکت کنند و به همین علت جریان الکتریکی عبور نمیکند. ترکیبات یونی در آب و برخی از حلالهای قطبی محلول بوده و در حلالهای ناقطبی مانند بنزن یا کلروفرم حل نمیشوند.
مثال ترکیب یونی
یکی از رایج ترین مثالهای ترکیب یونی، ساختار نمک طعام است که یکی ترکیب یونی تشکیل شده از یونهای سدیم و کلر است. هنگامی که سدیم و کلر برای تشکیل ترکیب سدیم کلرید با هم ترکیب میشوند، یون سدیم یک الکترون به یون کلر داده و هر دو به یک آرایش الکترونی پایدار میرسند. به تصویر زیر دقت کنید.
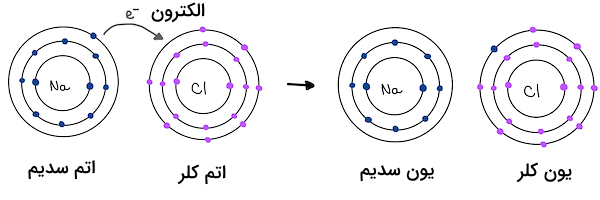
در جدول زیر، برخی از ترکیبات یونی رایج به همراه فرمول شیمیایی آنها معرفی شدهاند.
| ترکیب یونی | فرمول شیمیایی |
| پتاسیم برمید | |
| کلسیم کلرید | |
| اکسید منیزیم | |
| آلومینیوم کلرید | |
| باریم نیترات | |
| آمونیوم فسفات | |
| آهن (ااا) کلرید | |
| اکسید روی (زینک اکسید) | |
| سولفات مس (اا) |
مثال تشخیص ترکیب مولکولی و یونی
مشخص کنید که کدام یک از ترکیبات زیر یونی و کدام مولکولی است؟
پاسخ
برای تشخیص نوع ترکیب، باید بتوانیم نوع فلز، نافلز و یون های چند اتمی را تشخیص دهیم. در ترکیب اول، فلز مس و یون چند اتمی غیر فلزی نیترات وجود دارند. پس این ترکیب قطعا یک ترکیب یونی است.
در ترکیب دوم، یک اتم کربن و چهار اتم کلر وجود دارد که هر دو نافلز هستند پس این ترکیب یک ترکیب مولکولی است. در ترکیب سوم، دو یون چند اتمی آمونیوم و سولفات وجود دارد پس این ترکیب یک ترکیب یونی است.
تشکیل ترکیب مولکولی
در واکنش های شیمیایی ساده، هسته اتمها تغییری نمیکند. الکترونهای اتمها میتوانند به اتمهای دیگر متنقل شده، از اتمهای دیگر جذب شده یا بین اتمهای مختلف به اشتراک گذاشته شوند. انتقال و اشتراک الکترون بین اتمها همان چیزی است که ترکیبات شیمیایی را تشکیل میدهد و اساس انجام واکنشهای شیمیایی است.
زمانی که الکترونها به اشتراک گذاشته میشوند و مولکولها تشکیل میشوند، پیوندهای کووالانسی به وجود میآیند. پیوندهای کووالانسی نیروهای جاذبهای بین هستههای با بار مثبت اتمهای متصل و یک یا چند جفت الکترون هستند که بین آنها قرار دارند. ترکیبات بر اساس نوع پیوندهایی که در آنها وجود دارد به دو دسته یونی یا مولکولی (کووالانسی) طبقهبندی میشوند.
پیوند شیمیایی در ترکیب مولکولی
پیوندهای شیمیایی در ترکیبات شیمیایی معمولا به دو دسته کلی یونی و کووالانسی تقسیم میشوند. ترکیبات یونی از یونهای مثبت و منفی تشکیل شدهاند که به وسیله نیروی الکترواستاتیکی قوی در کنار هم نگه داشته میشوند.
در مقابل ترکیبات مولکولی معمولا از مولکولهایی تشکیل شدهاند که اتمها در آنها با به اشتراک گذاری یک یا چند جفت الکترون به هم متصل شدهاند. در این نوع پیوندها، اتمها توسط جاذبه بین بارهای مثبت هسته اتم و بارهای منفی الکترونهای مشترک در کنار هم قرار میگیرند. به این نوع پیوند بین اتمها و مولکولها، پیوند کووالانسی گفته میشود.
اشتراک الکترون در ترکیبات مولکولی
در قسمتهای قبل توضیح دادیم که ترکیب مولکولی ترکیبی است که از به اشتراک گذاری الکترون بین اتمها به وسیله پیوند کووالانسی تشکیل میشود. اتمها میتوانند با به اشتراک گذاشتن الکترونها به حالت پایدار هشتتایی (در مورد هیدروژن، حالت دوتایی) برسند.
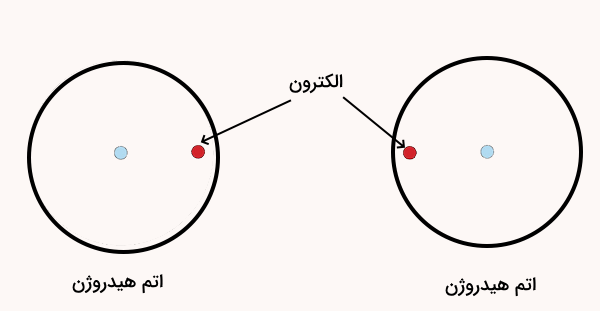
برای مثال، هر اتم هیدروژن تنها یک الکترون در لایه ظرفیت خود دارد و بهتنهایی نمیتواند به حالت پایدار برسد. اما زمانی که دو اتم هیدروژن به یکدیگر نزدیک میشوند و الکترونهای خود را به اشتراک میگذارند، هر دو اتم دارای دو الکترون در لایه ظرفیت میشوند، که معادل پیکربندی پایدار گاز نجیب هلیوم است. این اشتراک الکترونی، که منجر به تشکیل پیوند کووالانسی میشود، اتمها را بهصورت یک مولکول پایدار در کنار هم نگه میدارد.
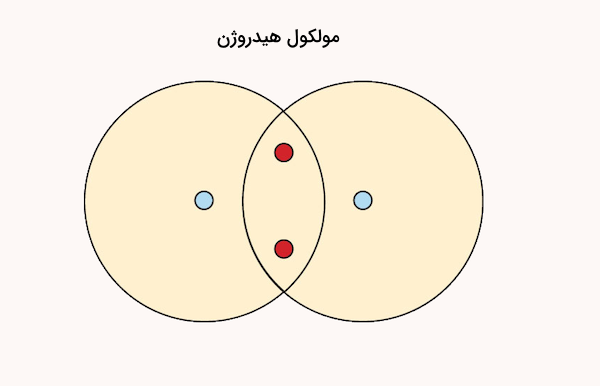
نمایش پیوند کووالانسی
شیمیدانها اغلب از نمودار نقطهای لوویس برای نمایش پیوند کووالانسی در مواد مولکولی استفاده میکنند. بهعنوان مثال، دو اتم جداگانه هیدروژن در ساختار لوویس بهصورت دو نقطه مجزا نشان داده میشوند. زمانی که این دو اتم هیدروژن الکترونهای خود را به اشتراک میگذارند، ساختار لوویس آنها دو نقطه مشترک بینشان را نشان میدهد.

برای سادهسازی بیشتر، از یک خط برای نمایش پیوند کووالانسی استفاده میشود. بنابراین، مولکول هیدروژن با یک خط بین دو نماد H نوشته میشود. این خط، که پیوند یگانه نام دارد، نمایانگر یک جفت الکترون پیوندی است.
رسم ساختار لوویس
برای نمایش ترکیبات کووالانسی و پیوند کووالانسی، از رسم ساختار لوییس استفاده میشود. در رسم این ساختار، الکترونهای ظرفیت عناصر به صورت جفت نقطههایی در ۴ طرف نماد شیمیایی آنها نمایش داده میشوند. در نمایش پیوند کووالانسی این نقطهها که بین اتمها به اشتراک گذاشته میشوند، معمولا با خطوطی که نشانگر پیوند کووالانسی است نمایش داده میشوند.
برای مثال به ساختار لوییس ترکیب مولکولی فلوئور دقت کنید.
انوع پیوند کووالانسی
در قسمت قبل آموختیم که ترکیبات مولکولی از به اشتراک گذاری الکترونها بین اتمها و تشکیل پیوند کووالانسی تشکیل میشود. پیوند کووالانسی میتواند به وسیله نیروهای جاذبه و دافعه با شدتهای متفاوت و فرآیندهای مختلفی تشکیل شود. بدین ترتیب، پیوند کووالانسی میتواند انواع پیوند کووالانسی قطبی، پیوند کووالانسی ناقطبی و پیوند کووالانسی کوئوردیناسی را داشته باشد.
همچنین، این پیوندها میتواند از نوع پیوند یگانه، دوگانه یا سهگانه باشد. در ادامه هریک از این انواع پیوند را توضیح می دهیم.
پیوند کووالانسی غیر قطبی
پیوند کووالانسی غیرقطبی یا ناقطبی پیوندی است که الکترون در آن به اندازه تقریبا برابری بین هسته اتمها به اشتراک گذاشته میشود. در برخی از مولکولها، اتمها یکسان هستند یا مقدار الکترونگاتیوی این اتمها به هم نزدیک است. این بدین معنی است که اشتراک الکترون بین این اتمها با قدرت برابری انجام میشود. برای مثال، به دانسیته الکترونی دو اتم هیدروژن دقت کنید.
ساختار لوویس برای دو اتم هیدروژنی که با هم یک پیوند کووالانسی تشکیل دادهاند به شکل بالا نمایش داده میشود. این پیوند یک پیوند کووالانسی غیر قطبی است که در آن دو الکترون به مقدار برابری بین دو اتم به اشتراک گذاتشه شدهاند. برخی از ترکیبات مولکولی غیرقطبی در جدول زیر معرفی شدهاند.
| نام ترکیب مولکولی غیرقطبی | فرمول شیمیایی |
| هیدروژن | |
| نیتروژن | |
| اکسیژن | |
| کلر | |
| کربن دی اکسید | |
| متان | |
| اتان | |
| بنزن | |
| کربن تترا کلرید |
پیشنهاد میکنیم برای یادگیری بیشتر در مورد پیوند قطبی، غیر قطبی و یونی و قدرت آنها، مطلب مقایسه قدرت پیوندهای شیمیایی مجله فرادرس را مطالعه کنید.
پیوند کووالانسی قطبی
پیوند کووالانسی قطبی پیوندی است که در آن اشتراک الکترون به شکل برابر انجام نمیشود و الکترونها توسط هسته یکی از اتمها بیش از دیگری جذب میشوند. در حالی که پیوند کووالانسی به معنای اشتراکگذاری الکترونهاست الکترونها معمولا به طور مساوی بین دو اتم پیوند دهنده تقسیم نمیشود. در پیوندهایی که بین دو عنصر متفاوت تشکیل میشوند، معمولا یک اتم الکترونها را قویتر جذب میکند.

این تفاوت باعث ایجاد بارهای جزئی میشود. بار منفی جزئی در نزدیکی اتمی که الکترونها را بیشتر جذب میکند و بار مثبت جزئی در سوی دیگر پیوند ایجاد میشود. بدین ترتیب یک دو قطبی در دو سر پیوند ایجاد شده و پیوند کووالانسی قطبی نامیده میشود. برای مثال، به دانسیته بار الکترونی در پیوند بین اتمهای هیدروژن و فلوئور دقت کنید.
معمولا هر پیوند کووالانسی بین اتمهای عناصر مختلف پیوندی قطبی است، اما درجه قطبیت آن بسیار متفاوت است. برخی از این پیوندها کمترین میزان قطبیت را دارند و برخی دیگر بسیار قطبی هستند. پیوند یونی را میتوان شدیدترین نوع قطبیت دانست که در آن الکترونها کاملا منتقل میشوند و اشتراکگذاری رخ نمیدهد.
برای سنجش میزان قطبیت نسبی یک پیوند کووالانسی، شیمیدانها از الکترونگاتیویتی استفاده میکنند که معیاری نسبی از قدرت جذب الکترون توسط یک اتم هنگام تشکیل پیوند کووالانسی است.
چگونه پیوند کووالانسی را تشخیص دهیم؟
در قسمتهای قبل آموختیم پیوندهای شیمیایی ترکیب مولکولی چیست. ترکیب مولکولی از پیوندهای کووالانسی و ترکیب یونی از پیوند یونی تشکیل میشود. تشخیص این نوع پیوندها میتواند به ما در درک نوع ماده کمک کند. ترکیبات یونی عمدتا از ترکیب یک فلز و یک نافلز ساخته شدهاند. در حالیکه ترکیبات نافلز و نافلز یا شبهفلز و نافلز بیشتر دارای ماهیت کووالانسی هستند.
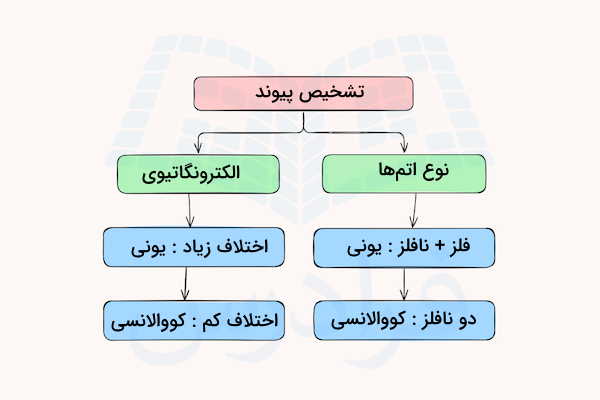
این تفاوت، یک روش اولیه برای تشخیص نوع پیوند در ترکیبات به شمار میرود. روش دیگر تشخیص نوع پیوند بین اتمها، استفاده از اختلاف الکترونگاتیوی آنهاست. در قسمت بعد این روش را توضیح دادهایم.
تشخیص نوع ترکیب و الکترونگاتیوی
الکترونگاتیوی یک اتم به توانایی آن اتم برای جذب جفت الکترون پیوندی گفته میشود. مقیاسهای عددی مختلفی برای اندازهگیری الکترونگاتیویی وجود دارد که یکی از معروفترین آنها مقیاس پاولینگ است. قطبیت یک پیوند کووالانسی را میتوان با محاسبه اختلاف الکترونگاتیویی دو اتم تشکیلدهنده آن پیوند سنجید. مقادیر الکترونگاتیوی عناصر معمولا در جدول تناوبی عناصر ارائه میشود.
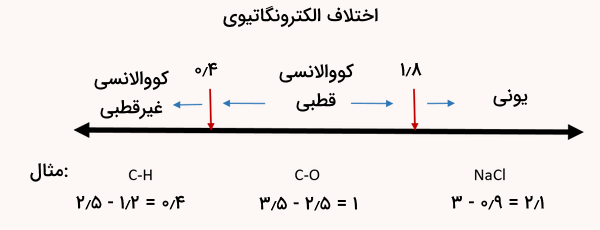
برای تشخیص نوع ترکیب، باید اختلاف الکترونگاتیوی بین عناصر را بررسی کنیم. اگر مقدار عددی این اختلاف بیش از ۱٫۸ باشد، احتمال زیادی وجود دارد که ترکیب یونی باشد و در غیر این صورت، ترکیب کووالانسی است. الکترونگاتیوی عناصر در هر دوره جدول تناوبی از چپ به راست افزایش یافته و در هر گروه جدول از بالا به پایین کاهش مییابد.
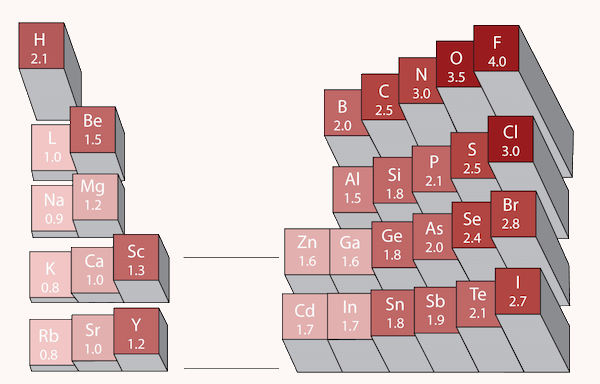
برای مثال، فلزات قلیایی و فلزات قلیایی خاکی الکترونگاتیوی کمی دارند و نافلزاتی مانند فلوئور الکترونگاتیوی بسیار زیادی دارند. به همین دلیل، وقتی یک فلز با یک نافلز واکنش میدهد، الکترونها به راحتی منتقل شده و ترکیب یونی تشکیل میشود. برای درک بهتر این روش تشخیص، به مثال زیر دقت کنید.
مثال
با استفاده از مقایسه الکترونگاتیوی عناصر، تشخیص دهید ترکیبات و از نوع ترکیب یونی هستند یا ترکیب مولکولی؟
پاسخ
برای تشخیص نوع ترکیبات، ابتدا اختلاف الکترونگاتیوی آنها را با استفاده از جدول تناوبی به دست میآوریم. مقدار الکترونگاتیوی آلومینیوم برابر ۱٫۶۱ و مقدار الکترونگاتیوی هیدروژن برابر با ۲٫۲ است. اختلاف الکترونگاتیوی این عناصر برابر با ۰٫۵۹ خواهد بود. از آنجا که این اختلاف کمتر از عدد ۱٫۸ است، این تریب یک ترکیب مولکولی است.
در مورد ترکیب بعدی، ید دارای الکترونگاتیوی برابر با ۲٫۶۶ و فلوئور دارای الکترونگاتیوی ۳٫۹۸ است. بنابراین، اختلاف الکترونگاتیوی بین این دو عنصر ۱٫۳۲ خواهد بود. از آنجایی که این مقدار بیشتر از ۰٫۴ و کمتر از ۱٫۸ است، میتوان گفت که یک ترکیب مولکولی قطبی است.
نمایش ترکیبات مولکولی
ترکیبات مولکولی را میتوان به شیوههای مختلفی نمایش داد. استفاده از فرمول شیمیایی، ساختار لوویس، مدل گلوله و میله، مدل فضا پرکن و فرمول ساختاری این روشهای نمایش هستند. در ادامه هر یک از این روش های نمایش را توضیح میدهیم.
فرمول شیمیایی
یکی از روشهای نمایش این ترکیبات، استفاده از فرمول شیمیایی است. فرمول شیمیایی مواد که یکی از رایجترین شیوه های نمایش آنها است، عناصر به کار رفته در آنها و تعداد این عناصر را مشخص میکند. برای مثال، فرمول شیمیایی ماده آب، به صورت است.
این بدین معنی است که آب از دو اتم هیدروژن و یک اتم اکسیژن تشکیل میشود. فرمول شیمیایی سه ترکیب دیگر در را در جدول زیر توضیح دادهایم..
| ترکیب مولکولی | فرمول شیمیایی |
| گلوکز | |
| بوتان | |
| اتانول |
فرمول شیمیایی ترکیبات مولکولی آلی و معدنی
ترکیبات کووالانسی دارای کربن و هیدروژن معمولا ترکیبات آلی نامیده میشوند و ترتیب نوشتن فرمول شیمیایی آنها با کربن، سپس هیدروژن و بعد سایر عناصر بهترتیب حروف الفباست. برای مثال، فرمول شیمیایی ماده آلی متانول به شکل زیر نوشته میشود.
در مقابل، ترکیباتی که عمدتا شامل عناصری بهجز کربن و هیدروژن هستند، ترکیبات معدنی نام دارند و ترتیب نوشتن آنها معمولا با عنصری که در جدول تناوبی سمت چپتر قرار دارد آغاز میشود. برای مثال، فرمول شیمیایی ماده کربن دی اکسید به شکل زیر نوشته میشود.
ساختار لوویس
ساختار لوویس اتمهای مولکولها، الکترونهای ظرفیت و الکترونهای موجود در پیوند کووالانسی بین آنها را مشخص میکند. در این شیوه نمایش از نقطههایی برای نمایش الکترونها و خطهایی برای نمایش پیوندها استفاده می شود. برای مثال، ساختار لوویس ترکیب مولکولی آب به شکل زیر است.
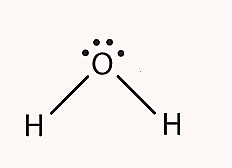
در این ساختار، برای نمایش پیوند شیمیایی از خط و برای نمایش الکترونهای غیر پیوندی از نقطه استفاده میشود.
نمایش گلوله و میله
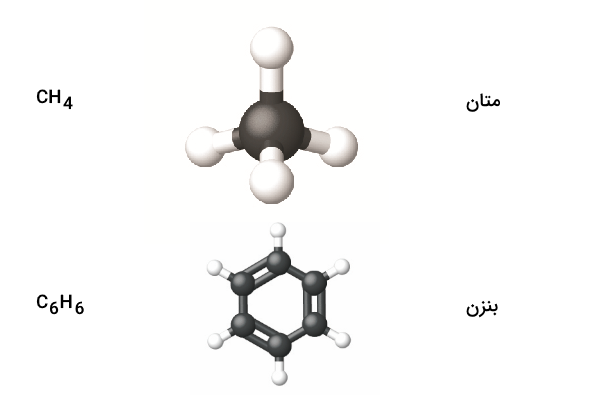
این روش نمایش، یک ساختار سه بعدی از مولکولها را نمایش میدهد. در این مدل، اتمها با کره و پیوند بین آنها با خطوطی بین آنها نمایش داده میشود. این روش نمایش به ما کمک میکند تا تصور کنیم شکل تقریبی سه بعدی ترکیب مولکولی چیست. نمایش گلوله و میله متان و بنزن در ادامه به همراه فرمول شیمیایی آنها در ادامه ارائه شده است.
مدل فضا پرکن
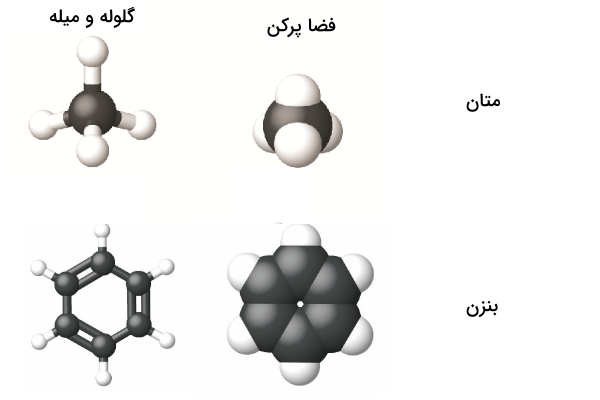
این روش نمایش مشابه مدل گلوله و میله است با این تفاوت که پیوندها در این مدل نمایش داده نمیشوند. این روش نمایش، اندازه نسبی اتمها و شکل مولکولها را با استفاده از موقعیت نسبی عناصر نشان میدهد. مدل فضا پرکن متان و بنزن در ادامه ارائه شده است.
فرمول ساختاری
فرمول ساختاری، فرمول سادهسازی شده یک مولکول است. در فرمول ساختاری، اتمها با استفاده از نماد شیمیایی آنها و پیوند بین آنها با استفاده از خطوط نمایش داده میشود. با این مدل نمایش، اتصال اتمها به هم نمایش داده میشود. در ادامه، فرمول ساختاری چند مولکول به همراه فرمول شیمیایی آنها را میآموزیم.
| نلم ترکیب مولکولی | فرمول شیمیایی | فرمول ساختاری |
| آب | ||
| آمونیاک | ||
| متان | ||
| کربن دی اکسید | ||
| اتانول | ||
| هیدروژن پراکسید | ||
| استیک اسید |
یادگیری شیمی دبیرستان با فرادرس
در این مطلب آموختیم تفاوت ترکیب یونی و ترکیب مولکولی چیست. برای درک بهتر مفهوم ترکیب مولکولی، نیاز است با مفاهیمی مانند آرایش الکترونی، ساختار اتم و اصل آفبا آشنا شویم. این مفاهیم به ما کمک میکنند بفهمیم اتمها چگونه با اشتراکگذاری الکترون پیوند میسازند و مولکولهای پایدار تشکیل میدهند. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه تفاوت ترکیب یونی و ترکیب مولکولی دسترسی داشته باشید.
نامگذاری ترکیبات مولکولی و یونی
در قسمتهای قبل اموختیم ترکیب مولکولی چیست. نامگذاری ترکیبات شیمیایی مختلف یکی از مهمترین مباحث در شناخت ترکیبات شیمیایی است. با نامگذاری صحیح ترکیبات میتوان به ساختار شیمیایی آنها پی برد.
برای نامگذاری ترکیبات مولکولی و یونی مراحل مشخصی وجود دارد که در ادامه توضیح داده میشود.
نامگذاری ترکیبات مولکولی
فرآیند نامگذاری ترکیبات مولکولی (که معمولا از دو نافلز تشکیل شدهاند) شامل استفاده از پیشوندهای عددی است. مراحل زیر در نامگذاری این ترکیبات رعایت میشود:
- پیشوند عددی متناسب با تعداد اتمهای عنصر اول نوشته میشود. (به جز زمانی که فقط یک اتم از عنصر اول وجود دارد، که در این صورت پیشوند «مونو» (mono) حذف میشود.)
- سپس نام کامل عنصر اول نوشته میشود.
- پیشوند عددی متناسب با تعداد اتمهای عنصر دوم ذکر میگردد.
- در پایان، ریشه نام عنصر دوم آورده شده و پسوند آن به «-ید» (-ide) تغییر مییابد.
برای درک بهتر این مراحل، به مثالهای زیر دقت کنید.
مثال ۱
نام ترکیب مولکولی چیست؟
پاسخ
تعداد اتم نیتروژن در این ترکیب ۲ عدد و تعداد اتم اکسیژن در آن ۴ عدد است. پیشوند عددی مناسب برای ۲ عبارت «دی» و برای عدد ۴ عبارت «تترا» است. پس نام این ترکیب مولاکولی، دی نیتروژن تتراکسید خواهد بود.
مثال ۲
نام ترکیب مولکولی چیست؟
پاسخ
در این ترکیب ۲ اتم برم (دی برم) و ۷ اتم اکسیژن (هپتا اکسید) وجود دارد. پس نام این ترکیب دی برم هپتوکسید خواهد بود.
نامگذاری ترکیبات یونی
در قسمت قبل آموختیم روش نامگذاری ترکیب مولکولی چیست. برای نامگذاری ترکیبات یونی، باید اصول مشخصی را دنبال کنیم:
- ابتدا همیشه کاتیون (یون مثبت) را نام میبریم، سپس آنیون (یون منفی) را ذکر میکنیم.
- در مواردی که کاتیون دارای چند حالت اکسیداسیون باشد، باید بار آن را با استفاده از عدد رومی درون پرانتز مشخص کنیم. این قاعده برای فلزاتی مثل آهن (Fe)، مس (Cu)، و قلع (Sn) کاربرد دارد.
- با این حال، برای فلزاتی مانند عناصر گروه اول و دوم، و همچنین آلومینیوم ()، روی ()، نقره () و کادمیوم ()، نیازی به مشخصکردن بار یون نیست.
- هنگام نامگذاری آنیون، قسمت ابتدایی نام عنصر حفظ میشود ولی به جای پایان اصلی آن، پسوند «-ید» (-ide) به کار میرود.
برای درک بهتر این سیستم نامگذاری، به مثالهای زیر دقت کنید.
مثال ۱
نام ترکییب یونی چیست؟
پاسخ
از آنجا که در این ترکیب سدیم کاتیون و اکسیژن آنیون است، ابتدا نام سدیم و سپس نام اکسیژن با پسوند «-ید» نوشته میشود. سدیم در این ترکیب از فلزات قلیایی است و نیازی به مشخص کردن مقدار بار یون آن نیست. در نتیجه، نام این ترکیب «سدیم اکسید» خواهد بود.
مثال ۲
نام ترکیب یونی چیست؟
پاسخ
در این ترکیب، منیزیم با ۲ بار مثبت، کاتیون و کلر با ۱ بار منفی آنیون است. منیزیم از فلزات گروه قلیایی خاکی است و نیازی به مشخص کردن مقدار بار آن نیست. در نتیجه، نام این ترکیب «منیزیم کلرید» خواهد بود.
مثال ۳
نام ترکیب یونی چیست؟
پاسخ
در این ترکیب، فلز آهن با ۳ بار مثبت کاتیون و اکسیژن با دو بار منفی آنیون است. از آن جا که فلز آهن میتواند ۲ حالت اکسایش ۲ و ۳ را داشته باشد، حالت اکسایش آن در این ترکیب باید نوشته شود. بدین ترتیب، نام این ترکیب «آهن (ااا) اکسید» خواهد بود.
نکته: در برخی از متون شیمی به آهن با حالت اکسایش ۲ «فرو» و به آهن با حالت اکسایش ۳، «فریک» گفته میشود. بر این اساس، به این ترکیب «فریک اکسید» (Ferric Oxide) نیز گفته میشود.
نامگذاری ترکیبات یونی چند اتمی
در قسمت قبل آموختیم تفاوت نامگذاری ترکیب یونی و ترکیب مولکولی چیست. همه ترکیبات به سادگی قابل نامگذاری نیستند. زمانی که با یونهای چنداتمی روبهرو میشویم، شیوه نامگذاری تا حدی متفاوت خواهد بود. بیشتر یونهای چنداتمی رایج، دارای بار منفی هستند (آنیون)، با این حال، برخی استثناها نیز وجود دارد. برای مثال، یون آمونیوم با فرمول شیمیایی و یون جیوه (ا) با فرمول شیمیایی بار مثبت دارند.
نکته مهم در مورد یونهای چنداتمی این است که هنگام حضور در یک ترکیب، نام آنها بدون هیچ تغییری حفظ میشود. بنابراین برای نامگذاری صحیح ترکیباتی که شامل این نوع یونها هستند، بهترین راه، حفظ کردن نام آنها است. یونهای چنداتمی از پیوند میان دو یا چند اتم به وجود میآیند. در ادامه این مطلب از مجله فرادرس به چند نمونه از متداولترین یونهای چنداتمی را میآموزیم.
| یون چند اتمی | فرمول شیمیایی |
| آمونیوم | |
| استات | |
| بی کربنات | |
| کلرات | |
| هیدروکسید | |
| کربنات | |
| کرومات | |
| سولفات | |
| فسفات |
برای درک بهتر روش نامگذاری ترکیبات یونی چند اتمی، به مثالهای زیر توجه کنید.
مثال ۱
نام ترکیب یونی چیست؟
پاسخ
دقت کنید که این ترکیب یک ترکیب یونی چند اتمی است. پس ابتدا باید یون چند اتمی موجود در این ترکیب را بیابیم. این ترکیب از یک یون کربنات و یک یون کبالت ۲ بار مثبت تشکیل میشود. (ترکیب در حالت کلی خنثی است و بار کاتیون و آنیون برابر است.)
کبالت یک فلز چند ظرفیتی است و باید حالت اکسایش آن را در نامگذاری مشخص کنیم. پس نام این ترکیب «کبالت (اا) کربنات» خواهد بود.
مثال ۲
فرمول شیمیایی ترکیب یونی منیزیم سولفات را بنویسید.
پاسخ
منیزیم سولفات یک تریب یونی چند اتمی است که از اتصال یون منیزیم و یون سولفات تشکیل میشود. فرمول شیمیایی یون سولفات و فرمول شیمیایی یون منیزیم است. پس فرمول شیمیایی این ترکیب خواهد بود. دقت کنید که بار کاتیون و آنیون برابر است و یکدیگر را خنثی می کنند و نیازی نیست تعداد آنها را در فرمول شیمیایی بنویسیم.
source
