گرمای واکنش یا آنتالپی واکنش، میزان انرژی است که در جریان یک واکنش شیمیایی آزاد یا جذب میشود. این مقدار که آن را با عبارت نمایش میدهند، نشاندهنده تغییر انرژی مواد هنگام تبدیل از حالت واکنشدهنده به فرآورده است. واکنشها ممکن است گرمازا یا گرماگیر باشند. این ویژگی یکی از پارامترهای مهم ترمودینامیکی است و معمولا بهصورت کیلوژول بر مول بیان میشود. در این مطلب از مجله فرادرس میآموزیم گرمای واکنش چیست و روش محاسبه آن کدام است.
آنچه در این مطلب میآموزید:
-
میآموزید مفهوم گرمای واکنش و فرمول محاسبه آن چیست.
-
تفاوت واکنش گرماده و گرماگیر و رابطه آنها با گرمای واکنش را درک میکنید.
-
روش محاسبه گرمای واکنش به وسیله کالریمتری با گرماسنج را میآموزید.
-
میتوانید گرمای واکنشهای پیچیده را با قانون هس به دست آورید.
-
نقش آنتالپی پیوند و آنتالپی تشکیل مواد را در گرمای واکنش میآموزید.
-
با کاربرد گرمای واکنش در صنایع مختلف آشنا میشوید.

در ابتدای این مطلب میآموزیم گرمای واکنش چیست و فرمول محاسبه آن کدام است. سپس به بررسی واکنشهای گرماده و گرماگیر پرداخته و روشهای محاسبه گرمای واکنش را میآموزیم. پس از آن به بررسی عوامل موثر بر گرمای واکنش پرداخته و انواع مختلف گرمای واکنش را توضیح میدهیم. در نهایت، کاربرد گرمای واکنش را در صنایع مختلف بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با مفهوم گرمای واکنش آشنا شوید.
گرمای واکنش چیست؟
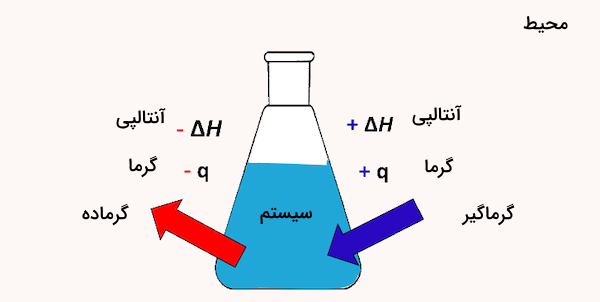
گرمای واکنش، میزان گرمایی است که باید در طول یک واکنش شیمیایی به سیستم افزوده یا از آن خارج شود تا واکنشدهندهها به فرآوردهها تبدیل شوند. اگر فشار در ظرف حاوی مواد واکنشدهنده ثابت نگه داشته شود، گرمای اندازهگیریشده در واقع نشاندهنده تغییر در یک کمیت ترمودینامیکی به نام آنتالپی (یا محتوای گرمایی) نیز خواهد بود.
یعنی انرژی گرمایی برابر با اختلاف بین آنتالپی مواد موجود در پایان واکنش و آنتالپی مواد موجود در آغاز آن است.
در نتیجه گرمای واکنش در فشار ثابت را آنتالپی واکنش نیز مینامند و با نماد نمایش میدهند. اگر گرمای واکنش عددی مثبت باشد واکنش گرماگیر است. اگر این عدد منفی باشد واکنش گرمازا خواهد بود. اطلاع از گرمای واکنش برای طراحی ایمن و موفقیتآمیز فرآیندها، بهویژه هنگام انتقال از مقیاس آزمایشگاهی به مقیاس صنعتی، اهمیت زیادی دارد.
فرمول گرمای واکنش
در قسمت قبل آموختیم گرمای واکنش چیست. مقدار گرمای یک واکنش شیمیایی که آن را با علامت نشان میدهند، مقدار تفاوت انرژی واکنشدهندهها و فرآوردهها را مشخص میکند. به این انرژی، آنتالپی واکنش گفته میشود. فرمول محاسبه آنتالپی واکنش به شکل زیر است.
واکنش = فرآوردهها – واکنشدهندهها
فرم ریاضی نمایش این فرمول به شکل زیر است.
در این فرمول Products نشاندهنده فرآوردهها و Reactants نشاندهنده واکنشدهندهها هستند.
- مقدار مثبت نشاندهنده این است که فرآوردهها انرژی بیشتری دارند و واکنش گرماگیر است.
- مقدار منفی نشاندهنده این است که واکنشدهندهها انرژی بیشتری دارند و واکنش گرماده است.
رابطه گرمای واکنش و گرمای مبادله شده
وقتی یک فرآیند در فشار ثابت انجام میشود، مقدار گرمای آزادشده یا جذبشده برابر با تغییر آنتالپی است. آنتالپی (H) برابر است با مجموع انرژی درونی (U) و حاصلضرب فشار در حجم (PV) که با رابطه زیر نشان داده میشود:
وقتی فرآیند در فشار ثابت انجام میشود، گرمای مبادلهشده (چه آزاد و چه جذب شود) برابر با تغییر آنتالپی خواهد بود. آنتالپی یک تابع حالت است، یعنی فقط به شرایط حالت سیستم بستگی دارد، مثل دما (T)، فشار (P) و انرژی درونی (U). معمولا آنتالپی بهصورت تغییر آن بین دو حالت اولیه و نهایی بیان میشود و آن را با نماد نشان میدهند.
همچنین، در فشار ثابت، مقدار گرمای مبادلهشده (q) در فرآیند برابر با تغییر آنتالپی است که با رابطه زیر تعریف میشود:
آنتالپی استاندارد
گرمای واکنش را میتوان به شکل آنتالپی استاندراد و با علامت نمایش داد. این آنتالپی که با نام آنتالپی استاندارد شناخته میشود، مقدار آنتالپی یک ماده در شرایط استاندارد است. شرایط استاندارد شرایطی است که فشار برابر با ۱ اتمسفر و دما ثابت (۲۵ درجه سانتیگراد) باشد.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر این که گرمای واکنش چیست، نیاز است ابتدا با مفاهیمی چون ترموشیمی، ظرفیت گرمایی، فرآیندهای گرماده و گرماگیر و … آشنا شوید. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده و کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه گرمای واکنش دسترسی داشته باشید.
واکنش گرماده و گرماگیر
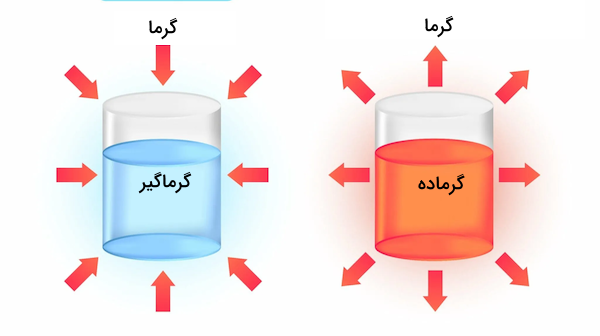
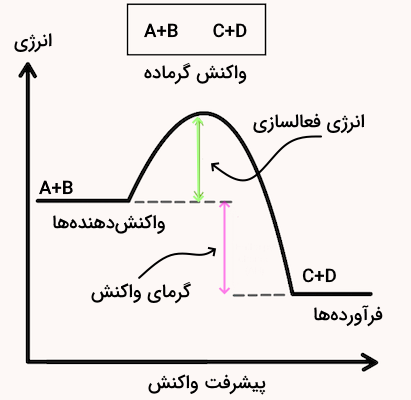
در بررسی انرژی گرمایی واکنشهای شیمیایی ممکن است ۲ حالت پیش بیاید. یا واکنش طی انجام شدن انرژی گرمایی را دریافت میکند یا اینکه گرما به عنوان یکی از فرآوردههای واکنش طی واکنش آزاد میشود. بدین ترتیب واکنش میتواند گرماگیر یا گرماده باشد.
- واکنش گرماگیر: واکنش است که برای انجام شدن به دریافت انرژی نیاز دارد و مقدار تغییرات آنتالپی برای این واکنشها مثبت است.
- واکنش گرماده: واکنشی است که طی انجام شدن گرما آزاد کرده و مقدار تغییرات آنتالپی برای این واکنشها منفی است.
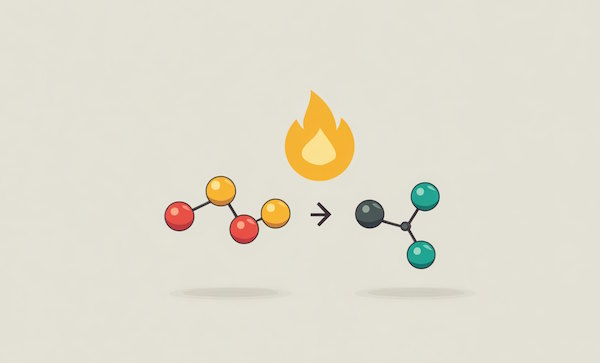
طی هر واکنش شیمیایی، پیوند بین مواد واکنشدهنده شکسته شده و پیوندهای جدیدی برای تولید مواد فرآورده تشکیل میشود. تشکیل پیوندهای شیمیایی گرما را آزاد کرده و آنتالپی آن منفی است و شکستن پیوندهای شیمیایی نیاز به انرژی دارد و گرما میگیرد و آنتالپی آن مثبت است.
در واکنشهای گرماگیر، مقدار انرژی مواد واکنشدهنده (شکستن پیوند) کمتر از انرژی مواد فرآورده (تشکیل پیوند) است. به همین دلیل، واکنش برای انجام گرفتن نیاز به دریافت انرژی دارد. در مقابل، در واکنشهای گرماده، انرژی مواد واکنشدهنده (شکستن پیوند) بیشتر از انرژی مواد فرآورده (تشکیل پیوند) است به همین دلیل واکنش طی تبدیل واکنشدهندهها به فرآوردهها انرژی آزاد میکند.
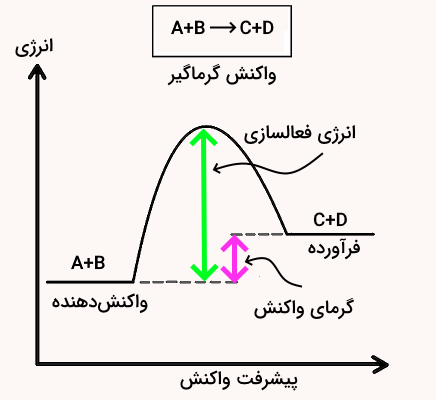
شکل بالا نمودار محتوای انرژی واکنشهای گرماگیر و شکل زیر نمودار محتوای انرژی واکنش گرماده است.
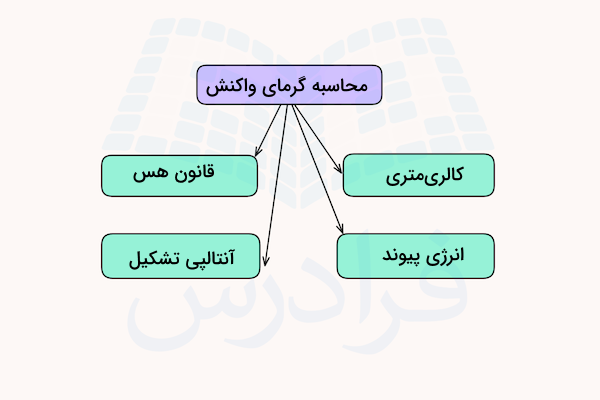
روش های محاسبه گرمای واکنش
در قسمت قبل آموختیم فرمول محاسبه گرمای واکنش چیست. گرمای واکنش را میتوان با استفاده از گرمای تشکیل استاندارد مواد واکنشدهنده محاسبه کرد، اما معمولا این مقدار از طریق اندازهگیری میزان گرمای تولیدشده در طول زمان، با استفاده از دستگاه کالریسنج واکنش مانند کالریسنج جریان گرما (لیوانی یا بمبی) به دست میآید.
گرمای احتراق استاندارد نیز بهصورت مقدار گرمایی تعریف میشود که در دمای ۲۵ درجه سانتیگراد و فشار یک اتمسفر، هنگام سوختن یک مول از ماده در حضور اکسیژن اضافی آزاد میشود. روش محاسبه گرمای واکنش از روی مقادیر اندازهگیریشده گرمای تشکیل و احتراق بر پایه قانونی به نام قانون هس انجام میشود. در ادامه هر یک از این روشهای محاسبه را توضیح میدهیم.
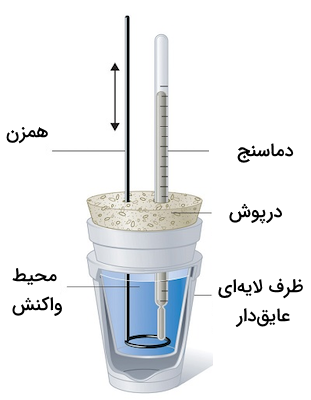
محاسبه گرمای واکنش به صورت عملی
آنتالپی واکنش را میتوان بهصورت تجربی با استفاده از دستگاه کالریسنج اندازهگیری کرد. کالریسنج یک سیستم ایزوله است که در آن فشار ثابت باقی میماند. گرماسنج وسیلهای است که مقدار گرما را در یک فرآیند فیزیکی یا شیمیایی اندازهگیری میکند. بنابراین، تغییر آنتالپی را به روش عملی میتوان با رابطه زیر محاسبه کرد:
در فرمول بالا، m جرم ماده، c ظرفیت گرمایی آن و برابر با تغییرات دما است که از تفریق مقدار نهایی دما و مقدار اولیه آن به دست میآید. اندازهگیری عملی گرمای واکنش با استفاده از معادله بالا و تغییرات دمای اندازهگیری شده، به وسیله گرماسنج بمبی و لیوانی انجام میشود.
گرماسنج لیوانی
سادهترین نوع کالریسنج، دستگاهی با فشار ثابت است. نسخه سادهای از این دستگاه که در آزمایشگاههای شیمی عمومی استفاده میشود، به کالریسنج لیوانی (فنجان قهوهای) معروف است. کالریسنجهای تجاری نیز بر پایه همین اصل کار میکنند، اما با حجم کمتری از محلول قابل استفاده هستند، عایق حرارتی بهتری دارند و میتوانند تغییر دماهایی در حد چند میلیونیم درجه سانتیگراد را هم تشخیص دهند.
گرماسنج بمبی
میتوان کالریسنجی در حجم ثابت را نیز با استفاده از کالریسنجهای بمبی انجام داد. کالریسنجی در حجم ثابت معمولا برای واکنشهایی استفاده میشود که گاز تولید میکنند. یکی از رایجترین مثالها، واکنشهای سوختن است. چون در این نوع آزمایش تغییر حجم صفر است، کار ناشی از تغییر فشار و حجم حذف میشود. با این روش هم میتوان گرمای واکنش را اندازهگیری کرد.
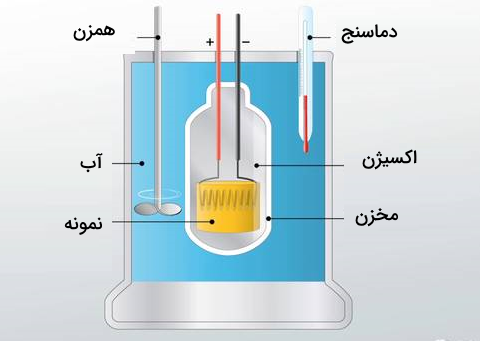
از آنجا که گرمای واکنش به عنوان جریان گرما در فشار ثابت تعریف میشود، اندازهگیریهایی که با استفاده از کالریسنج فشار ثابت انجام میشوند، مقدار گرمای واکنش را بهطور مستقیم به ما میدهند. این نوع کالریسنج برای بررسی واکنشهایی که در محلول و در فشار ثابت جوی انجام میشوند، بسیار مناسب است. پیشنهاد می کنیم برای درک بهتر این آزمایشها و محاسبات، مطلب تعیین تغییرات انرژی درونی و آنتالپی در آزمایشگاه مجله فرادرس را مطالعه کنید.
مثال ۱
برای نمونه، فرض کنید ۴ گرم سدیم هیدروکسید که معادل ۰٫۱۰ مول از این ماده است در ۱۰۰ میلیلیتر آب حل شده و محلول آبی تهیه میشود. همزمان ۳٫۶۵ گرم هیدروکلریک اسید که آن هم برابر با ۰٫۱۰ مول است در ۱۰۰ میلیلیتر آب جداگانه حل میشود. این دو محلول در یک کالریسنج عایقشده با یکدیگر ترکیب میشوند، دماسنج درون سیستم قرار میگیرد و درپوش دستگاه بسته میشود.
در حین انجام واکنش بین یونهای موجود، دماسنج افزایش دما را از ۲۲٫۴ درجه به ۲۹٫۱ درجه سانتیگراد ثبت میکند. با فرض اینکه گرمای ویژه و چگالی این محلولها مشابه آب خالص باشد، میتوان تغییرات انرژی گرمایی واکنش را محاسبه کرد. حجم کل محلول برابر ۲۰۰ میلیلیتر است و با چگالی ۱ گرم بر میلیلیتر، جرم کل محلول ۲۰۰ گرم خواهد بود. با استفاده از رابطه محاسبه گرمای جذب یا آزاد شده و اطلاعات تجربی به دست آمده، انرژی آزادشده در این واکنش قابل تعیین است.
برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۲
یک محلول ۱۰۰ میلیلیتری که حاوی ۰٫۲۵ مول یون کلسیم بود، با محلولی که در آن ۰٫۵۰ مول یون فلوئور وجود داشت، مخلوط شد. در نتیجه این واکنش، ترکیب جامد فلورید کلسیم تشکیل شد.
در جریان این واکنش، دمای محلول بهمیزان ۱۰٫۵ درجه سانتیگراد افزایش یافت. با استفاده از اطلاعات داده شده، مقدار گرمای واکنش چیست. محلول مورد نظر دارای چگالی و گرمای ویژهای برابر با آب خالص است.
پاسخ
به دلیل اینکه مقدار تغییرات دما مستقیما به ما داده شده، میتوانیم با جایگذاری آن در معادله گرمای مبادله شده، مقدار گرمای واکنش را به دست آوریم.
مثال ۳
در یک کالریمتر در فشار ثابت، ۰٫۱ مول متان و ۰٫۲ مول اکسیژن طی واکنش زیر با هم ترکیب میشوند.
این واکنش باعث گرم شدن ۷۵۰٫۰ گرم آب بهاندازه ۲۸٫۴ درجه سانتیگراد میشود. آنتالپی واکنش در مقیاس مولی چقدر است؟
پاسخ
ابتدا مقدار گرمای مبادله شده را با استفاده از فرمول آن به دست میآوریم.
سپس این مقدار را بر مول متان تقسیم میکنیم.
محاسبه گرمای واکنش با انرژی پیوند
مقدار گرمای واکنشهای شیمیایی را میتوان با مقدار اختلاف انرژی تفکیک پیوند واکنشدهندهها و فرآورده ها محاسبه کرد. فرمول این محاسبه به شکل زیر است.
گرمای واکنش ≈ آنتالپی تفکیک پیوند واکنشدهندهها – آنتالپی تفکیک پیوند فرآوردهها
علامت ≈ به این دلیل استفاده میشود که در این روش، از میانگین انرژی پیوندها استفاده میکنیم و بنابراین مقدار بهدستآمده تقریبی است و دقیق نیست. در یک واکنش شیمیایی، پیوندهایی که شکسته میشوند معمولا با پیوندهایی که دوباره شکل میگیرند متفاوت هستند. گاهی گرمای بیشتری جذب میشود چون تعداد بیشتری از پیوندها شکسته میشود و گاهی هم گرمای بیشتری آزاد میشود چون پیوندهای بیشتری تشکیل میگردند.

فرمول محاسبه گرمای واکنش با انرژی پیوند
در قسمت قبل آموختیم روش محاسبه گرمای واکنش با انرژی پیوند چیست. فرمول محاسبه گرمای واکنش با آنتالپی پیوند مواد به شکل ریاضی به صورت زیر نوشته میشود.
در فرمول بالا، عبارت BDE به معنی انرژی تفکیک پیوند و خلاصهی عبارت (Bond Dissociation Energy) است. برای درک بهتر این روش محاسبه، به واکنش زیر دقت کنید.
در این واکنش، پیوند بین اتم های هیدروژن و اکسیژن در واکنشدهندهها شکسته شده و پیوند بین اکسیژن و هیدروژن در فرآوردهها تشکیل میشود. در محاسبه گرمای واکنش به این روش باید تعداد پیوندها و نوع پیوندها را در نظر بگیریم. به تصویر زیر دقت کنید.
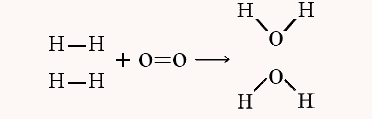
همانطور که در واکنش بالا مشاهده میکنید، دو پیوند هیدروژن – هیدروژن و یک پیوند دوگانه اکسیژن – اکسیژن میشکند و ۴ پیوند اکسیژن – هیدروژن تشکیل میشود. مقادیر انرژی پیوند را از جداول مرجع به دست میآوریم. انرژی پیوند هیدروژن – هیدروژن برابر با ۱۰۵ کیلوکالری بر مول، انرژی پیوند دوگانه بین اکسیژنها ۱۱۹ کیلوکالری بر مول و انرژی پیوند اکسیژن هیدروژن ۱۱۰ کیلوکالری بر مول است. پس آنتالپی واکنش با محاسبات زیر به دست میآید.
تغییر آنتالپی واکنش () حدود منفی ۱۱۱ کیلوکالری بر مول است. به بیان دیگر، پیوندهای موجود در فرآوردهها نسبت به پیوندهای مواد واکنشدهنده حدود ۱۱۱ کیلوکالری قویتر هستند. از آنجایی که پیوندهای فرآوردهها محکمترند، واکنش انرژی بیشتری آزاد میکند تا اینکه جذب کند.
این انرژی اضافه به صورت گرما آزاد میشود، بنابراین واکنش از نوع گرماده است. پیشنهاد میکنیم برای درک بهتر انرژی پیوند و محاسبه آن، فیلم آموزش انرژی پیوند در پیوندهای کووالانسی فرادرس که لینک آن در ادامه آمده است را مشاهده کنید.
انرژی تفکیک پیوند چیست؟
اتمها برای تشکیل ترکیبها با یکدیگر پیوند برقرار میکنند، چون در این حالت انرژی آنها از زمانی که بهصورت جدا از هم هستند، کمتر و پایدارتر میشود. گرما برابر با مقدار مشخصی از انرژی است. این مقدار برابر با اختلاف انرژی بین اتمهای پیوندخورده و اتمهای جدا از هم است. به بیان دیگر، اتمهای پیوندخورده انرژی کمتری نسبت به اتمهای تنها دارند.
وقتی اتمها به هم متصل میشوند تا یک ترکیب بسازند، همیشه مقداری انرژی آزاد میشود و ترکیب نهایی انرژی کلی کمتری دارد. اگر به یک مولکول انرژی وارد کنیم، میتوانیم این فرآیند را معکوس کنیم. این انرژی باعث شکسته شدن پیوندها شده و مولکول را به اتمهای جداگانه تبدیل میکند. پیوند بین بعضی عناصر خاص انرژی مشخصی نیاز دارد که به آن انرژی تفکیک پیوند گفته میشود.
اصطلاح انرژی تفکیک پیوند معمولا برای توصیف استحکام پیوندهای کووالانسی به کار میرود. برای مثال، پیوند C-C انرژی پیوندی حدود ۸۰ کیلوکالری بر مول دارد، در حالی که پیوند C=C انرژیای حدود ۱۴۵ کیلوکالری بر مول دارد. بنابراین پیوند C=C قویتر از پیوند C-C است.
مقدار انرژی پیوند مواد
هرچند هر مولکول انرژی تفکیک پیوند مخصوص به خود را دارد، اما میتوان مقدار تقریبی این موارد را محاسبه کرد. برای مثال، با اینکه مقدار دقیق انرژی پیوند C-H به نوع مولکول خاصی که پیوند در آن است، بستگی دارد، همه پیوندهای C-H انرژی تقریبا مشابهی دارند. شکستن یک مول از پیوندهای C-H تقریبا به ۱۰۰ کیلوکالری انرژی نیاز دارد. بنابراین گفته میشود انرژی تفکیک پیوند C-H حدود ۱۰۰ کیلوکالری بر مول است.
در جدول زیر، مقدار انرژی پیوند برخی از پیوندها را ارائه کردهایم.
| پیوند | انرژی تفکیک پیوند (کیلوکالری بر مول) |
| C-H | ۱۰۰ |
| C-O | ۸۶ |
| C-N | ۷۰ |
| C-C | ۸۵ |
| C=C | ۲۰۰ |
| H-H | ۱۰۵ |
| Cl-Cl | ۵۸ |
| C=O | ۱۹۰ |
| O=O | ۱۱۹ |
مثال ۱
مقدار گرمای واکنش زیر را بیابید.
- انرژی پیوند H-H برابر با ۱۰۵ کیلوکالری بر مول است.
- انرژی پبوند Br-Br برابر با ۴۶ کیلوکالری بر مول است.
- انرژی پیوند H-Br برابر با ۸۷ کیلوکالری بر مول است.
پاسخ
یک پیوند هیدروژن – هیدروژن و یک پیوند برم- برم شکسته شده و دو پیوند هیدروژن- برم تشکیل میشود.
مثال ۲
مقدار گرمای واکنش زیر را بیابید.
- انرژی پیوند H-H برابر با ۱۰۵ کیلوکالری بر مول است.
- انرژی پبوند Cl-Cl برابر با ۵۸ کیلوکالری بر مول است.
- انرژی پیوند H-Cl برابر با ۱۰۳ کیلوکالری بر مول است.
پاسخ
یک پیوند هیدروژن – هیدروژن و یک پیوند کلر – کلر شکسته شده و دو پیوند هیدروژن – کلر تشکیل میشود.
محاسبه گرمای واکنش با قانون هس
وقتی دو یا چند معادله شیمیایی موازنهشده را با هم جمع میکنیم تا به معادله کلی برسیم، مقدار واکنش نهایی با مجموع واکنشهای جداگانه برابر است. این اصل به «قانون هس» (Hess’s Law) معروف است.
از آنجا که گرمای واکنش یک تابع حالت است، تغییر آنتالپی در یک واکنش تنها به دو عامل بستگی دارد.
- مقدار جرم مواد واکنشدهنده
- حالت فیزیکی واکنشدهندهها و فرآوردهها
گرمای واکنش به مسیری که طی آن واکنش دهندهها به فرآوردهها تبدیل میشوند بستگی ندارد بنابراین میتوان مقدار آنتالپی یا گرمای واکنش را به وسیله آنتالپی مسیرهای متفاوتی که واکنش برای انجام گرفتن طی میکند، به دست آورد. قانون هس به ما این امکان را میدهد که مقدار آنتالپی واکنشهایی را که انجام آنها به شکل مستقیم دشوار است، با جمع کردن مقدار آنتالپی واکنشهای سادهتری که به تولید فرآورده میانجامد، به دست آوریم.
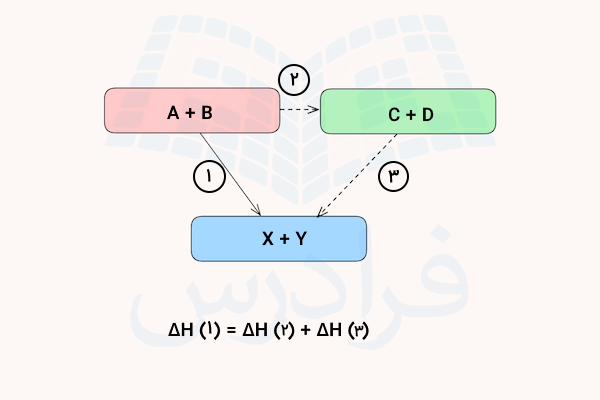
به تصویر بالا دقت کنید. دو مسیر برای رسیدن به فرآورده X و Y وجود دارد. مسیر اول تبدیل مستقیم واکنش دهندههای A و B به این فرآوردهها و مسیر دوم تشکیل فرآوردههای واسطه C و D از واکنشدهندههای A و B و سپس مسیر سوم یعنی تولید فرآوردهها است. طبق قانون هس، مقدار گرمای واکنش مسیر ۱ برابر با جمع گرمای واکنش مسیر ۲ و ۳ است.
روش محاسبه
برای درک بهتر این روش محاسبه، به واکنش زیر دقت کنید.
در واقعیت، انجام این واکنش به سادگی ممکن نیست. در حالت طبیعی، کربن تمایل دارد که به ترکیب پایدارتری مانند دی اکسید کربن واکنش دهد.
اما اگر هدف ما تولید کربن مونوکسید (CO) از کربن و اکسیژن باشد، انجام مستقیم این واکنش به دلیل پایداری بیشتر با دشواری همراه است. در چنین مواردی میتوان از قانون هس استفاده کرد. برای درک بهتر، دو واکنش زیر را در نظر بگیرید.
با جمع جبری این دو واکنش، ابتدا تمام واکنشدهندهها را در یک طرف و تمام فرآوردهها را در طرف دیگر قرار میدهیم:
در این مرحله، مواد مشترک در دو طرف معادله را حذف میکنیم. از آنجا کهکربن دی اکسید در هر دو طرف معادله وجود دارد، حذف میشود. همچنین، ۲ مول اکسیژن در سمت واکنشدهنده و ۱ مول در سمت فرآورده قرار دارد در نتیجه، ۱ مول اکسیژن نیز از دو طرف حذف میشود.
این معادله نهایی، واکنشی است که قصد داشتیم به آن برسیم. این روش نشان میدهد که چگونه میتوان با استفاده از قوانین ترموشیمی و قانون هس، واکنشهای پیچیده یا غیرقابل انجام را بهصورت تئوری تحلیل و معادلهی مربوطه را استخراج کرد.
قانون هس بیان میکند که اگر چند واکنش شیمیایی را بهصورت جبری با یکدیگر ترکیب کنیم، تغییرات آنتالپی آنها نیز به همان صورت قابل جمع زدن است. این اصل بر مبنای آن است که آنتالپی یک تابع حالت است و صرفنظر از مسیر واکنش، فقط به حالت اولیه و نهایی بستگی دارد.
دو قانون مهم در بکارگیری قانون هس برای به دست آوردن گرمای واکنش وجود دارد. این قوانین به شرح زیر هستند.
- اگر جهت یک واکنش شیمیایی معکوس شود، علامت آنتالپی نیز تغییر میکند.
- اگر ضرایب یک واکنش در عددی ضرب شوند، مقدار آنتالپی واکنش نیز باید به همان نسبت تغییر کند.
برای درک بهتر اینکه روش محاسبه گرمای واکنش با قانون هس چیست، به محاسبات مربوط به واکنش ارائه شده در این قسمت توجه کنید. برای محاسبه گرمای واکنش کربن و اکسیژن برای تولید کربن دی اکسید، دو معادله واکنش دیگر که طی آن واکنش انجام میشود را به همراه آنتالپی آنها مینویسیم. سپس ضرایب مورد نیاز را اعمال کرده و واکنش دوم را به صورت عکس مینویسیم تا به واکنش نهایی برسیم.
همانطور که مشاهده میکنیم، این تغییرات روی آنتالپی واکنشها نیز اعمال شده و در نهایت با جمع این مقادیر میتوانیم گرمای واکنش کربن و اکسیژن برای تولید کربن مونوکسید را بیابیم. برای درک بهتر این محاسبات، به مثالهای زیر دقت کنید.
مثال ۱
واکنش زیر را در نظر بگیرید.
با توجه به واکنشها و آنتالپیهای داده شده، مقدار گرمای واکنش معادله اول چیست.
پاسخ
برای شروع، واکنشهایی را طوری تنظیم میکنیم که تعداد مولهای ماده مورد نظر در سمت درست واکنش قرار بگیرد. در واکنش اول، ترکیب اتیلن بهعنوان یک واکنشدهنده حضور دارد. فقط یکی از واکنشهای موجود شامل این ماده است، اما در آن اتیلن به عنوان فرآورده قرار گرفته است. برای قرار دادن اتیلن در سمت واکنشدهنده باید جهت آن واکنش را برعکس کنیم. وقتی واکنشی معکوس میشود، علامت آنتالپی آن نیز معکوس خواهد شد.
در واکنش اول، کربن دی اکسید و آب باید بهعنوان فرآورده ظاهر شوند. در میان واکنشهای موجود واکنش دوم را نیز مینویسیم.
در نهایت نیز معادله آخر را به همان شکلی که هست نوشته و محاسبات لازم را برای به دست آوردن گرمای واکنش اول انجام میدهیم.
سپس با ساده سازی مواد میتوانیم به معادله واکنش اول رسیده و با جمع آنتالپیهای نوشته شده، گرمای واکنش آن را محاسبه کنیم.

مثال ۲
واکنش زیر را در نظر بگیرید.
اگر مقادیر آنتالپی دو واکنش زیر به صورت زیر باشد، مقدار گرمای واکنش معادله اول را به دست آورید.
پاسخ
برای پاسخ به این پرسش نیاز است معادله واکنشهای داده شده را به شکلی تنظیم کنیم که معادله تنهایی طبق قانون هس مطابق معادله خواسته شده باشد. برای این کار، باید واکنش اول را عکس کرده و واکنش دوم را همانگونه که هست بنویسیم. در نتیجه خواهیم داشت:
و معادله نهایی به دست میآید.
محاسبه گرمای واکنش با آنتالپی استاندارد تشکیل
آنتالپی تشکیل () به تغییر آنتالپیای گفته میشود که هنگام تشکیل ۱ مول از یک ترکیب از عناصر سازندهاش روی میدهد. برای مثال، تشکیل کربن دی اکسید از کربن و اکسیژن، آنتالپی استاندارد تشکیل مشخصی دارد. تشکیل هر ترکیب شیمیایی را میتوان بهصورت واکنشی از عناصر تشکیلدهندهاش در نظر گرفت. مقادیر آنتالپی استاندارد تشکیل مواد مختلف در جداول و کتب مرجع ارائه شدهاند.
از آنجا که اندازهگیری گرما برای تمام واکنشها در عمل ممکن نیست و حتی برای بعضی واکنشها غیرقابل انجام است، معمولا گرمای واکنش را با استفاده از ترکیب مناسبی از پارامترهای حرارتی استاندارد تخمین میزنند. این دادهها معمولا بهصورت گرمای تشکیل استاندارد و گرمای احتراق استاندارد ارائه میشوند.
گرمای تشکیل استاندارد بهصورت مقدار گرمایی تعریف میشود که در دمای ۲۵ درجه سانتیگراد و فشار یک اتمسفر، هنگام تشکیل یک مول از یک ترکیب از عناصر سازندهاش در حالت فیزیکی طبیعی (گاز، مایع یا جامد) جذب یا آزاد میشود. علامت آنتالپی استاندارد تشکیل مانند آنتالپی واکنش است. اگر هنگام ترکیب مواد برای تشکیل یک ترکیب گرما آزاد شود، آنتالپی تشکیل منفی و اگر گرما جذب شود، آنتالپی تشکیل مثبت خواهد بود.
نکته: آنتالپی استاندارد تشکیل مواد در حالت عنصری و حالت فیزیکی پایدار در شرایط استاندارد، برابر با صفر درنظر گرفته میشود. برای مثال، آنتالپی استاندارد تشکیل کربن (گرافیت)، اکسیژن گازی و هیدروژن گازی برابر با صفر است.
مقادیر جدولبندی شده گرمای استاندارد حاصل از تشکیل مواد را میتوان برای محاسبه تغییرات گرمای واکنش در هر واکنشی که مواد اولیه و فرآوردههای آن دارای این مواد هستند، بهکار برد. برای مثال، یک واکنش کلی را در نظر بگیرید.
روش محاسبه
مقدار گرمای واکنش را میتوان با استفاده از تفریق مقدار آنتالپی استاندارد تشکیل فرآوردهها منهای آنتالپی استاندارد تشکیل واکنشدهندهها به دست آورد.

همچنین، طبق معادله بالا، ضرایب استوکیومتری نیز باید در این محاسبات لحاظ شوند. برای مثال، به واکنش زیر دقت کنید.
مقدار گرمای این واکنش را میتوان با تفریق آنتالپی استاندارد تشکیل ۶ مول اکسیژن و ۱ مول گلوکز از آنتالپی استاندارد تشکیل ۶ مول کرن دی اکسید و ۶ مول آب به دست آورد. فرمول این محاسبات به شکل زیر است.
با به دست آوردن مقادیر آنتالپی استاندارد تشکیل از جداول مرجع، مقدار گرمای واکنش به شکل زیر به دست میآید.
$$begin{align} Delta H_{comb}^{o} &= left [ 6left ( -393.5 ; kJ/mol right ) + 6 left ( -285.8 ; kJ/mol right ) right ] – left [-1273.3 + 6left ( 0 ; kJ;mol right ) right ] label{7.8.8} \[4pt] &= -2802.5 ; kJ/mol end{align}$$
برای درک بهتر این محاسبات، به مثال های زیر دقت کنید.
مثال
سولفات آمونیوم که بهعنوان ماده ضدحریق و نگهدارنده چوب استفاده میشود، به صورت صنعتی از واکنش بسیار گرماده آمونیاک گازی با اسید سولفوریک تولید میشود.
مقدار گرمای این واکنش برابر با ۱۷۹٫۴- کیلوژول بر مول است. با استفاده از مقادیر داده شده برای آنتالپی تشکیل مواد، مقدار آنتالپی استاندارد تشکیل آمونیوم سولفات را بر حسب کیلوژول بر مول به دست آورید.
- آنتالپی استاندارد تشکیل آمونیاک برابر با ۴۵٫۹- کیلوژول بر مول است.
- آنتالپی استاندارد تشکیل اسید سولفوریک برابر با ۹۰۹٫۸- کیلوژول بر مول است.
پاسخ
برای پاسخ به این سوال، مقدار آنتالپی مواد واکنشدهنده را از آنتالپی واکنش کم میکنیم تا آنتالپی آمونیوم سولفات به دست آید.
عوامل موثر بر گرمای واکنش چیست؟
گرمای واکنشهای شیمیایی میتواند با تغییر برخی از شرایط تغییر کند. برای مثال، حالت فیزیکی مواد، دما، فشار و غلظت از عوامل تاثیرگذار بر گرمای واکنش هستند. در ادامه اثر این عوامل را توضیح میدهیم.
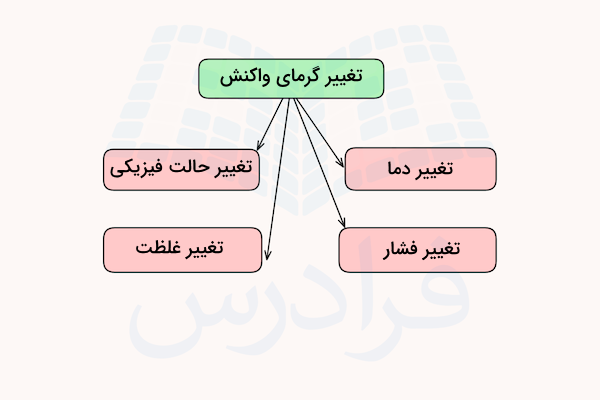
اثر حالت فیزیکی
حالت فیزیکی واکنشدهندهها و فرآوردهها نقش مهمی در تعیین آنتالپی واکنش دارد. برای مثال، تغییر آنتالپی یک واکنش که در آن گازها شرکت دارند، معمولا با تغییر آنتالپی همان واکنش در حالتی که مواد به صورت جامد یا مایع باشند، متفاوت است.
اثر دما
با افزایش دما، مقدار برهمکنشهای مولکولی افزایش مییابد. با افزایش تعداد برهمکنشهای مولکولی، مقدار انرژی درونی سیستم افزایش مییابد. بنابراین، اگر مقدار انرژی درونی واکنش (U) افزایش یابد، مقدار آنتالپی یا گرمای واکنش نیز افزایش مییابد.
اثر فشار
در واکنشهایی که گازها در آنها شرکت دارند، فشار انجام واکنش میتواند بر مقدار آنتالپی واکنش تاثیر بگذارد. تغییرات فشار ممکن است وضعیت انرژی گازها را تغییر دهد و در نتیجه باعث تفاوت در گرمای آزاد یا جذبشده در طول واکنش شود.
اثر غلظت
غلظت واکنشدهندهها نیز میتواند بر آنتالپی واکنش تاثیر بگذارد. معمولا غلظتهای بالاتر منجر به تغییرات آنتالپی بیشتری میشوند، زیرا تعداد برخوردهای موثر بین ذرات افزایش مییابد و در نتیجه انرژی آزاد یا جذبشده در واکنش میتواند بیشتر باشد. این موضوع بهویژه در واکنشها در فاز محلول اهمیت دارد.
یادگیری ترمودینامیک با فرادرس
در این مطلب آموختیم گرمای واکنش چیست. برای درک بهتر مفهوم گرمای واکنش، نیاز است با مفاهیمی چون خواص و حالتهای ماده، قوانین ترمودینامیک، انواع انتقال گرما و انرژی درونی آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش ترمودینامیک فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه گرمای واکنش دسترسی داشته باشید.
انواع دیگر گرمای واکنش
یکی از روشها برای گزارش مقدار گرمای جذبشده یا آزادشده این است که مجموعهای بزرگ از جدولهای مرجع تهیه کنیم که تغییر آنتالپی تمام واکنشهای شیمیایی ممکن را فهرست کرده باشند. انجام چنین کاری نیاز به تلاش بسیار زیادی دارد.
خوشبختانه، قانون هس این امکان را میدهد که تغییر آنتالپی تقریبا هر واکنش شیمیایی را با استفاده از مجموعهای از دادههای محاسبه کنیم، در ادامه، برخی از انواع گرمای واکنش معرفی شدهاند.
آنتالپی سوختن
آنتالپی سوختن، مقدار تغییرات آنتالپی است که طی واکنش سوختن رخ میدهد. مقدار تغییرات آنتالپی برای واکنش سوختن بسیاری از مواد با اکسیژن قبلا محاسبه شده و در دسترس هستند. این مقادیر معمولا بهصورت آنتالپی سوختن به ازای هر مول از ماده گزارش میشوند. برای مثال، به آنتالپی سوختن برای متان دقت کنید.
آنتالپی محلول
آنتالپی محلول که آن را با علامت نشان میدهند، مقدار تغییرات آنتالپی است که طی فرآیند حل شدن مقدار مشخصی از ماده حل شونده در مقدار مشخصی از حلال رخ میدهد. برای مثال، به آنتالپی محلول برای سدیم هیدروکسید دقت کنید.
گرمای تغییر فاز در واکنش
در انجام واکنشهای شیمیایی ممکن است حرارت منتقل شده طی واکنش شیمیایی، صرف تغییر فاز مواد موجود در واکنش شود. با شناخت گرمای تغییر فاز (آنتالپی فاز) مواد میتوانیم محاسبات مربوط به گرمای واکنش را به شکلی دقیقتر انجام دهیم. در ادامه، آنتالپیهای تغییر فاز را توضیح میدهیم.
آنتالپی استاندارد تبخیر
آنتالپی استاندارد تبخیر که آن را با علامت نشان میدهند، انرژی است که صرف تبخیر یک مول از ماده در شرایط استاندارد میشود. مقادیر این آنتالپی برای مواد مختلف، در کتب راهنما موجود است. برای مثال، به آنتالپی تبخیر برای آب دقت کنید.
آنتالپی استاندارد ذوب
آنتالپی استاندارد ذوب که آن را با علامت نشان میدهند، انرژی است که صرف ذوب یک مول از ماده در شرایط استاندارد میشود. مقادیر این آنتالپی برای مواد مختلف، در کتب راهنما موجود است. برای مثال، به آنتالپی ذوب برای آب دقت کنید.
به همین ترتیب میتوان آنتالپی تغییر فازهای دیگر مواد را نیز به دست آورد. برای مثال، آنتالپی استاندارد تصعید یک ماده برابر با جمع آنتالپی استاندارد ذوب و تبخیر آن خواهد بود. همچنین، آنتالپی انجماد و میعان مواد نیز به ترتیب برابر با آنتالپی ذوب و تبخیر آنها خواهد بود با این تفاوت که علامت آن تغییر میکند.
کاربرد گرمای واکنش
در این مطلب آموختیم گرمای واکنش چیست. گرمای واکنش، که با عنوان آنتالپی واکنش نیز شناخته میشود، در حوزههای گوناگون از جمله شیمی، صنعت، پژوهش و علوم محیطی کاربردهای فراوانی دارد. در ادامه این مطلب از مجله فرادرس به برخی از مهمترین کاربردهای آن اشاره میشود.

بهینه سازی فرآیندهای شیمیایی
در صنایع شیمیایی، آگاهی از میزان گرمای آزاد یا جذبشده در واکنشها برای طراحی فرآیندهایی کارآمد، اقتصادی و سازگار با محیط زیست ضروری است. مهندسان با استفاده از این دادهها میتوانند واکنشهایی با بازدهی بالاتر طراحی کنند.
تعیین ارزش انرژی سوخت
گرمای سوختن، نوعی خاص از گرمای واکنش است که برای محاسبه ارزش حرارتی سوختها مانند بنزین، گاز طبیعی و زغال سنگ کاربرد دارد. این اطلاعات برای ارزیابی بازده انرژی و کیفیت احتراق ضروریاند.
پژوهش دارویی
در فرآیند توسعه و سنتز داروها، دانستن گرمای واکنش برای انتخاب مسیرهای بهینه شیمیایی، کاهش فرآوردههای جانبی ناخواسته و افزایش خلوص دارو اهمیت زیادی دارد.
سنتز مواد جدید
در تولید موادی مانند سرامیکها، پلیمرها و نانوذرات، واکنشهای شیمیایی با تبادل گرما همراه هستند. شناخت گرمای این واکنشها برای تولید مواد با خواص دلخواه ضروری است.
مطالعات زیست محیطی
درک گرمای واکنش در پدیدههایی مانند احتراق و تشکیل آلایندهها به پژوهشگران کمک میکند تا تاثیرات زیستمحیطی فعالیتهای صنعتی و وسایل نقلیه را بهتر بررسی کنند.
پژوهش زیستی و بیوشیمیایی
در بیوشیمی، اطلاعات مربوط به گرمای واکنش در تحلیل مسیرهای متابولیکی، بررسی واکنشهای آنزیمی و کشف داروها کاربرد دارد.
منابع انرژی جایگزین
برای توسعه منابع انرژی نو مانند پیلهای سوختی هیدروژنی و باتریها، شناخت واکنشهای شیمیایی و میزان انرژی آزادشده در آنها اهمیت حیاتی دارد.
واکنش هسته ای
در فیزیک و مهندسی هستهای، آنتالپی واکنش به تحلیل انرژی آزاد شده در فرآیندهای شکافت و همجوشی هستهای کمک میکند و در طراحی و ارزیابی ایمنی راکتورهای هستهای بهکار میرود.
source
