ترکیبات شیمیایی موادی هستند که از اتصال چند اتم به یکدیگر تشکیل شدهاند. این ترکیبات بسته به نوع پیوند شیمیایی بین اتمها، میتوانند از نوع کووالانسی ناقطبی، کووالانسی قطبی و یونی باشند. برای نمایش این ترکیبات از فرمول شیمیایی استفاده میشود. فرمول شیمیایی شامل نمادهای شیمیایی عناصر و تعداد آنها در ترکیب به صورت زیروند است. در این مطلب از مجله فرادرس میآموزیم مفهوم ترکیبات شیمیایی چیست، انواع و طبقهبندی آن کدامند و فرمول ترکیبات شیمیایی چیست.
آنچه در این مطلب میآموزید
-
مفهوم ترکیبات شیمیایی و اجزای تشکیل دهنده آنها را میآموزید.
-
با طبقهبندی ترکیبات شیمیایی بر اساس نوع پیوند و اتم ها آشنا میشوید.
-
با روش نوشتن فرمول ترکیبات شیمیایی مختلف آشنا میشوید.
-
انواع پیوندهای موجود در ترکیبات شیمیایی را به همراه ویژگیهای آنها درک میکنید.
-
روش نمایش ترکیبات شیمیایی را به همراه مثال و تصویر میآموزید.
-
به تفاوت کلیدی ترکیبات شیمیایی با عناصر شیمیایی پی میبرید.

در این مطلب ابتدا یاد میگیریم مفهوم ترکیبات شیمیایی چیست و چه تفاوتی با عناصر و مخلوطها دارد. سپس ویژگیهای فیزیکی و شیمیایی ترکیبات را بررسی میکنیم و با انواع پیوندهای شیمیایی مانند یونی، کووالانسی، فلزی و هیدروژنی آشنا میشویم. در ادامه، طبقهبندی جامعی از ترکیبات شیمیایی ارائه میدهیم و به معرفی ترکیبات آلی، معدنی، کووالانسی، یونی و تفاوت آنها میپردازیم. همچنین با فرمولنویسی ترکیبات و نمایش فضایی آنها آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با ترکیبات شیمیایی آشنا شوید.
طبقه بندی ترکیبات شیمیایی
ترکیب شیمیایی ترکیبی است که از اتصال چند عنصر با پبوندهای شیمیایی تشکیل شده است. ترکیبات شیمیایی بسته به نوع پیوند شیمیایی بین آنها میتوانند به دو نوع کووالانسی و قطبی تقسیم شوند. مواد کووالانسی خود به دو نوع کووالانسی قطبی و ناقطبی تقسیم میشوند.
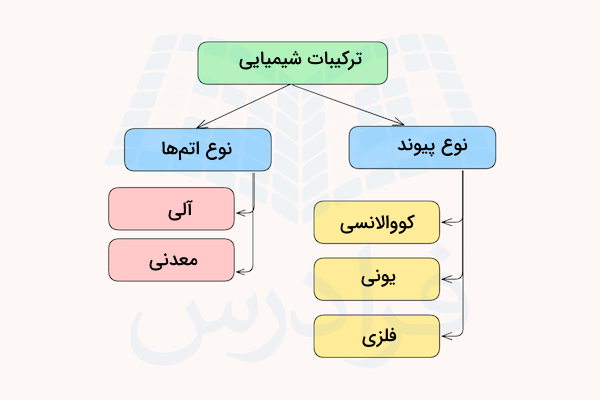
در جدول زیر، انواع ترکیبات شیمیایی را به همراه مثالهایی از آنها توضیح دادهایم.
| تعریف | مثال |
| ترکیبات یونی: یون و پیوند یونی | ترکیبات یونی: سدیم کلرید و کلسیم کربنات |
| ترکیبات کووالانسی: عنصر و پیوند کووالانسی | ترکیبات کووالانسی: آب و متان |
| ترکیبات آلی: کربن و هیدروژن | ترکیبات آلی: کربوهیدرات و پروتئین |
| ترکیبات معدنی: ترکیبات غیرکربنی | ترکیبات معدنی: نمکها |
| ترکیبات فلزی: فلز و پیوند فلزی | ترکیبات فلزی: آلیاژها |
| اسیدها و بازها: دارای یون هیدروژن یا هیدروکسید | اسیدها و بازها: اسید کلریدریک |
| ترکیبات کوئوردیناسی: مرکز فلزی و لیگاند | ترکیبات کوئوردیناسی: سولفات مس ۵ آبه |
| ترکیبات آلی – فلزی: عنصر فلزی و مولکول آلی | ترکیبات آلی – فلزی: تری اتیل بوران |
| ترکیبات پلیمری: اتصال مونومرها | ترکیبات پلیمری: پلاستیک |
ترکیب شیمیایی چیست؟
تمام ترکیبات شیمیایی، از چند اتم تشکیل شدهاند که به وسیله نیروهای الکترواستاتیکی، در کنار هم قرار گرفتهاند. نیروهای الکترواستاتیکی بین ذرات بارداری مانند پروتون و الکترون، باعث جذب بارهای ناهمنام و دفع بارهای همنام میشوند. هنگامی که نیروهای جاذبه الکترواستاتیکی بین اتمها از نیروهای دافعه بیشتر باشد، ترکیبات شیمیایی تشکیل میشوند.
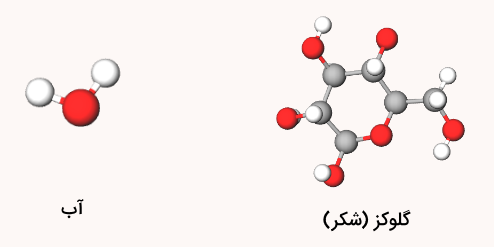
در ترکیبات شیمیایی، اتمها با نسبت مشخصی در کنار هم قرار گرفتهاند و این نسبت همواره رعایت میشود. به همین دلیل، ترکیبات شیمیایی با مخلوطها که دارای مواد مختلف با نسبتهای نامشخصی هستند، تفاوت دارند. برای مثال، محلول شکر یک مخلوط است و آب و شکر هر یک به تنهایی یک ترکیب شیمیایی محسوب میشوند.
ویژگی ترکیبات شیمیایی
در قسمت قبل آموختیم که ترکیبات شیمیایی از متصل شدن اتمها و عناصر به وسیله پیوند شیمیایی تشکیل میشوند. ویژگیهای فیزیکی و شیمیایی ترکیبات شیمیایی با ویژگیهای اتمهای سازنده آنها متفاوت است.
در ادامه، ویژگیهای ترکیبات شیمیایی را توضیح میدهیم.
- ترکیبات شیمیایی ویژگیهای فیزیکی بسیار متفاوت و گستردهای دارند. هر ترکیب شیمیایی رنگ، بو، نقطه ذوب، نقطه جوش، حلالیت و واکنشپذیری منحصر به فردی دارند.
- ترکیبات شیمیایی در فرمهای مختلفی یافت میشوند. این ترکیبات میتوانند به شکل جامد، مایع یا گاز وجود داشته باشند و نقش مهمی در زندگی انسانها دارند.
- این ترکیبات از قانون نسبتهای ثابت پیروی میکنند و نسبت عناصر موجود در این ترکیبات همواره مقدار مشخص و ثابتی دارد.
- ترکیبات شیمیایی میتوانند به انواع کووالانسی، یونی، آلی، معدنی، دو اتمی و چند اتمی دستهبندی شوند.
یادگیری شیمیدهم با فرادرس
برای درک بهتر مفهوم ترکیبات شیمیایی، نیاز است ابتدا با مفاهیمی چون ساختار اتم، آرایش الکترونی عناصر، الکترون ظرفیت، فرآیند تشکیل یونها و انواع پیوند شیمیایی آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس پایه دهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه ترکیبات شیمیایی دسترسی داشته باشید.
پیوند در ترکیبات شیمیایی
تشکیل ترکیبات شیمیایی بین دو یا چند اتم، مولکول یا یون، با اتصال آنها توسط پیوند شیمیایی انجام میگیرد. این پیوندهای شیمیایی اتمها را در کنار هم نگه میدارد.
در ترکیبات شیمیایی ممکن است یک یا چند نوع از پیوندهای شیمیایی یونی، کووالانسی، فلزی، هیدروژنی یا داتیو وجود داشته باشد.
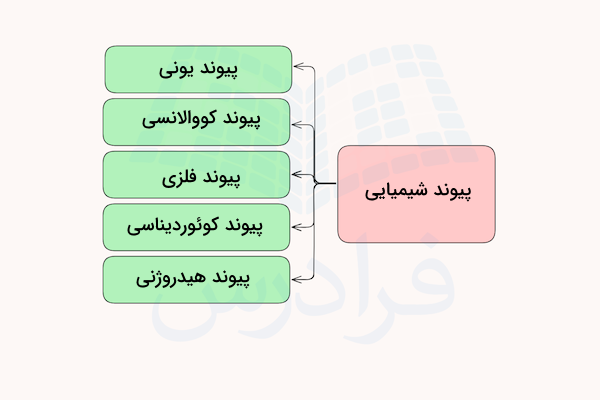
در ادامه هر یک از این پیوندها معرفی شدهاند.
پیوند یونی
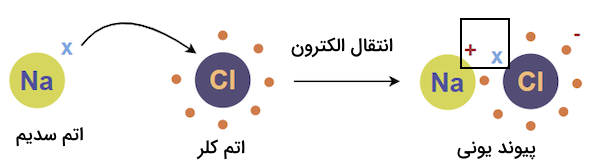
پیوندهای یونی زمانی تشکیل میشوند که یک یا تعداد بیشتری الکترون از یک اتم به اتمی دیگر منتقل شود و یونهای مثبت (کاتیون) و منفی (آنیون) تشکیل شوند. پیوند بین یونهای مثبت و منفی پیوند یونی نام دارد. برای مثال، در نمک طعام، پیوند بین یونهای سدیم و کلر یونی است.
پیوند کووالانسی
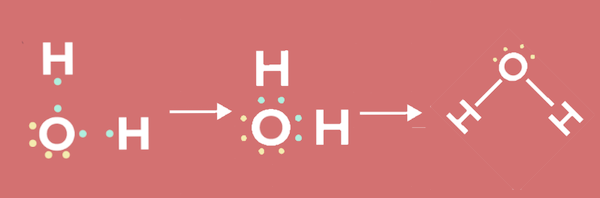
پیوند کووالانسی شامل به اشتراکگذاری جفتهای الکترونی برای رسیدن اتمها به آرایش الکترونی پایدار است. در پیوند کووالانسی، اتمها یک یا چند جفت الکترون را به اشتراک میگذارند. برای مثال در آب، پیوند بین اتمهای هیدروژن و اکسیژن از نوع کووالانسی است.
پیوند داتیو
پیوند داتیو که با نام پیوند کوئوردیناسی نیز شناخته میشود، در ترکیبات کوئوردیانسی بین لیگاند و فلز مرکزی برقرار میشود. در این نوع پیوند، جفت الکترونهای غیرپیوندی لیگاند با اتم فلز مرکزی به اشتراک گذاشته میشود. پیوند داتیو نوعی پیوند کووالانسی است.
پیوند فلزی
پیوند فلزی نوعی از پیوند شیمیایی است که در فلزات و آلیاژها تشکیل میشود. نقش این پیوند، نگه داشتن فلزات با بار مثبت در کنار هم است. در این پیوندها، الکترونها میتوانند آزادانه در طول مواد حرکت کرده و باعث رسانایی جریان الکتریکی شوند. برای مثال پیوند فلزی در موادی مانند سرب، قلع و برنز وجود دارد.
پیوند هیدروژنی
پیوند هیدروژنی نوعی از پیوند کووالانسی قطبی است که بین اتمهای اکسیژن و هیدروژن برقرار میشود. در این نوع پیوند، هیدروژن بار جزئی مثبت داشته و الکترونها بیشتر به سمت اتم اکسیژن جذب شده و اکسیژن بار جزئی منفی پیدا میکند.
فرمول ترکیبات شیمیایی
تمامی ترکیبات شیمیایی با یک فرمول شیمیایی نمایش داده میشوند که نوع عناصر و تعداد آنها را در ترکیب مشخص میکند. این فرمولهای شیمیایی شامل نماد عناصر ترکیب و تعداد آنها به شکل زیروند هستند. در ادامه، فرمول شیمیایی برخی از ترکیبات نوشته شده است.
| نام ترکیب | فرمول شیمیایی |
| آب | |
| آمونیاک | |
| سدیم کلرید | |
| کلسیم کربنات | |
| کربن دی اکسید | |
| سدیم بیکربنات | |
| متان |
روش نوشتن فرمول شیمیایی ترکیبات شیمیایی به تفکیک نوع ترکیب در ادامه توضیح داده شده است.
انواع ترکیبات شیمیایی بر اساس نوع پیوند
ترکیبات شیمیایی را می توان بر اساس نوع پیوند بین اتمهای آنها در سه دسته ترکیبات کووالانسی، ترکیبات یونی و ترکیبات فلزی بررسی کرد.
ترکیبات شیمیایی کووالانسی
ترکیبات شیمیایی کووالانسی از پیوندهای شیمیایی کووالانسی تشکیل شدهاند. پیوند کووالانسی پیوندی است که از اشتراک الکترونهای ظرفیت بین دو اتم یا مولکول تشکیل میشود. این پیوندهای کووالانسی میتواند از اشتراک الکترون بین دو عنصر یکسان، عناصر مختلف و مولکولها تشکیل شود. ترکیبات کووالانسی معمولا از اتصال دو عنصر نافلز تشکیل میشوند.
برای مثال، ترکیباتی چون آب، هیدروژن کلرید و کربن دی اکسید ترکیباتی کووالانسی هستند که از اشتراک الکترون بین اتمهای نافلزی تشکیل شدهاند.
فرمول ترکیبات کووالانسی
تمامی ترکیبات کووالانسی یک فرمول شیمیایی منحصر به فرد دارند که ترکیب اجزای سازنده آنها را مشخص میکند. این فرمول شیمیایی از نماد عناصر و تعداد آنها به شکل زیروند تشکیل شده است. تعداد عناصر تنها در صورتی نوشته میشود که تعداد آن عنصر در ترکیب بیشتر از عدد ۱ باشد. برای مثال به فرمول شیمیایی مولکول آب توجه کنید:
مولکول آب که از دو اتم هیدروژن و یک اتم اکسیژن تشکیل شده است، به شکل بالا نوشته میشود. به همین شکل، مولکول کربن دی اکسید که از یک اتم کربن و دو اتم اکسیژن تشکیل شده است به شکل نوشته میشود.
تصویر زیر نمایانگر برخی از ترکیبات کووالانسی به همراه فرمول شیمیایی آنها است. پیشنهاد میکنیم برای آشنایی بیشتر با تعیین فرمول ترکیبات شیمیایی، فیلم آموزش فرمول مولکولی و فرمول تجربی فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
ویژگی ترکیبات شیمیایی کووالانسی
ترکیبات شیمیایی کووالانسی از مولکولهایی جداگانه تشکیل شدهاند که به وسیله نیروهای جاذبه ضعیف بین مولکولی در کنار هم قرار گرفتهاند. با وجود اینکه اتمها در این مولکولها به وسیله پیوندهای قوی کووالانسی به هم متصل شدهاند، نیروهای بین این مولکولها ضعیف است و بسته به شدت این نیروها، ترکیبات کووالانسی میتوانند مایع، جامد یا گاز باشند.
ترکیبات کووالانسی جامد ساختارهای کریستالی را تشکیل میدهند که در دماهای پایین ذوب میشوند و به راحتی تبخیر میشوند. برخی از ترکیبات کووالانسی نیز وجود دارند که کریستالهای بسیار سخت تشکیل میدهند که به راحتی قابل شکستن نیستند. برای مثال، الماس یکی از این موارد است.
انواع ترکیبات شیمیایی کووالانسی
ترکیبات شیمیایی کووالانسی بسته به نوع نیروهای جاذبه بین اتمها به دو نوع قطبی و غیرقطبی تقسیم میشوند. همچنین، این ترکیبات بسته به نوع مواد تشکیل دهنده میتوانند به دو نوع دو اتمی و چند اتمی تقسیم شوند. ترکیبات کووالانسی چند اتمی میتوانند از ترکیب عناصر و مولکولهای یکسان یا مختلف تشکیل شوند.
مولکول های کووالانسی دو اتمی
برخی از هالوژنها، اکسیژن، نیتروژن و هیدروژن به شکل طبیعی به صورت ترکیبات شیمیایی کووالانسی دو اتمی وجود دارند. برخی دیگر از ترکیبات شیمیایی نیز از دو عنصر متفاوت تشکیل شدهاند. برخی از مولکولهای کووالانسی دو اتمی در جدول زیر معرفی شدهاند.
| نام ترکیب شیمیایی | فرمول شیمیایی |
| کربن مونوکسید | |
| نیتروژن مونوکسید | |
| هیدروژن کلرید | |
| هیدروژن فلوئورید |
نکته
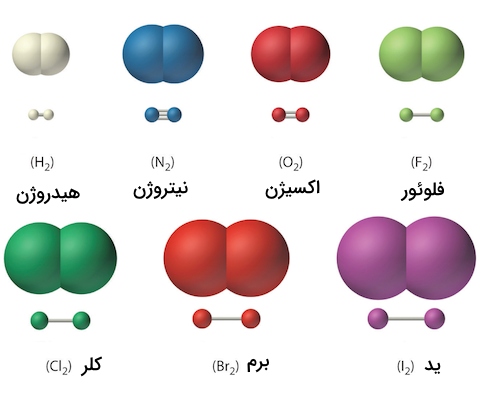
در برخی از منابع، مولکولهای دو اتمی جور هسته مانند هیدروژن ، نیتروژن ، اکسیژن ، کلر، برم و … با عنوان ترکیبات شیمیایی نام برده شدهاند. این درحالی است که برخی دیگر از منابع، این ترکیباتی را عضوی از دسته ترکیبات شیمیایی ندانسته و به آنها مولکول عنصری میگویند.
مولکول های کووالانسی چند اتمی
برخی دیگر از ترکیبات شیکیایی کووالانسی از اتصال بیش از دو اتم یا عنصر تشکیل شدهاند. این ترکیبات میتوانند از عناصر مختلف یا عناصر مشابه تشکیل شده باشند. برای مثال، مولکول های آب، کربن دی اسکید، فسفر، گوگرد، متانول و … از این نوع ترکیبات هستند. برخی از ترکیبات شیمیایی کووالانسی چند اتمی در جدول زیر معرفی شدهاند.
| نام ترکیب | فرمول شیمیایی |
| آب | |
| کربن دی اکسید | |
| فسفر | |
| گوگرد | |
| متانول | |
| سرکه (استیک اسید) | |
| اسید سولفوریک | |
| سدیم کربنات |
همانطور که قبلا اشاره کردیم، ترکیبات کووالانسی بسته به قدرت پیوند شیمیایی آنها به دو دسته قطبی و ناقطبی تقسیم میشوند. قطبیت مولکولهای کووالانسی به اختلاف الکترونگاتیوی بین اتمهای سازنده آنها و همچنین، شکل هندسی مولکول وابسیته است.
ترکیبات شیمیایی کووالانسی قطبی
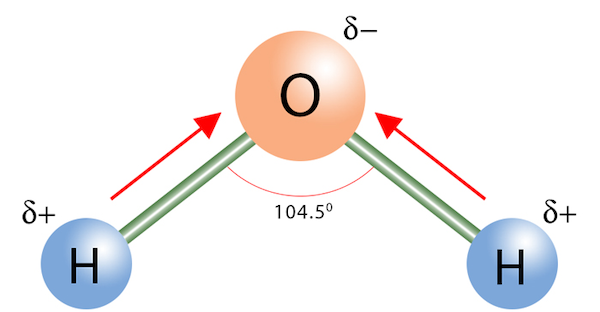
اگر الکترونگاتیوی یکی از اتمهای ترکیب بیشتر باشد، با قدرت بیشتری الکترونهای پیوند کووالانسی را به خود جذب میکند. بدین ترتیب، سری که الکترونگاتیوی بیشتری دارد، مقداری بار جزئی الکترونی منفی و سر دیگر مقدار بار جرئی مثبت واهد داشت و یک دوقطبی تشکیل میشود. اگر ممان دو قطبی این پیوندها را رسم کنیم و برآیند این ممان های دو قطبی در یک سمت مولکول بیشتر باشد، مولکول از نوع قطبی است.
برای مثال، در مولکول آب، دو پیوند کووالانسی اکسیژن هیدوژن وجود دارد که قطبیت پیوند از هیدروژن به سمت اکسیژن است. به دلیل خمیده بودن مولکول آب، برایند ممان دو قطبی این دو پیوند در سمت اکسیژن بیشتر خواهد بود و این مولکول قطبی است.
در مثالی دیگر، مولکول کربن دی اکسید را بررسی میکنیم. این مولکول از دو پیوند کربن اکسیژن تشکیل شده است که اکسیژن در آن الکترونگاتیوی بیشتری دارد و جهت دو قطبی به سمت اتمهای اکسیژن است. اما به دلیل خطی بودن مولکول کربن دی اکسید، برآیند ممانهای دو قطبی یکدیگر را خنثی میکنند و مولکول در حالت کلی غیر قطبی است.
در جدول زیر برخی از ترکیبات شیمیایی قطبی به همراه فرمول شیمیایی آنها ارائه شده است.
| نام ترکیب شیمیایی قطبی | فرمول شیمیایی |
| آب | |
| آمونیاک | |
| هیدروژن فلوئورید | |
| اتانول | |
| استون | |
| کلروفرم | |
| گوگرد دی اکسید | |
| اسید فرمیک | |
| اسید نیتریک | |
| آب اکسیژنه (هیدروژن پراکسید) |
ترکیبات شیمیایی کووالانسی غیرقطبی
ترکیبات شیمیایی کووالانسی میتوانند غیرقطبی باشند. در این ترکیبات، اختلاف الکترونگاتیوی بین اتمهای تشکیل دهنده ترکیب، صفر یا خیلی کم است. برای مثال، ترکیبات شیمیایی دو اتمی یا چند اتمی جور هسته، که نوع اتمهای سازنده آنها یکسان است، اختلاف الکترونگاتیوی برابر صفر دارند و ناقطبی هستند. همچنین در برخی از موارد برایند ممانهای دو قطبی همدیگر را خنثی میکنند که باعث ناقطبی شدن مولکول خواهد شد.
برای مثال، مولکول کربن دی اکسید را بررسی میکنیم. این مولکول از دو پیوند کربن اکسیژن تشکیل شده است که اکسیژن در آن الکترونگاتیوی بیشتری دارد و جهت دو قطبی به سمت اتمهای اکسیژن است. اما به دلیل خطی بودن مولکول کربن دی اکسید، برآایند ممانهای دو قطبی یکدیگر را خنثی میکنند و مولکول در حالت کلی غیر قطبی است.
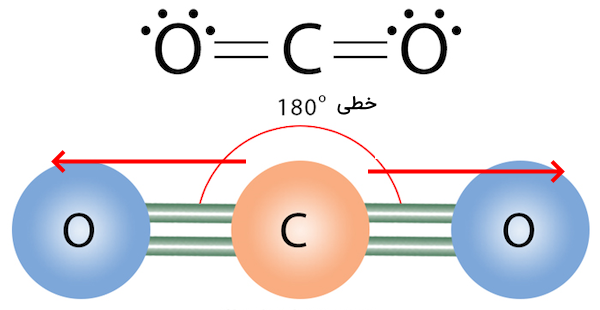
روش دیگری نیز برای بررسی قطبیت پیوندهای کووالانسی و تشخیص نوع ترکیب شیمیایی وجود دارد. در این روش که برای مولکولهای دو اتمی دقیق است، اختلاف الکترونگاتیوی بین دو اتم دو سر پیوند محاسبه میشود. اگر اختلاف الکترونگاتیوی اتمها به شکل زیر باشد، میتوان قطبی یا ناقطبی بودن این ترکیبات را تشخیص داد.
| اختلاف الکترونگاتیوی | نوع ترکیب شیمیایی |
| صفر | کووالانسی غیرقطبی |
| کمتر از ۰٫۴ | کووالانسی غیر قطبی |
| بین ۰٫۴ تا ۱٫۷ | کووالانسی قطبی |
| بیش از ۱٫۷ | یونی |
ترکیبات شیمیایی یونی
ترکیبات کووالانسی که در قسمت قبل توضیح داده شدند، از اتم اهای خنثی تشکیل میشوند. در اتمهای این ترکیبات، تعداد پروتونها و الکترونها برابر است. برخی از ترکیبات شیمیایی از اتصال یونها تشکیل میشوند و ترکیب یونی نام دارند. این یونها در ترکیبات شیمیایی به وسیله پیوندهای یونی به هم متصل میشوند. یونها ترکیباتی هستند که از اضافه شدن یا از دست دادن الکترون به عناصر تشکیل شدهاند.
برای مثال، هالوژنها همواره با از دست دادن یک الکترون، آنیون یک بار منفی تولید میکنند. همچنین، فلزات قلیایی و فلزات قلیایی خاکی با جذب یک و دو الکترون یه ترتیب یونهای یک و دو بار مثبت تشکیل میدهند. در تصویر زیر تفاوت بین ترکیب کووالانسی هیدروژن و سدیم کلرید را مشاهده میکنید.
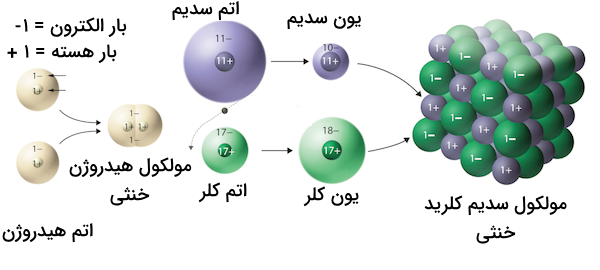
همانطور که مشاهده میکنید در ترکیب کووالانسی الکترونها بین دو اتم و بین دو هسته اتمها به اشتراک گذاشته میشوند. این درحالی است که در ترکیب یونی، کاتیونها و آنیونها به وسیله نیروهای الکترواستاتیک بین بار مثبت و منفی در کنار هم قرار گرفتهاند. در یک ترکیب شیمیایی یونی، کاتیونها و آنیونها به شکلی در فضای سه بعدی در کنار هم قرار میگیرند که بیشترین مقدار جاذبه الکترواستاتیکی و کمترین میزان دافعه الکترواستاتیکی بین یونها برقرار باشد.
تشکیل ترکیب یونی
یکی از مثالهای ترکیبات شیمیایی یونی، ماده سدیم کلرید است که در قسمت قبل به آن اشاره کردیم. در تولید ترکیبات شیمیایی، بسیاری از اتمها تمایل دارند الکترون از دست بدهند یا دریافت کنند. با از دست دادن و دریافت الکترون، عناصر به آرایش الکترونی مشابه نزدیکترین گاز نجیب به آنها در جدول تناوبی میرسند. این پدیده به این علت است که آرایش الکترونی گازهای نجیب پایدارترین حالت آرایش الکترونها در یک اتم است که در آن تمامی زیرلایههای موجود در ماده پر شدهاند. در سدیم کلرید، هر یون سدیم با ۶ یون کلر و هر یون کلر با ۶ یون سدیم احاطه شده است.
تشکیل یونها
همانطور که قبلا اشاره کردیم، اتمها تمایل دارند که با از دست دادن یا دریافت الکترون، به آرایش الکترونی گاز نجیب برسند. بدین ترتیب، اتمهای گروه اول جدول تناوبی ۱ الکترون و اتمهای گروه دوم جدول ۲ الکتورون از دست میدهند. به همین ترتیب، هالوژنها و اتمهای گروه اکسیژن و نیتروژن به ترتیب ۱، ۲ و ۳ الکترون دریافت میکنند. بررسی ساختار تشکیل یون از فلزات عناصر واسطه پیچیدهتر است و برخی از آنها میتوانند بیش از ۱ یون مشخص تشکیل دهند.
در ادامه برخی از یونهای تک اتمی رایج معرفی شدهاند.
| یون | نماد |
| لیتیوم | |
| پتاسیم | |
| سزیم | |
| منیزیم | |
| اسکاندیم | |
| آلومینیوم | |
| نیترید | |
| سولفید | |
| یدید |
ویژگی ترکیبات شیمیایی یونی
ترکیبات یونی به طور کلی خواصی متفاوت اc ترکیبات شیمیایی کووالانسی دارند. ترکیبات یونی جامدات کریستالی سختی تشکیل میدهند که تنها در دماهای بسیار بالا ذوب میشوند و در برابر تبخیر مقاومت میکنند. این خواص به دلیل ساختار مولکولی داخلی ترکیبات یونی است. این ترکیبات در حالت مذاب و محلول جریان الکتریسیته را از خود عبور میدهند و محلول الکترولیت تولید میکنند.
فرمول ترکیبات یونی
به دلیلی اینکه ترکیبات یونی از مولکولهای جداگانه تشکیل نشدهاند، از فرمول تجربی برای نشان دادن ترکیب این ترکیبات استفاده میشود. تمامی ترکیبات، چه کووالانسی و چه یونی، باید از لحاظ بار الکتریکی خنثی باشند. در نتیجه، مقدار بارهای مثبت و منفی در یک ترکیب یونی باید یکدیگر را خنثی کنند. اگر مقدار بار یون مثبت و منفی باهم برابر باشد، نسبت آنها ترکیب یونی برابر و ۱:۱ خواهد بود. اما اگر مقدار بار یون مثبت و منفی باهم برابر نباشد، نسبت یونها باید به شکلی باشد که ترکیب به شکل کلی خنثی باشد.
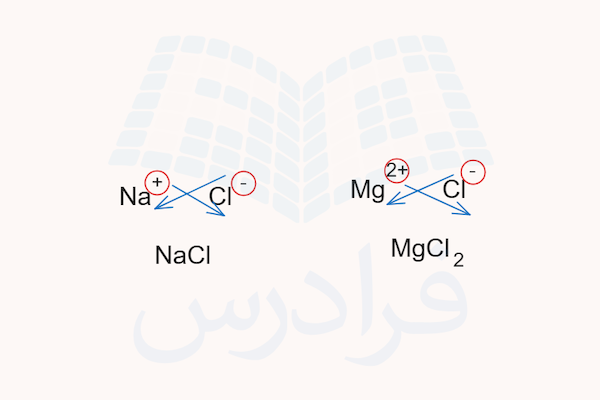
برای مثال، در ترکیب سدیم کلرید، بار یون کلر ۱- و بار یون سدیم ۱+ است و در نتیجه فرمول شیمیایی این ترکیب NaCl خواهد بود. اما در ترکیب یونی منیزیم کلرید، بار یون منیزیم ۲+ و بار یون کلر ۱- است پس نسبت یون منیزیم و کلر ۲:۱ خواهد بود و بدین ترتیب دو بار ۱- و یک بار ۲+ خواهیم داشت و فرمول تجربی آن خواهد بود.
فرمول ترکیبات یونی دوتایی
ترکیبات یونی که تنها از دو عنصر تشکیل شدهاند و یکی از آنها آنیون و دیگری کاتیون است، ترکیبات یونی دوتایی نام دارند. یکی از انواع ترکیبات شیمیایی یونی دوتایی، منیزیم کلرید است که به عنوان منعقد کننده در تولید توفو از خمیر سویا استفاده میشود. برای ترکیبات یونی دوتایی، زیروندهای مواد در فرمول تجربی را میتوان با جابه جا کردن بار یونها به دست آورد. برای مثال، به تصویر زیر دقت کنید.
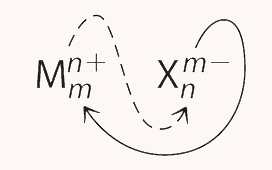
در این روش مقدار صحیح بار آنیون و کاتیون بدون علامت به عنوان زیروند کاتیون و آنیون قرار گرفته و تعداد این مواد را در ترکیب شیمیایی مشخص میکند. گاهی اوقات برای به دست اوردن فرمول تجربی نیاز است تا دو زیروند به بزرگترین مخرج مشترکشان نقسیم شوند.
برای مثال، به ترکیب اکسید منیزیم دقت کنید.
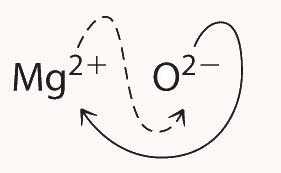
این ترکیب نسبت برابری از منیزیم و اکسیژن دارد و فرمول تجربی آن MgO است.
فرمول یون های چند اتمی
یونهای چند اتمی یونهایی هستند که از ترکیب چند اتم تشکیل شدهاند و بار الکتریکی دارند. با وجود اینکه در این ترکیبات، اتمها به وسیله پیوندهای کووالانسی در کنار هم قرار گرفتهاند، مجموعه این اتمها بار الکتریکی دارد. انواع بسیار زیاد و مخلفی از یونهای چند اتمی وجود دارد. برای مثال، سولفات، آمونیوم، نیترات و هیدروکسید از انواع یونهای چند اتمی هستند.
از ترکیب یونهای چند اتمی مثبت و منفی و اتصال این یونها به وسیله پیوند یونی، ترکیب شیمیایی یونی تشکیل میشود. در ادامه برخی از یونهای چند اتمی به همراه فرمول شیمیایی آنها معرفی شده است.
| یون چند اتمی | فرمول شیمیایی |
| آمونیوم | |
| هیدروکسید | |
| پر اکسید | |
| کربنات | |
| نیترات | |
| سیانید | |
| سولفات | |
| فسفات | |
| کلرات | |
| کرومات |
همان شیوهای که برای تعیین فرمول تجربی ترکیبات یونی دوتایی به کار گرفته شد را میتوان برای ترکیبات یونی چند اتمی نیز استفاده کرد. در این روش، بار آنیون به عنوان تعداد کاتیون و بار کاتیون به عنوان بار آنیون به صورت زیروند قرار میگیرد. برای مثال، از ترکیب یونهای سدیم یک بار مثبت و سولفات دو بار منفی، ترکیب تشکیل میشود.
مثال فرمول ترکیبات یونی
برای درک بهتر فرمول شیمیایی ترکیبات یونی، به مثالهای زیر دقت کنید.
مثال ۱
فرمول تجربی ترکیباتی یونی دوتایی زیر را بنویسید.
- و
- و
- کلسیم و کلر
پاسخ
برای پاسخ به این سوال کافی است این یونها را در کنار هم قرار داده و بارهای آنها را جابهجا کرده و به عنوان زیروند هم قرار داده و در صورت امکان ساده کنیم. در مورد اول، خواهیم داشت:
با قرار دادن این موارد به عنوان زیروند خواهیم داشت:
و با ساده کردن اعداد، فرمول تجربی این ترکیب، GaAs خواهد بود. در مورد دوم نیز همین مراحل را انجام میدهیم.
در مورد سوم، کلسیم بار ۲+ و کلر بار ۱- دارد پس فرمول تجربی آن است.
مثال ۲
فرمول شیمیایی ترکیبات زیر را بنویسید.
- یون سدیم و
- یون پتاسیم و سیانید
- یون کلسیم و هیپوکلریت
پاسخ
در ترکیب اول یون هیدروژن فسفات بار ۲- و یون سدیم بار ۱+ دارد. با جابهجایی این مقادیر فرمول تجربی به دست آمده خواهد بود. در ترکیب دوم، یون پتاسیم بار ۱+ و یون سیانید بار ۱- دارد پس نسبت این ترکیبات ۱:۱ است و فرمول تجربی آن است.
در ترکیب سوم، یون کلسیم بار ۲+ و هیپوکلریت، بار ۱- دارد. در نتیجه یک اتم کلسیم و دو مولکول هیپوکلریت در این ترکیب خواهیم داشت و فرمول شیمیایی آن است.
مقایسه ترکیبات یونی و کووالانسی
در قسمتهای قبل آموختیم ترکیبات یونی و کووالانسی چه ترکیباتی هستند و چه ویژگیهایی دارند. در ادامه، در جدولی ویژگیهای این ترکیبات را مقایسه کردهایم.
| ترکیبات یونی | ترکیبات کووالانسی |
| جامدات سخت | جامد نرم، مایع و گاز |
| نقطه ذوب بالا | نقطه ذوب پایین |
| غیرفرار | فرار |
ترکیبات شیمیایی را میتوان از جنبههای مختلفی مانند نوع پیوند، نوع اتمهای تشکیل دهنده و تعداد اتمها در دستههای مختلفی طبقهبندی کرد.
ترکیبات شیمیایی فلزی
ترکیبات شیمیایی فلزی ترکیباتی هستند که در آنها فلزات به وسیله پیوندهای فلزی به هم متصل شدهاند. پیوندهای فلزی بین فلزات رخ میدهند. اگر فلزات متفاوت باشند، به آنها آلیاژ گفته میشود. برنز آلیاژی از مس و قلع است، در حالی که برنج آلیاژی از مس و روی میباشد، و خواص آلیاژها میتواند با تغییر نسبت فلزات مختلف تغییر کند.
در بسیاری از منابع آلیاژها به عنوان ترکیبات شیمیایی شناخته نمیشوند زیرا مولکولها و اتمهای مختلف در آلیاژها نسبت ثابت و معینی ندارند. فلزات همچنین میتوانند در ترکیبات کمپلکس به وسیله پیوند کووالانسی و در ترکیبات یونی به وسیله پیوند یونی ترکیبات شیمیایی تشکیل دهند.
انواع ترکیبات شیمیایی بر اساس نوع اتم ها
ترکیبات شیمیایی را میتوان بر اساس نوع اتمهای به کار رفته در آنها در دو دسته آلی و معدنی بررسی کرد. در ادامه هریک از این موارد را توضیح میدهیم.
ترکیبات شیمیایی آلی
ترکیبات شیمیایی که از ترکیب اتمهای کربن و هیدروژن تشکیل شده باشند، ترکیبات شیمیایی آلی هستند. نام دیگر این دسته از ترکیبات، هیدروکربن است. این دسته از ترکیبات، از نوع ترکیبات کووالانسی هستند.
فرمول ترکیبات شیمیایی آلی
روش نوشتن فرمول ترکیبات آلی به این شکل است که ابتدا نماد عنصر کربن نوشته شده و سپس تعداد آن به شکل زیروند پس از آن قرار میگیرد. پس از کربن هیدروژن تعداد آن نوشته میشود و سپس باقی عناصر به ترتیب الفبای انگلیسی نوشته میشوند. برای مثال، ترکیب شمیایی متانول (متیل الکل) که از یک اتم کربن، ۴ اتم هیدروژن و یک اتم اکسیژن تشکیل شده است، به شکل زیر نوشته میشود.
برای درک بهتر فرمول شیمیایی ترکیبات یونی به مثالهای زیر دقت کنید.
مثال ۱
فرمول شیمیایی ترکیبی که از یک اتم کربن، یک اتم هیدروژن و سه اتم کلر تشکیل شده است را بنویسید.
پاسخ
ابتدا اتم کربن و تعداد آن، سپس هیدروژن و سپس کلر را نوشته و تعداد آنها را به شکل زیروند زیر آنها قرار میدهیم. فرمول شیمیایی ذکر شده به شکل است.
مثال ۲
تری متیل آمین یکی از عوامل تولید بوی ماهی فاسد شده است. فرمول ساختاری فشرده آن به شکل (CH3)3N است. فرمول شیمیایی آن را بنویسید.
پاسخ
ابتدا نوع مولکول را تشخیص میدهیم. این ماده از سه اتم کربن، ۹ اتم هیدروژن و یک اتم نیتروژن تشکیل شده است. ساختار اصلی این مولکول از اتمهای کربن و هیدروژن تشکیل شده است و یک مولکول آلی است. برای نوشتن فرمول شیمیایی آن، ابتدا اتم کربن، سپس هیدروژن و سپس نیتروژن را مینویسیم. فرمول شیمیایی تری متیل آمین به شکل است.
ترکیبات شیمیایی معدنی
ترکیباتی که قسمت اصلی آنها را عناصری بجز کربن و هیدروژن تشکیل داده است، با نام ترکیبات معدنی شناخته میشوند. این ترکیبات معمولا از پیوندهای کووالانسی و یونی در کنار هم تشکیل شدهاند.
فرمول شیمیایی ترکیبات معدنی
در ترکیبات معدنی، فرمول شیمیایی به شکلی نوشته میشود که ابتدا نماد عنصری که در جدول تناوبی عناصر نزدیکتر به سمت چپ جدول است نوشته میشود. برای مثال، فرمول شیمیایی کربن دی اکسید و گوگرد هکزا فلوئورید به ترتیب و است.
در ترکیبات معدنی که عناصر آنها در یک گروه از جدول تناوبی قرار گرفتهاند، نماد عنصری که پایینتر قرار گرفته است ابتدا نوشته میشود. برای مثال فرمول شیمیایی کلر فلوئورید به شکل است. نکته دیگری که در مورد ترکیبات معدنی وجود دارد این است که هیدروژن معمولا آخرین عنصری است که نماد آن در فرمول شیمیایی ترکیب نوشته میشود. برای مثال، فرمول شیمیایی ترکیبات آمونیاک و سیلان به ترتیب به شکل و نوشته میشود.

ترکیباتی نیز وجود دارند که فرمول شمیایی آنها قبل از تعیین شدن قوانین ذکر شده، در بین دانشمندان رایج بوده است و به همان شکل استفاده میشود. برای مثال، فرمول شیمیایی آب به شکل نوشته میشود و به شکل نوشته نمیشود. همچنین، در فرمول شیمیایی اسیدهای معدنی، اول عنصر هیدروژن و سپس باقی عناصر نوشته میشود. اسید سولفوریک با فرمول شیمیایی و اسید نیتریک با فرمول شیمیایی از این نوع هستند.
مثال فرمول ترکیبات شیمیایی
برای درک بهتر آنچه تا اینجا در مورد ترکیبات شیمیایی و فرمول آنها آموختیم، به مثال های زیر توجه کنید.
مثال ۱
فرمول شیمیایی سولفور مونوکلرید ( که با نام دی سولفور کلرید نیز شناخته میشود) را بنویسید. فرمول ساختاری فشرده این ترکیب به شکل ClSSSCl است.
پاسخ
بای پاسخ به این سوال ابتدا عناصر داده شده در فرمول ساختار فشرده را شناسایی کرده و تشخیص میدهیم که این مولکول آلی است یا معدنی. سپس با توجه به قوانین نامگذاری ترکیبات آلی یا معدنی، عناصر و زیروندهای آنها را مینویسیم.
هر مولکول سولفور مونوکلرید از دو اتم گوگرد و دو اتم کلر تشکیل شده است. به دلیل اینکه این مولکول به شکل عمده از کربن و هیدرون تشکیل نشده است، یک ترکیب معدنی است. گوگرد در جدول تناوبی در سمت چپ مولکول کلر قرار دارد پس در فرمول شیمیایی ابتدا گوگرد و سپس کربن را نوشته و عدد ۲ را به عنوان زیروند برای هر اتم قرار میدهیم. بدین ترتیب، فرمول شیمیایی آن به شکل خواهد بود.
مثال ۲
اتیلن گلیکول یکی از مواد اصلی تشکیل دهنده ضدیخ است. ساختار فرمولی فشرده این ماده به شکل HOCH2CH2OH است.. فرمول شیمیایی آن را بنویسید.
پاسخ
ابتدا نوع مولکول را تشخیص میدهیم. این مولکول به شکل عمده از مولکولهای کربن و هیدروژن تشکیل شده است پس یک مولکول آلی است. برای نوشتن فرمول، ابتدا اتم کربن را مینویسیم، سپس هیدروژن و تعداد آن را مشخص میکنیم و در نهایت اکسیژن را مینویسیم. در این ترکیب شش اتم هیدروژن، دو اتم کربن و دو اتم اکسیژن وجود دارد. فرمول شیمیایی اتیلن گلیکول است.
مثال ۳
فرمول شیمیایی مادهای که فرمول ساختار فشرده آن به شکل H2NCH2CH2CH2CH2NH2 است را بنویسید.
پاسخ
این مولکول یک مولکول آلی است که در فرمول شیمیایی آن ابتدا اتم کربن، سپس هیدوژن و سپس نیتروژن مشخص میشود. این ترکیب از ۴ اتم کربن، ۱۲ اتم هیدروژن و ۲ اتم نیتروژن تشکیل شده است پس فرمول شیمیایی آن به شکل خواهد بود.
نمایش ترکیبات شیمیایی
فرمول شیمیایی ترکیبات تنها نوع و تعداد اتمهای موجود در این ترکیبات را مشخص میکند. از طرف دیگر، فرمول ساختاری ترکیبات نمایشی از ترکیبات شیمیایی است که مشخص میکند اتمها به چه شکلی به هم متصل شدهاند و در برخی از موارد، شکل نقریبی این ترکیبات را در فضای سه بعدی نیز مشخص میکند.
دانستن فرمول ساختاری یک ترکیب شیمیایی به شیمیدانان این امکان را میدهد که یک شکل سه بعدی از مولکول را نمایش دهند و این شکل مشخص میکند که ترکیبات شیمیایی چه ویژگیهای فیزیکی و شیمیایی از خود نشان میدهند.
فرمول ساختاری ترکیبات، مرتبه پیوند شیمیایی (یگانه، دوگانه و سهگانه) را نیز مشخص میکند. برای مثال، شکلهای زیر نمایش فرمول ساختاری وگلوله و میله ترکیباتی با مراتب پیوند مختلف را نشان میدهد.
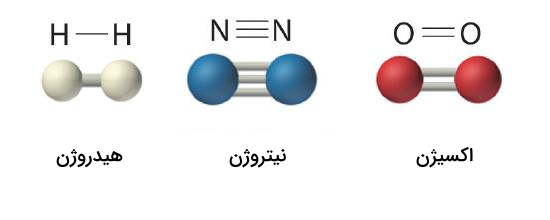
فرمول ساختاری ترکیب هیدروژن به شکل H-H نوشته میشود که نمایش دهنده پیوند یگانه کووالانسی بین اتمهای هیدروژن است. به همین ترتیب، دو خط موجود بین اتمهای اکسیژن در ترکیب شیمیایی آن، نشاندهنده پیوند دوگانه، و سه خط بین اتمهای نیتروژن در ترکیب آن، نشاندهنده پیوند سهگانه هستند.
شکل فضایی ترکیبات شیمیایی
فرمول ساختاری به شکل دو بعدی برای موکلولها و ترکیبات شیمیایی تنها شکل اتصال اتمهای آنها را نشان میدهد. به فرمول ساختاری مولکولهای آب، آمونیاک و متان توجه کنید.
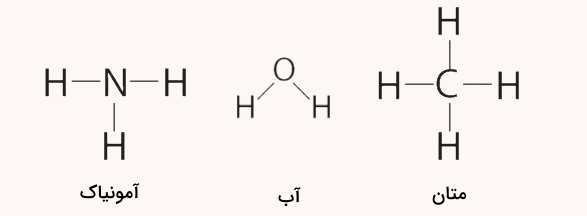
مولکول آب معمولا به شکل خمیده رسم میشود و فرم مولکولهای آمونیاک و متان نیز معمولا به شکل بالا نمایش داده میشوند اما این شکلها برای آمونیاک و متان، ساختار آنها و زوایای بین پیوندهای آنها در فضا را مشخص نمیکند. پیشنهاد میکنیم برای آشنایی بیشتر ویژگیهای ترکیبات شیمیایی در فضا، مطلب شیمی فضایی مجله فرادرس را مطالعه کنید.
با اطلاع از تعداد پیوندها و جفت الکترونهای غیر پیوندی اتمها میتوان فرمول ساختاری آنها را نزدیک به شکلی که در فضا دارند رسم کرد. برای این کار از ساختارهای گوه و خط چین برای نمایش پیوندهای جلو و پشت صفحه مولکول استفاده میشود. برای مثال به شکلهای زیر دقت کنید. در این شکلها، پیوندهایی که به شکل خط رسم شدهاند صفحه مولکول را تشکیل میدهند.
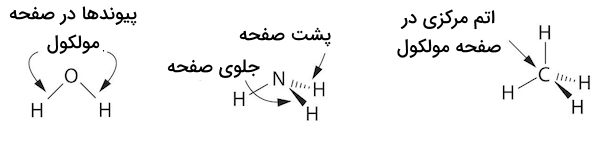
همچنین، شکلهای دیگری نیز برای نمایش ساختار مولکول ترکیبات شیمیایی استفاده میشود. برای مثال، ساختار گوی و میله و مدل فضا پرکن از این نوع نمایشها هستند. این ساختارها را برای سه مولکول آب، آمونیاک و متان در تصویر زیر مشاهده میکنید. مدل گوی و میله تنها زمانی استفاده میشوند که بخواهیم ساختار سه بعدی یک مولکول را مشخص کنیم. مدل فضاپرکن نیز زمانی استفاده میشود که بخواهیم اندازه نسبی اتمها را در ترکیبات تصور کنیم.
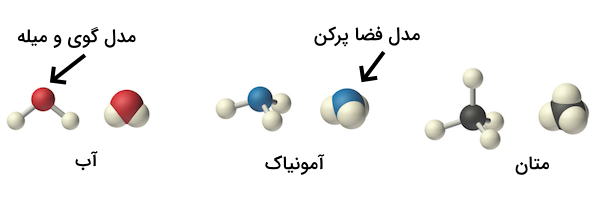
با وجود اینکه فرمول ساختاری، مدل گوی و میله و مدل فضا پرکن همگی اطلاعات بسیار مفیدی را راجع به ساختار مولکولی ترکیبات شیمیایی مشخص میکنند، تهیه و رسم هر یک زمان و تلاش زیادی میطلبد. به همین دلیل، شیمیدانها معمولا تنها از فرمول ساختاری فشرده استفاده میکنند که تنها اتمها را با خطوط سادهای در کنار هم رسم میکند. گروههای مولکولی چندتایی در پرانتز نوشته شده و زیروند آنها تعداد این گروهها را در مولکول مشخص میکند. برای مثال، فرمول ساختاری فشرده متانول به شکل است که مشخص میکند مولکول یک واحد دارد که مشابه یکی از مشتقات متان است.
یادگیری شیمی دبیرستان با فرادرس
در این مطلب آموختیم مفهوم ترکیبات شیمیایی چیست و چگونه میتوان فرمول شیمیایی آنها را نوشت. برای درک بهتر ترکیبات شیمیایی نیاز است با مفاهیمی چون جرم مولی، ساختار لوویس، نام عناصر جدول تناوبی و عدد اکسایش آشنا شویم. پیشنهاد می کنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در مورد این ترکیبات دسترسی داشته باشید.
تفاوت ترکیبات شیمیایی و عناصر
عناصر خالص ترین نوع مواد هستند. این مواد تنها از یک نوع اتم تشکیل شدهاند اما ترکیبات شیمیایی از اتصال دو یا چند اتم شکی می شوند. مقایسه جزسیتر تفاوتهای عناصر و ترکیبات شیمیایی در جدول زیر ارائه شده است.
| عنصر | ترکیب شیمیایی |
| تعریف: شامل یک نوع اتم | تعریف: شامل چند عنصر |
| مثال: سدیم | مثال: سدیم کلرید |
| حالت: مایع، جامد یا گاز | حالت: مایع، جامد یا گاز |
| تعداد: حدود ۱۱۸ عنصر | تعداد: بیشمار |
| انواع: فلز، نافلز و شبهفلز | انواع: آلی، معدنی، اسیدی و … |
| خواص: منحصر به فرد | خواص: وابسته به عناصر |
| ساختار اتمی: تنها یک اتم | ساختار اتمی: دو یا چند عنصر |
| تقسیمپذیری: تقسیمناپذیر | تقسیمپذیری: تقسیمپذیر |
جمعبندی
در این مطلب از مجله فرادرس آموختیم مفهوم ترکیبات شیمیایی چیست. این مواد که از اتصال عناصر مختلف به هم تشکیل شدهاند میتوانند در گروههای مختلفی از جمله ترکیبات یونی و کوالانسی و ترکیبات آلی و معدنی جای بگیرند. ترکیبات یونی از یونهای مثبت و منفی تشکیل شدهاند که در آرایشهای منظم به دلیل نیروهای الکترواستاتیکی کنار هم قرار میگیرند و معمولا جامداتی سخت با نقطه ذوب بالا هستند. در مقابل، ترکیبات کووالانسی از مولکولهایی با پیوندهای اشتراکی بین اتمها ساخته میشوند و میتوانند در دمای اتاق به شکل گاز، مایع یا جامد وجود داشته باشند.
ترکیبات آلی عمدتا از کربن و هیدروژن ساخته شدهاند و ترکیبات معدنی شامل سایر عناصر هستند. فرمول تجربی و مولکولی اطلاعاتی درباره نوع و تعداد اتمها در یک ترکیب میدهند. یونها میتوانند تکاتمی یا چنداتمی باشند و بار آنها معمولا با موقعیتشان در جدول تناوبی قابل پیشبینی است.
source
