هیدراتها ترکیباتی مولکولی و اغلب کریستالی هستند که در ساختار شیمیایی آنها مولکولهای آب وجود دارد. آب موجود در این ترکیبات به شکل شیمیایی و با نسبت استوکیومتری مشخصی با مولکول اصلی ترکیب میشود. این ترکیب شدن گاهی توسط پیوند کوالانسی و گاهی توسط پیوند هیدروژنی اتفاق میافتد. در این مطلب از مجله فرادرس میآموزیم مفهوم ترکیبات هیدرات چیست و چه ویژگیهایی دارند.

در ابتدای این مطلب میآموزیم هیدرات چیست و این ترکیبات چگونه نامگذاری میشوند. سپس، فرمول شیمیایی عمومی این ترکیبات را بررسی میکنیم. در ادامه، انواع مولکولهای هیدرات را نام برده و فرآیند تشکیل این مولکولها را توضیح میدهیم. سپس خواص این ترکیبات را بررسی کرده و مثالهایی از انواع هیدرات را میآموزیم. در نهایت به کاربرد این ترکیبات در صنایع و فرآیندهای گوناگون میپردازیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با این ترکیبات آشنا شوید.
هیدرات چیست؟
هیدراتها (Hydrates) ترکیباتی هستند که مقادیر استوکیومتری از مولکول آب را در ساختار مولکولی خود دارند. این بدین معنی است که مقادیر آب در این ترکیبات به اندازهای زیاد است که میتواند با مقدار اتمهای اصلی ساختار مولکولی مقایسه و محاسبه شود. به فرآیندی که طی آن یک مولکول آبدار میشود، هیدراتاسیون گفته میشود.
فرمول شیمیایی هیدراتها با نوشتن فرمول شیمیایی ترکیب، سپس نقطه و پس از آن تعداد مولکول آب با عدد و فرمول مولکول آب () نشان داده میشود. فرم کلی مولکولهای هیدرات به شکل زیر است.
در این فرم، AB فرمول شیمیایی ماده به صورت خشک و باقی فرمول شیمیایی مولکول آب به همراه تعداد آن است. برای مثال، فرمول شیمیایی ماده منیزیم سولفات ۷ آبه به شکل زیر است.
فرمول بالا مشخص میکند که به ازای هر مولکول منیزیم سولفات، ۷ مولکول آب در ساختار ماده وجود دارد. برای مثال، از مواد معدنی که به فرم هیدرات در طبیعت وجود دارند میتوان به سنگ گچ (سولفات کلسیم دو آبه)، بوراکس و نمک اپسوم (سولفات منیزیم ۷ آبه) اشاره کرد.

ترکیبات هیدرات میتوانند آب و رطوبت را از محیط اطراف خود جذب کنند و اغلب به عنوان نمگیر در محیطهای مختلف استفاده میشوند. مقدار پایداری هیدراتهای مختلف با توجه به طبیعت شیمیایی آنها، دمای آنها و رطوبت نسبی آنها اگر در معرض هوا قرار بگیرند سنجیده میشود.
یادگیری شیمی دبیرستان با فرادرس
برای درک بهتر اینکه هیدرات چیست، ابتدا باید با مفاهیمی چون مولکول و ساختارهای کوئوردیناسی آشنا شویم. همچنین شناخت مسائلی چون پیوند شیمیایی، پیوند یونی و نیروهای بین مولکولی به ما در درک این مفهوم کمک میکند. پیشنهاد میکنیم برای یادگیری این مفاهیم، به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه هیدرات دسترسی داشته باشید.
نام گذاری ترکیبات هیدرات
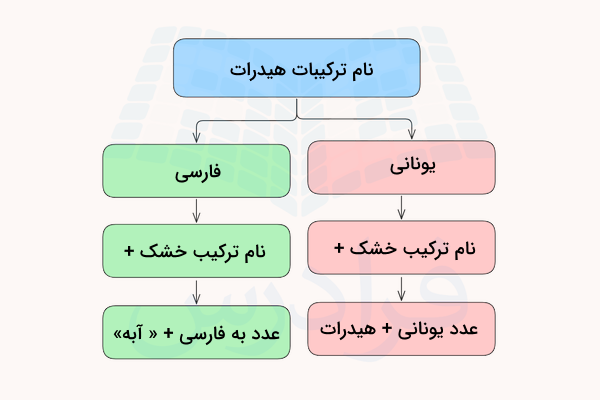
در قسمت قبل آموختیم هیدرات چیست و چگونه نمایش داده میشود. در زبان فارسی، و در شیمی، دو فرم برای اشاره به نام ترکیبات هیدرات وجود دارد. این دو فرم به شکل زیر هستند.
- نام ترکیب شیمیایی + تعداد مولکول آب به فارسی + کلمه «آبه»
- نام ترکیب شیمیایی + تعداد مولکول آب به یونانی + کلمه «هیدرات»
تعداد مولکولهای آب در زبان یونانی، طبق جدول زیر نامگذاری میشوند.
| تعداد | نام |
| ۰٫۵ | همی |
| ۱ | مونو |
| ۱٫۵ | سسکی |
| ۲ | دی |
| ۳ | تری |
| ۴ | تترا |
| ۵ | پنتا |
| ۶ | هگزا |
| ۷ | هپتا |
| ۸ | اوکتا |
| ۹ | نونا |
| ۱۰ | دکا |
| ۱۱ | آندکا |
| ۱۲ | دودکا |
| ۱۳ | تری دکا |
| ۱۴ | تترادکا |
برای مثال، سولفات منیزیم اشاره شده در قسمت قبل را میتوان با نامهای «سولفات منیزیم ۷ آبه» و «سولفات منیزیم هپتا هیدرات» مشخص کرد. در ادامه، نام و فرمول شیمیایی برخی از ترکیبات هیدرات ارائه شده است.
| فرمول شیمیایی | نام فارسی | نام یونانی |
| مس (اا) سولفات پنج آبه | مس (اا) سولفات پنتا هیدرات | |
| کلرید کبالت (اا) شش آبه | کلرید کبالت (اا) هگزا هیدرات | |
| بلریم سولفات چهار آبه | بلریم سولفات تترا هیدرات | |
| سدیم کربنات ده آبه | سدیم کربنات دکا هیدرات | |
| سدیم تترا بورات ده آبه (بوراکس) | سدیم تترا بورات دکا هیدرات |
انهیدرات چیست؟
در قست قبل آموختیم هیدرات چیست و چگونه نامگذاری میشوند. انهیدراتها (Anhydrous) ترکیباتی هستند که درون آنها مولکول آب به دام نیافتاده است. در مورد ترکیبات هیدرات، زمانی که مولکول آنها به صورت بدون آب استفاده میشود گفته میشود ماده به فرم خشک یا انهیدرات یا انهیدوز است.
ترکیبات خشک معمولا بدون پسوند نامیده میشوند اما گاهی نیز با پسوندهای خشک یا انهیدروس به آنها اشاره میشود. برای مثال، سولفات منیزیم خشک با نام سولفات منیزیم انهیدروس نیز شناخته میشود.
فرمول هیدرات
در قسمت قبل آموخیتم هیدرات چیست. برای محاسبه این که در ترکیبات هیدرات چه مقدار آب وجود دارد، باید جرم فرم هیدرات مولکول و فرم انهیدروس آن مقایسه شود. با کسر جرم ماده خشک از ماده هیدرات، میتوانیم جرم آب موجود در مولکول را به دست آورده و با استفاده از جرم مولی آب (۱۸ گرم بر مول) تعداد مول یا مولکول آب ترکیب را به دست آوریم.
این محاسبات به شکل زیر نمایش داده میشود.
برای درک بهتر روش انجام این محاسبات، به مثال زیر دقت کنید.
مثال ۱
یک نمونه از کلرید کبالت (اا)، ۱۱۹ گرم وزن دارد. فرم خشک این نمونه جرمی برابر ۶۵ گرم دارد. اگر جرم مولی مولکول آب برابر ۱۸٫۰۲ گرم بر مول و جرم مولی کلرید کبالت (اا) برابر با ۱۲۹٫۸۴ گرم بر مول باشد، فرمول این ترکیب آبدار چیست؟
پاسخ
برای پاسخ به این سوال نیاز است ابتدا جرم ترکیب بدون آب را از ترکیب نمونه آبدار کم کنیم.
$$119,g,_{text{Hydrous solid}}-65,g,_{text{Anhydrous solid}}=54,g,_{H_2O}$$
این مقدار به دست آمده، جرم آب تبخیر شده از مولکول است و میتوان با استفاده از آن، تعداد مول مولکول آب را به دست آورد.
$$n_{H_2O}=frac{54,g,_{H_2O}}{18.02frac{g}{mol}_{H_2O}}$$
$$n_{H_2O}=3,mol,_{H_2O}$$
همچنین، با تقسیم جرم کلرید کبالت خشک بر جرم مولی آن، تعداد مول کلرید کبالت خشک را به دست میآوریم.
$$n_{CoCl_2}=frac{65,g,_{CoCl_2}}{129.84frac{g}{mol}_{CoCl_2}}$$
در نهایت، با تقسیم تعداد مول آب به تعداد مول کلرید کبالت خشک، میتوانیم نسبت این ترکیبات را در مولکول آبدار به دست آوریم.
$$x=frac{3,mol,_{H_2O}}{0.5,mol,_{CoCl_2}}$$
نسبت بالا نشان میدهد که به ازای هر مول کلرید کبالت، ۶ مول آب در ترکیب شیمیایی نمونه وجود دارد. در نتیجه، فرمول مولکولی این ترکیب به شکل زیر است.
مثال ۲
نمونه ای از نمک کلرید نیکل (اا) آبدار به وزن ۰٫۴۷ گرم، با حرارت دیدن، به ۰٫۲۵۶ گرم تبدیل شده است. اگر جرم مولی کلرید نیکل (اا) برابر با ۱۲۹٫۶ گرم بر مول باشد، فرمول مولکولی ترکیب آبدار را بیابید.
پاسخ
مانند سوال قبل، ابتدا با کم کردن جرم ماده خشک از آبدار، جرم آب از دست رفته را به دست میآوریم.
سپس تعداد مولکولهای آب را با استفاده از جرم مولی آب و این جرم به دست آمده به دست میآوریم.
همچنین، تعداد مولهای نمک کلرید نیکل خشک را با استفاده از جرم مولی و جرم داده شده در صورت سوال برای نمک خشک به دست میآوریم.
در نهایت، با تقسیم تعداد مول آب به نمک خشک میتوانیم نسبت این ترکیبات و فرمول مولکولی ترکیب آبدار را به دست آوریم.
پس فرمول مولکولی این ترکیب به شکل زیر است و به ازای هر مول کلرید نیکل، ۶ مول آب در این ترکیب وجود دارد.
اندازهگیری مقدار آب موجود در مواد مختلف در آزمایشگاه به روشهای مختلفی انجام میشود. رایجترین این روشها، توزین اولیه، حرارت دادن به ماده در محیطی خشک مانند آون آزمایشگاه و توزین نهایی ماده است. پیشنهاد میکنیم برای آشنایی با سایر روشها، فیلم آموزش آزمایشهای شیمیایی برای اندازهگیری آب در مواد فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
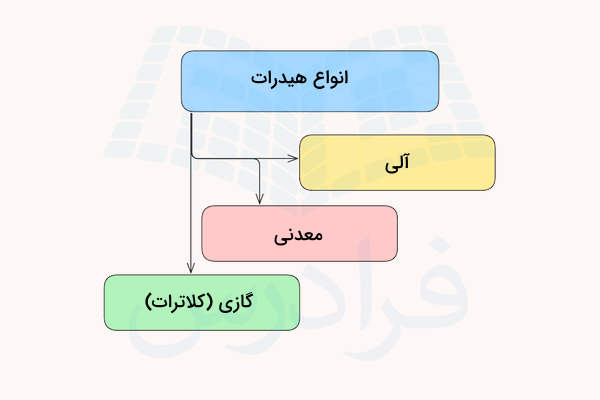
انواع هیدرات
هیدراتها میتوانند به سه فرم هیدرات معدنی، هیدرات آلی و هیدرات گازی وجود داشته باشند. در ادامه، هریک از این موارد را توضیح میدهیم.
هیدرات معدنی
هیدراتهای معدنی ترکیبات هیدراتی هستند که از ترکیبات یونی فلزی تشکیل شدهاند. در این ترکیبات، مولکولهای آب به سستی به ترکیب متصل شده است و با حرارت دادن به این ترکیبات میتوان مولکولهای آب را از آنها خارج کرد. بیشتر هیدراتهای موجود در زمین، از نوع هیدراتهای معدنی هستند. در بسیاری از موارد این ترکیبات هیدرات، ترکیبات کوئوردیناسیونی هستند.
در مواردی که به جای عنصر هیدروژن، ماده معدنی دارای ایزوتوپ دوتریم در مولکول آب باشد، به ان دوترات گفته میشود.
مثال هیدرات معدنی
از انواع هیدراتهای معدنی میتوان به سولفات مس، کلرید کبالت، سولفات سدیم ۶ آبه و سنگ گچ اشاره کرد. در ادامه این مثالها را بررسی میکنیم.
سولفات مس (اا)
سولفات مس (II) میتواند درجههای هیدراتاسیون مختلفی داشته باشد. این بدین معنی است که این ماده میتواند تعداد مختلفی از مولکولهای آب را در ساختار شیمیایی خود جذب کند. بیشترین تعداد مولکولی که میتواند در ساختار این مولکول به دام بیافتد، ۵ عدد است. مولکولهای آب این ترکیب در اثر حرارت دادن از ساختار آن خارج میشوند. فرمول مولکولی این ترکیب به شکل زیر است.
با حرارت دادن فرم ۵ آبه این مولکول، یک مولکول دو آبه و سه آبه از این مولکول تشکیل میشوند. با ادامه حرارت، سولفات مس (اا) یک آبه نیز میتواند تشکیل شود. برای خارج کردن آخرین مولکول آب از این ترکیب، باید آن را تا دمایی بیش از ۲۰۰ درجه سانتیگراد حرارت داد.

فرمهای آبدار این مولکول به دلیل آبپوشی یونهای مس آبی رنگ هستند و فرم خشک آن رنگی سفید دارد. به دلیل توانایی این مولکول در تولید هیدراتهای مختلف و توانایی نمگیری فوق العاده آن، از آن برای جذب آب در محلولهای مختلف استفاده میشود.
کلرید کبالت (اا)
فرم خشک مولکول کبالت (اا) کلرید به شدت نمگیر است. به دلیل توانایی این مولکول در جذب آب، میتواند حتی رطوبت موجود در هوا را نیز جذب کند. این فرآیند موجب تولید هیدراتهایی از این نمک میشود. رایجترین نوع این نمکها، کلرید کبالت (اا) شش آبه و پس از آن کلرید کبالت (اا) دو آبه است.

همچنین، این ماده میتواند در فرمهای مختلف رنگهای متفاوتی را از خود نشان دهد. فرم خشک این نمک آبیرنگ، فرم دو آبه آن صورتی- قرمز و فرم شش آبه آن قرمز پررنگ است.
سدیم سولفات
نمک سدیم سولفات دو فرم هیدرات رایج دارد. یکی از آنها فرم ۷ آبه است که در آن ۵ مولکول آب در ساختار مولکول وجود دارد و فرم دیگر آن ده آبه است که هر ده مولکول آب درون ساختار مولکول قرار گرفتهاند. فرم خشک این نمک در طبیعت به عنوان یکی از سنگها کمیاب وجود دارد. سدیم سولفات ده آبه با نام نمک گلوبر شناخته میشود.
این ماده به شکلی گسترده در تولید شیشه، کاغذ، مواد شوینده لباس و سودا استفاده میشود. از نمک گلوبر در مواد اولیه ضروری تولید رنگ دانه لاجوردی استفاده میشود. به علاوه، این ماده اثری درمانی بر سیستم گوارش دارد.
سنگ گچ
یکی از پرکاربردترین نمکهای هیدرات معدنی سنگ گچ (Gypsum) است. این ماده یک ماده معدنی متشکل از فرمهای آبدار نمک کلسیم سولفات است. سنگ گچ کریستالی، فرم دی هیدرات این نمک است. تحت شرایط استاندارد، این ماده طی فرآیند تبخیر رودها و رودخانهها در دمای کمتر از ۴۲ درجه سانتیگراد تشکیل میشود.
کلسیم سولفات خشک با نام سنگ گچ خشک شناخته میشود. سنگ گچ ساخت و ساز، کلسیم سولفات نیم آبه (همی هیدرات) است. تشکیل فرمهای هیدرات این نمک، به دمایی که سنگ مادر آن در آن تولید و استفاده شده بستگی دارد. سنگ گچی که در ساختمان سازی استفاده میشود، ترکیبی از چند نمونه سنگ آهک هیدرات است.
کاربردهای این ماده هیدرات بسیار زیاد است. برخی از مهمترین این کاربردها در ادامه نام برده شده است.
- در ساخت و ساز، سنگ گچ در محصولات و مصالح آماده به کار میرود.
- این ماده یکی از مواد تشکیل دهنده مواد نیمه آماده شل، چسبها و … است.
- در پزشکی از این ماده برای ثابت نگه داشتن اندامهایی که استخوان آنها دچار شکستگی شده است، استفاده میشود.
- صنایع مختلفی از این ماده برای ساخت سازهها و مدلهای مختلف استفاده میکنند.
- از این ماده در کشاورزی نیز به عنوان مادهای برای افزودن به کودها استفاده میشود.
هیدراتهای آلی
هیدراتهای آلی با استفاده از واکنشهای هیدراته شدن ترکیبات آلی به دست میآیند. در این واکنشها، مولکول آب با استفاده از واکنشهای شیمیایی به ترکیبات آلی اضافه میشود. در بیشتر این موارد، ساختار مولکول آب شکسته شده و به وسیله پیوندهای شیمیایی قوی به ساختار مولکولهای آلی متصل میشوند.
در برخی موارد نیز، مولکولهای آب بدون شکسته شدن و به شکل مولکولی به این ترکیبات متصل میشوند. برخی از ترکیبات آلی نیز میتوانند مانند هیدراتهای معدنی، مولکولهای آب را به دام بیاندازند بدون اینکه با آنها پیوند شیمیایی برقرار کنند. برای مثال، شکر ترهالوز یکی از این موارد است که به فرم خشک و دی هیدرات وجود دارد. همچنین، کریستالهای پروتئینی حدودا از ۵۰ درصد آب تشکیل شدهاند.
مثال هیدرات آلی
ترکیبات بسیاری هستند که از هیدراته شدن مواد آلی دیگر به وجود آمدهاند. برای مثال، اتانول، فرم هیدرات اتیلن است. معادله واکنش این فرآیند به شکل زیر است.
از دیگر هیدراتهای آلی میتوان به کلرال هیدرات اشاره کرد که میتواند با اضافه شدن آب به مولکول کلرال طی واکنش شیمیایی زیر تولید شود.
برخی از مولکولهای آلی به دلایل تاریخی با نام هیدرات شناخته میشوند. بهعنوان مثال، مولکول گلوکز به شکل و به عنوان یک کربوهیدرات شناخته میشد. اما امروزه میدانیم که ساختار گلوکز بدین شکل بررسی نمیشود.
به علاوه، متانول نیز، گاهی با نام متیل هیدرات یاد میشود که با توجه به فرمول مولکولی متیل هیدرات () و متانول () برداشتی اشتباه است.
هیدراتهای گازی
هیدراتهای گازی که با نام کلاترات نیز شناخته میشوند، ترکیبات گازی هستند که مولکولهای آب در آنها ، مولکول گاز را به دام میاندازند. در این ترکیبات، مولکولهای آب، ساختاری قفس مانند را تشکیل میدهند که به آن میزبان گفته میشود. مولکول گازی که درون این قفس متشکل از مولکولهای آب به دام میافتد با نام مولکول مهمان شناخته میشود.
برخی از گازها مانند متان، اتان، پروپان، استیلن، کلر و کربن دی اکسید و گازهای نجیب میتوانند هیدرات گازی (کلاترات ) تشکیل دهند. کلاتراتهای مولکول گازی متان از رایجترین این ترکیبات هستند. شکل شبیهسازی شده یک کلاترات متان در ادامه آورده شده است.
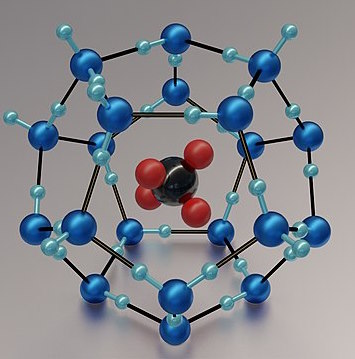
کلاتراتهای متان یکی از دلایل تغییرات اقلیمی سریع در زمین هستند. این مواد با نامهای هیدرات متان و یخ متان نیز شناخته میشوند. این مواد، جامدی از جنس یخ و متان تشکیل میدهند. این مولکولها ساختار کریستالی خاصی دارند و تحت فشار اضافی تولید میشوند. این مواد جامداتی بیبو وسفید رنگ هستند که عموما ظاهری شبیه به یخ دارند.
نکته قابل توجه در این ترکیبات این است که مولکولهای آب و متان در این ترکیبات پیوند شیمیایی برقرار نمیکنند و ۴۶ مولکول آب، اطراف مولکولهای متان مانند قفسی آنها را به دام میاندازند. در سالهای گذشته، منابعی از این ماده در اعماق اقیانوسها کشف شده است.
یکی از نگرانیهایی که در مورد این ترکیب وجود دارد این است که ممکن است با افزایش دما در اثر گرمایش جهانی، این کلاتراتها شکسته شده و گاز متان بسیار زیادی را آزاد کنند که خود باعث افزایش اثر گلخانهای میشود. متان یکی از گازهای گلخانهای است که اثر زیادی روی بالا رفتن دمای زمین دارد. پیشنهاد میکنیم برای آشنایی بیشتر با این نوع گازها، مطلب گازهای گلخانهای مجله فرادرس را مطالعه کنید.
نحوه تشکیل هیدرات
هیدراتها با در معرض رطوبت هوا و آب قرار گرفتن، میتوانند مولکولهای آب را جذب کرده و در ساختار مولکولی خود به دام بیاندازند. تشکیل هیدرات به دو صورت انجام میگیرد که در ادامه توضیح داده شده است.
- مولکول آب میتواند به مرکز فلزی ترکیب متصل شود.
- مولکول آب میتواند درون ساختار کریستالی ترکیب قرار بگیرد.
در ادامه هر یک از این فرآیندهای تشکیل هیدرات را توضیح میدهیم.
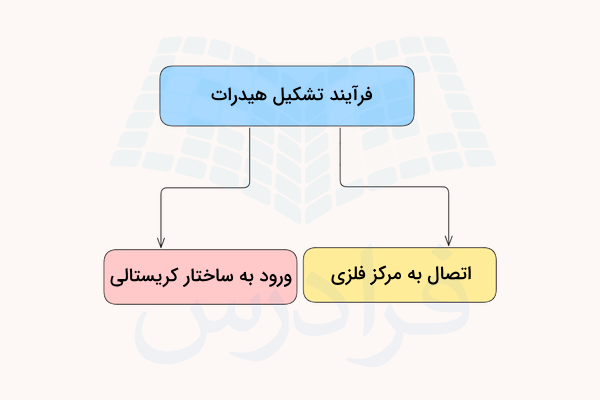
اتصال آب به مرکز فلزی
در ساختار برخی از هیدراتها، مولکول آب مستقیما به مرکز فلزی ترکیب یونی و با پیوند شیمیایی به آن متصل میشود. در این روش، مولکولهای آب، یونهای موجود در ترکیب را احاطه میکنند. به این مولکولهای آب، آب هیدراتاسیون گفته میشود.
برای درک بهتر این فرآیند، مولکول منیزیم سولفات انهیدارات را در نظر بگیرید. ساختار این ترکیب یونی بدون حضور مولکول آب به شکل زیر است.
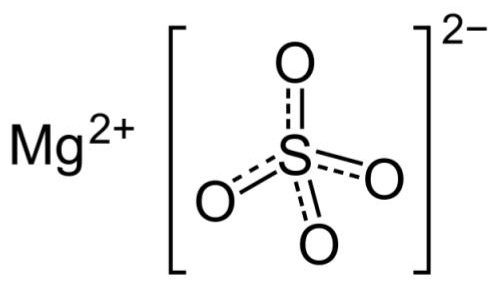
با افزودن آب به این مولکول، مولکولهای آب، یون فلزی منیزیم را احاطه کرده و با آن پیوند شیمیایی تشکیل میدهند و توسط آن جذب میشوند. فرم این ترکیب پس از جذب آب به شکل زیر تبدیل میشود. در این فرآیند، یک کمپلکس فلزی از ترکیب آب (به عنوان لیگاند) و فلز تشکیل شده و یون دیگر آزاد میشود.
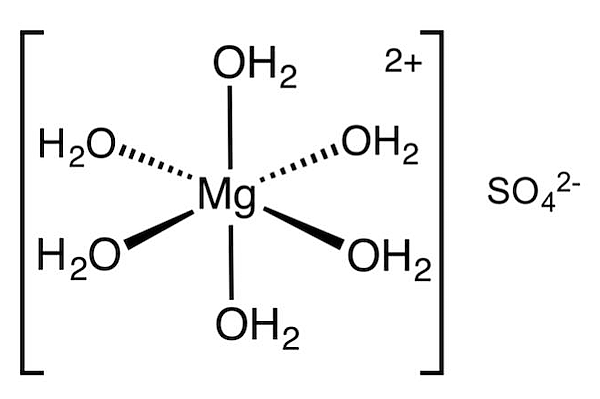
قرارگیری آب در ساختار کریستالی
در فرآیندی دیگر، آب به جای تشکیل پیوند شیمیایی داتیو با مرکز فلزی، به وسیله پیوند هیدروژنی به کل مولکول متصل میشود. معمولا هیدراتها میتوانند هر دو فرم ترکیب با مولکول آب را داشته باشند. به این مولکولهای آب، آب کریستالیزاسیون گفته میشود. برای مثال، به ترکیب سولفات آهن ۷ آبه دقت کنید.
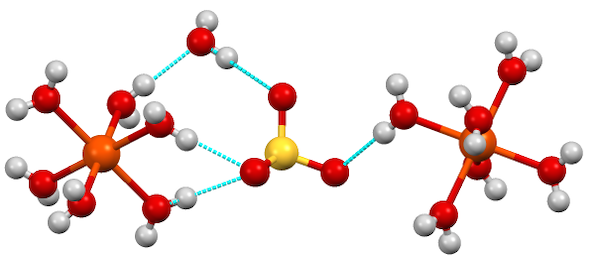
در این ترکیب، مولکولهای آب هم به مرکز فلزی آهن متصل شده و هم بین مولکولهای ترکیب قرار گرفتهاند.
خواص هیدراتها
در بیشتر مواقع میتوان آب ترکیبات هیدرات را با حرارت دادن ترکیب از ساختار مولکول آنها خارج کرد. ساختار و خواص ترکیب خشکی که پس از حرارت دادن به مولکولهای هیدرات باقی میماند، با ترکیب آبدار متفاوت است و حتی ممکن است رنگ متفاوتی داشته باشد.
برای مثال، تصویر زیر، یک نمونه از ترکیب مس (اا) سولفات ۵ آبه (آبی رنگ) به همراه سولفات مس (اا) خشک (سفیدرنگ) را نشان میدهد.

واکنش جذب و از دست دادن آب این ترکیب به شکل زیر نوشته میشود. طی واکنش از دت دادن آب، به ماده حرارت داده میشود و مولکولهای آب به فرم گاز از ساختار مولکول خارج میشوند و رنگ ماده از آب پررنگ به سفید خاکستری تغییر میکند. طی واکنش جذب آب، ب فرم خشک ماده آب اضافه شده و رنگ این ترکیب از سفید به ابی پررنگ تغییر میکند.
به طور کلی، ترکیبات هیدرات در حالت بدون آب (انهیدرات) ویژگی های زیر را دارند.
- این ترکیبات به راحتی در آب حل میشوند.
- رنگ محلول این ترکیبات با رنگ مولکول آبدار آنها یکسان است. رنگ ترکیب خشک این مواد معمولا با رنگ ترکیب هیدراته آنها متفاوت است.
هیدراتها معمولا در دمای اتاق پایدار هستند. با این وجود، برخی از هیدراتها زمانی که فشار بخار آنها از فشار بخار محیط بالاتر میرود، مولکولهای آب خود را از دست میدهند. این فرآیند با نام افلورسانس شناخته میشود.
برخی دیگر از مواد میتوانند مولکولهای آب هوا را بدون اعمال نیروی خارجی جذب کنند. به این ترکیبات، هیگروسکوپیک (نمگیر) گفته میشود. برخی از این ترکیبات مانند و کلسیم کلرید خشک، برای جذب آب از گازها و مایعات استفاده میشوند. به این مواد، مواد جاذب یا دسیکانت گفته میشود.
برخی دیگر از ترکیبات هیگروسکوپیک مانند سدیم هیدروکسید به حدی آب و رطوبت محیط را جذب میکنند که در آن حل میشوند. به این ترکیبات، دلیکوئسانت گفته میشود.
مثال هیدرات
ترکیبات هیدرات ترکیبات بیشماری هستند که در صنایع مختلف تهیه و استفاده میشوند. در ادامه، برخی از مهمترین هیدراتها را توضیح میدهیم.
هیدرات کربن
هیدراتهای کربن با نام کربوهیدرات شناخته میشوند. این مواد یکی از مهمترین و اصلی ترین منابع انرژی برای بدن انسان هستند. در ترکیبات هیدرات کربن، نسبت هیدروژن و اکسیژن عموما ۲ به ۱ است. فرمول شیمیایی کلی هیدراتهای کربن، است.
کربوهیدراتهای سادهای که شیرین هستند با نام قند شناخته میشوند. کربوهیدراتها انواع مختلفی مانند مونوساخارید، اولیگوساخارید و پلی ساکارید دارند.
نمک اپسوم
نمک اپسوم، نمک منیزیم سولفات ۷ آبه است. فرمول مولکولی این ماده به شکل است. نمک اپسوم کاربردهای فراوانی دارد. این مولکول برای درمان مشکلات ماهیچههای بدن استفاده میشود. همچنین، نمک اپسوم در تهیه نمک حمام نیز استفاده میشود. این ماده، فشار سیستولیک خون را کاهش میدهد و به عنوان یک افزودنی به خاک اضافه میشود تا به رشد گیاهان کمک کند.
سدیم کربنات
نمک هیدرات سدیم کربنات با فرمول مولکولی و ۱۰ مولکول آب، یکی از پرکاربردترین نمکهای هیدرات است که از آن در تولید شویندهها استفاده میشود. این ماده که با نام سودای شست و شو شناخته میشود، یکی از فرمها اولیه صابون بوده است. این ماده یک هیدرات افلورسنانس است و در دمای اتاق برخی از مولکولهای آب خود را از دست میدهد.
بوراکس
بوراکس یک نمک هیدرات سدیم بورهیدرید با فرمول مولکولی است. این هیدرات ده آبه، یکی از مواد اولیه در بسیاری از مواد آرایشی، شونیدهها، لعاب مینا و ضدحریقها استفاده میشود.
سولفات مس
هیدرات پنج آبه سولفات مس (II) به دلیل رنگ آبی خاصی که دارد در مواد اولیه تولید رنگ و سفالگری کاربرد دارد. این ماده همچنین به عنوان ضد قارچ و ضد علف نیز استفاده میشود.
کلرید کبالت
کلرید کبالت (II) شش آبه در حالت آبی رنگی بنفش و در حالت خشک رنگ آبی روشن دارد. کاغذهایی که با این ماده پوشانده شدهاند به عنوان یکی از ابزار تشخیص رطوبت محیط استفاده میشوند.

هیدرازین هیدرات
هیدرازین هیدرات فرم آبدار مولکول هیدرازین است که یک مولکول به شدت بازی، خورنده، سمی و نمگیر است. از این ماده در داروسازی و صنایع مختلف به عنوان آنتی اکسیدان، عامل کاهنده، عامل فوم دهنده و محرک موشک استفاده میشود. این ماده بیشتر به فرم یک آبه به فروش میرسد و بدون رنگ است و بویی شبیه به آمونیاک دارد. فرمول مولکولی هیدرازین مونو هیدرات به شکل است.
یادگیری شیمی عمومی با فرادرس
یادگیری این موضوع که مولکول هیدرات چیست و چگونه تشکیل میشود نیازمند دانستن برخی از مفاهیم پایه مانند هیدراتاسیون و واکنش افزایشی است. همچنین، شناخت استوکیومتری واکنشهای شیمیایی و کسرهای تبدیل استوکیومتری به ما در درک رفتار ترکیبات هیدرات در واکنشهای مختلف کمک میکند. پیشنهاد میکنیم برای یادگیری بیشتر این مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده و کاربردی به توضیح این مسائل میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه ترکیبات هیدرات دسترسی داشته باشید.
کاربرد ترکیبات هیدرات
در این مطلب از مجله فرادرس آموختیم ترکیب هیدرات چیست و چه ویژگیهایی دارد. ترکیبات هیدرات ترکیباتی بسیار پرکاربرد و متنوع هستند که به دلیل ویژگی جذب و دفع آب از ساختار شیمیایی آنها، در بسیاری از صنایع استفاده میشوند. در ادامه، برخی از مهمترین کاربردهای ترکیبات هیدرات را توضیح میدهیم.
ساخت و ساز
به طور کلی، در صنایع ساخت و ساز و تولید مواد دیرگداز، آب از پیوند دهندههای معدنی جدا میشود. برای مثال، در ترکیات سیمان و گچ، به مواد اولیه حرارت داده میشود. با افزودن آب به این مواد، ترکیبات شیمیایی دوباره هیدراته میشوند و میتوانند با سایر مواد پیوند برقرار کنند. مولکولهای آبی که به شکل شیمیایی با این مواد پیوند برقرار نکردهاند به شکل بخار آب از مخلوط خارج میشوند.
خشک شدن نابهنگام ترکیبات گچ و سیمان یکی از دلال اصلی ترک خوردن و شکستن این مواد است.
حفاظت در برابر آتش
جلوگیری از خشک شدن نابهنگام ملات سیمان و گچ برای تمامی مواد ساختمان سازی مشابه این دو مورد نیز مهم است. مولکول آبی که به شکل شیمیایی به مولکولهای دیگر متصل شده است، در صورت حضور آتش، واکنشی گرماگیر را پیش میبرد. از این ویژگی ترکیبات هیدرات برای مهار یا کنترل آتش در ساختمانها استفاده میشود.
در صورت آتشسوزی در ساختمانها، دما میتواند تا ۱۱۰۰ درجه سانتیگراد بالا رود. وجود هیدراتها در این شرایط باعث پایین ماندن دمای سطوح تا ۱۰۰ درجه سانتیگراد یا کمتر از آن میشود. در نتیجه، هرچه مقدار ترکیبات هیدرات در این موارد بیشتر باشد، مدت زمان مهار آتش نیز افزایش مییابد.
source
