شیمیدانها از واحد اکی والان برای بیان ظرفیت واکنش مواد شیمیایی مانند یونها و الکترونها استفاده میکنند. تعداد همارز، عددی است که بیان میکند چند الکترون یا یون میتواند در واکنش شیمیایی منتقل شود. این واحد در واقع ظرفیت واکنشپذیری مواد شیمیایی را مشخص میکند. اکی والان یک ماده را میتوان با تقسیم جرم مولی آن بر ظرفیت واکنشپذیری آن به دست آورد. در این مطلب از مجله فرادرس میآموزیم اکی والان چیست و روشهای مختلف محاسبه آن کدامند.

در ابتدای این مطلب میآموزیم اکی والان چیست و فرمول محاسبه این واحد را بررسی میکنیم. سپس، این واحد را برای عناصر با حالت اکسایش آنها و برای اسیدها و بازها در واکنشهای شیمیایی بررسی میکنیم. در ادامه، مفاهیمی مانند جرم اکی والان، اکی والان گرم و نرمالیته را توضیح میدهیم. در نهایت، به بررسی اهمیت و کاربرد مفهوم این واحد در شیمی، الکتروشیمی و بیوشیمی میپردازیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل و کاربردی بیاموزید اکی ولان چیست.
اکی والان چیست؟
اکی والان (Equivalent) مشخص میکند که به ازای هر واحد از یک ماده چند واحد از ماده دیگر با آن واکنش میدهد. در شیمی به اکی والان، همارز نیز گفته میشود. ظرفیت واکنشپذیری مواد شیمیایی مانند الکترونها و یونها به وسیله این واحد نشان داده میشود. این ظرفیت به این بستگی دارد که چند یون یا الکترون در واکنش شیمیایی منتقل میشود.
برای مثال در واکنشهای اسید و باز، اکی والان مقدار مادهای است که با یون های هیدروژن واکنش میدهد. در واکنشهای اکسایش- کاهش، الکترونها منتقل میشوند و اکی والان تعداد مول الکترونهای منتقل شده در این واکنشها است. پیدا کردن تعداد همارزهای ماده با بررسی ساختار شیمیایی ماده انجام میشود. یکی دیگر از تعاریف همارز بیان میکند که چه مقدار ماده (بر حسب گرم) با عبور یک کولن جریان الکتریکی در یک واکنش الکتروشیمیایی تولید یا مصرف میشود.
همچنین، تعریف کلی دیگری از این واحد بیان میکند که چه مقدار ماده بر حسب گرم با ۱ گرم اتم هیدروژن وارد واکنش میشود. از این واحد در محاسبات استوکیومتری شیمی برای بیان نرمالیته محلولها استفاده میشود. در واکنشهای شیمیایی معمولا مقدار ماده بسیار کم است و به همین دلیل بر حسب میلیاکی والان بیان میشود.
یادگیری محلول سازی با فرادرس
همارزی یکی از واحدهای بررسی مواد شیمیایی در واکنشها و محلولها است و از آن به خصوص در تهیه محلولهای نرمال بسیار استفاده میشود. برای اینکه درک کنیم اکی والان چیست، ابتدا باید با مفاهیمی چون مبانی تیتراسیون اسید و باز و تیتراسیون اکسایش کاهش و روشهای محلولسازی آشنا شویم. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش محلولسازی در آزمایشگاه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه اکی والان دسترسی داشته باشید.
تعریف های اکی والان
در قسمت قبل آموختیم اکی والان چیست و برای چه مفاهیمی استفاده میشود. در این قسمت، مهم ترین تعاریف این واحد در واکنشهای مختلف ارائه شده است.
- مقدار مادهای است که با یک مول یون هیدروژن در واکش های خنثی شدن واکنش میدهد.
- مقدار مادهای است که با یک مول الکترون در واکنشهای اکسایش – کاهش واکنش میدهد.
- مقدار مادهای است که در واکنشهای الکتروشیمیایی با عبور یک کولن جریان تولید یا مصرف میشود.
انجام محاسبات استوکیومتری بر حسب این واحد نسبت به انجام محاسبات بر حسب مول ماده مزیتهایی دارد. یکی از این مزایا این است که برای محاسبات بر حسب اکی والان نیازی به بررسی طبیعت واکنش و آنالیز و موازنه واکنش شیمیایی نیست.

فرمول اکی والان چیست؟
در قسمتهای قبل آموختیم اکی والان چیست. با استفاده از فرمولهایی که بر اساس تعریف این واحد در واکنشهای شیمیایی تعیین شده اند، میتوان اکی والان مواد مختلف را به دست آورد. برای تبدیل میلیگرم ماده به همارزی آن، از فرمول زیر بهره میگیریم.
که در این فرمول، n ظرفیت شیمیایی ماده و MW جرم مولی آن است. پس با ضرب تعداد مول ماده در ظرفیت آن، تعداد همارز آن به دست میآید.
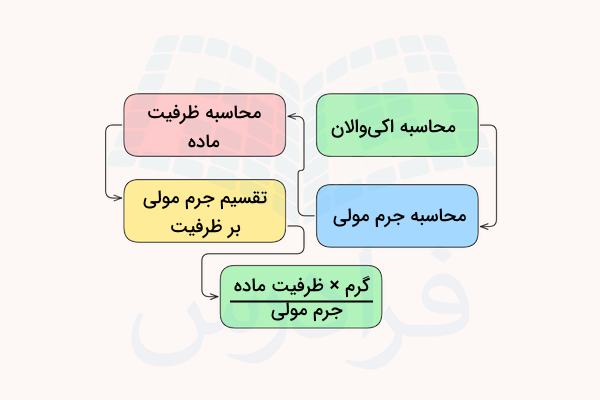
برای مثال، اکی والان ۱۰٫۶ گرم از ماده سدیم کربنات با جرم مولی ۱۰۶ گرم بر مول را به روش زیر محاسبه میکنیم. سدیم کربنات یک ترکیب یونی است که از ترکیب ۲ یون سدیم با بار ۱+ و یک یون کربنات با بار ۱- تشکیل شده است و ظرفیت آن برابر ۲ است.
این بدین معنی است که اگر ۱۰٫۶ گرم از این ماده در یک واکنش شرکت کند، ۰٫۱ مول و ۰٫۲ اکی والان از آن وارد واکنش شده است. این فرمول یکی از مهمترین فرمولها در محاسبات استوکیومتری واکنشهای شیمیایی است. پیشنهاد میکنیم برای آشنایی بیشتر با روش حل این مسائل، آموزش حل مسائل استوکیومتری فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
محاسبه فاکتور ظرفیت مواد
در شیمی، ظرفیت مواد (Valence) اندازهگیری توانایی آن برای واکنش با سایر مواد و تشکیل پیوندهای شیمیایی است. طبق تعاریف جدید، ظرفیت مواد تعداد یونهای هیدروژنی است که میتواند از آنها جدا شده یا با آنها واکنش دهد. ظرفیت مواد مختلف را در ادامه بررسی میکنیم.
- ظرفیت اسید: ظرفیت اسید تعداد یون های هیدروژن مثبتی است که اسید آزاد میکند.
- ظرفیت باز: ظرفیت باز تعداد یون های هیدروکسیدی است که از باز جدا میشود.
- ظرفیت عناصر مختلف، حالت اکسایش یا بار الکتریکی یونهای آنها است.
- ظرفیت شیمیایی نمکها، مقدار و تعداد بار الکتریکی تولید شده از آنها در واکنش تفکیک است.
جدول زیر حاوی ظرفیت برخی از مواد رایج ارائه شده است.
| عنصر / ترکیب/ نمک | فرمول شیمیایی | ظرفیت شیمیایی |
| اسید کلریدریک | ۱ | |
| اسید فسفریک | ۳ | |
| اسید سولفوریک | ۲ | |
| اسید نیتریک | ۱ | |
| سدیم هیدروکسید | ۱ | |
| کلسیم هیدروکسید | ۲ | |
| آومنیویم هیدروکسید | ۳ | |
| سدیم کربنات | ۲ | |
| آلومینیوم سولفات | ۶ | |
| کربن | ۴ | |
| اکسیژن | ۲ | |
| هالوژنها | — | ۱ |
اکی والان و حالت اکسایش
حالت اکسایش عناصر بیان میکند که چه تعداد الکترون در واکنشهای این مواد منتقل میشود. برای مثال، حالت اکسایش عناصر زیر برابر با حالت اکسایش آنها است.
| عنصر / یون | حالت اکسایش | اکی والان |
| کلسیم | ۲+ | ۲ |
| آلومینیوم | ۳+ | ۳ |
اکی والان اسیدها و بازها
برای اسیدها، ظرفیت و اکی والان برابر با تعداد یونهای هیدروژنی است که اسید منتقل میکند. در واقع میتوان ظرفیت و اکی والان اسیدها را با استفاده از فرمول شیمیایی آنها یا واکنش خنثی شدن آنها به دست آورد. اسیدها معمولا به تعداد هیدروژنهایی که در فرمول شیمیایی خود دارند، ظرفیت دارند.
برای مثال، اسید کلریدریک با فرمول شیمیایی یک اکی والان و اسید سولفوریک با فرمول شیمیایی دو اکی والان دارد. برای بازها، ظرفیت و تعداد همارز را میتوان با تعداد یونهای هیدروکسیدی که آزاد میکنند، پیدا کرد. برای مثال، سدیم هیدروکسید یک ظرفیت و باریم هیدروکسید با فرمول شیمیایی دو ظرفیت دارند.
بررسی واکنش اسید و باز با اکی والان
هر اکی والان از اسید با یک اکی والان از باز واکنش میدهد. برای مثال، برای اسید کلریدریک و سدیم هیدروکسید که همارزی هر دو برابر با ۱ است، به یک اندازه و با یک نسبت واکنش میدهند. اسید سولفوریک اکی والانی برابر ۲ دارد و اگر با سدیم هیدروکسید وارد واکنش شود، ۲ اکی والان از این باز برای واکنش با ۱ اکی والان از اسید سولفوریک نیاز است و با نسبت ۲:۱ وارد واکنش میشوند.
ترکیب اسیدها و بازها با همارزی برابر منجر به انجام واکنش خنثی شدن میشود.
جرم اکی والان چیست؟
جرم اکی والان (جرم همارزی) برابر با جرم یک اکی والان از یک ماده است که با مقدار مشخصی از ماده دیگر وارد واکنش میشود. مقدار جرم همارزی ماده را با حرف انگلیسی E نمایش میدهند و برابر با نسبت جرم مولی ماده بر ظرفیت آن است. فرمول محاسبه جرم اکی والان ماده به شکل زیر است.
در این فرمول، E جرم همارزی ماده، MW جرم مولکوی آن و n فاکتور ظرفیت ماده است. همچنین میتوان مقدار اکیوالان ماده را با استفاده از جرم ماده و جرم اکی والان ماده به دست آورد.
که در این فرمول، n تعداد همارز ماده، m جرم آن و E جرم اکی والان آن است.
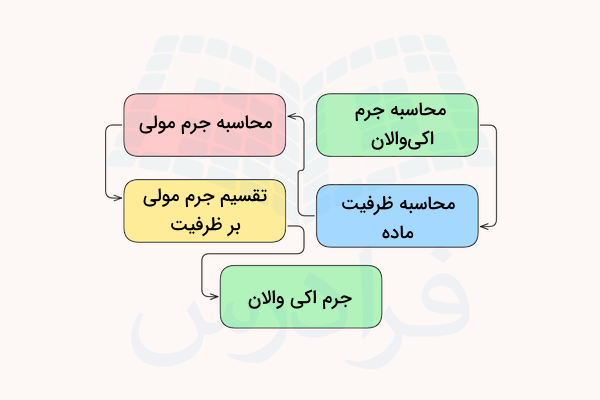
در جدول زیر، نحوه محاسب جرم همارزی مواد مختلف ارائه شده است.
| نوع ماده | روش محاسبه جرم اکی والان |
| عنصر | جرم اتمی تقسیم بر طرفیت عنصر |
| اسید | جرم مولکولی تقسیم بر تعداد هیدروژنها (ظرفیت اسید) |
| باز | جرم مولکولی تقسیم بر تعداد هیدروکسیدها (ظرفیت باز) |
| نمک | جرم مولکولی تقسیم بر مجموع بار الکتریکی مثبت یا منفی ماده |
جرم اکی والان عناصر
همانطور که در جدول بالا اشاره شده است، جرم اکی والان یک عنصر، جرم یک مول از ماده تقسیم بر ظرفیت آن است. این کمیت که با گرم اندازهگیری میشود، از تقسیم جرم اتمی ماده بر ظرفیت آن (حالت اکسایش) به دست میآید. برای مثل، جرم همارزی عنصر اکسیژن برابر با جرم اتمی آن (۱۶) تقسیم بر ظرفیت آن که ۲ است و برابر با ۸ گرم است.
جرم اکی والان اسیدها و بازها
در واکنشهای اسید و باز، جرم اکی والان یک اسید یا باز برابر با جرمی از ماده است که یک مول یون هیدروژن آزاد کرده یا با آن واکنش میدهد.
جرم اکی والان اسید
برای مثال، به واکنش خنثی شدن سولفوریک اسید توجه کنید.
با توجه به واکنش بالا مشاهده میکنیم که ۲ یون هیدروژن از این اسید جدا شده و با یونهای هیدروکسید واکنش دادهاند. برای محاسبه جرم همارزی این ماده کافی است جرم مولی اسید سولفوریک (۹۸) را بر ۲ تقسیم کنیم پس جرم همارزی این ماده برابر با ۴۹ خواهد بود.
حال به واکنش تفکیک شدن اسید کلریدریک توجه کنید.
مشاهده میکنید که طی واکنش تفکیک شدن این اسید یک یون هیدروژن آزاد میشود پس ظرفیت آن ۱ است و جرم مولی این ماده (۳۶٫۴۵ گرم بر مول) برابر با جرم همارزی آن خواهد بود.
جرم اکی والان باز
برای بازها نیز باید به همین شکل اکی والان و جرم را بررسی کنیم. برای مثال، به واکنش آمونیوم هیدروکسید با یون هیدروژن توجه کنید.
مشاهده میکنید که در این واکنش، یک هیدروکسید موجود در ساختار مولکولی این ماده با یون هیدروژن وارد واکنش شده و خنثی شده است. در نتیجه، ظرفیت این ماده برابر ۱ است و جرم اکی ولان آن با جرم مولی آن برابر است.
حال همین روند را برای باز آلومینیوم هیدروکسید بررسی میکنیم. واکنش تفکیک آلومینیوم هیدروکسید در آب به شکل زیر است.
همانطور که در واکنش بالا مشاهده میکنید، این ماده سه ظرفیتی است و سه یون هیدروکسید در آب آزاد میکند. در نتیجه برای به دست آوردن جرم همارزی آن، جرم مولی این ماده را بر ۳ تقسیم میکنیم.
جرم اکی والان در واکنشهای اکسایش کاهش
در واکنشهای اکسایش کاهش، جرم اکی والان یک واکنشدهنده جرمی از آن ماده است که در این واکنشها با یک مول الکترون واکنش داده یا آن را آزاد میکند. برای مثال به واکنش زیر دقت کنید.
در این واکنش، درجه اکسایش منیزیم از ۷+ به ۲+ تغییر کرده است. در نتیجه، n در این واکنش برابر با عدد ۵ است. برای به دست آوردن جرم همارزیاین ماده، باید جرم مولی آن را بر عدد ۵ تقسیم کنیم.

جرم همارزی، با واحدهای اندازه گیری جرم اندازه گیری میشود. جرمهای همارزی در گذشته با انجام واکنشهای شیمیایی و بررسی آنها به دست می آمدند. جرم همارزی مواد را میتوان با استفاده از جرم موکولی و تعداد بارهای مثبت یا منفی که از انحلال ماده تولید میشود نیز به دست آورد.
جرم اکی والان نمک فلزات
ترکیبات شیمیایی مانند نمک فلزات در آب تفکیک شده و یونهای تشکیلدهنده این ترکیبات آزاد میشود. برای محاسبه جرم همارزی این مواد باید جرم مولکولی آنها را بر تعداد بار در مقدار بار یون مثبت یا منفی آزاد شده تقسیم کرد. برای مثال، به واکنش تفکیک ماده آلومینیوم کلرید توجه کنید.
همانطور که در واکنش بالا مشاهده میکنید، یک یون آلومینیوم ۳ بار مثبت از این ماده آزاد شده است. پس ظرفیت این ماده برابر با عدد ۳ بوده و برای محاسبه جرم همارزی آن، باید جرم مولکولی آلومینیوم کلرید (۱۳۳٫۳۴ گرم بر مول) را بر ۳ تقسیم کنیم.
برای درک بهتر محاسبات مربوط به این مواد، به واکنش تفکیک ماده کربنات نقره نیز توجه کنید.
از واکنش تفکیک این ماده، دو یون نقره ۱ بار مثبت تولید میشود، پس ظرفیت آن ۲ است و برای محاسبه جرم اکی والان، باید جرم مولی کربنات نقره (۲۷۵٫۷۵ گرم بر مول) را بر ۲ تقسیم کنیم.
محاسبه جرم اکی والان
برای محاسبه جرم اکی والان مواد مختلف، مطابق فرمول ارائه شده در بخش قبل عمل میکنیم. جرم همارزی اسید فسفریک با فرمول شیمیایی را محاسبه میکنیم. برای این کار، ابتدا جرم مولی اسید فسفریک را محاسبه میکنیم.
اسید فسفریک از ۳ اتم هیدروژن با جرم مولی ۱٫۰۱، چهار اتم اکسیژن با جرم مولی ۱۶ و یک فسفر با جرم مولی ۳۰٫۹۷ تشکیل شده است.
سپس این جرم را بر ظرفیت اسید فسفریک که برابر با ۳ است تقسیم میکنیم. مقدار جرم همارزی این اسید از طریق زیر محاسبه میشود.

برای درک بهتر این محاسبات، به مثالهای زیر توجه کنید.
مثال ۱
جرم اکی والان ماده بوریک اسید با فرمول شیمیایی را با توجه به واکنش شیمیایی زیر پیدا کنید.
پاسخ
با مشاهده این معادله واکنش درمییابیم که یک یون هیدروژن در این واکنش ابهحا شده است پس ظرفیت بوریک اسید برابر با عدد ۱ است. برای محاسبه جرم همارزی این ماده، جرم مولی را بر عدد ۱ تقسیم میکنیم.
مثال ۲
جرم اکی والان روی را در واکنش زیر محاسبه کنید.
پاسخ
با توجه به واکنش بالا، عدد اکسایش عنصر نقره از ۰ به ۲+ تغییر کرده است پس برای محاسبه جرم اکی ولاان این عنصر، باید جرم مولی آن (۶۵٫۳۸ گرم بر مول) را بر عدد ۲ تقسیم کنیم.
اکی والان گرم چیست؟
اکی والان گرم یکی از واحدهای اندازهگیری است که از جرم همارزی ماده به دست میآید و در محاسبات استوکیومتری به خصوص محاسبه غلظت محلولها بر اساس نرمالیته، به کار می رود. یک اکی ولاان گرم یک ماده برابر با جرم آن ماده بر حسب گرم تقسیم بر جرم همارزی آن است. فرمول محاسبه این کمیت به شکل زیر است.
که در این فرمول، nGE برابر با تعداد همارز گرم، m جرم ماده بر حسب گرم و E جرم همارزی ماده است.
مثال
برای درک بهتر این فرمول، به محاسبه اکی والان گرم ماده اسید سولفوریک دقت کنید. در قسمتهای قبل بررسی کردیم که ظرفیت اسیدها برابر با تعداد هیدروژنهایی است که می توانند از خود ازاد کنند و ظرفیت اسید سولفوریک برابر ۲ است. اگر مقدار ۲۴٫۵ گرم از این اسید داشته باشیم، می خواهیم اکی والان گرم آن را محاسبه کنیم. برای این کار، ابتدا جرم همارزی این ماده را با تقسیم جرم مولی آن بر عدد ۲ محاسبه میکنیم.
سپس جرم داده شده این ماده را بر جرم همارزی آن تقسیم می کنیم تا اکی والان گرم ان به دست آید.
نرمالیته چیست؟
نرمالیته یکی از راههای بیان غلظت است و برای اندازهگیری اکی والان ماده در لیتر محلول استفاده میشود. فرمول محاسبه نرمالیته محلول به شکل زیر است.
در فرملو بالا، N نماد نرمالیته، n(Eq) نماد تعداد همارز ماده حل شونده و L تعداد لیتر محلول است. همچنین، نرمالیته با استفاده از رابطه زیر نیز محاسبه میشود.
که در این فرمول، nGE برابر با تعداد همارز گرم، m جرم ماده بر حسب گرم ، E جرم همارزی ماده و V حجم محلول است. در آزمایشاه شیمی، اطلاع از نحوه محاسبه غلظتهای مختلف و واحدهای آنها از مهمترین قدمها برای محاسبات استوکیومتری واکنشهای شیمیایی مختلف است. شناخت نرمالیته و اکی والان نیز یکی از قدمهای ابتدای برای یکی از روشهای بیان غلظت محلول است. پیشنهاد میکنیم برای آشنایی بیشتر با این روشها، مطلب غلظت محلولها و واحدهای آنها از مجله فرادرس را مطالعه کنید.
برای درک بهتر مفهوم نرمالیته، مثالی را بررسی میکنیم. برای مثال، نرمالیته ۳۱۰ میلیلیتر محلول سدیم هیدروکسید که از ۰٫۴ گرم سدیم هیدروکسید به دست آمده را محاسبه میکنیم. برای این کار، ابتدا جرم همارزی این ماده را محاسبه میکنیم. سدیم هیدروکسید، یک باز تک ظرفیتی است پس جرم اکی والان آن با جرم مولی آن برابر خواهد بود.
سپس این مقدار را به همراه جرم ماده حل شونده (سدیم هیدروکسید) و حجم محلول (۳۱۰ میلیلیتر) در فرمول محاسبه نرمالیته جای گذاری میکنیم.
مثال نرمالیته
برای درک بهتر اینکه استفاده اکی والان در نرمالیته چیست، به مثالهای زیر دقت کنید.
مثال ۱
مقدار غلظت محلول ۰٫۳۲۱ گرم سدیم کربنات در ۲۵۰ میلیلیتر محلول بر حسب نرمالیته چیست؟
پاسخ
برای حل این سوال، ابتدا ظرفیت این ماده و جرم همارزی آن را پیدا میکنیم. برای این کار، ابتدا معادله واکنش تفکیک سدیم کربنات در آب را مینویسیم.
با توجه به این واکنش تفکیک، ظرفیت این ماده برابر با ۲ است و باید جرم مولکولی آن را بر ۲ تقسیم کنیم تا جرم اکی والان آن به دست اید.

مثال ۲
با توجه به معادله واکنش شیمیایی زیر، مقدار نرمالیته محلولی که با حل کردن ۵۵ گرم سدیم هیدروکسید در ۱ لیتر آب به دست میآید چهقدر است؟
جرم مولی سدیم هیدروکسید برابر با ۴۰ گرم بر مول است.
پاسخ
با توجه به معادله تفکیک و فرمول شیمیایی سدیم هیدروکسید، ظرفیت این ماده برابر با عدد ۱ است و جرم همارزی آن برابر با جرم مولی آن است. پس برای به دست آوردن نرمالیته آن، تنها کافی است، جرم، جرم اکی والان (جرم مولی) و حجم محلول را در فرمول نرمالیته جایگذاری کنیم.
اکی والان در الکتروشیمی
در شیمی، اکی والان الکتروشیمیایی که با حروف (Eq) و (Z) نمایش داده میشود، جرم مادهای است که در حضور مقدار مشخصی الکتریسیته جابهجا میشود. این کمیت، با واحد گرم در کولن یا بار الکتریکی سنجیده میشود. مقدار همارزی الکتروشیمیایی یک ماده با استفاده از ولتمتر اندازهگیری میشود.
در واقع همارزی الکتروشیمیایی یک ماده، مقدار جرمی از ماده است که با عبور جریانی به بزرگی ۱ آمپر در مدت ۱ ثانیه جابهجا میشود. فرمول محاسبه همارزی الکتروشیمیایی یک ماده به شکل زیر است.
در این فرمول، z نمایش دهنده اکی والان الکتروشیمیایی ماده، M جرم ماده و q مقدار بار عبور داده شده است. از آن جا که مقدار بار منتقل شده برابر با جریان در زمان است، میتوان فرمول بالا را به شکل زیر نوشت.
که I برابر با جریان و t زمان است. یک فرمول دیگر نیز برای محاسبه مقدار اکی ولاان الکتروشیمیایی وجود دارد که به شکل زیر است.
در این فرمول، E مقدار جرم اکی ولاان ماده و F ثابت فارادی است. در ادامه، مقدار همر ارزی الکترشیمیایی برخی از مواد بر حسب کیلوگرم بر کولن نوشته شده است.
| ماده | اکی والان الکتروشیمیایی |
| نقره | |
| مس | |
| طلا | |
| آهن | |
| سدیم | |
| اکسیژن |
اکی والان در بیوشیمی
در سیستمهای زیستی، واکنشها در مقیاس کوچک اتفاق میافتند و این مواد باید در مقیاس میلیاکی والان بررسی شوند. در خیلی از موارد، اندازهگیریها بر اساس میلیاکی والان ماده حل شونده در لیتر محلول اندازهگیری میشود که با نام میلینرمال شناخته میشود. این واحد اندازهگیری به خصوص برای اندازهگیریها در ترکیبات مایعات بدن بسیار رایج است. برای مثال، مقدار مجاز ماده پتاسیم در خون انسان بین ۳٫۵ تا ۵ میلیاکیوالانن در لیتر گزارش شده است.

یادگیری شیمی تجزیه با فرادرس
برای درک بهتر این موضوع که اکی والان چیست، ابتدا باید با مفاهیمی چون واحدهای اندازهگیری در سیستم SI و روشهای بیان غلظت مانند مولاریته و فرمالیته آشنا شویم. همچنین، شناخت مفاهیمی مانند تعادل شیمیایی، واکنشهای اکسایش کاهش و تیتراسیون انواع مواد میتواند به درک ما در این مفهوم کمک کند. پینشهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه اکی والان دسترسی داشته باشید.
کاربرد اکی والان در شیمی
اکی والان و جرم همارزی مواد در شیمی جایگزین استفاده از جرم مولی شده است. جرم اکی والان مواد را میتوان با استفاده از جرم مولی موادی که در شیمی به خوبی شناخته شدهاند مانند اسید سولفوریک و پتاسیم پرمنگنات به دست اورد. این محاسبات در ادامه آورده شده است.
- سولفوریک اسید جرم مولی برابر با ۹۸٫۰۷۸ گرم بر مول و ۲ اتم هیدروژن دارد پس جرم همارزی آن برابر با ۴۹٫۰۳۹ خواهد بود.
- پتاسیم پرمنگنات جرم مولی برابر با ۱۵۸٫۰۳۴ گرم بر مول دارد و با ۵ مول الکترون واکنش میدهد و جر مهمارزی آن برابر با ۳۱٫۶۱ خواهد بود.
در گذشته، جرم اکی ولاان مواد با استفاده از واکنش شیمیایی عناصر با اکسیژن به دست می آمده است. برای مثال، ۵۰ گرم روی با اکسیژن وارد واکنش شده و ۶۲٫۲۴ گرم اکسید روی تولید میکند و این با توجه به قانون پایستگی مواد به این معنی است که ۱۲٫۲۴ گرم اکسیژن در این واکنش مصرف میشود. جرم اکی والان روی برابر با جرمی خواهد بود که با ۸ گرم اکسیژن وارد واکنش شده است در نتیجه جرم همارزی روی در این واکنش برابر با ۳۲٫۷ گرم خواهد بود.
کاربرد اکی والان در آنالیز حجمی مواد
در زمان انتخاب استاندادهای اولیه در شیمیتجزیه، موادی که وزن همارزی بالاتری دارند معمولا انتخابهای بهتری هستند زیرا خطاهای به وجود آمده در توزین این مواد کاهش مییابد. برای مثال، در استانداردسازی حجمی محلول سدیم هیدروکسید، نیاز است تا وزن ماده جامدی که با ۲۰ سانتی متر مکعب از این ماده واکنش میدهد را محاسبه کنیم. جامدات ممکن برای انجام این کار موادی مانند اسید اگزالیک ۲ آبه، پتاسیم هیدروژن فتالات و پتاسیم هیدروژن یدات هستند.
کاربرد اکی والان در تجزیه وزنی مواد
عبارت جرم همارزی معنی بسیار روشنی در آنالیزهای وزنی مواد دارد و آن بدین معنی است که ماده جامد تولید شده در ازای ۱ گرم از آنالیت، برابر با ۱ اکی والان گرم از آن ماده است. این تفاوت در تعریف همارز، با استفاده از تعیین مقدار جرم تولید شده از آنالیت در واکنشهای رسوبی و مانند آن است.
تجزیههای وزنی یکی از کاربردیترین روشها برای آنالیزهای شیمیایی هستند اما این روشها معمولا زمانبر و پر هزینه هستند و روشهایی مانند جذب اتمی که جرم آنالیت استفاده شده را با نموداری به دست میآورد، جایگزین شدهاند.

کاربرد اکی والان در شیمی پلیمر
در این مطلب از مجله فرادرس آموختیم اکی والان چیست. در شیمی پلیمر، جرم همارزی یک پلیمر فعال برابر با جرمی از ماده است که به اندازه یک اکی والان فعالیت شیمیایی دارد. این مقدار با استفاده از جرمی که مربوط به ۱ مول از شاخههای متصل به زنجیره اصلی پلیمر هستند به دست میآید.
این محاسبات برای مشخص کردن مقادیر و تعداد موادی مانند پلیاَلها، ایزوسیاناتها و اپوکسیهای ترموست بسیار کاربری است. همچنین، اکی والان گرم در مطالعات مربوط به رزینهای تبادل یون نیز بسیار مهم است. یک همارز از یک پلیمر تبادل یونی میتواند ۱ مول از یونهایی با بار ۱ و نصف یونهایی با بار ۲ را تبادل کند.
source
