محلولها، مخلوطهایی همگن هستند که در آنها، یک یا چند حلشونده در یک حلال حل شده است. حلشونده مادهای است که در یک ماده دیگر حل میشود و حلال مادهای است که مادهای دیگر را در خود حل میکند. برای تهیه محلولها میتوان از روشهای مختلفی استفاده کرد. برای مثال، رقیقسازی و تهیه محلول از مواد جامد از این روشها هستند. در این مطلب از مجله فرادرس میآموزیم محلول سازی چیست و روشهای آن کدامند.

در ابتدای این مطلب میآموزیم محلول سازی چیست و غلظت و سایر اصطلاحات مربوط به محلول سازی را بررسی میکنیم. سپس میآموزیم روش محلول سازی از مایعات و جامدات چیست و روش تبدیل واحد بین غلظتهای محلول را بررسی میکنیم. در ادامه، درمورد محلول استاندارد و روش تهیه آن و روش تهیه محلول بافر توضیح میدهیم. در نهایت، در جدولی قوانین انحلالپذیری نمکهای مختلف را بررسی میکنیم. با مطالعه این مطلب تا انتها، میتوانید به شکلی کامل بیاموزید محلول سازی چیست.
محلول سازی چیست؟
برای انجام واکنشهای شیمیایی همواره باید بستری مناسب برای برهمکنش اتمها و مولکولهای مختلف فراهم کنیم. تهیه محلول و محلول سازی یکی از این روشها است. گستره وسیعی از مواد شیمیایی به فرم محلول در واکنشهای شیمیایی استفاده میشوند. این محلولها با غلظتها و قدرتها و حجمهای مختلفی مورد استفاده قرار میگیرند. نوع محلولها، مقدار و غلظت آنها بسته به هدف آزمایش متفاوت است.
در آزمایشهای مختلف معمولا ۵ روش برای تهیه و استفاده محلول انجام میشود. این روشها به شرح زیر هستند.
- تهیه محلول با غلظت بر حسب مول در لیتر، غلظت مولی یا مولاریته
- تهیه محلول با غلظت بر اساس درصد حجمی، درصد وزنی یا درصد وزنی – حجمی
- تهیه محلول با غلظت بر حسب گرم بر لیتر
- تهیه محلول با رقیقسازی محلول غلیظ
- تهیه محلول استاندارد
برای درک بهتر این موضوع که محلول سازی چیست، ابتدا باید با مفهوم غلظت آشنا شویم. در ادامه این مفاهیم توضیح داده شده است.
یادگیری محلول سازی با فرادرس
برای درک بهتر این موضوع که محلول سازی چیست، ابتدا باید با مفاهیمی چون محیط آزمایشگاه و ایمنی در آزمایشگاه شیمی، علائم هشدار دهنده در آزمایشگاه شیمی، حلالها و محلولها و تیتراسیون آشنا شد. پینشهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش محلول سازی در آزمایشگاه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در مورد محلولها دسترسی داشته باشید.
غلظت چیست؟
غلظت محلول اشاره به مقدار کمی ماده حلشونده که در مقدار مشخصی حلال حل شده است، اشاره دارد. روشهای متفاوتی برای بیان غلظت محلولها وجود دارد. برای مثال، غلظت مولی، غلظت درصدی، گرم در لیتر و … از این نوع هستند. در ادامه برخی از این واحدهای بیان غلظت را توضیح میدهیم.
غلظت مولی
غلظت مولی یا مولاریته یکی از روشهای بیان غلظت است که مقدار مول نمونه حلشونده را در لیتر محلول اندازهگیری میکند. یک مول از ماده تعداد ذره از یک ماده است. یک مول از ماده میتواند این تعداد ذره از یک اتم، مولکول، یون، الکترون و … باشد. مقدار مول یک ماده را میتوان با استفاده از جرم آن و جرم مولی آن محاسبه کرد. این محاسبه به شکل زیر انجام میشود.
که در این فرمول، mole تعداد مول ماده، m جرم ماده بر حسب گرم و M جرم مولی ماده است. جرم مولی ماده که بر اساس مول بر گرم ماده گزارش میشود، برای هر ماده منحصر به فرد است و میتوان با دانستن جرم ماده، مول آن را محاسبه کرد.
مولاریته در شیمی یکی از پرکاربردترین و رایجترین روشهای بیان غلظت محلولها است. مولاریته با حرف انگلیسی M نمایش داده شده و واحد آن مول بر لیتر است.

در زمانی که میخواهیم غلظت یک محلول را بر حسب مولاریته بیان کنیم یا محلول مولار تهیه کنیم باید دقت داشته باشیم که در این واحد حجم بر حسب لیتر بیان میشود و باید حتما به لیتر تبدیل و گزارش شود. همچنین، حجم در نظر گرفته شده شامل مجموع حجم حلشونده و حلال است که در صورت مایع بودن حلشونده باید حتما به این نکته دقت شود.
غلظت درصدی
غلظت درصدی مقدار ماده حلشونده را در لیتر یا گرم حلال بر حسب درصد بیان میکند. مقدار غلظت درصدی مواد میتواند بر حسب درصد حجمی، درصد وزنی – حجمی و درصد وزنی بیان شود. در ادامه هریک از این موارد را توضیح میدهیم.
- درصد حجمی: حجم ماده حل شونده را در حجم محلول بر حسب درصد نشان میدهد.
- درصد وزنی – حجمی: وزن ماده حلشونده را در حجم محلول بر حسب درصد نشان میدهد.
- درصد وزنی: جرم ماده حلشونده را در جرم محلول بر حسب درصد بیان میکند.
اصطلاحات محلول سازی
در مطالعه و انجام روشهای محلول سازی، احتمالا با عباراتی چون محلول بافر، غلظت، جرم مولی و … روبهرو میشوید. در ادامه، برخی از این اصطلاحات را توضیح میدهیم.
اصطلاحات مربوط به محلولها
در بررسی محلولها عباراتی چون محلول غلیظ، محلول بافر و … بیان میشود. در ادامه این موارد را توضیح دادهایم.
- محلول بافر: محلول بافر محلولی است که مقدار اسیدیته (pH) آن با افزودن اسید یا باز تغییر زیادی نمیکند.
- انحلال پذیر: به توانایی دو مایع برای حل شدن به شکلی کامل در یکدیگر، انحلالپذیری و به آن دو مایع انحلالپذیر گفته میشود.
- محلول اشباع: محلول اشباع محلولی است که بیشترین میزان ماده حلشونده را در دمای معینی در خود حل کرده است.
- محلول: به ترکیب حلال و حلشونده که یک مخلوط همگن را تشکیل میدهند، محلول گفته میشود.
- محلول استاندارد: محلولهای استاندارد، محلولهایی با غلظت بسیار دقیق هستند که برای انجام فرآیندهای کمی مورد استفاده قرار میگیرند.
- محلول فوق اشباع: محلولهای فوق اشباع محلولهایی هستند که مقدار ماده حلشونده بیشتری نسبت به محلول اشباع و به صورت حل شده دارند. این محلولها ناپایدارند و مقدار ماده حل شده اضافی میتواند با کوچکترین تغییری به صورت رسوب از محلول خارج شود.
اصطلاحات مربوط به غلظت
در برسی غلظت مواد، به اصطلاحاتی چون نرمالیته، مولالیته و … برخورد میکنیم. در ادامه، این موارد توضیح داده شده است.
- غلظت: غلظت به مقدار ماده حلشونده در حجم مشخصی از محلول گفته میشود.
- نرمالیته:نرمالیته یک روش بیان غلظت است که در ان، تعداد اکیوالانهای ماده حلشونده در لیتر محلول محاسبه میشود.
- مولالیته: مولالیه یک روش بیان غلظت است که در آن تعداد مولهای ماده حلشونده بر تعداد کیلوگرم حلال تقسیم میشود.
- جرم مولی: جرم مولی، جرم یک مول از هر ماده است.
- محلول غلیظ: این عبارت بیشتر برای بیان اسیدها و بازها با بالاترین غلظت ممکن در دمای اتاق یا درحالت خالص استفاده میشود.

اصطلاحات مربوط به حلال و حل شونده
در بررسی محلولها، عباراتی در مورد حلالها و مواد حل شونده بررسی میشود که در ادامه توضیح داده میشود.
- هیدرات: ترکیباتی که در ساختار مولکولی خود مولکولهای آب را به دام انداختهاند، هیدرات نامیده میشوند. در این ترکیبات، جرم مولکولهای آب نیز در جرم مولکولی مولکول لحاظ میشود.
- آب مقطر: آب مقطر یکی از حلالهای رایج استفاده در آزمایشگاه است که در آن هیچ ماده معدنی، ناخالصی و بسیاری از مواد آلی وجود ندارد.
- آب دیونیزه: آب دیونیزه یکی دیگر از حلالهای استفاده شده در آزمایشگاههای مختلف است که در آن، مواد معدنی و بسیاری از ناخالصیها و آلودگیها وجود ندارد.
- حلال: به قسمت بزرگتر محلول که یک ماده دیگر را در خود حل میکند، حلال گفته میشود. حلالها معمولا مایع هستند و میتوانند از نوع آلی یا معدنی باشند.
- حلشونده: حلشونده به مادهای گفته میشود که در حلال حل میشود و معمولا جامد است و قسمت کمتری از محلول را تشکیل میدهد.
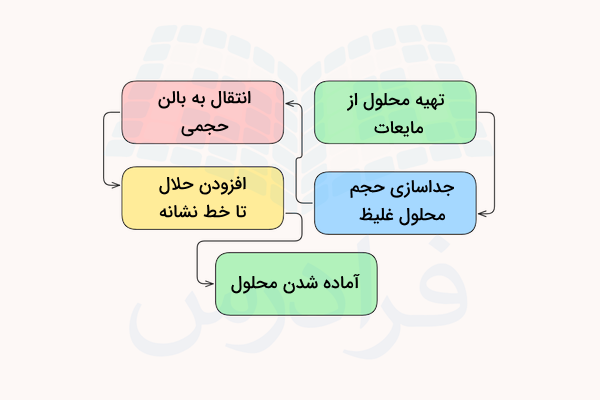
تهیه محلول از جامدات
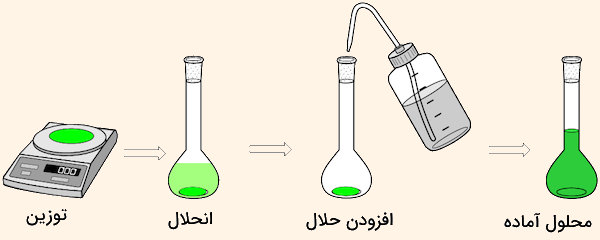
میتوان از جامدات محلولهای مختلفی تهیه کرد. در این روشها، مقدار مورد نیاز از جامد مورد نظر برای تهیه محلول با غلظت مشخص روی ترازوی دیجیتال توزین شده و اندازهگیری میشود. سپس این ماده با مقدار مناسبی از حلال مخلوط شده و به وسیله هم زدن یا حرارت دادن حل میشود. از مواد جامد میتوان محلولهای مولار ، محلول استاندارد، محلول اشباع و محلول بافر تهیه کرد.

ظرف مناسب برای این کار بشر آزمایشگاهی است اما باید دقت داشت مقدار زیاد حلال نباید به ماده اضافه شود و تنها برای حل کردن ماده جامد کافی است. سپس محلول تهیه شده به بالن تهگرد حجمی اضافه شده و با آب مقطر رقیق شده تا به خط نشانه بالن برسد. پیشنهاد میکنیم برای آشنایی بیشتر با وسایل مورد نیاز انجام فرآیند محلول سازی و طرز استفاده آنها، مطلب لوازم آزمایشگاه شیمی مجله فرادرس را مطالعه کنید.
تهیه محلول مولار
در روش تهیه محلول مولار، غلظت نهایی محلول تهیه شده بر حسب مول بر لیتر گزارش میشود. محلولهای مولار با استفاده از وزن مولی یا مولکولی حلشونده تهیه میشوند. وزن مولکولی مواد اغلب بر روی برچسب مشخصات مواد، کتب مرجع یا برگههای ایمنی مواد آزمایشگاهی ذکر میشود. همچنین، با جمع جرم اتمی اتمهای سازنده یک ماده نیز میتوان به جرم مولی آن دست یافت. برای مثال، جرم مولی سدیم کلرید از جمع جرم اتمی سدیم و کلر به سدت میآید.
بنابراین، در یک محلول ۱ مولار سدیم کلرید، مقدار ۵۸٫۴۴ گرم سدیم کلرید در یک لیتر آب حل شده است. باید به این نکته توجه داشت که اگر در محلول سازی از مولکولهای هیدراته (آبدار) استفاده میشود، جرم تعداد ملوکولهای آب ترکیب نیز باید محاسبه شود. با به درست آوردن جرم مولکولی مواد میتوان با استفاده از فرمول زیر مقدار ماده حلشونده مورد نیاز برای محلولسازی را به دست آورد.
در این فرمول، m نماد جرم بر حسب گرم، c غلظت بر حسب مولاریته، V حجم محلول بر حسب لیتر و M جرم مولی حل شونده است. عبارت 1M به شکل «۱ مولار» خوانده میشود. برای درک بهتر این روش محلول سازی به مثال زیر توجه کنید.
مثال ۱
میخواهیم مقدار ۱ لیتر محلول ۰٫۵ مولار مس (II) سولفات تهیه کنیم. مقدار مس (II) سولفات ۵ آبه مورد نیاز برای تهیه این محلول را محاسبه کنید.
پاسخ
برای پاسخ به این سوال ابتدا جرم مولی سولفات مس ۵ آبه را محاسبه کرده و سپس در فرمول ارائه شده در قسمت قبل میگذاریم.
برای درک بهتر این روش محلول سازی به دو مثال بعد توجه کنید.
مثال ۲
برای تهیه ۲۵۰ میلیلیتر محلول ۰٫۲ مولار سدیم کربنات با استفاده از نمک خشک آن، چه مقدار نمونه نیاز خواهیم داشت؟
پاسخ
پیش از پاسخ به سوال ابتدا به بررسی دادههای صورت سوال و تبدیل واحدها میپردازیم. برای این کار ابتدا باید حجم ۲۵۰ میلیلیتر را به لیتر تبدیل کنیم. سپس دادههای سوال را مینویسیم.
سپس با استفاده از فرمول قسمت قبل، جرم مورد نیاز برای تهیه این محلول را محاسبه میکنیم.
مثال ۳
برای تهیه ۲۵۰ سیسی از محلول ۰٫۲ مولار سدیم بی کربنات، چه جرمی از سدیم بی کربنات مونو هیدرات نیاز داریم؟
پاسخ
مانند سوال قبل، با تبدیل واحدها و محاسبه جرم مولی، مقدار جرم مورد نیاز را با استفاده از فرمول ذکر شده به دست میآوریم.
سپس داده ها را در فرمول ذکر شده جایگذاری میکنیم.
برای درک بهتر این روش محلول سازی به تمرینهای زیر پاسخ دهید.
تمرین ۱
برای تهیه ۵۰۰ میلیلیتر محلول ۰٫۱۲۵۰ مولار پتاسیم برومات، به چه مقدار از این ماده احتیاج داریم؟ جرم مولی پتاسیم برومات ۱۶۷ گرم بر مول است.
برای انجام محاسبات این سوال، به روش زیر عمل میکنیم.
پس برای تهیه این محلول به ۱۰٫۴۴ گرم پتاسیم برومات نیاز داریم.
تمرین ۲
در محلول ۰٫۹۴۳ مولار پتاسیم نیترات، چند گرم از این ماده وجود دارد؟ جرم مولی پتاسیم نیترات، ۱۰۱٫۱۱ گرم بر مول است.
۱۶۰۹۷۹٫۱۲ گرم
برای محاسبه مقدار گرم موجود در این محلول به روش زیر عمل میکنیم.
برای تهیه این محلول به ۱۶۰٫۹۶ گرم پتاسیم نیترات نیاز داریم.
دستورکار تهیه محلول مولار
برای محلول سازی و انجام واکنشهای شیمیایی همواره باید پیش از انجام کار در آزمایشگاه، یک دستورکار تهیه کنید. در دستورکار آزمایشگاه، لوازم آزمایشگاهی و مواد مورد نظر و مقادیر نمونههای مورد نیاز و باقی نکات نوشته میشود که برای هر آزمایش با آزمایش دیگر متفاوت است.
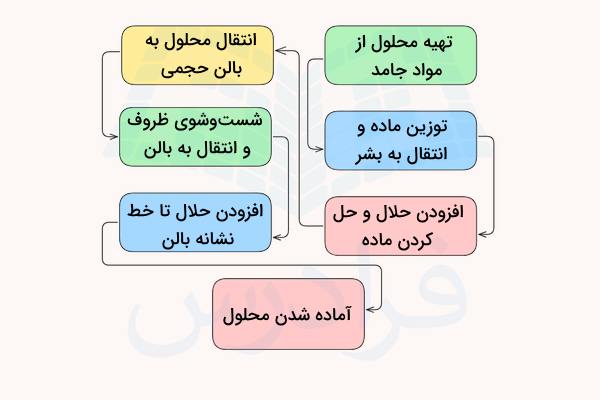
از آنجا که روشهای محلولسازی روشهای مشخصی هستند، میتوان هر روش را با یک دستورکار کلی مشخص کرد. در ادامه مراحل انجام این دستورکار نوشته شده است. برای تهیه محلول با استفاده از ماده اولیه جامد و آب مقطر به شکل زیر عمل میکنیم.
- ابتدا با استفاده از محاسبات قسمت قبل، مقدار نمونه مورد نظر برای تهیه ۱ لیتر از محلول با غلظت مشخص را به دست میآوریم.
- سپس مقدار مورد نظر از نمونه را بر روی یک شیشه ساعت خشک و روزی ترازو اندازهگیری و وزن میکنیم.
- مواد شیمیایی وزن شده را به یک بشر منتقل کرده و دو سوم (۵۰۰ تا ۶۵۰ سیسی) مقدار حلال را روی آن ریخته و با هم زدن یا حرارت دادن حل میکنیم.
- با استفاده از یک آبفشان (پیسِت) باقی مانده مواد روی شیشه ساعت را شسته و به بشر اضافه میکنیم. پس از حل شدن نمونه در حلال، آن را با استفاده از یک قیف شیشهای به یک بالن حجمی ۱ لیتری منتقل میکنیم.
- با استفاده از پیسِت و آب مقطر، قیف، بشر و همزن را شستوشو داده و به بالن میافزاییم.
- در نهایت تا رسیدن حجم محلول به خط نشانه روی گردن بالن حجمی، به آن آب مقطر افزوده و سپس درب آن را بسته و هم میزنیم و محلول ما آماده است.
نکته قابل توجه این است که در تهیه نمونههای مختلف اگر از ابتدا از بالن حجمی استفاده کردیم باید دقت داشته باشیم که تغییرات دمایی روی حجم این ظروف اثر میگذارد و اندازهگیریها حتما باید در دمای اتاق انجام شوند. در غیر این صورت، اگر در فرآیند محلول سازی به حرارت دادن نیاز بود، باید از بشر یا ظروفی به غیر از بالن حجمی استفاده شده و سپس به بالن حجمی منتقل شود.
حل مسائل غلظت مولی یکی از مهمترین روش های حل مسئله در استوکیومتری واکنشهای شیمیایی است و در آزمایشگاه شیمی و محلول سازی به شکل گستردهای استفاده میشود. پیشنهاد میکنیم برای آشنایی بیشتر با روش حل این مسائل، فیلم آموزش روش حل مسائل غلظت مولی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
تهیه محلول درصدی
در روشهای تهیه محلول درصدی، در نهایت حجم محلول ساخته شده بر حسب درصد حجمی، درصد وزنی یا درصد وزنی – حجمی گزارش میشود. این درصدها، وزن یا حجم نمونه حلشونده را به محلول بیان میکنند. اگر نمونه مورد استفاده جامد باشد، درصد وزنی – حجمی برای گزارش غلظت استفاده میشود. فرمول محاسبه این واحد غلظت به شکل زیر است.
اگر نمونه مورد استفاده مایع باشد، از غلظت درصد حجمی استفاده میشود که در آن حجم حلشونده به حجم محلول محاسبه میشود.
برای مثال، یک محلول ۵ درصد حجمی اتانول شامل ۵ میلیلیتر اتانول خالص خواهد بود که با ۱۰۰ میلیلیتر آب رقیق شده است. اگر ماده حلشونده جامد باشد و مقدار وزن حلال (محلول) را نیز داشته باشیم میتوانیم غلظت را بر حسب درصد وزنی گزارش کنیم. فرمول محاسبه این غلظت به شکل زیر است.
این روش بیان غلظت میتواند برای مثال مقدار جرم ماده حلشونده را در ۱۰۰ گرم محلول محاسبه کند. همچنین، روش دیگری نیز برای بیان غلظت نمونهها وجود دارد که وزن نمونه حلشونده را در وزن محلول به شکل درصدی بیان میکند و به آن درصد وزنی گفته میشود و با علامت w/w نمایش داده میشود.
درصد وزنی میزان گرم ماده حلشونده را در ۱۰ گرم محلول مشخص میکند. این روش بیان غلظت معمولا در محلولهای آبی تجاری مانند محلول غلیظ اسیدهای مختلف استفاده میشود و یکی از مزیتهای محلول سازی با این واحد، مستقل بودن فرآیند آن از دما است. فرمول محاسبه درصد وزنی یک محلول به شکل زیر است.
برای درک بهتر این واحدها، به مثال زیر توجه کنید.
مثال
برای تهیه ۱۰۰ میلیلیتر محلول ۱۰ درصد حجمی اتیل الکل، چند میلیلیتر از آن باید با چه مقدار آب مخلوط شود؟
پاسخ
برای تهیه ۱۰۰ میلیلیتر محلول ۱۰ درصد حجمی اتیل الکل، ۱۰ میلیلیتر از آن باید با ۹۰ میلیلیتر آب مخلوط شود.
تهیه محلول گرم در لیتر
یک محلول میتواند با حل کردن وزن مشخصی از ماده حلشونده در حجم مشخصی از حلال مشخص شود. غلظت گرم در لیتر مشخص کننده وزن ماده حلشونده در یک لیتر حلال است. برای مثال اگر ۵ گر از یک ماده در یک لیتر آب حل شده باشد، غلظت آن ۵ گرم در لیتر خواهد بود.
تهیه محلول اشباع
مقدار انحلالپذیری یک ماده بیشترین مقدار آن ماده که میتواند در دمایی مشخص در حجم مشخصی از حلال حل شود را مشخص میکند. مقدار انحلالپذیری مواد، به نوع ماده حلشونده، نوع حلال و دما وابسته است. محلول اشباع محلولی است که در دمایی مشخص نمیتواند مقدار بیشتری از ماده حلشونده را در خود حل کند و از آن «اشباع» شده است. در این وضعیت اگر به محلول اشباع، ماده حلشونده بیشتری اضافه کنیم، علیرغم هم زدن ماده اضافه شده حل نمیشود و ته ظرف تهنشین میشود.
مقدار انحلالپذیری مواد جامد به دما وابسته است و با افزایش دما افزایش مییابد. پس یک محلول اشباع در دمای بالاتر حاوی مقدار ماده حلشونده بیشتری از همان محلول در دمای پایینتر است. اگر یک محلول اشباع که در دمای بالا تهیه شده است را سرد کنیم، مقدار ماده حلشونده اضافی به شکل رسوب از محلول خارج میشود.

مقدار انحلالپذیری بیشتر مواد شیمیایی را میتوان با استفاده از کتب راهنما، برگههای ایمنی مواد شیمیایی یا نمودار حلالیت آنها به دست آورد. برای مثال، مقدار انحلالپذیری شکر در دمای ۲۰ درجه سانتیگراد برابر با ۲۰۳٫۹ گرم در ۱۰۰ میلیلیتر آب است. انحلالپذیری شکر در دمای ۱۰۰ درجه سانتیگراد برابر با ۵۰۰ گرم در ۱۰۰ میلیلیتر آب است. اگر تلاش کنیم که ۲۲۰ گرم شکر را در ۱۰۰ میلیلیتر آب در دمای ۲۰ درجه سانتیگراد حل کنیم، ۲۰۳٫۹ گرم آن حل شده و باقی آن، یعنی ۱۶٫۱ گرم ته ظرف و به شکل جامد باقی میماند. ماده حل نشده میتواند به وسیله صاف کردن و فیلتراسیون جداسازی شود.
تهیه محلول از مایعات
محلولها را میتوان با استفاده از مایعات و محلولهای مختلف نیز تهیه کرد. در این روشها، حلال یا محلول به محلولی دیگر اضافه میشود و رقیق میشود. رقیقسازی محلولها یکی از مهمترین روشهای محلول سازی در آزمایشگاه شیمی است و بسیار پرکاربرد است. در ادامه، روشها و نکات تهیه محلول از مایعات را توضیح میدهیم.
رقیق کردن محلولها
رقیقسازی فرآیند اضافه کرن حلال اضافه به یک محلول است. محلولها میتوانند با استفاده از رقیقسازی محلولهای غلیظ به دست بیایند. برای مثال در آزمایشگاهها معمولا محلولهای از قبل آماده شده و غلیظ بسیاری از اسیدها مانند اسید کلریدریک و اسید سولفوریک وجود دارد که باید برای انجام آزمایشهای مختلف رقیق شوند.
برای انجام فرآیند رقیقسازی، حجم مشخصی از محلول غلیظ اندازهگیری شده و به یک بالن حجمی منتقل میشود و سپس تا خط نشانه ظرف رقیق میشود. فرمول استفاده شده برای دستیابی به حجم و غلظت مورد نیاز از محلول غلیظ به صورت زیر است.
در فرمول بالا، عبارات c غلظت مول بر لیتر محلولهای غلیظ و رقیق و عبارات v حجم آنها را مشخص میکنند. فرمول بالا با استفاده از برابر قرار دادن تعداد مول محلول رقیق و غلیظ به دست آمده است زیرا مول ماده حلشونده با رقیق کردن محلول تغییر نمیکند.
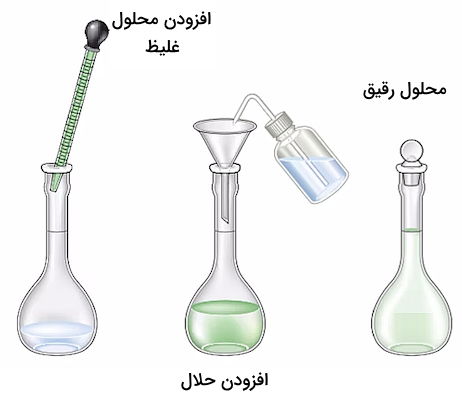
دقت داشته باشید که این معادله تنها برای محلولهایی صحیح است که غلظت آنها تابعی از حجم محلول باشد. برای مثال، غلظتهای مولاریته، فرمالیته، نرمالیته، درصد حجمی و درصد وزنی – حجمی از این موارد هستند. همچنین اگر چگالی محلول ۱ گرم بر میلیلیتر باشد، این رابطه را میتوان برای محلولهایی با غلظت درصد وزنی و قسمت در میلیون (ppm) نیز استفاده کرد. اما این رابطه برای محلولهایی با غلظت مولالیته که به جرم ماده وابسته است نمیتوان استفاده کرد.
مثال و تمرین رقیق سازی
برای درک بهتر روش محلول سازی با رقیق کردن، به مثال های زیر دقت کنید.
مثال ۱
میخواهیم یک محلول ۵۰۰ میلیلیتری از اسید کلریدریک ۰٫۵ مولار را با استفاده از محلول غلیظ ۲ مولار آن تهیه کنید. چه حجمی از محلول غلیظ مورد نیاز است؟
پاسخ
برای محاسبه غلظت محلول غلیظ مورد نیاز، از فرمول بالا استفاده کرده و غلظت و حجمهای داده شده را در آن جایگذاری میکنیم. یک طرف معادله را برای محلول غلیظ و سمت دیگر را برای محلول رقیق در نظر میگیریم.
این حجم از محلول ۲ مولار اسید کلریدریک به کمک یک پیپت مدرج به بالن حجمی ۵۰۰ میلیلیتری منتقل شده و تا به حجم رسیدن آن به آن آب مقطر اضافه میشود. با مخلوط شدن مناسب محلول، محلول به دست آمده ۵۰۰ میلیلیتر محلول ۰٫۵ مولار اسید کلریدریک خواهد بود.
مثال ۲
برای تهیه ۱۰۰ میلیلیتر محلول ۱ مولار اسید کلیدریک، به چه حجمی از محلول ۱۲٫۱ مولار این اسید نیاز داریم؟
پاسخ
مانند سوال قبل، حاصل ضرب حجم و غلظت محلول رقیق را برابر حاصل ضرب حجم و محلول اسید غلیظ قرار داده و مقدار آن را محاسبه میکنیم .
مثال ۳
چگونه میتوان ۲۵۰ میلیلیتر محلول ۰٫۱ مولار آمونیاک را با استفاده از محلول ۱۴٫۸ مولار آمونیاک تهیه کرد؟
پاسخ
برای تهیه این محلول از فرمول بالا استفاده میکنیم.
مقدار ۱٫۷ میلیلیتر آمونیاک را به مقدار آب اضافه کرده سپس محلول را به بالن حجمی ۲۵۰ میلیلیتری منتقل کرده و تا خط نشانه ظرف به آن آب اضافه میکنیم. برای درک بهتر این روش محلول سازی، به تمرینهای زیر پاسخ دهسید.
تمرین ۱
برای تهیه محلول استاندارد یون روی (II) مقدار ۱٫۰۰۴ از نمونه سیم روی در کمترینمقدر ممکن اسید کلردیدریک حل شده و تا حجم ۵۰۰ ملیلیتر رقیق میشود. اگر ۲ میلیلیتر از ایت محلول مادر تا حجم ۲۵۰ میلیلیتر رقیق شود، غلظت این یون بر حسب میکروگرم بر میلیلیتر را محاسبه کنید.
برای پاسخ به این سوال ابتدا باید غلظت محلول مادر تهیه شده از سیم روی را محاسبه کنیم. همچنین، این غلظت را بر حسب میکروگرم بر میلیلیتر محاسبه میکنیم. محاسبات به شکل زیر خواهد بود.
حال برای یافتن غلظت محلول رقیق شده، از معادله رقیقسازی محلول استفاده میکنیم.
پس غلظت محلول تهیه شده با ۲ میلیلیتر از محلول غلیظ، ۱۶٫۰۶ میکروگرم بر لیتر خواهد بود.
تمرین ۲
یک نمونه مجهول برای وجود یون مس (II) آنالیز و بررسی شده است. ۱٫۲۵ گرم از این نمونه در مقدار کمی اسید حل شده و سپس تا حجم ۲۵۰ میلیلیتر رقیق شده است. ۲۰ میلیلیتر از محلول تهیه شده به یک بالن حجمی ۲۵۰ میلیلیتری منتقل شده و رقیق شده است. غلظت مشخص شده یون مس در این محلول ۴٫۶۲ میکروگرم بر میلیلیتر بوده است. درصد جرمی مس را در نمونه اولیه محاسبه کنید.
برای حل این مسئله ابتدا غلظت محلول غلیظ را با استفاده از معادله رقیقسازی محلول به دست میآوریم.
غلظت محلول غلیظ تهیه شده از نمونه اولیه ۱۱۳۵۵ میکروگرم بر میلیلیتر بوده است. حال برای محاسبه جرم یون مس موجود در نمونه، این غلظت را در حجم کلی محلول ضرب میکنیم. محاسبات به شکل زیر است.
پس در این محلول، این مقدار از یون مس وجود داشته است. حال برای محاسبه درصد جرمی مس در نمونه اولیه، کافی است نسبت این جرم را به جرم اولیه در ۱۰۰ واحد محاسبه کنیم.
$$frac {2.888 times 10^{-3} text{ g } {Cu^{2+}}} {1.25 text{ g sample}} times 100 = 0.231 text{% w/w }{Cu^{2+}} nonumber$$
تهیه محلول از اسیدها
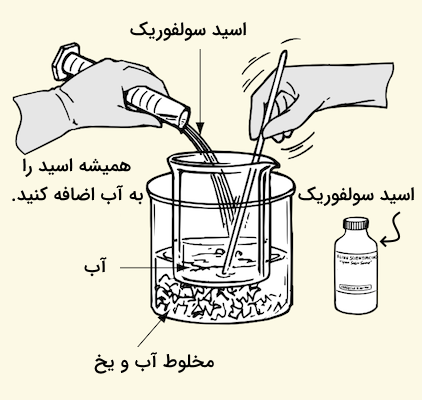
همواره برای محلول سازی از اسیدها باید این نکته را به خاطر داشته باشیم که اسید باید به آب اضافه شود و نه بالعکس. با ترکیب اسید و آب حرارت بسیار زیادی آزاد میشود که میتواند بسیار خطرناک باشد. افزایش دما در این موارد به اندازهای سریع است که میتواند به سرعت باعث رسیدن محلول به دمای جوش شده و محلول به شدت اسیدی را به اطراف بپاشد. قرار دادن ظرف آزمایش در یخ و افزایش آهسته اسید به آب میتواند از این اتفاق جلوگیری کرده و دما را تا حد ایمنی پایین نگه دارد. همچنین، با افزایش اسید به آب، محلول باید مرتبا هم زده شود.
تهیه محلول از بازها
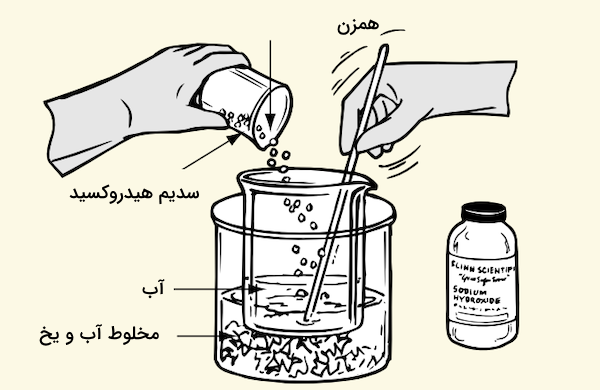
تهیه محلول از مواد با خاصیت بازی نیز میتواند مانند محلول سازی از اسیدها خطرناک باشد و باید با دقت خاصی انجام شود. برای مثال، سدیم هیدروکسید که یک باز قوی اسید، هنگام ترکیب با آب حرارت زیادی آزاد میکند. سرعت افزایش دما در این فرآیند به اندازهای زیاد است که میتواند محلولی داغ و خورند را به اطراف پرتاب کند. برای جلوگیری از این اتفاق، بهتر است که ظرف آزمایش را در مخلوط آب و یخ قرار داده و ترکیب بازی به آرامی به آب اضافه شده و مرتبا هم زده شود. همچنین، در این محلول سازیها باید به نوع ظرف مورد استفاده نیز توجه شود. شیشه بشر یا ارلن مورد استفاده باید از نوع بورسیلیکات و بدون خط و خش یا ترک و شکستگی باشد.
تبدیل واحد بین غلظت محلولها
گاهی نیاز است برای تهیه یک محلول با یک غلظت مشخص، ابتدا غلظت آن را با یک واحد به دست آورده و سپس بری ادامه آزمایش، از واحد دیگری از غلظت استفاده کنیم. به همین دلیل، یکی از مهمترین مباحثی که باید در مسیر یادگیری این موضوع که محلول سازی چیست بیاموزیم، تبدیل واحدهای غلظت به یکدیگر است.
در ادامه تبدیل واحدهای مهم مربوط به این مبحث مانند تبدی واحد بین غلظتهای درصدی و محاسبه مولاریته با استفاده از غلظت درصدی را بررسی میکنیم.
تبدیل واحدهای غلظت درصدی
گاهی نیاز است واحد درصد حجمی را به درصد وزنی یا بالعکس تبدیل کنیم. برای این کار، ابتدا حجم ماده مورد آزمایش را برحسب چگالی آن مینویسیم. سپس حجم کلی محلول را با استفاده از جرم و چگالی محلول به دست میآوریم. در نهایت نیز مقدار درصد حجمی را با استفاده از تقسیم حجم ماده حلشونده بر حجم محلول به دست میآوریم. برای درک بهتر این محاسبات، به مثال زیر توجه کنید.
مثال
۱۰ میلیلیتر محلول ۱۰ درصد وزنی اتیل الکل با حل کردن ۱۰ گرم از آن در ۹۰ گرم آب تهیه شده است. درصد حجمی آن را محاسبه کنید.
پاسخ
برای این تبدیل واحد ابتدا مقدار حجم اتیل الکل را با استفاده از چگالی آن به دست میآوریم. چگالی این ماده، ۰٫۷۹۴ گرم بر لیتر است. حجم آن با استفاده از تقسیم جرم بر چگالی به دست میآید.
سپس باید حجم محلول را محاسبه کنیم. برای این کار باید مقدار چگالی محلول ۱۰ درصد اتیل الکل را از کتب مرجع به دست آوریم. این چگالی برابر با ۰٫۹۸۳ گرم بر میلیلیتر است.
حال با تقسیم حجم حلشونده بر محلول میتوانیم درصد حجمی آن را به دست آوریم.
نکته حائز اهمیت در محلول سازی این است که درصد حجمی معمولا واحدی دقیق برای بیان غلظت است. اما درصد حجمی معمولا به شکل مستقیم از تقسیم غلظتهای مخلوط شده محاسبه نمیشود زیرا با مخلوط کردن محلولهای مختلف، حجم نهایی با جمع حجم اولیه مواد برابر نخواهد بود. برای مثال در سوال بالا، حجم الکل (۱۲٫۶ میلیلیتر) که به ۹۰ میلیلیتر آب افزوده شده، کمتر از ۱۰۲٫۶ خواهد بود.

تهیه محلول استاندارد
محلولهای استاندارد محلولهایی هستد که از قبل با غلظت و حجم مشخص تهیه شده و در آزمایشگاهها نگهداری میشوند. این محلولها با اندازهگیری و افزودن مقداری از ماده جامد یا مایع خالص به ظروف مناسب و تهیه محلول رقیق از آنها با حجم مشخص تهیه میشوند. از این محلولها در آزمایشهای مختلف استفاده میشود و معمولا قسمتی از این محلولها برداشته شده و رقیق میشود. برای مثال، برای تهیه محلولی با مولاریته مشخص، مقدار مشخصی از جرم یک ماده وزن شده و در مقداری حلال، حل شده و سس تا رسیدن به حجم مورد نظر رقیق میشود.
محلولهای استاندارد معمولا محلولهای اسید و باز با غلظتهای مشخص هستند. غلظت این محلولها معمولا ۱ مولار و حجم آنها معمولا ۱ لیتر است. این محلولها از محلولهای مادر (استوک) تهیه میشوند. محلولهای استوک نیز در غلظتها و حجمهای مشخص از قبل آماده و در آزمایشگاه نگهداری میشوند. برای مثال، محلول ۰٫۱ مولار سدیم هیدروکسید یا محلول ٪۴ استیک اسید از این موارد هستند. برای تهیه این محلولها، از محاسباتی که در ابتدای این مطلب گفته شد استفاده میشود. برای تمرین بیشتر به مثال زیر توجه کنید.

مثال ۱
توضیح دهید چگونه میتوان ۵۰۰ میلیلیتر محلول استاندارد ۰٫۲ مولار سدیم هیدروکسید را با استفاده از سدیم هیدروکسید خالص جامد تهیه کرد.
پاسخ
برای تهیه ۵۰۰ میلیلیتر محلول استاندارد ۰٫۲ مولار سدیم هیدروکسید، باید مقدار جرم مورد نیاز از این ماده را برای تهیه محلول محاسبه کنیم. مقدار جرم مولی سدیم هیدروکسید ۴۰ گرم بر مول است. با استفاده از محاسبات کمی زیر، مقدار جرم مورد نیاز این محلول به دست می آید.
پس با حل کردن ۴ گرم سدیم هیدروکسید در مقداری آب و سپس انتقال آن به بالن حجمی ۵۰۰ میلیلیتری و افزودن آب تا خط نشانه بالن، محلول استاندارد ۰٫۲ مولار سدیم هیدروکسید تهیه کردهایم.
مثال ۲
چگونه میتوان با استفاده از محلول غلیظ ٪ ۹۹٫۸ حجمی اسید استیک گلاسیال، ۲ لیتر محلول حدودا ٪۴ حجمی اسید استیک تهیه کرد؟
پاسخ
از آنجا که غلظت محلول خواسته شده دقیق نیست، میتوان از ٪۱۰۰ نبودن غلظت استیک اسید صرف نظر کرد. استیک اسید ٪۴ حجمی یعنی اینکه در هر ۱۰۰ میلیلیتر از این محلول، ۴ میلیلیتر استیک اسید وجود دارد. پس با استفاده از محاسبات زیر، میتوان حجم اسید مورد نیاز را محاسب کرد.
برای تهیه استیک اسید ٪۴ ابتدا مقداری آب به ظرف منتقل کرده و به آرامی همراه با سرد کردن و هم زدن، ۸۰ میلیلیتر اسید به آن میافزاییم و پس از انتقال محلول رقیق شده به بالن حجمی ۲ لیتری، تا رسیدن محلول به خط نشانه ظرف، به آن آب میافزاییم. انتهای سطح محدب محلول در لوله بالن حجمی باید با خط نشانه بالن مماس شود.
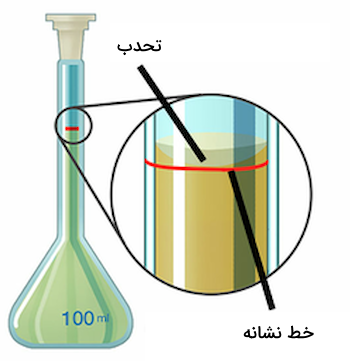
روش تهیه محلول بافر
محلولهای بافر محلولهایی هستند که با افزودن اسید یا باز به آنها، میزان اسیدیته (pH) آنها تغییر چندانی نمیکند. این مواد معمولا از ترکیب اسید ضعیف یا باز ضعیف و نمکهای آنها به دست میآید و تهیه میشود. به این ترکیبات، زوجهای اسید و باز مزدوج گفته میشود که میتوانند در برابر افزایش ملایم اسید یا باز، مقاوم باشند. محلولهای بافر با pH برابر ۴، ۷ و ۱۰ معمولا به صورت از قبل آماده شده برای خریداری وجود دارند اما روشهایی نیز برای تهیه این محلولها در آزمایشگاه شیمی وجود دارد. در ادامه، روش تولید برخی از بافرهای رایج توضیح داده شده است.
بافر ۴
برای تهیه محلول بافری با pH برابر ۴، ۵٫۱۰ گرم پتاسین هیدروژن فتالات را در ۲۵۰ سیسی آب مقطر حل کرده و ۰٫۵ میلیلیتر اسید کلریدریک ۰٫۱ به آن بیافزایید. سپس محلول را تا حجم ۵۰۰ میلیلیتر رقیق کنید.
بافر ۷
برای تهیه محلولی با اسیدیته ۷، یک محلول ۰٫۱ مولار پتاسیم فسفات مونوبازیک را با حل کردن ۳٫۴ گرم از این ماده در ۲۵۰ میلیلیتر آب تهیه میکنیم. یک محلول ۰٫۲ مولار سدیم هیدروکسید را نیز با حل کردن ۰٫۸ گرم از آن در ۲۵۰ میلیلیتر آب تهیه میکنیم. سپس ۲۵۰ میلیلیتر از محلول پتاسیم فسفات را با ۷۳ میلیلیتر از محلول سدیم هیدروکسید مخلوط کرده و تا حجم ۵۰۰ میلیلیتر رقیق میکنیم.
بافر ۱۰
برای تهیه محلولی با pH برابر ۱۰، باید محلول ۰٫۰۲۵ مولار سدیم بورات تهیه کنیم. برای این کار، ۲٫۳۸ گرم از این ماده را در ۲۵۰ میلیلیتر آب مقطر حل میکنیم. سپس محلول ۰٫۲ مولار سدیم هیدروکسید را با انحلال ۰٫۸ گرم سدیم هیدروکسدید در ۱۰۰ میلیلیتر آب مقطر تهیه میکنیم. در نهایت، ۲۵۰ میلیلیتر محلول سدیم بورات را با ۲۷ میلیلیتر محلول سدیم هیدروکسید مخلوط کرده و تا حجم ۵۰۰ میلیلیتر رقیق میکنیم.
یادگیری شیمی دانشگاهی با فرادرس
یکی از روشهای یادگیری این موضوع که محلول سازی چیست، آشنایی با مباحثی چون سیستم بینالمللی SI، واحدهای فرعی، مفهوم غلظت، تبدیل غلظتهای مختلف و استوکیومتری واکنشها است. همچنین آشنایی با نظریههای اسید و باز و قدرت اسید میتواند به ما در درک فرآیندهای محلول سازی کمک کند. پیشنهاد میکنیم برای یادگیری بهتر این مباحث، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه محلول سازی دسترسی داشته باشید.
جدول انحلالپذیری مواد معدنی
در این مطلب از مجله فرادرس آموختیم محلول سازی چیست. شناخت ترکیبات معدنی، نمکهای مختلف و قوانین کلی انحلالپذیری آنها میتواند به محلول سازی راحت تر و سریعتر کمک کند. در ادامه جدولی در مورد قوانین کلی انحلالپذیری نمکهای معدنی ارائه شده است.
| نمک معدنی | قوانین انحلالپذیری |
| نیترات | تمامی نمکهای نیترات در آب حل میشوند. |
| استات | تمامی نمکهای استات در آب حل میشوند. تنها استات نقره به شکل کامل حل نمیشود. |
| برمید، کلرید و یدید | بیشتر نمکهای این یونها در آب حل میشوند بجز در مواردی که حاوی نقره، سرب یا جیوه باشند. |
| سولفات | تمامی سولفاتها بجر سولفات باریم و سرب در آب حل میشوند. |
| هیدروژن سولفات | نمکهای هیدروژن سولفات انحلالپذیری بیشتری نسبت به سولفاتها دارند. |
| کربنات، فسفات، کرومات، سیلیکات | نمک تمامی این ترکیبات در آب انحلال ناپذیر هستند بجز در مواردی که ترکیب سدیم، پتاسیم و آمونیوم داشته باشد و همچنین کرومات منیزیم نیز در آب حل میشود. |
| هیدروکسیدها | تمامی هیدروکسیدها بجز در ترکیب با لیتیم، سدیم، پتاسیم، سزیم، روبیدیم و آمونیوم انحلالناپذیر هستند. |
| سولفیدها | تمامی سولفیدها بجز در ترکیب با سدیم، پتاسیم، آمونیوم، منیزیم، کلسیم و باریم انحلالناپزیر هستند. |
| سدیم، پتاسیم و آمونیوم | تمامی نمکهای سدیم، پتاسیم و امونیوم در آب حل میشوند. |
| نقره | تمامی نمکهای نقره انحلالناپذیر هستند. تنها نمکهای نقره نیترات، نقره کلرات و سولفات نقره مقداری در آب حل میشوند. |
source
