سدیم کلرید ترکیبی یونی است که از اتصال یونهای سدیم مثبت () و کلر منفی () به وجود آمده است. نسبت این یونها در ماده سدیم کلرید ۱ به ۱ است. سدیم کلرید معمولا با نامهای نمک، نمک طعام و کلرید سدیم شناخته میشود. فرمول شیمیایی این ماده () است که از نمادهای شیمیایی عنصر سدیم و عنصر کلر تشکیل شده است. این ماده یک ماده معدنی بسیار مهم و پرکاربرد است که در بسیاری از صنایع به شکل گستردهای کاربرد دارد. در این مطلب از مجله فرادرس میآموزیم سدیم کلرید چیست، چه ویژگیهایی دارد و کاربردهای آن چیست.

در ابتدای این مطلب میآموزیم سدیم کلرید چیست و از چه ترکیباتی تشکیل شده است. سپس فرمول این ماده را بررسی کرده و ساختار آن را توضیح میدهیم. پس از آن ویژگیهای کلرید سدیم را برشمرده و ساختار شیمیایی محلول آبی آن را بررسی میکنیم. در ادامه، میآموزیم منابع و روشهای تولید سدیم کلرید چیست. سپس کاربردهای این ماده و اثر نمک بر سلامت بدن را بررسی میکنیم. درنهایت میآموزیم این ماده در چه مواد غذایی وجود دارد و چه موادی به آن اضافه میشود. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید سدیم کلرید چیست و چه خواصی دارد.
سدیم کلرید چیست؟
سدیم کلرید یا نمک خوراکی، یک ترکیب یونی متشکل از اتمهای سدیم و کلر است. در واقع این ماده از به هم پیوستن یونهای سدیم مثبت و کلر منفی به وسیله پیوند یونی تشکیل میشود. این ماده کریستالهای شفاف و طعمی شور دارد. بسیاری از سیستمهای زیستی و بیولوژیکی حیوانات و جانوران بدون وجود ماده این ماده قادر به عملکرد صحیح نخواهند بود. این ماده به عنوان یک محلول الکترولیت در سلولها، اندامها و سیستمها عمل میکند.
این ماده همچنین برای اقیانوسها و دریاها نیز مادهای ضروری است. حدود ۷۷٫۷۶۶ درصد تمامی نمکهای موجود در اقیانوسها از کلرید سدیم شکیل شده است. این شور بودن آب دریاها و اقیانوسها بر جریان موجود در این آبها، ظرفیت گرمایی آنها و سیستم آب و هوا به شکل کلی تاثیر میگذارد.

فرمول سدیم کلرید چیست؟
سدیم کلرید یک ترکیب ساده تشکیل شده از ۲ عنصر است. این دو عنصر، سدیم و کلر هستند. این عناصر به شکل ترکیب یونی در ساختار کریستالی این ماده قرار گرفتهاند و در صورت انحلال در آب یونهای سدیم و کلر آزاد میکنند. جرم مولی این ماده برابر با ۵۸٫۴۳۳ گرم بر مول است.
پیوندهای یونی مولکول نمک به اندازهای قدرتمند هستند که برای شکستن آنها به انرژی بسیار زیادی نیاز است. برای مثال، نقطه ذوب سدیم کلرید ۸۰۰٫۷ درجه سانتیگراد است. پیوندهای یونی موجود در این ماده، یک شبکه بلوری محکم را میسازند که انرژی شبکه بلوری آن برابر با ۷۸۷٫۳ کیلوژول بر مول است. میزان حلالیت کلرید سدیم در دمای ۲۵ درجه سانتیگراد برابر با ۳۶۰ گرم در هر لیتر آب است.
یادگیری علوم هفتم با فرادرس
برای درک بهتر این موضوع که سدیم کلرید چیست، نیاز است ابتدا با مفاهیی چون ماده، اتم، مولکول، واحدهای اندازهگیری و تغییرات فیزیکی و تغییرات شیمیایی آشنا شویم. همچنین، شناخت مفاهیمی چون انحلالپذیری و واکنشهای شیمیایی به ما در درک ویژگیهای کلرید سدیم کمک میکند. پیشنهاد میکنیم برای درک بهتر این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه هفتم، بخش علوم مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که در ادامه اورده شده است میتوانید به آموزشهای بیشتری در مورد سدیم کلرید دسترسی داشته باشید.
ساختار سدیم کلرید
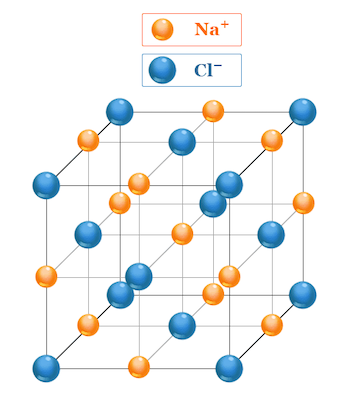
در قسمتهای قبل آموختیم سدیم کلرید چیست. در ساختار این ماده (نمک طعام) هر یون سدیم توسط شش یون کلرید و هر یون کلرید توسط شش یون سدیم احاطه شده است. این آرایش مولکولی پایداری بالایی از نظر نیروهای جاذبه الکترواستاتیکی دارد. یونهای کلرید بزرگتر هستند و به شکل یک شبکه مکعبی منظم کنار هم قرار میگیرند. یونهای کوچکتر سدیم در فضای خالی بین آرایش مکعبی یونهای کلرید جای میگیرند. این نوع ساختار، ساختار نمک سنگی یا ساختار NaCl نام دارد.
این ساختار باعث به وجود آمدن برخی ویژگیهای منحصر به فرد برای کلرید سدیم شده است. برای مثال نقطه ذوب (۸۰۱ درجه سانتیگراد) و نقطه جوش (۱۴۶۵ درجه سانتیگراد) بالای این ماده در نتیجه این ساختار مستحکم به وجود آمدهاند. این پیوندها توسط جاذبه یونهای مثبت و منفی به وجود آمده است. یونهای مثبت سدیم و یونهای منفی کلر به شدت یکدیگر را مانند دو قطب مثبت و منفی آهنربا جذب میکنند. اگر به شکلی به ساختار این مولکول ضربه وارد شود که یونهای کلر و سدیم در مجاورت یون همنوع خودشان قرار گیرند، بر اثر دافعه بین یونهای همنوع، یک لایه از نمک شکسته و جدا میشود.

ویژگی های سدیم کلرید
سدیم کلرید یا نمک یک پودر یا کریستال بیرنگ، بدون بو و با مزه شور است. نام عمومی این ماده نمک طعام یا نمک خوراکی است که یکی از مواد غذایی ضروری برای بدن انسان است. این ماده در طبیعت به شکل کانی هالیت استخراج میشود.
این ماده خالص بیرنگ است اما اگر این ماده دارای ناخالصی باشد میتواند رنگهای دیگری مانند بنفش، آبی، زرد، صورتی یا سفید داشته باشد. در ادامه توضیح میدهیم خواص فیزیکی و شیمیایی سدیم کلرید چیست.

خواص فیزیکی سدیم کلرید
سدیم کلرید در آب حل میشود و مقدار حلالیت آن خیلی به دما وابسته نیست. برای مثال، در دمای ۲۱ درجه سانتیگراد، ۳۵٫۹ گرم این ماده در ۱۰۰ گرم آب حل میشود. در دمای ۱۰۰ درجه سانتیگراد، ۳۸٫۱ گرم از این ماده در ۱۰۰ گرم آب حل میشود. این ماده ساختاری بلوری و مکعبی دارد که معمولا در آن یونهای سدیم در بالا قرار میگیرند. دمای ذوب سدیم کلرید ۸۰۰٫۸ درجه سانتیگراد است و نقطه جوش آن ۱۴۶۵ درجه سانتیگراد است.
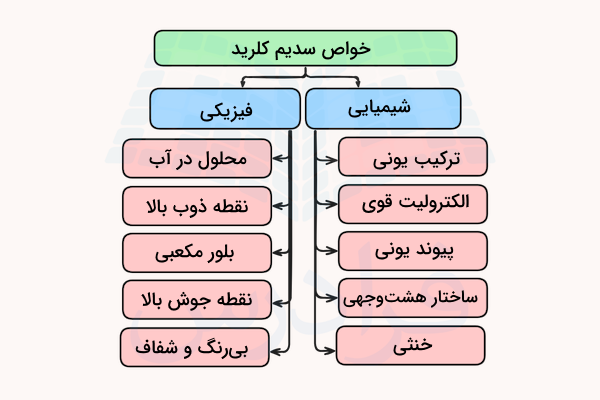
خواص شیمیایی سدیم کلرید
سدیم کلید یک نمک است که در نتیجه واکنش اسید و باز ایجاد میشود. این ماده یک الکترولیت بسیار قوی است. یونها در این ترکیب به وسیله پیوندهای یونی بسیار قوی به هم متصل شدهاند و وجود ساختار کریستالی مستحکم آن به همین دلیل است. ساختار هندسی اطراف هر یون سدیم و کلر اوکتاهدرال (هشت وجهی) است.
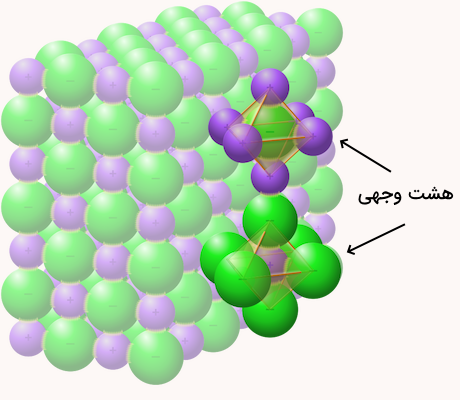
پیوند بین یونهای سدیم و کلر تنها به وسیله حلالهای قطبی مانند آب قابل شکستن است. کلرید سدیم محلول در آب، یونهای سدیم و کلر آزاد میکند و این یونها در آب، محلول الکترولیتی قوی تولید میکنند که میتواند به خوبی جریان الکتریکی را از خود عبور دهد.
محلول آبی سدیم کلرید
جاذبه قوی بین یونهای سدیم و کلر در ترکیب جامد این ماده به اندازهای زیاد است که این ماده تنها در حلالهای قطبی مانند آب حل میشود. زمانی که بلورهای سدیم کلرید در آب حل میشوند، پیوندهای یونی بین سدیم و کلر شکسته شده و یونهای سدیم و کلر در محلول آبی آن آزاد میشود.
سدیم کلرید یا همان نمک طعام بهراحتی در آب حل میشود، چون آب یک حلال قطبی قوی است و میتواند پیوند بین یونهای مثبت سدیم و یونهای منفی کلرید را بشکند. بعد از حل شدن، یونهای سدیم با حدود ۸ مولکول آب و یونهای کلرید با حدود ۶ مولکول آب احاطه میشوند. خواص این محلولها با واص آب خالص متفاوت است. برای مثال نقطه انجماد محلول اشباع نمک به ۲۱ درجه زیر صفر میرسد و نقطه جوش آن تا حدود ۱۰۹ درجه بالا میرود.
محلول رقیق سدیم کلرید pH خنثی دارد، چون یون کلرید که از اسید قوی HCl بهوجود میآید، خاصیت بازی بسیار ضعیفی دارد و روی pH تأثیر نمیگذارد. این ماده در آب بسیار خوب حل میشود ولی در بسیاری از حلالهای دیگر، مانند الکل و استون، انحلالپذیری بسیار پایینی دارد.
منابع سدیم کلرید
منابع اصلی کلرید سدیم شامل آب دریا، آبهای شور طبیعی و سنگهای نمک هستند. نمک در پوسته زمین به صورت مادهای معدنی به نام هالیت یا سنگ نمک وجود دارد. مقدار بسیار کمی از نمک نیز به صورت ذرات معلق در هوا دیده میشود. این ذرات نقش مهمیدر تشکیل ابرها دارند، به ویژه در مناطق دور از خشکی که هوا آلودگی صنعتی ندارد. در ادامه توضیح میدهیم هر یک از این منابع سدیم کلرید چیست.
استخراج نمکها و استفاده از آنها برای فرآیندهای مختلف یکی از مهم ترین فرآیندهای مطرح شده در صنعت است. پیشنهاد میکنیم برای آشنایی بیشتر با این زمینه، فیلم آموزش نمکسازی و کاربردهای آن در صنعت فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
آب دریا
نمک درصد بسیار زیادی از مواد حل شده در آب دریا را تشکیل میدهد. با وجود اینکه شوری اب دریا به دلیل وجود ترکیبات متفاوتی در آن است، این ماده فراوانترین ترکیب بین سایر مواد حل شده در آب دریا است. طبق تخمینهای انجام شده، ۴ لیتر آب دریا حدود ۱۰۵ گرم از این ماده خواهد داشت. تخمین زده شده است که اگر اقیانوسها و دریاهای کل زمین را خشک کنیم، حداقل ۴٫۵ میلیون متر مکعب سدیم کلرید باقی خواهد ماند. ترکیب آب دریا در نقاط مختلف زمین متفاوت است و درصد نمک این آبها نیز میتواند متفاوت باشد. ترکیبات دیگر حل شده در آب دریاها مواردی مانند منیزیم کلرید، منیزیم سولفات، کلسیم سولفات، پتاسیم کلرید، منیزیم برمید و کلسیم کربنات هستند.
آب های شور طبیعی
آب شور یا آب نمک محلول آب نمکی است که درصد بسیار زیادی سدیم کلرید در خود حل کرده است. آبهای شور طبیعی اهمیت زیادی از لحاظ تجاری و برای تولید نمک دارند. نمک موجود در آبهای شور طبیعی معمولا با ترکیباتی چون کلریدها و سولفاتهای پتاسیم، کلسیم و منیزیم و کربناتها و عنصر برم همراه است.
از مثالهای آبهای شور طبیعی میتوان به دریاچه ارومیه در ایران اشاره کرد که در کنار وسعت زیاد، منبعی غنی از انواع نمکها از جمله سدیم کلرید است. این دریاچه در بهار بین ۸ تا ۱۱ درصد و در پاییز بین ۲۶ تا ۲۸ درصد نمک دارد.

سدیم کلرید یکی از مهمترین نمکهای موجود در طبیعت است که در بسیاری از صنایع استفاده می شود. نمکها از واکنش خنثی شدن اسید و باز به وجود میآیند و به اندازه گستره وسیع اسیدها و بازها میتوان نمک به دست آورد. پیشنهاد میکنیم برای آشنایی بیشتر با این مواد، مطلب انواع نمکها در شیمی مجله فرادرس را مطالعه کنید.
سنگ نمک
سنگ نمک قطعهای بلوری و بزرگ از کلرید سدیم است که با نام هالیت شناخته میشود. این کانی به شکل سنگ در مناطق جغرافیایی مختلف تشکیل میشود. به دلیل حلالیت بسیار بالای این ماده در آب، معمولا در مناطق مرطوب روی آن با لایهای پوشانده میشود. تمامی سنگ نمکها از تبخیر آبهای شور و آب دریاها به مرور زمان به دست امده اند. با تبخیر حدود نه دهم این آبها، سنگ نمک به دست میآید. در این ترکیبات معمولا کلسیم سولفات و نمکهای پتاسیم و منیزیم نیز وجود دارد.
تولید سدیم کلرید
امروزه نمک بهصورت گسترده از طریق تبخیر آب دریا یا آبهای شور (مانند چاههای آب شور و دریاچههای نمک) تولید میشود. استخراج سنگ نمک نیز یکی از منابع اصلی تولید آن است. چین بزرگترین تولیدکننده نمک در جهان است. در سال ۲۰۱۷، تولید جهانی نمک حدود ۲۸۰ میلیون تن برآورد شد که چین با ۶۸ میلیون تن، آمریکا با ۴۳، هند با ۲۶، آلمان و کانادا هر کدام با ۱۳ میلیون تن، در صدر تولیدکنندگان قرار داشتند. همچنین نمک بهعنوان محصول جانبی استخراج پتاسیم نیز بهدست میآید.

تبخیر آب شور یکی از رایجترین روشهای تولید نمک است و در کشورهای زیادی از جمله هند کاربرد دارد. با این حال، نمک بلورین معمولا حاوی ناخالصیهایی مانند سولفات سدیم، سولفات کلسیم و سایر ترکیبات است. برای به دست آوردن بلور خالص این ماده، ابتدا این بلورها در آب حل شده و سپس از طریق فرآیند فیلتراسیون، تصفیه میشود.

یکی دیگر از روشهای به دست آوردن نمک خالص، استفاده از کانی هالیت است. از آنجا که محلولهای نمکی میتوانند سدیم کلرید (NaCl) تولید کنند، استخراج این ذخایر آسانتر میشود. در این روش، نمکها در آب حل میشوند و سپس محلول حاصل از محل استخراج پمپ میشود.
واکنشهای سدیم کلرید
کلرید سدیم یک ماده اولیه معدنی بسیار مهم است که برای تولید انواع مواد شیمیایی صنعتی کاربرد دارد. در فرآیند «کلر- قلیا» (Chloralkali process)، کلرید سدیم ماده اولیهای است که طی الکترولیز برای تولید کلر و سدیم هیدروکسید به کار میرود. واکنش این فرآیند به شکل زیر است.
همچنین، کلرید سدیم در «فرآیند سلوی» (Solvay process) به کربنات سدیم () و کلرید کلسیم () تبدیل میشود. واکنش این فرآیند به شکل زیر است.
این ماده در «فرآیند مانهایم» (Mannheim process) نیز برای تولید سولفات سدیم و اسید هیدروکلریک استفاده میشود. واکنش این فرآیند به شکل زیر است.
این مواد شیمیایی صنعتی به طور گسترده در صنعت سودا – اش (Soda-ash industry) برای ساخت شیشه، رنگ، و بسیاری از محصولات خانگی و تجاری دیگر به کار میروند. این ماده با بسیاری از ترکیبات واکنش میدهد و مادهای فعال است. برای مثال، واکنش این ماده و نیترات نقره به شکل زیر است.
همچنین، سدیم کلرید و اسید سولفوریک واکنش میدهند و اسید کلریدریک و سولفات سدیم تولید میکنند.
کاربرد سدیم کلرید چیست؟
سدیم کلرید مادهای با حلالیت بالا در آب است. این خاصیت سدیم کلرید آن را به عنوان یک ماده جاذب بسیار خوب تبدیل میکند. این ماده به خوبی میتواند رطوبت را به خود جذب کرده و باعث خشکی محیط شود. این خاصیت کلرید سدیم را به مادهای برای نگهداری و حفظ مواد غذایی تبدیل کرده است. به همین علت است که برخی برای نگهداری از برخی از مواد غذایی آنها را نمک سود میکنند.
این ماده در ترکیب با سدیم کربنات و سدیم بیکربنات نیز به عنوان یک ماده جاذب در نگه داری وسایل و مومیایی کردن اجساد استفاده شده است. در ادامه توضیح میدهیم مهمترین کاربردهای سدیم کلرید چیست.
الکترولیت
الکترولیتها موادی هستند که به خوبی جریان الکتریکی را از خود عبور میدهند. این ترکیبات معمولا ترکیبات یونی هستند که در صورت انحلال در آب به یونهای سازنده شان تفکیک میشوند. این ماده نیز یک ماده الکترولیت است که در صورت انحلال در آب به یونهای سازنده اش تفکیک میشود. محلول این ماده یک الکترولیت است که برای تامین سدیم بدن باید مصرف شود. همچنین، استفاده از محلول الکترولیت این ماده در مقادیر مناسب میتواند از دیهیدراسیون بدن و از دست رفتن آب آن جلوگیری کند.
سدیم کلرید به عنوان محلول الکترولیت موجود در بدن وظایفی مهم مانند انتقال مواد مغذی به سلولها را بر عهده دارد. این یونها میتوانند فشار خون را تنظیم کرده و تعادی مایعات بدن را با استفاده از فشار اسمزی تامین کنند. کلرید سدیم به عنوان محلول الکترولیت در بدن نقش انتقال صحیح سیگنالهای عصبی را به عضلات را نیز بر عهده دارد.
آب و هوا
حدود ۳ درصد آب دریا از نمک تشکیل شده است. این درصد در مناطق مختلف بین ۱ تا ۵ درصد متغیر است. وجود سدیم کلرید به همراه سایر نمکها مانند منیزیم کلرید و کلسیم کربنات در آب دریاها چگالی این آبها را به وجود آورده است. این ماده رایجترین نمک موجود در آب دریاهاست و نقش مهمی را در آب و هوا ایفا میکند. وجود این ماده در آب باعث تعادل دمای دریاها و اقیانوسها شده و به جریان آب آن کمک میکند. به همین ترتیب وجود کلرید سدیم در آب و هوا میتواند حتی به وقوع طوفان نیز بیانجامد و به آن کمک کند.

تولیدات شیمیایی
حجم بسیار زیادی از سدیم کلرید، سالانه برای واکنشها و فرآیندهای شیمیایی تولید میشود. کلرید سدیم میتواند به عنوان پیش ماده، واکنشدهنده یا فرآورده تولیدات شیمیایی مقیاس بالا استفاده شود. برای مثال، این ماده به عنوان نقطه شروع فرآیندهای بازی صنعتی تولید کلر و سدیم هیدروکسید طی فرآیند الکترولیز مقیاس بالا استفاده میشود. واکنش زیر واکنش شیمیایی این فرآیند است.
صنعت خاکستر کربنات
در صنعت خاکستر کربنات (Soda Ash Industry) سدیم کلرید برای تولید کربنات سدیم و کلرید کلسیم استفاده میشود. سدیم کربنات برای تولید شیشه، سدیم بیکربنات و بسیاری از مواد شیمیایی دیگر به کار میرود. همچنین از این ماده برای تولید سولفات سدیم و اسید کلریدریک نیز استفاده میشود.
کاربردهای صنعتی گوناگون
نمک به طور گستردهای در صنایع مختلف استفاده میشود و حتی کاربردهای نسبتا کوچک میتوانند مقادیر عظیمی از آن را مصرف کنند. در اکتشاف نفت و گاز، نمک بخش مهمی از سیالات حفاری است که در حفاری چاهها به کار میرود. این ماده برای افزایش چگالی سیال حفاری و مقابله با فشار گازهای زیاد در چاه استفاده میشود. نمک همچنین برای تسریع فرآیند سخت شدن بتن در پوششهای سیمانی به کار میرود.
در ادامه برخی از کاربردهای این ماده در سایر صنایع را بررسی میکنیم.
صنعت نساجی
در صنعت نساجی و رنگرزی، نمک برای شستوشوی نمکی جهت جداسازی آلودگیهای ارگانیک، افزایش رسوبگیری رنگدانهها و افزایش عملکرد رنگها استفاده میشود. یکی از کاربردهای اصلی این ماده، تولید بار یون مثبت برای جذب یونهای منفی موجود در رنگها است.
کاغذسازی
در صنعت کاغذسازی، از نمک برای تولید سدیم کلرات استفاده میشود. این ماده سپس با اسید سولفوریک و متانول واکنش داده و دی اکسید کلر تولید میشود که یک ماده سفید کننده برای خمیر چوب است.
چرم
در صنعت دباغی و فرآوری چرم، نمک به پوستهای حیوانی اضافه میشود تا از فعالیت میکروبی در زیر سطح پوست جلوگیری کرده و رطوبت را به پوست بازگرداند.
تولید لاستیک
در تولید لاستیک، نمک برای ساخت انواع لاستیک یونا، نئوپرن و لاستیک سفید به کار میرود. نمک و اسید سولفوریک برای لختهسازی لاتکس امولسیونی تولید شده از کلرهشدهی بوتادیان استفاده میشود.
راهسازی
نمک همچنین برای تثبیت خاک و استحکام بخشیدن به بنیانهای جادهها استفاده میشود. این نمک برای کاهش اثرات تغییرات رطوبت و بار ترافیکی که در زیرسطح خاک ایجاد میشود به کار میرود.
نرم کردن آب
یکی دیگر از کاربردهای عظیم سدیم کلرید، فرآیند نرم کردن آب و حذف برخی از نمکها از آن است. منابع آب طبیعی شامل مواد معدنی ماند ترکیبات کلسیم و منیزیم هستند که به شکل ترکیب یونی در آن حل شدهاند. این ترکیبات باعث ایجاد لایه ای از مواد جامد در سیستمهای لوله گشی میشوند. کلرید سدیم برای تولید رزینهای تبادل یونی رای تصفیه و حذف آب استفاده میشود.
ذوب یخ
ار سدیم کلرید در فرآیند ذوب یخهای جادهها و راهها استفاده میشود. این ماده توانایی تاثیر بر نقطه ذوب آب را دارد و باعث میشود ذوب آن در دمای پایینتر از صفر درجه سانتی گراد آغاز شود. اما این روش برای کاهش نقطه ذوب یخها و برفهای جادهای تبعاتی را به همراه دارد.

نمک جادهای وارد آبهای شیرین میشود و میتواند به گیاهان و حیوانات آبزی آسیب بزند، زیرا باعث اختلال در تنظیم اسمزی آنها میشود. میزان نمک قابل قبول، طبق مقررات بینالمللی، ۵۰ میلیگرم بر مترمربع است. در زمینه یخزدایی جادهها، نمک به خوردگی پلها، وسایل نقلیه و ساختارهای فولادی جادهها منجر میشود. همچنین نمک میتواند به خاک، گیاهان کنار جاده و منابع آب محلی آسیب برساند. اگرچه در زمانهای اوج استفاده از نمک مشکلات زیستمحیطی بیشتری دیده میشود، اما بارانهای بهاری معمولا این غلظتها را کاهش میدهند.
در حال حاضر برخی از سازمانها به جای نمک از مواد دیگری مثل آبجو، ملاس و آب چغندر استفاده میکنند. همچنین، خطوط هوایی بیشتر به جای محلولهای نمکی از گلیکول و شکر برای یخزدایی استفاده میکنند.
صنایع غذایی
سدیم کلرید توسط تولیدکننده غذا یا توسط مصرفکننده، بهعنوان یک تقویتکننده طعم، نگهدارنده، عامل بایندر (چسبنده)، افزودنی کنترلکننده تخمیر، عامل کنترلکننده بافت و توسعهدهنده رنگ به غذا اضافه میشود. مصرف این ماده در صنعت غذا شامل فرآوری سایر مواد غذایی، فرآوردههای گوشتی، کنسروسازی، نانوایی، لبنیات و محصولات آسیاب دانه است.
بهبود کیفیت مواد غذایی
نمک به توسعه رنگ در گوشتهای فرآوریشده مانند کالباس کمک میکند. نمک به عنوان یک نگهدارنده، رشد باکتریها را مهار میکند. همچنین نمک بهعنوان یک بایندر در سوسیسها عمل میکند و یک ژل چسبنده از گوشت، چربی و رطوبت تشکیل میدهد. نمک همچنین بهعنوان یک تقویتکننده طعم عمل میکند.
ماده خشک کننده
سدیم کلرید بهعنوان یک ماده خشککننده ارزان و ایمن استفاده میشود، زیرا خاصیت جذب رطوبت دارد که باعث میشود نمکزنی یک روش موثر برای نگهداری غذا در طول تاریخ باشد. نمک از طریق فشار اسمزی، آب را از باکتریها خارج میکند و از تکثیر آنها جلوگیری میکند، که یکی از عوامل اصلی فساد غذا است. با اینکه مواد خشککننده موثرتری وجود دارند، تعداد کمی از آنها برای انسانها ایمن هستند. بسیاری از میکروارگانیسمها در محیطی نمکی قادر به زندگی نیستند، زیرا آب از سلولهای آنها توسط اسمز خارج میشود. به همین دلیل نمک برای نگهداری برخی از غذاها مانند ماهی نمک اضافه میشود.

بهبود تخمیر و بافت
در بسیاری از صنایع لبنی، نمک به پنیر افزوده میشود تا به کنترل رنگ، تخمیر و بافت کمک کند. در صنعت کنسروسازی، نمک عمدتا برای افزایش طعم و نگهداری محصول به کار میرود.در نانوایی، نمک به کنترل سرعت تخمیر خمیر نان کمک میکند. همچنین باعث تقویت گلوتن (ترکیب پروتئینی-آبی کشسان در برخی خمیرها) و بهبود طعم میشود و در مواردی بهعنوان پوششی بر روی محصولات پختهشده به کار میرود نمک همچنین بهعنوان عامل طعمدهنده در محصولاتی مانند چیپس سیبزمینی، چوبشور و غذای سگ و گربه به کار میرود.
پزشکی و داروسازی
از محلول این ماده و آب برای درمانهای تزریقی استفاده میشود. اسپریهای بینی نیز مقداری کلرید سدیم دارند. قرص سدیم کلرید خوراکی نیز برای دمان سطح پایین سدیم در بدن مصرف میشود.
اطفای حریق
سدیم کلرید یکی از مادههای خاموش کننده آتش پودری است. از این ماده برای خاموش کردن فلزات اشتعال پذیر مانند منیزیم، زیکونیوم، تیتانیوم و لیتیوم استفاده میشود. نمک با ایجاد یک لایه پوستهای مانع رسیدن اکسیژن شده و آتش را خاموش میکند.
اپتیک مادون قرمز
در زمینه اپتیک مادون قرمز، بلورهای کلرید سدیم حداقل ۹۰٪ عبور نور (در ضخامت ۱ میلیمتر) برای طول موجهای بین ۰.۲ تا ۱۸ میکرومتر دارند. این بلورها زمانی برای ساخت اجزای نوری مثل پنجرهها و لنزها به کار میرفتند. بلورهای این ماده ارزان هستند، نرم و رطوبتپذیرند و وقتی در معرض رطوبت هوا قرار میگیرند، به مرور پوششی از شبنم روی آنها تشکیل میشود.
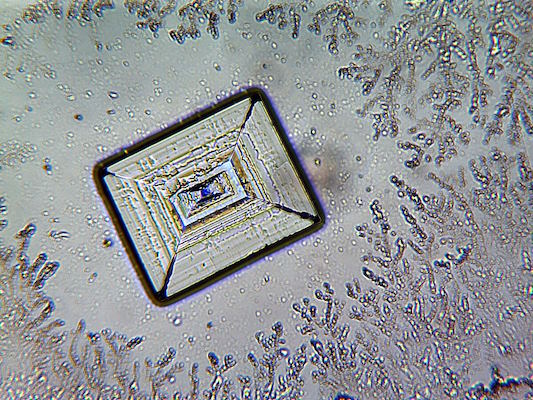
این ویژگی کلرید سدیم را به محیطهای خشک، محفظههای خلأ یا استفادههای کوتاهمدت مثل نمونهسازی محدود میکند.
اثر سدیم کلرید بر سلامت انسان
سدیم کلرید یک الکترولیت ضروری بدن است و وجود آن در بدن برای انجام بسیاری از فعالیتهای بدن حیاتی است. به همین دلیل، وجود این ماده در بدن نه تنها ایمن است حتی ضروری است. با این وجود، مصرف بیش از اندازه این ماده باعث مشکلات بسیاری میشود.
برای مثال، میزان غلظت کشنده سدیم کلرید حدود ۰٫۷۵ تا ۳ گرم در هر کیلوگرم نسبت به وزن انسان است. برای یک انسان بالغ با وزن ۷۵ کیلوگرم، مقدار مصرف نمک باید حدود ۵۶ تا ۲۵۵ گرم باشد و مقدار بیشتر از آن میتواند برای فرد خطرات جانی به همرا داشته باشد. به همین شکل، وجود درصد بالای کلرید سدیم در آب اقیانوسها آن را به آبی غیر قابل شرب برای انسانها تبدیل کرده است. مصرف بیش از اندازه این ماده میتواند باعث بروز مشکلاتی مانند بیماری کلیه، فشار خون بالا، کم آبی بدن و مشکلات قلبی شود.
کلرید سدیم به شکل سرم تزریقی سدیم کلرید و به شکل محلول شست و شوی نرمال سالین برای مصارف پزشکی و ضدعفونی عرضه میشود. این ماده در بدن مواد مغذی را جذب و پخش کرده، فشار خون را تنظیم می کند، تعادل مایعات بدن را حفظ کرده و سیگنالهای عصبی را منتقل میکند. غلظت کلرید سدیم در این مواد معمولا ۹ درصد است.
سدیم کلرید در چه موادی وجود دارد؟
سدیم کلرید به عنوان یک ماده شیمیایی در بسیاری از مواد غذایی وجود دارد. مواد غذایی و خوراکیهای فرآوردی شده معمولا درصد نمک بسیار بالایی دارند. نمک در این غذاها علاوه بر خواص نگهدارندگی، به مواد غذایی طعم میدهد. به علاوه، تقریبا تمامی مواد غذایی مقداری کلرید سدیم دارند. در ادامه برخی از مواد غذایی که به شکل طبیعی دارای سدیم کلرید هستند معرفی شدهاند.
- میگو: حدود ۸۵ گرم از میگوی یخ زده حدود ۸۰۰ میلیگرم سدیم دارد که حدود ۳۵ درصد نیاز مصرفی روزانه انسان است.
- گوشت قرمز: حدود ۸۵ گرم گوشت قرمز به طور میانگین ۱۱۱۷ ملیگرم سدیم دارد که حدود ۴۸ درصد نیاز روزانه انسان را تشکیل میدهد.
- پیتزا: یک تکه پیتزای ۱۴۰ گرمی ۷۶۵ میلی گرم از این ماده را دارد.
- بیسکوییت: یک عدد بیسکویت حدود ۵۲۸ گرم سدیم دارد که حدود ۲۳ درصد نیاز روزانه انسان است.
یادگیری شیمی دانشگاهی با فرادرس
یادگیری این موضوع که سدیم کلرید چیست و چه ویژگیهایی دارد، نیازمند درک مفاهیمی چون انرژی شبکه بلور، تبلور مواد، انواع پیوند شیمیایی، روشهای جداسازی مواد و … است. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه سدیم کلرید و ساختار بلوری آن دسترسی داشته باشید.
مواد افزودنی به نمک
در این مطلب از مجله فرادرس آموختیم سدیم کلرید چیست. نمک طبیعی به طور طبیعی حاوی انواعی از ترکیبات شیمیایی است. هنگام فرآوری آن به نمک خوراکی، ممکن است افزودنیهایی نیز به آن اضافه شود.
ید
یکی از رایجترین افزودنیها، ید است که به شکل یدید پتاسیم، یدید سدیم یا یدات سدیم به نمک افزوده میشود. نمک یددار ممکن است حاوی دکستروز (نوعی قند) نیز باشد تا پایداری ید را حفظ کند. کمبود ید یکی از بزرگترین علل قابل پیشگیری ناتوانیهای ذهنی (که در گذشته به عقبماندگی ذهنی معروف بود) محسوب میشود.
افزودن ید به نمک به جلوگیری از کرتینیسم در کودکان و کمکاری تیروئید و گواتر در بزرگسالان کمک میکند. در برخی کشورها، ید به صورت روتین به نمک افزوده میشود و محصولاتی که این افزودنی را ندارند، با عنوان «نمک بدون ید» شناخته میشوند. نمک بدون ید به این معنا نیست که ترکیباتی از آن حذف شده، بلکه فقط ید اضافی به آن افزوده نشده است.
سدیم فلوئورید
افزودنی رایج دیگر، فلوراید سدیم است. فلوراید برای جلوگیری از پوسیدگی دندان به نمک اضافه میشود و این کار بیشتر در کشورهایی انجام میشود که آب آشامیدنی را فلورایددار نمیکنند.
آهن
نمک دوگانه تقویتشده حاوی نمکهای آهن و ید است. منبع معمول آهن در این نوع نمک، فروس فومارات است که برای پیشگیری از کمخونی ناشی از فقر آهن به نمک افزوده میشود.
ویتامین ب
افزودنی دیگر، اسید فولیک (ویتامین B9) است. اسید فولیک یا فولیسین به نمک اضافه میشود تا از بروز نقصهای لوله عصبی و کمخونی در نوزادان در حال رشد جلوگیری کند. نمک غنیشده با فولیسین به دلیل وجود این ویتامین رنگی زرد متمایل به طلایی دارد.
عوامل ضدکلوخه
برای جلوگیری از چسبیدن دانههای نمک به یکدیگر، عوامل ضدکلوخه نیز به نمک افزوده میشوند. برخی از مواد شیمیایی رایج مورد استفاده مواردی مانند کلسیم آلومینوسیلیکات، کلسیم کربنات، کلسیم سیلیکات، نمکهای اسیدهای چرب، منیزیم کربنات، منیزیم اکسید، سیلیکون دیاکسید، سدیم آلومینوسیلیکات، سدیم فروسیانید و تریکلسیم فسفات هستند.
source
