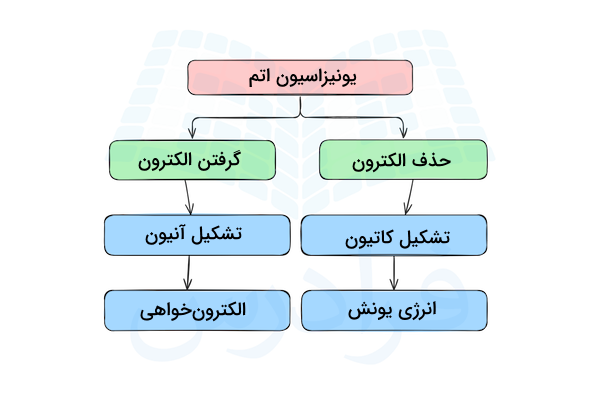
یونیزاسیون فرآیندی است که در آن اتمها الکترون از دست داده یا دریافت میکنند و یونها را تشکیل میدهند. اگر یک اتم یا مولکول چند اتمی الکترون دریافت کند، بار آن منفی خواهد شد و به آن آنیون گفته میشود. اگر یک اتم یا مولکول الکترون از دست بدهد، بار آن مثبت خواهد شد و به آن کاتیون میگویند. فرآیند یونیزاسیون، با انتقال انرژی همراه است و به این انرژی، انرژی یونش گفته میشود. در این مطلب از مجله فرادرس میآموزیم یونیزاسیون چیست و به چه واکنشهایی واکنش یونش گفته میشود.

در ابتدای این مطلب میآموزیم یونیزاسیون چیست و فرآیند یونش مواد چگونه انجام میشود. سپس مثالهایی را از فرآیند یونش بررسی کرده و توضیح میدهیم انواع یونیزاسیون چیست. در ادامه، توضیح میدهیم انرژی یونش چیست و با چه روندی برای اتمها تعیین میشود. در نهایت، کاربردهای یونیزاسیون را نام برده و روش تولید یون به وسیله دستگاه یونساز را بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با فرآیند یونیزاسیون و کاربردهای آن آشنا شوید.
یونیزاسیون چیست؟
هنگامی که یک اتم یا مولکول، الکترون لایه ظرفیت خود را از دست داده یا یک الکترون دریافت کند، دچار یونش (Ionization) میشود. این فرآیند که با نامهای یونیزاسیون و یونش شناخته میشود، شامل تبدیل اتمها، مولکولها یا یونها، به کاتیون و آنیون است. آنیون به یونی گفته میشود که دارای بار منفی باشد و کاتیون به یونی گفته میشود که دارای بار مثبت باشد.
در فرآیند یونیزاسیون، معمولا انرژی تغییر میکند. به انرژی منتقل شده انرژی یونش یا انرژی یونیزاسیون نیز گفته میشود. یونیزاسیون معمولا طی انجام یک واکنش شیمیایی یا فرآیند انحلال اتفاق میافتد. به دلیل اینکه طی فرآیند یونیزاسیون باید به اتم یا مولکول انرژی بدهیم، میتوان آن را فرآیندی گرماگیر در نظر گرفت. به همین دلیل، انرژی یونیزاسیون همواره مقداری مثبت دارد.
یوینزاسیون میتواند در اثر از دست رفتن الکترون در نتیجه برخورد ذرات زیراتمی، برخورد با سایر اتمها، مولکولها، الکترونها، پوزیترونها، پروتونها و برهمکنش با امواج الکترومغناطیس اتفاق بیافتد.
واکنش یونیزاسیون چیست؟
در قسمت قبل آموختیم یونیزاسیون چیست. یونیزاسیون به فرآیند جدا کردن یک الکترون از یک اتم گفته میشود. یونیزاسیون اول که شامل جدا کردن الکترون ظرفیت از یک اتم یا مولکول است، با واکنش کلی زیر نمایش داده میشود.
همانطور که در واکنش بالا مشاهده میکنید، اتم x یک الکترون از دست داده است و کاتیون تشکیل داده است. یونیزاسیون همچنین میتواند برای الکترونهای بعدی اتم نیز اتفاق بیافتد. به فرآیند جدا کردن دومین، سومین و … الکترون از اتم، فرآیند یونش دوم، سوم و … گفته میشود. واکنش این فرآیندها به شکل زیر نوشته میشود.
یادگیری شیمی دوازدهم با فرادرس
برای اینکه بهتر درک کنیم یونیزاسیون چیست، ابتدا باید با مفاهیمی چون مولکول، یون، پیوند یونی، ترکیبات یونی و یونهای چند اتمی آشنا شوید. همچنین، آشنایی با آرایش الکترونی عناصر، ثابت یونش اسید و باز و … نیز میتواند به درک ما از اینکه یونیزاسیون چیست کمک کند. پیشنهاد میکنیم برای درک بهتر این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه یونش دسترسی داشته باشید.
فرآیند یونیزاسیون چگونه انجام میشود؟
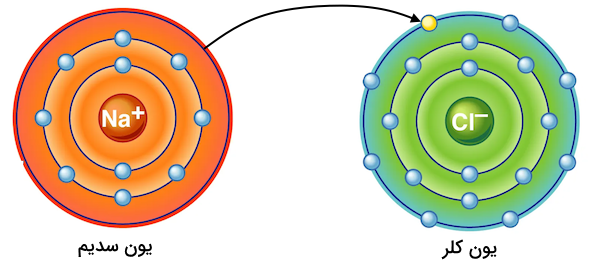
فرآیند یونیزاسیون شامل جداسازی یک الکترون از ساختار الکترونی یک اتم خنثی، یون یا مولکول است. برای درک بهتر اینکه روند انجام یونیزاسیون چیست، مولکول سدیم کلرید (نمک طعام ) را در نظر بگیرید. در این مولکول، یک اتم سدیم به یک اتم کلر به وسیله پیوند کووالانسی متصل شده است. عدد اتمی اتم سدیم ۱۱ و عدد اتمی اتم کلر ۱۷ است. این بدین معنی است که اتم سدیم یک ۱۱ الکترون و اتم کلر ۱۷ الکترون را در ساختار الکترونی خود دارند.
برای درک بهتر این فرآیند بهتر است ابتدا آرایش الکترونی این اتمها را بررسی کنیم. آرایش الکترونی اتمهای سدیم و کلر در ادامه آورده شده است.
با توجه به آرایش الکترونی رسم شده، اتم سدیم ۱ الکترون در لایه ظرفیت خود و اتم کلر ۷ الکترون در آخرین لایه الکترونی خود دارند. طبق قاعده اوکتت، اتمها تمایل دارند به آرایش الکترونی گاز نجیب برسند. اتم کلر برای رسیدن به ارایش الکترونی هشتایی اتم نئون نیاز است تا یک الکترون دریافت کند. به همین ترتیب، اتم سدیم با از دست دادن یک الکترون میتواند به آرایش گاز نجیب اتم نئون برسد. به همین علت، سدیم و کلر هر دو از لحاظ شیمیایی فعال هستند و تمایل دارند تا یون تشکیل دهند.

بدین ترتیب، اگر یک اتم کلر به یک اتم سدیم نزدیک شود، یک الکترون از اتم سدیم به اتم کلر منتقل شده و این دو اتم به هم متصل شده و سدیم کلرید تشکیل میدهند. این روند برای تمامی اتمهایی که از نظر شمیایی فعال هستند میتواند اتفاق بیافتد.
درواقع تشکیل ترکیبات مولکول مختلف و تشکیل پیوند شیمیایی به آرایش الکترونی این مواد و یونیزاسیون آنها وابسته است. به همین دلیل است که برای مثال، اتمهای گروه فلزات قلیایی و فلزات قلیایی خاکی با هالوژنها واکنش میدهند و ترکیباتی مانند سدیم برمید، منیزیم کلرید، کلسیم کلرید و … تشکیل میشوند.
چند مثال از یونیزاسیون
در قسمت قبل آموختیم فرآیند یونیزاسیون چیست. برای درک بهتر فرآیند یونیزاسیون، به واکنشهای زیر دقت کنید. در این واکنشها، مواد در محلول به یونهای سازندهشان تفکیک شدهاند.
معادله یونش اسید کلریدریک به شکل زیر است.
معادله یونش سدیم هیدروکسید به شکل زیر است.
معادله یونش اسید سولفوریک به شکل زیر است.
معادله یونش سدیم سولفات به شکل زیر است.
معادله یونش اتم هیدروژن به شکل زیر است.
معادله یونش اتم منیزیم به شکل زیر است.
انرژی یونش چیست؟
انرژی یونش (Ionization Energy) یا انرژی یونیزاسیون، مقدار انرژی مورد نیاز برای جداسازی یک الکترون از یک اتم تنها در حالت گازی است. درواقع، انرژی یونش، انرژی مورد نیاز برای انجام فرآیند یونیزاسیون برای یک اتم تنها و در حالت گازی است. برای مثال، برای اتم هیدروژن، انرژی یونش انرژی مورد نیاز برای تولید یون هیدروژن یک بار مثبت از اتم تک هیدروژن گازی است. واکنش یونش آن به شکل زیر نوشته میشود.
انرژی یونش معمولا بر حسب کیلوژول بر مول اندازهگیری میشود. انرژی یونش را میتوان به عنوان انرژی مورد نیاز برای تبدیل یک مول الکترون از یک مول اتم نیز تعریف کرد. در محاسبه انرژی یونش، ابتدا اتم را به عنوان یک اتم خنثی و تک در نظر میگیریم که بار الکتریکی ندارد و طی فرآیند یونیزاسیون، بیرونیترین الکترون آن که بیشتری انرژی را دارد (الکترون ظرفیت) از آن جدا میشود. انرژی یونش میتواند برای مقدار انرژی مورد نیاز برای جداسازی الکترونهای بعدی اتم نیز تعریف شود. بدین ترتیب، انرژی یونش اول، دوم، سوم .و … مقدار انرژی مورد نیاز برای جداسازی اولین، دومین، سومین و .. الکترون از اتم است.

به طور کلی، هرچه الکترون از هسته اتم دورتر باشد، اثر جاذبه هسته اتم بر آن کمتر شده و راحتتر از اتم جدا میشود. به همین علت است که جدا کردن اولین الکترون از اتم انرژی کمتری از دومین و سومین الکترون نیاز دارد. به بیان دیگر، هرچه شعاع اتمی بزرگتر باشد، انرژی یونیزاسیون کمتر خواهد بود.
تشخیص نوع پیوند با استفاده از انرژی یونش
در قسمت قبل آموختیم رابطه انرژی یونش و یونیزاسیون چیست. در واکنشهای شیمیایی، شناخت و اندازهگیری انرژی یونش برای تشخیص نوع پیوندی که اتمها تشکیل میدهند بسیار حائز اهمیت است. برای مثال، انرژی یونیزاسیون سدیم که یک فلز قلیایی است، ۴۹۶ کیلوژول بر مول است. انرژی یونیزاسیون کلر که یک هالوژن است، ۱۲۵۱٫۱ کیلوژول بر مول است.
با توجه به این تفاوتها، با ترکیب شیمیایی این دو ماده، پیوند یونی تشکیل میدهند. اتمهایی که در جدول تناوبی عناصر نزدیک به هم قرار گرفتهاند، یا اتمهایی که انرژی یونیزاسیونی نزدیک به هم دارند، بیشتر پیوندهای کووالانسی قطبی یا کوالانسی غیر قطبی تولید میکنند. برای مثال، کربن و کلر ماده کربن تترا کلرید را تولید میکنند که پیوندهای آن کووالانسی هستند.
| اختلاف انرژی یونش | نوع پیوند |
| زیاد | یونی |
| کم | کووالانسی قطبی |
| خیلی کم | کووالانسی غیر قطبی |
برای تشخیص نوع پیوند میتوان از تفاوت انرژی یونیزاسیون یا الکترونگاتیوی دو عنصر استفاده کرد. برای مثال، تفاوت زیاد در مقادیر انرژی یونش دو اتم سدیم و کلر منجر به تولید پیوند یونی بین آنها میشود. در این پیوند، الکترون به شکلی کامل از اتم سدیم جدا شده و کلر به شکلی کامل الکترون را دریافت میکند. اگر تفاوت بین مقادیر الکترونگاتیوی و انرژی یونش کم باشد، این الکترون بین اتمها به اشتراک گذاشته شده و پیوند کووالانسی شکل میگیرد.
روند تغییر انرژی یونیزاسیون در جدول تناوبی
روند تغییر انرژی یونیزاسیون در جدول تناوبی با شعاع اتمی تغییر میکند. از آنجا که در جدول تناوبی با حرکت از راست به چپ در دورهها، شعاع اتمی افزایش مییابد، انرژی یونیزاسیون نیز در هر دوره از چپ به راست افزایش مییابد. گروه فلزات قلیایی خاکی و گروه نیتروژن از این قاعده مستثنی هستند. عناصر گروه دوم جدول تناوبی انرژی یونش بالاتری نسبت به گروه ۱۳ دارند. به همین شکل، عناصر گروه ۱۵ جدول تناوبی انرژی یونش بالاتری نسبت به عناصر گروه ۱۶ دارند. این تفاوت به دلیل آرایش الکترونی پر و نیمه پر این عناصر است. به دلیل این آرایشهای الکترونی، جداسازی الکترون از آنها دشوارتر خواهد بود.
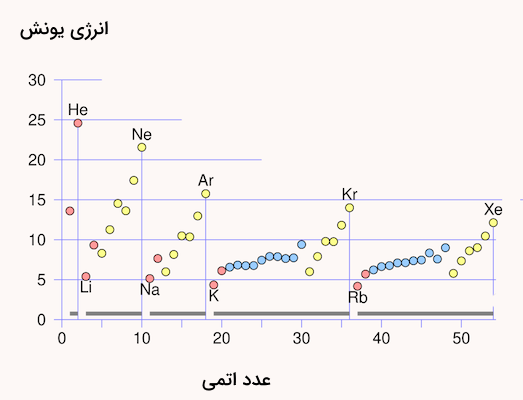
فلزات قلیایی انرژی یونیزاسیون کوچکی دارند. به خصوص در مقایسه انرژی یونیزاسیون این عناصر با انرژی یونش هالوژنها متوجه مقدار تفاوت آنها میشویم. انرژی یونش علاوه بر شعاع اتمی، به تعداد الکترونهای بین هسته اتم و لایه ظرفیت نیز وابسته است. بار مثبت هسته اتم توسط الکترونهای لایه خارجی اتم به دلیل الکترونهای بین آنها کمتر حس میشود. به اثر یاد شده اثر پوششی الکترون درونی میگویند.
هرچه تعداد الکترونهای بین هسته و لایه ظرفیت بیشتر باشد، جداسازی الکترون ظرفیت راحتتر بوده و مقدار انرژی یونش کمتر خواهد بود. به دلیل اینکه اثر پوششی الکترون درونی در هرگروه جدول تناوبی از بالا به پایین افزایش مییابد، مقدار انرژی یونش در هر گروه از بالا به پایین کاهش مییابد. انرژی یونش یکی از مهمترین خواص عناصر است که به شکل دورهای و بسته به الگوی آرایش الکترونی عناصر تغییر میکند. پیشنهاد میکنیم برای یادگیری سایر الگوهای جدول تناوبی، مطلب «قانون دورهای عنصرها چیست» از مجله فرادرس را مطالعه کنید.
انرژی یونش اول، دوم و سوم
همانطور که در قسمتهای قبل توضیح دادیم، میتوان از اتمها و مولکولها، الکترون لایه ظرفیت را به روشهای متفاوتی جدا کرد و به این فرآیند یونیزاسیون گفته میشود. طی این فرآیند، انرژی مصرف میشود که به آن انرژی یونش یا انرژی یونیزاسیون گفته میشود. به انرژی مورد نیاز برای جداسازی اولین الکترون از لایه ظرفیت یک اتم، انرژی یونش اول گفته میشود و آن را با علامت نمایش میدهند. انرژی مورد نیاز برای جداسازی الکترون بعدی از لایه ظرفیت اتم، انرژی یونش دوم نام دارد و آن را با علامت نمایش میدهند. تصویر زیر مشخص میکند یونیزاسیون اول و دوم لیتیوم چیست.
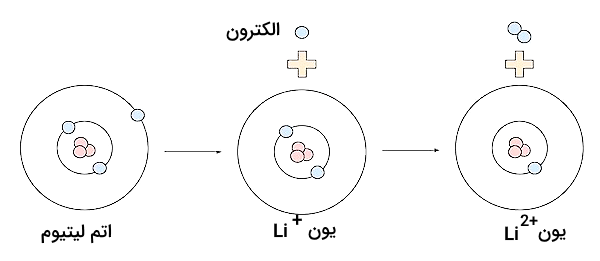
انرژیهای یونش برای الکترونهای اتم به همین ترتیب مشخص میشوند و همواره انرژی یونش اول از انرژی یونش دوم، سوم و .. کمتر خواهد بود. این بدین علت است که با جداسازی یک الکترون از اتم، مقدار اثر جاذبه هسته بر الکترونهای باقی مانده بیشتر خواهد بود و جداسازی آنها از اتم، انرژی بیشتری نیاز خواهد داشت. رابطه زیر همواره برای انرژی یونش اتمها برقرار است.
برای درک بهتر این مفاهیم، به یونیزاسیون اول و دوم اتم منیزیم دقت کنید. واکنش یونیزاسیون و مقادیر انرژی یونش برای این اتم در ادامه آورده شده است.
اثر لایه های الکترونی بر انرژی یونش
یکی از بهترین راههای درک این مفهوم که یونیزاسیون چیست، بررسی انرژی یونش بر اساس آرایش الکترونی است. اوربیتالهای الکترونی به لایههای مختلف تقسیم شدهاند و این لایهها اثری مهم بر انرژی یونش الکترونهای مختلف دارند. برای مثال، به عنصر آلومینیوم دقت کنید. آلومینیوم اولین عنصر دوره خود است که درای الکترون در لایه 3P است. وجود این لایه الکترونی ، انرژی یونیزاسیون را تا حد قابل توجهی نسبت به انرژی یونش برای سایر عناصر موجود در دوره کاهش میدهند. این بدین علت است که برای یونیزاسیون اول آلومینیوم، تنها باید یک الکترون از اوربیتال 3P جدا شود تا این عنصر به آرایش پایدار زیرلایه پر 3S برسد.
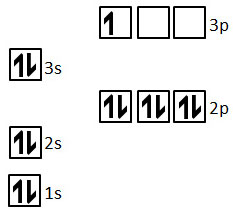
هرچند با گذر از انرژی یونش اول به انرژی یونش دوم این عنصر با تفاوت انرژی بزرگی مواجه میشویم. این بدین علت است که برای یونیزاسیون دوم، الکترون باید از حالت آرایش الکترونی پایدار اوربیتال 3s پر جدا شود و به همین ترتیب انرژی زیادی احتیاج خواهد داشت.
مثال انرژی یونش
برای درک بهتر اینکه یونیزاسیون چیست و انرژی یونش چگونه بیان میشود، به مثالهای زیر توجه کنید.
مثال ۱
کدام یک از عناصر سدیم و منیزیم، انرژی یونیزاسیون بیشتری دارد؟
پاسخ
انرژی یونیزاسیون منیزیم بیشتر از سدیم است. نیروهای جاذبه الکترواستاتیکی به مقدار بار مثبت پروتونهای هسته نیز وابسته است و میزان قدرت این نیروها تنها به فاصله بین هسته و الکترون ظرفیت وابسته نیست. مقدار نیروهای الکترواستاتیکی بین بارهای منفی الکترونها و بار مثبت هسته زمانی که تعداد پروتونهای هسته بیشتر باشد، قویتر است. به همین دلیل، منیزیم که تعداد پروتونهای بیشتری از سدیم دارد، قویتر است و جدا کردن الکترون از آن دشوارتر خواهد بود. به همین دلیل، مقدار انرژی یونیزاسیون برای منیزیم بیشتر است.
مثال ۲
مقدار انرژی یونیزاسیون اول تا چهارم اتم آلومینیوم در جدول زیر ارائه شده است.
| واکنش یونش | انرژی یونش (کیلوژول بر مول) |
| ۵۷۸ | |
| ۱۸۱۷ | |
| ۲۷۴۵ | |
| ۱۱۵۷۵ |
علت تفاوت بسیار زیاد انرژی یونش سوم و چهارم اتم آلومینیوم را با توجه به آرایش الکترونی آن شرح دهید.
پاسخ
با توجه به آرایش الکترونی اتم آلومینیوم و شکل اوربیتالهای آن میتوانیم دریابیم که الکترونهای ظرفیتی که طی فرآیندهای یونیزاسیون اول، دوم و سوم از اتم جدا میشوند، از اوربیتالهای 3p و 3s خارج میشوند. از آن جا که این الکترونها در آخرین لایه و زیرلایههای الکترونی قرار دارند، اثر جاذبه هسته و بار موثر هسته بر آنها کمتر است و راحتتر جدا میشوند. الکترون چهارم متعلق به زیرلایه 2p است. الکترونهای این زیرلایه به شکلی کامل اوربیتالها را پر کردهاند. در این لایه، الکترونهای از دست رفته باعث شدهاند اثر پوششی الکترونهای درونی کمتر و بار موثر هسته بیشتر شود.
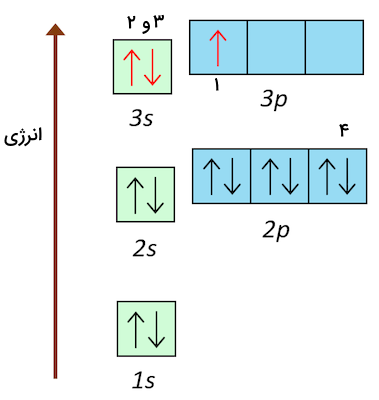
بدین ترتیب جدا کردن این الکترونها سخت خواهد بود. علاوه بر این، این الکترون متعلق به آرایش الکترونی شبیه به آرایش الکترونی گاز نجیب است. تمامی الکترونها، اوربیتالهای لایه دوم را پر کردهاند و قبلا توضیح دادیم که آرایشهای الکترونی پر و نیمهپر پایداری بیشتری دارند. پس سه عامل باعث افزایش زیاد انرژی یونش چهارم برای اتم آلومینیوم خواهد شد. این سه عامل به شرح زیرند.
- الکترونهای لایه آخر از اتم جدا شدهاند و اثر پوششی الکترونهای درونی کمتر شده است.
- الکترونهای لایه آخر از اتم جدا شدهاند و اثر بار موثر هسته بر الکترونهای باقی مانده افزایش یافته است.
- الکترون چهارم در آرایش الکترونی پر لایه دوم قرار دارد و پایدار است و جدا کردن آن دشوار است.
تفاوت انرژی یونش، الکترونخواهی و الکترونگاتیوی
در مطالعه مفاهیم مربوط به یونش و تولید یون توسط اتمها، احتمالا به سه مفهوم الکترونگاتیوی، الکترونخواهی و انرژی یونش برخورد میکنید که تعاریفی نزدیک به هم دارند و ممکن است با هم اشتباه گرفته شوند. برای درک بهتر اینکه یونیزاسیون چیست، باید تفاوت این سه مفهوم را بیاموزیم. در ادامه، تفاوت این سه مفهوم را با ارائه توضیحاتی درباره آنها توضیح میدهیم.
الکترون خواهی
الکترونخواهی به مقدار انرژی آزاد شده در فرآیند افزودن یک الکترون به اتم در حالت گازی پایه آن اتم گفته میشود. نماد الکترونخواهی است و واحد اندازهگیری آن کیلوژول بر مول است. مقدار الکترونخواهی اول عناصر معمول مقداری منفی دارد. تنها عناصر گروه ۸ و ۲ جدول تناوبی هستند که مقدار الکترونخواهی برای آنها مقداری مثبت دارد. دومین الکترونخواهی (انرژی آزاد شده در اثر اضافه کردن الکترون دوم به) تمامی عناصر مقداری مثبت دارد.
مقدار الکترونخواهی از چپ به راست در دورههای جدول تناوبی روندی کاهشی دارد و معمولا در یک گروه از بالا به پایین افزایش مییابد.
انرژی یونش
در قسمتهای قبل توضیح دادیم رابطه انرژی یونش و یونیزاسیون چیست. انرژی یونش مقدار انرژی مورد نیاز برای جدا کردن یک الکترون از اتم در حالت خنثی و گازی و پایه است. این انرژی با علامت نمایش داده میشود و همواره مقداری مثبت دارد. انرژی یونش با واحد کیلوژول بر مول اندازهگیری میشود. انرژی یونش در هر ردیف جدول تناوبی از چپ به راست افزایش یافته و در هر گروه جدول تناوبی از بالا به پایین کاهش مییابد.
الکترونگاتیوی
الکترونگاتیوی عناصر، مقدار تمایل آنها برای جذب الکترونها به سمت خود را مشخص میکند. الکترونگاتیوی کمیتی بدون واحد است و مقادیر آن به شکل نسبی تعیین شدهاند. الکترونگاتیوی عناصر در هر دوره از چپ به راست افزایش یافته و در هر گروه از بالا به پایین کاهش مییابد. در جدول زیر، تفاوتهای این سه پارامتر به شکلی خلاصه ارائه شده است.
| الکترونخواهی | انرژی یونش | الکترونگاتیوی |
| انرژی آزاد شده از افزودن یک الکترون | انرژی مورد نیاز برای جدا کردن یک الکترون | تمایل برای جذب الکترونها |
| کیلوژول بر مول | کیلوژول بر مول | بدون واحد |
| در هر ردیف کاهش | در هر ردیف افزایش | در هر ردیف افزایش |
| در هر گروه افزایش | در هر گروه کاهش | در هر گروه کاهش |
ثابت یونش چیست؟
در قسمتهای قبل توضیح دادیم که یونیزاسیون اسید و باز چیست. ثابت یونش (ثابت یونیزاسیون) که با حرف K نمایش داده میشود، معیاری از قدرت اسید یا باز مورد نظر است. ثابت یونش با نام ثابت تفکیک اسید یا باز نیز شناخته میشود. کمیت ثابت یونیزاسیون با استفاده از معادله واکنش تفکیک (یونیزاسیون) اسید یا باز در آب محاسبه میشود. مقدار ثابت یونش مشخص میکند که اسید یا باز به چه میزان در آب تفکیک میشود. هرچه مقدار ثابت یونیزاسیون اسید یا باز بیشتر باشد، آن اسید قویتر است.
شناخت ثابت یونش و آموختن روش محاسبه آن یکی از مهمترین مباحث برای شناخت اسیدها و بازها و تحلیل رفتار آنها در حلالها و واکنشهای مختلف است. پیشنهاد میکنیم برای یادگیری بهتر این مبحث، فیلم آموزش ثابت یونش فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
برای یک اسید با فرمول شیمیایی کلی HA، معادله تفکیک و ثابت یونیزاسیون به شکل زیر است.
همچنین، برای یک باز با فرمول کلی BOH، معادله واکنش تفکیک و ثابت یونش به شکل زیر نوشته میشود.
انواع روش های یونیزاسیون
یونش میتواند از جنبههای مختلف و برای مواد مختلف بررسی شود. در ادامه، انواع روشهای یونیزاسیون را بررسی خواهیم کرد. یونیزاسیون میتواند برای اتمها، مولکولها، الکترونها، پلاسما و ترکیبات مختلف اتفاق بیافتد. در ادامه توضیح میدهیم برای هریک از این مواد، روش یونیزاسیون چیست.
یونیزاسیون اتمها
در یونیزاسیون اتمها دو حالت ممکن است اتفاق بیافتد. اتم میتواند الکترون دریافت کرده و به آنیون تبدیل شود یا الکترون از دست داده و به کاتیون تبدیل شود. تبدیل اتمهای خنثی به کاتیون یا آنیون به آرایش الکترونی اتم و محل قرارگیری آن در جدول تناوبی بستگی دارد.
تشکیل آنیون
اگر یک اتم الکترون بگیرد و به آنیون تبدیل شود، انرژی طی فرآیند یونیزاسیون آن آزاد میشود. به این انرژی الکترونخواهی اتم گفته میشود و مقدار این انرژی برای هر اتم مشخص و متفاوت است. اتمهایی که الکترونخواهی بیشتری دارند، بیشتر تمایل دارند که الکترون دریافت کنند و یون منفی تشکیل دهند.
تشکیل کاتیون
از دست دادن الکترون و تشکیل یون مثبت برای یک اتم با دریافت انرژی همراه است. مقدار انرژی مورد نیاز یک اتم برای از دست دادن الکترون و تشکیل کاتیون با نام انرژی یونش شناخته میشود. جداسازی الکترون از اتمهایی با انرژی یونیزاسیون کوچکتر آسانتر از اتمهایی با انرژی یونش زیاد است. این انرژی به عوامل مختلفی وابسته است که در قسمتهای بعد توضیح داده میشود.
به طور کلی، فلزات انرژی یونش کوچکتری دارند و بیشتر کاتیون تشکیل میدهند. در جدول تناوبی، فلزات قلیایی کمترین مقدار انرژی یونش را دارند. به همین ترتیب، هالوژنها و گازهای نجیب بیشتری انرژی یونش را دارند و نمیتوان به راحتی از آنها الکترون جدا کرد. تغییرات و روند تغییر انرژی یونش و الکترونخواهی با اثر ساختار الکترونی اتم و نوع و قدرت پیوندهای شیمیایی که تشکیل میدهند مرتبط است.
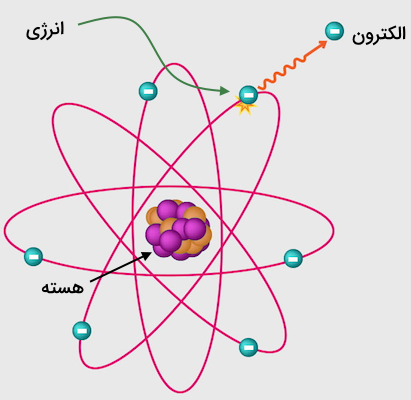
یونیزاسیون الکترون
یونش الکترونی که با نام یونش اثر الکترون نیز شناخته میشود، یک روش یونیزاسیون است که در آن الکترونهای پرانرژی ساخته میشوند تا با مواد جامد و گازها وارد واکنش شده و یون تولید کنند. این روش با نام بمباران الکترونی نیز شناخته میشود. تصویر زیر نمایی کلی از این فرآیند است.
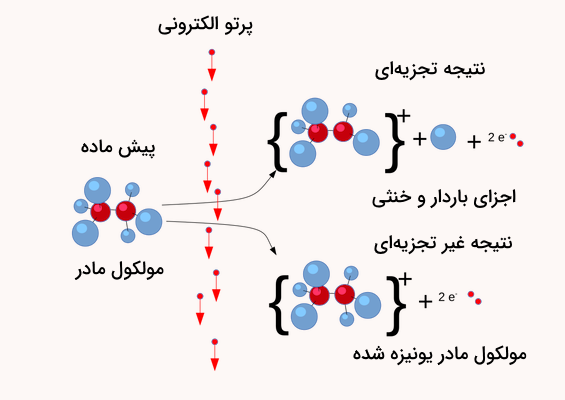
یونش الکترونی اولین تکنیک ارائه شده برای طیفسنجی جرمی بوده است. با این وجود، این روش یونیزاسیون هنوز استفاده میشود. این روش معمولا با چالشهای بسیاری همراه است. این چالشها به دلیل استفاده از الکترونهای پرانرژی به وجود آمدهاند. این روش در شناخت ترکیبات مجهول بسیار موثر است.
یونیزاسیون پلاسما
پلاسما در واقع یک گاز یونیزه شده است. هنگامی که یک گاز تحت انرژی حرارتی بسیار زیادی قرار میگیرد، الکترونها از اتمهای گاز جدا میشوند و پلاسما تشکیل میشود. برای روش یونش پلاسما، دمای بسیار بالا نیاز است و گاز با انرژی و شدت بسیاری هدایت میشود تا یونها بتوانند به راحتی حرکت کنند و یون تشکیل دهند. بهترین مثال یونیزاسیون پلاسما، یونش تاج خورشید است که در آن گاز هیدروزن تحت دماهای بسیار بالا یونیزه شده و یون هیدروژن مثبت تولید میکند.
یونیزاسیون اسیدها و بازها
اسیدها در آب یونیزه میشوند. اسیدهای قوی به شکلی کامل و اسیدهای ضعیف به شکل جزئی در آب تفکیک شده و یون تولید میکنند. درجه یونش یک اسید مقیاسی از میزان قدرت آن است. این روش با نام یونش درصدی یا یونیزاسیون درصدی نیز شناخته میشود. این روش تعیین میکند که کدام اسیدها در آب یونیزه میشوند و این یونش به چه مقدار انجام میشود. برای مثال یونیزاسیون اسید قوی هیدروکلریک و اسید ضعیف استیک به شکل زیر است.
به همین شکل، بازها نیز در محلولهای آبی یونیزه شده و یون هیدروکسید آزاد میکنند. بازهای قوی به شکلی کامل در آب یونیزه شده و بازهای ضعیف به شکل جزئی در آب یون تولید میکنند. این روش برای بررسی و اندازهگیری قدرت بازها نیز بکار میرود. برای مثال، یونیزاسیون اسید ضعیف آمونیاک و اسید قوی پتاسیم هیدروکسید به شکل زیر انجام میشود.
یونیزاسیون آب
یونیزاسیون آب که با نام خود یونش آب نیز شناخته میشود، فرآیندی است که در آن یک مولکول آب دچار یونیزاسیون شده و یونهای هیدروکسید و هیدروژن یا هیدرونیوم تولید میکند. واکنش یونیزاسیون آب به شکل زیر نوشته میشود.
پرتو یونیزاسیون
تابش میتواند در صورت داشتن انرژی کافی برای جداسازی الکترونها از اتم، به عنوان یک روش یونیزاسیون در نظر گرفته شود. انرژی تابشهای آلفا و تابش بتا و فوتونهای پرتو گاما معمولا بالاتر از انرژی یونش بیشتر اتمها و مولکولها هستند. به همین دلیل با ترکیب این تابشها با اتمها یا مولکولها، الکترون از این ترکیبات جدا شده و دچار یونیزاسیون میشوند.
برای مولکولها، در معرض این تابشها قرار گرفتن ممکن است حتی پیوندهای بین اتمها را شکسته و مولکول را تجزیه کند و تغییر دهد. این روش برای تولید یون در روش طیف سنجی جرمی استفاده میشود. با استفاده از این روش قدرتمند، دانشمندان میتوانند ترکیبات و اتمهای موجود در ترکیبات ناشناخته و مجهول را تشخیص دهند.
یونیزاسیون گرمایی
در یونیزاسیون گرمایی، اتمها یا مولکولها با استفاده از گرمادهی یونیزه میشوند. این بدین معنی است که اتمها یا مولکولها به اندازهای حرارت میبینند تا الکترون از دست دهند. این روش یونیزاسیون در طیف سنجی جرمی کاربرد دارد.
یونیزاسیون شیمیایی
در یونیزاسیون شیمیایی، یک اتم یا الکترون با استفاده از مواد شیمیایی دیگر یونیزه میشوند. این روش یونیزاسیون در کروماتوگرافی گازی کاربرد دارد. این روش روش یونیزاسیون شیمیایی، برای یونیزه کردن مولکولهای گازی استفاده میشود که با مولکولهای آنالیت در فاز گازی واکنش میدهند. از انواع یونیزاسیون شیمیایی میتوان به یونیزاسیون شیمیایی منفی، یونیزاسیون شیمیایی تبادل بار، یونیزاسیون فشار اتمسفری و یونیزاسیون نوری فشار اتمسفری اشاره کرد. از این روش در سایر زمینههای تحقیقاتی مانند تحقیقات بیولوژیک، بیوشیمی و داروسازی نیز استفاده میشود.
کاربرد یونیزاسیون
یونیزاسیون کاربردهای بسیار مهمی دارد. برای مثال، از فرآیند یونش وواد در لامپهای فلوئورسانس یا تخلیه الکتریکی سایر لامپها استفاده میشود. همچنین از این فرآیند در آشکارسازهای پرتوزایی یا محفظه یونش استفاده میشود. این فرآیند در بسیاری از تجهیزات مانند تجهیزات طیف سنجی جرمی یا پرتودرمانی نیز استفاده میشود.
یکی از کاربردهای گسترده این فرآیند در تصفیه و پاکسازی هوا است. در ادامه برخی از کاربردهای یونیزه کردن مواد را توضیح میدهیم.
طیف سنجی جرمی
در طیف سنجی جرمی، یونیزاسیون برای شکستن مولکولها به اجزای سازندهشان و شناسایی اتمهای آنها به کار میرود.
تحقیقات پلاسما
در این تحقیقات، یونیزاسیون برای تولید پلاسما و انجام مطالعات بر روی آنها انجام میشود.
پرتوزایی
یونیزاسیون نقش مهمی در پرتوزایی دارد. ایزوتوپهای پرتوزا، با استفاده از یونیزاسیون دچار واپاشی میشوند و طی این فرآیند پرتوزایی میکنند.
شیمی
یونیزاسیون نقش مهمی در شیمی دارد. الکترونها میتوانند حین انجام واکنشهای شیمیایی منتقل شوند و این پدیده باعث ایجاد و تشکیل یون میشود. از روشهای یونیزاسیون در فرآیندهای طیف سنجی جرمی و همجوشی هستهای استفاده میشود. در این روشها با اندازهگیری نسبت جرم به بار ذرات باردار و با استفاده از یونیزاسیون، میتوان طیف جرمی مواد را تحلیل کرد و به ساختار ترکیبات آنها پی برد.
این روش برای شناسایی ساختار مواردی مانند داروها، پروتئینها، آلودگیها و … استفاده میشود..
در طبیعت
یونیزاسیون در طبیعت نیز در اتمها و مولکولها اتفاق میافتد. اتمها با قرار گرفتن در معرض امواج پرانرژی مانند پرتوهای کیهانی، نور خورشید و سایر موارد یونیزه میشوند. برای مثل، باد خورشیدی که شامل ذراتی است که از خورشید ساطع میشود، میتواند اتمهاو مولکولهای موجود در اتمسفر بالای زمین را یونیزه کند. در این فرآیند، لایهای از جنس پلاسما به نام یونوسفر تشکیل میشود که امکان ارتباطات دوربرد را برای بشر فراهم میکند.

یک مثال دیگر از فرآیند یونیزاسیون در طبیعت، تشکیل شفق قطبی است که رنگهای زیبایی را که به دلیل برهمکنش ذرات باردار با باد خورشیدی و میدان مغناطیسی خورشید نمایش میدهد. ذرات باردار با مولکولهای هوا برخورد میکنند و باعث انتشار طول موجها در محدوده مرئی میشوند.
یادگیری شیمی عمومی با فرادرس
برای درک بهتر این موضوع که یونیزاسیون چیست، باید با مفاهیمی چون جدول تناوبی عناصر، بار موثر هسته، تغییرات انرژی یونش و الکترونخواهی آشنا باشیم. همچنین، شناخت مباحثی چون قطبیت مولکولها و اندازهگیری قدرت اسیدها و بارها به ما در درک این موضوع که یونیزاسیون چیست، کمک میکند. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده به توضیح این مفاهیم میپردازند.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه یونش دسترسی داشته باشید.
فیلم آموزش شیمی معدنی ۱ فرادرس
فیلم آموزش شیمی معدنی ۱ مرور و حل تمرین فرادرس
فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
یون ساز چیست؟
در این مطلب از مجله فرادرس آموختیم یونیزاسیون چیست. یونسازها دستگاههایی هستند که با استفاده از وارد کردن انرژی به مولکولها یا اتمها باعث یونیزه شدن آنها میشود. از یون سازها به خصوص در دستگاههای تصفیه هوای خانگی استفاده میشود. در این روشها، دستگاه یون ساز باعث یونیزه شدن هوا میشود. یونیزاسیون هوا باعث میشود ذرات باردار به ذراتی مانند دود و موجودات ریز مانند ویروسها و باکتریها و آلودگی و گرد و خاک متصل شده و به سطوح بچسبند. در برخی از موارد این یون سازها صفحهای نیز دارند که پس از یونیزاسیون هوا و جدا شدن ذرات آلودگی، به صفحه باردار دستگاه جذب میشوند.
انواع متفاوتی از دستگاههای یون ساز وجود دارند که از آنها میتوان به یون ساز جریان ac و یون ساز کرونا اشاره کرد.
source
