محلول الکترولیت محلولی است که از انحلال مواد الکترولیت در حلال به دست آمده و جریان الکتریکی را از خود عبور میدهد. هنگامی که برخی مواد در آب حل میشوند، دچار یک تغییر شیمیایی یا تغییر فیزیکی میشوند و یون آزاد میکنند. به این دسته مهم از مواد، الکترولیت گفته میشود. موادی که در صورت انحلال هیچ یونی آزاد نمیکنند، غیرالکترولیت نامیده میشوند. محلولهای الکترولیت از انحلال مواد الکترولیت در آب به دست میآیند و نقش مهمیدر صنایع مختلف و بیولوژی بدن انسان دارند. در این مطلب از مجله فرادرس میآموزیم محلول الکترولیت چیست و چه کاربردهایی دارد.

در ابتدای این مطلب میآموزیم محلول الکترولیت چیست و به چه موادی الکترولیت گفته میشود. سپس انواع محلول الکترولیت را بررسی کرده و روش تشخیص آنها را میآموزیم. در ادامه میآموزیم محلول غیرالکترولیت چیست و تفاوت محلول الکترولیت با آن چیست. در ادامه، اثر حلال را بر این محلولها بررسی کرده و واکنشهای شیمیایی آنها را توضیح میدهیم. در نهایت وجود محلولهای الکترولیت را در بدن انسان و در باتریها بررسی میکنیم. با مطالعه این مطلب تا انتها، میتوانید به شکلی کامل با این محلولهای مهم و پرکاربرد آشنا شوید.
محلول الکترولیت چیست؟
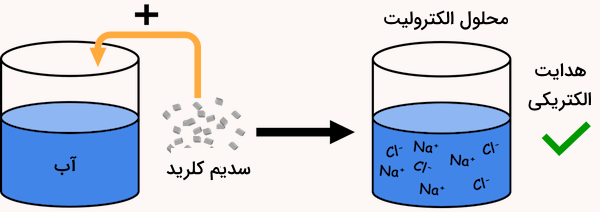
محلول الکترولیت محلولی است که توانایی انتقال جریان الکتریکی را دارد. محلولهای الکترولیت از انحلال مواد الکترولیت در آب تشکیل میشوند. مواد الکترولیت موادی هستند که در صورت انحلال در آب یون تولید میکنند و جریان الکتریکی از طریق مهاجرت این یونها میتواند برقرار شود.
برای مثال، سدیم کلرید که ترکیب نمک خوراکی است، یک الکترولیت است. این ماده که در واقع یک ترکیب یونی است، با انحلال در آب به یونهای سدیم و کلر تفکیک شده و میتواند جریان الکتریکی را از خود عبور دهد. محلولهای الکترولیت به دو دسته ضعیف و قوی تقسیم میشوند. شرط الکترولیت بودن یک محلول این است که محلول دارای ذرات بارداری باشد که آزادانه در آن حرکت میکنند. محلولهای الکترولیت میتوانند به شکل یونی یا کووالانسی یونهای ذرات حل شده را از هم جدا کنند.
الکترولیت چیست؟
الکترولیت به موادی گفته میشود که میتوانند جریان الکتریکی را از خود عبور دهند. یک ماده تنها در صورتی میتواند الکترولیت باشد که ذرات بارداری (یون) داشته باشد که آزادانه حرکت میکنند. بدین ترتیب، محلولهای الکترولیت از انحلال ترکیباتی به وجود میآید که میتوانند در حلال، یون آزاد کنند.
برای مثال در قسمت قبل آموختیم محلول سدیم کلرید یک محلول الکترولیت است. ذرات سدیم کلرید به تنهایی و در حالت جامد الکترولیت نیستند و نمیتوانند جریان الکتریکی را از خود عبور دهند. اما با انحلال سدیم کلرید در آب، ذرات سدیم و کلر از هم جدا شده و یونهای سدیم و کلرید تولید شده میتوانند به راحتی در بستر آب حرکت کنند.
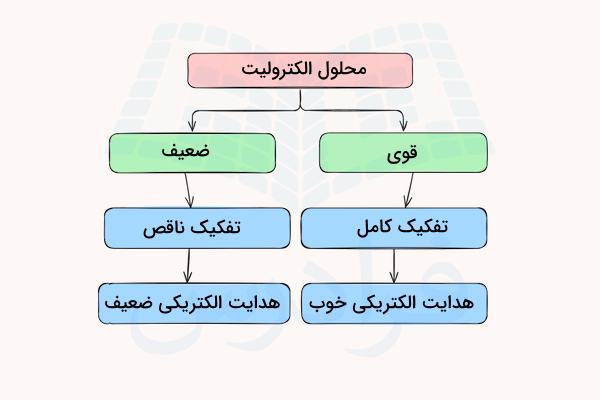
الکترولیتها بسته به اینکه تا چه میزان میتوانند در آب تفکیک شده و یون تولید کنند، به دو دسته الکترولیت ضعیف و قوی تقسیم میشوند.
- اگر با انحلال یک ترکیب، تمامی ماده به یونها تفکیک شود، آن ماده الکترولیت قوی است.
- اگر در اثر انحال مادهای، قسمتی از آن تفکیک شده و قسمتی از آن دست نخورده باقی بماند، به آن الکترولیت ضعیف گفته میشود.
به همین ترتیب، ترکیباتی نیز هستند که نه در حالت جامد و نه در حالت مذاب یا محلول، نمیتوانند یون ایجاد کنند و جریان الکتریکی را از خود عبور نمیدهند. به این مواد، غیرالکترولیت گفته میشود. مواد الکترولیت میتوانند به فرم جامد نیز وجود داشته باشند. همچنین، برخی از مواد در حالت مذاب نیز یون آزاد کرده و الکترولیت محسوب میشوند. برای مثال در جامدات فلزی، الکترونهایی که میتوانند از طریق شبکه بلوری جامد حرکت کنند باعث ایجاد جریان الکتریکی میشوند.
یادگیری شیمیدوازدهم با فرادرس
برای درک بهتر این موضوع که محلول الکترولیت چیست، ابتدا باید با مفاهیمی چون انتقال الکترون، مواد کووالانسی و یونی، سلولهای الکتروشیمیایی و تعادل شیمیایی آشنا شویم. همچنین، شناخت عوامل موثر بر تعادل شیمیایی نیز به ما در درک این مفهوم کمک میکند. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آمده است میتوانید به آموزشهای بیشتری در زمینه محلولهای الکترولیت دسترسی داشته باشید.
انواع محلول الکترولیت
در قسمت قبل آموختیم محلول الکترولیت چیست. موادی که در صورت انحلال در آب یون آزاد میکنند، الکترولیت هستند. این مواد را میتوان به چند دسته اسیدها، بازها و نمکهای یونی تقسیم کرد. تمامی این مواد در صورت انحلال در آب میتوانند یون آزاد کنند. این مواد به دلیل آزاد کردن یونها و حرکت این یونها در بستر آب، میتوانند جریان الکتریکی را از خود عبور دهند. الکترولیتهای قوی موادی هستند که به شکلی کامل در آب حل شده و تفکیک و یونیزه میشوند. یونیزاسیون این مواد باعث ایجاد کاتیون و آنیون در آب و عبور جریان الکتریکی میشود.
محلول الکترولیت قوی
در قسمت قبل آموختیم انواع محلول الکترولیت چیست. محلول الکترولیت قوی، محلولی است که به خوبی جریان الکتریکی را از خود عبور میدهد. موادی مانند سدیم کلرید، اسید نیتریک، اسید پرکلریک، کلسیم کلرید و … الکترولیتهای قوی هستند. معادله یونش این مواد میتواند به شکل زیر نمایش داده شود.
از آنجا که سدیم کلرید یک جامد یونی است، از یونهای سدیم مثبت و کلر منفی تشکیل شده است. با انحلال سدیم کلرید در آب، هیچ مولکول سدیم کلریدی به صورت تفکیک نشده در آب باقی نخواهد ماند. محلول الکترولیت تولید شده به شکل ۱۰۰ درصدی یونیزه شده است. برخی دیگر از جامدات یونی اینچنینی مواردی مانند کلسیم کلرید، آمونیوم کلرید، پتاسیم برمید، سولفات مس، سدیم استات، کلسیم کربنات و سدیم بی کربنات هستند.
مثال محلول الکترولیت قوی
در قسمت قبل آموختیم محلول الکترولیت قوی چیست. در ادامه، برخی از الکترولیتهای قوی معرفی شدهاند.
| نام ماده | معادله واکنش تفکیک |
| اسید کلریدریک | |
| هیدروبرمیک اسید | |
| نیتریک اسید | |
| اسید سولفوریک | |
| پرکلریک اسید | |
| سدیم کلرید | |
| پتاسیم نیترات | |
| باریم هیدروکسید | |
| سدیم هیدروکسید | |
| کلسیم هیدروکسید |
محلول الکترولیت ضعیف
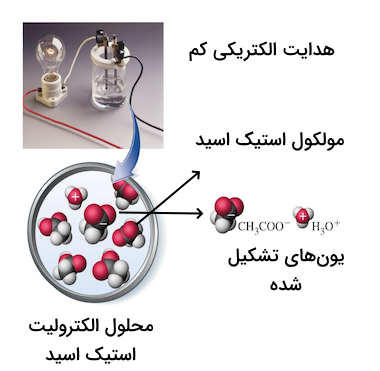
الکترولیتهای ضعیف موادی هستند که یونش و تفکیک برای آنها اتفاق میافتد اما مقدار آن کم است و مقدار قابل توجهی از ماده الکترولیت ضعیف به شکل تفکیک نشده در آب باقی میماند. برای مثال، موادی مانند آمونیاک، کربنیک اسید، استیک اسید و بیشتر اسیدها و بازهای آلی الکترولیتهای ضعیف هستند. برای مثال، واکنش یونش زیر به مقدار کمیدر محلول کربنیک اسید اتفاق میافتد.
در محلول کربنیک اسید تشکیل شده، مولکولهای تفکیک نشده کربنیک اسید نیز حضور خواهند داشت. مقدار از ماده (که معمولا به شکل درصد بیان میشود) دچار یونش شده و در محلول حضور خواهد داشت. همچنین از طرف دیگر، فرآیند یونیزاسیون را میتوان به استفاده از تعادل برقرار شده در واکنش و با استفاده از ثابت تعادل بررسی کرد. ثابت تعادل برای واکنش بالا به شکل زیر نوشته میشود.
با استفاده از علامت «[ ]» در واقع غلظت یونهای موجود در محلول را نمایش میدهیم. برای کربنیک اسید، مقدار ثابت تعادل بالا برابر با است. با توجه به عدد کوچک این ثابت تعادل میتوانیم دریابیم که غلظت یونهای ایجاد شده حاصل از انحلال به نسبت غلظت ماده اولیه بسیار کم است. پس در نتیجه این محلول یک محلول الکترولیت ضعیف است. تصویر زیر نمایانگر ساختار محلول الکترولیت ضعیف استیک اسید است.
از الکترولیتهای قوی در تولید سلولهای الکتروشیمیایی مختلف و باتریها استفاده گستردهای میشود. پیشنهاد میکنیم برای درک بهتر این سلولها، فیلم آموزش الکتروشیمی در شیمی پایه دوازدهم فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال محلول الکترولیت ضعیف
مثال دیگری از الکترولیتهای ضعیف، آب است. آب خالص هدایت الکتریکی بسیار کمیدارد. این هدایت الکتریکی به علت وجود یونهایی است که در اثر فرآیند خود یونش آب آزاد میشوند. معادله خود یونش آب به شکل زیر نوشته میشود.
ثابت تعادل برای واکنش بالا به شکل زیر نوشته میشود.
برای آب خالص، مقدار غلظت آب ثابت و برابر با ۵۵٫۶ مولار است. برای آب معمولا از معادله حاصل ضرب یونی استفاده میکنیم تا بتوانیم مقدار pH را به دست آوریمم. معادله حاصل ضرب یونی به شکل زیر نوشته میشود.
مقدار عدی به دما وابسته است. در دمای ۲۹۸ کلوین، مقدار آن برابر با است. اگر هیچ مادهای در آب حل نشده باشد، محلول مقادیر برابری از یونهای هیدروژن و هیدروکسید خواهد داشت. در نتیجه خواهیم داشت:
همچنین مقدار pH آب با استفاده از معادله بالا به دست میآید.
معادله بالا یکی از معادلههای مهم و اساس محاسبه مقدار اسیدیته و pH برای اسیدها و بازهای مختلف است. پیشنهاد میکنیم برای درک بهتر این مفاهیم، مطلب روش محاسبه pH مجله فرادرس را مطالعه کنید. در جدول زیر، برخی دیگر از الکترولیتهای ضعیف به همراه معادله تفکیک آنها معرفی شده است.
| نام ترکیب الکترولیت ضعیف | معادله شیمیایی تفکیک |
| اسید استیک | |
| هیدروژن سیانید | |
| اسیدهای ضعیف مانند فرمیک اسید | |
| باز های ضعیف مانند آمونیاک | |
| متیل آمین | |
| هیدروفلوئوریک اسید | |
| فسفریک اسید | |
| پیریدین | |
| آب |
محلول غیرالکترولیت چیست؟
محلول غیرالکترولیت محلولی است که نمیتوند جریان الکتریکی را از خود عبور دهد. ترکیبات کووالانسی، در صورت انحلال در آب یون تولید نمیکنند و الکترولیت نیستند. برای مثال، اگر مقداری شکر را که یک ترکیب کووالانسی است در آب حل کنید، هیچ جریان الکتریکی را از خود عبور نمیدهد و محلول آن، یک محلول غیرالکترولیت است.
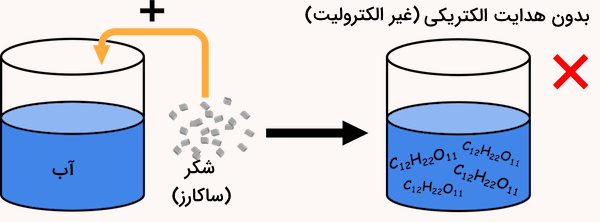
مثال محلول غیرالکترولیت
برخی از مواد غیرالکترولیت در جدول زیر ارائه شده است.
| ماده غیرالکترولیت | فرمول شیمیایی |
| گلوکز | |
| اتیل الکل | |
| گلیسرین | |
| اوره | |
| استون | |
| اتیلن گلیکول | |
| کلروفرم | |
| گازهای غیر قطبی مانند نیتروژن | |
| هیدروکربنهایی مانند متان | |
| متانول |
ویژگی محلولهای غیرالکترولیت
محلولهای غیرالکترولیت از انحلال مواد غیرالکترولیت در حلالهایی مانند آب به وجود میآیند. در این محلولها، حل شونده به یونهای سازندهاش تفکیک نمیشود و نمیتواند جریان الکتریکی را از خود عبور دهد. این محلولها ویژگیهایی دارند که در ادامه توضیح داده شده است.
- محلولهای غیرالکترولیت را نمیتوان الکترولیز و جداسازی کرد.
- این مواد بر روی نقطه انجماد حلال تاثیری نمیگذارند.
- این موا بر روی نقطه جوش حلال اثری نمیگذارند.
- این مواد جریان الکتریکی را از خود عبور نمیدهند.
- غیرالکترولیتها معمولا ترکیباتی مولکولی با پیوندهای کووالانسی هستند.
- این مواد دچار فرآیند تفکیک مولکولی نمیشوند.
- این مواد معمولا کم محلول هستند.
- این مواد فشار اسمزی محلول را افزایش میدهند.
کاربرد محلول غیرالکترولیت
محلولهای غیرالکترولیت به عنوان حلال و در بسیاری از داروها، مواد آرایشی، صنایع غذایی و به عنوان شیرین کننده در بسیاری از صنایع استفاده میشوند. در ادامه در مورد کاربرد محلولهای غیرالکترولیت توضیح میدهیم.
حلال، دارو و پزشکی
در آزمایشگاهها، برای هدفهای تحقیقاتی و حل کردن مواد به برخی از حلالها نیاز است. تنوع محلولهای غیرالکترولیت موجود بسیار زیاد است و به همین علت میتوان از آنها برای دستیابی به بسیاری از هدفها استفاده کرد. برای مثال، بنزن و استون حلالهایی هستند که تقریبا در تمامی آزمایشگاهها استفاده میشوند. در ترکیب بسیاری از داروها نیز، از ترکیبات غیرالکترولیت استفاده میشود.
واکنشهای شیمیایی و تولیدات
محلولهای غیرالکترولیت به عنوان حلال در واکنشهای شیمیایی آلی استفاده میشوند. در این گونه واکنشها که ممکن است حضور یون در بستر واکنش، مسیر واکنش را تغییر دهد، وجود مواد غیرالکترولیت میتواند بسیار کارآمد باشد. همچنین، از این مواد در تولید جوهر و رنگ نیز استفاده میشود.
مواد شوینده و بهداشتی
برخی از مواد غیرالکترولیت مانند اتانول به عنوان عامل شوینده و ضدعفونی کننده عمل میکنند. این ماده میتواند در روغنها حل شود و به عنوان عامل ضد باکتری عمل میکند.
ضد یخ
اتیلن گلیکول و پروپیلن گلیکول که هر دو غیرالکترولیت هستند به عنوان ضد یخ در سیستمهای خودران استفاده میشوند.
تفاوت محلولهای الکترولیت و محلول های غیرالکترولیت
در قسمتهای قبل آموختیم محلول الکترولیت چیست و به چه موادی غیرالکترولیت گفته میشود. این مواد بر اساس توانایی آنها در عبور جریان الکتریکی به وسیله ذرات باردار متحرک دسته بندی میشوند. برای تشخیص بهتر تفاوت محلول الکترولیت و غیرالکترولیت، به جدول زیر دقت کنید.
| محلول الکترولیت | محلول غیرالکترولیت |
| جریان الکتریکی را از خود عبور میدهند. | جریان الکتریکی را از خود عبور نمیدهند. |
| با انحلال در آب به یونهای سازندهشان تفکیک میشوند. | در صورت انحلال در آب، تفکیک نمیشوند. |
| این مواد معمولا ترکیبات یونی هستند که از اتصال یونهای مثبت و منفی به وجود آمدهاند. | این مواد معمولا ترکیبات مولکولی هستند که از اتصال اتمها با پیوند کووالانسی به وجود آمدهاند. |
| با عبور جریان الکتریکی میتوان آنها را الکترولیز کرد. | این مواد با عبور جریان الکتریکی، الکترولیز نمیشوند. |
انواع انحلال الکترولیت
در قسمت قبل آموختیم الکترولیت و محلول الکترولیت چیست. این محلولها از لحاظ میزان تفکیک میتوانند به سه دسته ضعیف و قوی و محلولهای غیرالکترولیت تقسیم شوند. همچنین در محلول الکترولیت، یونهای سازنده ماده الکترولیت از هم جدا شده و میتوانند در محلول حرکت کرده و جریان الکتریکی را برقرار کنند. حلالها میتوانند ماده الکترولیت را به دو روش یونی و کووالانسی هم از جدا کنند.
از همین رو، محلولهای الکترولیت را میتوان به دو دسته الکترولیت کووالانسی و الکترولیت یونی تقسیم کرد. در ادامه هر یک از این موارد را توضیح میدهیم.
الکترولیت یونی
محلول الکترولیت یونی محلولی است که یونهای سازنده الکترولیت به شکل یونی در آن حل شده و جداسازی شده است. حلالهایی مانند آب و سایر مواد قطبی میتوانند یونها را به سر مثبت و منفی خود جذب کنند. نیروهای الکترواستاتیک بین یون و مولکول قطبی با نام جاذبه یون – دوقطبی شناخته میشود. این جاذبهها نقش مهمی را در حل کردن مواد یونی در آب و سایر حلالهای قطبی دارند.
هنگامی که یک ترکیب یونی در آب حل میشود، یونهای الکترولیت جامد یا مایع از هم جدا شده و در حلال پخش میشوند. مولکول های حلال در این مرحله یونها را احاطه کرده و نیروهای الکترواستاتیک قوی بین ذرات باردار ترکیب یونی الکترولیت را ضعیف میکنند. این فرآیند یک تغییر فیزیکی با نام تفکیک است. تحت اغلب شرایط موجود، ترکیبات یونی به شکلی کامل بین مولکولهای حلال پخش میشوند و بدین ترتیب با نام الکترولیت قوی شناخته میشوند.
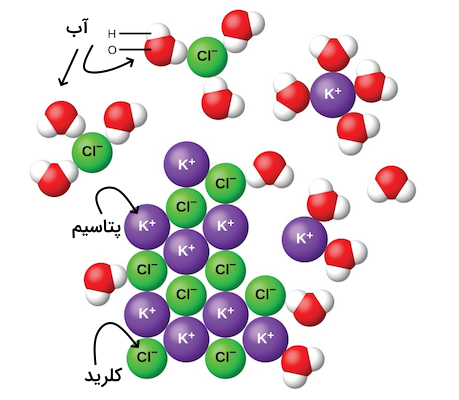
برای مثال تصور کنید که پتاسیم کلرید جامد را در آب حل کنیم. پتاسیم کلرید یک ترکیب یونی است که از یونهای مثبت پتاسیم و یونهای منفی کلر تشکیل شده است. نیروهای یون دوقطبی موجود، یون هیدروژن را به کلر و اکسیژن را به پتاسیم نزدیک میکنند. هر یون پتاسیم و کلر توسط چند مولکول آب احاطه شده و از هم جدا میشوند. پیشنهاد میکنیم برای درک بهتر این نوع انحلال و نیروهای بین آنها، مطلب «نیروهای بین مولکولی در شیمی» مجله فرادرس را مطالعه کنید.
الکترولیت کووالانسی
آب خالص یک هدایت کننده ضعیف جریان الکتریکی است زیرا به مقدار خیلی کمیدچار یونش شده و به یونهای هیدروژن و هیدروکسید تفکیک میشود. در برخی از موارد، محلولهای الکترولیت با استفاده از ترکیبات کووالانسی تهیه میشوند. در این موارد، مولکولهای حلال با ماده حل شونده به شکل شیمیایی واکنش داده و یون تولید میکنند. برای مثال، هیدروژن کلرید خالص گازی است که از مولکولهای کووالانسی اسید کلریدریک تشکیل شده است. این گاز شامل هیچ یونی نیست. با این وجود، اگر این گاز را در آب حل کنیم، محلول تشکیل شده یک الکترولیت قوی خواهد بود. مولکولهای آب نقش مهمیدر تولید یونها را در این مثال دارند. معادله شیمیایی واکنش انجام شده بین اسید کلریدریک گازی و آب به شکل زیر است.

اثر حلال بر الکترولیت
بنظر میرسد که آب به عنوان حلال تنها بستری را برای عبور یونها فراهم میآورد. اما در حقیقت حلال در تشکیل محلولهای الکترولیت نقشی بسیار مهم دارد. حلال های مناسب مانند آب، توانایی این را دارند که یونهای ترکیبات الکترولیت را به وسیله نیروهایی که اعمال میکنند از هم جدا کنند و بدین شکل باعث آزاد شدن یونهای الکترولیت در محلول شوند.
آب نه تنها حلالی رایج برای تولید محلولهای الکترولیت است، بلکه مهمترین حلال موجود نیز هست. این پدیده به علت ویژگیهای خاص آب است که در ادامه توضیح داده میشود. بر اساس قانون کولن، نیروی بین دو ذره باردار () با ضرب آن دو بار و مربع فاصله بین آنها () رابطه دارد.
D در معادله بالا نشان دهنده ثابت دی اکتریک حلال و یک کمیت بدون واحد است. آب بین حلالهای دیگر، بالاترین مقدار ثابت دی الکتریک را دارد و این به تفکیک یونهای مواد الکترولیت در آب کمک میکند. برای درک بهتر این پارامتر، این را در نظر بگیرید که جداسازی دو یون سدیم و کلر در خلاء و فاصله ۲۳٫۶ پیکومتر، ۵۸۶ ژول است درحالی که نیروی لازم برای جداسازی این دو یون در آب تنها ۷٫۳ ژول است.
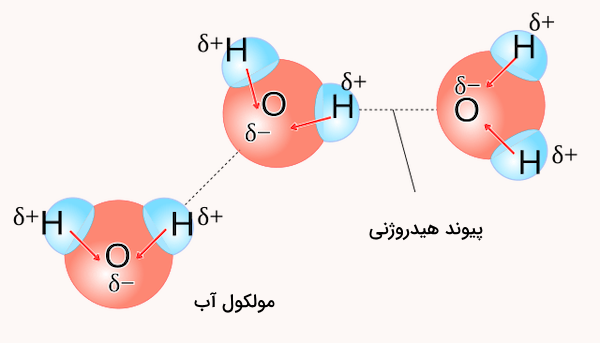
ثابت دی الکتریک یکی از ویژگیهایی است که در حجم ماده بررسی میشود. این کمیت برای تمامی مولکولها در محلول تعریف میشود که به همراه اندازه بار الکتریکی مورد نیاز برای جهتگیری مولکولها از سمت منفی به قطب مثبت میدان الکتریکی اندازهگیری میشود. هنگامی که یک یون درون حلال قرار میگیرد، نیروهای جاذبه بین مولکولی حلال باید کم شود تا بین ذرات یون فاصله ایجاد کند. این کار نیاز به انرژی دارد. با این وجود اگر حلال ممان دوقطبی بالایی داشته باشد، انرژی مورد نیاز بیشتر از انرژی یون دوقطبی بین یون و مولکولهای حلال خواهد بود.
آب، مادهای است که ملوکولهای آن ممان دوقطبی بالایی دارند و این مولکولها به وسیله پیوندهای هیدروژنی به هم متصل شدهاند. بالاتر بودن مقدار نیروهای دوقطبی نسبت به پیوند هیدروژنی به حل شدن راحتتر یونها در آب کمک میکند.
واکنش شیمیایی محلولهای الکترولیت
هنگامی که محلولهای الکترولیت با هم مخلوط میشوند، کاتیونها و آنیونه در محاورت یکدیگر قرار میگیند. اگر یونهای آزاد شده در محلولهای الکترولیت مخلوط شده مشابه باشند، هیچ واکنش شیمیایی رخ نمیدهد. اما اگر کاتیونها و آنیون ه متفاوت بانشند، ممکن است بتوانند با ترکیب شدن، جامدات یونی تشکیل دهند. به اینگونه واکنشها که جای کاتیون و آنیون دو ماده الکترولیت با هم جابه جا ی شود، واکنش جابهجایی یا واکنش جانشینی گفته میشود.
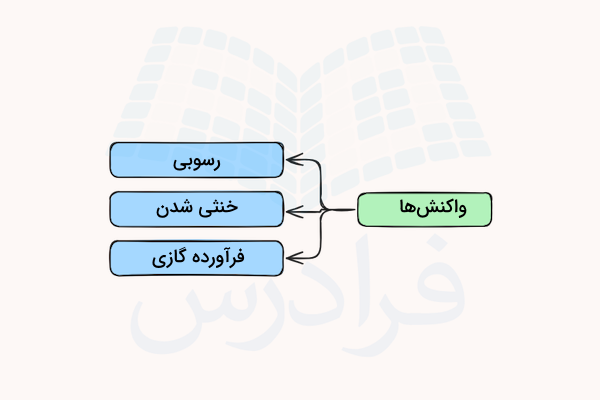
این واکنشها میتوانند یکی از سه فرآورده زیر را داشته باشند.
- تولید جامد: طی واکنشهای جابهجایی دو محلول الکترولیت ممکن است یک یا دو جامد یونی جدید تشکیل شود.
- خنثی شدن: اگر دو محلول الکترولیت ترکیب شده اسید و باز باشند، یونهای هیدروژن و هیدروکسید این مواد با هم ترکیب شده و آب و ترکیب یونی نمک تشکیل میشود. به این واکنشها خنثی شدن گفته میشود.
- تولید گاز: هنگامی که طی واکنشهای جابهجایی دو الکترولیت موکلولهای گازی خنثی تشکیل شود، حباب هایی در ظرف واکنش مشاهده میشود.
علاوه بر واکنشهای گفته شده بالا، واکنشهای اکسایش – کاهش نیز میتواند بین یونهای محلولهای الکترولیت تشکیل شود. در واقع واکنشهای انجام شده در باتریها از نوع واکنش اکسایش کاهش هستند.
مثال واکنش محلول الکترولیت
واکنش شیمیایی که بین محلولها الکترولیت مختلف انجام میشود، واکنش جانشینی است. در این واکنشها، جای دو یون در دو ترکیب یونی مختلف یا محلول الکترولیت جابهجا میشود. فرآورده این واکنشها میتواند به شل محلول، گازی یا جامد باشد. در ادامه مثالهایی را از این واکنشها ارائه کرده ایم.
واکنش رسوبی
واکنش محلولهای الکترولیت نیترات نقره و سدیم کلرید به شکل زیر است.
واکنش محلولهای الکترولیت سدیم کربنات و کلسیم کلرید به شکل زیر است.
واکنش محلولهای الکترولیت باریم کلرید و سدیم سولفات به شکل زیر است.
واکنش محلولهای الکترولیت سرب (II) نیترات و پتاسیم یدید به شکل زیر است.
واکنش محلولهای الکترولیت آهن (III) کلرید و سدیم هیدروکسید به شکل زیر است.
واکنش خنثی شدن
واکنش خنثی شدن واکنشی است که بین یک اسید و باز اتفاق میافتد. فرآورده این واکنشها، آب و ترکیب یونی است. برای مثال به واکنشهای زیر دقت کنید. واکنش محلول الکترولیت اسید کلریدریک و سدیم هیدروکسید به شکل زیر است.
واکنش اسید سولفوریک و باریم هیدروکسید به شکل زیر است.
واکنش اسید استیک و سدیم هیدروکسید به شکل زیر است.
فرآورده گازی
هنگامی که طی واکنشهای جابهجایی دو الکترولیت موکلولهای گازی خنثی تشکیل شود، حباب هایی در ظرف واکنش مشاهده میشود. واکنش سدیم کربنات و اسید کلریدریک به شکل زیر است.
واکنش آمونیوم کلرید و سدیم هیدروکسید به شکل زیر است.
واکنش آهن (II) سولفید و اسید کلریدریک به شکل زیر است.
محلولهای الکترولیت در باتری ها
محلولهای الکترولیت همواره در باتریها و سلولهای الکتروشیمیایی استفاده میشوند و حضور آنها ضروری است. ساده ترین نوع باتری از دو الکترود تشکیل شده است که در یک محلول الکترولیت قرار گرفتهاند. محلولهای الکترولیت بستر یونی مناسب را برای انتقال جریان الکتریکی در باتریها فراهم میکنند.
برای مثال، به باتری (پیل) زیر توجه کنید. این باتری از دو الکترود روی و مس تشکیل شده است. الکترود سمت راست الکترود روی و الکترود چپ راست الکترود مس است.
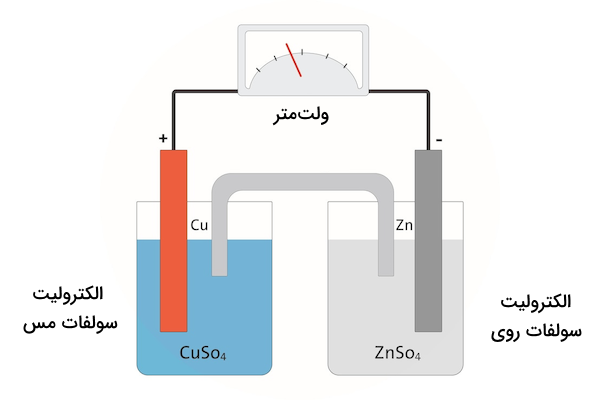
اتمهای روی تمایل دارند به یون تبدیل شده و دو الکترون آزاد کنند.
در حالی که اتمهای روی به محلول وارد میشوند، آنیونها از الکترود مس به سمت الکترود روی حرکت میکنند عالی شتا خنثی شوند. همچنین، الکترونها از الکترود روی به الکترود مس حرکت میکنند تا یونهای مس را خنثی کنند.
در باتریهای خشک، به جای محلول الکترولیت یک ماده خمیری مانند درون باتری قرار میگیرد تا از جاری شدن محلول جلوگیری شود.
سلول الکتروشیمیایی
سلولهای الکتروشیمایی در سه نوع سلول الکترولیتی، سلول گالوانی و سلول غلظتی میتوانند وجود داشته باشند. تمامی این سلولها ۴ جزء اصلی و مشابه دارند که محلول الکترولیت یکی از آنها است.
- محلول الکترولیت: این محلولها با قابلیت انتقال بار الکتریکی به وسیله یونهای باردار میتوانند جریان را بین آند و کاتد برقرار کنند.
- آند و کاتد: قطعههای معمولا فلزی هستند که در محلول الکترولیت قرار میگیرند و میتواند با تولید یون به انتقال جریان کمک کنند.
- سیم اتصال: آند و کاتد را به هم متصل کرده و باعث تکمیل مدار میشود.
یادگیری شیمیدانشگاهی با فرادرس
برای درک بهتر این موضوع که محلول الکترولیت چیست، باید با مفاهیمی چون ساختار اتم، پیوند یونی، پیوند کووالانسی، پیوند فلزی، اوربیتالهای مولکولی و … آشنا شویم. پینشهاد میکنیم برای یادگیری بیشتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث پرداخته شده است.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه الکترولیت دسترسی داشته باشید.
محلولهای الکترولیت در بدن
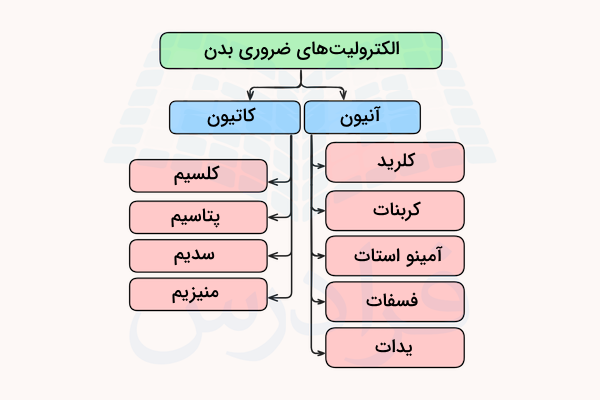
مایعات بدن انسانها محلولهایی از الکترولیتها و مواد دیگر هستند. الکترولیتهای اصلی که وجود آنها در مایعات بدن انسان ضروری است، کاتیونهای کلسیم، پتاسیم، سدیم و منیزیم و آنیونهای کلرید، کربنات، آمینو استات، فسفات و یدات هستند. به این محلولهای الکترولیت، ماکرومینرال (Macro mineral) یا مواد معدنی پرنیاز گفته میشود.
وجود محلولهای الکترولیت در بدن به سه علت حائز اهمیت است که در ادامه توضیح داده شده است.
- محلولهای الکترولیت جرایان الکتریکی را عبور میدهند و برای عملکرد عضلات و سیستم عصبی ضروری هستند.
- محلولهای الکترولیت فشار اسمزی اعمال کرده و مایعات بدن را در جای خود نگه میدارند.
- محلولهای الکترولیت به بافری بودن مایعات بدن و جلوگیری از تغییر pH آنها کمک میکنند.
تعادل الکترولیتها در بدن یکی از عوامل مهم برای عملکرد بدن است. برای مثال، پایین بودن پتاسیم بدن باعث آریتمی قلبی میشود و کم بودن آن باعث فلج شدن میشود. اگر بیماری، آب بدن خود را از دست بدهد، محلول های الکترولیت از قبل آماده شدهای برای او تجویز میشود که مقادیر این محلولهای الکترولیت را در بدن افزایش یابد.
منابع محلولهای الکترولیت
در این مطلب از مجله فرادرس آموختیم محلول الکترولیت چیست. محلولهای الکترولیت آماده شده برای بدن به صورت پودر و سرم وجود دارند. این محلولها برای جلوگیری یا درمان کم آبی بدن پس از ورزش، ازدیاد الکل در خون، عرق کردن زیاد، اسهال، استفراغ، مسمومیت و … استفاده میشود. یک محلول الکترولیت خانگی میتواند با ترکیب کردن آب، شکر و نمک با مقادیر دقیق تهیه شود. افزودن شکر برای تهیه صحیح این محلول ضروری است. الکترولیتها به شکل طبیعی در محلولهایی مانند آبمیوهها، نوشیدنیهای ورزشی، شیر، آجیلها، سبزیجات و … وجود دارند.
source
