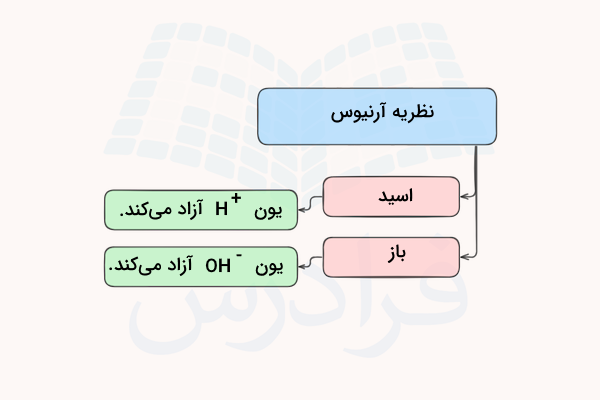
نظریه آرنیوس بیان میکند که اسیدها موادی هستند که در آب تفکیک شده و یون هیدروژن تولید میکنند و بازها موادی هستند که در آب تفکیک شده و یون هیدروکسید تولید میکنند. رفتار بسیاری از اسیدها و بازها طبق نظریه آرنیوس قابل توجیه است اما این نظریه برای اسیدها و بازهایی که در آب حضور ندارند قابل توضیح نیست. در این مطلب از مجله فرادرس میآموزیم نظریه آرنیوس چیست و مزایا و نقصهای آن کدامند.

در ابتدای این مطلب میآموزیم نظریه آرنیوس چیست و اسید و باز طبق این نظریه چه تعاریفی دارند. سپس معایب و مزایای این نظریه را بررسی میکنیم و مثالهایی را برای درک بهتر این نظریه ارائه میدهیم. در ادامه، نظریههای کاملتر تعریف اسید و باز مانند لوری – برونستد و لوییس را توضیح میدهیم. در نهایت به توضیح برخی از خواص مانند خاصیت آمفوتری آب و خاصیت اسیدی و بازی میپردازیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با نظریه آرنیوس و مثالهای آن آشنا شوید.
نظریه آرنیوس چیست؟
نظریه آرنیوس اولین بار در سال ۱۸۸۷ میلادی توسط دانشمند سوئدی سوانت آرنیوس (Svante Arrhenius) بیان شد. او مشاهده کرد که محلولهای حاوی مواد اسیدی جریان الکتریسیته را از خود عبور میدهند و نتیجه گرفت این مواد برای رسانا بودن باید یون آزاد کنند. او بدین ترتیب نتیجهگیری کرد که اسیدها در آب یون هیدروژن و بازها یون هیدروکسید تولید میکنند.
بر اساس این تعریف، واکنش تفکیک اسید نیتریک و باز لیتیوم هیدروکسید در آب به شکل زیر است.
بعدها اثبات شد که یون هیدروژن تولید شده توسط اسید آرنیوس در آب به همان صورت در آب باقی نمیماند و با ترکیب شدن با یک مولکول آب به شکل یون هیدرونیوم وجود خواهد داشت.
از اسیدهای آرنیوس میتوان به اسید کلریدریک، اسید سولفوریک و اسید نیتریک اشاره کرد. از بازهای آرنیوس میتوان به موادی مانند سدیم هیدروکسید، پتاسیم هیدروکسید، کلسیم هیدروکسید و … اشاره کرد.
یادگیری شیمی دوازدهم با فرادرس
یرای درک این موضوع که نظریه آرنیوس چیست، باید ابتدا با مفاهیمی مانند روش تشخیص اسید و باز و محاسبه pH محلولها آشنا شویم. همچنین، شناخت انواع واکنشهای شیمیایی، انواع پیوندها و عدد اکسایش مواد میتواند به درک ما از این مفهوم کمک کند. پیشنهاد میکنیم برای یادگیری این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازده بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازند.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به اموزشهای بیشتری در زمینه شیمی دبیرستان دسترسی داشته باشید.
اسید آرنیوس چیست؟
در قسمت قبل آموختیم نظریه آرنیوس چیست. در این قسمت بررسی میکنیم رفتار اسیدها طبق نظریه آرنیوس چیست. اسید آرنیوس مادهای است که در آب حل شده و یون هیدروژن تولید و آزاد میکند. در واقع، در محلولهای اسیدی مقدار غلظت یون هیدروژن افزایش مییابد.
برای مثال، واکنش تفکیک اسید کلریدریک را در آب در نظر بگیرید.
با تشکیل محلول آبی اسید کلریدریک، اسید به یونهای و تفکیک شده و غلظت یون هیدروژن در آن افزایش مییابد.
یون هیدروژن یا هیدرونیوم
تصور کنید که یک محلول ۲ مولار از هیدروبرمیک اسید را تهیه کردهایم. با توجه به تعریف اسید آرنیوس، آیا غلظت یون هیدروژن نیز در محلول ۲ مولار خواهد بود؟ یونهای هیدروژن تولید شده با مولکولهای آب اطراف خود وارد واکنش شده و یون هیدرونیوم را تولید میکنند. واکنش تولید یون هیدرونیوم به شکل زیر است.
با وجود اینکه معمولا واکنشهای تفکیک اسیدها در آب با تولید یون هیدروژن محلول در آب به صورت مشخص میشود، باید همواره این نکته را در نظر داشته باشیم که در ظرف واکنش این یون به صورت واقعی به شکل تنها وجود ندارد. تصویر زیر نشاندهنده تولید یون هیدرونیوم از یون هیدروژن و مولکول آب است.
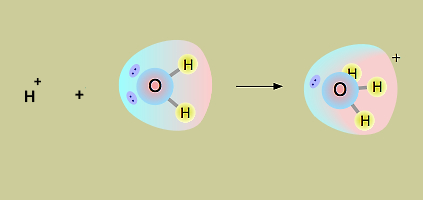
در واقع اگر بخواهیم واکنش تفکیک اسید آرنیوس را به شکل درستی بنویسیم، باید یون هیدرونیوم را به عنوان فرآورده واکنش بنویسیم. برای مثال، واکنش تفکیک اسید هیدروبرمید در آب به شکل زیر خواهد بود.
مثال اسید آرنیوس
تا اینجا آموختیم تعریف اسید بر اساس نظریه آرنیوس چیست. در جدول زیر، برخی از مثالهای اسید آرنیوس به همراه واکنش تفکیک آنها ارائه شده است.
| اسید آرنیوس | واکنش تفکیک |
| کلریک اسید | |
| نیتریک اسید | |
| پرکلریک اسید | |
| فسفریک اسید | |
| سولفوریک اسید | |
| سولفوروس اسید | |
| هیدروکلریک اسید | |
| استیک اسید | |
| هیدروبرومیک اسید |
ظرفیت اسید آرنیوس
اسیدهای آرنیوس مانند نیتریک اسید و هیدروکلریک اسید که در آب تنها یک یون هیدروژن آزاد میکنند، با نام اسید تک ظرفیتی یا اسید تک پروتونه شناخته میشوند. پروتون در اینجا به یون هیدروژن اشاره دارد که الکترون و نوترون ندارد و مانند یک پروتون تک عمل میکند. برخی دیگر از اسیدهای آرنیوس مانند اسید سولفوریک و اسید فسفریک میتوانند بیش از یک یون هیدروژن را در آب آزاد کنند. به این اسیدها، اسید چند پروتونه گفته میشود.
چندپروتونه بودن اسیدها لزوما ارتباطی با قدرت آنها ندارد و میزان قدرت اسیدها را با استفاده از ثابت تفکیک آنها مشخص میکنند. در ادامه، واکنشهای تفکیک اسید سولفوریک و جدا شدن هر یون هیدروژن را از آن مشاهده میکنید.
باز آرنیوس چیست؟
باز آرنیوس مادهای تعریف شده است که در صورت تفکیک در آب یون هیدروکسید تولید میکند. یکی از مثالهای باز آرنیوس، ماده سدیم هیدروکسید است. معاله واکنش تفکیک سدیم هیدروکسید در آب به شکل زیر است.
سدیم هیدروکسید در آب به شکلی کامل در آب تفکیک شده و یونهای هیدروکسید و سدیم تولید میکند. برخی از بازهای آرنیوس موادی مانند هیدروکسیدهای فلزات قلیایی و فلزات قلیایی خاکی هستند. تصویر زیر نشاندهنده یونهای تفکیک شده حاصل از انحلال سدیم هیدروکسید در آب است.
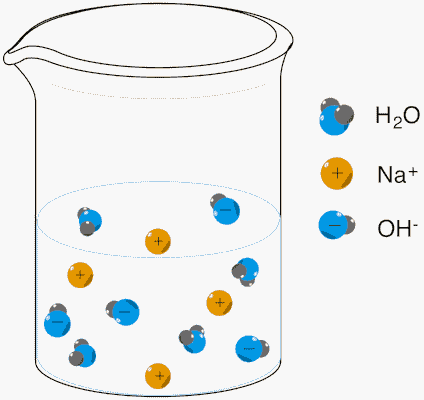
در برخی از تعاریف، باز آرنیوس به عنوان مادهای تعریف شده است که میتواند غلظت یون هیدروکسید را در محلول افزایش دهد و با این حال، خود شامل یون هیدروکسید در ساختار مولکول خود نباشد. برای مثال، باز متیل آمین طبق این تعریف میتواند باز آرنیوس در نظر گرفته شود. واکنش انحلال متیل آمین در آب به شکل زیر است.
بنابر این اگر تعریف دوم را به عنوان تعریف باز آرنیوس در نظر بگیریم، این ماده میتواند باز آرنیوس باشد.
مثال باز آرنیوس
در قسمت قبل آموختیم تعاریف باز بر اساس نظریه آرنیوس چیست. در ادامه برخی از بازهای آرنیوس به همراه معادله واکنش تفکیک آنها در جدول زیر ارائه شدهاند.
| باز آرنیوس | واکنش تفکیک |
| سدیم هیدروکسید | |
| آمونیوم هیدروکسید | |
| پتاسیم هیدروکسید | |
| منیزیم هیدروکسید | |
| کلسیم هیدروکسید | |
| آلومینیوم هیدروکسید |
واکنش تفکیک مواد
یک واکنش تفکیک، واکنشی است که در آن یک ماده به دو یا چند قسمت تقسیم و شکسته میشود. واکنشهای تفکیک معمولا واکنشهای برگشتپذیری هستند که در آنها یک واکنشدهنده و چند فرآورده وجود دارد.
در این واکنشها معمولا آب حلال به عنوان واکنشدهنده نوشته نمیشود و یونهای اجزای تشکیل دهنده با بار معمول نوشته شده و واکنش از لحاظ جرم و بار الکتریکی موازنه میشود. برای اسیدها و بازهای آرنیوس، واکنش تفکیک همواره شامل یونهای هیدروژن یا هیدروکسید است.
واکنش خنثی شدن اسید و باز آرنیوس
تا اینجا آموختیم تعریف اسید و باز بر اساس نظریه آرنیوس چیست. در ادامه واکنش حاصل از ترکیب شدن این اسیدها و بازها را بررسی میکنیم. هنگامی که یک اسید آرنیوس با یک باز آرنیوس واکنش میدهد، فرآوردههای واکنش اغلب نمک و آب هستند. به این واکنشها، واکنش خنثی شدن گفته می وشد. معادله واکنش کلی خنثی شدن اسید و باز آرنیوس به کشل زیر است.
واکنشهای خنثی شدن اسید و باز از مهمترین دستهبندی انواع واکنشهای شیمیایی هستند که کاربردهای بسیاری مانند تنظیم اسیدیته خاک در کشاورزی و … دارند. پیشنهاد میکنیم برای یادگیری بیشتر در مورد این واکنشها، فیلم آموزش نقش اسیدها و بازها در واکنشهای خنثیسازی فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
برای مثال، ترکیب دو واکنش تفکیک زیر را در نظر بگیرید.
ار ترکیب دو ماده بالا، آب از ترکیب یونهای هیدروکسید و هیدروژن به دست می اید. همچنین، ترکیب دو یون دیگر، نمک لیتیوم فلوسورید را تشکیل میدهد.
اگر ترکیب دو واکنش تولید آب و نمک را با هم ترکیب کنیم، واکنش کلی به شکل زیر نوشته میشود.
نقص نظریه آرنیوس
بر اساس تعاریفی که تا اینجا ارائه شد میتوانیم بسیاری از اسیدها و بازها را بر اساس نظریه آرنیوس تعریف کنیم اما این نظریه نقصی قابل توجه دارد. بر اساس نظریه آرنیوس اسید و باز تنها در صورت انحلال در آب تعریف میشوند و این نظریه برای اسید و بازهایی که در آب محلول نیستند تعریفی ارائه نمیکند. بر اساس نظریه آرنیوس، موادی مانند آمونیاک یا آمونیوم کلرید به عنوان باز تعریف نمیشوند در حالی که میدانیم این مواد باز هستند.
همچنین، این تعریف خاصیت اسیدی و بازی را در صورتی که این مواد در حلالی بجز آب حل شوند نیز توجیه نمیکند. برای مثال، طبق نظریه آرنیوس اگر اسید نیتریک در حلالی مانند بنزن حل شود دیگر اسید به شمار نمیآید در صورتی که میدانیم این تعریف صحیح نیست و این اسید همواره خاصیت اسیدی خود را حفظ میکند. یکی دیگر از نقصهای نظریه آرنیوس این است که این نظریه اسیدی و بازی بودن موادی مانند آلومینیوم کلرید، کربن دی اکسید و گوگرد دی اکسید را توجیه نمیکند.

در این نظریه، نمک تولید شده از واکنش خنثی شدن، نه اسیدی است و نه خاصیت بازی دارد. در صورتی که میدانیم از ترکیب برخی از اسیدها و بازها میتوانند نمکهایی با خاصیت اسیدی یا بازی به دست آورند. برای مثال، واکنش استیک اسید و سدیم هیدروکسید از این دسته است. در ادامه، ایرادهای نظریه آرنیوس در لیست زیر ارائه شده است.
- نظریه آرنیوس، اسید و باز را تنها در محیطهای آبی تعریف میکند.
- این نظریه تنها برای اسیدهایی با فرمول و بازهایی با فرمول قابل اعمال است.
- بر اساس این نظریه، اثر حلال بر خواص اسیدی و بازی مواد در نظر گرفته نمیشود.
- این نظریه نمیتواند خواص اسیدی و بازی مواد را در حلالهایی مانند بنزن توجیه کند.
- بر اساس نظریه آرنیوس، نمک حاصل از واکنش خنثی شدن، نمیتواند اسید یا باز باشد.
- این نظریه، یون هیدروژن را به عنوان فرآورده تفکیک اسید در نظر میگیرد و یون هیدرونیوم را تعریف نمیکند.
مزایای نظریه آرنیوس چیست؟
در قسمت قبل آموختیم نقصها و محدودیتهای نظریه آرنیوس چیست. با این وجود، نظریه آرنیوس میتواند در مورد بسیاری از مواد اعمال شده و به خوبی به ما در بررسی خواص مواد کمک کند. این نظریه میتواند خواص اسیدها و بازها و قدرت آنها را در محلولهای آبی مشخص کند. همچنین میتواند مشخص کند ظرفیت اسیدها چیست و واکنش های خنثی شدن و هیدرولیز چگونه انجام میشود.
نظریه آرنیوس در کنار سایر نظریههای اسید و باز و مفاهیمی مانند تشخیص و شناسایی اسیدها و بازها از مفاهیم مهم مطرح شده در شیمی دوازدهم هستند. پیشنهاد میکنیم برای آشنایی با سایر مفاهیم و فرمولهای این پایه، مطلب فرمولهای شیمی دوازدهم مجله فرادرس را مطالعه کنید.
مثال و تمرین نظریه آرنیوس
در قسمتهای قبل آموختیم نظریه آرنیوس چیست و چگونه اسید و باز را تعریف میکند. در ادامه، برای درک بهتر اینکه نظریه آرنیوس چیست، به مثالهای زیر دقت کنید و به تمرینها پاسخ دهید.
مثال ۱
مشخص کنید کدام یک از مواد و اسید آرنیوس است.
پاسخ
برای تشخیص اسید آرنیوس، نیاز است ابتدا معادله تفکیک مواد نوشته شود. اگر طی تفکیک این مواد، یون هیدروژن یا هیدرونیوم آزاد شود، آن ماده اسید آرنیوس است.
ماده اول، هگزان است. هگزان یک ماده آلی است که در آب تفکیک نمیشود پس نه اسید آرنیوس است و نه باز آرنیوس. ماده دوم، دی هیدروژن سولفید است که معادله تفکیک آن در آب به شکل زیر است.
همانطور که مشاهده میکنید، این ماده در آب یون هیدروژن آزاد میکند. پس یک اسید آرنیوس است.
مثال ۲
مشخص کنید کدام یک از مواد و باز آرنیوس است.
پاسخ
برای تشخیص باز آرنیوس، نیاز است ابتدا معادله تفکیک مواد نوشته شود. اگر طی تفکیک این مواد، یون هیدروکسید آزاد شود، آن ماده باز آرنیوس است. ابتدا معادله تفکیک هیدروژن فلوئورید را مینویسیم.
طبق معادله بالا، این ماده در آب یون هیدروژن آزاد میکند و یون هیدروکسید تولید نمیکند پس این ماده باز آرنیوس نیست و اسید آرنیوس است. حال معادله تفکیک آهن (III) هیدروکسید را می نویسیم.
طبق معادله بالا، با تفکیک این ماده در آب یون هیدروکسید آزاد شده پس یک باز آرنیوس است.
مثال ۳
مشخص کنید که ماده یک اسید آرنیوس است یا یک باز آرنیوس و معادله واکنش شیمیایی که این خاصیت را مشخص میکند، بنویسید.
پاسخ
با توجه به فرمول مولکولی این ماده (باریم هیدروکسید) و اینکه شامل یونهای هیدروکسید است باید یک باز آرنیوس باشد. برای نشان دادن خاصیت بازی آن، باید معادله تفکیک آن را در آب بنویسیم. این معادله به شکل زیر خواهد بود.
تمرین ۱
در کدام گزینه تمامی موارد، اسیدها و بازهای آرنیوس هستند؟
،
،
،
،
گزینههای اول، دوم و آخر شامل موادی هستند که اسید و باز آرنیوس نیستند. در دو گزینه اول، مواد و نمک هستند و در گزینه آخر آمونیاک یک باز است اما به دلیل نداشتن گروه OH باز آرنیوس به شمار نمیآید.
تمرین ۲
معادله صحیح تفکیک ماده کدام است؟
ماده ذکر شده در صورت سوال، استیک اسید است که یک اسید آرنیوس به شمار میآید و طی معادله واکنش تفکیک، یک یون آزاد میکند.
تمرین ۳
معادله صحیح تفکیک ماده کدام است؟
ماده ذکر شده هیدروکسید کروم (III) و یک باز آرنیوس است. معادله تفکیک این ماده باید یون هیدروکسید و یون کروم با بار +۳ آزاد کند.
نظریه های کامل تر
پس از اثبات کامل نبودن نظریه آرنیوس برای توجیه خاصیت اسیدی و بازی برخی از مواد، نظریههایی دیگر برای تعریف کاملتر اسید و باز تعریف شد. این نظریهها، نظریه برونستد – لوری و نظریه لوییس هستند. در ادامه، هریک از این موارد را به شکل مختصر توضیح میدهیم.
نظریه لوری – برونستد
بر اساس نظریه لوری – برونستد، اسید مادهای است که بتواند حداقل یک یون هیدروژن را به مادهای دیگر بدهد. بر اساس این تعریف، باز مادهای است که بتواند یون هیدروژن را از ماده دیگر دریافت کند. برای مثال، بر اساس این تعریف، هیدروکلریک اسید یک اسید و آمونیاک یک باز است و واکنش بین آنها به شکل زیر انجام میشود.
در این واکنش، یک یون هیدروژن از هیدروژن کلرید جدا شده (اسید) و این یون توسط آمونیاک (باز) دریافت شده است. این نظریه میتواند اسید و باز را در محیطهای آبی و غیر آبی تعریف کند و همچنین، خاصیت بازی و اسیدی موادی که دارای یون هیدروژن یا هیدروکسید در ساختار خود نیستند را توضیح دهد. برای مثال، خاصیت اسیدی کربن دی اکسید و خاصیت بازی آمونیاک طبق این تعریف توجیه میشود.
این تعریف میتواند خاصیت اسیدی و بازی مواد یونی را نیز توجیه کند و مفاهیم کاربردی اسید و باز مزدوج نیز طیق این نظریه تعریف میشود. با این وجود، این تعریف نمیتواند خاصیت آمفوتری مواد را تعریف کند. همچنین، خاصیت اسیدی برخی از کلریدها و خاصیت اسیدی و بازی برخی از اکسیدها را توجیه نمیکند.
نظریه آرنیوس و نظریه لوری برونستد مخالف یکدیگر نیستند و نظریه لوری برونستد تنها کامل کننده نظریه آرنیوس است.
نظریه لوییس
بر اساس تعریف لوییس، اسید مادهای است که میتواند جفت الکترون غیرپیوندی را از یک ماده دیگر دریافت کند و باز مادهای است که میتواند به ماده دیگری جفت الکترون غیرپیوندی بدهد. اسید لوییس باید ظرفیت (اوربیتال) خالی برای پذیرش جفت الکترون داشته باشد. بر اساس این تعریف، تمامی کاتیونها به دلیل ظرفیت پذیرش الکترون، اسید لوییس هستند و تمامی آنیونها به دلیل دارا بودن جفت الکترون اضافی، باز لوییس هستند.
تمامی اسیدها و بازهای آرنیوس و لوری – برونستد، اسید و باز لوییس نیز هستند اما عکس این مورد صحیح نیست.
خاصیت آمفوتری آب
آمفوتر به موادی گفته میشود که هم میتوانند به عنوان باز و هم به عنوان اسید عمل کنند. آب نیز یک آمفوتر است و میتواند همزمان خاصیت اسیدی و بازی داشته باشد. طبق نظریه آرنیوس، واکنش تفکیک آب که هم یون هیدروکسید و هم یون هیدروژن تولید میکند، تاییدی بر خاصیت آمفوتری آن است.
مفهوم pH
pH محلولها، معیاری از میزان اسیدی یا بازی بودن آنها است. اگر pH یک محلول برابر با عدد ۷ باشد، گفته میشود که آن محلول خنثی است و نه اسیدی و نه بازی است. pH بین اعداد ۰ و ۷ نشان دهنده خاصیت اسیدی محلول و pH بین ۷ تا ۱۴ نشاندهنده خاصیت بازی محلول است. مقدار pH با استفاده از غلظت یون هیدروژن یا هیدرونیوم محلول و با استفاده از ثابت تفکیک آب به دست می آید.
یادگیری شیمی عمومی با فرادرس
اسیدها و بازها از مهمترین دسته بندیهای مواد شیمیایی هستند که در بسیاری از مسائل کاربرد دارند. برای شناخت بهتر اسید و باز آرنیوس و سایر مواد ابتدا باید با مفاهیمی مانند قاعده اوکتت، الکترونخواهی، پیوند یونی و انواع محلولها آشنا شوید. همچنین، شناخت مباحثی مانند شناساگرها، اسید و بازهای قوی و ضعیف و محلولهای بافر نیز به درک این موضوع که نظریه آرنیوس چیست کمک میکنند. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.

همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه شیمی دانشگاهی دسترسی داشته باشید.
خواص کلی اسیدها و بازها
در این مطلب از مجله فرادرس آموختیم نظریه آرنیوس چیست و سایر نظریهها چگونه اسید و باز را تعریف میکنند. در ادامه، خواص کلی اسیدها و بازها را معرفی میکنیم. در جدول زیر، ویژگی های اسیدها و بازها معرفی شدهاند.
| اسید | باز |
| افزایش غلظت یون هیدروژن در محلول طبق نظریه آرنیوس | افزایش غلظت یون هیدروکسید در محلول طبق نظریه آرنیوس |
| طعم ترش | طعم تلخ |
| تغییر رنگ کاغذ لیتموس آبی به قرمز | تغییر رنگ کاغذ لیتموس قرمز به آبی |
| محلول دارای ۷ pH | محلول دارای ۷ pH |
| موادی مانند مرکبات، سرکه و هیدروکلریک اسید | موادی مانند صابونها، آمونیاک و سدیم هیدروکسید |
معادله آرنیوس چیست؟
معادله آرنیوس یک معادله ریاضی است که سوانت آرنیوس برای بررسی سرعت واکنشهای شیمیایی بیان کرده است و نباید با نظریه آرنیوس در مورد اسیدها و بازها اشتباه گرفته شود. این معادله به شکل زیر است.
در این معادله، k ثابت سرعت، A ضریب پیشنمایی، انرژی فعالسازی، R ثابت جهانی گازها و T دما بر حسب کلوین است.
source
