در فیزیک اتمی و شیمی کوانتوم، قاعده هوند یا قواعد هوند به مجموعه قوانین و اصولی گفته میشود که توسط فردریک هوند برای تعیین ترم طیفی و حالت انرژی یک اتم ارائه شده است. در شیمی عمومی و دبیرستان، قاعده هوند بیان میکند که در آرایش الکترونی یک اتم در حالت پایه، الکترونها ابتدا با جهت اسپینی مشابه هم زیرلایههای الکترونی را پر کرده و سپس با اسپین متفاوت در هر زیرلایه جفت میشوند. در این مطلب از مجله فرادرس میآموزیم قاعده هوند چیست و به روش استفاده از این قاعده در آرایش الکترونی عناصر میپردازیم.

در ابتدای این مطلب میآموزیم قاعده هوند چیست و این قاعده را در حد شیمی دبیرستان بررسی میکنیم. سپس قاعده اول هوند را در مولکولها و اوربیتال مولکولی بررسی میکنیم. در ادامه، ارتباط حالت برانگیخته اتم را با قاعده هوند بررسی کرده و اهمیت آرایش الکترونی عناصر را توضیح میدهیم. همچنین، با توضیح و مثال سایر قواعد هوند را آموخته و در نهایت نیز مثالهایی را از قاعده هوند بررسی کرده و کاربردهای این قاعده را توضیح میدهیم. با مطالعه این مطلب تا انتها میتوانید با قاعده هوند و کاربرد آن در شیمی به شکلی کامل آشنا شوید.
قاعده هوند چیست؟
فردریک هوند (Friedrich Hund) فیزیکدان آلمانی برای تعیین ترم طیفی الکترونهای حالت پایه یک اتم چند الکترونی، مجموعه قوانینی را ارائه کرده است که به قاعده هوند یا اصل هوند معروف هستند. اولین قاعده هوند، مهمترین قانون در شیمی کوانتوم است و آن را با نام اصل هوند میشناسند. این قاعده در شیمی دبیرستان و برای توضیح ترتیب پر شدن اوربیتالهای الکترونی بیان شده است.
قواعد هوند از ۳ قانون تشکیل شدهاند که به شرح زیرند.
قاعده اول هوند
قاعده اول هوند بیان می کند که برای یک آرایش الکترونی مشخص، ترمی که بیشترین چندگانگی را دارد، دارای کمترین انرژی است. این بدین معنی است که می توان حالت پایدار یک اتم (حالت پایه) را بر اساس آرایش الکترونی آن به دست آورد. میزان چندگانگی یک الکترون با عبارت 2s+1 مشخص میشود که در آن S مجموع کل اعداد کوانتومی اسپین الکترون است که از جمع مقادیر اعداد کوانتومی اسپین الکترون به دست میآید.
بیان سادهی قاعده هوند بدین شکل است که در حالت پایه اتم، الکترونها ابتدا با اسپین هم جهت اوربیتالهای الکترونی را یکی یکی پر کرده و سپس با اسپین مخالف و به صورت دوتایی در اوربیتالها جفت میشوند. این حالت، پایدارترین حالت آرایش الکترونها در اوربیتال اتمها است و کمترین انرژی را دارد.

برای یک اتم یا مولکول در حالت پایه، الکترونهای جفت نشده در اوربیتالها اغلب اسپین همجهت دارند. در این موارد، مقدار چندگانگی این مواد برابر با تعداد الکترونهای جفت نشده آنها به علاوه عدد ۱ است. قانون اول هوند که بیشترین استفاده را در شیمی دارد، با نامهای قاعده هوند و قاعده بیشینه چندگانگی الکترون نیز شناخته میشود.
قاعده دوم هوند
برای یک الکترون با چندگانگی مشخص که از قانون اول به دست میآید، حالتی که بیشترین مقدار برای مجموع اعداد کوانتومی فرعی L برای الکترونها در حالت پایه را داشته باشد، کمترین مقدار انرژی را دارد.
قاعده سوم هوند
برای یک حالت مشخص الکترون، در یک اتم که آخرین لایه الکترونی آن نیمهپر یا پر نشده باشد، مقدار جمع اعداد کوانتومی اصلی و فرعی، کمترین مقدار انرژی را دارد.
این قوانین به سادگی تعیین میکنند که اتم در حالت پایه چه آرایش الکترونی خواهد داشت. دانستن این قوانین به ما کمک میکند پدیدههای مربوط به انتقال الکترون مانند تشکیل یون یا پیوند شیمیایی را بهتر درک کنیم. قاعده دوم و سوم هوند در شیمی دبیرستان و شیمی عمومی توضیح داده نمیشوند.
یادگیری شیمی دبیرستان با فرادرس
در قسمت قبل آموختیم قاعده هوند چیست و قواعد هوند چه مسائلی را توضیح میدهند. شاخت قاعده هوند و اثر آن در آرایش الکترونی مواد میتواند به ما اطلاعات مهمی در مورد پایداری اتمها، حالت پایه و حالت برانگیخته اتم، اوربیتالهای مولکولی و نحوه تشکیل پیوندهای شیمیایی بدهد. برای یادگیری قاعده هوند ابتدا باید با آرایش الکترونی عناصر و اصل آفبا آشنا شد. پیشنهاد میکنیم برای یادگیری این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آمده است، میتوانید به آموزشهای بیشتری در زمینه شیمی متوسطه دسترسی داشته باشید.
توضیح و مثال از قاعده هوند
قاعده اول هوند مهمترین قاعده هوند در تعیین ساختار آرایش الکترونی یک اتم در شیمی و درک پدیدههای مربوط به آن است. این قانون که با نام قانون بیشینه چندگانگی هوند شناخته میشود، مربوط به اسپین الکترون و عدد کوانتومی اسپین آن است. هر الکترون میتواند اسپین رو به بالا یا پایین داشته باشد و یکی از مقادیر اعداد کوانتومی اسپین یا را اختیار کند.
قانون هوند بیان میکند که در هر زیرلایه الکترونی، هر الکترون با اسپین بالا ابتدا به ترتیب اوربیتالهای خالی را اشغال میکند و سپس باقی الکترونها پس از نیمهپرشدن زیرلایه، سایر اوبیتالها را با اسپین مخالف اشغال میکنند. برای مثال فرض کنید که یک زیرلایه p با ۳ اوربیتال و ظرفیت ۶ الکترون داریم. اگر ۴ الکترون برای پر کردن این اوربیتالها وجود داشته باشد، حالتی پایدارتر است که ابتدا ۳ الکترون با اسپین رو به بالا تک تک اوربیتالها را اشغال کرده و سپس الکترون چهارم با اسپین مخالف با یکی از الکترونها جفت شود.
تصویر زیر نشاندهنده قاعده هوند برای مثال ارائه شده است.

مقدار بیشینه چندگانگی برای این مثال از طریق زیر به دست میآید. سه الکترون با اسپین و یک الکترون با اسپین وجود دارد پس جمع مقادیر اسپین S برابر با عدد ۱ میشود.
بنابر اصل طرد پائولی، دو الکترون نمیتوانند با اعداد کوانتومی کاملا یکسان در یک اتم وجود داشته باشند و دست کم عدد کوانتومی اسپین آنها متفاوت خواهد بود. بنابر قاعده اول هوند، پایدارترین حالت انرژی اتم حالتی است که در آن مقدار عدد کوانتومی اسپین کلی برای الکترونها در یک زیرلایه پر نشده، بیشترین مقدار را داشته باشد.
برای درک بهتر اینکه قاعده هوند چیست، باید به خوبی بتوانیم آرایش الکترونی عناصر را رسم کنیم و الکترونها را در آنها جای دهیم. پیشنهاد میکنیم برای درک بهتر نحوه رسم این آرایشها، فیلم آموزش آرایش الکترونی عناصر فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال از قانون اول هوند
برای درک بهتره شیوه بکارگیری قانون هوند برای آرایش الکترونی، به مثالهای زیر توجه کنید.
مثال ۱
آرایش الکترونی اتم نیتروژن با عدد اتمی ۷ را نوشته، سپس این آرایش الکترونی را با رسم الکترونها در زیرلایهها مشخص کنید.
پاسخ
ابتدا طبق قوانین آفبا، آرایش الکترونی اتم نیتروژن را مینویسیم.
طبق این آرایش الکترونی، دو زیرلایه s با اوربیتالهای پر شده و یک زیرلایه p با اوربیتالهای نیمهپر داریم. اوربیتالهای زیرلایه s دارای ظرفیت ۲ الکترون و اوربیتالهای زیرلایه p دارای ظرفیت ۶ الکترون هستند. پس دو الکترون با اسپین مخالف اوربیتالهای 1s و 2s را پر کرده و سه الکترون باقیمانده به شکلی تکی و هم جهت هر یک در اوربیتالهای 2p جای میگیرند.
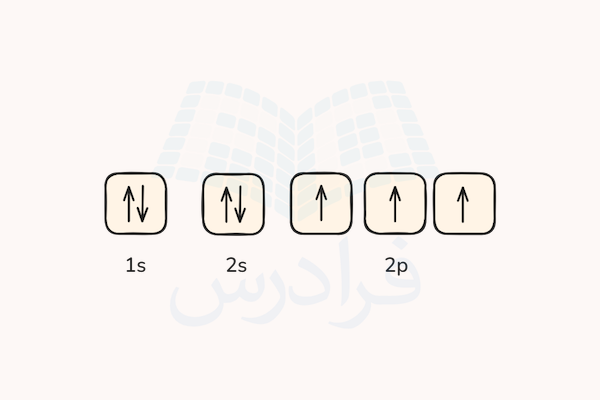
دقت داشته باشید که قاعده هوند در قانون اول بیان کرد که بیشترین مقدار عدد کوانتومی اسپین کلی اتم پایدارترین حالت آن است و بنابر اصل طرد پائولی، الکترونها با اسپین موافق نمیتوانند دریک اوربیتال قرار بگیرند. در نتیجه حالت رسم شده بالا پایدارترین حالت آرایش الکترون برای اتم نیتروژن بوده و مقدار عدد کوانتومی اسپین کلی S برای این اتم برابر با است.
مثال ۲
آرایش الکترونی اتم اکسیژن با عدد اتمی ۸ را نوشته، سپس این آرایش الکترونی را با رسم الکترونها در زیرلایهها مشخص کنید.
پاسخ
ابتدا طبق قوانین آفبا، آرایش الکترونی اتم اکسیژن را مینویسیم.
اتم اکسیژن نیز مانند اتم نیتروژن دارای اوربیالهای الکترونی 1s و 2s و 2p است. در هر اوربیتال s، دو الکترون با اسپینهای مخالف در عر زیرلایه جای می گیرند. زیرلایه p سه زیرلایه با ظرفیت ۶ الکترون درا. طبق قاعده هوند،ابتدا ۳ الکترون با اسپینهای رو به بالا سه زیرلایه را به صورت نیمهپر اشغال میکنند. الکترون چهارم میتواند در یکی از زیرلایهها با اسپین رو به پایین با الکترونی دیگر جفت شود.
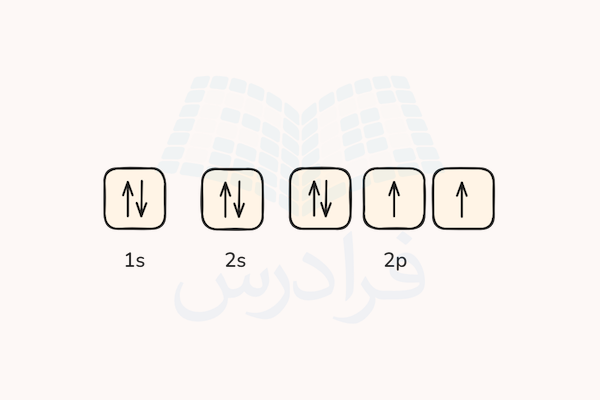
توجه داشته باشید که هیچ دو الکترونی طبق اصل طرد پائولی نمیتوانند اعداد کوانتومی یکسان داشته باشند در نتیجه اسپین هر دو الکترون موجود در هر زیرلایه باید خلاف جهت هم باشند. الکترون چهارم اتم اکسیژن میتواند هر کدام از سه زیرلایه را اشغال کند و انرژی آنها با هم برابر است اما به صورت قراردادی برای نشان دادن حالت آرایش الکترونها در اتم، معمولا الکترونها از چپ به راست زیرلایهها را پر میکنند.
مثال ۳
با نوشتن آرایش الکترونی چهار اتم بور، کربن، نیتروژن و اکسیژن، نمودار اوربیتال الکترون آنها را رسم کرده و قاعده هوند را برای آن بررسی کنید.
پاسخ
اتم بور عدد اتمی برابر ۵، اتم کربن عدد اتمی ۶، اتم نیتروژن عدد اتمی ۷ و اکسیژن عدد اتمی ۸ دارد. تمامی این اتمها دارای دو الکترون در اوربیتال 1s و دو الکترون در اوربیتال 2s هستند که مجموعه ۴ الکترون را شامل میشود. باقی الکترونها به ترتیب زیرلایههای اوربیتال 2p را اشغال میکنند.
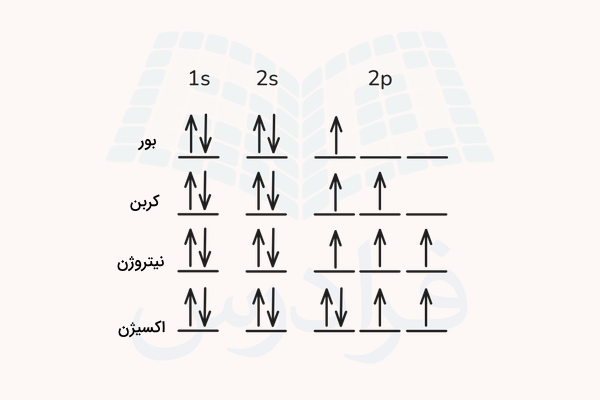
بنابر قواعد هوند، هر الکترون ابتدا با اسپین رو به بالا و از چپ به راست، زیرلایههای اوربیتال 2p را به صورت تکی اشغال کرده و سپس در اتم اکسیژن که ۴ الکترون در اوربیتال 2p دارد، الکترون چهارم، با اسپین رو به پایین با یکی از الکترونها جفت میشود.
مثال ۴
دلیل پایداری آرایش الکترونی را برای اتم کروم با استفاده از قانون هوند توضیح دهید.
پاسخ
برای پاسخ به این سوال، ابتدا آرایش الکترونی این اتم را بر اساس قوانین آفبا رسم میکنیم. آرایش الکترونی اتم کروم با عدد اتمی ۲۴ به شکل زیر است.
در بررسی آرایش الکترونی عناصر فلزات واسطه میآموزیم که اوربیتال d نیمهپر از اوربیتال d با ۴ الکترون و زیرلایه s پر پایدارتر است. یعنی حالت پایه اتم کروم، آرایش الکترونی مشابه زیر دارد.
برای بررسی پایداری این آرایش الکترونی، از قواعد هوند بهره میبریم. بر اساس قاعده هوند، حالتی که بیشترین چندگانگی را داشته باشد (مجموعه اعداد کوانتومی اسپین آن بیشتر باشد) پایدارتر است. برای بررسی این قانون، شکل اوربیتال الکترون زیرایه 3d و 4s را برای هر دو حالت این اتم بررسی میکنیم.
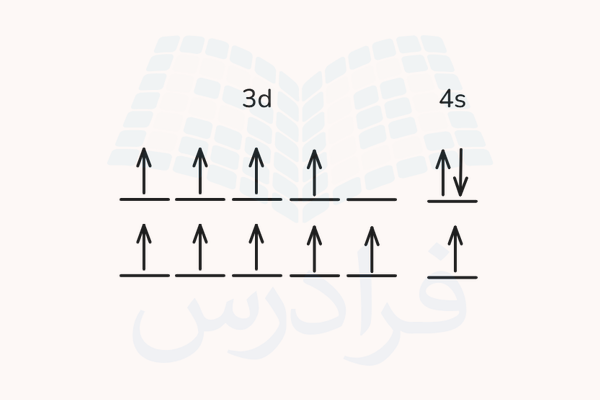
همانطور که در تصویر بالا مشاهده میکنید، در حالتی که هر دو اوربیال نیمهپر هستند، مجموع اعداد کوانتومی اسپین الکترونها در این اتم برابر با +۳ خواهد بود. این درحالی است که اگر اوربیتال 4s به صورت جفت شده باشد و اوربیتال d چهار الکترون داشته باشد، مجموع اعداد کوانتومی اسپین برای این اتم برابر با +۲ میشود. پس حالت اوربیتال نیمهپر پایدارتر خواهد بود.
مثال ۵
قاعده هوند را برای آرایش الکترونی اتم مس با عدد اتمی ۲۹ بررسی کنید.
پاسخ
ابتدا آرایش الکترونی را برای اتم مس بر اساس قوانین آفبا مینویسیم.
مانند مثال قبل، حالت برای این اتم طبق قوانین آفبا نوشته میشود اما حالت برای این اتم پایدارتر است. با این حال، قاعده هوند نمیتواند مانند مثال قبل این پایداری را توجیه کند. پایداری اوربیتال d پر به دلیل تقارن آرایش الکترونی، دافعه کمتر بین الکترونها پایدارتر است و این قانون در تمامی اتمها با این آرایش الکترونی برقرار است.
مثال ۶
آرایش الکترونی اتمهای طلا، کلر و کلسیم با اعداد اتمی ۷۹، ۱۷ و ۲۰ رسم کرده و مقدار چندگانگی را برای آنها محاسبه کنید.
پاسخ
برای پاسخ به این پرسش ابتدا باید آرایش الکترونی این اتمها را رسم کرده و سپس بررسی کنیم اثر قاعده هوند برای آنها چیست. سپس با استفاده از فرمول چندگانگی، مقدار 2s+1 را برای آنها محاسبه میکنیم. ابتدا آرایش الکترونی اتم طلا را مینویسیم.
در این آرایش الکترونی، تمامی اوربیتالها پر هستند بجز زیرلایه 5d که شامل ۹ الکترون است. هشت الکترون این زیرلایه جفت شده هستند و یک اوربیتال حاوی الکترون جفت نشده دارد پس مقدار مجموع عدد کوانتومی اسپین برای آن برابر است و مقدار چندگانگی آن برابر با ۲ میشود.

حال آرایش الکترونی اتم کلر را بررسی کرده و مقدار عدد کوانتومی اسپین کلی آن را به دست می آوریم.
در این اتم، الکترونهای تمامی اوربیتالها بجز اوربیتالهای 3p به صورت جفت شده و پر هستند. در این زیرلایه، ۴ الکترون به صورت جفت شده اوربیتالها را پر کردهاند و یک الکترون به صورت تک وجود دارد. مقدار عدد کوانتومی اسپین کلی آن برابر با است و مقدار چندگانگی آن برابر با ۲ میشود.
در بررسی اتم کلسیم و قاعده هوند برای آن، آرایش الکترونی آن را رسم میکنیم.
با توجه به آرایش الکتروینی این اتم، تمامی اوربیتالها و زیرلایهها با الکترونهای دوتایی جفت شده و اسپین مخالف پر شدهاند پس مقدار کلی عدد کوانتومی اسپین برای این اتم برابر با صفر و بیشینه مقدار چندگانگی برابر با ۱ است.
بررسی قاعده هوند در مولکولها
در قسمتهای قبل آموختیم قاعده هوند چیست و چگونه بررسی میشود. حال مهمترین قاعده هوند را در مورد اتمها و مولکولها و در اوربیتالهای الکترونی و مولکولی بررسی و مقایسه خواهیم کرد. قاعده چندگانگی هوند قانونی است که بر اساس بررسی طیف اتمی مواد به دست آمده است. این طیفها و قوانین میتوانند حالت پایه یک اتم یا موکول را در یک یا تعداد بیشتری لایه الکترونی باز (پر نشده) بررسی و پیشبینی کنند.
این قانون بیان میکند که برای یک آرایش الکترونی مشخص، کمانرژی ترین حالت، حالتی است که بیشترین چندگانگی اسپین S را داشته باشد. این قانون به این صورت تعبیر میشود که اگر دو یا تعداد بیشتری از اوربیتالها با انرژی برابر برای الکترون در دسترس باشد، الکترونها ابتدا به صورت تکی تمامی اوربیتالها را اشغال کرده و سپس جفت میشوند.
با وجود اینکه پایدارترین مولکولها معمولا زیرلایههای پر شده در اوربیتال مولکولی خود دارند، در برخی از موارد ممکن است الکترونهای جفت نشدهای وجود داشته باشند که قاعده هوند برای آنها اعمال میشود. یکی از مثالهای این مورد، مولکول دواتمی اکسیژن است. این مولکول، دو اوربیتال مولکولی ضدپیوندی پای دارد که در آنها تنها دو الکترون وجود دارد. با توجه به قانون هوند، حالت پایه این مولکول حالت سهتایی اکسیژن با چندگانگی ۱ = S دارد که در آن دو الکترون جفت نشده دو زیرلایه را به صورت تکی اشغال کردهاند.
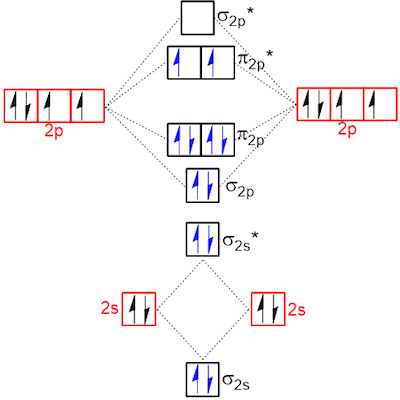
حالت تکی اکسیژن با یک اوربیتال ضدپیوندی پای پر شده به صورت دوتایی و یک اوربیتال ضدپیوندی پای استار خالی، درواقع یک حالت برانگیخته به شمار میآید که خواص شیمیایی متفاوت و واکنشپذیری بیشتری نسبت به حالت پایه این مولکول دارد.
از دیگر مولکولهای اینچنینی که در ساختار اوربیتال مولکولی خود، اوربیتالهای پر نشده دارند میتوان به متیلن اشاره کرد. از دیگر مثالهای این مولکولها میتوان به مولکولهای آلی کاربن اشاره کرد که در ساختار خود اتمهای کربنی دارند که تنها ۶ الکترون در لایه ظرفیت آنها وجود دارد و درنتیجه در ساختار اوبیتال مولکولی آنها تمامی زیرلایهها با الکترون اشغال نشدهاند و قاعده هوند برای انها اعمال میشود. تا کنون تنها یک مولکول شناخته شده است که حالت پایه آن از قوانین هوند پیروی نمیکند. این مولکول ۵- دی هیدرو ام زالین است.
حالت برانگیخته اتم و قاعده هوند
قوانین هوند تنها برای حالت پایه اتم قابل اعمال هستند و برای حالات برانگیخته الکترونی به سختی میتوان بر اساس قوانین هوند نتیجهگیری کرد.
اهمیت آرایش الکترونی
هنگامی که اتمها با یکدیگر ارتباط برقرار کرده و بین آنها پیوند تشکیل میشود، اولین الکترونهایی که برهمکنش دارند، الکترونهای لایه ظرفیت (آخرین لایه الکترونی) هستند. یک اتم در حالتی ناپایدار است و بیشتر تمایل به واکنش دارد که لایه آخر الکترونی آن از الکترون پر نشده باشد و زیرلایههای خالی در آن وجود داشته باشد. این الکترونهای ظرفیت درواقع رفتار شیمیایی اتمها و نحوه برهمکنش آنها در ترکیبات و واکنشهای شیمیایی را مشخص میکنند.
آرایش الکترونی همچنین میتواند میزان پایداری یک اتم را نیز مشخص کند. اتم در حالتی پایدار است که تمامی اوربیتالهای آن پر باشد و زیرلایهای خالی در ساختار الکترونی آن وجود نداشته باشد. به همین دلیل است که گازهای نجیب که آرایشی با اوربیتالهای الکترونی پر دارند، تمایلی به تشکیل ترکیب یا شرکت در واکنشهای شیمیایی ندارد. تمامی مفاهیم مطرح شده برای درک اینکه قاعده هوند چیست، بر اساس مدل کوانتومی اتم عریف شدهاند. پیشنهاد میکنیم برای یادگیری بیشتر در مورد این مدل، مطلب «مدل کوانتومی اتم چیست» مجله فرادرس را مطالعه کنید.
یادگیری شیمی دانشگاهی با فرادرس
در این مطلب آموختیم قاعده هوند چیست و چگونه آرایش الکترونی عناصر و مولکولها را توجیه میکند. برای یادگیری قاعده هوند باید با مفاهیمی چون ساختار اتم، خواص بنیادی اتم و آرایش الکترون آن اشنا شویم. هم چنین آشنایی با ترم طیفی عناصر، تبهگنی و انرژیهای کوانتومی نیز به درک بهتر قواعد هوند کمک میکند. پیشنهاد میکنیم برای یادگیری بهتر این مسائل و مفاهیم، مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.

همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه قاعده هوند دسترسی داشته باشید.
کاربرد قاعده هوند
در قسمتهای قبل این مطلب از مجله فرادرس آموختیم قاعده هوند چیست و چگونه تعیین میشود. حال به بررسی کاربردهای این قاعده میپردازیم. قاعده هوند در مطالعات و بررسیهای شیمی و فیزیک کوانتومی اصلی بسیار مهم است. این قانون، اوربیتالهای همانرژی و میزان پایداری آنها را در زیرلایههای مشابه بررسی میکند. این قاعده در طیفسنجی و برای تشکیل و توضیح طیف اتمی عنصرهای متفاوت به کار میرود.
قاعده هوند در اندازهگیری و بررسی آرایش الکترونی پایدار مواد با درنظر گرفتن بیشترین چندگانگی اسپین به کار گرفته میشود. یکی از مهمترین نتایج بررسی قاعده هوند، پی بردن به خواص مغناطیسی مواد است. اتمهایی که در ساختار الکترونی آنها الکترونهای جفت نشده وجود داشته باشد، پارامغناطیس هستند و در میدان مغناطیسی جهتگیری میکنند. موادی که در آنها تمامی الکترونها به شکل جفت شده هستند، اسپین خالص آنها برابر صفر خواهد بود و در میدان مغناطیسی جهتگیری نمیکنند و با نام دیامغناطیس شناخته میشوند.
source
