اسید نیتریک یک اسید معدنی خورنده است که از یک اتم هیدروژن، یک اتم نیتروژن و سه اتم اکسیژن تشکیل شده است. از این ماده در صنایع بسیاری همچون کشاورزی و جواهرسازی استفاده میشود. این اسید در دو فرم خشک و در ترکیب با نیتروژن دی اکسید به رنگ قرمز وجود دارد. در این مطلب از مجله فرادرس میآموزیم اسید نیتریک چیست و چه ویژگیهایی دارد.

در ابتدای این مطلب میآموزیم اسید نیتریک چیست و فرمول، ساختار، انواع و خواص آن را بررسی میکنیم. سپس روشهای تولید و واکنشهای شامل اسید نیتریک را توضیح میدهیم. در ادامه مطلب کاربردها و مزایا و معایب این ماده شیمیایی را بررسی کرده و در نهایت به توضیح تاریخچه آن میپردازیم. با مطالعه این مطلب تا انتها، میتوانید با این اسید کاربردی و خواص آن به شکلی کامل آشنا شوید.
اسید نیتریک چیست؟
اسید نیتریک (به انگلیسی: Nitric Acid) یک اسید معدنی با فرمول شیمیایی است که از دسته اسیدهای قوی به شمار میآید. این اسید مایعی بدون رنگ است که به مرور زمان و با تجزیه شدن به اکسیدهای نیتروژن، رنگ آن به زرد – قهوهای تغییر میکند.
اسید نیتریک یکی از اصلیترین مواد برای انجام واکنشهای نیتروژنه کردن است. این ماده به شدت خورنده و خطرناک است و حاوی بخارات سمی است. این ماده نقشی مهم در تولید کودهای شیمیایی و مواد منفجره دارد.
یادگیری شیمی دبیرستان با فرادرس
برای درک این موضوع که اسید نیتریک چیست، باید با مفاهیمی چون نظریه آرنیوس، مفهوم اسید و باز، درجه یونش و ثابت یونش آشنا شد. همچنین، با آشنایی با بررسی محاسبات pH و مفهوم خنثی شدن اسید و باز میتوانیم بهتر بفهمیم اسید نیتریک چیست. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس متوسطه بخش شیمی مراجعه کنید که با زبانی ساده و کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی دبیرستان دسترسی داشته باشید.
فرمول اسید نیتریک
در قسمت قبل آموختیم اسید نیتریک چیست. فرمول شیمیایی اسید نیتریک به شکل است. این ماده از یک اتم هیدروژن، یک اتم نیتروژن و سه اتم اکسیژن تشکیل شده است. شکل مولکول اسید نیتریک به صورت زیر است.
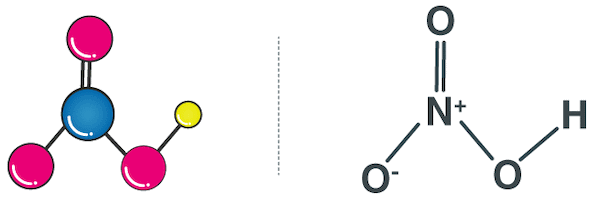
نامهای دیگر اسید نیتریک، آکوا فورتیس (Aqua Fortis) و هیدروژن نیترات هستند.
ساختار اسید نیتریک
یکی از روشهای درک اینکه اسید نیتریک چیست، توجه به ساختار آن است. اسید نیتریک از سه اتم اکسیژن، یک اتم هیدروژن و یک اتم نیتروژن تشکیل شده است. بین دو اکسیژن تنهای متصل به نیتروژن ساختاری رزونانسی وجود دارد و طول این پیوندها چیزی حدود ۱٫۲ آنگستروم گزارش شده است. ساختار این مولکول تقریبا مسطح است.
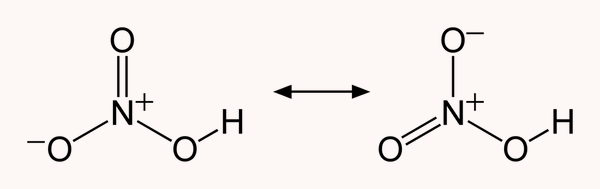
یکی از اکسیژنها با پیوند دوگانه به اتم نیتروژن مرکزی متصل است. سایر پیوندهای این مولکول از نوع یگانه هستند و یکی از اکسیژنهای متصل به نیتروژن بار ۱- دارد. از آنجا که اتم نیتروژن در این مولکول با ۴ پیوند به اتمهای دیگر متصل شده است، بار ۱+ دارد و مولکول از لحاظ بار الکتریکی به طور کلی خنثی است.
انواع نیتریک اسید
نیتریک اسید در غلظتها و انواع مختلفی به بازار عرضه شده و در کاربردهای متنوعی استفاده میشود. این اسید در اثر حرارت و نور تجزیه شده و نیتروژن دی اکسید تولید میکند. بسته به مقدار نیتروژن دی اکسید تولید شده، اسید نیتریک در فرمهای اسید نیتریک قرمز دودزا و اسید نیتریک خشک سفید به بازار عرضه میشود.
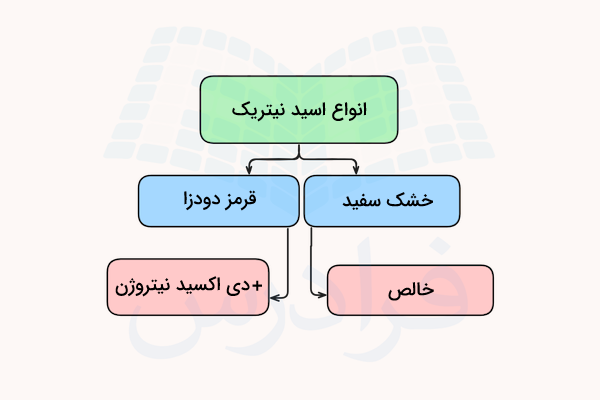
اسید نیتریک قرمز دودزا
اسید نیتریک قرمز دودزا (Red Fuming Nitric Acid) تجاری دارای ۹۸ درصد با چگالی ۱٫۵۰ گرم بر سانتیمتر مکعب است و معمولا در صنایع مواد منفجره استفاده میشود. این نوع اسید نسبت به شکل بیآب آن کمتر فرار و خورنده است و غلظت تقریبی ۲۱٫۴ مولار دارد.

اسید نیتریک قرمز (RFNA) به دلیل داشتن مقادیر زیادی دیاکسید نیتروژن محلول، رنگی مایل به قهوهای – قرمز دارد و چگالی آن کمی کمتر، حدود ۱٫۴۹۰ گرم بر سانتیمتر مکعب است. برای کاهش خوردگی در مخازن فلزی، به اسید نیتریک دودکننده، مقدار کمی فلورید هیدروژن (HF) اضافه میشود که یک لایه محافظ فلوئوریدی روی فلز ایجاد میکند.
اسید نیتریک خشک سفید
اسید نیتریک بیآب، که بهعنوان اسید نیتریک دودکننده سفید (White Fuming Nitric Acid) نیز شناخته میشود، تقریبا خالص بوده و حاوی ۹۹٫۹ درصد است. این مایع بیرنگ با چگالی حدود ۱٫۵۱۲ گرم بر سانتیمتر مکعب، در دمای منفی ۴۲ درجه سانتیگراد منجمد شده و در ۸۳ درجه سانتیگراد به جوش میآید.
با گذشت زمان، در اثر تجزیه به دیاکسید نیتروژن و آب، به رنگ زرد متمایل میشود و به همین دلیل در بطریهای شیشهای مقاوم به ضربه و با فضای کافی برای آزادسازی فشار ذخیره میشود.
خواص اسید نیتریک
در قسمت قبل آموختیم اسید نیتریک چیست و ساختار آن چگونه است. حال توضیح میدهیم خواص فیزیکی و شیمیایی اسید نیتریک چیست.
خواص فیزیکی اسید نیتریک
اسید نیتریک مایعی بدون رنگ و با بخارات فراوان است. این ماده بویی تند و اسیدی دارد. چگالی آن برابر با ۱٫۵۱ گرم بر سانتیمتر مکعب است. نقطه جوش و ذوب آن به ترتیب برابر با ۸۳ درجه سانتی گراد و ۴۲- درجه سانتیگراد است.
این ماده به شکلی کامل در آب حل میشود. اسید نیتریک در غلظتهای متفاوتی عرضه میوشود که رنگ آنها نسبت به ترکیبات موجود در آنها میتواند بدون رنگ، زرد یا قرمز باشد.

خواص شیمیایی اسید نیتریک
اسید نیتریک یک اسید قوی تک پروتونه و تک ظرفیتی است. این اسید رنگ کاغذ لیتموس قرمز را به آبی تغییر میدهد. این ماده به شکلی مداوم هیدراتهایی همچون مونو هیدرات و تریهیدرات تولید میکند.
با تابش گرما یا نور به اسید نیتریک، این ماده به راحتی به نیتروژن دی اکسید تجزیه میشود. این ماده به شدت اکسنده است و با بسیاری از ترکیبات غیر فلزی واکنش میدهد. همچنین، فلزات در این اسید حل شده و اکسید فلزی تولید میکنند.
جرم مولی اسید نیتریک ۶۳٫۰۱ گرم بر مول و pH آن برابر با ۳٫۰۱ است. اسید نیتریک یک اسید معدنی است. اسیدهای معدنی برخلاف اسیدهای آلی، ترکیباتی معدنی هستند که ساختار کربنی ندارند. این اسیدها معمولا از اسیدهای آلی قویتر بوده و قادرند به طور کامل در آب یونیزه شوند. پیشنهاد میکنیم برای درک بهتر خواص این اسیدها، فیلم آموزش اسیدهای آلی و معدنی فرادرس که لینک آن در ادامه درج شده است را مشاهده کنید.
تولید اسید نیتریک
اسید نیتریک به روشهای آزمایشگاهی و صنعتی متفاوتی تولید میشود. در ادامه توضیح میدهیم روشهای تولید اسید نیتریک چیست.
مقیاس صنعتی
اصلیترین روش تولید اسید نیتریک، اکسیداسیون کاتالیستی آمونیاک است. در این روش، گاز آمونیاک به وسیله هوا یا اکسیژن اکسید شده و نیتریک اکسید و نیروژن دی اکسید تولید میکند.
به این روش روش استوالد گفته میشود و کاتالیزور این روش، فلز پلاتین است. سپس نیتروژن دی کسید تولید شده توسط آب جذب شده و اسید نیتریک تولید میکند. واکنشهای انجام شده برای تولید اسید نیتریک به روش استوالد به شرح زیر هستند.
اکسیدهای نیتروژن حل شده یا در محلول باقی میمانند تا اسید نیتریک قرمز تولید کنند یا از محلول جداسازی میشوند. اسید نیتریک تجاری معمولا با درصد خلوص بین ۵۲ تا ۶۸ درصد عرضه میشود. خلوص بالاتر تا ۹۸ درصد با استفاده از دیهیدراتاسیون و حذف آب اسید با استفاده از اسید سولفوریک انجام میشود. اکسیدهای نیتروژن از مهمترین و پرکاربردترین اکسیدهای تولید شده هستند. پیشنهاد میکنیم برای آشنایی بیشتر با این مواد، مطلب «اکسید چیست» مجله فرادرس را مطالعه کنید.
مقیاس آزمایشگاهی
روش دیگر تولید اسید نیتریک، سنتز و تولید آزمایشگاهی آن است. در این روشها بسیاری از نمکهای نیترات با سولفوریک اسید وارد واکنش شده و اسید نیتریک تولید میکنند. برای مثال، واکنش سدیم نیترات و پتاسیم نیترات با سولفوریک اسید به شکل زیر است.
سیستم متشکل از وسایل و تجهیزات مورد نیاز برای انجام این روش مطابق شکل زیر است.
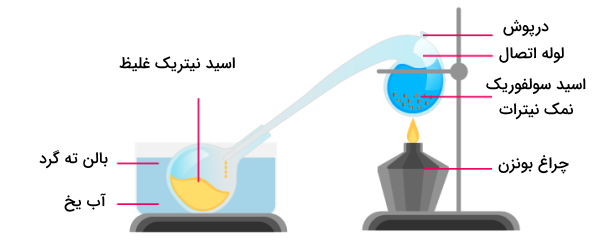
روش دیگر، تقطیر اسید نیتریک در دمای ۸۳ درجه برای جداسازی نمکهای فلزی محلول است. این روش، مخلوطی از آزئوتروپهای اسید نیتریک را با خلوص ۶۸٫۵ درصد تولید میکند. این اسید نیتریک سپس میتواند با استفاده از اسید سولفوریک یا منیزیم نیترات به غلظتهای بالاتر برسد.
در روشی دیگر، تجزیه حرارتی نیترات مس (II) به تولید نیتروژن دی اکسید و گاز اکسیژن میانجامد. سپس این مواد از آب یا آب اکسیژنه عبور داده میشوند و مشابه روش استوالد، اسید نیتریک تولید میشود. واکنشهای این روش به شکل زیر هستند.
واکنشهای اسید نیتریک
اسید نیتریک اسیدی غلیظ است که در واکنشهای متنوعی شرکت کرده و مواد کاربردی و مفیدی را تولید میکند. در ادامه بررسی میکنیم مهم ترین واکنشهای اسید نیتریک چیست.
تجزیه اسید نیتریک
اسید نیتریک در دمای اتاق و با کمک نور و حرارت، به نیتروژن دی اکسید، اکسیژن و آب تجزیه میشود. واکنش این تجزیه به شکل زیر است و محلولی به رنگ زرد تا قهوه ای تولید میکند. رنگ رسوب نیتروژن دی اکسید در این واکنش قهوهای است.
واکنش با فلزات
اسید نیتریک با فلزات وارد واکنش شده و گاز هیدروژن و نیترات فلزی تولید میکند. واکنشهای زیر، نمونههایی از این نوع واکنش هستند.
واکنش اسید نیتریک و فلزات به ماهیت فلزات و غلظت اسید نیز وابسته است. برای مثال، اسید نیتریک در واکنش با فلزاتی که فعال نیستند مانند مس و نقره میتواند فلزات را اکسید کند.

بیشتر فلزات در واکنش با نیتریک اسید، به ترکیبات نیترات فلزی تبدیل میشوند. برخی از شبهفلزات و فلزات در واکنش با اسید نیتریک، اکسید فلزی تولید میکنند.
برخی از فلزات گرانبها مانند طلا و فلزات گروه پلاتین، با اسید نیتریک واکنش نمیدهند. با این وجود، طلای خالص با ترکیب مخلوط اسید نیتریک و اسید کلریدریک (تیزاب سلطانی) واکنش میدهد. برخی از ترکیبات موجود در آلیاژهای طلا مانند طلای رنگی با اسید نیتریک واکنش داده و اکسید میشوند و باعث تغییر رنگ سطح طلا میشوند. به همین دلیل از اسید نیتریک در صنعت جواهرسازی استفادههای فراوان میشود.
واکنش با غیر فلزات
اسید نیتریک یک اکسنده قوی است و با بسیاری از ترکیبات آلی واکنش میدهد. ترکیبات آلی تولید شده با استفاده از نیتریک اسید، مبنای تولید بسیاری از مواد منفجره مانند نیتروگلیسرین و تری نیترو تولوئن (TNT) هستند.
واکنش اسید نیتریک با نافلزات (بجز نیتروژن، اکسیژن، گازهای نجیب، سیلیسیم و هالوژنها بجز ید) معمولا منجر به اکسیداسیون آنها به بالاترین حالات اکسایش میشود. در این واکنشها، اسید نیتریک غلیظ، نیتروژن دی اکسید تولید کرده و اسید نیتریک رقیق، نیتروژن اکسید تولید میکند.
برای مثال، واکنش کربن به شکل گرافیت با اسید نیتریک غلیظ و رقیق، به ترتیب به شکل زیر است.
واکنش های بیوشیمیایی
نیتریک اسید با پروتئینها واکنش داده و ترکیبات نیترات زرد رنگ تولید میکند. این واکنشها با نام واکنشهای زانتوپروتیک شناخته میشود. این واکنشها با اضافه کردن اسید نیتریک غلیظ به نمونهها و سپس حرارت دادن آنها انجام میشود.
اگر یک ترکیب پروتئینی شامل آمینو اسیدهایی با حلقههای آروماتیک باشد، رنگ مخلوط به زرد تغییر پیدا میکند. اگر به این مخلوط یک باز نیز اضافه شود، این مخلوطها به نارنجی تغییر رنگ میدهند. این تغییرات رنگ به دلیل نیتراته شدن حلقههای آروماتیک موجود در پروتئینها انجام میشود.
کاربرد اسید نیتریک
اسید نیتریک در بسیاری از صنایع مختلف مانند تولید کودهای شیمیایی نیتراته، جواهر سازی، نساجی، مواد منفجره و تولید مواد شیمیایی کاربرد دارد. در ادامه میآموزیم مهمترین کاربردهای اسید نیتریک چیست.

تولید کود شیمیایی
اصیترین کاربرد صنعتی اسید نیتریک، استفاده از آن در تولید کودهای شیمیایی است. اسید نیتریک با آمونیاک خنثی شده و آمونیوم نیترات تولید میکند که در تولید کودهای نیتراته کاربرد دارد. این کاربرد اسید نیتریک حدود ۷۵ تا ۸۰ درصد تولیدات سالانه صنعتی اسید نیتریک را مصرف میکند.
تولید پلاستیک و نایلون
پیش ماده تولید نایلون، آدیپیک اسید است که در مقیاس صنعتی با اکسیداسیون ترکیباتی از سیکلوهگزانون و سیکلوهگزانون با اسید نیتریک تولید میشود.
سوخت موشک
اسید نیتریک به فرمهای مختلف به عنوان اکسید کننده در موشکهای سوخت مایع استفاده میشود. فرمهای اسید نیتریک استفاده شده دراین کاربرد عبارتند از اسید نیتریک دودزای قرمز، اسید نیتریک دودزای سفید و اسید نیتریک مخلوط با اسید سولفوریک.
جواهرسازی
اسید نیتریک قابلیت اکسید کردن فلزات را دارد، به عنوان مثال، میتواند مس را به نیترات مس (II) تبدیل کند. همچنین، زمانی که با اسید هیدروکلریک ترکیب شود، محلولی به نام تیزاب سلطانی ایجاد میکند که قادر است فلزات نجیبی مانند طلا را حل کرده و آن را به اسید کلرواوریک تبدیل کند.

از این نمکها میتوان برای خالصسازی طلا و سایر فلزات تا خلوص بالای ۹۹٫۹٪ از طریق روشهایی مانند تبلور مجدد و رسوبگیری انتخابی استفاده کرد. ویژگی اسید نیتریک در حل کردن برخی فلزات بهطور انتخابی یا به عنوان حلال نمکهای فلزی، باعث شده که در فرآیند جداسازی طلا کاربرد داشته باشد.
آنالیز آزمایشگاهی
در آنالیز عنصری و طیف سنجی جذب اتمی شعلهای از محلول رقیق اسید نیتریک (۰٫۵ تا ۵٫۰ درصد) به عنوان ترکیب برای تعیین مقدار ناچیز فلزات در محلولها استفاده میشود. برای این نوع آنالیز اسید نیتریک با درجه خلوص بسیار بالا و فاقد فلزات مورد نیاز است زیرا حتی مقدار کمی از یونهای فلزی میتواند بر نتایج تاثیر بگذارد.
همچنین این اسید معمولا در فرآیند هضم نمونههای آب کدر، لجن، مواد جامد و سایر نمونههای خاص که نیاز به آنالیز عنصری دارند به کار میرود. در حوزه الکتروشیمی اسید نیتریک به عنوان عامل ناخالصی شیمیایی برای نیمه رساناهای آلی و همچنین در فرآیندهای خالص سازی نانولولههای کربنی خام کاربرد دارد.
صنعت چوب
اسید نیتریک در غلظت پایین (تقریبا ۱۰ درصد) معمولا برای کهنهسازی مصنوعی چوب کاج و افرا استفاده میشود. رنگی که ایجاد میشود، خاکی-طلایی است که شبیه به چوبهای قدیمی که با واکس یا روغن پوشش داده شدهاند، به نظر میرسد.
پاک کنندهها
اثر خورندگی اسید نیتریک برای برخی کاربردهای خاص بهطور گستردهای استفاده میشود، مانند حکاکی در چاپ، اسیدشویی فولاد ضدزنگ یا تمیز کردن ویفرهای سیلیکونی در صنعت الکترونیک. برای حکاکی فلزات و نمایان ساختن ریزساختار، محلول اسید نیتریک، آب و الکل به نام نیتال بهکار میرود. اسید نیتریک بهصورت ترکیبی با اسید هیدروکلریک یا بهطور جداگانه برای تمیز کردن لامها و پوششهای شیشهای در میکروسکوپهای پیشرفته استفاده میشود. همچنین برای تمیز کردن شیشه پیش از فرآیند نقرهزدن آینهها بهکار میرود.
ترکیبات آبی تجاری اسید نیتریک با غلظت ۵ تا ۳۰ درصد و اسید فسفریک با غلظت ۱۵ تا ۴۰ درصد معمولا برای پاکسازی تجهیزات غذایی و لبنیات بهویژه برای حذف ترکیبات رسوبی کلسیم و منیزیم استفاده میشود. این ترکیب به جلوگیری از خوردگی آلیاژهای آهنی توسط اسید نیتریک رقیق کمک میکند.
بازیابی سوخت هستهای
اسید نیتریک در روشهای بازیابی سوخت هستهای نقش کلیدی دارد،. این اسید میتواند بسیاری از اکتنیدها را حل کند. نیتراتهای حاصل به ترکیبهای مختلفی تبدیل میشوند که میتوانند بهطور انتخابی واکنش داده و استخراج شوند تا فلزات از یکدیگر جدا شوند.
تصفیه آب
در فرآیند تصفیه، اسید نیتریک گاهی برای تنظیم pH آب در تصفیه آب آشامیدنی و فاضلاب صنعتی به کار میرود.
مزایا و معایب اسید نیتریک
اسید نیتریک ممکن است از صنایع مختلفی که آن را تولید میکنند، استفاده میکنند یا با آن کار میکنند، مانند کارخانههای شیمیایی، صنایع فلزات، شیشه و پلاستیک، آزاد شود. همچنین در دود اگزوز خودروها و مقادیر کمی در فاضلاب مزارع کشاورزی نیز وجود دارد.
این اسید ممکن است در محیط زیست بهعنوان محصول تجزیه دیاکسید نیتروژن حضور داشته باشد، که یک آلاینده رایج است که از فعالیتهای صنعتی و تجاری به جو وارد میشود. دیاکسید نیتروژن در محیط، همراه با آب، بهراحتی تبدیل به اسید نیتریک میشود. این اسید همچنین یکی از اجزای باران اسیدی است که میتواند به محیط زیست آسیب بزند.
اسید نیتریک همچنین در محیط از طریق واکنش نیتروژن و اکسیژن در طوفانهای رعد و برق تولید میشود. به دلیل خاصیت واکنشپذیری بالای آن، این ماده در عرض چند روز تجزیه میشود و در گیاهان و حیوانات انباشته نمیگردد. در ادامه معایب و مزایای این اسید را بررسی میکنیم.
مزایا
از مزایای اسید نیتریک میتوان به نقش آن در صنایع مختلف اشاره کرد. این ترکیب به دلیل خواص اکسیدکنندگی قوی در تولید کودهای شیمیایی، تصفیه و بازیافت فلزات گرانبها، آنالیزهای آزمایشگاهی و صنایع دارویی کاربرد دارد. همچنین، مزایای اسید نیتریک شامل استفاده در ساخت نیمهرساناها، تمیز کردن فلزات، شیشه و سیلیکون و تنظیم pH در تصفیه آب است. علاوه بر این، در تولید مواد منفجره و ترکیبات شیمیایی نظامی نیز از مزایای اسید نیتریک بهره گرفته میشود.
معایب
حضور اسید نیتریک در محیط همیشه به معنای مواجهه با آن نیست. برای اینکه این اسید اثرات منفی بر سلامت بگذارد، باید با آن تماس پیدا کرد. این تماس ممکن است از طریق استنشاق، خوردن، نوشیدن یا تماس با پوست صورت گیرد.

محلولهای قوی اسید نیتریک بسیار خورندهاند و میتوانند در هر قسمتی از بدن که با آن تماس پیدا کند، سوختگی ایجاد کنند. نوشیدن محلول اسید نیتریک باعث سوختگی در دهان، گلو و معده میشود و در برخی موارد ممکن است به مرگ منجر شود. استنشاق هوای حاوی سطوح بالای اسید نیتریک میتواند خشکی گلو و بینی، سرفه، تنگی نفس، مشکلات تنفسی و درد قفسه سینه به همراه داشته باشد. در مواردی، استنشاق مقادیر زیاد اسید نیتریک ممکن است باعث مرگ شود.
محلولهای رقیقتر اسید نیتریک ممکن است باعث تحریک پوست، چشمها و گلو شوند. استنشاق طولانی مدت هوای حاوی اسید نیتریک میتواند به ریهها آسیب برساند و مینای دندانها را فرسوده کند.
یادگیری شیمی دانشگاهی با فرادرس
برای درک اینکه اسید نیتریک چیست، باید با مفاهیمی چون تئوریهای اسید و باز برونستد – لوری و لوییس، ثابت تفکیک اسید و مکانیزمهای یونش آشنا شد. همچنین، آگاهی از اثر غلظت یونهای هیدروژن بر pH، مفهوم تعادل شیمیایی و محاسبات مربوط به فعالیت یونها برای درک دقیقتر رفتار اسیدی این ماده ضروری است. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده و کاربردی به توضیح این مباحث میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه شیمی دبیرستان دسترسی داشته باشید.
تاریخچه
در این مطلب از مجله فرادرس آموختیم اسید نیتریک چیست و چه کاربردهایی دارد. اسید نیتریک در قرون وسطی کشف شد و دستورالعملهای تهیه آن در متون علمی آن دوره ذکر شده است. این اسید با ترکیب نیترات و سایر مواد به دست میآمد و بهتدریج روشهای تولید آن پیشرفت کرد. در قرنهای بعد، دانشمندان ترکیب شیمیایی آن را بررسی کرده و نشان دادند که میتوان آن را با واکنشهای الکتریکی یا ترکیب گازهای موجود در هوا تولید کرد.
در اوایل قرن بیستم، روشهایی برای تولید صنعتی این اسید توسعه یافت. ابتدا از تخلیه الکتریکی در هوا استفاده میشد، اما به دلیل مصرف بالای انرژی، روش دیگری جایگزین شد که در آن از اکسیداسیون آمونیاک برای تولید اسید نیتریک استفاده میشود. این روش که کارایی بالایی دارد، همچنان در صنایع مختلف ازجمله تولید کودهای شیمیایی و ترکیبات صنعتی بهکار میرود.
source
