اسید سیتریک یک اسید آلی خوراکی با فرمول شیمیایی است. این ماده یک اسید ضعیف و جامدی سفیدرنگ است. سیتریک اسید به طور طبیعی در مرکبات و میوههای ترش وجود دارد. اسید سیتریک با نام «جوهر لیمو» نیز شناخته میشود. از این ماده به شکلی گسترده در صنایع غذایی و نگهداری استفاده میشود. در این مطلب از مجله فرادرس میآموزیم اسید سیتریک چیست، چه ویژگیهایی دارد و کاربردهای آن کدامند.

در ابتدای این مطلب میآموزیم اسید سیتریک چیست و فرمول شیمیایی آن چگونه است. سپس خواص فیزیکی و شیمیایی این ماده را بررسی کرده و منابع آن را توضیح میدهیم. سپس به بررسی واکنشهای شامل اسید سیتریک پرداخته و میآموزیم کاربرد اسید سیتریک چیست. در ادامه مطلب مزایا، معایب، خطرات و اقدامات ایمنی کار با اسید سیتریک را بررسی کرده و در نهایت مختصری از تاریخچه آن را توضیح میدهیم. با مطالعه این مطلب تا انتها میتوانید با این ماده مهم و ویژگیهای آن به شکلی کامل آشنا شوید.
اسید سیتریک چیست؟
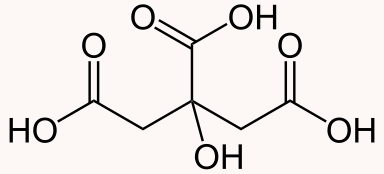
اسید سیتریک یک اسید ضعیف آلی با فرمول شیمیایی است. نام دیگر اسید سیتریک بر اساس قوانین آیوپاک، «۲- هیدروکسی پروپان ۱، ۲، ۳- تری کربوکسیلیک اسید» است. اسید سیتریک به طور طبیعی در میوههای ترش و مرکبات به خصوص لیمو ترش زرد و سبز وجود دارد. این ماده همچنین از یک نوع کپک خاص نیز تولید میشود و به عنوان افزودنی مواد غذایی، شویندهها و مکملهای غذایی استفاده میشود. اسید سیتریک به راحتی در آب حل میشود.
اسید سیتریک به دلیل خاصیت اسیدی ضعیف و مزه ترش، به شکل گستردهای به عنوان طعمدهنده و نگهدارنده به مواد غذایی اضافه میشود. این استفاده از اسید سیتریک به طور ویژه در نوشیدنیها و آبنباتها دیده میشود. همچنین، از این ماده در صنایع دارویی به عنوان پایدار کننده یا ضدعفونی کننده استفاده میشود. سیتریک اسید به فرم خشک (بدون آب) و مونو هیدرات (یک آبه) وجود دارد.
اسید سیتریک یکی از مواد مهم موجود در متابولیسم بدن است و به مقدار کم در تمامی گیاهان و جانوران حضور دارد. این ماده یک ماده واسطه در فرآیند متابولیسم است که به جذب انرژی از کربوهیدراتها، چربیها و پروتئینها کمک میکند. اسید سیتریک در موجودات زنده طی چرخهای به نام چرخه سیتریک اسید در متابولیسم تمامی ارگانیسمهای هوازی به عنوان ماده واسطه تولید میشود.
یادگیری شیمی دبیرستان با فرادرس
برای یادگیری بهتر ساختار اسید سیتریک و خواص آن نیاز است به شکلی کاملتر با مواد شیمیایی آشنا شویم. برای این کار باید با مفاهیمی مانند جدول تناوبی، خاصیت اسیدی و بازی، روشهای تشخیص اسید و ثابت تفکیک اسید آشنا شویم. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس دوره متوسطه، بخشهای شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازند.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه شیمی متوسطه دسترسی داشته باشید.
فرمول اسید سیتریک چیست؟
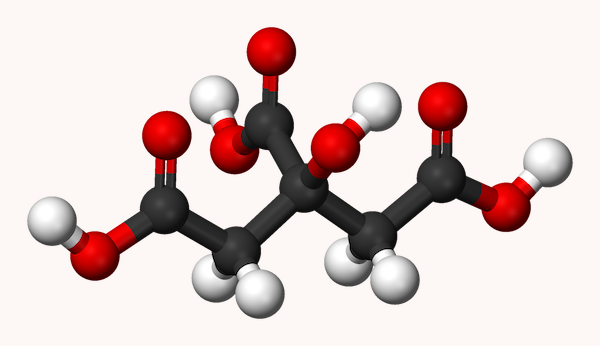
در قسمت قبل آموختیم اسید سیتریک چیست. فرمول شیمیایی اسید سیتریک به شکل است. در ساختار این اسید، شش اتم کربن، ۸ اتم هیدروژن و ۷ اتم اکسیژن وجود دارد. شکل این مولکول مانند تصویر زیر است.
خواص فیزیکی و شیمیایی اسید سیتریک
در قسمت قبل آموختیم فرمول شیمیایی اسید سیتریک چیست. اسید سیتریک نیز مانند سایر مواد شیمیایی، خواص فیزیکی و شیمیایی منحصر به فردی دارد. در ادامه، این خواص را بررسی میکنیم.
خواص فیزیکی اسید سیتریک
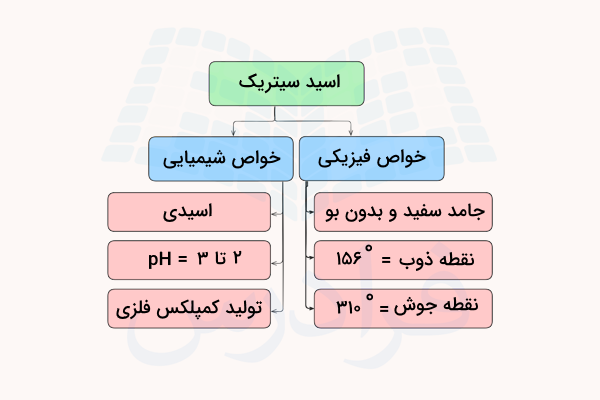
فرم مونوهیدرات و خشک این ماده، جامدی سفیدرنگ است. این ماده بدون بو است. نقطه ذوب سیتریک اسید ۱۵۶ درجه سانتیگراد و نقطه جوش آن ۳۱۰ درجه سانتیگراد است. چگالی فرم یک آبه اسید سیتریک ۱٫۵۴۲ گرم بر سانتیمتر مکعب و چگالی اسید سیتریک خشک، ۱٫۶۶۵ گرم بر سانتیمتر مکعب است.
اسید سیتریک در استون، الکل، اتر، اتیل استات، و دی متیل سولفوکسید حل میشود و در بنزن، کلروفرم، کربن دی سولفید و تولوئن حل نمیشود. اسید سیتریک ظاهری شبیه به نمک طعام دارد.
خواص شیمیایی اسید سیتریک
جرم مولی اسید سیتریک خشک ۱۹۲٫۱۲۳ گرم بر مول و جرم مولی اسید سیتریک یک آبه برابر با ۲۱۰٫۱۴ کرم بر مول است. اسید سیتریک مادهای آلی و متعلق به خانواده کربوکسیلیک اسید است. فرم خشک اسید سیتریک در آب گرم متبلور شده و فرم تک آبه آن در آب سرد متبلور میشود.
فرم آبدار اسید سیتریک را میتوان با حرارت دادن تا دمای ۷۸ درجه سانتیگراد به فرم خشک آن تبدیل کرد. در دمای ۱۷۵ درجه سانتیگراد، اسید سیتریک با از دست دادن کربن دی اکسید از ساختار خود، تجزیه میشود. محلولهای اسید سیتریک محلول بافر با pH بین ۲ و ۸ تولید میکنند. pH محلول آبلیمو حدود ۲ تا ۳ است.

یون سیترات موجود در ساختار اسید سیتریک میتواند با فلزات وارد واکنش شده و کمپلکسهای فلزی تولید کند. اسید سیتریک از خانواده کربوکسیلیک اسیدها است. این اسیدها دارای گروه عاملی کربوکسیل هستند. درواقع، تمامی این اسیدها از خواص مشابهی برخوردارند. پیشنهاد میکنیم برای آشنایی بیشتر با این مواد، فیلم آموزش «کربوکسیلیک اسید چیست» فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
منابع اسید سیتریک
اسید سیتریک در بسیاری از میوههای اسیدی و مرکبات به شکل طبیعی وجود دارد. همچنین، این ماده میتواند طی فرآیندهای شیمیایی و بیوشیمیایی از تخمیر یک قارچ به روش مصنوعی به دست آید. در ادامه توضیح میدهیم منابع طبیعی و مصنوعی اسید سیتریک چیست.
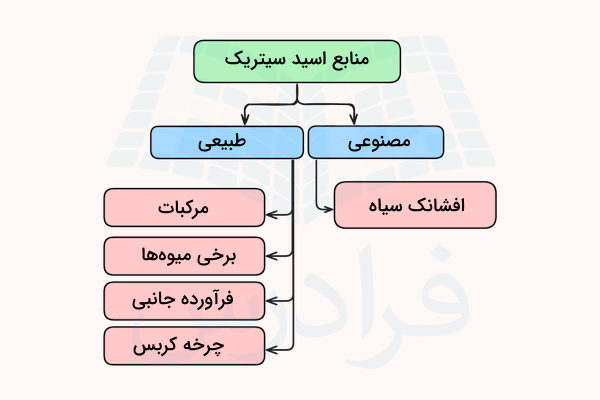
منابع طبیعی
مرکبات و آب مرکبات از بهترین منابع طبیعی اسید سیتریک هستند. در واقع واژه سیتریک از واژه لاتین (Citrus) به معنی مرکبات گرفته شده است. از مثالهای مرکبات حاوی اسید سیتریک میتوان به انواع لیموها، پرتقال، گریپفروت، نارنگی و دارابی اشاره کرد.

همچنین برخی دیگر از میوهها نیز دارای مقادیری سیتریک اسید اما کمتر از مرکبات هستند. از این میوهها میتوان به آناناس، توتفرنگی، تمشک، کرنبری، گیلاس، کلم بروکلی، هویج، برخی از فلفلها و گوجه اشاره کرد. مواد غذایی که از این میوهها تولید میشود، (برای مثال رب گوجه فرنگی) نیز دارای اسید سیتریک هستند. اسید سیتریک به عنوان یک فرآورده جانبی در تولید پنیر، شراب و خمیر ترش نان نیز تولید میشود.
اسید سیتریکی که به عنوان مواد تشکیل دهنده مواد خوراکی روی بسته بندی آنها درج میشود، تنها شامل اسید سیتریک افزوده شده به آنها است و شامل اسید سیتریک طبیعی موجود در آنها نیست. اسید سیتریک در ساختار تمامی موجودات و ارگانیسمهای هوازی نیز وجود دارد و به عنوان یک ماده واسطه در سری واکنشهایی به نام چرخه اسید سیتریک تولید میشود.
چرخه اسید سیتریک چیست؟
چرخه اسید سیتریک که با نام چرخه کربس یا چرخه تری کربوکسیلیک اسید نیز شناخته میشود، مجموعهای از واکنشهای بیوشیمیایی است که انرژی موجود در مواد مغذی را با استفاده از اکسیداسیون ماده «استیل- کوآ» (Acetyl-CoA) موجود در کربوهیدراتها، چربیها پروتئینها و الکلها آزاد میکند.
یون سیترات میتواند از میتوکندری خارج شده و به سیتوپلاسم وارد شود، سپس به اسیتل – کوآ تبدیل شده و برای تولید اسید چرب و اگزالواستات استفاده شود. به طور خلاصه، یون سیترات به درون سیتوپلاسم منتقل میشود، به استیل کوآ تبدیل میشود و سپس توسط استیل کوآ کربوکسیلاز به مالونیل کوآ تبدیل میشود. این ماده نیز به شکل آلوستریکی به سیترات تبدیل میشود.
تخمیر یکی از واکنشهای بیوشیمیایی مهم است که در تنفس گیاهان و جانوران و تولید بسیاری از محصولات شیمیایی نقش مهمی دارد. پیشنهاد میکنیم برای یادگیری بیشتر درباره این واکنشها، مطلب «تخمیر چیست» مجله فرادرس را مطالعه کنید.
منابع مصنوعی
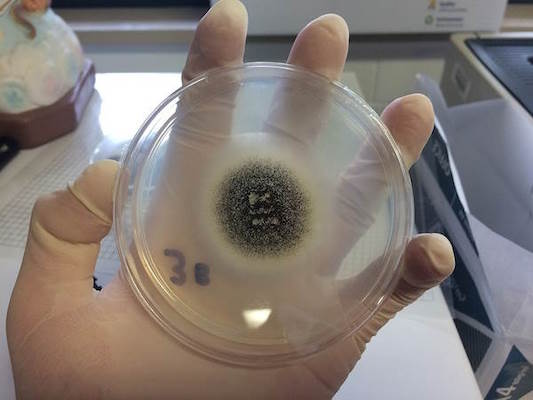
سالانه در جهان بیش از دو میلیون تن سیتریک اسید از روشهای غیر طبیعی تولید میشود. این روشها شامل تخمیر قندهای موادی مانند ملاس و نشاسته ذرت با استفاده از کپکی قارچی به نام «افشانک سیاه» (Aspergillus niger) است. این کپک، قندهای موجود در مواد را به سیتریک اسید تبدیل میکند. اسید سیتریک تولید شده به این روش سالم و قابل استفاده در صنایع غذایی، آرایشی و .. است.
واکنش های اسید سیتریک
در قسمتهای قبل آموختیم اسید سیتریک چیست و منابع آن کدامند. اسید سیتریک به عنوان یک ماده شیمیایی در واکنشهای زیادی شرکت میکند که در ادامه به مهمترین آنها اشاره میکنیم.
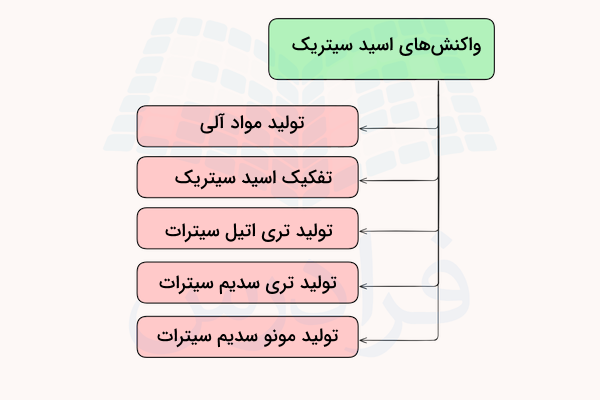
تولید مواد آلی
اسید سیتریک یک پیشماده برای تولید بسیاری از مواد آلی مختلف است. مسیرهای خشک کردن این ماده میتواند ماده ایتاکونیک اسید و انیدرید آن را تولید کند. با ایزومریزاسیون گرمایی ایتاکونیک اسید انیدرید، ستراکونیک اسید تولید میشود. فرآیند تولید ایتاکونیک اسید از اسید سیتریک آبدار با کمک اسید سولفوریک به روش زیر انجام میشود.
از فرآیند دیکربوکسیله کردن سیتریک اسید با اسید سولفوریک میتوان ماده آلی استون دی کربوکسیلیک اسید را تولید کرد.
واکنش تفکیک اسید سیتریک
اسید سیتریک یک اسید ضعیف آلی است که گروههای هیدروکسیل و کربوکسیل دارد. این گروههای عاملی در آب به شکل جزئی تفکیک میشوند. میزان قدرت اسید با کمیتی به نام ثابت تفکیک اسید اندازه گیری میشود که عبارت است از غلظت یونهای تفکیک شده بر غلظت تعادلی اسید به توان ضرایب استوکیومتری آنها. برای یک اسید ساده HA، ثابت تفکیک اسید به شکل زیر محاسبه میشود.
برای اسید سیتریک، سه مرحله تفکیک اتفاق میافتد که طی هر یک از آنها یک یون هیدروژن از اسید جدا میشود. مقادیر ثابت تفکیک اسید در هر مرحله برای اسید سیتریک مشخص شده است.
همانطور که مشاهده میکنید، میزان ثابت تفکیک اسید سیتریک طی واکنشهای تفکیک دوم و سوم کمتر میشود. این پدیده به بافری شدن محلول اسید سیتریک و تولید گستره pH بین ۲٫۱ و ۷٫۴ کمک میکند.
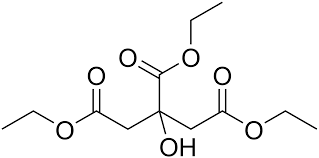
تولید تری اتیل سیترات
تری اتیل سیترات یک استر تولید شده از سیتریک اسید است. این ماده یک مایع است که به عنوان افزودنی مواد غذایی، محلول امولسیون کننده و حلال برای پایدار کردن فومها خصوصا فوم سفیده تخم مرغ استفاده میشود. این ماده در تولید روکشهای دارویی و پلاستیکها نیز استفاده میشود.
تولید تری سدیم سیترات
از واکنش اسید سیتریک و سدیم بی کربنات، ماده تری سدیم سیترات به دست میآید. معادله این واکنش به شکل زیر است.
تولید مونو سدیم سیترات
از واکنش اسید سیتریک و سدیم هیدروکسید، طی واکنش خنثی شدن، ماده مونو سدیم سیترات تولید میشود. معادله این واکنش به شکل زیر است.
کاربردهای اسید سیتریک
اسید سیتریک به دلیل خواصی که دارد به عنون یکی از مهمترین افزودنیها در بسیاری از صنایع شناخته میشود. حدود ۷۰ درصد اسید سیتریک تولید شده در صنایع غذا و نوشیدنی استفاده میشود. حدود ۲۰ درصد این ماده نیز در مواد دارویی و مکملها استفاده شده و باقی مانده تولیدات این ماده در شویندهها استفاده میشود.
در ادامه کاربردهای اسید سیتریک را در صنایع مختلف بررسی میکنیم.
صنایع غذایی
اسید سیتریک اسیدی ضعیف و خوراکی است. اسید سیتریک تولید شده یکی از رایجترین مواد افزودنی در صنایع غذایی به شمار میآید. این ماده به عنوان ماده افزودنی مواد غذایی، اسیدیته را زیاد میکند، طعم را بهبود میبخشد و از مواد تشکیل دهنده محافظت میکند. اسید سیتریک در موادی مانند نوشیدنیهای گازدار، آبمیوهها، نوشیدنیهای پودری، آبنباتها، مواد یخ زده و برخی از مکملهای غذایی به عنوان ماده افزودنی وجود دارد. مواد مکمل معدنی مانند منیزیم و کلسیم نیز ممکن است دارای اسید سیتریک با فرم یون سیترات باشند تا فرآیند جذب آنها بهبود یابد.

نمک سیترات بسیاری از فلزات برای رساندن ترکیبات معدنی داخل آنها به بدن، در بسیاری از مکملهای غذایی به فرم بیولوژیکی وجود دارند. اسید سیتریک در هر ۱۰۰ گرم دارای ۲۴۷ کیلوکالری انرژی است. اسید سیتریک میتواند به عنوان امولسیفایر به بستنی اضافه شود و از جدا شدن چربیهای آن جلوگیری کند. همچنین، اسید سیتریک به کارامل اضافه میشود تا از تبلور شکر در آن جلوگیری شود. همچنین، از این ماده میتوان به عنوان جایگزینی برای آبلیمو در دستورهای غذا استفاده کرد.
از ترکیب اسید سیتریک و سدیم بیکربنات در فرمولاسیون بسیاری از مواد خوراکی آزاد کننده گاز به شکل پودر و قرص استفاده میشود. هم چنین از این ترکیب برای تولید نمک حمام، کوکتل حمام و تمیز کننده گریس استفاده میشود. فرم پودر خشک اسید سیتریک با عنوان نمک ترش در فروشگاهها فروخته میشود و به عنوان جایگزینی برای سرکه و آبلیمو در غذاها استفاده میشود. از اسید سیتریک برای تنظیم pH رنگهای خوراکی بازی استفاده میشود.
ضدعفونی و شویندهها
سیتریک اسید به عنوان یک ضدعفونی کننده موثر در برابر بسیاری از باکتریها و ویروسها استفاده میشود. برخی از تحقیقات نشان داده است که اسید سیتریک میتواند یک نوروویروس انسانی را که باعث بیماری حاصل از غذا میشود را از بین برده یا ضعیف کند.
سیتریک اسید از نظر تجاری به عنوان یک ضدعفونی کننده عمومی و پاک کنندهای برای از بین بردن کف صابون، لکههای آب سخت، لکه آب لیمو و زنگ آهن استفاده میشود. این ماده از نظر ایمنی و سلامت به عنوان جایگزینی ایمنتر برای برخی از مواد پاک کننده مانند سفیدکنندههای حاوی کلر مانند وایتکس معرفی شده است.
اسید سیتریک یک عامل چنگالش (کلاته سازی) خوب در ترکیب کمپلکسهای فلز است. میتوان از این خاصیت اسید سیتریک برای جدا کردن گچ آب از دیگهای بخار استفاده کرد. همچنین، از این ماده میتوان در بهبود عملکرد صابونها و شویندهها برای تمیزکردن آلودگیها در آب سخت استفاده کرد.
یک محلول ۶ درصد حجمی اسید سیتریک میتواند لکههای شیشه را بدون نیاز به سابیدن، پاک کند. همچنین، استفاده از سیتریک اسید در شامپوها برای شستن موم و رنگ از موها استفاده میشود.
صنایع شیمیایی
به دلیل بالا بودن خاصیت چنگالش اسید سیتریک، از آن به عنوان یک شوینده مفید در جداسازی لانتانیدها به روش تبادل یون در یک پروژه مهم تولید سلاح اتمی در سال ۱۹۴۰ استفاده شد.
صنایع آرایشی و بهداشتی
سیتریک اسید به عنوان یک عامل اسیدی کننده به ژلها، کرمها و مایعات اضافه میشود. اسید سیتریک یک آلفا- هیدروکسیل اسید است که به عنوان یک ماده شیمیایی فعال در لایهبردارهای شیمیایی پوست استفاده میشود. همچنین از اسید سیتریک برای پوست در تولید دستمالهای پاک کننده صورت با خواص ضد ویروسی استفاده میشود.

سایر کاربردها
اسید سیتریک علاوه بر کاربردهای اشاره شده در قسمتهای قبل، کاربردهای دیگری در برخی از صنایع دارد. بیشتر این کاربردها به دلیل خواص این ماده مانند اسیدی بودن، خوراکی بودن، مزه ترش، بافر بودن محلول آن و خاصیت چنگالش آن هستند. در ادامه برخی از این کاربردها را توضیح میدهیم.
- به دلیل خاصیت بافری نمکهای سیترات، از این ماده در کنترل اسیدیته پاککنندههای خانگی و مواد دارویی استفاده میشود.
- از اسید سیتریک به عنوان بک جایگزین بدون بو برای سرکه سفید در رنگرزی پارچهها با رنگهای اسیدی استفاده میشود.
- سدیم سیترات یکی از مواد تشکیل دهنده واکنش دهنده بندیکت است که برای سنجش قندهای بدن مورد استفاده قرار میگیرد.
- از اسید سیتریک میتوان به عنوان جایگزینی برای نیتریک اسید در غیرفعال کردن فولاد ضد زنگ استفاده کرد.
- از این اسید به عنوان جایگزین اسید استیک در اتاق تاریک ظهور عکس به عنوان محلول حمام توقف برای توقف فرآیند ظهور عکس استفاده میشود.
- از سیترات بازی برای جلوگیری از تولید سنگ کلیه با استفاده از افزایش سطح سیترات ادرار استفاده میشود. این ماده برای جلوگیری از سنگهای کلسیمی و افزایش pH ادرار استفاده شده که از افزایش و تولید اوریک اسید و سنگهای کریستالی جلوگیری میکند.
مزایای اسید سیتریک
اسید سیتریک در متابولیسم بدن نقشی مهم دارد. همچنین تحقیقاتی نشانداده است که این ماده میتواند به جذب مواد معدنی کمک کند و از تولید سنگ کلیه جلوگیری کند. برای مثال، ماده کلسیم سیترات نیازی به حضور اسید معده برای جذب شدن ندارد. همچنین، از دیگر فرمهای مکمل کلسیم، عوارض جانبی کمتری دراد.
به همین شکل، منیزیم سیترات جذب بالاتری نسبت به سایر فرمهای مکمل منیزیم مانند منیزیم سولفید و منیزیم اکسید دارد. سیتریک اسید در فرم پتاسیم سیترات، از تولید سنگ کلیههای جدید جلوگیری میکند و به شکستن سنگهای ایجاد شده نیز کمک میکند.

قرص اسید سیتریک که معمولا به همراه سدیم سیترات عرضه میشود، میزان اسیدیته بدن را تنظیم میکند. این دارو، از ایجاد سنگ کلیه جلوگیری کرده و به شکستن سنگهای ایجاد شده کمک میکند. همچنین، به سلامت کلیه کمک کرده و میزان اسید اوریک بدن را کاهش میدهد.
خطرات و اقدامات ایمنی اسید سیتریک
اسید سیتریک تولیدی توسط سازمان جهانی غذا و دارو به عنوان مادهای بی خطر معرفی شده است. با وجود اینکه اسید سیتریک یک اسید ضعیف است، در معرض اسید سیتریک خالص بودن میتواند اثرات مخربی را به دنبال داشته باشد. از عوارض اسید سیتریک این است که تنفس اسید سیتریک غلیظ میتوان باعث سرفه، تنگی نفس و گلودرد شود.
ازدیاد در خوردن اسید سیتریک باعث دل درد و گلودرد میشود. تماس محلول غلیظ اسید سیتریک میتواند باعث قرمزی و درد پوست و چشم شود. از مضرات اسید سیتریک میتوان به از بین رفتن مینای دندان در اثر مصرف مداوم اسید سیتریک اشاره کرد.
یادگیری شیمی دانشگاهی با فرادرس
در این مطلب آموختیم اسید سیتریک چیست و چه ویژگیها و کاربردهایی دارد. برای درک بهتر خواص اسیدها و واکنشهای آنها باید با مفاهیمی چون پیوند شیمیایی، قاعده هشتتایی، پیوند یونی و پیوند فلزی و هیبریداسیون و اوربیتال مولکولی آشنا شوید. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه شیمی دانشگاهی دسترسی داشته باشید.
تاریخچه کشف اسید سیتریک
در این مطلب از مجله فرادرس آموختیم اسید سیتریک چیست. سیتریک اسید اولین بار توسط «کارل شیل» (Carl Wilhelm Scheele) در سال ۱۷۸۴ از آب لیمو جداسازی شد. آب لیمو حاوی ۴۷ گرم در لیتر اسید سیتریک است که میتوان آن را با استفاده از رسوب دهی کلسیم سیترات با اضافه کردن کلسیم هیدروکسید اسیدی شده با سولفوریک اسید جداسازی کرد.
حدود صد سال بعد، «کارل ومر» (Carl Friedrich Wilhelm Wehmer) کشف کرد که کپک پنی سیلین میتواند از شکر، اسید سیتریک تولید کند. این روش به یک روش صنعتی برای تولید اسید سیتریک تبدیل شد و تا سال ۱۹۱۷ ادامه پیدا کرد.
در این تاریخ، شیمیدان مواد غذایی، «جیمز کوری» (James Currie) کشف کرد که مقادیری از کپک افشانک سیاه میتواند غلظت بالایی از اسید سیتریک را در بستر قندی تولید کند. این کپک همان کپک سیاهی است که هنگام فاسد شدن موادی مانند زردآلو، پیاز و انگور روی آنها نقش میبندد. در جنگ جهانی اول و کاهش صادرات مرکبات، روش کوری برای تولید اسید سیتریک به یک روش صنعتی عظیم تبدیل شد.
source
