به نسبت تعداد ذرات یونی در فاز گاز یا محلول در آب به تعداد کل ذرات، درجه یونش () گفته میشود. درجه یونش تنها برای موادی که در آب یا حالت مذاب تفکیک میشوند و یون تشکیل میدهند، تعریف میشود. درجه یونش میتواند مقداری بین ۰ و ۱ داشته باشد. با دانستن میزان درجه یونش یک ماده میتوانیم به ثابت تفکیک آن و انرژی یونش دست یابیم. در این مطلب از مجله فرادرس، میآموزیم درجه یونش چیست و با این پارامتر مهم و محاسبه و کاربردهای آن آشنا میشویم.

در ابتدای این مطلب میآموزیم درجه یونش چیست. سپس به یادگیری مفهوم یونش و فرمول درجه یونش میپردازیم. در ادامه، قانون رقت استوالد و روشهای محاسبه درجه یونش را میآموزیم. سپس عوامل موثر بر درجه یونش و انرژی یونش را توضیح داده و نظریه آرنیوس را در تعریف درجه یونش بیان میکنیم. درنهایت، رابطه درجه یونش را با هدایت الکتریکی مواد بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با درجه یونش و مفاهیم مرتبط با آن آشنا شوید.
درجه یونش چیست؟
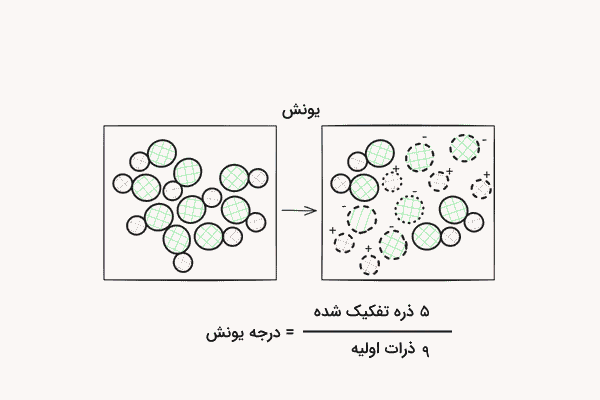
درجه یونش (به انگلیسی: Ionization Degree) که با نام درجه تفکیک نیز شناخته میشود، نسبت یونهای تولید شده به ماده خنثی در محلول است. تعداد مولکولها یا اتمهای یونیزه شده (تفکیک شده) نسبت به کل تعداد مولکولهای تفکیک نشده ماده اصلی، درجه یونش آن است. این پارامتر میتواند بدون واحد یا به شکل درصد بیان شود. در صورت بیان درجه یونش بر حسب درصد، به آن درصد یونش نیز گفته میشود.
موادی که دارای درجه یونش پایین هستند، به میزان کمی در آب تفکیک میشوند. موادی که درجه یونش بالایی دارند، به شکلی تقریبا کامل در آب تفکیک میشوند. به بیان دیگر توانایی یک اسید یا باز برای تولید یون در یک محلول، درجه یونش آن است. درجه یونش میتواند بر حسب کسر غلظت یونهای تفکیک شده به غلظت ماده اولیه نیز بیان شود. از آنجا که هر مولکول در تفکیک به دو یون تفکیک میشود، برای محاسبه درجه یونش باید دقت داشته باشیم که تنها غلظت یکی از یونهای تفکیک شده را بر غلظت اولیه ماده محاسبه کنیم.
اسیدهای قوی درجه یونشی بزرگتر از ٪۳۰ و اسیدهای ضعیف، درجه یونشی کمتر از ٪۳۰ دراند. باقی اسیدها و بازها بین این بازه، قدرتی میانگین دارند. اگر مادهای به شکل کامل تفکیک شده باشد یا اصلا تفکیک نشده باشد، معمولا درجه یونش برای آن محاسبه نمیشود.
یادگیری شیمی دوازدهم با فرادرس
در قسمت قبل آموختیم درجه یونش چیست. برای درک بهتر مفهوم درجه یونش و کاربردهای آن، ابتدا باید با مفاهیمی مانند اسید و باز، شناساگرها، یون، الکترون ظرفیت و … آشنا شویم. با شناخت این موارد میتوانیم به محاسبه pH محلولها و تشخیص اسیدی و بازی بودن مواد بپردازیم. پیشنهاد میکنیم برای یادگیری این مفاهیم به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم می پردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی دسترسی داشته باشید.
یونش چیست؟
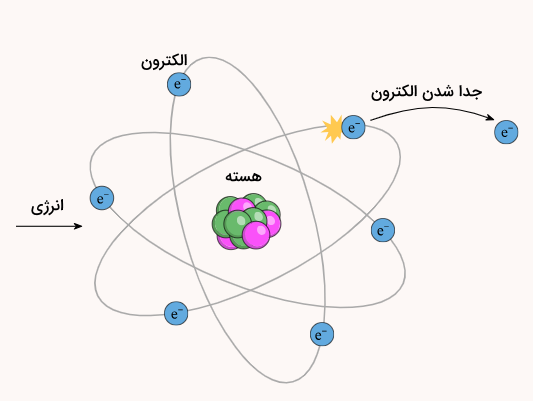
یونش فرآیندی است که طی آن ماده یک الکترون خود را از دست میدهد. یونش میتواند در مقیاس اتمی یا مولکولی رخ دهد. در یونش در مقیاس اتمی، اتم با دریافت انرژی (انرژی خارجی یا نیروهای بین اتمی و بین مولکولی) یک الکترون از آخرین لایه الکترونی خود را از دست میدهد.
یونش در مقیاس مولکولی بیشتر به واکنشهایی اطلاق میشود که طی آنها ماده تفکیک شده و به یک یون مثبت و منفی تقسیم میشود. موادی مانند اسیدها، بازها، برخی از نمکها و آب میتوانند دچار فرآیند یونش شوند.
یونش به یونیزه شدن مواد طی تفکیک در آب نیز گفته میشود. مواد در زمان انحلال در آب به دو دسته الکترولیت و غیرالکترولیت تقسیم میشوند. مواد غیرالکترولیت مواد قطبی هستند که در شکل محلول در آب یا مذاب، یون تشکیل نمیدهند. این مواد، موادی مانند گلوکز، بنزن و الکلها هستند و این مواد به یونهای سازندهشان تفکیک نشده و جریان الکتریسیته را از خود عبور نمیدهند.
مواد الکترولیت، مواد شیمیایی هستند که در صورت انحلال در آب یا ذوب شدن، یون تشکیل میدهند. این مواد که به یونهای سازندهشان تفکیک میشوند، موادی مانند اسید کلریدریک، سدیم کلرید و دیگر یونها هستند و جربان الکتریسیته را از خود عبور میدهند.
یک الکترولیت قوی، به شکلی کامل تفکیک شده و الکترولیت ضعیف مقدار کمی یونش مییابد. معادله واکنش تفکیک اسید و باز در محلول آبی به شکل زیر است.
یونش میتواند برای موادی مانند اسیدها، بازها، نمکها و برخی مواد دیگر مانند آب اتفاق بیافتد. در ادامه هر یک از این موارد را بررسی میکنیم.
یونش اسید
اسیدها میتوانند در آب دچار یونش شوند. اسیدها بر اساس میزان یونش و تفکیک آنها در آب، به دو دسته اسید ضعیف و اسید قوی تقسیم میشوند. معادله تفکیک اسیدها در آب به شکل زیر است.
در این واکنشها، ثابت تفکیک اسید ضعیف از روش زیر محاسبه میشود.
اسید قوی اسیدی است که به شکل کامل به یونهای سازندهاش تفکیک میشود. برای مثال، اسید کلریدریک در آب به شکلی کامل تفکیک شده و اسیدی قوی محسوب میشود. معادله تفکیک این اسید در آب به شکل زیر است.
به دلیل تفکیک کامل این مواد در آب، درجه یونش اسیدهای قوی تقریبا برابر با ۱ است. میزان ثابت تفکیک اسید برای اسیدهای قوی محاسبه نمیشود. زیرا غلظت اسید اولیه تقریبا برابر با صفر بوده و مخرج کسر محاسبه ثابت تفکیک صفر شده و میزان ثابت تفکیک به بینهایت میل خواهد کرد.
اسید ضعیف اسیدی است که در آب دچار تفکیک جزئی میشود. برای مثال، استیک اسید در آب به شکلی جزئی تفکیک میشود. معادله تفکیک این اسید در آب به شکل زیر است.
یونش باز
بازها میتوانند در آب دچار یونش شوند. بازها بر اساس میزان یونش و تفکیک آنها در آب، به دو دسته باز ضعیف و باز قوی تقسیم میشوند. معادله تفکیک بازها در آب به شکل زیر است.
در این واکنشها، ثابت تفکیک باز ضعیف از طریق زیر محاسبه میشود.
باز قوی بازی است که به شکلی کامل در محلول آبی به یون های سازندهاش تفکیک میشود. میزان ثابت تفکیک باز برای بازهای قوی محاسبه نمیشود. زیرا میزان غلظت باز پس از انجام واکنش تفکیک تقریبا به صفر میل میکند و مخرج کسر محاسبه ثابت تفکیک باز صفر شده و میزان آن به بی هایت میل خواهد کرد. برای مثال، سدیم هیدروکسید بازی قوی است که معادله تفکیک آن در آب به شکل زیر است.
به دلیلی کامل بودن تفکیک این مواد در آب، درجه یونش آنها تقریبا برابر با ۱ است. بازهای ضعیف بازهایی هستند که به شکلی جزئی در آب تفکیک میشوند. برای مثال، آمونیاک یک باز ضعیف است و معادله تفکیک آن در آب به شکل زیر نوشته میشود.
یونش نمک
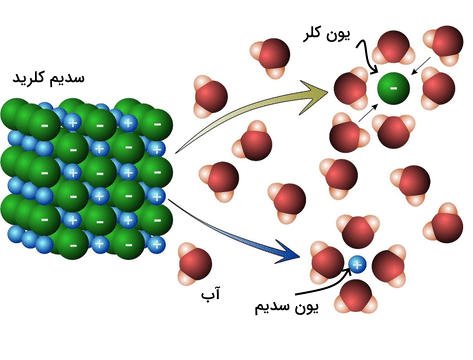
برخی از نمکها نیز میتوانند در آب یونیزه شوند. در این فرآیند، کاتیون و آنیون سازنده نمک توسط مولکولهای قطبی آب جدا شده و نمک در آب حل میشود. برای مثال میتوان به تفکیک سدیم کلرید در آب اشاره کرد.
نمکها بر اساس میزان تفکیکشان در آب به دو دسته الکترولیت ضعیف و الکترولیت قوی تقسیم میشوند. الکترلیتهای قوی بیشتر در آب تفکیک شده و میتوانند توسط حرکت یونهای سازندهشان جریان الکتریسیته را عبور دهند. سدیم کلرید یک الکترولیت قوی است.
الکترولیتهای ضعیف نمکهایی هستد که به شکلی کامل در آب تفکیک نمیشوند. این مواد بیشتر در آب به صورت تفکیک نشده باقی مانده و نمیتوانند به خوبی جریان الکتریسیته را از خود عبور دهند. برای مثال، آمونیوم استات یک الکترولیت ضعیف است و واکنش تفکیک آن در آب به شکل زیر است.
برای درک بهتر اینکه یونهای تولید شده طی فرآیند یونش با چه فرآیندی جدا میشوند، باید با مفهوم پیوند شیمیایی و انواع آن آشنا باشید. پیشنهاد میکنیم برای درک بهتر این پیوندها و انواع آن، فیلم آموزش پیوندهای شیمیایی در شیمی عمومی فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
خودیونش آب
آب یک حلال آمفیپروتیک است. بدین معنی که میتواند همزمان به شکل اسید و باز عمل کند. بدین ترتیب، مولکول آب میتواند به خود یک یون هیدروژن داده و دچار خودیونش شود. معادله واکنش خود یونش آب به شکل زیر است.
ثابت تعادل برای واکنش بالا به شکل زیر نوشته میشود.
با توجه با ثابت بودن غلظت آب، و اندازهگیریهای انجام شده، مقدار ثابت تعادل بالا برابر با خواهد بود. از این معادله در محاسبه pH و اسیدیته محلولهای مختلف استفاده میشود.
معادله یونش
معادله یونش معادله واکنشی است که طی آن یک ماده به یونهای سازندهاش تفکیک میشود. این واکنشها به شکل تعادلی نوشته میشوند. معادله یونش اسید، باز و ترکیب یونی به شکل زیر نوشته میشوند.
- برای اسیدها، فرآورده واکنش اسید، یون هیدروژن و باز مزدوج آن خواهد بود.
- برای بازها، فرآورده واکنش یونش یون هیدروکسید و اسید مزدوج آن خواهد بود.
- برای نمکها، فرآورده واکنش، آنیون و کاتیون سازنده ترکیب یونی خواهند بود.
باید دقت داشته باشیم که اسیدها و بازهای قوی به شکلی کامل در آب تفکیک میشوند و اسیدها و بازهای ضعیف به شکلی جزئی تفکیک میشوند. این بدین معنی است که پس از انحلال اسید و باز قوی، ماده اولیهای باقی نمیماند و معادله به صورت یک طرفه نوشته میشود. این درحالی است که اسیدها و بازهای ضعیف پس از تفکیک به صورت جزئی، در آب به صورت دست نخوره باقی خواهند ماند. پس واکنش یونش اسیدها وبازهای ضعیف به صورت تعادلی نوشته می شود.
معادله واکنش یونش برخی از اسیدها، بازها و نمکها در ادامه نوشته شده است.
| ماده | واکنش یونش |
| اسید سولفوریک | |
| اسید اگزالیک | |
| اسید فسفریک | |
| اسید بنزوییک | |
| اسید استیک | |
| سدیم هیدروکسید | |
| آمونیاک | |
| کلسیم کلرید | |
| سدیم کلرید |
ثابت یونش
ثابت یونش، میزان ثابت تعادلی است که از واکنش تفکیکی یک اسید ضعیف، باز ضعیف یا نمک در آب به دست میآید. ثابت تفکیک اسید، باز یا نمک، میزان غلظت مواد تفکیک شده را در محلول محاسبه میکند. هنگامی که یک اسید ضعیف در آب حل میشود، اسید ضعیف به شکل زیر در آب تفکیک میشود.
میزان ثابت تفکیک اسید معادله واکنش بالا، به شکل زیر محاسبه میشود.
برای یک باز ضعیف نیز، معادله تفکیک به شکل زیر خواهد بود.
میزان ثابت تفکیک باز نیز از معادله واکنش زیر به دست میآید.
پیشنهاد میکنیم برای درک بهتر ثابت یونش و درک اینکه تفاوت آن با درجه یونش چیست، مطلب «فرق ثابت تعادل و ثابت یونش» مجله فرادرس را مطالعه کنید.
تفاوت ثابت یونش و درجه یونش چیست؟
در قسمت قبل آموختیم که درجه یونش به نسبت تعداد مولکولهای تفکیک شده و یونیزه شده به تعداد کل مولکولها گفته میشود. این پارامتر در مورد اسیدها، بازها و نمکها بررسی میشود. در واقع، درجه یونش نشاندهنده این است که در صورت تهیه محلول از یک ماده، تا چه مقدار یونیزه میشود.
درحالی که ثابت یونش میزان کمی مولکولهای یونیزه شده را مشخص میکند. این پارامتر با عنوان ثابت تفکیک اسید برای اسیدهای ضعیف و ثابت تفکیک باز برای بازهای ضعیف استفاده میشود. درواقع، ثابت یونش همان ثابت تعادل برای واکنشهای یونش است که با استفاده از غلظت یونهای تولید شده و غلظت تعادلی ماده محاسبه میشود.
فرمول درجه یونش چیست؟
در قسمت قبل آموختیم مفهوم درجه یونش چیست. برای محاسبه درجه یونش کافی است طبق تعریف آن عمل کرده و نسبت تعداد یونهای تولید شده از یک ماده را به تعداد کل مولکولهای آن حساب کنیم.
تعداد کل مولکولهای ماده ÷ تعداد یونهای تولید شده = درجه یونش ()
همچنین، درجه یونش را میتوان با استفاده از ثابت تفکیک اسید یا باز و غلظت اسید یا باز نیز محاسبه کرد. فرمول محاسبه درجه یونش به این طریق، به شکل زیر است.
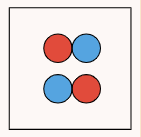
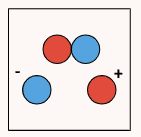
در این فرمول ، درجه یونش، ثابت تفکیک اسید یا باز و C غلظت اسید یا باز در آغاز واکنش تفکیک است. برای درک بهتر اینکه درجه یونش چیست، به جدول زیر دقت کنید.
| نوع محلول |
 |
 |
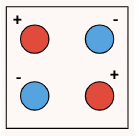 |
| تعداد مولکول تفکیک شده | ۰ | ۱ | ۲ |
| تعداد مولکول تفکیک نشده | ۲ | ۱ | ۰ |
| تعداد کل مولکولها در ابتدا | ۲ | ۲ | ۲ |
| درجه یونش | ۰ = ۲ ÷ ۰ | ۰٫۵ = ۲ ÷ ۱ | ۱ = ۲ ÷ ۲ |
درجه یونش همواره مقداری بین ۰ و ۱ دارد. در محاسبه درجه یونش همواره باید دقت داشت تعداد ذرات جداگانه شمارش نشوند و تنها تعداد ذرات تفکیک شده شمارش شوند. درواقع، تعداد ذرات تشکیل شده حاصل از فرآیند تفکیک و یونش نباید در این محاسبه شمارش شوند و تنها تعداد ذراتی که دچار تفکیک شدهاند شمارش میشوند. (در مثال بالا به جای شمارش ۴ ذره حاصل از تفکیک در ستون آخر، دو مولکولی که تفکیک شدهاند شمرده شدند.)
قانون رقت استوالد
قانون رقت استوالد بیان میکند که میزان ثابت تفکیک مواد با مربع درجه یونش در غلظت آنها ارتباطی مستقیم دارد. فرمول رقت استوالد به شکل زیر است.
برای درک بهتر این فرمول، معادله تفکیک یک اسید ضعیف در آب را در نظر بگیرید.
اگر معادله واکنش با ۱ مول از اسید آغاز شود، میزان مول از یون و مول از یون تولید میشود. میدانیم که اسید ضعیف به شکلی جزئی در آب تفکیک میشود. این واکنش مقداری یون و یون تولید کرده و مقداری از اسید به شکل تفکیک نشده در محلول باقی میماند. میزان غلظت هریک از این موارد به میزان قدرت اسید بستگی دارد. نسبت یونهای تولید شده به میزان اسید تفکیک نشده برابر با درجه یونش خواهد بود.
اگر میزان غلظت هریک از این موارد را در جدولی تنظیم کنیم، خواهیم داشت:
| ماده | اسید | یون | يون |
| غلظت اولیه | ۱ | ۰ | ۰ |
| تغییر غلظت | |||
| غلظت نهایی |
حال اگر میزان ثابت تفکیک اسید را برای این موارد محاسبه کنیم، خواهیم داشت:
در غلظت یک مولار از اسید ضعیف، رابطه درجه یونش و ثابت تفکیک اسید به شکل زیر خواهد بود:
برای بسیاری از اسیدهای ضعیف، میزان درجه یونش نزدیک به صفر است. این پدیده به ما کمک میکند تا معادله بالا را با تقریب تقریبا درستی تغییر دهیم. اگر میزان درجه یونش نزدیک به صفر باشد، عبارت تقریبا برابر با ۱ خواهد بود. در نتیجه خواهیم داشت:
حل مثال و تمرین از نحوه محاسبه درجه یونش
در قسمت قبل آموختیم میزان درجه یونش مواد میتواند با استفاده از ثابت تفکیک مواد و غلظت آنها به دست آید. پس با داشتن میزان ثابت تفکیک و غلظت آنها میتوانیم درجه یونش آنها را محاسبه کنیم. فرمولهای محاسبه درجه یونش به شکل زیر هستند.
تعداد کل مولکولهای ماده ÷ تعداد یونهای تولید شده = درجه یونش ()
برای درک مراحل محاسبه درجه یونش، به مثالهای زیر توجه کنید.
مثال ۱
میزان درجه یونش و pH محلول ۰٫۰۵ مولار باز ضعیفی را محاسبه کنید که ثابت تفکیک آن برابر است.
پاسخ
با توجه به فرمول قسمت قبل خواهیم داشت:
برای محسابه pH این محلول باید میزان غلظت یون هیدروژن را با استفاده از غلظت یون هیدروکسید و ثابت تفکیک آب محاسبه کنیم. از آنجا که غلظت اولیه محلول ۰٫۰۵ مولار بوده است و میزان درجه یونش آن را نیز محسابه کردهایم، میتوانیم غلظت تعادلی یون هیدروکسید را محاسبه کنیم.
حال با استفاده از ثابت تفکیک آب ()، میزان غلظت هیدروژن را به دست آورده و از آن لگاریتم میگیریم تا pH به دست آید.
برای درک بهتر این محاسبات، به مثال بعدی توجه کنید.
مثال ۲
محلولی با غلظت ۰٫۲ مولار از استیک اسید تهیه شده است. اگر میزان ثابت تفکیک این اسید در دمای اتاق برابر با باشد، میزان درصد یونش و pH محلول آن را محاسبه کنید.
پاسخ
برای پاسخ به این پرسش، ابتدا معادله تفکیک اسید ضعیف استیک اسید را مینویسیم.
با توجه به فرمول محاسبه درجه یونش خواهیم داشت:
پس درجه یونش برابر با ٪ ۰٫۹۵ خواهد بود. حال برای محاسبه pH محلول، باید ابتدا میزان غلظت یون هیدروژن حاصل از تفکیک را محاسبه کنیم. با توجه به اینکه غلظت اولیه محلول ۰٫۲ مولار بوده است و درجه یونش را نیز محاسبه کردهایم، غلظت تعادلی یون هیدروژن با استفاده از روش زیر به دست میآید.
حال با استفاده از فرمول محاسبه pH به شکل زیر، میزان اسیدیته محلول را مشخص میکنیم.
مثال ۳
یک محلول از اسید هیدروفلوئوریک با فرمول شیمیایی HF تولید شده است. این محلول شامل ۲۰۰ مولکول هیدروفلوئوریک اسید است که ۴۰ مولکول آن تفکیک شدهاند. مقدار درجه یونش و درصد یونش را برای این محلول محاسبه کنید.
پاسخ
برای حل این مثال، از فرمول کلی محاسبه درجه یونش بهره میبریم.
تعداد کل مولکولهای ماده ÷ تعداد یونهای تولید شده = درجه یونش ()
از آنجا که تعداد مولکولهای تفکیک شده به ما داده شده است، کافی است مقدار آن را بر تعداد کل مولکولها تقسیم کنیم.
برای محاسبه درصد یونش کافی است درجه یونش را در عدد ۱۰۰ ضرب کنیم.
$$alpha times 100 = 0.2 times 100 =20 text{%} $$

برای درک بهتر روش محاسبه درجه یونش، به تمرینهای زیر پاسخ دهید.
تمرین ۱
یک محلول ۰٫۱ مولار از ماده آمونیوم هیدروکسید تهیه شده است. غلظت یونهای آمونیوم و هیدروکسید موجود در این محلول ۰٫۰۰۲ مولار است. میزان درجه یونش و درصد یونش را برای این محلول محاسبه کنید.
۰٫۰۰۰۴ و ٪ ۰٫۰۰۴
۰٫۰۰۰۲ و ٪ ۰٫۰۰۲
برای محاسبه درجه یونش این محلول کافی است غلظت یونهای تفکیک شده را بر غلظت اولیه ماده تقسیم کنیم.
برای محاسبه درصد یونش این محلول کافی است درجه یونش آن را در عدد ۱۰۰ ضرب کنیم.
$$alpha times 100 = 0.02 times 100 =2 text{%} $$
تمرین ۲
یک اسید ضعیف با فرمول شیمیایی HA و با ثابت تفکیک اسید تفکیک شده است. غلظت اولیه اسید برابر با ۰٫۰۱ مولار است. درجه یونش این اسید چقدر است؟
در توضیح این قانون گفتیم درجه یونش اسیدهای ضعیف بسیار کم است و میتوان از آن در مخرج فرمول محاسبه ثابت تفکیک صرف نظر کرد. درجه یونش فرمول به طریق زیر به دست میآید.
تمرین ۳
یک محلول از سدیم کلرید به شکلی کامل در آب تفکیک شده است. میزان درجه یونش را برای آن محاسبه کنید.
از آنجا که صورت سوال بیان کرده ترکیب سدیم کلرید به شکلی کامل یونیزه شده است، نتیجه میگیریم که تمامی مولکولهای سدیم کلرید تفکیک شده و به یونهای سدیم و کلر تبدیل شدهاند. بنابراین، درجه تفکیک این ترکیب برابر با عدد ۱ و درصد تفکیک آن برابر با ٪۱۰۰ میباشد.
تمرین ۴
یک باز ضعیف، ثابت یونشی برابر با دارد. اگر میزان درجه یونش این باز برابر یا ۰٫۰۵ باشد، غلظت محلول این باز را محاسبه کنید.
با توجه با قانون رقت استوالد و ضعیف بودن باز خواهیم داشت:
از آنجا که درجه یونش و ثابت تفکیک باز را داریم، مقادیر را در معادله بالا جایگذاری کرده و مقدار غلظت را به دست میآوریم.
عوامل موثر بر درجه یونش
در قسمت قبل آموختیم فرمول محاسبه درجه یونش چیست. با توجه به این فرمول، درجه یونش میتواند به عوامل مختلفی وابسته باشد. این عوامل مواردی مانند خواص حلال، خواص حلشونده، دما، اثر یون مشترک و غلظت محلول هستند.
در ادامه اثر هر یک از این عوامل توضیح داده شده است.
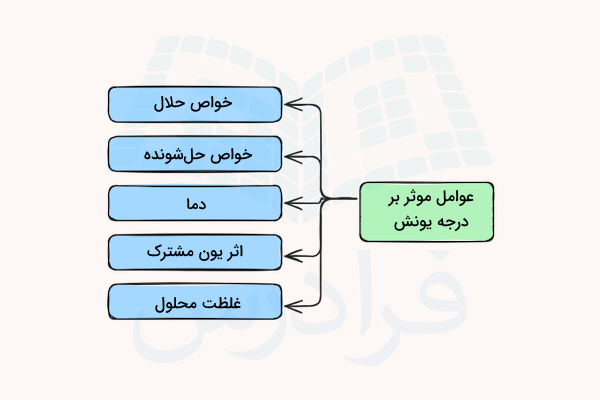
خواص حلال
میزان اثر حلال روی درجه یونش حل شونده به ثابت دی الکتریک آن وابسته است. حلالهای قطبی مانند آب و آمونیاک، یونها را جدا کرده و به عنوان حلالهای یونیزه کننده قوی شناخته میشوند. حلالهای غیر قطبی مانند کربن دی سولفید و بنزن، تمایل کمی به تفکیک یونها دارند. هرچه میزان ثابت دی الکتریک حلال بالاتر باشد، درجه یونش ماده بیشتر خواهد بود.
خواص حل شونده
اسیدهای قوی، بازهای قوی و نمکها، درجه یونش بالایی دارند زیرا به شدت در محلول یونیزه میشوند. برای مثال، اسیدهای قوی مانند اسید کلریدریک و اسید نیتریک و بازهای قوی مانند سدیم هیدروکسید و پتاسیم هیدروکسید و نمکهای قوی مانند سدیم کلرید و پتاسیم کلرید درجه یونش بالایی دارند.
این در حالی است که اسید و بازهای ضعیف به سختی در آب تفکیک می شوند و بیتشر به صورت تفکیک نشده در محلول باقی میمانند. میزان درجه یونش برای اسیدها و بازهای قوی حدود ۱ و برای اسیدها و بازهای ضعیف کمتر از یک و نزدیک به صفر است.
دما
درجه یونش با افزایش دما افزایش می یابد. با کاهش دما، درجه یونش کاهش مییابد. این پدیده به این علت است که تفکیک واکنشی گرماگیر است و با افزایش دما، طبق اصل لوشاتلیه، واکنش در جهت رفت پیش رفته و میزان تفکیک و درجه یونش افزایش مییابد.
اثر یون مشترک
اثر یون مشترک اثری است که طی آن مقدار کمی از یک الکترولیت قوی شامل یون موجود در محلول به محلول اضافه میشود. این پدیده باعث میشود میزان درجه یونش الکترولیت ضعیف کم شود زیرا یون اضافه شده فرآیند یونش الکترولیت را محدود میکند.
غلظت محلول
درجه یونش به شکل معکوس با غلظت محلول و وزن آن در ارتباط است. میزان درجه یونش با افزایش غلظت ماده کاهش مییابد و بالعکس. در واقع میزان درجه یونش با رقت محلول ارتباط مستقیمی دارد و هرچه میزان رقیق بودن محلول افزایش یابد، تفکیک بیشتر شده و درجه یونش افزایش مییابد.
این پدیده به این علت است که با افزایش رقت محلول، یونها از هم فاصله گرفته و میزان نیروهای جاذبه و دافعه بین آنها کاهش مییابد و قابل صرف نظر است و یونش میتواند به شکلی کاملتر صورت بگیرد.
انرژی یونش چیست؟
میزان انرژی مورد نیاز برای جداسازی یک الکترون از یک اتم در حالت گازی و تولید یون از آن، انرژی یونش گفته میشود. به میزان انرژی مورد نیاز برای جداسازی یک مول الکترون از یک مول اتم گازی ایزوله یا یون نیز انرژی یونش اولیه (Ei) گفته میشود.
انرزی یونش میتواند تصوری از این باشد که جداسازی الکترون از اتم چقدر دشوار است یا اینکه قدرت الکترون متصل به یون یا اتم چقدر است. هرچه میزان انرژی یونش بیشتر باشد، جداسازی الکترون از ماده سختتر خواهد بود. به همین علت، انرژی یونش یکی از پارامترهای سنجش واکنش پذیری در نظر گرفته میشود و هرچه میزان انرژی یونش بالاتر باشد، واکنش پذیری ماده کمتر خواهد بود.
انرژی یونش اول، دوم و پس از آن
انرژی یونش اولیه میزان انرژی است که باید برای جدا شدن آخرین الکترون لایه ظرفیت اتم مصرف شود. انرژی مورد نیاز برای جدا کردن الکترون بعدی از اتم انرژی یونش دوم است و این فرآیند به همین ترتیب ادامه مییابد. انرژی یونش اولیه برای جدا کردن دورترین الکترون اتم کمتر از انرژیهای یونش بعدی است زیرا اثر جاذبه پروتون هسته بر روی الکترونهای باقی مانده بیشتر میشود.
نظریه آرنیوس و درجه یونش
در قسمتهای قبل آموختیم تعریف درجه یونش چیست. برای محسابه درجه یونش یک ماده، باید معادله تفکیک آن را در آب یا به حالت مذاب بنویسیم. بنابر نظریه آرنیوس، اسید مادهای است که با انحلال در یک حلال آبی، یون هیدروژن تولید میکند. از طرف دیگر، باز مادهای است که در صورت انحلال در یک حلال آبی، یون هیدروکسید تولید میکند.
نظریه آرنیوس در توضیح یونش اسید و باز بسیار مهم است. این بدین دلیل است که یونش معمولا در حلال آبی اتفاق میافتد. درجه یونش به اسیدی و بازی بودن مواد بستگی دارد. برخی از مواد اسیدی مانند پرکلریک اسید و هیدروکلریک اسید، به شکلی کامل در محلولهای آبی به یونهای سازندهشان تفکیک میشوند. به این مواد، اسید قوی گفته میشود. برای بازهای نیز به همین شکل است و درجه یونش اسید و باز به درجه تفکیک آنها به یونهای سازندهشان بستگی دارد.
یادگیری شیمی دانشگاهی با فرادرس
در این مطلب آموختیم درجه یونش چیست و چگونه محاسبه میشود. نیاز است برای درک بهتر اینکه درجه یونش چیست، ابتدا با مفاهیمی مانند الکترونخواهی، بار موثر هسته، روند تناوبی خواص مواد در جدول تناوبی و … آشنا شویم. همچنین، با شناخت این موارد میتوانیم مفاهیم پیچیدهتری مانند اوربیتالهای هیبدریدی و نظریه پیوند ظرفیت را درک کنیم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی عمومی دسترسی داشته باشید.
رابطه درجه یونش و هدایت الکتریکی
در این مطلب از مجله فرادرس آموختیم درجه یونش چیست و چگونه محاسبه میشود. هرچه میزان درجه یونش یک ماده بیشتر باشد، بدین معنی است که تعداد یونهای بیشتری از آن ماده در محلول وجود خواهد داشت. یونها میتوانند به هدایت جریان الکتریسیته کمک کنند و بدین ترتیب هدایت الکتریکی محلول را افزایش دهند. برای مثال، تصور کنید پنج اسید مجهول با میزان درجه یونشهای زیر داریم و میخواهیم مشخص کنیم میزان هدایت الکتریکی کدام محلول بیشتر است.
| اسید | درجه یونش |
| HU | ٪ ۲٫۸ |
| HW | ٪ ۵٫۹ |
| HX | ٪ ۱۱٫۲ |
| HY | ٪ ۶٫۷ |
| HZ | ٪ ۷٫۹ |
اگر غلظت تمامی این اسیدها باهم برابر باشد، اسیدی که بیشترین درجه یونش را دارد، هدایت الکتریکی بیشتری در آب خواهد داشت. پس هدایت الکتریکی محلول اسید HX از باقی موارد بیشتر خواهد بود.
source
