کمپلکس در شیمی مولکولی است که در آن یک اتم فلزی در مرکز مولکول قرار دارد و این اتم به چند لیگاند متصل شده است. لیگاند میتواند اتم، یون یا مولکولی باشد که به فلز مرکزی الکترون میدهد. به ترکیبات کمپلکس در شیمی ترکیبات کوئوردیناسیون گفته میشود. کمپلکسها خواصی ویژه دارند و معمولا رنگهایی خاص دارند. در این مطلب از مجله فرادرس توضیح میدهیم کمپلکس چیست و چه ویژگیهایی دارد.

در ابتدای این مطلب میآموزیم کمپلکس چیست و چگونه تشکیل میشود. سپس به توضیح مفاهیمی چون عدد کوئوردیناسیون و لیگاند میپردازیم و فرآیند تشکیل، خواص و روش نامگذاری کمپلکسها را بررسی میکنیم. در ادامه، میآموزیم ثابت پایداری کمپلکس چیست و شیمی کوئوردیناسیون به چه مفاهیمی میپردازد. در نهایت، تاریخچه و کاربرد ترکیبات کمپلکس را بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل با این ترکیبات آشنا شوید.
کمپلکس چیست؟
کمپلکس مولکولی است که از اتصال لیگاند به اتم فلز مرکزی تشکیل شده است. یک ترکیب کمپلکس یک اتم فلز در مرکز دارد و اطراف آن تعدادی اتم یا یون قرار دارد که لیگاند نام دارند. این لیگاندها با پیوندهایی به نام پیوند داتیو (پیوند کوئوردیناسی) به هم متصل شدهاند.
در برخی از موارد، پیوند تشکیل شده پیچیدهتر از تنها یک پیوند معمولی است. مولکولها یا یونهایی که اتم فلز مرکزی را احاطه میکنند میتوانند موادی پیچیده حاوی موادی مانند آب، آمونیاک یا یونهای کلرید باشند.
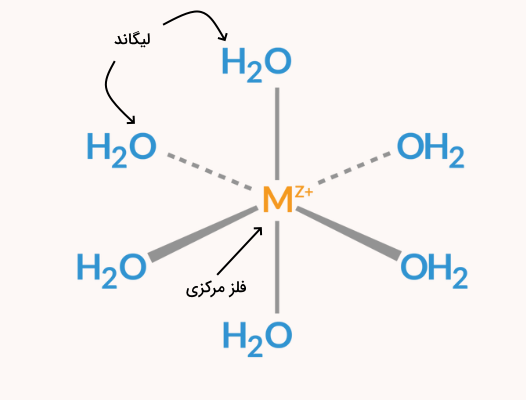
تمامی لیگاندها دارای جفت الکترون غیر پیوندی هستند و این الکترونها را به فلزات میدهند و ترکیبات کوئوردیناسی تشکیل میدهند. به بیانی دیگر، تمامی لیگاندها مانند باز لوییس عمل میکنند.
ساختار کمپلکس
برای اینکه بدانیم کمپلکس چیست، باید ویژگیهای آن را بررسی کنیم. این ویژگیها مواردی مانند انحلالپذیری، رنگ، طیف جذبی، خواص مغناطیسی و … است. خواص شیمیایی ترکیبات کمپلکس با خواص شیمیایی اتمهای تک متفاوت است. با تشکیل ترکیبات کمپلکس، ویژگیهای اتمهای فلزی تغییر میکند.
پیوندهای فلز – لیگاند معمولا از نوع برهمکنشهای اسید و باز لوییس هستند. اتمهای فلزی به عنوان پذیرنده جفت الکترون رفتار میکنند و لیگاندها به عنوان دهنده جفت الکترون رفتار میکنند. میزان قدرت پیوند بین لیگاند و فلز قویتر از نیروهای بین مولکولی است زیرا پیوندهای بین این مواد جهت دارد. اما این پیوندها از پیوندهای یونی و پیوند کووالانسی ضعیفتر هستند.
مثال کمپلکس
در قسمت قبل آموختیم کمپلکس چیست. حال روش تشکیل چند کمپلکس رایج را میآموزیم.
مثال ۱
اگر یک کمپلکس میان یون آهن (II) و شش لیگاند یون سیانید () تشکیل شود، کمپلکس بار ۴- خواهد داشت و فرمول شیمیایی آن به شکل نوشته میشود. نام این ترکیب، یون کمپلکس هگزا سیانوفرات (II) است.
مثال ۲
اگر یک کمپلکس میان یون نقره و دو لیگاند آمین () تشکیل شود، کمپلکس بار ۱+ خواهد داشت و فرمول شیمیایی آن به شکل نوشته میشود. نام این ترکیب یون کمپلکس دی آمین نقره (I) است.
مثال ۳
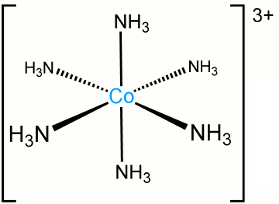
اگر یک کمپلکس میان یون کبالت (III) و شش لیگاند آمین تشکیل شود، کمپلکس بار ۳+ خواهد داشت و شکل کمپلکس آن به شکل زیر خواهد بود. نام این ترکیب، یون هگزا آمین کبالت (III) است.
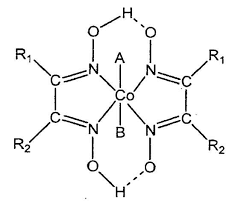
از دیگر کمپلکسهای رایج میتوان به کلروفیل، هموگلوبین، ویتامین ب، رنگها، رنگدانهها و کاتالیستها اشاره کرد. در ادامه، ساختار کمپلکس مولکول شیمیایی ویتامین ب – ۱۲ را مشاهده میکنید.
یادگیری شیمی معدنی با فردرس
در قسمت قبل آموختیم کمپلکس چیست. برای درک بهتر کمپلکسها و خواص آنها باید با مواردی مانند انواع لیگاند، ساختار و شکل ترکیبات کمپلکس و خواص ترکیبات کوئوردیناسیون آشنا شویم. پیشنهاد میکنیم برای درک بهتر و آشنایی با این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است میتوانید به آموزشهای بیشتری در زمینه ترکیبات کمپلکس دسترسی داشته باشد.
عدد کوئوردیناسیون
برای اینکه بهتر درک کنیم کمپلکس چیست باید به بررسی مفهومی به نام عدد کوئوردیناسیون بپردازیم. عدد کوئوردیناسیون تعداد لیگاندهایی است که به اتم مرکزی متصل هستند. اعداد کوئوردیناسیون معمولا مقادیری بین ۲ تا ۹ دارند. تعداد لیگاندهای متصل به فلز بیشتر نیز در برخی از ترکیبات دیده شده است. تعداد لیگاندهای متصل به اتم فلز مرکزی به عواملی مانند اندازه، بار و آرایش الکترونی یون فلزی بستگی دارد. بیشتر یونهای فلزی بیشتر از یک عدد کوئوردیناسیون دارند.
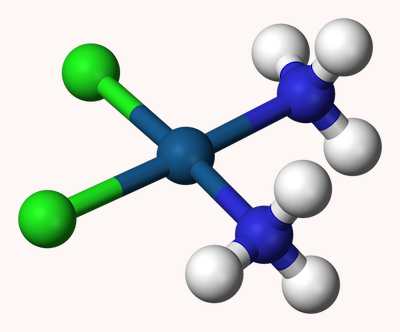
برای مثال، شکل زیر نشاندهنده کمپلکس سیس پلاتین با فرمول شیمیایی است. عدد کوئوردیناسیون پلاتین در این ترکیب ۴ است زیرا چهار لیگاند به آن متصل است.
لیگاند چیست؟
در قسمت قبل آموخیتم کمپلکس چیست. یونها یا مولکولهایی که اتم فلز مرکزی را احاطه میکنند با نام لیگاند شناخته میشوند. لیگاندها معمولا به یون فلز با پیوندهای کوئوردیناسی کووالانسی متصل میشوند. به این صورت که این لیگاندها الکترونهایی را به صورت جفت الکترون غیر پیوندی به اوربیتالهای خالی فلز مرکزی اهدا میکنند. به همین علت گفته میشود که لیگاندها به یون فلز مرکزی کوئوردینه شدهاند.
لیگاندهای دندانه دار
لیگاندها بر اساس تعداد جفت الکترونهای غیر پیوندی که بر روی کل مولکول لیگاند قرار دارد، به دو دسته تک دندانه و چند دندانه تقسیم میشوند.
- لیگاندهای تک دندانه لیگاندهایی هستند که تنها یک جفت الکترون برای اتصال به اتم مرکزی دارند. انواع لیگاندهای تک دندانه مواردی مانند هالیدها، فسفینها، آمونیاک و آمینها هستند.
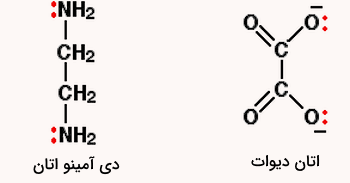
- لیگاندهای چند دندانه لیگاندهایی هستند که بیش از یک جفت الکترون غیر پیوندی برای اتصال به مرکز فلزی دارند. برای مثال، اتیلن دی آمین، اتان دیوات و دی آمینو اتان از این نوع هستند. ساختار این مولکولها را در شکل زیر مشاهده میکنید.
این ترکیبات میتوانند از هر دو سر مولکول به اتم مرکزی وصل شوند. برای مثال، ساختار کمپلکس تریس اتیلن دی آمین نیکل (II) به شکل زیر خواهد بود.
لیگاندهای رایج
لیگاندهای تک دندانه یک جفت الکترون را به اتم فلز مرکزی اهدا میکنند. یکی از مثالهای این نوع لیگاندها، هالوژنها (فلوئور، کلر، برم و ید) هستند. لیگاندهای چند دندانه که با نامهای کلاته، عامل کلاته یا عامل چنگالش نیز شناخته میشوند، بیش از یک جفت الکترون به اتم فلز مرکزی میدهند.
این ترکیبات، کمپلکسهایی با پیوندهای قویتر از لیگاندهای یک دندانه تشکیل میدهند. یکی از عوامل کلاته، ترکیب اتیلن دی آمین است که شامل دو ترکیب آمین با جفت الکترون پیوندی است و میتواند از دو سمت به اتم فلز مرکزی متصل شود. یکی از مثالهای لیگاند سه دندانه، بیس – دی اتیلن تری آمین است که سه جفت الکترون دارد و میتواند این سه جفت الکترون را در اختیار اتم فلز مرکزی قرار دهد.
برای مثال به جدول زیر دقت کنید. در این جدول، ترکیب یا یون کمپلکس به همراه عدد کوئوردیناسی و حالت اکسایش اتم مرکزی مشخص شده است.
| ترکیب یون کمپلکس | عدد کوئوردیناسیون | حالت اکسایش اتم فلزی مرکزی |
| ۶ | +۲ | |
| ۵ | +۱ | |
| ۴ | +۲ | |
| ۶ | +۲ |
یونهای کمپلکس میتوانند ترکیبات زیادی را با اتصال به یونهای کمپلکس دیگر تشکیل دهند. این پدیده باعث میشود ترکیبات کوئوردیناسی زیادی پدید آیند. برخی از ترکیبات کمپلکس میتوانند ایزومر داشته باشند و این ایزومرها میتوانند برهمکنشهای متفاوتی با سایر مواد داشته باشد. اتصال بین لیگاند و فلز در ترکیبات فلزی، ترکیبات تتراهدارل و ترکیبات اکتاهدارل مطالعه میشود. بسیاری از مواد دارویی و بیولوژیکی از به وجود آمدن ترکیبات کمپلکس و ایزومرهای آنها تولید شدهاند.
فرآیند تشکیل کمپلکسها
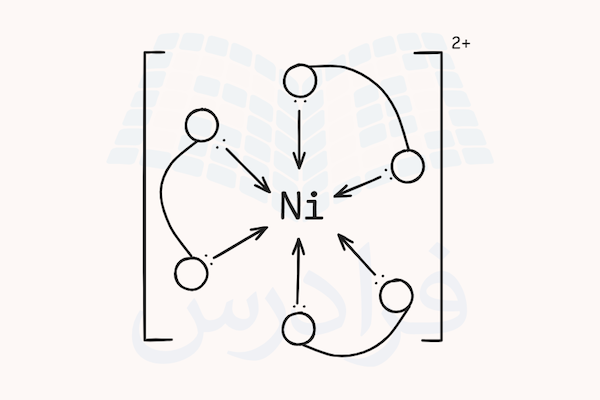
در قسمت قبل آموختیم کمپلکس چیست و از چه اجزایی تشکیل شده است. در این قسمت میآموزیم لیگاندها چگونه به اتمهای فلز مرکزی متصل میشوند و کمپلکسها را تشکیل میدهند. لیگاندها ترکیباتی هستند که جفت الکترونهایی غیر پیوندی برای ارائه به اتم فلز مرکزی دارند. اتمهای فلزی مرکزی نیز اوربیتالهایی خالی برای پذیرفتن این الکترونها دارند.
برای مثال، تصویر کنید میخواهیم کمپلکسی بین اتم آلومینیوم و مولکولهای آب به عنوان لیگاند تشکیل دهیم. ابتدا آرایش الکترونی اتم آلومینیوم را بررسی میکنیم. آرایش الکترونی این ترکیب به شکل زیر است.
اگر این اتم ۳ الکترون از دست داده و یون آلومینیوم ۳ بار مثبت تشکیل دهد، اوربیتالهای s و p لایه ظرفیت این اتم خالی خواهد شد. همچنین، اوربیتال d این اتم نیز ممکن است برای هیبریداسیون در دسترس باشد. یون آلومینیوم با ترکیب اوربیتال های s و p و با انجام هیبریداسیون میتواند با ۶ مولکول آب پیوند کوئوردیناسی برقرار کرده و ساختار کمپلکس هشت گوشه تولید کند.
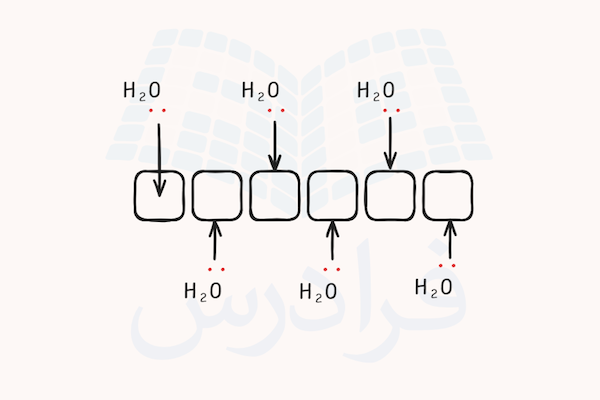
شش عدد بیشترین تعداد مولکول آبی است که میتواند اطراف یون آلومینیوم قرار بگیرد. با تشکیل بیشترین تعداد ممکن پیوند کوئوردیناسی، این یون پایدار شده و به شکل ترکیب کمپلکس با آنیون مناسب به پایداری کامل میرسد. شکل یون کمپلکس این ماده در تصویر زیر مشخص شده است.
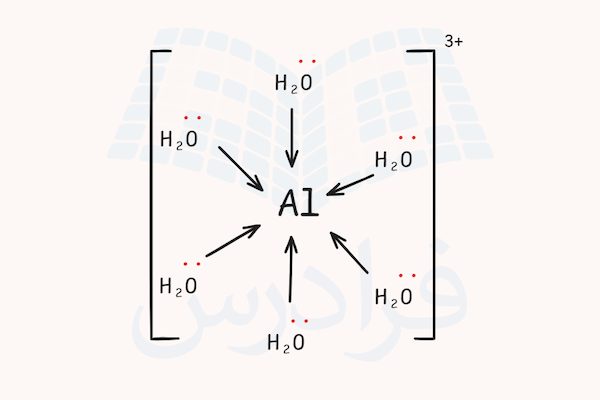
به دلیل اینکه الکترونها به سمت مرکز یون میروند، بار ۳+ دیگر به شکل اختصاصی روی اتم آلومینیوم قرار ندارد و در سرتاسر یون کمپلکس پخش میشود. به دلیل اینکه آلومینیوم در این ترکیب با ۶ اتم دیگر پیوند برقرار میکند، عدد کوئوردیناسیون آن برابر ۶ است.
خواص کمپلکسها
تا اینجا آموختیم کمپلکس چیست و از چه اجزای تشکیل شده است. ترکیبات کمپلکس ترکیباتی هستند که در آنها لیگاندهایی با جفت الکترونهای غیر پیوندی، به مرکز فلزی با اوربیتالهای خالی متصل میشوند. ساختار و خواص ترکیبات کمپکلس را میتوان از چند جنبه برسی کرد. مهمترین خواصی که در مورد این ترکیبات باید بررسی شوند خواصی مانند شکل هندسی این ترکیبات، خواص الکتریکی آنها ایزومری آنها، رنگ، خواص مغناطیسی و واکنش پذیری است. در ادامه هر یک از این موارد را بررسی میکنیم.
برای درک بهتر خواص کمپلکسها نیاز است تا بیشتر با پیوندهای شیمیایی در ترکیبات کوئوردیناسیون آشنا شوید. با یادگیری مواردی مانند نظریه پیوند والانس بهتر میتوانید به خواص و ساختار کمپلکس آشنا شوید. پیشنهاد میکنیم برای یادگیری این موارد فیلم آموزش تشکیل پیوند در ترکیبات کوئوردیناسیون را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
ساختار شیمیایی
یونها یا مولکولهایی که اتم مرکزی را احاطه میکنند با نام لیگاند شناخته میشوند. لیگاندها به دو دسته X و L تقسیم میشوند. این دسته بندی بر اساس تعداد الکترونهای موجود برای پیوند بین لیگاند و اتم مرکزی است.
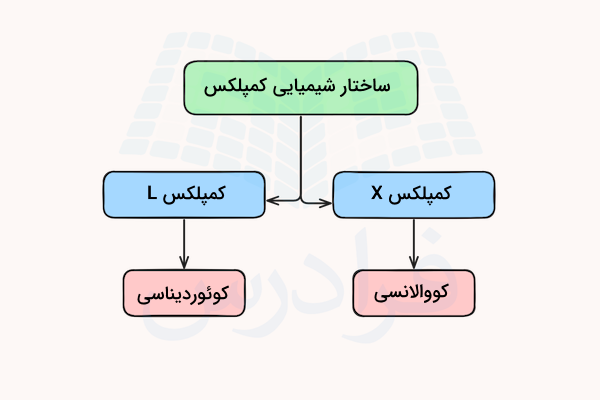
- لیگاندهای L دو الکترون از یک جفت الکترون غیر پیوندی را در اختیار اتم مرکزی قرار میدهند و پیوند کووالانسی کوئوردیناسی تشکیل میدهند.
- لیگاندهای X یک الکترون تنها را با یک الکترون از اتم مرکزی به اشتراک میگذارند و یک پیوند کووالانسی معمولی تشکیل میدهند.
ساختار هندسی
یکی از مهمترین روشهای درک این که کمپلکس چیست، رسم ساختار هندسی آن است. ساختار هندسی مولکول شیمیایی ترکیبات کمپلکس با تمرکز بر عدد کوئوردیناسیون تعیین میشود. تعداد لیگاندهای متصل به فلز یا به شکلی دقیقتر، تعداد پیوندهای سیگمای بین لیگاندها و اتم مرکزی همان عدد کوئوردیناسیون است.
در برخی از موارد شمارش پیوندهای بین اتم مرکزی و لیگاندها راحت است اما در برخی دیگر از موارد ممکن است کمی نامعلوم و گیج کننده باشد. عدد کوئوردیناسیون معمولا مقداری بین ۲ و ۹ دارد اما میتواند مقادیر بیشتری نیز داشته باشد. عدد کوئوردیناسیون به اندازه، بار و ساختار آرایش الکترونی یون فلزی وابسته است. بسیاری از فلزات بیش از یک عدد کوئوردیناسیون دارند.
معمولا شیمی ترکیبات کمپلکس با بررسی برهمکنشهای بین اوربیتالهای مولکولی s و p بین لیگاندها و اوربیتالهای d یا f اتم فلز مرکزی بررسی میشود. اوربیتالهای s، p و d فلز میتوانند ۱۸ الکترون را در خود بپذیرند. بیشترین تعداد لیگاندهای ممکن برای یک اتم فلزی به ساختار آرایش الکترونی آن بستگی دارد و اینکه چند اوربیتال d یا f خالی را میتواند در اختیار جفت الکترون غیر پیوندی لیگاند قرار دهد.
همچنین، مقدار عدد کوئوردیناسیون به اندازه لیگاند و یون فلزی نیز وابسته است. فلزاتی با اندازه بزرگ و لیگاندهای کوچک باعث به وجود آمدن کمپلکسهایی با عدد کوئوردیناسیون بالا میشوند. برای مثال، کمپلکس از این نوع است. فلزات کوچک با لیگاندهای بزرگ باعث به وجود آمدن عدد کوئوردیناسیون کوچکتر میشوند. برای مثال ترکیب از این نوع است. لانتانیدها و اکتنیدها و فلزات واسطه با عدد اتمی کمتر، اعداد کوئوردیناسیون بیشتری دارند.
شکل کمپلکسها
ساختارهای مختلف اتصال لیگاندها باعث میشود کمپلکسها اعداد کوئوردیناسیون متفاوتی داشته باشند. بیشتر ساختارها الگوی نقطه روی کره را دنبال میکنند. به شکلی که اتم مرکزی در وسط یک چندگوشه قرار گرفته است و گوشههای این چندگوشه مکان قرارگیری لیگاندها هستند. هنگامیکه اوربیتالهای لیگاند و اوربیتاهای اتم فلز مرکزی همپوشانی میکنند، اثر دافعه لیگاند – لیگاند باعث میشوند کمپلکس شکل هندسی مشخصی را به خود بگیرد. ساختارهای هندسی رایج در جدول زیر مشخص شدهاند.
| عدد کوئوردیناسیون | ساختار هندسی |
| ۲ | خطی |
| ۳ | تریگونال مسطح (سه وجهی منتظم مسطح) |
| ۴ | تتراهدرال (هرمی) یا چهارگوشه مسطح |
| ۵ | دوهرمی سه وجهی با هرمی مربعی |
| ۶ | اکتاهدارل (اورتوگونال، هشت وجهی) یا منشور مثلثی |
| ۷ | پنج وجهی دو هرمی |
| ۸ | ضدمنشور مربعی |
| ۹ | منشور سه ضلعی سه سر پوشیده (سه کلاهکی) |
ممکن است مواردی نیز وجود داشته باشد که شکل مولکول کمپکلس از این ساختارهای معمول فاصله بگیرد. برای مثال، لیگاندها اگر از انواع مختلفی باشند، باعث میشود طول پیوندهای بین لیگاندها و اتم فلز مرکزی متفاوت باشد. برخی از استثناها و نکات برای تشخیص شکل کمپلکس به شرح زیر هستند.
- برای کمپلکسهایی با اعداد کوئوردیناسیون ۵، ۶، ۷، ۸ یا ۹ ساختار کمپکلس ترکیبی از چند مدل چندوجهی است و تفاوت کمی بین گوشههای لیگاند – فلز – لیگاند وجود دارد. یکی از این مثالهای این ساختارها، ساختار هرم مربعی و دوهرمی سهگوشهای هستند.
- به دلیل اثرهای الکترونیکی ، برخی از ساختارهای ممکن برای یک کمپلکس نسبت به سایر ساختارها پایدارتر هستند. برای مثال، ساختار منشوری سه ضلعی برای برخی از مواد پایدارتر از هشتوجهی است.
- در ادامه، ساختارهای ذکر شده را بررسی میکنیم تا بهتر درک کنیم شکل هریک از این ساختارها برای کمپلکس چیست.
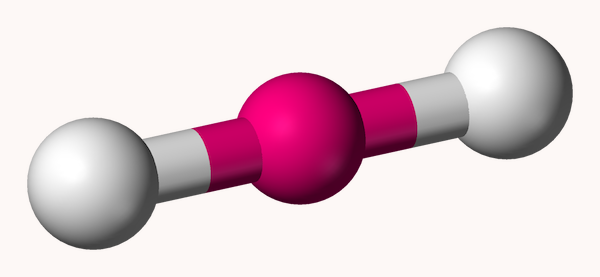
ساختار خطی
منظور از ساختار خطی، ساختاری است که در آن اتم مرکزی به دو اتم دیگر متصل شده است و زاویه بین این پیوندها ۱۸۰ درجه است. این ساختار هندسی برای مولکولهایی شکل می گیرد که در آنها، اتم مرکزی به دو اتم دیگر متصل باشد و جفت الکترونهای غیر پیوندی نداشته باشد. شکل این ساختار هندسی به شکل زیر است.
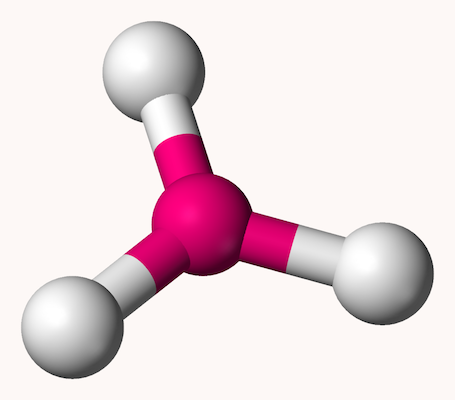
سه گوشه منتظم مسطح
ساختار سه وجهی منتظم مسطح (سه گوشه مسطح) ساختاری است که در آن اتم مرکزی با سه اتم دیگر پیوند برقرار کرده است. هر سه پیوند برقرار شده در این ساختار در یک صفحه هستند. زاویه بین پیوندها ۱۲۰ درجه است و اتم مرکزی الکترون غیر پیوندی ندارد. شکل این ساختار به شکل زیر است.
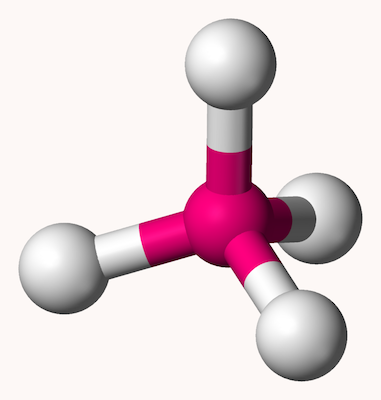
چهاروجهی
ساختار هندسی چهاروجهی ساختاری است که در آن اتم مرکزی در مرکز یک هرم قرار دارد و ۴ اتم در ۴ گوشه این هرم قرار دارند. زاویه بین پیوندها در این ساختار در صورت یکسان بودن پیوندها ۱۰۹٫۵ درجه است. شکل این ساختار به شکل زیر است.
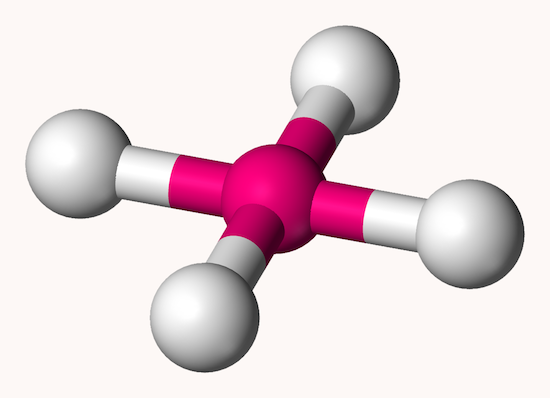
چهارگوشه مسطح
ساختار چهارگوشه مسطح یا چهاروجهی مسطح ساختاری است که در ان یک اتم مرکزی در مرکز یک مربع یا مستطیل قرار گرفته و اتمهای دیگر در چهارگوشه چهاروجهی هستند. تمامی پیوندهای این ساختار در یک صفحه هستند و در صورت یکسان بودن پیوندها، زاویه بین آنها ۹۰ درجه است. شکل این ساختار به صورت زیر است.
دوهرمی سه وجهی
ساختار دوهرمی سه وجهی (مثلثی) ساختاری است که اتم مرکزی در مرکز یک صفحه در مرکز مثلثی قرار گرفته و سه اتم سه گوشه این مثلث را تشکیل میدهند. دو اتم دیگر عمود بر این صفحه قرار گرفتهاند و دو سر هرمهای مثلثی بالا و پایین را تشکیل میدهند . این ساختار برای اتمهایی با ۵ پیوند شکل میگیرد. زاویه بین پیوندها در این ساختار ۹۰ و ۱۲۰ درجه است. شکل این ساختار در ادامه آورده شده است.
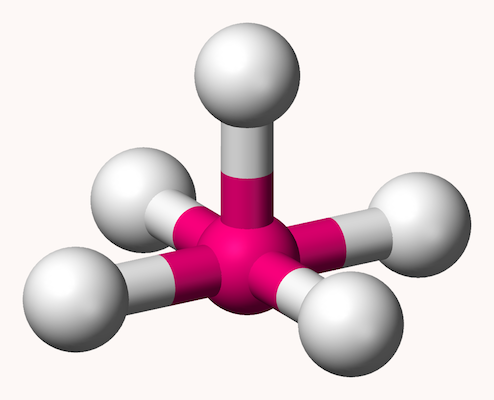
هرم مربعی
هرم مربعی ساختاری برای مولکولهایی با ۵ گروه متصل به اتم مرکزی است. در این ساختار، ۴ اتم در یک صفحه یک مربع را اطراف اتم مرکزی تشکیل میدهند و گروه پنجم راس هرم را تشکیل میدهد. این ساختار در تصویر زیر مشخص شده است.
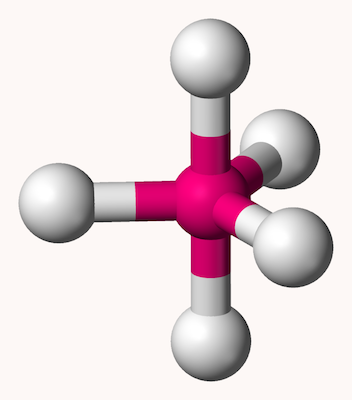
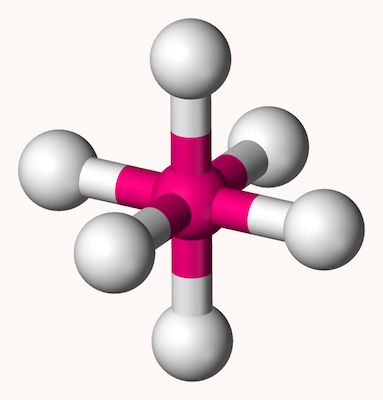
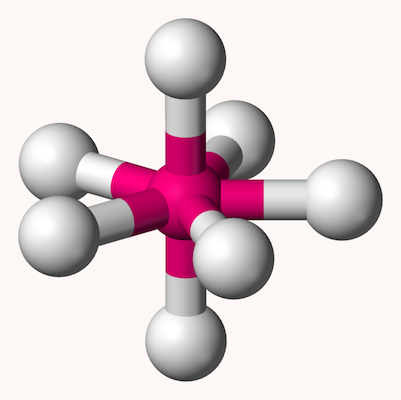
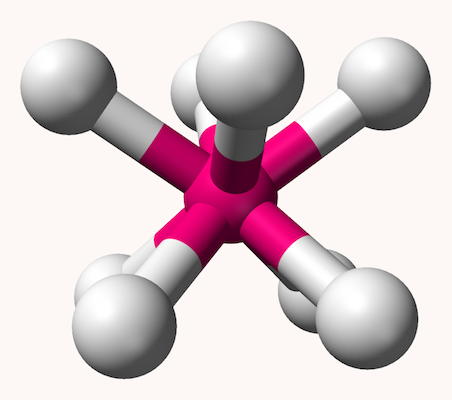
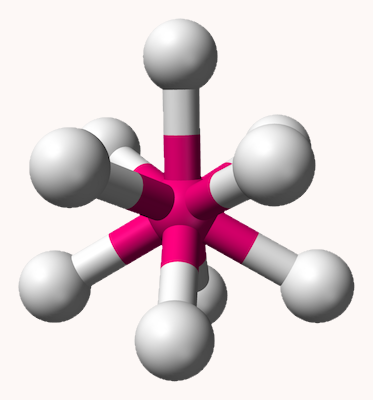
اکتاهدرال
ساختار مولکولی هشت وجهی یا اوکتاهدرال یا ۸ گوشه که با نام دوهرمی مربعی نیز شناخته میشود، شکل ترکیباتی با ۶ اتم لیگاند در اطراف یک اتم مرکزی را بیان میکند. در این ساختار، ۴ اتم اطراف اتم مرکزی یک مربع را تشکیل میدهند و دو اتم دیگر به شکلی عمود دو سر هرم بالا و پایین را تشکیل میدهند و زاویه تمامی پیوندها در این ساختار ۹۰ درجه است. شکل این ساختار مانند شکل زیر است.
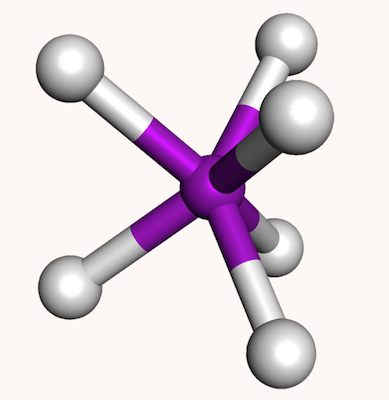
منشور مثلثی
منشور مثلثی ساختاری برای مولکولهایی است که در آنها ۶ اتم اطراف اتم مرکزی قرار گرفتهاند. جایگیری این گروهها یا اتمها به شکلی است که دو مثلث در بالا و پایین صفحه اتم مرکزی تشکیل میدهند. شکل این ساختار در تصویر زیر مشخص شده است.
پنج وجهی دوهرمی
در این ساختار، هفت لیگاند اطراف یک اتم مرکزی قرار دارند. پنج اتم اطراف اتم مرکزی در یک صفحه یک پنج ضلعی را تشکیل میدهند و دو اتم دیگر به شکلی عمود، راس هرمهای بالا و پایین را تشکیل میدهند. در این ساختار، زاویه بین پیوندها ۹۰ و ۷۲ درجه است. شکل این ساختار در ادامه درج شده است.
ضدمنشور مربعی
این ساختار مربوط به مولکولهایی است که در آن ۸ اتم، گروه اتمی یا لیگاند اطراف یک اتم مرکزی قرار گرفتهاند. در این ساختار هر ۴ اتم متصل به اتم مرکزی میتوانند در یک صفحه قرار بگیرند و دو هرم متصل از یک راس را تشکیل دهند. این ساختار در شکل زیر نشان داده شده است.
منشور سه ضلعی سه سر پوشیده
این ساختار برای مولکولهایی با ۹ اتم در اطراف یک اتم مرکزی شکل میگیرد. در این ساختار سه هرم مثلثی توسط مولکولهای متصل شکل میگیرد که یک اتم عمود بر وجه مثلثی هرم قرار میگیرد. شکل این ساختار در تصویر زیر نمایش داده شده است.
ایزومری
تا اینجا آموختیم روش رسم ساختار کمپلکس چیست. ساختار و قرارگیری لیگاندها در هر ترکیب کمپلکس ثابت است اما در برخی از موارد و با انجام واکنشهایی میتوان از آنها ایزومرهای پایدار ساخت. بسیاری از انواع ایزومری در ترکیبات کمپلکس وجود دارد. در ادامه برخی از این موارد مانند ایزومری هندسی، ایزومری نوری و ایزومری ساختاری را بررسی میکنیم .
ایزومری فضایی
ایزومری فضایی زمانی اتفاق میافتد که یک پیوند در جهتهای متفاوتی در فضا قرار بگیرد. ایزومری فضایی میتواند در دو دسته ایزومری هندسی و ایزومری نوری بررسی شود.
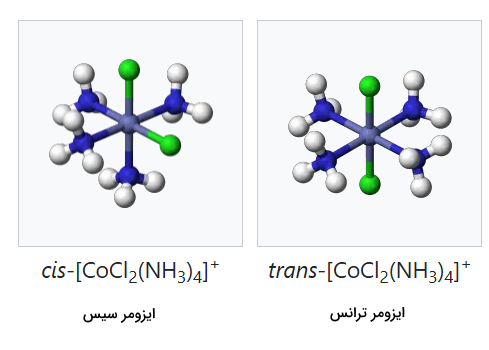
ایزومری هندسی
ایزومری هندسی در کمپلکسهای هشتوجهی و مربعی مسطح اتفاق میافتد. هنگامی که دو لیگاند در مکانهای مخالف یکدیگر قرار دارند با نام ترانس (Trans) شناخته میشوند و اگر در مجاورت یکدیگر قرار بگیرند با نام سیس (Cis) شناخته میشوند. برای مثال، به حالتهای مختلف ایزومری کمپلکس توجه کنید.
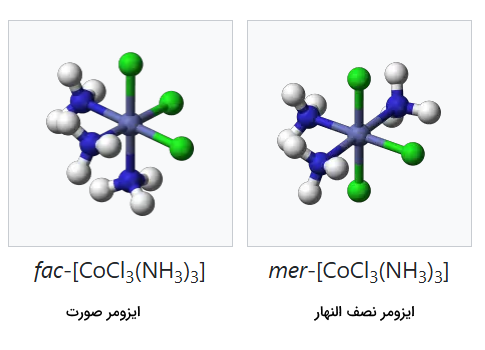
هنگامیکه سه لیگاند مشابه در یک سمت هشت وجهی قرار می گیرند، ایزومر با نام ایزومر صورت (Facial) یا fac مشخص میشود در این ایزومر، سه لیگاند یکی از صفحههای هشت وجهی را تشکیل میدهند. اگر این سه لیگاند صفحهای را اشغال کنند که از مرکز فلزی میگذرد به آن ایزومر نصف النهار (Meridional) یا mer گفته میشود. برای مثال، به حالتهای مختلف ایزومری کمپلکس توجه کنید.
انواع دیگری از ایزومرهای فضایی با نام دیاسترومر و انانتیومر وجود دارند که میتوانند در ترکیبات آلی فلزی تشکیل شوند. پیشنهاد میکنیم برای آشنایی بیشتر با این ایزومرها، مطلب دیاسترومر چیست مجله فرادرس را مطالعه کنید.
ایزومر نوری
ایزومری نوری زمانی اتفاق میافتد که تصویر آینهای یک ترکیب بر تصویر اصلی آن منطبق نباشد. این نامگذاری به این دلیل است که این ایزومرها معمولا از لحاظ نوری فعال هستند و در صفحه نور قطبیده شده، میچرخند.
علامت لاندا () به عنوان پیشوندی برای چرخش چپ دست ترکیبات سه لیگاند دو دندانهای استفاده میشود. به همین شکل، علامت دلتا () به عنوان پیشوند برای چرخش راست دست این لیگاندها به کار میرود. برای مثال، به تصاویر ایزومرهای ترکیب توجه کنید.
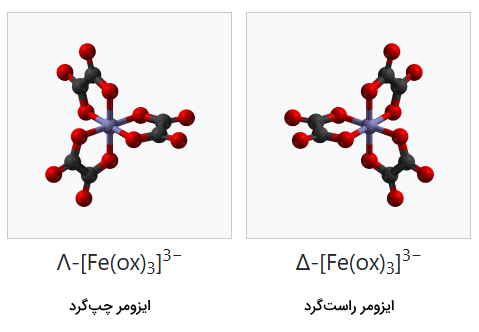
ایزومر ساختاری
ایزومرهای ساختاری زمانی تشکیل میشوند که پیوندهای بین اتمها در مولکول متفاوت باشد. ایزومری اتصال تنها یکی از چندین مدل ایزومری ساختاری در ترکیبات کمپلکس کوئوردیناسیون است. ایزومری اتصال زمانی اتفاق میافتد که لیگاندهای چند دندانه میتوانند از موقعیتهای مختلفی به دیگر اتمها متصل شوند. برای مثال، ترکیب یک لیگاند چند دندانه است و میتواند از سر اکسیژن یا نیتروژن به اتم فلز مرکزی متصل شود.
انواع دیگر ایزومری
انواع دیگری از ایزومری در مورد ترکیبات کمپلکس بررسی میشود که به دلیل ظهور اصول جدید شیمی ساختاری، دیگر از آنها استفاده نمیشود. برخی از این ایزومریها ایزومری یونش و ایزومری حلال هستند که در ادامه توضیح داده میشود.
- ایزومری یونش: بیان میکند که ایزومرهایی میتواند از جابهجایی یونهای بین کره بیرونی و کره درونی کمپلکس به وجود بیاید. این ساختارها بر اساس تعریف قدیمی ترکیبات کمپلکس که شامل کره بیرونی و کره درونی بوده است بیان شده است و در این ساختار لیگاندهای بیرونی در محلول ممکن است در صورت یونش با لیگاندهای درونی جابه جا شده بایو ایزومر تولید کنند.
- ایزومری حلال: بیان میکند که کره داخلی لیگاند ممکن است با یک مولکول حلال جایگزین شود. این تعریف بدون اساس است زیرا حلال را به عنوان مادهای جدا از لیگاند معرفی میکند. برخی از مشکلاتی که این تعریف پدید میآورد مربوط به تعداد آب ترکیبات هیدارتاسیون است.
ساختار الکترونی کمپلکس
برای درک بهتر اینکه خواص کمپلکس چیست، باید به ساختار الکترونی آن دقت کنیم. بسیاری از خواص کمپلکسهای فلزی بر اساس خواص الکتریکی آنها بیان میشود. ساختار الکتریکی این ترکیبات را میتوان با استفاده از یک ساختار تقریبا یونی تعریف کرد که میزان بارهای ذرات را به فلز و لیگاند مربوط میداند و نه به ساختار کووالانسی آنها.
این روش تعریف، اصل نظریه میدان بلوری است. ای نظریه، یک تعریف بر اساس مکانیک کوانتومی برای درک ساختار کمپلکسها را ارائه میدهد. اما این نظریه بر تمامی برهمکنشهای درون یک کمپلکس به عنوان برهمکنش یونی درنظر میگیرد و تصور میکند تمامی لیگاندها بار الکتریکی منفی دارند.
مدلهای پیچیده تر شامل پیوند کووالانسی مواد نیز هستند. این نظریهها با عنوان نظریه میدان لیگاند و اوربیتال مولکولی شناخته میشوند. این نظریهها را میتوان برای دستههای زیادی از کمپلکسها به کار برد و بر اساس آن ترکیبات کووالانسی را نیز بررسی کرد.
رنگ کمپلکس
ترکیبات کمپلکس فلزی معمولا رنگهایی تماشایی دارند که به دلیل انتقالات الکترونی آنها و جذب نور نمایان میشود. به همین علت از آنها به عنوان رنگدانه استفاده میشود. بیشتر انتقالات الکترونی که مربوط به رنگ این ترکیبات است، انتقالات زیرلایه d به d یا باند انتقال شارژ است. به دلیل این انتقالات، این کمپلکسها قسمتی از طول موج نور مرئی را جذب کرده و مکمل نور را از خود عبور داده و نشان میدهند.
برای مثال، اگر نور معمولی (برای مثال نور خورشید یا لامپ) از یک محلول مس (II) سولفات عبور کند، قسمتی از طول موج این نور از محلول عبور میکند و قسمتی از آن توسط محلول جذب میشود. بخشی از نور که رد میشود، شامل تمامی طول موجهای نور مرئی بجز قرمز خواهد بود. به همین دلیل رنگ محلول با رنگ آبی دیده میشود.

رنگ ترکیبات کمپلکس با ساختار و آرایش الکترونی آنها ارتباط نزدیکی دارد. ترکیبات کمپلکس فلزی معمولا رنگهای خاصی را با الگوهای مشخص تشکیل میدهند. در انتقال d-d، یک الکترون در اوربیتال d فلز با یک الکترون d پرانرژی تر برانگیخته میشود. به همین دلیل، این انتقالات تنها برای فلزاتی با اوربیتال d نیمهپر اتفاق میافتد. برای فلزاتی که اوربیتال d پر یا کاملا خالی دارند، انتقال الکترون بین از اوربیتال فلزی را به اوربیتال خالی لیگاند ممکن میکند. همچنین، عکس این انتقال از لیگاند به فلز نیز ممکن است.
در ادامه رنگ برخی از ترکیات کمپلکس آهن مشخص شده است.
| لیگاند / فلز | آهن (II) | آهن (III) |
| آب | محلول سبز گمرنگ | محلول زرد |
| هیدروکسید | رسوب سبز پررنگ | رسوب قهوهای |
| آمین | رسوب سبز پررنگ | رسوب قهوهای |
| کربنات | رسوب سبز پررنگ | رسوب قهوهای |
ترکیبات کمپلکس لانتانیدها نیز مانند فلزات واسطه است و برخی از آنها میتواند رنگی باشد. هرچند، برای برخی از یونهای لانتان ۳ بار مثبت، رنگ ترکیبات بسیار کم است و به سختی تحت اثر خواص لیگاند قرار می گیرد. این رنگها مربوط به انتقالات الکترونی در اوربیتال 4f هستند.
با قرار گرفتن الکترونهای اوربیتال 4f در هسته زنون و پوشیده شدن آنها با اوربیتال های 5s و 5p، دیگر با برقراری پیوند فلز و لیگاند تحت تاثیر قرار نمیگیرند. در ادامه رنگهای کمپلکسهای کبالت (II) و مس (II) نیز با لیگاندهای هیدرات، هیدروکسید، آمین و کربنات مشخص شده است.
| لیگاند / فلز | کبالت (II) | مس (II) |
| آب | محلول صورتی | محلول آبی |
| هیدروکسید | رسوب سبزآبی | رسوب آبی |
| آمین | محلول کاهیرنگ | رسوب سرمهای |
| کربنات | رسوب صورتی | رسوب سبزآبی |
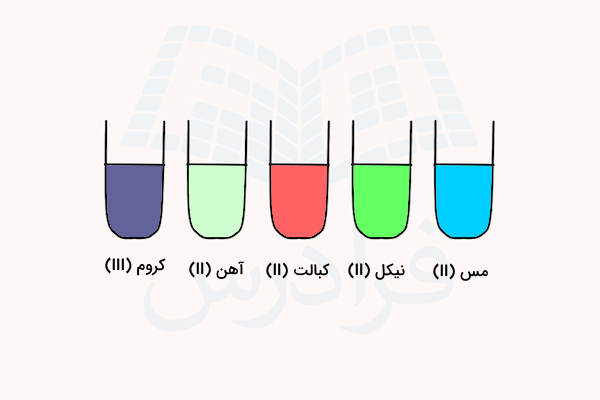
تصویر زیر نشاندهنده رنگ محلولهای کمپلکس هگزاآکوا مربوط به برخی از فلزات را نشان میدهد. نام فلزات در زیر تصاویر مشخص شده است.
خواص مغناطیسی
تا اینجا اموختیم کمپلکس و خواص آن چیست. کمپلکسهای فلزی که الکترونهای جفت نشده دارند، خواص پارامغناطیسی از خود نشان میدهند. با در نظر گرفتن کمپلکسهای تک فلزه، الکترونهای جفت نشده به دلیل فرد بودن تعداد الکترونهای ترکیب یا کامل نشدن جفت شدگی الکترونها به وجود میآیند.
در کمپلکسهایی که دو یا تعداد بیشتری فلز دارند، مرکزهای تکی تعداد فردی الکترون دارند یا اسپینهای بالایی دارند، وضعیت مغناطیسی کمپلکس پیچیده میشود. اگر برهمکنش مستقیم یا از طریق لیگاند بین دو فلز برقرار باشد، الکترونها جفت میشوند. این جفت شدگی ها ممکن است ضد فرومغناطیس باشد و ترکیب دیامغناطیس شود یا اینکه فرومغناطیس باشد. اگر برهمکنشی بین فلزات وجود نداشته باشد، مراکز فلزی مانند مولکولهای جداگانه عمل میکنند.
واکنشپذیری
کمپلکسها واکنشپذیریهای مختلفی را از خود نشان میدهند. برای مثال میتوان به انتقال الکترون، جایگزینی لیگاند و فرآیندهای اشتراکی اشاره کرد. در ادامه، توضیح دادهایم واکنش پذیری کمپلکس چیست.
انتقال الکترون
یک واکنش خیلی رایج در ترکیبات کمپلک کوئوردیناسیون شامل انتقال الکترون بین لیگاندهای بیرونی و درونی است. در واکنش لیگاندهای درونی، یک لیگاند پل زننده به عنوان معبری برای عبور الکترون عمل میکند.
جایگزینی لیگاند (کاهشی)
یکی از عوامل واکنشپذیری ترکیبات کمپلکس، سرعت واکنش جایگزینی لیگاند کاهشی است. برای مثال، سرعت جانشینی آب کوئوردیناسیون در ترکیبات کمپلکس میتواند ۲۰ مقدار با بزرگیهای متفاوت داشته باشد. کمپلکسهایی که در آنها لیگاندها آزاد شده و سپس به سرعت دوباره پیوند برقرار میکنند با عنوان لیگاند ناپایدار شناخته میشوند.
فرآیندهای اشتراکی
کمپلکسهایی که اوربیتال نیمهپر با پر نشده دارند معمولا میتوانند با سوبستراها واکنش دهند. بیشتر سوبستراها یک حالت پایه دارند که در آن جفت الکترونهای غیر پیوندی وجود دارد. برای مثال، مولکولهایی مانند آب، آمین و اترها از این نوع هستند. این سوبستراها نیاز به یک اوربیتال خالی دارند تا بتوانند با مرکز فلزی واکنش دهند. برخی از سوبستراها مانند مولکول اکسیژن دو اتمی، حالت پایه سهتایی دارند ک باعث میشود فلزاتی که اوربیتالهای نیمهپر دارند تمایل داشته باشند با این سووبستراها وارد واکنش شوند.
نام گذاری کمپلکسها
کمپلکسها نیز مانندسایر ترکیبات شیمیایی، به شکلی خاص نامگذاری میشوند. رایجترین روش برای نامگذاری این ترکیبات شامل ۵ مرحله کلی است. در ادامه توضیح دادهایم روش نامگذاری ترکیبات کمپلکس چیست.
مرحله اول
در نامگذار ترکیبات کمپلکس، ابتدا نام لیگاند و قبل از اتم فلز نوشته میشود.
مرحله دوم
نام لیگاندها به ترتیب الفبای انگلیسی نوشته میشود. پیوندهای عددی تاثیری بر روی ترتیب نامگذاری الفبایی نمیگذارند. نامگذاری لیگاندها به شکل زیر است.
- چند لیگاند تک دندانه پیشوندی متناسب با تعدادشان می گیرند. این پیشوندها بر اساس اعداد یونانی مونو،دی، تری، تترا و … است.
- چند لیگاند چنددندانه (مانند اتیلن دی آمین و اگزالات) پیشوند بیس، تریس، تتراکسی و …. میگیرند.
- آنیونها با حرف «-و» تمام میشوند. اگر آنیونی با حروف «ید»، «-ات»، «-یت» و .. تمام شود، حرف e انتهای آنیون، به حرف o تبدیل میشود. برای مثال، کلرید به کلرو و سولفات به سولفاتو تبدیل میشود.
- لیگاندهای خنثی با نام خود میآیند. چند استثنا در این مورد وجود دارد. برای مثال، به آمین، به آکوا، به کربونیل و به نیتروزیل تبدیل میشود.
مرحله سوم
پس از نوشتن نام لیگاند، نام اتم فلز مرکزی را مینویسیم. در این مرحله مهم است تشخیص دهیم نوع کمپلکس چیست. اگر کمپلکس از نوع آنیون است، نام اتم فلز مرکزی پسوند «-ات» میگیرد. برای مثال، کبالت به کبالتات و آلومینیوم به آلومینات تبدیل میشود.
مرحله چهارم
تشخیص اینکه عدد اکسایش فلز کمپلکس چیست نیز در این مرحله مهم است. عدد اکسایش اتم مرکزی باید در نام آن مشخص شود. مگر اینکه فلز مرکزی تنها یک حالت اکسایش به طور کلی و در تمام ترکیبات داشته باشد. حالت اکسایش اتم مرکزی باید با عدد رومی به شکل (I)، (II)، (III)، (IV) و … نشان داده شود.
مرحله پنجم
نام کاتیون باید قبل از نام آنیون بیاید. برای درک بهتر نحوه نامگذاری این ترکیبات، دقت کنید نام ترکیبات کمپلکس زیر چیست.
| فرمول شیمیایی | نام کمپلکس |
| دی سیانو بیس اتیلن دی آمین کادمیم (II) | |
| پنتا آمین کلریدو کبالت (III) سولفات | |
| یون هگزا آکوا مس (II) | |
| یون آمین پنتا کلریدو کوپرات (II) | |
| پتاسیم هگزا سیانو فرات (II) | |
| یون تترا کلریدو نیکلات (II) |
عدد کوئوردیناسیون لیگاندهایی که به بیش از یک اتم فلزی متصل هستند ( لیگاند بریج یا لیگاند پل) با استفاده از زیروند یونانی نمایش داده میشود.
تمامی گروههای آنیونی میتوانند با یک کاتیون خنثی شوند. یک کمپلکس آنیونی میتواند با استفاده از کاتیون هیدروژن پایدار شده و به یک کمپلکس اسیدی تبدیل شود که با انحلال خود یون هیدروژن آزاد میکند. در نامگذاری اینگونه کمپلکسهای اسیدی، پس از نام فلز مرکزی، پسوند «-یک» میآید. برای مثال، نام ترکیب ، تتراسیانوپلاتینیک (II) اسید است.
ثابت پایداری کمپلکس چیست؟
تمایل فلزات و یونهای فلزی برای دریافت الکترون و اتصال به لیگاندها با کمیتی به نام ثابت پایداری کمپلکس بیان میشود. به این ثابت، ثابت تشکیل کمپلکس نیز گفته میشود و با عبارت نمایش داده میشود. این عبارت درواقع ثابت تعادل واکنش تشکیل کمپلکس از اتم فلزی و لیگاندها به صورت جداگانه است و میتواند برای یک واکنش ساده به شکل زیر محاسبه شود.
در این واکنش شیمیایی حرف M نشاندهنده فلز و L و z نشاندهنده یون کمپلکس است. نشاندهنده لیگاند است. x و y ضرایب استوکیومتری آنها هستند. عبارت ثابت پایداری کمپلکس برای همچین واکنشی از طرق زیر به دست میآید.
گاهی اوقات ثابت پایداری کمپلکس با تعریفی تفاوت و به عنوان ثابت ناپایدری کمپلکس بیان میشود. این عبارت بیانکننده عکس پایداری و فرآیند تجزیه کمپلکس به لیگاند و فلز است. فرمول محاسبه ثابت ناپایداری کمپلکس به شکل زیر است.
شیمی کوئوردیناسیون
کمپلکسهای فلزی که با نام ترکیبات کوئوردیناسی نیز شناخته میشوند، شامل تمامی ترکیبات فلزی بجز بخار فلزی، پلاسما و آلیاژها میشود. مطالعه شیمی کئودیناسیون در واقع مطالعه شیمی معدنی فلزات قلیایی، فلزات قلیایی خاکی، فلزات واسطه، لانتانیدها، اکتنیدها و شبه فلزات است. بنابراین، شیمی کوئوردیناسیون در واقع شیمی قسمت عمدهای از جدول تناوبی عناصر است. فلزات و یونهای فلزی تنها در حالات فشردهای که با لیگاندها احاطه شدهاند وجود دارند.
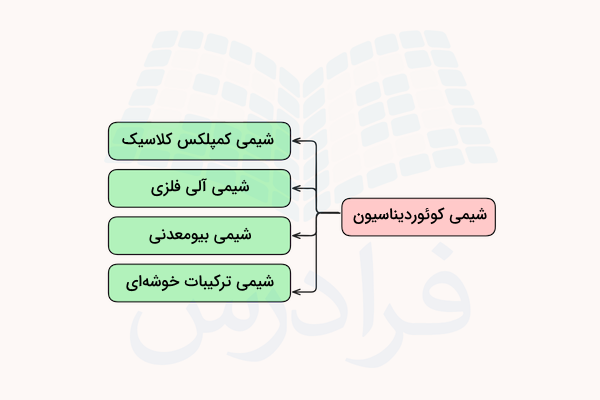
شیمی کوئوردیناسیون را میتوان در چند شاخه بررسی کرد. این شاخه ها، کلاسیک (کمپلکسهای ورنر)، شیمی آلی – فلزی و شیمی بیومعدنی است.
شیمی کمپکلس کلاسیک
این شاخه که بر اساس نظریه کوئوردیناسیون ورنر بنا شده است، شامل کمپکلسهای ساده است. در این کمپلکسها، لیگاندها با جفت الکترونهای غیر پیوندی خود به اتم فلز مرکزی وصل میشوند و این جفت الکترون غیر پیوندی متعلق به اتمهای اصلی مولکول لیگاند است. برای مثال، لیگاندهایی مانند ، ، و از این نوع هستند. از مثال ترکیبات کمپلکس کلاسیک میتوان به ترکیبات زیر اشاره کرد.
شیمی آلی فلزی
در این شاخه، لیگاندهایی که به اتم فلز مرکزی متصل میشوند از نوع مواد آلی مانند آلکنها، آلکینها یا آلکیلها هستند. همچنین مواد شبه آلی مانند فسفینها، هیدریدها و کربن مونوکسید نیز میتواند از این نوع لیگاندها باشند. از مثالهای کمپلکس آلی – فلزی میتوان به ترکیب اشاره کرد.
شیمی بیومعدنی
در این شاخه، لیگاندها موادی هستند که در طبیعت یافت میشوند. به خصوص، این لیگاندها شامل زنجیرههای جانبی آمینو اسیدها و بسیاری از کوفاکتورها مانند پورفیرینها هستند. یکی از مثال های این ترکیبات کمپکس، هموگلوبین است.
شیمی ترکیبات خوشهای
در این ترکیات، لیگاندها ترکیبی شامل ترکیبات آلی فلزی، زیستی و .. هستند. برای مثال، از این نوع است. در برخی موارد نیز، ترکیب کمپلکس ممکن است ترکیبی از تمامی عوامل یاد شده باشد. برای مثال میتوان به ترکیب کمپلکس اشاره کرد.
مطالعه ترکیبات معدنی، علم مواد و شیمی حالت جامد همگی به یونهای فلزی مربوط میشوند و زیرشاخهای از شیمی کوئوردیناسیون هستند. در بسیاری از موارد، لیگاندها اکسیدها یا سولفیدها هستند. اما فلزات به هر حال کوئوردینه میشوند و تمامی قوانین ترکیبات کمپکلسها برای آنها اعمال میشود.
با وجود ارتباط علوم شیمی کوئوردیناسیون و علم مواد و شیمی مواد جامد و ترکیبات معدنی، تمرکز این علوم با یکدیگر متفاوت است. علم ترکیبات معدنی بیشتر درباره ترکیبات و ساختارهای پلیمری تمرکز دارد . ترکیبات و خواصی که این مواد دارند و ارتباط آنها را با فلزات بررسی میکند. در حالی که شیمی کوئوردیناسیون، واکنشپذیری و ویژگیها و خواص ترکیبات کمپلکسی که شامل اتمهای فلزی هستند را بررسی میکند.
تاریخچه
شیمی کمپلکسها در نتیجه کارهای دانشمند سوییسی آلفرد وارنر (Alfred Werner) به وجود آمد. او ترکیبات مختلف کبالت (III) کلرید و آمونیاک را بررسی کرد. با افزایش اسید کلریدریک مشاهده کرد که آمونیاک به شکلی کامل از بین میرود. سپس او بیان کرد که آمونیاک باید به شکلی قوی به یون کبالت مرکزی متصل شده باشد. هرچند هنگامیکه محلول نیترات نقره آبی به این ترکیبات اضافه کرد، تشکیل رسوب جامد کلرید نقره را مشاهده کرد.
مقدار کلرید نقره تولید شده با تعداد مولکولهای آمونیاک متصل به کبالت (III) کلرید مرتبط بود. نتیجه این تحقیقات و آزمایشهای ورنر، تشکیل ترکیبات کمپلکس شیمیایی را اثبات کرد. او اثبات کرد که در کره اول کوئوردیناسی که در برخی از موارد با نام کره نزدیک نیز به آن گفته میشود، لیگاندها به شکلی مستقیم به فلز مرکزی متصل شدهاند.
در کره دوم (کره بیرونی) یونهای دیگری به یون کمپلکس متصل میشوند. ورنر برای نظریه کوئوردیناسیون، در سال ۱۹۱۳ میلادی جایزه نوبل را دریافت کرد.
یادگیری مهندسی متالورژی با فرادرس
در این مطلب آموختیم کمپلکس چیست. مهندسی متالورژی علمی است که قوانین فیزیک را با اصول شیمی فلزات و دادههای مهندسی ترکیب میکند. بیشتر فلزات در طبیعت به صورت ترکیبات کمپلکس یافت میشوند و برای استخراج آنها باید با مفاهیمی چون ساختار کمپلکس و پیوندهای کوئوردیناسی آشنایی داشت. پیشنهاد میکنیم برای آشنایی با این مفاهیم و مباحث به مجموعه فیلم آموزش مهندسی متالورژی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه کمپلکسهای فلزی دسترسی داشته باشید.
کاربرد ترکیبات کمپلکس
فلزات در طبیعت بیشتر در حالات محلول و کمپلکس وجود دارند و ترکیبات کمپلکس زیادی وجود دارند که از آنها به شکلی گسترده در بسیاری از زمینهها استفاده میشود. برخی از این صنایع میتوان به صنایع زیست معدنی شیمی، صنایع مختلف و آنالیز مواد اشاره کرد. در ادامه این مطلب از مجله فرادرس میآموزیم کاربردهای ترکیبات کمپلکس چیست.
شیمی زیست معدنی
در شیمی زیست معدنی و شیمی زیست آلی – فلزی، ترکیبات کمپلکس کاربردهایی ساختاری یا کاتالیستی دارند. محاسبه شده است که حدود ۳۰ درصد پروتئینها حاوی فلز هستند. برای مثال میتوان به ویتامین ب -۱۲ ، گروه هم در هموگلوبین، سیتوکرومها و گروه کلرین در کلروفیل اشاره کرد. یک ترکیب کمپلکس زیستی دیگر آنزیم کاتالاز است که هیدروژن پروکسید دفع شده سلول را تجزیه میکند. ترکیبات کمپلکس آزمایشگاهی نیز برای اتصال پروتئینها و نوکلئیک اسیدها استفاده میشوند.
صنعت
تولید کاتالیستهای همگن یکی از بزرگترین کاربردهای ترکیبات کمپلکس برای تولید ترکیبات آلی است. فرآیندهای تولید از این نوع شامل هیدروژناسیون، هیدروفرمیلاسیون و اکسیداسیون است. برای مثال، ترکیب ترکیب تیتانیوم تری کلرید و تری اتیل آلومینیوم برای تولید یک کاتالیست استفاده میشود که باعث پلیمری شدن اتیلن و پروپیلن میشود. از این پلیمرها در تولید فیبر، فیلم و پلاستیک استفاده میشود.
نیکل، کبالت و مس را میتوان طی فرآیندهای هیدرومتالورژیکی شامل یونهای کمپلکس آنها استخراج کرد. سنگ معدن این فلزات شامل کمپلکس آنها با یون آمین است. همچنین، فلزات را میتوان با استفاده از رسوبدهی انتخابی و با توجه به حلالیت یونهای کمپلکس آنها استخراج کرد. برای مثال، از یون سیانید برای استخراج طلا و نقره از سنگهای معدن آنها استفاده میشود.
آنالیز مواد
در گذشته، ترکیبات کمپلکس برای شناسایی حضور فلزات در نمونههای مختلف استفاده میشدند. تجزیه کیفی معدنی مواد به شکلی گسترده جای خود را به روشهای دستگاهی آنالیز مواد مانند اسپکتروسکوپی جذب اتمی، طیف سنجی نشر اتمی، پلاسمای جفت شده القایی و طیف سنجی جرمی پلاسمای جفت شده القایی دادهاند.
source
