غلظت مولی که به آن «مولاریته» یا «غلظت مولار» نیز گفته میشود، معیاری است که با آن غلظت یک محلول را بیان میکنند. غلظت مولی با نماد حرف انگلیسی (M) نمایش داده میشود. معنی غلظت مولار، میزان مول حلشونده در لیتر حلال است. به طور کلی به تعداد مول یک ماده حلشونده شیمیایی در واحد حجم حلال، غلظت مولی گفته میشود. نماد واحد غلظت مولی (mol/L) یا (mmol/mL) است. در این مطلب از مجله فرادرس میآموزیم غلظت مولی چیست و چگونه محاسبه میشود.
در ابتدای این مطلب میآموزیم غلظت مولی و فرمول آن چیست و چگونه محاسبه میشود. سپس روشهای مختلف استفاده از فرمول غلظت مولی مانند تهیه محلول، محاسبه غلظت ماده، غلظت محلولهای ترکیبی و غلظت یونها در محلول را بررسی میکنیم. پس از آن، تفاوت غلظت مولی را با نرمالیته و مولالیته توضیح میدهیم و عوامل موثر بر غلظت مولی را برمیشماریم. در نهایت نیز کاربردهای مفهوم غلظت مولی را توضیح می دهیم. با مطالعه این مطلب تا انتها میتوانید با این پارامتر مهم به شکلی کامل آشنا شوید.
غلظت مولی یا مولاریته، یک روش بیان غلظت محلول است که بر اساس تعداد مول حلشونده در لیتر حلال بیان میشود. در اغلب اوقات واحد اندازهگیری غلظت مولی، مول بر لیتر است. گاهی برای نشان دادن غلظت مولی، از نوشتن نماد ماده شیمیایی حلشونده در دو براکت «[ ]» استفاده میشود.
واحد اندازهگیری استاندارد غلظت مولی در سیستم اندازهگیری SI برابر با «مول بر دسیمتر مکعب» () یا «مول بر متر مکعب» () است. اما به دلیل سخت بودن اندازهگیری این واحد، این غلظت بیشتر بر حسب مول بر لیتر بیان میشود. محلولی که غلظت مولی آن ۱ مول بر لیتر باشد، ۱ مولار خوانده میشود.
برای مثال، عبارت بیانگر غلظت مولی یون کلرید در یک محلول است. مقدار غلظت مولی میتواند با استفاده از میزان گرم ماده حلشونده در حجم حلال و با استفاده از کسرهای تبدیل استوکیومتری محاسبه شود.
در تصویر بالا، برخی از روشهای گزارش غلظت محلولها نوشته شده است. غلظت یک محلول میتواند به شکل مول بر لیتر، گرم بر لیتر، درصد حجمی، درصد جرمی، درصد جرمی حجمی و ppm بیان شود.
یک مول از ماده برابر با عدد آووگادرو از ماده است. عدد آووگادرو که مقداری برابر با ذره دارد به عنوان واحد اندازهگیری مول بیان میشود. برای مثال، یک مول از آب مقدار مولکول آب درون خود دارد. در نتیجه، غلظت مولی مواد برابر با تعداد مولهای ماده حلشونده در حجم مشخصی از حلال (اغلب اوقات ۱ لیتر) بیان میشود.
برای به دست آوردن مقدار مول در مسائل غلظت مولی باید از کسرهای تبدیل استوکیومتری و مفاهیمی مانند جرم مولی و دانسیته استفاده کنیم.
برای درک بهتر اینکه غلظت مولی چیست ابتدا باید بدانیم محلول چیست. محلول، مخلوطی همگن است که از حل کردن مقداری حلشونده در حلال به دست میآید. قسمتی از محلول که بخش بزرگتری از محلول را تشکیل میدهد با نام حلال شناخته میشود. مادهای که قسمت کوچکتر محلول را تشکیل میدهد و در ماده دیگر حل میشود با نام حلشونده شناخته میشود.
برای بیان میزان ماده حل شده در حلال از عبارات تعریف کننده غلظت استفاده میشود. غلظت محلولها میتواند به روشها متفاوتی بیان شود. غلظت مولار، مولالیته، درصد حجمی و درصد جرمی و ppm از روشهای بیان غلظت محلولهای هستند.
برای درک بهتر این موضوع که غلظت مولی چیست، ابتدا باید با مفاهیمی مانند جرم اتمی، جرم مولی و ساختار اتم آشنا شوید. سپس استوکیومتری واکنش و روشهای حل مسائل استوکیومتری را بیاموزید. در نهایت با یادگیری روشهای مختلف بیان غلظت محلولها میتوانید به درک این مفهوم که غلظت مولی چیست برسید. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم پرداخته است.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه غلظت مولی دسترسی داشته باشید.
غلظت به طور کلی بیان کننده مقدار ماده حلشونده در مقدار حلال است. فرمول محاسبه غلظت مولی برابر با تقسیم تعداد مول ماده حلشونده بر لیتر حلال یا محلول است. این فرمول به شکل زیر نوشته میشود.
غلظت مولی یا مولاریته یکی از پرکاربردترین واحدهای اندازهگیری غلظت است و میتوان با استفاده از آن به بسیاری از فرمولهایی دیگر برای انجام محاسبات استوکیومتری دست یافت. برای استفاده از این واحد غلظت در گستره وسیعتر، غلظت مولار به عنوان مقدار ماده حلشونده در واحد حجم حلال یا واحد حجم در دسترس برای مواد استفاده میشود و با حرف انگلیسی (c) نمایش داده میشود.
این فرمول گسترده به شکل زیر است.
در این فرمول (n) مقدار مول ماده حلشونده است. (N) تعداد ذرات ماده موجود در حجم (V) بر حسب لیتر است. () عدد آووگادرو است که مقدار آن () است. به کسر () چگالی تعداد گفته میشود.
برای محاسبه میزان غلظت مولی یک محلول باید از کسرهای استوکیومتری استفاده کنیم. با استفاده از کمیتهایی مانند دانسیته و جرم مولی در نهایت باید میزان مول ماده حلشونده را در لیتر حلال به دست آوریم. برای درک بهتر اینکه روش محاسبه غلظت مولی چیست، به مثال زیر دقت کنید.
یک محلول با حل کردن ۲٫۳۵۵ گرم سولفوریک اسید در ۵۰ میلیلیتر آب به دست آمده است. میخواهیم غلظت مولی سولفوریک اسید را در این محلول محاسبه کنیم. برای انجام این کار ابتدا باید میزان مول سولفوریک اسید را به دست آوریم. میدانیم جرم مولی سولفوریک اسید برابر با ۹۸٫۰۸ گرم بر مول است. با استفاده از این مقدار، مول سولفوریک اسید را محاسبه میکنیم.
حال میتوانیم این مقدار مول سولفوریک اسید را بر حجم محلول تقسیم کنیم تا میزان غلظت مولی سولفوریک اسید به دست آید.
بنابراین غلظت سولفوریک اسید در این محلول برابر با ۰٫۴۸ مول بر لیتر است.
جرم مولی یک مولکول یا اتم برابر با جرم یک مول (۱ عدد آووگادرو) از آن مولکول یا اتم است. برای مثال، جرم یک مول اتم کربن برابر با ۱۲ است و جرم مولی آن به شکل ۱۲ گرم بر مول گزارش میشود. میزان جرم مولی تمامی عناصر را میتوان از منابع مرجع به دست آورد. برای محاسبه جرم مولی یک ترکیب مولکولی کافی است جرم مولی هر عنصر را در تعداد آن ضرب کرده و با هم جمع کنیم.
برای تمرین بیشتر، به مثالهای زیر توجه کنید.
در ادامه برای درک بهتر اینکه فرمول محاسب غلظت مولی چیست، مثالهایی ارائه شده است.
میزان غلظت مولی یون در یک محلول ۴٫۸ مولار سولفوریک اسید چیست؟
برای پاسخ به این سوال باید به این بیاندیشیم که در یک محلول چه اتفاقی میافتد. از آنجا که سولفوریک اسید یک اسید قوی است، به شکلی کامل در آب تفکیک میشود و یونهای هیدروژن و سولفات تولید میکند. واکنش تفکیک این اسید در آب به شکل زیر است.
با توجه به واکنش بالا، میتوانیم مشاهده کنیم که هر مول از سولفوریک اسید، ۲ مول یون هیدروژن تولید میکند. با استفاده از این نسبت مولی، و تعریف غلظت مولی که میزان مول حلشونده در لیتر حلال است، میتوانیم تعداد مول هیدروژن را به دست آورده و در فرمول غلظت مولی اعمال کنیم.
در نتیجه، میزان غلظت یون هیدروژن در این محلول، ۹٫۸ مول بر لیتر خواهد بود.
تعداد مول موجود سدیم هیدروکسید را در ۲٫۵ لیتر محلول ۰٫۱ مولار آن محاسبه کنید.
برای پاسخ به این سوال باید به یاد بیاوریم فرمول محاسبه غلظت مولی چیست. غلظت مولی تعداد مول نمونه حل شده در لیتر محلول است. حال که غلظت و حجم محلول را داریم به راحتی میتوانیم میزان مول آن را محاسبه کنیم.
میزان میلیمول آلانین را در یک مولکول بیولوژیک در ۲۷٫۲ میلیلیتر محلول ۱٫۵۳ مولار آلانین محاسبه کنید.
مانند مثال قبل، برای محاسبه میزان مول نمونه، از فرمول محاسبه غلظت مولی بهره میبریم.
دقت داشته باشید که در این مثال به دلیل اینکه مقدار نهایی خواسته شده بر حسب میلی مول است، نیازی نیست حجم میلیلیتر را تغییر دهیم. در واقع در این سوال تبدیل میلیمولار به مولار واجب نیست. اما اگر صورت سوال مقدار مول آلانین را میخواست، نیاز بود تا تغییر حجم از میلیلیتر به لیتر نیز لحاظ شود.
یک محلول با حل کردن مقدار ۴۲٫۲۳ گرم آمونیوم کلرید در ۵۰۰ میلیلیتر آب به دست آمده است. مقدار غلظت مولی این محلول چیست؟ (جرم مولی آمونیوم کلرید برابر با ۵۳٫۳۰ گرم بر مول است.)
ابتدا میزان مول نمونه را محاسبه کرده و سپس غلظت مولی آن را با استفاده از فرمول محاسبه غلظت مولی به دست میآوریم.
حال برای تمرین بیشتر به تمرینهای زیر پاسخ دهید.
مقدار غلظت مولی محلول ساخته شده از انحلال ۱۳۷ گرم سدیم کلرید در ۵۰۰ میلیلیتر آب چیست؟
ابتدا میزان مول نمونه را محاسبه کرده و سپس غلظت مولی آن را با استفاده از فرمول محاسبه غلظت مولی به دست میآوریم.
در ادامه برای درک بهتر مسائل مربوط به غلظت مولی، آنها را در دستهبندیهای مختلفی بررسی میکنیم.
تهیه محلول با غلظت مشخص
در برخی از سوالات و در انجام آزمایشات عملی در آزمایشگاه نیاز است تا یک محلول با غلظتی مشخص بسازیم. برای اینکار نیاز است بدانیم چه میزانی از ماده حلشونده را برای حل شدن در مقدار مشخص حلال باید استفاده کنیم. برای انجام محاسبات اینگونه سوالات، فرمول محاسبه غلظت مولی را به شکل زیر تغییر میدهیم.
لیتر حلال × غلظت مولی = مول حلشونده
برای مثال، اگر بخواهیم ۲۵۰ میلیلیتر از یک محلول آبی سدیم کلرید ۰٫۸ مولار بسازیم، ابتدا باید میزان مول مورد نیاز از سدیم کلرید را با استفاده از فرمول بالا محاسبه کنیم. سپس میتوانیم با استفاده از جرم مولی سدیم کلرید، مقدار گرم مورد نیاز سدیم کلرید را محاسبه کنیم.
با استفاده از محاسبات بالا، فهمیدیم که باید ۰٫۲ مول سدیم کلرید استفاده کنیم. حال با استفاده از جرم مولی سدیم کلرید که برابر ۵۸٫۴۴ گرم بر مول است، میتوانیم گرم سدیم کلرید را محاسبه کنیم.
برای ساخت محلولی با مشخصات بالا باید ابتدا مقدار ۱۱٫۷ گرم از سدیم کلرید را با ترازو وزن کنیم و سپس آن را به بالن مدرج ۲۵۰ میللیتری تمیزی منتقل کنیم. سپس تا خط مشخص شده بالن آب اضافه کنیم. سپس ۲۵۰ میلیلیتر محلول ۰٫۰۸ مولار سدیم کلرید خواهیم داشت.
مسائل استوکیومتری از مهمترین مسائل در شیمی هستند که به دانشمندان کمک میکند به سازوکار واکنشهای شیمیایی و پارامترهایی مانند سرعت واکنش و … پیببرند. پیشنهاد میکنیم برای یادگیری درباره روش حل مسائل استوکیومتری، فیلم آموزش حل مسائل استوکیومتری فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
برای تمرین بیشتر، به مثالهای زیر توجه کنید.
مثال ۱
توضیح دهید روش تهیه محلولی از کلرید کبالت ۶ آبه با حجم ۵۰۰ میلیلیتر و غلظت مولی ۰٫۰۸ مول بر لیتر چیست. (جرم مولی کبالت (II) کلرید ۶ آبه ۲۳۷٫۹ گرم بر مول است.)
پاسخ
برای تهیه محلول از کلرید کبالت با غلظت مولی ۰٫۰۸ و حجم ۵۰۰ میلیلیتر، ابتدا باید مقدار مول آن را با استفاده از فرمول غلظت مولی به دست آوریم. سپس میتوانیم غلظت مولی را به گرم تبدیل کنیم.
سپس با استفاده از جرم مولی کبالت (II) کلرید ۶ آبه، گرم مورد نیاز آن را محاسبه میکنیم.
برای تهیه محلول ۰٫۰۸ مولار از کبالت کلرید نیاز است که مقدار ۹۵٫۱۶ گرم از نمونه خشک را وزن کرده و به بالن حجمی اضافه کنیم.

سپس مقداری آب به بالن اضافه کرده و هم میزنیم و در نهایت تا رسیدن حجم محلول به خط نشانه بالن، آب اضافه میکنیم.
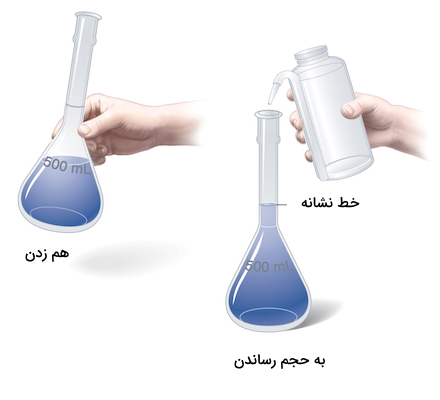
مثال ۲
به تصویر زیر دقت کنید. در این تصویر، از ۹۰ گرم از ماده آمونیوم کرومات با فرمول با اضافه کردن مقدار کافی آب، محلولی با حجم ۲۵۰ میلیلیتر تهیه شده است. میزان غلظت مولی این محلول چیست؟

پاسخ
برای محاسبه غلظت مولی این محلول، باید میزان مول ماده حلشونده را بر لیتر آن تقسیم کنیم. مول ماده حلشونده از جرم مولی آن به دست میآید.
سپس میتوانیم میزان غلظت مولی آن را با تقسیم میزان مول آن بر ۰٫۲۵۰ لیتر به دست آوریم.
حال برای درک بهتر اینگونه سوالات، به تمرینهای زیر پاسخ دهید.
تمرین ۱
یک شیمیدان میخواهد سه لیتر محلول ۰٫۲۵۰ مولار پتاسیم پرمنگنات تهیه کند. میزان گرم پتاسیم پرمنگنات مورد نیاز او را محسابه کنید.
ابتدا با استفاده از فرمول غلظت مولی، میزان مول پتاسیم پرمنگنات را محاسبه کرده و سپس با استفاده از کسرهای تبدیل استوکیومتری، گرم آن را به دست میآوریم.
تمرین ۲
چه مقدار از ماده حلشونده در ۱٫۰۸ لیتر از محلول ۰٫۰۵۷۸ مولار اسید سولفوریک وجود دارد؟
ابتدا با استفاده از فرمول غلظت مولی، میزان مول اسید سولفوریک را محاسبه کرده و سپس با استفاده از کسرهای تبدیل استوکیومتری، گرم آن را به دست میآوریم.
تمرین ۳
در چه حجمی از محلول ۱٫۵ مولار اسید کلریدریک، ۱۰ گرم هیدروژن کلرید وجود دارد؟
۱۸۳ میلیلیتر
۱۸٫۳ میلیلیتر
۱۸۰ میلیلیتر
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
محاسبه غلظت ماده در واکنش
غلظت مولی یکی از پارامترهایی است که برای محاسبه غلظت مواد تولید شده از واکنشها یا میزان ماده مورد نیاز برای انجام واکنش استفاده میشود. برای مثال واکنش زیر را در نظر بگیرید.
اگر بخواهیم میزان حجم پتاسیم یدید مورد نیاز با غلظت مولی ۰٫۱ را برای واکنش با ۰٫۱ لیتر محلول سرب (II) نیترات ۰٫۱ مولار محاسبه کنیم، به روش زیر عمل میکنیم. ابتدا میزان مول سرب نیترات را محاسبه میکنیم.
با توجه به ضرایب استوکیومتری واکنش متوجه میشویم که ۲ مول پتاسیم یدید برای واکنش با یک مول سرب نیترات نیاز است. اگر از این نسبت ضرایب استوکیومتری استفاده کنیم، میتوانیم میزان مول پتاسیم یدید مورد نیاز را بیابیم.
این بدین معنی است که ۰٫۰۲ مول پاسیم یدید نیاز است. برای به دست آوردن حجم پتاسیم یدید، از فرمول محاسبه غلظت مولی به شکل زیر استفاده میکنیم.
غلظت مولی ÷ مول حلشونده = حجم حلشونده
پس با استفاده از فرمول بالا و غلظت پتاسیم یدید که در صورت سوال داده شده است، میتوانیم حجم آن را محاسبه کنیم.
تهیه محلول رقیق از محلول غلیظ
برای رقیق کردن محلولهای غلیظ در آزمایشگاه با غلظت مشخص نیاز به استفاده از فرمول غلظت مولی داریم. در آزمایشگاه، معمولا محلولهای از قبل آماده شده غلیظ وجود دارند و این محلولها برای استفاده در واکنشهای مختلف باید رقیق شود. برای این کار از فرمول زیر استفاده میکنیم.
در این فرمول، عبارتهای (M) نشاندهنده غلظتهای اولیه و ثانویه و (V) نشاندهنده حجم این محلولها است. از آن جا که هر دو محلول (رقیق و غلیظ) از یک نوع ماده هستند، میتوان میزان مول آنها را در فرمول محاسبه غلظت مولی برابر قرار دارد و به فرمول بالا رسید.
برای مثال، محلول اسید کلریدریک ۲ مولار معمولا در آزمایشگاهها به صورت آماده شده وجود دارد و برای استفاده از آن در واکنشهای مختلف ممکن است به محلول ۰٫۱ مولار اسید کلریدریک احتیاج داشته باشیم. برای این کار، از فرمول بالا استفاده میکنیم. برای مثال، برای تهیه ۲۵۰ میلیلیتر () از محلول ۰٫۱ مولار اسید کلریدریک ()، به ۱۲٫۵ میلیلیتر از محلول ۲ مولار اسید کلریدریک () احتیاج داریم.
در این فرمول نیازی نیست که حجمها حتما بر اساس لیتر بیان شوند تنها کافی است حجم محلولها در هر دو سمت معادله یک واحد داشته باشد.این حجمها میتوانند هردو بر حسب لیتر یا میلیلیتر و … بیان شوند. برای درک بهتر روش رقیقسازی محلولهای غلیظ، به مثالهای زیر دقت کنید.

مثال ۱
چگونه میتوان از یک محلول ۱۴٫۸ مولار آمونیاک، ۲۵۰ میلیلیتر محلول ۰٫۱ مولار آمونیاک تهیه کرد؟
پاسخ
برای حل این سوال از فرمول استفاده شده در قسمت قبل استفاده میکنیم. غلظت و حجم ثانویه را ۲۵۰ میلیلیتر و ۰٫۱ در نظر میگیریم و ۱۴٫۸ مولار را به جای غلظت اولیه جایگذاری میکنیم.
بدین ترتیب میزان حجم مورد نیاز، ۱٫۷ میلیلیتر به دست میآید.
مثال ۲
برای تهیه یک محلول استاندارد از یون روی باید مقدار ۱٫۰۰۴ گرم از نمونه سیم حاوی این یون در مقدار کافی اسید کلریدریک حل شود و تا حجم ۵۰۰ میلیلیتر رقیق شود. اگر مقدار ۲ میلیلیتر از این محلول تا حجم ۲۵۰ میلیلیتر رقیق شود، غلظت نهایی محلول چقدر خواهد بود؟
پاسخ
این سوال دو قسمت دارد. در قسمت اول باید غلظت محلول استاندارد تهیه شده را محاسبه کنیم و سپس در قسمت دوم با استفاده از فرمول استفاده شده در این قسمت، میزان غلظت محلول رقیق را به دست آوریم. مقدار غلظت محلول استاندارد اولیه به روش زیر محاسبه میشود.
حال باید میزان غلظت محلول رقیق تهیه شده را محاسبه کنیم.
برای درک بهتر اینگونه سوالات، به تمرینهای زیر پاسخ دهید.
تمرین ۱
اگر ۱۷۵ میلیلیتر از محلول ۱٫۶ مولار لیتیوم کلرید تا ۱ لیتر رقیق شود، غلظت مولی جدید آن چیست؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
تمرین ۲
چند میلیلیتر از محلول ۵ مولار مس (II) سولفات باید به ۱۶۰ میلیلیتر آب اضافه شود تا محلول ۳ مولار مس (II) سولفات تهیه شود؟
مشاهده پاسخ تشریحی برخی از سوالات، نیاز به عضویت در مجله فرادرس و ورود به آن دارد.
رقیق سازی چیست؟
رقیقسازی به فرآیند کاهش غلظت یک محلول با افزودن حلال گفته میشود. فرآیند رقیقسازی اغلب برای محلولهای آبی که حلال آنها آب است استفاده میشود. برای این کار، میزان مشخصی از آب به محلول اضافه میشود تا به غلظت دلخواه برسد. برای این کار، غلظت مولار و تعداد مول استفاده شده در محلولها بسیار مهم است.
رقیق سازی یکی از روشهای مهم در تهیه محلولهای مختلف در آزمایشگاههای شیمی است. پیشنهاد میکنیم برای آشنایی بیشتر با روشهای محلولسازی، مطلب تهیه محلولها در آزمایشگاه شیمی مجله فرادرس را مطالعه کنید. لینک این آموزش در ادامه آورده شده است.
فرآیند رقیق سازی پس از انجام محاسبات استوکیومتری با استفاده از وسایل آزمایشگاهی مانند پیپت مدرج و بالن حجمی انجام میشود. برای مثال، در مثال بالا برای تهیه ۲۵۰ میلیلیتر محلول اسید کلریدریک ۰٫۱ مولار، میزان ۱۲٫۵ میلیلیتر از محلول ۲ مولار اسید کلریدریک به وسیله یک پیپت مدرج برداشته میشود و به یک بالن حجمی با حجم ۲۵۰ میلیلیتر منتقل میشود.

سپس به میزان کافی به آن آب اضافه میشود تا سطح محلول به خط نشانه بالن حجمی ۲۵۰ میلیلیتری برسد. بدین ترتیب با از محلول غلیظ ۲ مولار اسید کلریدریک، محلول ۰٫۱ مولار رقیق ساختهایم.

غلظت مولی محلولهای چندتایی
گاهی اوقات در برخی از مسائل نیاز است تا غلظت دو یا چند محلول را پس از مخلوط کردن آنها با یکدیگر به دست آوریم. با اینکه این مسائل ممکن است پیچیده به نظر برسد، باید همواره به یاد داشته باشیم که ابتدا باید تعداد مول کل را به دست آوریم و سپس حجم کل را محاسبه کنیم.
برای مثال تصور کنید محلولی داریم که از مخلوط شدن چند محلول به دست آمده است. ویژگی محلولها به شرح زیر است.
- محلول شماره ۱: ۵ لیتر محلول ۳ مولار از ماده A
- محلول شماره ۲: ۰٫۷۵ لیتر از محلول ۱٫۵ مولار A
- محلول شماره ۳: ۱ لیتر محلول ۰٫۷۵ مولار A
در نهایت میخواهیم میزان غلظت مولی کل محلول را به دست آوریم. برای این کار، ابتدا باید میزان مول ماده A را در هر محلول به شکلی جداگانه محاسبه کنیم.
مول ماده A در محلول شماره ۱ و ۲ و ۳ به ترتیب طبق معادلات زیر و با استفاده از فرمول غلظت مولی به دست میآید.
پس تعداد مول کل ماده A از جمع مقادیر مولی که به دست آوردهایم به دست میآید.
حجم کلی محلول نیز با استفاده از جمع حجمهای داده شده به دست میآید.
در نهایت برای محاسبه غلظت مولی کل محلول میتوانیم میزان مول کلی را بر حجم کل تقسیم کنیم.
حال با توجه به مثال حل شده به راحتی میتوانیم به فرمولی کلی برای محاسبه غلظت مولی محلولهای چندتایی دست یابیم. مقدار مول هر محلول از ضرب غلظت مولی آن در حجم آن به دست میآید. پس میزان غلظت مولی این محلولها را میتوان با استفاده از فرمول زیر محاسبه کرد.
برای درک بهتر اینگونه مسائل، به مثال های زیر دقت کنید.

مثال ۱
چه حجمی از محلول ۴٫۵ مولار اسید کلریدریک با مخلوط کردن محلول ۵٫۵۶۵ مولار اسید کلریدریک با ۲۵۰ میلیلیتر محلول ۳٫۵۵ از آن به دست میآید؟
پاسخ
برای حل این سوال، از فرمول قسمت قبل بهره میبریم و حجم مجهول را برابر X قرار میدهیم. بدین ترتیب خواهیم داشت:
بدین ترتیب، حجم محلول ۴٫۵ مولار برابر با ۰٫۴۵۶۵ لیتر است. این مقدار از جمع مقدار x با ۲۵۰ میلیلیتر به دست آمده است.
مثال ۲
حجم ۴۰ میلیلیتر از محلول ۱٫۸ مولار نیترات آهن (III) با ۲۱٫۵ میلیلیتر از محلول ۰٫۸۰۸ مولار از همین محلول مخلوط شده است. میزان غلظت نهایی محلول را محاسبه کنید.
پاسخ
بازهم میتوانیم از فرمول قسمت قبل استفاده کنیم.
غلظت مولی یونها در محلول
همانطور که در ابتدای این مطلب مشاهده کردید، ممکن است در سوالی، میزان غلظت یک یون از شما خواسته شود. برای حل اینگونه مسائل باید واکنش تفکیک ترکیب یونی را در آب بنویسید.
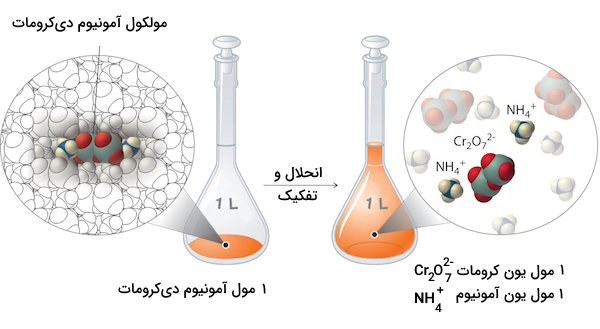
ترکیبات یونی و اسیدها و بازهای قوی در صورت حل شدن در آب، به یونهای سازنده شان تفکیک میشوند. برای نوشتن معادله تفکیک یونها، ابتدا باید آنیون و کاتیون را از هم تشخیص دهیم و سپس زیروند کاتیون را بار آنیون، و زیروند آنیون را بار کاتیون قرار دهیم. همچنین، تعداد اتمهای سمت چپ و راست معادله باید برابر باشند و معادله واکنش موازنه باشد. برای مثال به معادله واکنش تفکیک آمونیوم دی کرومات در آب دقت کنید.
همانطور که مشاهده میکنید در سمت چپ و راست معادله تعداد اتمها برابر است. حال با استفاده از ضرایب استوکیومتری به دست آمده میتوانیم میزان غلظت مولی یونهای مختلف را محاسبه کنیم. برای مثال، اگر غلظت آمونیوم دی کرومات در محلول ۲۵۰ میلیلیتری آن، ۱٫۴۳ مول بر لیتر باشد، غلظت یون کرومات در آن محلول نیز ۱٫۳۴ مول بر لیتر و غلظت یون آمونیوم، دو برابر آن یعنی ۲٫۸۶ مول بر لیتر خواهد بود.
برای درک بهتر اینگونه سوالات، به مثال های زیر توجه کنید.
مثال ۱
میزان غلظت مولی یونهای حاصل از محلول ۰٫۰۰۱۲ مولار باریم هیدروکسید چیست؟
پاسخ
برای پاسخ به این سوال، ابتدا معادله تفکیک باریم هیدروکسید را در آب مینویسیم.
با توجه به ضرایب استوکیومتری حاصل از واکنش تفکیک، غلظت یون باریم ۰٫۰۰۱۲ مول بر لیتر و غلظت یون هیدروکسید ۰٫۰۰۲۴ مول بر لیتر خواهد بود.
مثال ۲
میزان غلظت مولی یونهای موجود در محلول ۰٫۱۷ مولار سدیم سولفات چیست؟
پاسخ
مانند مثال قبل، ابتدا معادل تفکیک سدیم سولفات در آب را می نویسیم.
با توجه به ضرایب استوکیومتری به دست آمده از واکنش تفکیک این ماده، میزان غلظت مولی یون سدیم در این محلول برابر ۰٫۳۴ مول بر لیتر و غلظت یون سولفات در این محلول برابر ۰٫۱۷ مول بر لیتر است.
تفاوت غلظت مولی و مولالیته
غلظت مولی یا مولاریته یکی از رایجترین واحدهای اندازهگیری غلظت در شیمی است. این واحد غلظت به شکل تعداد مول ماده حلشونده در لیتر محلول یا حلال بیان میشود. غلظت مولی به دما وابسته است و میتواند با تغییر دما تغییر کند زیرا حلالیت مواد در محلولهای مایع به دما وابسته است.
از ظرف دیگر، مولالیته تعداد مولهای ماده حلشونده در یک کیلوگرم محلول تعریف میشود. مولالیته با تغییر دما تغییر نمیکند و ثابت میماند. فرمول محاسبه غلظت مولال به شکل زیر است.
در این فرمول (m) نشاندهنده غلظت مولال است که بر حسب مول بر کیلوگرم اندازهگیری میشود. (n) نشاندهنده مول حلشونده و (W) نشاندهنده کیلوگرم محلول یا حلال است.

انتخاب غلظت بین مولارته و مولالیته به خاصیت و ویژگیهای محلول مورد نظر بستگی دارد. معمولا اندازهگیری حجم در آزمایشگاه و اندازهگیریهای عملی راحتتر و دقیقتر از اندازهگیری جرم است و اندازهگیری جرم بیشتر با خطا مواجه میشود. به همین علت، استفاده از غلظت مولی در آزمایشگاه بسیار رایجتر از سایر روشهای اندازهگیری غلظت است. هرچند، در آزمایشهایی که دما تغییر میکند، اندازهگیری غلظت مولال روش دقیقتری خواهد بود.
تفاوت غلظت مولی و نرمالیته
بین پارامترهای غلظت مولی و نرمالیته رابطه بسیار نزدیکی است. در قسمتهای قبل آموختیم غلظت مولی چیست. غلظت مولی تعداد مولهای موجود در یک لیتر محلول را مشخص میکند. اما نرمالیته تعداد اکیوالان گرم ماده را در محلول مشخص میکند. در واقع، نرمالیته میتواند به عنوان ضریبی از غلظت مولی تعریف شود.
درحالیکه غلظت مولی، غلظت ترکیبات مختلف یا یونها را در یک محلول مشخص میکند، نرمالیته تنها مشخص کننده غلظت مولار مواد اسیدی یا بازی در محلول است. برای تبدیل غلظت مولی به نرمالیته میتوان از رابطه زیر استفاده کرد.
تعداد اکیوالان ÷ جرم مولی = نرمالیته
برای برخی از محلولها، میزان غلظت مولی و نرمالیته با هم برابر میشود. این رابطه هنگامی برقرار میشود که تعداد اکیوالانهای ماده اسیدی یا بازی برابر یک باشد. برای مثال در مورد غلظت مولی اسیدی مانند هیدروکلریک اسید، غلظت مولی با نرمالیته برابر است.
عوامل موثر بر غلظت مولی
مقدار غلظت مولی میتواند با تغییرات دما و فشار تغییر کند. تا اینجا آموختیم غلظت مولی چیست و چگونه محاسبه میشود. همانطور که در قسمتهای قبل توضیح داده شد غلظت مولی ممکن است با شرایط مختلف مانند دما تغییر کند و به همین علت در برخی از محاسبات نیاز است تا روشهای اندازهگیری غلظت دیگری مانند مولالیه به جای آن استفاده شود.
در ادامه عوامل تاثیرگذار بر غلظت مولی را توضیح میدهیم.
اثر دما
با افزایش دما، میزان غلظت مولی محلول کاهش مییابد. در قسمتهای قبل آموختیم که فرمول محاسبه غلظت مولی چیست. غلظت مولی از تقسیم مول حلشونده بر لیتر حلال به دست میآید. با افزایش دمای محیط و جذب شدن این دما توسط محلول، حجم حلال افزایش میابد. این افزایش حجم باعث کاهش میزان غلظت مولی محلول میشود.
اثر فشار
با افزایش فشار محلول، میزان غلظت مولی افزایش مییابد. همانطور که گفته شد، میزان غلظت مولی، تابعی از حجم محلول است. از آن جا که حجم مایعات، تابعی از فشار است و با تغییر فشار میتواند تا حدودی تغییر کند، غلظت مولی نیز با تغییر فشار تغییر خواهد کرد.
یادگیری محلول سازی با فرادرس
درک این مفهوم که غلظت مولی چیست یکی از کاربردیترین قدمها برای کار با مواد و وسایل در آزمایشگاه شیمی و انجام واکنشهای شیمیایی است. بسیاری از واکنشهای شیمیایی تنها در فاز محلول انجامپذیر هستند و به همین علت یادگیری اینکه غلظت مولی آنها در محلول چیست و چگونه محاسبه میشود بسیار حائز اهمیت است. با یادگیری این مفاهیم قادر خواهید بود آزمایشهایی همچون تیتراسیون را انجام دهید و سرعت واکنشهای شیمیایی را اندازه بگیرید. پیشنهاد میکنیم برای درک بهتر این مفاهیم و آزمایشها به مجموعه فیلم آموزش محلولسازی در آزمایشگاه فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم پرداخته است.
همچنین، با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است، میتوانید به آموزشهای بیشتری در زمینه محلولسازی دسترسی داشته باشید.
کاربرد غلظت مولی
در این مطلب از مجله فرادرس آموختیم غلظت مولی چیست و چگونه محاسبه میشود. به دست آوردن این واحد غلظت برای محلولها در بسیاری از مسائل و آزمایشهای عملی در آزمایشگاه کاربرد دارد. در ادامه برخی از این کاربردها را نام میبریم.
- از غلظت مولی برای پیدا کردن سایر واحدهای غلظت محلول مانند مولالیته یا نرمالیته استفاده میشود.
- از غلظت مولی در واکنشهای اسید – باز و روش تیتراسیون بسیار استفاده میشود.
- از غلظت مولی برای به دست آوردن میزان صحیح مواد مورد نیاز برای شرکت در واکنشهای مختلف استفاده میشود.
علاوه بر توضیحاتی که که در بالا دادیم، به این نکته نیز باید اشاره کنیم که غلظت مولی یکی از پارامترهای اصلی برای محاسبه سرعت واکنشهای شیمیایی است.
source