انرژی شیمیایی انرژی است که در پیوندهای شیمیایی و ترکیبات شیمیایی ذخیره شده است و با انجام واکنشهای شیمیایی آزاد میشود. انرژی شیمیایی در واقع انرژی پتانسیل ذخیره شده در پیوندهای مواد شیمیایی است. این انرژی بدون انجام واکنش شیمیایی قابل مشاهده نیست و میتواند به وسیله واکنشهای شیمیایی به انواع دیگری از انرژی مانند انرژی جنبشی یا انرژی حرارتی تبدیل شود. در این مطلب از مجله فرادرس میآموزیم انرژی شیمیایی چیست و چگونه به فرمهای دیگر انرژی تبدیل میشود.

در ابتدای این مطلب میآموزیم انرژی شیمیایی چیست و مثالهایی را برای درک بهتر آن ارائه میکنیم. سپس انرژی پتانسیل شیمیایی را تعریف کرده و انواع انرژی را نام میبریم. در ادامه، تبدیل انرژی پتانسیل را به انرژی شیمیایی بررسی کرده و مقدار آن را بررسی میکنیم. سپس روشهای تبدیل انرژی شیمیایی به سایر انرژیها را بررسی کرده و فرمول و روش محاسبه این انرژی را توضیح میدهیم. در قدم بعدی، انرژی پیوندها و آزاد شدن انرژی شیمیایی از آنها را بررسی میکنیم. میآموزیم رابطه ترمودینامیک و انرژی شیمیایی چیست و عوامل تاثیرگذار بر انرژی شیمیایی چیست. در نهایت، معایب، مزایا و کاربرد انرژی شیمیایی را برمیشماریم. با مطالعه این مطلب تا انتها میتوانید با این مفهوم مهم در شیمی آشنا شوید.
انرژی شیمیایی چیست؟
انرژی شیمیایی در پیوندهای بین اتمها یا پیوند بین مولکولها ذخیره شده است. به دلیل اینکه این انرژی ذخیره میشود، یک نوع انرژی پتانسیل به حساب میآید. هنگامی که یک واکنش شیمیایی انجام میشود، این انرژی آزاد میشود. انرژی شیمیایی یکی از ۶ نوع اصلی انرژی یعنی انرژی شیمیایی، انرژی الکتریکی، انرژی گرمایی، انرژی مکانیکی، انرژی هسته ای و انرژی تابشی است. این انرژی یا به فرم دیگری از انرژی تبدیل میشود یا به انرژی شیمیایی مواد جدید تبدیل میشود.
انرژی شیمیایی یکی از انواع انرژی است. اتمها که از کوچکترین اجزای سازنده مواد هستند میتوانند با یکدیگر ترکیب شده و ترکیبهای مختلف را به وجود بیاورند. انرژی شیمیایی همان نیرویی است که اتمها و مولکولهای را در یک ترکیب شیمیایی کنار یکدیگر نگه میدارد. با شکستن و تشکیل پیوند بین اتمها یا مولکولهای یک ماده، یک واکنش شیمیایی رخ میدهد. واکنش شیمیایی فرآیندی است که در آن یک یا تعداد بیشتری ماده به مواد شیمیایی دیگری تبدیل میشوند.
انرژی شیمیایی یکی از مهمترین انواع انرژی است که برای ادامه حیات جانوران و گیاهان ضروری است. انرژی شیمیایی در غذاها، چوب، انواع سوخت، باتری و … وجود دارد و میتواند به انواع دیگری از انرژی مانند انرژی الکتریکی تبدیل شود. تمامی سوختها دارای انرژی شیمیایی هستند.

انرژی برای انجام کار مورد نیاز است. در مباحث علمی، کار به نیروی مورد نیاز برای جابهجایی اجسام گفته میشود. بر اساس این تعاریف، انرژی شیمیایی، انرژی آزاد شده در صورت انجام واکنشهای شیمیایی است. با انجام واکنشهای شیمیایی ممکن است مواد جدیدی تولید شوند. با تولید این مواد و آزاد شدن انرژی میتوان کار انجام داد.
انرژی نقشی مهم در واکنشهای شیمیایی دارد. با تشکیل پیوندهای شیمیایی جدید، انرژی آزاد میشود. بالعکس، با شکستن پیوند بین اتمها و مولکولها، انرژی مصرف میشود. واکنشهای شیمیایی میتوانند گرماده یا گرماگیر باشند. اگر واکنشدهندهها جفت الکترونهای پیوندی ضعیفی داشته باشند و با پیوند برقرار کردن، مواد پایدارتری را تشکیل بدهند، انرژی آزاد میشود.
یادگیری علوم هفتم با فرادرس
انرژی شیمیایی از مباحثی است که در علوم تجربی پایه ششم به آن اشاره شده و در علوم تجربی پایه هفتم بیشتر توضیح داده میشود. برای شناخت و یادگیری اینکه انرژی شیمیایی چیست در علوم ششم باید با مفاهیمی مانند انرژی، اتم، مولکول، واکنش شیمیایی و .. آشنا شوید. همچنین، با شناخت انرژی شیمیایی میتوانید در مقاطع بالاتر مفاهیمی مانند آنتالپی، آنتروپی، قوانین ترمودینامیک و .. را بیاموزید. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم به مجموعه فیلم آموزش دروس پایه هفتم، بخش علوم تجربی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است، میتوانید به آموزشهای بیشتری درباره انرژی شیمیایی دسترسی داشته باشید.
مثال انرژی شیمیایی
در قسمت قبل آموختیم انرژی شیمیایی چیست. مثالهای زیادی از انرژی شیمیایی در زندگی روزمره وجود دارد. از انواع مثالهای آن میتوان به غذا، پروپان، باتری ماشین، مواد منفجره و بنزین اشاره کرد.
برای درک این انرژی، به سوختن گاز شهری فکر کنید که با استفاده از گرمای آن پخت و پز میکنید. واکنش انجام شده در سوختن گاز شهری به شکل زیر است.
یکی دیگر از انواع انرژی شیمیایی، در باتری گوشیهای موبایل وجود دارد. هر گوشی موبایل یک باتری دارد که با انرژی الکتریکی شارژ میشود. الکتریسیته باعث انجام یک واکنش شیمیایی درون باتری موبایل میشود.
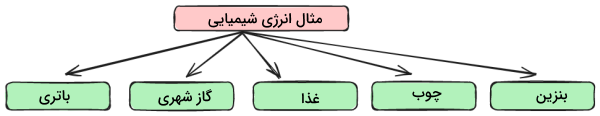
چوب یکی دیگر از منابع انرژی پتانسیل شیمیایی است. این منبع تجدیدپذیر حاوی هیدروکربنهایی است که با سوختن گرما آزاد میکنند. در ادامه، این انواع انرژی شیمیایی و برخی دیگر از مثالهای آن را نام میبریم.
- ذغال سنگ: در این منبع، سوختن باعث تبدیل انرژی شیمیایی به انرژی حرارتی میشود.
- چوب: در این منبع، واکنش سوختن باعث تبدیل انرژی شیمیایی به انرژی گرمایی میشود.
- بنزین: انرژی شیمیایی در این منبع میتواند با واکنش سوختن به نور و گرما تبدیل شود یا اینکه به فرم دیگری از ماده شیمیایی با یک انرژی شیمیایی جدید تبدیل شود.
- باتریهای شیمیایی: این منبع میتواند انرژی شیمیایی را ذخیره کرده و آن را به الکتریسیته تبدیل کند.
- زیست توده: در این منبع، واکنش سوختن انرژی شیمیایی را به حرارت و نور تبدیل میکند.
- گاز طبیعی: در این منبع، سوختن باعث تبدیل انرژی شیمیایی به انرژی حرارتی و انرژی تابشی میشود.
- غذا: هضم غذا، انرژی شیمیایی غذا را به انواع دیگر انرژی برای مصرف سلول تبدیل میکند.
- کمپرس یخ: انرژی شیمیایی با انجام یک واکنش شیمیایی در این وسیله جذب میشود.
- پروپان: انرژی شیمیایی پروپان با سوختن به نور و انرژی حرارتی تبدیل میشود.
- کمپرس گرم: در این وسایل، یک واکنش شیمیایی باعث تبدیل انرژی شیمیایی به انرژی حرارتی میشود.
- فتوسنتز: این واکنش، انرژی خورشیدی را به انرژی انرژی شیمیایی تبدیل میکند.
- تنفس سلولی: این فرآیند، شامل چند واکنش شیمیایی است که انرژی شیمیایی گلوکز را به انرژی شیمیایی ATP تبدیل میکند.

انرژی پتانسیل شیمیایی چیست؟
انرژی پتانسیل به انرژی گفته میشود که در جسمی ذخیره شده باشد. انرژی پتانسیل شیمیایی نیز مانند انرژی پتانسیل ذخیره میشود اما این انرژی درون پیوندهای شیمیایی بین اتمها یا مولکولها ذخیره شده است.
برای درک بهتر اینکه انرژی پتانسیل شیمیایی چیست، ماده شیمیایی بنزین را در نظر بگیرید. بنزین یا گازوئیل موجود در مخزن بنزین وسایل نقلیه، با وارد شدن به موتور میسوزد. با سوختن این سوختها، مواد جدیدی مانند کربن دی اکسید تولید میشود. این واکنش شیمیایی باعث تولید انرژی قابل توجهی میشود که این انرژی باعث حرکت و کارکردن ماشین میشود. یک مثال دیگر، انرژی تولید شده در نیروگاهها است. در نیروگاهها با سوختن ذغالسنگ، گاز طبیعی یا سوختهای فسیلی، انرژی الکتریکی تولید میشود.

انرژی پتانسیل شیمیایی یک انرژی ذاتی است که در پیوندهای بین مواد ذخیره شده است. این انرژی به ترکیب مواد و ترتیب قرارگیری اتمها بستگی دارد و برای هر ترکیبی منحصر به فرد است. تمامی مواد شامل مقداری انرژی پتانسیل شیمیایی هستند و این انرژی به طبیعت و قدرت پیوندهای شیمیایی درون ترکیب شیمیایی بستگی دارد.
بنابر قانون پایستگی انرژی، انرژی نه به وجود میآید و نه از بین میرود تنها از حالتی به حالت دیگر تبدیل میشود. با انجام گرفتن واکنشهای شیمیایی، مولکولها تغییر شکل داده و پیوندهایی جدید میسازند تا مواد جدیدی تولید کنند. انرژی جذب شده یا آزاد شده طی این فرآیند عموما به شکل گرما و نور تغییر میکند.
محاسبه انرژی پتانسیل شیمیایی مواد غذایی
یکی از مهم ترین کاربردهای شناخت اینکه انرژی شیمیایی چیست، محاسبه انرژی موجود در مواد غذایی است. انرژی مواد غذایی انرژی شیمیایی است که جانوران و انسانها با هضم مواد غذایی به دست میآورند. برخی از مواد غذایی مانند آب و فیبر انرژی پتانسیل شیمیایی بسیار کم یا صفر دارند اما مصرف آنها برای حفظ سلامتی بدن نیاز است. در کتب فارسی فرمولی برای محاسبه انرژی مواد غذایی آورده شده است که به شکل زیر است.
در این فرمول، e مقدار انرژی موجود در واحد جرم ماده غذایی و m مقدار جرم ماده غذایی است. انرژی موجود در مواد غذایی میتواند بر حسب ژول، کیلوژول یا کالری اندازهگیری شود. برای مثال، یک گرم گلوکز، ساکارز و نشاسته به ترتیب ۱۵٫۵۷، ۱۶٫۴۸ . ۱۷٫۴۸ کیلوژول بر گرم انرژی دارند.
انرژی شیمیایی چگونه از انرژی پتانسیل به دست میآید؟
در قسمتهای قبل آموختیم انرژی شیمیایی چیست. انرژی آزاد شده به عنوان انرژی شیمیایی، از قانون پایستگی انرژی پیروی میکند. این قانون بیان میکند که انرژی نمیتواند از بین رفته یا به وجود بیاید تنها از نوعی انرژی به نوع دیگی تبدیل میشود. انرژی ذخیره شده در مواد مختلف (انرژی پتانسیل)، هنگامی که اتمها یا مولکولها به شکل دیگری به هم متصل میشوند تا ماده جدیدی را تولید کنند، به انرژی شیمیایی تبدیل میشود.
برای مثال غذا یکی از بهترین مثالها برای توضیح انرژی شیمیایی است. به عنوان مثال، یک سیب را در نظر بگیرید. درخت سیب انرژی خورشید را به وسیله فتوسنتز به کربوهیدراتهایی مانند گلوکز تبدیل میکند. گلوکز یک منبع برای ذخیره انرژی پتانسیل است.
هنگامی که یک سیب را میخوریم، بدن ما انرژی پتانسیل موجود در سیب را شکسته و به مولکولهای دیگری که شامل انرژی هستند تبدیل میکند. مقداری از ماده دارای انرژی پتانسیل مولکول، دچار تغییر شیمیایی میشود. این انرژی به ماده ای به نام آدنوزین تری فسفات (ATP) تبدیل میشود که یکی از مولکولهای حمل انرژی است که در سلول تمامی موجودات زنده وجود دارد.
واکنشهای شیمیایی همچنین میتوانند انرژی حرارتی را دریافت یا آزاد کنند. به واکنشهای شیمیایی که گرما را آزاد میکنند، گرماده و به واکنشهای شیمیایی که برای انجام شدن نیاز به دریافت انرژی حرارتی دارند، گرماگیر گفته میشود. در ادامه هریک از این واکنشها را توضیح میدهیم.
واکنش گرماده چیست؟
واکنش گرماده واکنش است که طی انجام شدن آن گرما آزاد میشود. در واقع در این واکنشها، سطح انرژی مواد فرآورده (تولید شده) کمتر از سطح انرژی مواد اولیه (واکنشدهنده) است.
این واکنشها با انجام شدن به محیط خود انرژی داده و باعث گرم شدن محیط میشوند. این درحالی است که انرژی خود واکنش (سیستم) کاهش یافته و سرد میشود. میزان پایداری مواد فرآورده در این واکنشها بیشتر از واکنشدهندهها است.
واکنشهای سوختن
این واکنشها که با نام واکنش احتراق نیز شناخته میشوند، به فرآیندی گفته میشوند که یک ماده با اکسیژن هوا واکنش داده و نور و گرمای زیادی آزاد کند. برای مثال، سوختن گاز شهری، بنزین و چوب همگی از این نوع واکنش شیمیایی هستند.
واکنش اکسیداسیون
این واکنش به مواردی گفته میشود که یک ماده با اکسیژن وارد واکنش شده و اکسید تولید کند. سوختن نیز میتواند یک واکنش اکسیداسیون در نظر گرفته شود. طی این فرآیند ها گرما آزاد میشود.
واکنش خنثی شدن
واکنش خنثی شدن به واکنش بین اسیدها و بازها گفته میشود. این واکنشها که با آزاد شدن گرما همراه هستند، مواد پایدار نمک اسید و آب را تولید میکنند. واکنش بین سرکه و جوش شیرین یک واکنش خنثی شدن است.
واکنش گرماگیر چیست؟
واکنش گرماگیر واکنشی است که برای انجام شدن به دریافت انرژی اولیه نیاز دارد. این واکنشها در صورتی که به آنها انرژی داده نشود، به صورت خودبهخودی انجام نمیشوند. این واکنش با دریافت انرژی، دمای محیط را پایین میآورد. این درحالی است که خود ظرف واکنش (سیستم) گرم میشود. در این واکنشها، انرژی مواد تولید شده (فرآورده) بیشتر از واکنشدهندهها است.
این بدین معنی است که میزان پایداری واکنشدهنده ها بیشتر از فرآوردهها است. یکی از مثالهای این واکنشها، فرآیند فتوسنتز است. گیاهان به علاوه نور، گرمای خورشید را نیز جذب میکنند. با جذب حرارت خورششید، فتوسنتز انجام میشود.
رابطه انرژی شیمیایی و آنتالپی
در قسمتهای قبل آموختیم انرژی شیمیایی چیست و انرژی میتواند در واکنشهای شیمیایی آزاد یا جذب شود. این انرژی برابر با مقدار میزان اختلاف سطح انرژی پتانسیل شیمیایی مواد واکنشدهنده و فرآورده است. اگر میزان انرژی پتانسیل شیمیایی مواد واکنشدهنده بیشتر باشد، واکنش انرژی آزاد میکنند. اگر میزان انرژی پتانسیل شیمیایی فرآوردهها بیشتر باشد، واکنش انرژی را دریافت میکند.
این تغییرات انرژی میتواند با استفاده از میزان انرژی پیوند مواد واکنشدهنده و فرآورده محاسبه شود. همچنین، این میزان انرژی را میتوان با استفاده از میزان انرژی درونی تولید مولکولهای فرآورده و میزان انرژی درونی تولید مولکولهای واکنشدهنده به دست اورد. میزان تغییر انرژی درونی یک واکنش شیمیایی برابر با میزان حرارت مبادله شده در حجم ثابت و دمای ابتدایی و پایانی برابر است. اما در شرایط دیگر مانند شرایط فشار ثابت که درب ظرف واکنش باز باشد، میزان تغییرات گرما همراه برابر با میزان تغییر انرژی درونی واکنش نخواهد بود.
میزان گرمای مبادله شده در فشار ثابت برابر با میزان تغییرات آنتالپی واکنش خواهد بود. هرچه میزان انرژی شیمیایی آزاد شده از یک واکنش بیشتر باشد، نشاندهنده پایداری فرآوردههای آن واکنش است.
تبدیل انرژی شیمیایی به سایر انرژی ها
در قسمتهای قبلی آموختیم انرژی شیمیایی چیست و توضیح دادیم که این انرژی از بین نمیرود و به فرمهای دیگر انرژی تبدیل میشود. در ادامه، توضیح میدهیم روش تبدیل انرژی شیمیایی به سایرحالات انرژی مانند انرژی گرمایی، انرژی جنبشی، انرژی تابشی، انرژی الکتریکی و … چیست.
در مباحث ترمودینامیکی، تبدیل انرژی شیمیایی به انرژی گرمایی کاربردهای فراوانی دارد. این تبدیل انرژی، هسته اصلی تبدیلهای انرژی مختلف و فرآیندهایی است که در ترمودینامیک بررسی میشود. اولین قانون ترمودینامیک، که این تبدیلهای انرژی را توجیه میکند، بیان میکند که انرژی نه به وجود میآید و نه از بین میرود و تنها از حالتی به حالت دیگر تبدیل میشود. انرژی آزاد شده به شکل انرژی گرمایی در واقع انرژی بوده که در مواد شیمیایی و در پیوندهای بین مولکولهای آنها ذخیره شده است.
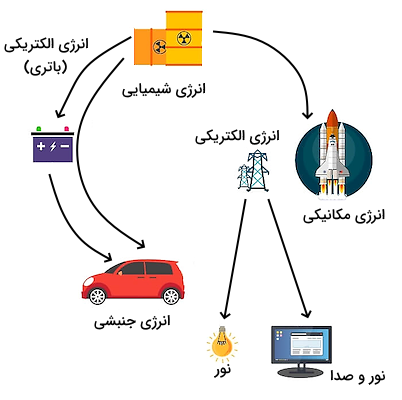
درواقع در مقیاس عملی، تبدیل انرژی گرمایی و آزاد شدن و دریافت آن راحتتر از باقی فرمهای تبدیل انرژی است. این انرژی میتواند برای گرم شدن محیط یا تولید سایر انواع انرژی به کار رود. برای مثال، در نیروگاههای برق از انرژی گرمایی برای تولید بخار و سپس انتقال انرژی فشار بخار برای حرکت توربین و تولید انرژی مکانیکی و سپس تولید الکتریسیته استفاده میشود. به همین علت، در نیروگاههای برق از موادی مانند ذغال سنگ یا گاز و سوزاندن آنها بری تولید انرژی حرارتی استفاده میشود.
چکیده این تبدیل انرژی در نیروگاهها میتواند به شکل زیر نوشته شود.
تبدیل انرژی شیمیایی به انرژی گرمایی، انرژی گرمایی به انرژی مکانیکی، انرژی مکانیکی به الکتریسیته
تبدیل انرژی شیمیایی به انرژی گرمایی
تبدیل انرژی شیمیایی به انرژی گرمایی یکی از رایجترین تبدیلهای انرژی است که در زندگی روزمره بسیار مشاهده میشود. این تغییر زمانی انجام میشود که پیوند بین اتمها شکسته شده و پیوندهای جدیدی تولید میشوند و انرژی آزاد میشود. این فرآیند و تبدیل انرژی شیمیایی به انرژی گرمایی تنها در فرآیندهای گرماده صورت میگیرد. فرآیند های گرماگیر به شکلی عکس عمل کرده و انرژی گرمایی را به انرژی شیمیایی تبدیل میکنند.
فرآیند تبدیل انرژی شیمیایی به انرژی گرمایی با انرژی پتانسیل ذخیره شده در پیوند بین مواد واکنشدهنده آغاز میشود. این انرژی در طی فرآیند واکنش شیمیایی آزاد شده یا تبدیل میشود. سپس این انرژی به صورت انرژی گرمایی به محیط اطراف واکنش منتقل میشود. یکی از بهترین مثالهای این تبدیل انرژی، تبدیل انرژی شیمیایی واکنش سوختن متان به انرژی گرمایی است. معادله این واکنش به شکل زیر است.
در این واکنش، گاز متان و اکسیژن، مقدار زیادی انرژی پتانسیل شیمیایی ذخیره شده دارند. با واکنش دادن این دو ماده که معمولا با جرقهای کوچک آغاز میشود، این مولکولها شکسته شده و پیوندهای جدیدی برای تولید کربن دی اکسید و آب تشکیل میشود. انرژی پتانسیل ذخیره شده در آن مولکولها بدین ترتیب به شکل انرژی گرمایی آزاد میشود. همچنین، مقداری انرژی نیز به صورت نور آزاد میشود.

این روش تبدیل انرژی بیشتر در همهی انواع سوختن سوختهای مختلف، سوختن چوب، سوختن شمع، تنفس سلولی، باتریها و … انجام میشود.
یکی از مهمترین مسائلی که امروزه شیمیدانها و مهندسان محیط زیست با آن روبهرو هستند، بحث انرژی تجدیدپذیر و پاک است. با تغییرات اقلیمی به وجود امده، کاهش منابع آب و آلودگی هوا و محیط زیست، دانشمندان همواره پی راههایی برای جایگزین کردن انرژی تجدیدپذیر و پاک با انرژیهای قدیمی مانند سوخت فسیلی هستند. پیشنهاد میکنیم برای یادگیری بیشتر درباره این انواع انرژی، فیلم آموزش آشنایی با انرژی پایدار فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
تبدیل انرژی شیمیایی به انرژی الکتریکی
از انرژی شیمیایی در سرتاسر دنیا برای تولید حرارت و الکتریسیته استفاده میشود. هنگامی که سوختهای فسیلی مانند متان، گاز طبیعی، روغن و بنزین میسوزند، از انرژی آزاد شده توسط آنها، برای تولید بخار پرفشار استفاده میشود که به وسیله آن، توربینهای تولید الکتریسیته به حرکت در میآیند. همچنین، از سلولهای الکتروشیمیایی مانند استفاده از سلولهای گالوانی نیز برای این تبدیل انرژی استفاده میشود. حال که میدانیم انرژی شیمیایی چیست، میتوانیم روش تبدیل آن را در سلولهای الکتروشیمیایی بررسی کنیم.
سلول گالوانی
یکی از روش های تبدیل مستقیم انرژی شیمیایی به انرژی الکتریکی، استفاده از سلولهای گالوانی است. سلولهای گالوانی، انرژی واکنشهای شیمیایی را به انرژی الکتریسیته تبدیل میکنند. این واکنشها، واکنشهای اکسایش کاهش (ردوکس) هستند. در این واکنشها، الکترون بین مواد جابهجا میشود. در سلول گالوانی، الکترونها از قطب منفی سلول (آند) که در آن اکسایش رخ میدهد به کاتد (قطب مثبت) که در آن کاهش انجام میشود حرکت میکنند. این حرکت الکترونها باعث ایجاد جریان الکتریسیته میشود. در یک سلول گالوانی، واکنش شیمیایی به شکل خودبهخودی و بدون نیاز به اعمال نیرو یا جریان خارجی انجام میشود.
برخلاف آن سلول های الکتروشیمیایی دیگری به نام سلول الکترولیتی وجود دارند که انرژی الکتریکی را به انرژی شیمیایی تبدیل میکنند. در این سلولها وجود جریان الکتریکی برای انجام شدن واکنش شیمیایی لازم و ضروری است. در این سلولها، جریان الکتریسیته از یک منبع خارجی تامین میشود و به سلول اعمال میشود تا واکنش اکسایش کاهش انجام شود. در این سلولها، آند قطب مثبت سلول است و به قطب مثبت باتری متصل میشود. برخلاف آن، کاتد قطب منفی سلول است و به سر منفی باتری متصل میشود. این سلولها معمولا در فرآیندهای الکترولیز مواد مختلف مانند تجزیه آب به هیدروژن و اکسیژن استفاده میشوند.
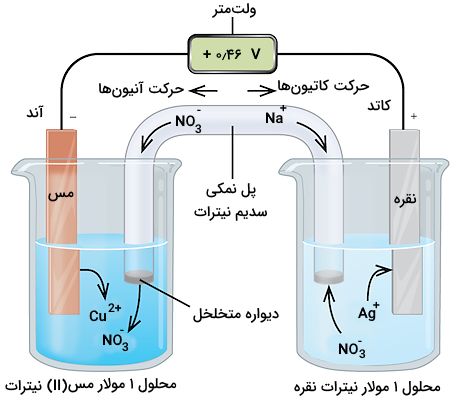
سازوکار سلول گالوانی
سلولهای گالوانی که انرژی شیمیایی را به انرژی الکتریکی تبدیل میکنند، از دو نیم سلول تشکیل شدهاند که در یکی از آنها، واکنش اکسایش انجام شده و در دیگری واکنش کاهش اتفاق میافتد. دو الکترود فلزی در این نیم سلولها قرار می گیرد که هر یک در محلول الکترولیتی قرار میگیرند که شامل یونهای فلزی آنها باشد. همچنین، یک پل نمکی یا یک غشا متخلخل برای حرکت آزادانه یونها و ایجاد جریان الکتریکی، دو سلول را به هم متصل میکند. یک مدار خارجی، دو الکترود را به یکدیگر متصل میکند تا جریان الکتریکی برقرار شود. در تصویر زیر، یک سلول گالوانی برای فلزات نقره و مس را مشاهده میکنید که به اندازه ۱٫۱ ولت جریان الکتریکی تولید میکند.
کاربرد تبدیل انرژی شیمیایی به انرژی الکتریکی
از این روش تبدیل انرژی شیمیایی به الکتریکی در صنایع و کاربردهای مختلفی استفاده میشود. در ادامه برخی از این کاربردها را توضیح میدهیم.
باتری برای وسایل و لوازم خانگی
برخی از سلولهای گالوانی اولیه مانند سلولهای آلکالین به طور گسترده برای استفاده به عنوان باتری کنترلهای تلویزیون، چراق قوه، باتری، اسباب بازی و … استفاده میشوند. این باتریها منبع انرژی قابل اعتمادی برای وسایلی هستند که انرژی زیادی احتیاج ندارند.
باتری های قابل شارژ
باتریهای لیتیومی باتریهایی هستند که به شکلی گسترده در وسایل مختلفی مانند گوشیهای موبایل، لپتاپ، تبلت و وسایل دیگری مانند ساعت مچی هوشمند استفاده میشوند. این باتریها به علت میزان انرژی بالا و قابلیت شارژ شدن مجدد استفاده میشوند. همچنین، باتریهایی مانند باتریهای نیکل هیبرید نیز در وسایلی مانند دوربینهای عکاسی، تلفنهای بیسیم و برخی وسایل هیبریدی استفاده میشوند.
جلوگیری از خوردگی فلزات
سلول های گالوانی نقشی مهم در جلوگیری از خوردگی فلزات دارند. برای مثال، آندهای فدا شونده مانند روی یا منیزیم به بدنه کشتیها، لولههای اتصال ساختمانی یا سایرلوازمی که ممکن است دچار خوردگی شوند اعمال میشوند تا از خوردگی آنها جلوگیری شوند. این کار با استفاده از سلولهای گالوانی انجام میشوند. به روش استفاده از انرژی شیمیایی برای تبدیل به انرژی الکتریکی و جلوگیری از خوردگی فلزات، حفاظت کاتدی گفته میشود. پیشنهاد میکنیم برای اشنایی بیشتر با این روش، مطلب «حفاظت کاتدی چیست» از مجله فرادرس را مطالعه کنید. لینک این مطلب در ادامه آورده شده است.
سنسورها و تجهیزات اندازه گیری
سنسورهای گالوانی اکسیژنی برای اندازه گیری اکسیژن موجود در هوا یا مایعات مختلف استفاده میشوند. این سلولها در بسیاری از کاربرد های صنعتی و پزشکی مانند هواکشها یا سایر وسایل ازمایشگاهی استفاده میشوند.
تبدیل انرژی شیمیایی به انرژی تابشی
انرژی تابشی انرژی ایجاد شده حاصل از موجهای الکترومغناطیس هستند. این نوع از انرژی مستقل از جرم ماده است و در فضای خلأ نیز میتواند منتشر شود. برای مثال، نور خورشید یکی از مثالهای انرژی تابشی است. امواج الکترومغناطیسی در دو جهت عمود بر هم منتشر میشوند و میتوانند طول موج و فرکانسهای مختلفی را داشته باشند. تمامی انرژیهای تابشی مانند نور قابل مشاهد نیستند. برای مثال، امواج ایکس که در رادیوگرافی استفاده میشوند یا امواج فروسرخ و فرابنفش نیز انواعی از انرژی تابشی هستند.
تبدیل مستقیم
انرژی شیمیایی میتواند به شکلی مستقیم به انرژی تابشی (نور) تبدیل شود. یک مثال بارز این تبدیل انرژی در کرمهای شبتاب اتفاق میافتد. این واکنش که به وسیله سلولهای این موجودات و آنزیمی به نام لوسیفرین از انرژی شیمیایی دریافت شده توسط آنها انجام میشود، نور را به عنوان فرآورده واکنش آزاد میکند.
در واکنش زیر، عبارت (Luciferin) ماده لوسیفرین، (Luciferase) ماده لوسیفراز، (Oxyluciferin) ماده اکسیلوسیفرین و AMP ماده آدنوزین مونوفسفات است.

همچنین، تبدیل مستقیم انرژی شیمیایی به انرژی تابشی میتواند از طریق برخی از واکنشها مانند واکنشهای اکسیداسیون و واکنش سوختن نیز انجام شود. برای مثال، از سوزاندن چوب، انرژی شیمیایی تبدیل به انرژی گرمایی و تابشی (نور) میشود.
تبدیل غیرمستقیم
تبدیل انرژی شیمیایی به انرژی تابشی به شکل غیرمستقیم نیز میتواند انجام شود. در این روش، انرژی شیمیایی ابتدا به فرم دیگری از انرژی مانند الکتریسیته تبدیل میشود. همانطور که در قسمت قبل آموختیم، انرژی شیمیایی با استفاده از سلولهای الکتروشیمیایی گالوانی میتواند به انرژی الکتریکی تبدیل شود. این انرژی الکتریکی نیز میتواند به انتقال به لامپ و سایر وسایل روشنایی الکتریکی، به انرژی تابشی تبدیل شود.
چگونگی تبدیل انرژی شیمیایی به انرژی تابشی
انرژی شیمیایی با استفاده از واکنشهای شیمیایی خاصی میتواند به انرژی تابشی تبدیل شود. فوتونهای برانگیخته الکترومغناطیسی در یک فرکانس مشخص میتوانند در محدوده طول موج نور مرئی حرکت کرده و با انرژی جنبشی (حرکتی) خود نور تولید کنند. انرژی شیمیایی میتواند با واکنشهای شیمیایی گوناگون یا با استفاده از انتقال الکترون، به این نوع از انرژی تابشی تبدیل شود.
برانگیخته کردن الکترونهای ظرفیت اتمها با دادن مقدار کافی انرژی به آنها نیز میتواند باعث تولید انرژی تابشی شود. برای مثال، اگر به الکترون اتم هیدروژن انرژی دهیم، میتواند برانگیخته شده و با بازگشت به حالت اولیه (پایه) خود، گستره وسیعی از امواج الکترومغناطیسی با طول موج و فرکانسهای مختلف را تولید کند. این امواج الکترومغناطیسی تولید شده در واقع همان انرژی تابشی هستند. در این نوع از تبدیل انرژی، ابتدا باید به اتم انرژی داده شود. انرژی تابشی تولید شده در این روش تقریبا برابر با مقدار انرژی است که در ابتدا به اتم داده میشود.
مثال تبدیل انرژی شیمیایی به انرژی تابشی
- سوختن ذغال سنگ
- سوختن چوب
- باتریهای سلول خشک، نیکل- کادمیوم و لیتیومی
- فرآیند های بیولومینسنس موجود در برخی از جانوران مانند فیتوپلانکتونها
- واکنش هوا با مواد بسیار فعالی مانند پتاسیم
تبدیل انرژی شیمیایی به انرژی جنبشی
در قسمتهای قبلا آموختیم انرژی شیمیایی چیست. تبدیل انرژی شیمیایی به انرژی جنبشی به تبدیل انرژی موجود در مواد طی واکنشهای شیمیایی به حرکتی گفته میشود. در ادامه با مثالی، این تبدیل انرژی را توضیح خواهیم داد. سوختن بنزین موجود در اتوموبیلها و حرکت ماشین یکی از مثالهای تبدیل انرژی شیمیایی به انرژی جنبشی است.
مثال
بنزین یکی از فرآورده های تقطیر نفت خام است که به عنوان سوخت ماشینهای حمل و نقل استفاده میشود. این ترکیب که مخلوطی از هیدروکربنهای مختلف است با سوختن در موتور ماشینها، انرژی حرارتی تولید میکند. این انرژی حرارتی باعث منبسط شدن گازهای موجود در سیستم ماشین شده و پیستونی را حرکت میدهند. حرکت این پیستون باعث حرکت ماشین میشود. بدین شکل، یک تغییر شیمیایی و انرژی شیمیایی آزاد شده حاصل از آن، به انرژی جنبشی تبدیل میشود.

یکی دیگر از مثالهای تبدیل انرژی شیمیایی به انرژی حرکتی، در ایربگ (کیسه هوا) ماشینها اتفاق میافتد. کیسه هوای ماشینها حاوی مادهای شیمیایی به نام سدیم آزید است. با مشتعل شدن این ماده شیمیایی، گاز نیتروژن درون کیسه هوا باعث حرکت کردن و بزرگ شدن آن میشود. در نتیجه، یک واکنش شیمیایی باعث تبدیل انرژی شیمیایی آزاد شده از واکنش به انرژی جنبشی (حرکت مولکولهای گاز نیتروژن و باز شدن کیسه هوای ماشین) شده است.
مثال دیگری از تبدیل انرژی شیمیایی به انرژی جنبشی را میتوان در انفجار مواد آتش بازی مشاهده کرد. با احتراق مواد موجود در مواد آتشبازی مانند ذغال، گورد و پتاسیم نیترات، انرژی تولید شده از این واکنشهای شیمیایی به اندازهای زیاد است که میتواند این مواد آتشبازی را تا ارتفاعات زیادی به بالا پرتاب کند و انرژی شیمیایی این واکنشها را به انرژی جنبشی تبدیل کند.
مثال تبدیل انرژی شیمیایی به انرژی جنبشی
از مثالهای دیگر تبدیل انرژی شیمیایی به انرژی جنبشی، میتوان به موارد زیر اشاره کرد.
- موتورهای بخار قایقها و کشتیها
- سوختن ذغالسنگ برای حرکت قطارها
- حرکت عضلات بدن در نتیجه دریافت انرژی شیمیایی غذاها
- حرکت پرههای پهپاد در نتیجه انرژی شیمیایی باتری آنها
- حرکت عقربههای ساعت در نتیجه انرژی شیمیایی باتری آن
- پرتاب موشک در نتیجه واکنش احتراق سوخت موشک
تبدیل انرژی شیمیایی به انرژی هستهای
تبدیل مستقیم انرژی شیمیایی به انرژی هستهای ممکن نیست. زیرا انرژی شیمیایی حاصل از انجام واکنشهای شیمیایی است. پیوندهایی که مواد در واکنشهای شیمیایی تشکیل میدهند و پیوندهایی که شکسته میشوند، همگی به علت انتقالات الکترونی بین اتمها و مولکولهای اتفاق میافتد. اما انرژی هسته ای مربوط به تغییرات به وجود آمده درون ساختار هسته اتم است.
به همین علت نمیتوان مستقیما انرژی شیمیایی را به انرژی هسته ای تبدیل کرد. انرژی شیمیایی به شکلی غیرمستقیم و طی چند مرحله میتواند به انرژی هستهای تبدیل شود. در این روش، انرژی شیمیایی به عنوان سوخت برای تولید الکتریسیته مورد نیاز دستگاههای شتابدهنده ذره و سانتریفیوژ برای انجام فرآیندهای هستهای استفاده میشود.
فرمول انرژی شیمیایی چیست؟
در قسمتهای قبل آموختیم روش تبدیل انرژی شیمیایی چیست. مجموع انرژی شیمیایی یک مولکول برابر با جمع انرژی پتانسیل ذخیره شده در پیوندهایی است که اجزا مولکول را به یکدیگر متصل نگه داشتهاند. هنگامی که یک واکنش شیمیایی انجام میشود، تبدیل انرژی در مدلهای مختلفی اتفاق میافتد. این تبدیل انرژی به وسیله انرژی پیوندهای مواد واکنشدهنده و فرآورده انجام میشود. انرژی پیوند مواد مهمترین قسمت فرمول انرژی شیمیایی است. این میزان انرژی میتواند با استفاده از فرمول زیر محاسبه شود.
در این فرمول، مجموع انرژی شیمیایی است و نشاندهنده میزان انرژی هر پیوند در مولکول است.
یکی دیگر از مهمترین مفاهیم مهم در بررسی میزان انرژی شیمیایی مواد، تغییر آنتالپی () است. این پارامتر، میزان انرژی جذب شده یا آزاد شده در یک واکنش شیمیایی را اندازهگیری میکند.
آنتالپی چیست؟
انرژی شیمیایی موجود در واکنشهای شیمیایی گاهی با مفهوم آنتالپی نیز معرفی میشود. واکنشهای شیمیایی همواره دارای تغییر آنتالپی هستند. این تغییر آنتالپی مربوط به انرژی صرف شده برای شکستن پیوندها و انرژی آزاد شده از تشکیل پیوندهای جدید است.
تغییر آنتالپی، اختلاف بین انرژی واکنشدهندهها و فرآوردهها تعریف میشود. تغییر آنتالپی به شکل انرژی گرمایی آزاد شده یا صرف شده در یک واکنش شیمیایی است. انرژی گرمایی آزاد شده یا دریافت شده در وکنشهای شیمیایی میتواند بر حسب ژول بر مول یا کیلوژول بر مول اندازهگیری شود.
محاسبه تغییرات آنتالپی
تغییرات آنتالپی در یک واکنش شیمیایی میتواند به وسیله فرمول زیر اندازهگیری شود.
در این فرمول، () میزان تغییرات آنتالپی است که بر حسب ژول بر مول یا کیلوژول بر مول به دست میآید. (c) میزان ظرفیت گرمایی ویژه آب است که مقدار ثابت ۴٫۱۸ کیلوژول بر کیلوگرم درجه سانتیگراد را دارد. (m) جرم آب بر حسب کیلوگرم است و (T) میزان تغییرات دما بر حسب درجه سانتیگراد است.
یکی دیگر از روش های محاسبه تغییرات آنتالپی، استفاده از فرمول زیر است.
که در ان، میزان جمع مقادیر آنتالپی فرآوردهها و جمع مقادیر آنتالپی واکنشدهندهها است. هر پیوند شیمیایی یک انرژی تفکیک پیوند منحصر به فرد دارد . این انرژی میزان انرژی مورد نیاز برای شکستن آن پیوند است. برای مثال، تصویر کنید میخواهیم پیوند بین دو اتم هیدروژن (H–H) را بشکنیم. میزان انرژی تفکیک پیوند برای این مولکول برابر با ۴۳۵٫۸۸ کیلوژول بر مول است.
برای درک بهتر نحوه محاسبه انرژی یک واکنش شیمیایی به مثالها زیر توجه کنید.
مثال
یک محلول با حل کردن پتاسیم نیترات در ۵۰ سانتیمتر مکعب آب به دست آمده است. دمای این محلول از ۲۰٫۴ درجه سانتیگراد به ۱۸٫۷ درج سانتیگراد رسیده است. میزان تغییرات آنتالپی را برای این واکنش محاسبه کنید.
پاسخ
برای محاسبه تغییرات آنتالپی، باید مقادیر c و m و تغییر دما را بدانیم. مقدار c برابر با ۴٫۱۸ است و جرم آب با توجه به میزان چگالی آن که برابر با یک است، برابر با ۰٫۰۵ کیلوگرم میشود.
با توجه به صورت سوال، مقدار ۱٫۷ درجه سانتیگراد، تغییر دما داشتهایم. با جایگذاری این موارد در فرمول قسمت قبل، میتوانیم میزان تغییرات انرژی این واکنش را به دست آوریم.
محاسبه انرژی شیمیایی
محاسبه انرژی شیمیایی میتواند به فرمهای مختلفی مانند محاسبه با فرمول انرژی، محاسبه آنتالپی واکنش یا استفاده از انرژی آزاد گیبس انجام میشود. برای درک اینکه چگونه میتوان انرژی شیمیایی را محاسبه کرد، ابتدا باید با مفهوم انرژی آشنا باشیم.
ساده ترین تعریف انرژی در فیزیک این است که انرژی توانایی انجام کار است. به میزان نیرویی که برای انجام یک کار نیاز است، انرژی گفته میشود. این بدین معنی است که مقدار مشخصی از انرژی نیاز است که با جابهجایی با تبدیل برای انجام دادن کاری استفاده شود.
کار به عنوان ضرب نیرو در مسافت معرفی میشود. این تعریف شامل جرم و حرکت میشود زیرا نیرو نیز به عنوان ضربی از جرم و شتاب است. در نتیجه، کار در واقع یکی از کاربردهای انرژی است. برای مثال، انرژی شیمیایی یک باتری میتواند برای حرکت دادن یا شتاب دادن به یک جرم مشخص برای طی کردن مسافتی مشخص استفاده شود. فرمول ساده انرژی مکانیکی برابر با نصف جرم در مربع سرعت خواهد بود.
فرمول مکانیکی انرژی، شاخه های مختلفی دارد و از این فرمول میتوان به فرمولهای مختلفی دست یافت. اما در مجموع تمامی این فرمولها اصلی ترین قسمت، جرم و حرکت هستند. برای مثال، حرارت تولید شده از آب در حال جوشیدن در واقعیت ذرات آبی هستند که به سرعت در حال حرکت هستند و به دلیل بالا بودن میزان انرژی این حرکتها و ارتعاشات، انرژی گرمایی تولید میشود. در مثالی دیگر، انرژی تابشی در اغلب اوقات حاصل حرکت و ارتعاشات ذرات برانگیخته است.
انرژی پیوندها در واکنش شیمیایی
تا اینا آموختیم انرژی شیمیایی و روش تبدیل آن چیست. در واکنشهای شیمیایی، پیوند بین اتمها یا مولکولهای مواد واکنشدهنده شکسته میشود. سپس پیوندهای جدیدی برای تولید مواد جدید فرآورده تشکیل میشود. با تولید پیوندهای جدید بین مواد مختلف، انرژی آزاد میشود. این درحالی است که شکستن پیوندها انرژی مشخصی نیاز دارد که با نام آنتالپی پیوند شناخته میشود.
به همین علت است که در واکنشهای گرماده انرژی مواد فرآورده کمتر از انرژی واکنشدهندهها است. در حقیقت، انرژی مورد نیاز برای شکستن مواد خیلی کمتر از انرژی آزاد شده توسط تشکیل پیوندهای جدید است و در مجموع، واکنش گرما آزاد میکند.
بالعکس، در واکنشهای گرماگیر، انرژی مورد نیاز برای شکستن پیوند بیشتر از انرژی آزاد شده از تشکیل پیوندهای جدید است. به همین علت است که در مجموع، واکنش برای انجام شدن انرژی میگیرد. برای مثال، واکنش سوختن متان را در نظر بگیرید. معادله این واکنش به شکل زیر است.
در این واکنش، پیوندهای بین کربن و هیدروژن در متان شکسته شده و بین اتمهای کربن و اکسیژن پیوند جدیدی برقرار میشود. انرژی آزاد شده از تشکیل پیوندهای جدید بین مولکولهای اکسیژن- هیدروژن و کربن- اکسیژن، بسیار بیشتر از انرژی صرف شده برای شکستن پیوند بین اتمهای متان و اکسیژن است. در نهایت، با سوختن متان انرژی حرارتی قابل توجهی آزاد میشود. از این انرژی برای پخت غذا و تولید سایر انواع انرژی مانند الکتریسیته استفاده میشود.
آزاد شدن انرژی شیمیایی
انرژی شیمیایی تولید شده در پی انجام واکنشهای شیمیایی میتواند به روشهای مختلفی آزاد شود. این روش آزاد شدن به واکنشدهندههای واکنش بستگی دارد و میتواند به فرمهای مختلفی مانند نور، حرارت، الکتریسیته و .. همراه فراورده واکنش آزاد شود.
برای مثال، در بدن انرژی شیمیایی غذایی که مصرف میکنیم میتواند به وسیله فرآیندهای متابولیکی آزاد شود. این فرآیندها به سلول ها اجازه میدهد که انرژی ذخیره شده در مولکولهای غذا را با شکستن پیوندهای بین آنها آزاد کند. در این مثال، واکنش انجام شده یک واکنش گرماده است و انرژی شیمیایی برای کمک به عملکرد بدن آزاد میشود.
در واکنشهای شیمیایی که خارج از بدن انجام میشوند، انرژی شیمیایی به شکلی مشابه آزاد میشود. در این روش نیز یک واکنش شیمیایی باعث شکسته شدن پیوند بین ترکیبات شیمیایی شده و انرژی پتانسیل شیمیایی ذخیره شده در این پیوندها آزاد میشود.
رابطه بین انرژی پتانسیل شیمیایی و ترمودینامیک
قوانین ترمودینامیک نقشی مهم در مفهوم انرژی پتانسیل شیمیایی ایفا میکنند. در قیمتهای قبل آموختیم انرژی شیمیایی چیست. انرژی پتانسیل شیمیایی، کامل کننده ترمودینامیک است که با انتقال انرژی تعریف میشود.
اولین قانون ترمودینامیک که با نام پایستگی انرژی شناخته میشود، بیان میکند که در یک سیستم بسته، انرژی از بین نمیرود و به وجود نمیآید تنها از حالتی به حالت دیگر تبدیل میشود. بنابراین، هنگام انجام گرفتن یک واکنش شیمیایی، انرژی شیمیایی مواد از بین نمیرود تنها از حالتی به حالت دیگر تبدیل میشود. بنابراین، انرژی پتانسیل شیمیایی ناپدید نمیشود و تنها تغییر حالت میدهد.

قانون دوم ترمودینامیک استنباط جالبی برای انرژی پتانسیل شیمیایی دارد. این قانون بیان میکند که هر فرآیندی در جهتی انجام میشود که آنتروپی کلی افزایش یابد. این افزایش آنتروپی با سهمهای انرژی و انتقالات آن در ارتباط است. در نتیجه، واکنشهای شیمیایی به شیوهای انجام میشوند که مجموع آن واکنش کمترین میزان انرژی پتانسیل ممکن را داشته باشد. بدین ترتیب، واکنشهای شیمیایی با میزان انرژی پتانسیل زیاد فرآوردهها تمایل دارند این انرژی را به شکلی آزاد کنند.
ترکیب این دو قانون ترمودینامیک به ما کمک میکند که جهت انجام واکنش شیمیایی و انجام شدنی بودن آن را بسنجیم. قانون اول میزان کلی تغییرات انرژی را در سیستم مشخص میکند و قانون دوم، تسهیم انرژی را بیان میکند. روابط بین ترمودینامیک و انرژی شیمیایی به دانشمندان اجازه میدهد که روند واکنشهای شیمیایی را پیشبینی کنند و از آن در فرآیندهای مهندسی مختلف استفاده کنند. پیشنهاد میکنیم برای آشنایی بیشتر با علم ترمودینامیک و قوانین آن، مطلب «ترمودینامیک چیست» مجله فرادرس، که لینک آن در ادامه آورده شده است را مطالعه کنید.
عوامل تأثیرگذار بر انرژی شیمیایی
در قسمتهای قبل آموختیم انرژی شیمیایی چیست و چگونه اندازهگیری میشود. برخی از موارد مانند قدرت پیوند بین مواد شیمیایی و میزان واکنشپذیری مواد میتواند بر مقدار انرژی شیمیایی آن مواد تاثیر بگذارد. در ادامه برخی از این موارد را توضیح میدهیم.
ترکیب شیمیایی
مواد مختلف از ترکیبهای شیمیایی متفاوتی تشکیل شدهاند. این ترکیبات شیمیایی میتواند بر میزان انرژی شیمیایی مواد اثر بگذارد. برای مثال، جرم برابری از یک هیدروکربن مقدار انرژی شیمیایی بیشتری از کربوهیدرات دراد.
قدرت پیوند
میزان قدرت پیوندهای شیمیایی بر میزان انرژی مورد نیاز برای شکستن آنها یا تشکیل آن پیوندها اثر میگذارد. به همین ترتیب، قدرت پیوند یکی از عوامل مهم تاثیرگذار بر میزان انرژی شیمیایی این پیوندها است. پیوندهای قویتر میزان انرژی ذخیره شده بیشتری از پیوندهای ضعیفتر دارند.
واکنش پذیری
میزان واکنشپذیری یک ترکیب بر تمایل آن در پیوند برقرار کردن با سایر اتمها، قدرت پیوندهای آن و انرژی شیمیایی آنها اثر دارد. موادی که واکنشپذیری بالاتری دارند، پتانسیل بیشتری برای آزاد کردن انرژی شیمیایی حاصل از تشکیل پیوند شیمیایی دارند.
شرایط واکنش شیمیایی
شرایطی که واکنش شیمیایی در آن انجام میشود نیز بر انرژی واکنش شیمیایی اثر دارد. برای مثال، واکنشهای سوختن میتوانند به دو شکل سوختن کامل و سوختن ناقص انجام شوند. واکنش سوختن کامل که در حضور میزان اکسیژن کافی انجام میشود، انرژی شیمیایی بیشتری نسبت به واکنش سوختن ناقص آزاد میکند.
منابع انرژی شیمیایی
انرژی شیمیایی میتواند درون اتم و در پیوندهای بین اتمها و مولکولها ذخیره شود. با نگاهی دقیقتر به ساختار اتم و انرژی شیمیایی ذخیره شده در آنها میتوانیم بگوییم انرژی شیمیایی درون اتم، در سطوح انرژی الکترونی و در پیوندهای شیمیایی ذخیره میشود. در ادامه هریک از این منابع انرژی شیمیایی را توضیح میدهیم.
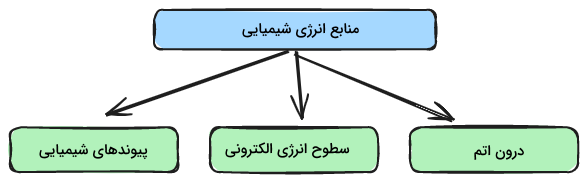
درون اتم
انرژی شیمایی درون پیوندهای بین اتمی و بین مولکولی وجود دارد. این بدین معنی است که اتمها با انرژی مشخصی در کنار یکدیگر قرار میگیرند بدین ترتیب میتوان گفت تمامی مواد میتوانند انرژی شیمیایی داشته باشند. در این سطح میتوان گفت انرژی شیمیایی درون اتم به دو نوع انرژی هستهای و انرژی شیمیایی تقسیم میشود.
انرژی هستهای تنها در صورتی آزاد میشود که بتوان هسته اتم را شکافت یا به آن انرژی زیادی داد. این مثالها چون بدون واکنش شیمیایی انجام میگیرند، از انواع انرژی شیمیایی به شمار نمیروند. همچنین، وجود انرژی هستهای برای ادامه حیاط گیاهان و جانوران مانند انرژی شیمیایی ضروری و حیاتی نیست.
سطوح انرژی الکترونی
پیوندهای بین مواد شیمیایی و اتمها با به اشتراکگذاری الکترونهای لایه ظرفیت یا انتقال این الکترونها انجام میشود. مواردی مانند واکنشپذیری مواد، الکترونگاتیوی آنها، سرعت واکنش و … روی میزان انرژی شمیایی آنها تاثیر میگذارد.
برای مثال، با انجام واکنشهای شیمیایی گرماده، اگر همراه با آزاد سازی نور باشند به خوبی انتقال الکترونی را مشخص میکنند. واکنشهایی که با آزاد شدن نور همراه هستند، شامل انتقال الکترون از سطح انرژی بالاتر به سطوح انرژی پایینتر (پایدارتر) هستند.
پیوندهای شیمیایی
اتمها و مولکولها با به اشتراکگذاری الکترون و تشکیل پیوند، به پایداری میرسند به همین علت است که بیشتر اتمها در طبیعت به شکل ترکیب وجود دارند و نه عنصر. این مسئله نشان دهنده وجود انرژی در پیوندهای بین مواد است و به همین دلیل است که شکستن پیوندها نیاز به صرف انرژی دارد و تولید پیوند شیمیایی که باعث پایداری اتمها میشود، با آزاد شدن انرژی شیمایی همراه است.
بدین ترتیب انرژی شیمیایی را میتوان با انجام واکنشهای شیمیایی مختلف آزاد کرد و از آن استفاده کرد. برای مثال میتوان انرژی شیمیایی انواع سوختها مانند سوخت فسیلی، بنزین و زغال سنگ را با استفاده از واکنش سوختن آزاد کرد. همچنین، انرژی شیمیایی برخی از واکنشها مانند اکسایش و کاهش را میتوان با استفاده از باتریها، ذخیره و استفاده کرد.
بدن انسان نیز انرژی شیمیایی مواد غذایی که مصرف میکند را با فرآیند هضم غذا و شکستن پیوند آنها آزاد میکند و این انرژی صرف فعالیت ها متابولیکی بدن انسان میشود.
معایب انرژی شیمیایی چیست؟
حال که آموختیم انرژی شیمیایی چیست، باید با معایب و مزایای آن اشنا شویم. انرژی شیمیایی تعداد کمی نکته منفی دارد که قابل توجه هستند. انرژی شمیایی که در سوختهای فسیلی و برخی از سوختها وجود دارد، انرژی پاکی نیست و به شدت موجب آلودگی محیط زیست میشود. بیشتر انرژیهای شیمیایی مواد با واکنشهای سوختن آزاد میشود یا اینکه محصولات جانی آسیبزایی دارند. همچنین، بسیاری از منابع انرژی شیمیایی، جزو منابع تجدید پذیر محسوب نمیشوند.
همچنین، استفاده از انرژی شیمیایی منابع سوختی تجدید پذیر مانند سوختهای زیستی که از ضایعات گیاهان و جانوران به دست میآید نیز میتواند بر محیط زیست آثار مخربی داشته باشد. با وجود اینکه این سوختها نسبت به سوختها فسیلی آلودگی کمتری تولید میکنند، فرآیند تولید و حمل و نقل آنها ممکن است با تولید گازهای گلخانهای و آلودگی آب همراه باشد.
مزایای انرژی شیمیایی چیست؟
استفاده از انرژی شیمیایی در برخی از موارد میتواند به شدت برای محیط زیست مفید باشد. برای مثال، استفاده از باتریهای الکتروشیمیایی مانند باتری استفاده شده در دستگاههای موبایل و لپتاپ میتواند در کاهش میزان نشر گازهای گلخانهای تولید شده در سایر روشهای تبدیل انرژی شیمیایی مفید باشد.
ماشینهای الکتریکی که با باتریهای لیتیومی کار میکنند، آلودگیهای تولید شده توسط ماشینهای بنزینی را ندارند و در نتیجه در حفظ پاکیزگی محیط زیست مفید هستند. همچنین، سیستمهای ذخیره انرژی تجدیدپذیر مانند انرژی خورشیدی یا باد، با استفاده از باتریهای شیمیایی کار میکنند و در مجموع به محیط زیستی پاکیزه تر کمک میکنند.
چند نوع انرژی وجود دارد؟
برای درک بهتر اینکه انرژی شیمیایی چیست باید با انواع انرژی آشنا شویم. انرژی، نیروی مورد نیاز برای انجام کار در فیزیک یا تولید گرما است. انواع مختلفی از انرژی وجود دارد. دانشمندان دستهبندی انرژی را از دو نوع کلی انرژی پتانسیل و انرژی جنبشی آغاز میکنند.
انرژی پتانسیل انرژی ذخیره شده و انرژی سینتکی انرژی مربوط به حرکت است. انرژی پتانسیل میتواند یکی از انواع انرژی پتانسیل جاذبهای، انرژی موقعیت، انرژی پتانسیل الاستیک و … باشد. انواع مهم انرژی هستند.
انرژی هستهای
انرژی هستهای، انرژی آزاد شده طی واکنش همجوشی هستهای اتمها است. یا اینکه این انرژی از اتم ها به دست میآید اما ارتباطی با انرژی شیمیایی ندارد زیرا با پیوند بین اتمها ارتباطی ندارد.
انرژی شیمیایی
انرژی شیمیای، انرژی ذخیره شده در مواد مختلف مانند انرژی غذا یا ذغال سنگ است.
انرژی مکانیکی
انرژی مکانیکی مجموع انرژی جنبشی و پتانسیل است. برای مثال انرژی صرف شده در راندن دوچرخه یک انرژی مکانیکی است. انرژی صرف شده در نیروگاهها برای حرکت توربینها و تولید الکتریسیته از نوع انرژی مکانیکی است که شامل انرژی پتانسیل سوخت یا منبع انرژی و انرژی جنبشی حرکت توربینها است.
انرژی صوتی
انرژی صوتی که یک نوع انرژی مکانیکی است، هنگامی پدید میآید که امواج صوتی باعث شوند یک جسم یا ماده دچار ارتعاش شود. برای مثال، لرزشی که بلندگوهای پرقدرت در سایر اجسام مانند پنجره خانه ایجاد میکنند، همان انرژی صوتی است که به وسیله ارتعاشات مولکولهای هوا به محیط و به گوش منتقل میشود.
اندازه گیری انرژی صوتی با استفاده از طول موج، بزرگی و فرکانس موج آن انجام میشود. این انرژی از انواع جنبشی انرژی است.
انرژی تابشی
انرژی تابشی که با نام انرژی الکترومغناطیسی نیز شناخته میشود، از امواج الکترومغناطیسی که در فضا وجود دارند به دست میآید. انرژی خورشید و انرژی ساطع شده از لامپها از نوع انرژی تابشی هستند. انرژی تابشی به عنوان انرژی که توسط ذرات حمل میشود شناخته میشود. پرتوهای گاما، ایکس، نور و … همگی منابع انرژی تابشی هستند.
انرژی نوری
انرژی نوری (انرژی فوتون) یکی از انواع انرژی تابشی است که تنها به انرژی حاصل از نور مرئی اشاره دارد. نور میتواند به شکلی همزان به شکل موج و ذره عمل کند. این انرژی، تنها نوع انرژی است که با چشم قابل مشاهده است. این نوع انرژی زیرمجموعهای از انرژی تابشی و امواج الکترومغناطیسی است و جزء انرژیهای سینتیکی به شمار میآید.
انرژی گرمایی
انرژی گرمایی که با نام حرارت نیز شناخته میشود، با افزایش دمای مواد مختلف به دست میآید. حرکات ذرهای اتمها و مولکولها نیز انرژی گرمایی تولید میکند.
انرژی الکتریکی
انرژی الکتریکی میتواند به عنوان انرژی پتانسیل یا انرژی جنبشی در نظر گرفته شود. هنگامی که جریان الکتریکی برقرار میشود، دارای انرژی سینتیکی است. تولید الکتریسیته هنگامی انجام میشود که الکترونها حرکت کرده و یکدیگر را به حرکت در بیاورند. برای مثال، الکترونها در طول سیمهای وسایل الکتریکی حرکت کرده و دارای انرژی سینتیکی هستند. هرچند در صورت استفاده نکردن از همان وسایل الکتریکی، انرژی الکریتیکی دیگر جریان پیدا نکرده و به عنوان انرژی پتانسیل درنظر گرفته میشود.
در نمودار زیر، انواع انرژی دسته بندی شدهاند.

یادگیری شیمی با فرادرس
یادگیری واکنشهای شیمیایی و نحوه برهمکنش مواد از اولین قدمهای شناخت شیمی است. با یادگیری این مفاهیم میتوان با درک عمیقتری بیاموزیم انرژی شیمیایی چیست و ترمودینامیک واکنشها و سینتیک آنها چه مفاهیمی هستند. با یادگیری این مباحث میتوان مفاهیم و مسائل پیچیده مانند سرعت واکنش، انرژی پیوند و انرژی یونش واکنشها را حل کرد. پینشهاد میکنیم برای یادگیری بهتر این مباحث به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی دسترسی داشته باشید.
کاربرد انرژی شیمیایی
در این مطلب از مجله فرادرس آموختیم انرژی شیمیایی چیست و چگونه آزاد میشود. انرژی شیمیایی تقریبا در تمامی مواد وجود دارد و میتوان آن را آزاد کرد. انرژی شیمیایی مواد مختلف بسته به پیوندهای شیمیایی و ساختار آنها متفاوت است. با نگاهی دقیقتر به محیط اطراف خود درمییابیم که انرژی شیمیایی در بسیاری از کاربردها و فعالیتها روزمره انسان نقش دارد.
لامپهای روشنایی، استفاده از وسایل حمل و نقل، انرژی بدن که از خوردن غذا به دست میآید، و … همگی از نمونههای مصرف انرژی شیمیایی هستند. این انرژی که ذخیره و استفاده از آن اسان است، میتواند پاسخگوی بساری از نیازهای روزمره ما باشد.
یافتن و دنبال کردن حرکت انرژی پتانسیل شیمیایی و تبدیل شدن آن به سایر انرژیها یکی از اساس برنامهریزیها در انواع صنایع مانند داروسازی، محیط زیست و علم مواد است.
source
