درصد خلوص نشاندهنده نسبت جرم (یا حجم) ماده خالص به کل نمونه است. برای محاسبه درصد خلوص، جرم یا حجم ماده خالص بر جرم یا حجم کل نمونه تقسیم شده و حاصل آن در عدد ۱۰۰ ضرب میشود. درصد خلوص همواره با علامت (٪) بیان میشود و نمیتواند بیشتر از ۱۰۰ درصد باشد. ماده خالص در شیمی به مادهای گفته میشود که تنها از یک نوع عنصر یا ترکیب تشکیل شده باشد. در این مطلب از مجله فرادرس، میآموزیم درصد خلوص چیست و به چه روشهایی بیان میشود.

در ابتدای این مطلب میآموزیم درصد خلوص چیست و چه فرمولی دارد. سپس مثالهایی را برای درک آن حل می کنیم. یکی از مهمترین کاربردهای درصد خلوص، به دست آوردن بازده واکنشهای شیمیایی است. پس با توضیح و مثال میآموزیم تفاوت بازده با درصد خلوص چیست. همچنین، روشهای بیان درصد خلوص مانند درصد وزنی و حجمی را با مثال توضیح میدهیم. برای درک بهتر این موضوع که درصد خلوص چیست، دستهبندی مواد را مرور میکنیم. در ادامه، روش تشخیص خلوص مواد را میآموزیم و توضیح میدهیم مواد چگونه خالصسازی میشوند. سپس، گریدهای مختلف خلوص مواد را بررسی میکنیم. در نهایت، به اهمیت درصد خلوص خواهیم پرداخت.
درصد خلوص چیست؟
درصد خلوص مواد میزان جرم ماده خالص در یک مخلوط به جرم کلی ماده ضرب در عدد ۱۰۰ است. درصد خلوص مواد که به فرم درصدی بیان میشود، نشان میدهد چه میزانی از کل یک ماده خالص است. درصد خلوص میتواند بر اساس جرم، حجم یا مول مواد محاسبه شود. در محاسبات درصد خلوص، واحد اندازهگیری ماده خالص و کل نمونه باید از یک جنس باشند. برای مثال، اگر جرم ماده خالص بر حسب گرم باشد، جرم کل نمونه نیز باید بر حسب گرم بیان شود.
یک محلول یا جامد خالص، تنها از یک نوع ماده تشکیل شده است. این ماده میتواند به فرم عنصر یا ترکیب باشد. گاهی برخی از مواد خالص با مواد ناخواسته دیگری ترکیب شده و ناخالص میشوند. گاهی اوقات در مسائل استوکیومتری از عبارت «گرم ناخالص» برای بیان جرم کل ماده (خالص + ناخالص) استفاده میشود و نباید آن را با تنها مقدار ناخالص ماده اشتباه گرفت.
درصد خلوص را میتوان با عناوینی مانند درصد حجمی، درصد وزنی و درصد حجمی-وزنی بیان کرد. این عناوین که بیشتر به عنوان واحد سنجش غلظت مواد به کار میروند، به عنوان انواع درصد خلوص نیز به کار برده میشوند. هریک از این انواع درصد خلوص در ادامه این مطلب توضیح داده خواهند شد.
یادگیری استوکیومتری با فرادرس
مسائل استوکیومتری در مقطع دبیرستان و دانشگاه از مهمترین مباحثی است که در شیمی ارائه میشوند و میتوان با استفاده از آنها به حل بسیاری از مسائل پیچیدهتر در مراحل تهیه و خالصسازی در آزمایشگاه پرداخت. برای یادگیری حل مسائل استوکیومتری نیاز است با مفاهیمی مانند موازنه واکنشهای شیمیایی، عدد آووگادرو، دما و فشار استاندارد و رفتار گازها در شرایط استاندارد، چگالی، دما و فشار و … آشنا شوید. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم به مجموعه فیلم آموزش دروس یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه استوکیومتری واکنش دسترسی داشته باشید.
فرمول درصد خلوص چیست؟
در قسمت قبل آموختیم درصد خلوص چیست. درصد خلوص نسبت ماده خالص را در کل نمونه مشخص میکند. فرمول درصد خلوص به شکل زیر است.
۱۰۰ × (جرم کل ماده ÷ جرم ماده خالص) = درصد خلوص
مثال درصد خلوص
برای درک بهتر این موضوع که فرمول و روش محاسبه درصد خلوص چیست، مثالهای زیر را حل کنید.
مثال ۱
نمونه ای از قلع برمید ۱۵ گرم وزن دارد. اگر میزان برمید قلع در این ترکیب ۱۳٫۵ گرم باشد، درصد خلوص این ماده را حساب کنید.
پاسخ
۹۰٪ = ۱۰۰ × (۱۵ ÷ ۱۳٫۵)
مثال ۲
یک محلول اشباع لیتیوم فلوئورید، که گاهی برای جلوگیری از پوسیدگی دندان استفاده میشود، شامل ۱٫۱۳۲ گرم لیتیوم فلوئورید در هر ۱۰۰ گرم آب است. میزان درصد خلوص این محلول را محاسبه کنید.
پاسخ
برای محاسبه درصد خلوص محلول باید جرم لیتیوم فلوئورید را بر جرم کل تقسیم کرده و در عدد ۱۰۰ ضرب کنیم. دقت داشته باشید، در این مورد ۱۰۰ گرم آب میزان جرم حلال است و نیاز است جرم آب و لیتیوم فلوئورید را برای محاسبه جرم کل، با هم جمع کنیم.
مثال ۳
کیسههای هوای خودرو زمانی باد میشوند که سدیم آزید جامد () بهطور انفجاری به عناصر تشکیلدهنده خود تجزیه شود. اگر ۱۲۰ گرم سدیم آزید با خلوص ۸۵ درصد تجزیه شود، چه حجمی از گاز نیتروژن تولید میشود؟ شرایط را STP فرض کنید.
پاسخ
برای پاسخ به این سوال ابتدا واکنش شیمیایی تجزیه سدیم آزید را مینویسیم.
سپس میزان جرم خالص سدیم آزید را با توجه به درصد خلوص پیدا میکنیم.
در مرحله بعد میزان مول گاز نیتروژن را با استفاده از جرم سدیم آزید خالص مییابیم. نسبت مولی سدیم آزید به گاز نیتروژن ۳:۲ است. یعنی به ازای هر دو مول سدیم آزید، سه مول گاز نیتروژن تولید میشود.
در نهایت با توجه به این قانون که در شرایط استاندارد، هرمول گاز ۲۲٫۴ لیتر حجم دارد، حجم گاز نیتروژن را از روی مول آن پیدا میکنیم.
بازده چیست؟
تا اینجا اموختیم درصد خلوص چیست. برای مقدار ماده واکنشدهنده مشخص، میتوانیم نهایت مقداری که از یک ماده به دست میآید را محاسبه کنیم. این مقدار بازده نظری شناخته میشود که با استفاده از محاسبات ریاضی و استوکیومتری به دست میآید. بازده عملی یا واقعی مقدار مادهای است که از انجام واقعی آزمایش به دست آید.
مقدار بازده درصدی واکنش در برخی از مقالههای علمی به شکل عددی در بالای فلش واکنش نوشته میشود. برای مثال، تصویر زیر نشاندهنده چند مرحله از رسیدن واکنشدهنده اولیه تا محصول نهایی است و بازده هر مرحله روی فلش بین آنها نشان داده شده است.
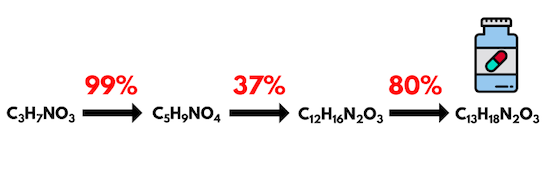
فرمول بازده درصدی
میزان بازده درصدی نسبت تقسیم بازده عملی را به بازده نظری نشان میدهد. میزان بازده مواد را میتوان از روی مقدار مول آنها، جرم آنها یا میزان حجم آنها به دست آورد.
۱۰۰ × بازده نظری ÷ بازده عملی = بازده درصدی
بازده درصدی هیچگاه نمیتواند بیشتر از ۱۰۰ درصد باشد. اگر مقدار بازده درصدی را بیشتر از ۱۰۰ درصد به دست آوردید، محاسبات را اشتباه انجام دادهآید. این اشتباه بین بیشتر دانشآموزان رایج است. در بیشتر مواقع با تقسیم اشتباه بازده نظری به عملی، این مقدار ممکن است بیشتر از ۱۰۰ درصد به دست بیآید.
علت کم شدن بازده واکنش
بازده واکنشهای شیمیایی همواره کمتر از ٪۱۰۰ است. علت این پدیده به عوامل مختلفی بستگی دارد. هیچ گاه تمامی ماده اولیه واکنشدهنده در واکنشهای شیمیایی مستقیما به فرآورده تبدیل نخواهد شد. برخی از این عوامل در ادامه توضیح داده شدهاند.
- مقداری از ماده واکنشدهنده در مراحل آماده کردن نمونه و با جابهجایی بین ظروف مختلف از دست میرود.
- واکنش ممکن است برگشتپذیر باشد و مواد فرآورده به شکلی مداوم به واکنشدهندهها تبدیل شوند.
- مقدار از مواد فرآورده ممکن است طی فرآیندهای جداسازی و خالصسازی از دست بروند.
- ممکن است واکنشهای جانبی وجود داشته باشد که مقداری از ماده در آن با هوا یا ناخالصیهای موجود واکنش دهد.
- فرآوردهها ممکن است طی انتقال بین ظروف از دست بروند.
تفاوت بازده درصدی و درصد خلوص چیست؟
تا اینجا آموختیم که تعریف بازده و درصد خلوص چیست. درصد خلوص ماده نشان دهنده میزان ماده خالص یا یک ترکیب مشخص در کل ماده است. در حالی که بازده درصدی برابر با میزان مادهای است که از واکنش به دست میآید در برابر مقدار فرآوردهای که با محاسبات تئوری به دست میآید.
مثال بازده درصدی
برای درک بهتر بازده اینکه واکنش و تفاوت آن با درصد خلوص چیست، به مثالهای زیر توجه کنید.
مثال ۱
سولفات مس (II) میتواند طی واکنش با سولفوریک اسید و اکسید مس به دست آید. دانشآموزی ۱٫۶ گرم سولفات مس خشک را آماده کرده است. مقدار بازده درصدی واکنش را در صورتی که بازده نظری برابر با ۲ گرم باشد، به دست آورید.
پاسخ
بازده نظری این واکنش مقداری است که دانشآموز از واکنش به دست آورده است که برابر با ۱٫۶ گرم است.
بازده درصدی واکنش برابر با تقسیم بازده عملی بر بازده نظری ضرب در عدد ۱۰۰ است. پس خواهیم داشت:
$$frac{1.6}{2}=text{80%}$$
مثال ۲
یک نمونه ۲۵ گرمی از اکسید کلسیم با مقدار اضافی اسید هیدروکلریک حرارت داده میشود تا آب و ۳۷٫۵ گرم کلرید کلسیم تولید کند. بازه درصدی این واکنش چقدر است؟
پاسخ
ابتدا واکنش شیمیایی این واکنش را مینویسیم.
سپس مقدار مول کلسیم اکسید را با توجه به جرم مولی آن محاسبه میکنیم. نسبت کلسیم اکسید به کلسیم کلرید ۱:۱ است. یعنی هر مول کلسیم اکسید، ۱ مول کلسیم کلرید تولید میکند.
جرم کلسیم کلرید را از روی مقدار مول آن و با استفاده از جرم مولی محاسبه میکنیم.
در نهایت جرمی که به دست آوردیم را بر جرمی که صورت سوال داده (بازده عملی) تقسیم کرده و در عدد ۱۰۰ ضرب میکنیم تا بازده درصدی به دست آید.
یادگیری کمیتهایی مانند درصد خلوص، نسبتهای استوکیومتری، چگالی و ضریب تبدیل از مهمترین مباحث پایه برای حل مسائل شیمی در پایه دبیرستان و پایههای بالاتر و دانشگاهی است. پیشنهاد میکنیم برای یادگیری این کمیتها و روش حل مسائل مربوط به آنها فیلم آموزش کمیتهای بنیادی فرادرس، که لینک آن در ادامه آمده است را مشاهده کنید.
مسائل ترکیبی درصد خلوص و بازده درصدی
دربرخی از سوالات ممکن است علاوه بر محاسبه درصد خلوص، محاسبه بازده درصدی نیز از شما خواسته شود. برای آشنایی با اینگونه سوالات، به مثالهای زیر توجه کنید.
مثال ۱
یک نمونه ۲۵ گرمی کلسیم اکسید با اسیدکلریدریک اضافی حرارت داده شده تا آب و ۳۷٫۵ گرم کلسیم کلرید تولید کند. میزان بازده درصدی واکنش و درصد خلوص نمونه کلسیم اکسید را حساب کنید.
پاسخ
ابتدا دادههای سوال را بررسی کرده و سپس سوال را در دو قسمت جداگانه حل میکنیم. دادههای این سوال به قرار زیر هستند.
- جرم کلسیم اکسید ناخالص: ۲۵ گرم
- جرم کلسیم کلرید تولید شده: ۳۷٫۵ گرم
- جرم مولی کلسیم اکسید: ۵۶٫۰۸ گرم بر مول
- جرم مولی کلسیم کلرید: ۱۱۰٫۹۸ گرم بر مول
واکنش مربوط به این سوال به شکل زیر است.
در قدم اول، میزان بازده درصدی این واکنش را به دست میآوریم. مقدار بازده درصدی با تقسیم بازده عملی به بازده تئوری به دست میآید. میزان بازده عملی (۳۷٫۵ گرم) توسط صورت سوال ارائه شده است پس کافی است میزان تئوری کلسیم کلریدی که با استفاده از ۲۵ گرم کلسیم اکسید به دست میآید را محاسبه کنید.
این محاسبات را با استفاده از نسبت ضرایب استوکیومتری و جرم مولی این ترکیبات به دست میآوریم.
حال که مقدار تئوری کلسیم کلرید را داریم کافی است مقدار عملی را بر آن تقسیم کرده و در عدد ۱۰۰ ضرب کنیم تا بازده درصدی به دست آید.
پس بازده درصدی این واکنش برابر با ٪۷۸٫۵ درصد است. حال برای به دست آوردن درصد خلوص نمونه با استفاده از جرم کلسیم کلرید به دست آمده عملی، نسبت ضرایب استوکیومتری و جرم مولی کلسیم اکسید، جرم خالص آن را به دست آورده و بر جرم کل نمونه تقسیم میکنیم تا درصد خلوص آن به دست آید.
حال برای به دست آوردن درصد خلوص کلسیم اکسید کافی است این عدد به دست آمده را بر ۲۵ گرم کلی نمونه تقسیم کرده و در عدد ۱۰۰ ضرب کنیم.
مثال ۲
یک محلول که شامل ۱۵٫۲ گرم باریم برمید است باید با مقدار اضافی سدیم فسفات واکنش دهد تا ۹٫۵ گرم باریم فسفات تولید کند. بازده درصدی و خلوص باریم برمید را محاسبه کنید.
پاسخ
معادله این واکنش به شکل زیر است.
حال دادههای صورت سوال را بررسی میکنیم.
- جرم باریم برمید ناخالص: ۱۵٫۲ گرم
- جرم باریم فسفات به دست آمده: ۹٫۵ گرم
- جرم مولی بارم برمید: ۲۹۷٫۱۳ گرم بر مول
- جرم مولی باریم فسفات: ۶۰۱٫۹۳ گرم بر مول
برای به دست آوردن بازده درصدی واکنش باید ابتدا جرم تئوری مقدار باریم فسفاتی که از واکنش ۱۵٫۲ گرم بارم برمید به دست میآید را محاسبه کنیم. برای این کار، جرم باریم برمید را به مول باریم برمید تبدیل میکنیم.
سپس این مول را با توجه به ضرایب استوکیومتری به مول باریم فسفات تبدیل میکنیم. به ازای هر ۳ مول باریم برمید ۱ مول باریم فسفات به دست میآید. پس به ازای یک مول باریم برمید، یک سوم مول باریم فسفات به دست میآید. پس مقدار مول به دست آمده را بر ۳ تقسیم میکنیم.
سپس جرم باریم فسفات را از مول به دست آمده و جرم مولی آن محاسبه میکنیم.
در نهایت جرم واقعی که صورت سوال داده را بر این مقدار تقسیم کرده و در عدد ۱۰۰ ضرب میکنیم. میرزان بازده درصدی به دست میآید.
پس بازده درصدی این واکنش برابر با ۹۲٫۲ درصد است. حال برای به دست آوردن درصد خلوص نمونه اولیه، باید میزان جرم باریم برمیدی که از مقدار تولید شده باریم فسفات (۹٫۵ گرم) به دست میآید به دست آوریم و آن را بر جرم نمونه تقسیم کنیم. ابتدا جرم باریم فسفات به دست آمده را به مول باریم فسفات تبدیل میکنیم.
سپس این مقدار را در عدد ۳ ضرب میکنیم تا مول باریم برمید به دست آید و سپس با استفاده از جرم مولی باریم برمید، جرم آن را محاسبه میکنیم.
در نهایت با تقسیم این مقدار بر جرم کل نمونه و ضرب آن در عدد ۱۰۰، درصد خلوص نمونه به دست میآید.

درصد وزنی
تا اینجا آموختیم درصد وزنی چیست و چه تفاوتی با بازده واکنش دارد. درصد وزنی یک ماده برابر با جرم هر یک از مواد تشکیل دهنده یک ماده بر جرم کل ترکیب است. تفاوت این درصد با درصد خلوص در این است که درصد خلوص میزان درصد ماده خالص را در نمونه بررسی میکند.
در حالی که درصد وزنی میتواند درصد هریک از مواد را در کل نمونه حساب کند. برای مثال اگر در مادهای ناخالصی داشته باشیم، میتوان میزان درصد وزنی ناخالصی را در کل نمونه نیز به دست آورد.
فرمول درصد وزنی
درصد وزنی برابر با جرم یک ماده تقسیم بر جرم کل ماده ضرب در عدد ۱۰۰ است.
۱۰۰ × جرم کل نمونه ÷ جرم ماده مورد نظر = درصد وزنی
مثال درصد وزنی
برای درک بهتر درصد وزنی و اینکه بفهمیم تفاوت آن با درصد خلوص چیست، به مثالهای زیر توجه کنید.
مثال ۱
میزان درصد وزنی آهن را در یک نمونه آهن (III) اکسید به دست آورید. جرم اتمی نسبی آهن و اکسیژن، به ترتیب ۵۶ و ۱۶ گرم است.
پاسخ
برای محاسبه درصد جرمی آهن در ترکیب آهن (III) اکسید، ابتدا جرم اتمی آهن (III) اکسید را محاسبه کرده سپس جرم اتمی آهن را بر آن تقسیم کرده و در صدد ۱۰۰ ضرب کنیم.
باید دقت داشته باشید که در این ترکیب ۲ اتم آهن ( ۲ مول) وجود دارد. پس باید جرم آهن را دو برابر کرده و به جرم ترکیب تقسیم کنیم.
$$frac{2times56}{160}times100=text{70%}$$
درصد حجمی
درصد حجمی یک ماده یا محلول برابر با حجم یک ماده، تقسیم بر حجم کل محلول ضرب در عدد ۱۰۰ است. درصد خلوص گاهی به عنوان درصد حجمی بیان میشود. درصد حجمی با علامت انگلیسی (V/V) بیان میشود. برای مثال ، اگر ۱۰۰ میلیلیتر محلول آب و الکل با درصد خلوص ۴۰ درصد حجمی داشته باشیم، بدین معنی است که ۴۰ میلی لیتر از آن ۱۰۰ میلیلیتر الکل است و باقی آب است.
باید دقت داشت درصد حجمی لزوما به معنی درصد خلوص نیست. برای مثال، در مورد مثال بالا، میتوان میزان آب موجود در محلول آب و الکل را نیز به شکل ٪۶۰ درصد حجمی بیان کرد. درصد حجمی را میتوان برای محلولهای گازی نیز استفاده کرد. برای مثال، هوایی که تنفس می کنیم دارای ٪۹۶ حجمی نیتروژن است.
فرمول درصد حجمی
درصد حجمی برابر با میزان حجم یک ماده تقسیم بر حجم کل ماده ضرب در عدد ۱۰۰ است. فرمول این محاسبات به شکل زیر نوشته میشود.
۱۰۰×حجم کل نمونه ÷ حجم ماده مورد نظر = درصد حجمی (v/v)
مثال درصد حجمی
برای درک بهتر درصد حجمی و درک اینکه شباهت و تفاوت آن با درصد خلوص چیست، مثالهای زیر را حل کنید.
مثال ۱
مقدار درصد حجمی محلولی که با استفاده از ترکیب ۵۱۹٫۲ میلیلیتر هلیوم و ۱۶۸٫۴ میلیلیتر کلر به دست میآید را محاسبه کنید.
پاسخ
برای محاسبه درصد حجمی محلولهایی که در صورت سوال مشخص نکرده است کدام ماده مد نظر است، باید درصد حجمی هر ماده جداگانه مشخص شود. همچنین، میتوان با استفاده از تعاریف حلال و حلشونده، درصد حجمی حلشونده را به عنوان درصد حجمی محلول در نظر گرفت. طبق تعاریف، حلشونده قسمتی از محلول است که در حلال حل میشود و قسمت کوچکتر محلول را ( از لحاظ جرمی یا حجمی) تشکیل میدهد.
در این مثال، میزان کلر خیلی کمتر از هلیوم است پس میتوانیم ابتدا درصد حجمی کلر را در محلول محاسبه کنیم. طبق تعاریف قسمت بالا، درصد حجمی برابر با حجم نمونه مورد نظر تقسیم بر کل نمونه ضرب در عدد ۱۰۰ است. بنابراین، برای محاسبه حجم کل نمونه، باید حجم هلیوم و کلر با یکدیگر جمع شوند. برای محاسبه درصد حجمی کلر مطابق زیر عمل میکنیم.
= درصد حجمی کلر
مثال ۲
حجم مورد نیاز از نیتریک اسید خالص را برای ساخت ۲۵۰ گرم محلول ٪۴ حجمی نیتریک اسید محاسبه کنید.
پاسخ
هنگامی که صورت سوال اشارهای به حلال مورد نیاز برای محلولسازی اشاره نمیکند، منظور آن ساخت محلول با استفاده از آب است. برای ساخت محلول ٪۴ حجمی نیتریک اسید باید تنها ۴ درصد از ۲۵۰ میلیلیتر محلول شامل نیتریک اسید باشد و باقی آب باشد. پس محاسبات معکوس را انجام میدهیم.
۱۰۰× ۲۵۰ میلیلیتر ÷ حجم نیتریک اسید مورد نیاز = ٪۴
حجم نیتریک اسید مورد نیاز =
پس ۱۰ میلیلیتر نیتریک اسید نیاز است.
درصد وزنی حجمی
تا اینجا آموختیم روشهای بیان درصد خلوص چیست. درصد وزنی حجمی یک محلول به عنوان کسری از جرم یک ماده حلشونده موجود در حجم کل محلول تعریف میشود. به دلیل اینکه این روش بیان غلظت به عنوان درصد بیان میشود باید در نهایت در عدد ۱۰۰ ضرب شود. از درصد وزنی حجمی برای بیان درصد خلوص و غلظت بسیاری از محلولها استفاده میشود.
فرمول درصد وزنی حجمی
درصد وزنی حجمی به عنوان گرم یا میلیگرم ماده حلشونده در لیتر حلال بررسی میشود. پس فرمول آن به صورت جرم حلشونده بر حجم حلال در عدد ۱۰۰ نوشته میشود. فرمول درصد وزنی حجمی به شکل زیر است.
۱۰۰ × حجم کل محلول ÷جرم نمونه (خالص) = درصد وزنی حجمی
مثال درصد وزنی حجمی
برای درک بهتر روش بیان درصد وزنی حجمی، به مثالهای زیر توجه کنید.
مثال ۱
میزان درصد وزنی حجمی یک محلول ۷۶۲٫۵ میلیلیتری را حساب کنید که با حل کردن ۲۸۹٫۱۵ گرم کلسیم آزید در آب تهیه شده است.
پاسخ
برای پاسخ به این سوال کافی است میزان جرم حلشونده را بر حجم کل محلول تقسیم کرده و در عدد ۱۰۰ ضرب کنیم.
مثال ۲
اگر ۲٫۵ گرم پتاسیم کلرید در ۵۰ میلیلیتر محلول پتاسیم کلرید وجود داشته باشد، میزان خلوص آن را بر حسب درصد وزنی حجمی محاسبه کنید.
پاسخ
برای حل این سوال کافی است جرم حل شونده را بر حجم حلال تقسیم کنیم.
$$frac{2.5}{50}×100=5 text{%}$$

مسائل مربوط به درصد خلوص
برای درک بهتر اینکه درصد خلوص چیست و مسائل مربوط به آن چگونه حل میشوند، سوالات زیر را حل کنید. در ادامه نمونه سوالهای درصد خلوص شیمی یازدهم با جواب ارائه شده است.
مثال ۱
۱۰ گرم از نمونه مس (II) سولفات حرارت دیده است و در نهایت سولفات مس خالص باقی مانده است. وزن نمونه بدون آب ۴٫۵ گرم است. میزان درصد خلوص نمونه اولیه را حساب کنید.
پاسخ
از آنجا که کل نمونه قبل از حرارت دیدن ۱۰ گرم وزن داشته و میزان سولفات مس خالص نیز در صورت سوال مشخص شده است، کافی است این مقدار را بر مقدار اولیه تقسیم کرده و در صد ضرب کنیم تا مقدار درصد خلوص نمونه اولیه به دست آید.
مثال ۲
۲۰۰ گرم کلسیم کربنات طی حرارت دیدن، ۱۱.۲ لیتر گاز کربن دی اکسید تولید میکند. درصد خلوص کلسیم کربنات را محاسبه کنید.
پاسخ
ابتدا باید واکنش تفکیک کلسیم کربنات را طی حرارت دیدن بنویسیم. معادله این واکنش شیمیایی به شکل زیر است.
بنابر واکنش بالا، ۱ مول از کلسیم کربنات یک مول کربن دی اکسید تولید میکند. تعداد مول کربن دی اکسید را با استفاده از کسرهای تبدیل استوکیومتری و مقدار جرم کلسیم کربنات محاسبه میکنیم. در قدم اول، داده های سوال را بررسی میکنیم. دقت داشته باشید که هیچ فرمول تستی درصد خلوص و بازده برای حل اینگونه مسائل وجود ندارد و یادگیری صحیح استفاده از کسرهای تبدیل استوکیومتری، بهترین روش برای صرفه جویی در زمان حل اینگونه سوالات است.
- جرم کلسیم کربنات ناخالص : ۲۰۰ گرم
- حجم کربن دی اکسید تولید شده: ۱۱٫۲ لیتر
- حجم ۱ مول گاز در شرایط استداندارد: ۲۲٫۴ لیتر
- جرم مولی کلسیم کربنات : ۱۰۰ گرم بر مول
در مرحله دوم تعداد مول کربن دی اکسید در شرایط استاندارد را محاسبه میکنیم.
در مرحله بعد، جرم کلسیم کربنات کلسیم کربنات خالص را که منجر به تولید کربن دی اکسید شده محاسبه میکنیم. با توجه به استوکیومتری واکنش مشخص است که در ازای هر مول کلسیم کربنات یک مول کربن دی اکسید تولید میشود. جرم کلسیم کربنات از ضرب مول کربن دی اکسید در جرم مولی کلسیم کربنات، جرم کلسیم کربنات خالص به دست میآید.
در نهایت میتوانیم طبق فرمول درصد خلوص که جرم ماده خالص به کل نمونه است، دریابیم مقدار درصد خلوص کلسیم کربنات چیست.
مثال ۳
میزان مورد نیاز محلول ۸۰ درصد سدیم هیدروکسید را برای واکنش با ۲۱٫۳ گرم کلر در شرایط گرم به دست آورید.
پاسخ
ابتدا واکنش شیمیایی مربوط به این سوال را نوشته و سپس میزان مول کلر را با استفاده از جرم مولی مولکول دو اتمی کلر به دست میآوریم.
جرم مولی مولکول کلر برابر با ۱۴۲ گرم بر مول است. با استفاده از آن تعداد مول کلر را پیدا میکنیم سپس میتوانیم با استفاده از روابط استوکیومتری مشخص شده در واکنش، تعداد مول سدیم هیدروکسید را به دست آوریم.
با توجه به ضرایب استوکیومتری واکنش درمییابیم تعداد مول سدیم هیدروکسیدی که با کلر واکنش میدهد، دو برابر آن است. پس برای به دست آوردن تعداد مول سدیم هیدروکسید باید مقدار به دست آمده مول کلر را در عدد ۲ ضرب کنیم.
همچنین، جرم مولی سدیم هیدروکسید برابر با ۴۰ گرم بر مول است. با استفاده از این مقادیر میتوانیم جرم سدیم هیدروکسید خالص مورد نیاز را به دست آوریم.
با توجه به اینکه میدانیم مقدار درصد خلوص محلول چیست، میتوانیم مقدار نمونه ناخالص سدیم هیدروکسید مورد نیاز را به دست آوریم.

در ادامه تمرینهایی برای درک بهتر فرمول درصد خلوص و روش حل مسائل آن ارائه شده است.
تمرین ۱
هنگامی که ۱٫۲۵ گرم گچ به شدت حرارت میبیند، ۰٫۴۴ گرم کربن دی اکسید تولید میشود. میزان درصد خلوص نمونه گچ را محاسبه کنید.
ابتدا واکنش شیمیایی مربوط به این سوال را مینویسیم. سپس تعداد مولهای کربن دی اکسید تولید شده را با استفاده از جرم مولی آن محسابه میکنیم. درصد زیادی از گچ از کربنات کلسیم تشکیل شده است. هر یک مول کلسیم کربنات یک مول کربن دی اکسید و یک مول کلسیم اکسید تولید میکند. معادله این واکنش به شکل زیر است.
در ادامه دادههای سوال را بررسی میکنیم.
- جرم نمونه گچ: ۱٫۲۵ گرم
- جرم کربن دی اکسید تولید شده: ۰٫۴۴ گرم
- جرم مولی کلسیم کربنات: ۱۰۰ گرم بر مول
- جرم مولی کربن دی اکسید: ۴۴ گرم بر مول
سپس تعداد مول کربن دی اکسید را با استفاده از جرم مولی آن محاسبه میکنیم.
در ادامه با توجه به ضرایب استوکیومتری، میتوانیم جرم کلسیم کربنات را با استفاده از جرم کربن دی اکسید به دست آوریم. به ازای هر مول کلسیم کربنات، ۱ مول کربن دی اکسید به دست میآید.
سپس میتوانیم با تقسیم جرم به دست آمده بر جرم نمونه، میزان درصد خلوص را به دست آوریم.
تمرین ۲
جرم اسید سولفوریک ۸ درصد مورد نیاز برای خنثی کردن ۱۰۶ گرم سدیم کربنات را به دست آورید.
ابتدا واکنش شیمیایی بین این دو ماده را مینویسیم و سپس مقدار مول سدیم کربنات را محاسب میکنیم. معادله شیمیایی این واکنش به شکل زیر است.
با توجه به ضرایب استوکیومتری واکنش درمییابیم که با هر یک مول سدیم کربنات، یک مول اسید سولفوریک واکنش میدهد. میزان جرم مولی سدیم کربنات ۱۰۶ گرم بر مول است =. با استفاده از جرم مولی سدیم کربنات، تعداد مول سدیم کربنات را به دست میآوریم.
با توجه به نسبت اسید سولفوریک و سدیم کربنات، ۱ مول از اسید سولفوریک خالص نیاز داریم. جرم مولی اسید سولفوریک ۹۸ گرم بر مول است. پس جرم یک مول اسید سولفوریک ۹۸ گرم میشود. در نهایت، با داشتم جرم اسید سولفوریک خالص، میتوانیم جرم نمونه مورد نیاز را محاسبه کنیم.
تمرین ۳
با افزودن اسید کلریدریک خالص به ۵٫۷۳ گرم کلسیم کربنات ناخالص، ۲۴۹ گرم کربن دی اکسید به دست میآید. میزان خلوص نمونه کلسیم کربنات را بیابید.
ابتدا واکنش بین کلسیم کربنات و اسید کلریدریک را نوشته و سپس مقدار مول کربن دی اکسید را با توجه به جرم مولی آن به دست میآوریم.
با توجه به معادله واکنش، به ازای هر مول کلسیم کربنات، ۱ مول اسید کلریدریک مصرف میشود. حال به دادههای صورت سوال توجه کنید.
- جرم کلسیم کربنات ناخالص: ۵٫۷۳ گرم
- جرم کربن دی اکسید تولید شده: ۲٫۴۹ گرم
- جرم مولی کلسیم کربناات: ۱۰۰ گرم بر مول
- جرم مولی کربن دی اکسید: ۴۴ گرم بر مول
سپس تعداد مول کربن دی اکسید را محاسبه میکنیم.
از آنجا که نسبت این مواد ۱:۱ است، در ازای هر مول کربن دی اکسید، یک مول کلسیم کربنات مصرف میشود. میتوانیم مقدار به دست آمده در قسمت بالا را برابر با تعداد مول مصرفی کلسیم کربنات خالص در نظر گرفته و با استفاده از جرم مولی آن، جرم کلسیم کربنات خالص را به دست آوریم.
حال با تقسیم جرم کلسیم کربنات بخالص به دست آمده بر جرم نمونه، درصد خلوص آن را محاسبه میکنیم.
تمرین ۴
یک نمونه از آهن پیرات با فرمول شیمیایی () داریم. هنگامی که ۱۳٫۹ گرم از این ماده حرارت داده میشود، آهن (III) اکسید و دی اکسید گوگرد تولید میشود. اگر ۸٫۰۲ گرم اکسید آهن به دست آید، میزان خلوص نمونه اولید سولفید آهن را محاسبه کنید.
ابتدا معادله واکنش شیمیایی مربوط به این سوال را مینویسیم و موازنه میکنیم.
با توجه به معادله واکنش موازنه شده، هر ۴ مول سولفید آهن، ۲ مول اکسید آهن تولید میکند و هر ۲ مول سولفید آهن، ۱ مول اکسید آهن تولید میکند. حال دادههای سوال را دستهبندی و بررسی میکنیم.
- جرم سولفید آهن ناخالص: ۱۳٫۹ گرم
- جرم اکسید آهن به دست آمده: ۸٫۰۲ گرم
- جرم مولی اکسید آهن: ۱۵۹٫۷ گرم بر مول
- جرم مولی سولفید آهن: ۱۱۹٫۸۵ گرم بر مول
حال با استفاده از این اطلاعات، میزان مول اکسید آهن را به دست میآوریم.
گفتیم تعداد مولهای سولفید آهن دو برابر اکسید آهن است. پس خواهیم داشت:
حال با استفاده از جرم مولی سولفید آهن، میزان جرم آن را در نمونه به دست میآوریم.
در نهایت با تقسیم گرم به دست آمده بر جرم کل نمونه، درصد خلوص سولفید آهن به دست میآید.
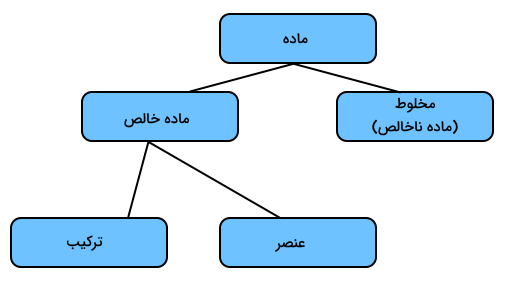
دستهبندی مواد
مواد شیمیایی مختلف از عناصر، ترکیبات یا مخلوطها تشکیل شدهاند. عناصر شامل اتمهایی هستند که دارای عدد اتمی برابرند. ترکیبات شامل دو یا تعدادی عنصر هستند که از لحاظ شیمیایی با یکدیگر پیوند شیمیایی برقرار کردهاند. مخلوطها شامل دو یا چند ماده هستند که از لحاظ شیمیایی با یکدیگر پیوندی برقرار نکردهاند. مواد مختلف داخل یک مخلوط میتوانند از نوع عنصر یا ترکیب باشند.
جدول زیر نشاندهنده این نوع مواد است.
ماده خالص چیست؟
مفهوم کلمه ماده خالص یا میزان خلوص در شیمی به این معنی است که ماده تنها از یک عنصر یا ترکیب تشکیل شده باشد. برای مثال، نمک یک ماده خالص است که تنها از ماده سدیم کلرید تشکیل شده است. یک ماده خالص همواره نقطه جوش و نقطه ذوبی ثابت دارد. این بدین معنی است که این مواد همواره در دمای مشخصی ذوب میشوند یا به جوش میآیند.
برای مثال، نقطه ذوب آب همواره صفر درجه سانتیگراد و نقطه جوش آن همواره ۱۰۰ درجه سانتیگراد است. اگر آب با ماده دیگری ترکیب شود، این دماها تغییر میکند. برای مثال اگر آب با نمک مخلوط شود، در دمای کمتر از صفر یخ میزند و در دمای بالای ۱۰۰ درجه به جوش میآید.
در زندگی روزمره ممکن است به دفعات زیادی از کلمه خالص استفاده کنید. این کلمه برای بیان مواد مختلف استفاده میشود. برای مثال پارچه ۱۰۰ درصد کتان یا حاوی ۴۰ ٪ آب میوه طبیعی، عسل ۱۰۰ درصد خالص و .. مواردی از این قبلی هستند. اما در شیمی، خالص تنها به موادی گفته میشود که از یک نوع عنصر یا ترکیب شیمیایی تشکیل شده باشند. جدول زیر برخی از مواد خالص شیمیایی را نشان میدهد.
| ماده خالص | شکل | فرمول شیمیایی |
| ساکاروز (شکر) |
 |
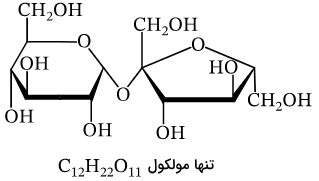 |
| مس |
 |
اتم مس (Cu) |
| هلیوم مایع |
 |
اتم هلیوم (He) |
بدین ترتیب، تمامی مواد میتوانند به دو دسته خالص و ناخالص (مخلوط) تقسیم شوند. تصویر زیر نشاندهنده این دسته بندی است.
ماده ناخالص چیست؟
ماده ناخالص مادهای است که از دو یا تعداد بیشتر عنصر یا ماده تشکیل شده است که از لحاظ شیمیایی با یکدیگر پیوند تشکیل ندادهاند. برای مثال ترکیب نمک و شکر یک ماده ناخالص است که از سدیم کلرید و ساکاروز تشکیل شده است.
حتی اگر مادهای مقادیر خیلی ناچیزی ناخالصی داشته باشد نیز خالص محسوب نمیشود. تنها موادی که از یک نوع عنصر یا ترکیب تشکیل شدهاند خالص حساب میشوند. وجود ناخالصی در تمامی موارد پدیده بدی نیست و گاهی ترکیب و تولید برخی مواد ناخالص میتواند مفید باشد. برای مثال، با ترکیب چند فلز میتوان آلیاژ تولید کرد که ترکیبی بسیار کارآمد است. مثالی دیگر از این موارد هوا است. هوا نیز یکی از مواد حیاتی برای بقای گیاهان و جانوران است که از مواد مختلفی مانند نیتروژن، اکسیژن، کربن دی اکسید و … تشکیل شده است.
روش تشخیص خلوص مواد
در قسمتهای قبل آموختیم فرق ماده خالص و ناخالص و درصد خلوص چیست. روشهای کمی و کیفی بسیاری برای بهدست آوردن و تشخیص خلوص مواد وجود دارد. از این روشها در فرآیندهای صنعتی، تشخیص طبی، کنترل کیفیت و صنایع دارویی استفاده میشود. این روشها به ۴ دسته بندی کلی علامتگذاری رادیو اکتیو، بررسی نقطه ذوب و جوش، روشهای رنگسنجی و روشهای تجزیهای تقسیم میشود.
استفاده از مواد نشانه گذاری شده
در این روش، مواد کربندار با استفاده از ایزوتوپهای رادیواکتیو علامتگذاری میشوند. خلوص مواد در این روش با بررسی نسبت مقدار مواد علامتگذاری شده در کل نمونه به دست میآید. این روش معمولا در صنایع دارویی استفاده میشود تا فرآیندهای بیولوژیکی شامل داروها را بررسی کرد.
بررسی نقطه ذوب و جوش
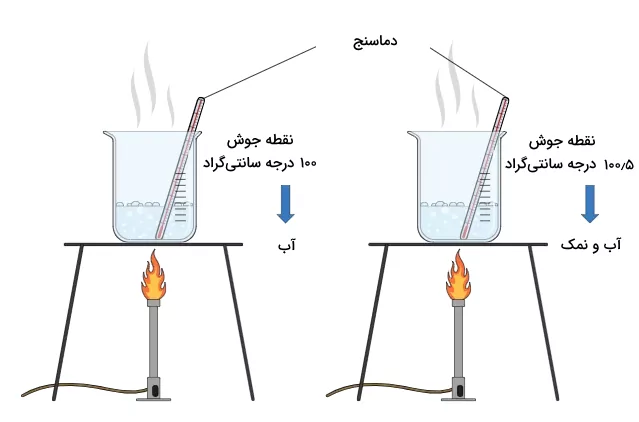
یکی از روشهای تشخیص اینکه درصد خلوص مواد چیست، بررسی نقطه جوش و ذوب مواد است. قبلا اشاره کردیم که مواد خالص نقطه ذوب و جوش مخصوص به خود را دارند. این نقاط ذوب و جوش در کتب مرجع قابل دسترسی هستند. پس برای بررسی این که یک ماده خالص است یا خیر، میتوان نقطه ذوب یا جوش آن را بررسی کرد. برای مثال، تصور کنید که دو ظرف حاوی مایعی بی رنگ هستند که یکی شامل آب خالص و دیگر حاوی مخلوط آب و نمک است. با به دست آوردن نقطه جوش آنها میتوان پی برد کدام آب است و کدام آب و نمک است.
تصویر زیر نشاندهنده انجام این آزمایش است.
در فشار ۱ اتمسفر، آب خالص در دمای ۱۰۰ درجه سانتیگراد میجوشد. درصورت وجود ناخالصی در آب، این دمای جوش تغییر خواهد کرد.به همین ترتیب، بررسی خلوص مواد جامد، با بررسی نقظه ذوب آنها و مقایسه با منابع مرجع انجام میشود. نقطه ذوب مواد ناخالص معمولا پایینتر از نقطه ذوب مواد خالص است و نقطه جوش مواد ناخالص معمولا بالاتر از نقطه ذوب مواد خالص است.
روشهای رنگسنجی (کالرمتری)
این روش با استفاده از رنگهای شیمیایی، خلوص یک ماده به دست میآید. این روش بیشتر در مواد بیوشیمیایی استفاده میشود که در حضور برخی از مواد تغییر رنگ میدهند. یکی از کاربردهای این روش برای بررسی حضور داروهای غیرقانونی در اندامها است.
روشهای تجزیهای
این روشها، از دقیقترین روشها برای سنجش خلوص مواد هستند زیرا اغلب میتوان با تقریب خوبی درصد خلوص مواد را با استفاده از این روشها به دست آورد. این روشها شامل روشهایی مانند تیتراسیون، اسپکتروسکوپی، کروماتوگرافی و چرخش نوری است.
روش تیتراسیون
روش تیتراسیون برای بررسی میزان خلوص مواد مختلف استفاده میشود. این روش با اندازهگیری حجم یک محلول با غلظت معلوم برای واکنش با یک محلول دیگر با غلظت (درجه خلوص) نامعلوم استفاده میشود. در روش تیتراسیون، مادهای که با غلظت نامشخص است با یک شناساگر مانند فنل فتالئین که به تغییر pH حساس است مخلوط میشود تا هنگام انجام واکنش، تشخیص آن راحت باشد. با ریختن محلول از قبل آماده شده با غلاظت معلوم در یک بورت آزمایشگاهی و ذره ذره اضافه کردن آن، میتوان به راحتی میزان خلوص مواد را به دست آورد.
برای تعیین درصد خلوص با تیتراسیون معمولا از رابطه زیر استفاده میشود.
در این رابطه عبارت نشاندهنده غلظت در حجم مصرفی ماده معلوم است و دیگری غلظت در حجم از قبل آماده شده ماده مجهول. بدین ترتیب میتوان میزان غلظت (خلوص ) ماده مجهول را به این روش به دست آورد. به عبارت دیگر، در این رابطه درصد خلوص موادی مانند اسید و باز به عنوان غلظت آنها استفاده میشود.
عبارات اسید ۶۰ درصد و محلول ۷۰ درصد در واقع نشانگر درصد حجمی آنها است که به عنوان درجه خلوص آنها به کار میرود. پیشنهاد میکنیم برای درک بهتر مفهوم غلظت و تفاوتها و شباهتهای آن با درصد خلوص، مطلب «غلظت محلولها و واحدهای آنها» از مجله فرادرس را مطالعه کنید. لینک این مقاله در ادامه آورده شده است.
روش خالصسازی مواد
برای جداسازی ناخالصی از یک نمونه ماده، میتوان از روشهای مختلف جداسازی مانند تقطیر، کرسیتاله کردن، کروماتوگرافی، تبخیر، فیلتراسیون و .. استفاده کرد. هریک از این روشها با توجه به ماهیت ماده و ترجیح فرد آزمایش کننده انجام میشود. هریک از این موارد در ادامه به اختصار توضیح داده میشوند.
تقطیر
تقطیر روشی است که برای خالصسازی مواد مایع و مخلوطهای مایع در مایع استفاده میشود. در این روش، مواد با استفاده از یک سیستم دستگاه تقطیر، بر اساس نقطه ذوبهایشان جداسازی میشوند.
فیلتراسیون
فیلتراسیون برای جداسازی اجزای جامد از یک مایع استفاده میشود. با این روش میتوان ماده خالص جامد یا محلول خالص مایع را جداسازی کرد. در این روش از فیلترهای جدا کننده مانند کاغذ صافی استفاده میشود. بدین ترتیب، ماده جامد از فیلتر عبور نکرده اما مایع از فیلتر رد میشود و توسط قیف به ظرف دیگری هدایت میشود. میتوان برای نتیجهگیری بهتر نیز جامد را حرارت داده و مایع را تقطیر کرد.
کریستاله کردن
فرآیند کریستاله کردن فرآیندی است که طی آن یک محلول اشباع را سرد میکنند تا مواد حلشونده به شکل کریستال جامد ته ظرف رسوب دهند. سپس میتوان این محلول را به وسیله فرآیند فیلتراسیون جداسازی کرد.
گرید های سنجش خلوص مواد
یک از راههای فهمیدن اینکه درصد خلوص یک ماده چیست، بررسی گرید آن ماده است. بسیاری از کشورها، سازمانها و ارگانهای بینالمللی، استانداردهای خاص خود را برای خلوص مواد شیمیایی دارند. این استانداردها، با عنوان «گرید شیمیایی» شناخته میشوند. ممکن است نام این گریدهای شیمیایی متفاوت باشد اما اغلب آنها بر اساس استانداردها و محدودههای مشابهی هستند. برخی از مهمترین گریدهای شیمیایی بین المللی در ادامه توضیح داده شده است.
گرید ACS
این گرید توسط جامعه شیمی آمریکا (American Chemical Society) تعیین شده است. مواد شیمیایی ممکن است حداقل درصدهای مربوط به این استاندارد را داشته باشند یا از آن خالصتر باشند. کمترین درصد خلوص قابل قبول در این گرید ۹۵ درصد است. این درصد برای بیشتر ارگانها و سازمانهای دارویی و غذایی قابل قبول است.
گرید USP
این گرید خلاصه حروف (United States Pharmacopeia) است و به سازمان دارویی آمریکا اشاره دارد. این گرید یک استاندارد قابل قبول برای بسیاری از آزمایشگاههای دارویی است. این گرید بسیاری از مواد دارویی و پزشکی را در بر میگیرد و همچنین برای بسیاری از محصولات مراقبتی و بهداشتی نیز قابل ارزیابی است. کمترین خلوص مورد قبول این گرید ۹۹٫۷ درصد است.
گرید آزمایشکاهی (Laboratory)
این گرید برای بسیاری از آزمایشگاههای معمولی و تحصیلی استفاده میشود. اطلاعاتی از مقدار دقیق درصد خلوص و یا حداقل درصد خلوص در این گرید وجود ندارد. موادی که گرید آزمایشگاهی دارند برای مصارف دارویی و غذایی مناسب نیستند.
یادگیری محلولسازی با فرادرس
یکی از مهمترین کاربردهای درصد خلوص، درصد حجمی و درصد جرمی، در آزمایشگاه شیمی در مقاطع دبیرستان و حتی مقاطع دانشگاهی است. برای یادگیری روشهای محلولسازی باید با مسائل و مفاهیمی مانند محاسبه درصد خلوص مواد، محاسبه درصد جرمی و حجمی مواد ، محاسبه غلظت مولار مواد، ظروف و وسایل آزمایشگاه شیمی و … آشنا شوید. پیشنهاد میکنیم برای یادگیری این مسائل و مفاهیم به مجموعه فیلم آموزش محلول سازی در آزمایشگاه شیمی مراجه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازند.
همچنین، با مراجعه به فیلمهای آموزش فردرس که لینک آنها در ادامه آورده شده است میتوانید با آموزشهای بیشتری در زمینه محلولسازی آشنا شوید.
اهمیت درصد خلوص
در این مطلب از مجله فرادرس آموختیم درصد خلوص چیست و انواع آن کدامند. درک این مفهوم که درصد خلوص چیست و اینکه مواد چقدر خالص هستند در شیمی بسیار حائز اهمیت است. از درصد خلوص برای اطمینان از درست بودن نتایج آزمایشها و جلوگیری از پیش آمدن واکنشهای جانبی استفاده میشود. خالصسازی مواد شیمیایی برای واکنشهای مختلف، یکی از مهمترین جنبههای علم شیمی است و فرآیند خالصسازی برای کاهش ناخالصی مواد در واکنش بسیار ضروری است. این ناخالصیها میتوانند تاثیر بسازیی روی نتیجه واکنشهای شیمیایی داشته باشند و فرآورده را تحت تأثیر قرار دهند.
برای مثال، در بررسی یک واکنش شیمیایی برای تولید یک ماده شیمیایی خاص، حضور ناخالصیها میتواند منجر به تولید ترکیبات ناخواسته شود. همچنین، برخی از ناخالصیها ممکن است برخی از مواد شیمیایی درگیر در واکنش را مصرف کنند و آن را از دسترس واکنش اصلی خارج کنند. این باعث میشود بازده عملی واکنش بسیار پایین بیاید. همچنین، گاهی وجود این آلودگیها و ناخالصیها ممکن است در طی انجام واکنش به مواد خطرناک و آسیب زا برای سلامت انسان و فرد آزمایش کننده تبدیل شوند.
source