آنتالپی پیوند (انرژی پیوند) میزان انرژی مورد نیاز برای شکستن یک مول پیوند شیمیایی بین دو اتم در حالت گازی است. آنتالپی پیوند معمولا با واحد ژول بر مول یا کیلوژول بر مول اندازهگیری میشود. برای شکستن هر پیوندی، باید به آن انرژی بدهیم. بنابراین، شکستن پیوند همواره فرآیندی گرماگیر است و آنتالپی پیوند همیشه مقدار مثبتی دارد. در مقابل، در زمان تشکیل پیوند انرژی آزاد میشود و تشکیل پیوند همواره فرآیندی گرماده است. در این مطلب از مجله فرادرس، به توضیح و بررسی آنتالپی پیوند و تفاوت آن با آنتالپی واکنش میپردازیم.

آنتالپی پیوند
آنتالپی پیوند انرژی مورد نیاز برای شکستن یک مول پیوند بین دو اتم است. انرژی پیوند معیاری برای اندازهگیری استحکام پیوند است. برای تبدیل یک مول از یک مولکول به اتمهای سازنده آن، مقداری گرما به اندازه انرژی پیوند باید وارد سیستم شود. هرچه انرژی پیوند مربوط به یک جفت اتم خاص بیشتر باشد، پیوند قویتر است و فاصله بین دو اتم کمتر است. سیستم استاندارد «آیوپاک» (IUPAC) انرژی پیوند را به عنوان مقدار میانگین انرژی تجزیه پیوند در فاز گازی (معمولا در دمای ۲۹۸٫۱۵ کلوین) برای تمام پیوندهای یکسان در درون یک گونه شیمیایی تعریف میکند. برای مثال، آنتالپی پیوند یگانه بین اکسیژن و هیدروژن ۴۶۳ کیلوژول بر مول است.
واکنشهای شیمیایی دارای انرژی پتانسیل هستند. شناخت انرژی موجود در پیوندهای شیمیایی بین مولکولهای متفاوت، قدم مهمی برای شناخت و اندازهگیری انرژی کلی واکنش است. آنتالپی پیوند با نامهای «آنتالپی تفکیک»، «انرژی میانگین پیوند» و «قدرت پیوند» نیز شناخته میشود. آنتالپی پیوند به شکلی ویژه انرژی مورد نیاز برای تفکیک متقارن پیوند در فاز گاز تعریف میشود. تفکیک متقارن پیوند به این معناست که با شکستن پیوند بین دو اتم، هر اتم یک الکترون را دریافت کرده و رادیکال آزاد تشکیل میشود. این فرآیند عکس فرآیند تشکیل پیوند یونی است.
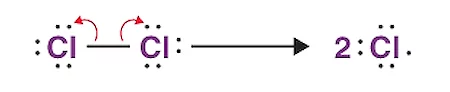
در تصویر بالا شکسته شدن پیوند بین دو اتم کلر و تولید دو رادیکال کلر را مشاهده میکنید. در برخی از تعاریف، انرژی پیوند یا آنتالپی پیوند به عنوان انرژی مورد نیاز برای شکستن یک مول پیوند کووالانسی در فاز گازی تعریف شده است. هنگامی که پیوند شکسته میشود، جفت الکترون پیوندی به طور مساوی بین محصولات تقسیم میشود. این فرآیند به نام «شکست پیوند هومولیتیک» (شکست هومولیتیک یا هومولیس) شناخته میشود و منجر به تشکیل رادیکالها میشود.
نمایش آنتالپی پیوند
یکی از روشهایی که برای نشان دادن آنتالپی پیوند به کار میرود این است که علامت پیوند را در پرانتز و جلوی حرف «E» بنویسید. برای مثال (H-H) E نشاندهنده میزان آنتالپی پیوند هیدروژن یا انرژی مورد نیاز برای شکستن یک مول پیوند بین دو اتم هیدروژن گازی است.
یادگیری شیمی یازدهم با فرادرس
آنتالپی پیوند و انرژی پتانسیل مواد و واکنشهای شیمیایی یکی از مواردی است که در کتب شیمی پایه یازدهم متوسطه ریاضی و تجربی بیان میشود. برای شناخت و یادگیری این مباحث و مفاهیم ابتدا باید با مفاهیمی مانند گرماشیمی، واکنش گرماده و گرماگیر، محیط و سامانه و … آشنا شوید. همچنین با یادگیری این مباحث و مفاهیم میتوانید آنتالپی و انرژی واکنشهای شیمیایی را بررسی کرده و قدم اول برای حل مسائل سینتیکی و ترمودینامیکی را بیاموزید. پیشنهاد میکنیم برای یادگیری بیشتر درباره این مباحث به مجموعه فیلم آموزش دروس پایه یازدهم بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه آنتالپی و ترمودینامیک پایه یازدهم دسترسی داشته باشید.
آنتالپی واکنش
تغییر میزان آنتالپی یک واکنش شیمیایی میتواند به شکلی تقریبی به وسیله آنتالپی پیوند واکنش دهندهها و فرآوردههای آن به دست بیاید. طی انجام یک واکنش شیمیایی، پیوندهای بین واکنشها شکسته شده و اتمهای جدا شده با یکدیگر ترکیب شده و پیوندهای جدیدی را برای تولید فرآوردهها تشکیل میدهند. آنتالپی کلی واکنش با استفاده از قانون هس یا به روش مستقیم یا به وسیله آنتالپی پیوند مواد به دست میآید. تغییر آنتالپی یک واکش شیمیایی با ترکیب انرژی کلی مورد نیاز برای شکستن پیوندها و انرژی آزاد شده از تشکیل پیوندهای جدید به دست میآید.
طی یک واکنش شیمیایی، پیوند شیمیایی بین اتمها ممکن است شکسته شود، دوباره تشکیل شود یا هر دو مورد انجام گیرد. طی این فرآیندها انرژی آزاد و دریافت میشود. نتیجه این تغییرات انرژی، تغییر انرژی پتانسیل کل سیستم واکنش خواهد بود. انرژی حرارتی آزاد شده یا دریافت شده یک سیستم واکنش شیمیایی در فشار ثابت، با نام آنتالپی شناخته میشود. تغییر آنتالپی که از انجام یک واکنش شیمیایی حاصل میشود، با نام آنتالپی واکنش شناخته میشود. آنتالپی واکنش معمولا با علامت «» نشان داده میشود.
مثال
برای درک بهتر مفهوم آنتالپی واکنش، واکنش هیدروژنه کردن پروپن را در نظر بگیرید. در این واکنش، گاز پروپن با گاز هیدروژن واکنش داده و گاز پروپان را تشکیل میدهد. این واکنش در تصویر زیر نمایش داده شده است.
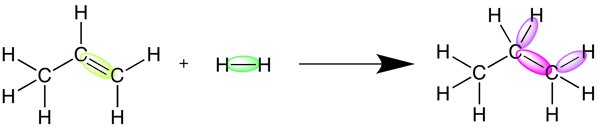
در اولین مرحله، پیوند دوگانه بین دو اتم کربن در مولکول پروپن و پیوند یگانه بین دو اتم هیدروژن در مولکول هیدروژن باید شکسته شود. همانطور که گفتیم، شکستن پیوند بین اتمها همواره نیازمند دریافت انرژی است. هرچه پیوندی که شکسته میشود قویتر باشد، انرژی بیشتری برای شکستن آن نیاز است. در این واکنش خاص، به دلیل اینکه پیوندهای تشکیل شده انرژی بیشتری از شکستن پیوندها آزاد میکنند، انرژی پتانسیل فرآوردهها از واکنش دهندهها پایینتر است. این به این معنی است که آنتالپی واکنش منفی است و واکنش در حالت کلی انرژی آزاد میکند.
اندازه گیری آنتالپی واکنش
برای اندازهگیری کمی میزان آنتالپی یک واکنش، میتوان از آنتالپی استاندارد تشکیل تمامی مولکولهای شرکتکننده در واکنش استفاده کرد. این مقادیر، میزان تغییر آنتالپی برای تشکیل یک ترکیب از عناصر تشکیلدهندهاش را توصیف میکنند. با کم کردن مقدار آنتالپی استاندارد تشکیل واکنشدهندهها از آنتالپی استاندارد تشکیل فرآوردهها، میتوان مقدار تقریبی آنتالپی واکنش را به دست آورد.
یک روش دیگر برای اندازهگیری میزان آنتالپی واکنش، درنظر گرفتن آنتالپی پیوندهای درگیر در واکنش است. با درنظر گرفتن میزان انرژی مورد نیاز برای شکستن پیوند بین اتمهای واکنشدهندهها و انرژی پیوندهای تشکیل شده فرآوردهها، میتوان میزان آنتالپی واکنش را محاسبه کرد. همچنین، روش دیگری به نام قانون هس نیز برای اندازهگیری میزان آنتالپی واکنشهای شیمیایی استفاده میشود.
آنتالپی تفکیک پیوند
آنتالپی تفکیک پیوند به انرژی مورد نیاز برای تفکیک یک پیوند شیمیایی گفته میشود. پیوندهای شیمیایی از نظر ترمودینامیکی پایدار هستند. به همین علت، شکستن آنها همواره نیازمند دریافت انرژی است. به همین علت، آنتالپی تفکیک پیوند شیمیایی همداره مقداری مثبت دارد.
پیوندهای شیمیایی بخشی مهم از واکنشهای شیمیایی هستند. با شناخت انواع پیوندهای شیمیایی و نوع تشکیل آنها میتوان به مسائل مهمی همچون تغییر انرژی سینتیکی و ترمودینامیکی واکنشها پی برد. پیشنهاد میکنیم برای آموختن درباره پیوندهای شیمیایی، فیلم آموزش پیوند شیمیایی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
آنتالپی تفکیک پیوند پیوند یک معیار از استحکام پیوند شیمیایی است، به این معنا که نشان میدهد چقدر احتمال دارد که یک جفت اتم در حضور اختلالات انرژی به پیوند خود ادامه دهند. میتوان آنتالپی تفکیک پیوند را به عنوان معیاری از پایداری که هنگام پیوند دو اتم به یکدیگر به دست میآید در مقابل حالتهای آزاد یا جداگانه آنها در نظر گرفت. در تصویر زیر، میزان آنتالپی تفکیک و واکنش آن را برای مولکلولهای آب و متان مشاهده میکنید.
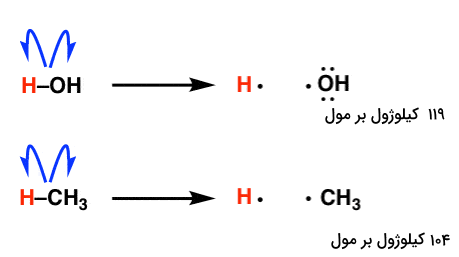
انرژی پیوند با اندازهگیری گرمای لازم برای شکستن یک مول از مولکولها به اتمهای مجزای آنها تعیین میشود و نمایانگر انرژی متوسط مرتبط با شکستن پیوندهای فردی یک مولکول است. هرچه انرژی پیوند بالاتر باشد، پیوند بین دو اتم «قویتر» گفته میشود و فاصله بین آنها (طول پیوند) کوچکتر است.
آنتالپی تشکیل پیوند
آنتالپی تشکیل پیوند مقدار انرژی آزاد شده از تشکیل یک پیوند شیمیایی از برخورد دو اتم مجزا و تک است. آنتالپی تشکیل پیوند با مقدار آنتالپی تفکیک پیوند برابر است. با این تفاوت که تشکیل پیوند انرژی آزاد میکند و میزان آنتالپی یا انرژی مورد نیاز برای تشکیل یک پیوند مقداری منفی خواهد داشت.
واکنش گرماده و گرماگیر
به شکل ریاضی، میتوان آنتالپی واکنش را برابر با تفاوت بین انرژی پتانسیل پیوند فرآوردهها و انرژی پتانسیل پیوند واکنش دهندهها در نظر گرفت. واکنشهایی که در آنها انرژی پتانسیل فرآوردهها پایینتر از واکنشدهندهها است، واکنشهای گرماده هستند. بالعکس، اگر میزان انرژی پتانسیل فرآوردهها بالاتر از واکنشدهندهها باشد، واکنش گرماگیر است.
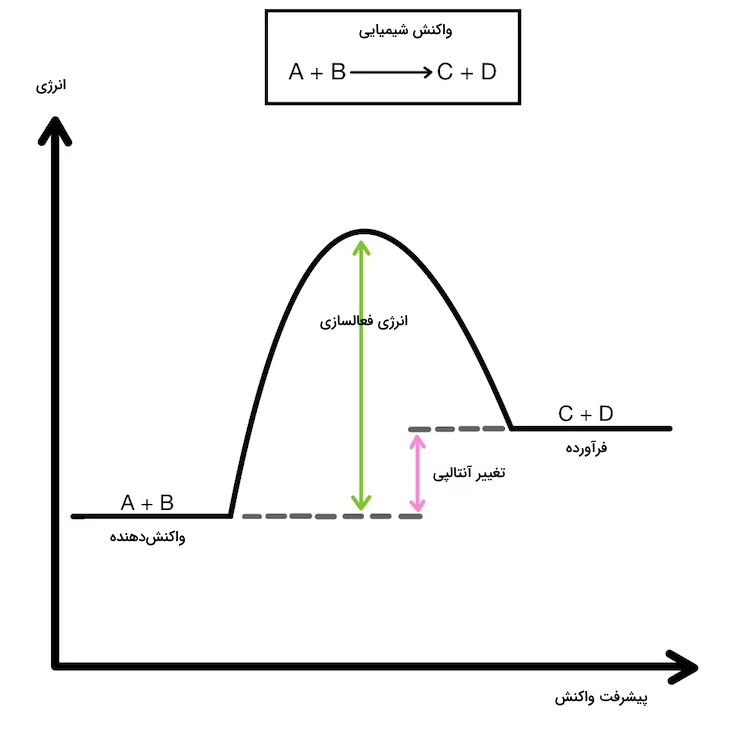
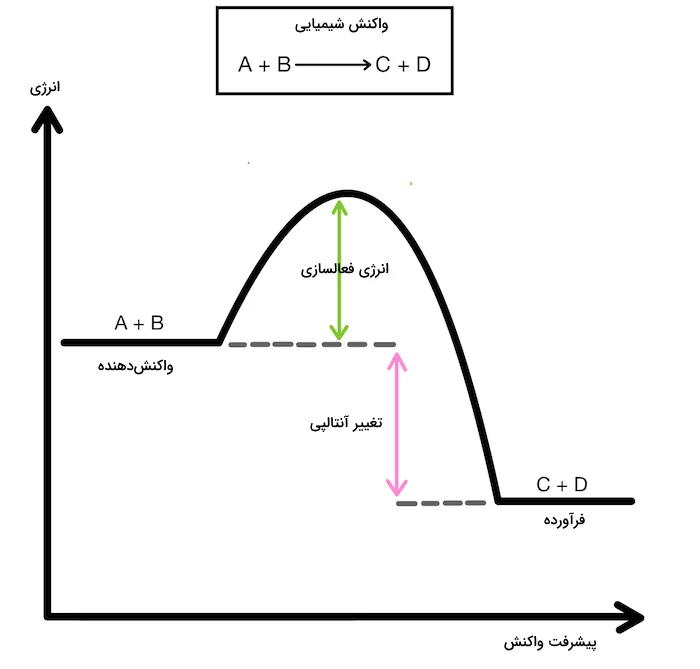
هنگامی که یک واکنش شیمیایی انجام میشود، اتمهای مواد واکنش دهنده تغییر موقعیت میدهند و پیوندهای آنها تغییر میکند تا پیوندهای جدیدی تشکیل شده و مواد فرآورده تولید شوند. در نتیجه، همواره با انجام واکنش شیمیایی، تغییر انرژی همراه خواهد بود. نمودار زیر، نمودار یک واکنش گرماگیر و انرژی دریافتی آن و موقعیت واکنشدهندهها و فرآوردهها است. انرژی فعالسازی حداقل انرژی مورد نیاز برای شروع واکنش شیمیایی است.
در برخی از واکنشهای شیمیایی، میزان انرژی فرآوردهها پایینتر از میزان انرژی واکنشدهندهها است. این به این علت است که واکنشها طی تبدیل شدن به فرآوردهها انرژی خود را از دست داده و آن را به شکل انرژی سینتیکی به محیط اطراف خود میدهند. در بیشتر موارد، انرژی آزاد شده به شکل حرارت است. در واکنشهای شیمیایی که فرآوردهها انرژی بالاتری نسبت به واکنش دهندهها دارند، انرژی باید از محیط اطراف دریافت شود. در این واکنشها معمولا انرژی حرارتی به وسیله یک منبع انرژی خارجی مانند هیتر یا شعله چراغ بونزن تامین میشود.
تشخیص واکنشهای گرماده و گرماگیر به تشخیص میزان انرژی نهایی واکنش و نسبت پایداری فرآوردهها به واکنشدهندهها کمک میکند. پیشنهاد میکنیم برای آشنایی بیشتر با روش تشخیص واکنشهای گرماده و گرماگیر، مطلب تشخیص واکنش گرماده و گرماگیر از مجله فرادرس، که لینک آن در ادامه آمده است را مطالعه کنید.
به واکنشهایی که در آنها سطح انرژی فرآوردهها از واکنشدهندهها بالاتر است و نیاز به دریافت انرژی دارند، واکنش گرماگیر و به واکنشهایی که سطح انرژی فرآوردههای آنها از واکنشدهندهها پایینتر است و انرژی آزاد میکنند، واکنش گرماده گفته میشود. میزان آنتالپی واکنش در واکنشهای گرماده منفی و در واکنشهای گرماگیر مثبت است. نمودار زیر، نمودار یک واکنش گرماده و انرژی آن و موقعیت واکنشدهندهها و فرآوردهها است.
در یک واکنش گرماده، انرژی آزاد شده از بین نمیرود. در عوض، این انرژی به انرژی سینتیکی تبدیل شده و باعث ایجاد حرارت میشود. این تغییر انرژی با افزایش دمای محیط و ظرف واکنش مشاهده میشود. از سوی دیگر، واکنشهای گرماگیر معمولا نیاز به دریافت انرژی برای انجام شدن و تشکیل فرآورده را دارند. این بدین معنی است که معمولا برای انجام این واکنشها باید حرارت به وسیله یک منبع خارجی به واکنش داده شود.
مثال تشخیص واکنش گرماده و گرماگیر
برای درک بهتر مفاهیم واکنش گرماگیر و گرماده، به مثالهای زیر توجه کنید.
مثال ۱
با توجه به توضیحات قسمت قبل، مشخص کنید واکنش زیر از کدام نوع گرماده یا گرماگیر است. سپس مشخص کنید پیوندهای مواد واکنشدهنده پایدارتر است یا پیوندهای مواد فرآورده.
پاسخ
برای تشخیص پاسخ این سوال، نیازی به انجام هیچ محاسباتی نیست. تنها با دقت به مکان انرژی حرارتی واکنش، میتوان تشخیص داد که واکنش گرماگیر است یا گرماده. اگر میزان انرژی حرارتی واکنش مانند سوال بالا در سمت فرآوردهها نوشته شده باشد، به این معنی است که گرما همراه انجام واکنش آزاد شده است و گرماده است. واکنشهایی که گرماده هستند انرژی آزاد میکنند و به سطح پایدارتری میرسند. پس مواد فرآورده در این واکنش پایدارتر هستند.
مثال ۲
با توجه به توضیحات قسمت قبل، مشخص کنید واکنش زیر از کدام نوع گرماده یا گرماگیر است. سپس مشخص کنید پیوندهای مواد واکنشدهنده پایدار است یا پیوندهای مواد فرآورده.
پاسخ
مانند سوال قبل باید به مکان قرارگیری انرژی حرارتی توجه کنیم تا بفهمیم واکنش گرماگیر است یا گرماده است. در این واکنش، انرژی حرارتی ۴۵ کیلوکالری در سمت واکنشدهندهها نوشته شده است. پس واکنش برای انجام شدن نیاز به دریافت انرژی حرارتی داشته است و گرماگیر بوده است. با توجه به این موضوع، مواد واکنشدهنده پایدارتر هستند زیرا در حالت عادی و بدون دریافت انرژی نمیتوانند به فراوردهها تبدیل شوند.
تفاوت آنتالپی پیوند و آنتالپی واکنش
تعریف آنتالپی (H) به عنوان معیاری از انرژی حرارتی کل در یک سیستم ترمودینامیکی است. حرارت واکنش (که به عنوان آنتالپی واکنش نیز شناخته میشود) تغییرات آنتالپی یک واکنش شیمیایی است که در فشار ثابت رخ میدهد. اما آنتالپی پیوند (انرژی پیوند) میزان انرژی مورد نیاز برای شکستن یک مول پیوند شیمیایی بین دو اتم در حالت گازی است.
به طور کلی، برای شکستن یک پیوند، تغییر آنتالپی مثبت مورد نیاز است، در حالی که تغییر آنتالپی منفی با تشکیل یک پیوند همراه است. بنابراین، تشکیل یک پیوند یک فرآیند گرماده است و شکستن یک پیوند یک فرآیند گرماگیر است. آنتالپی واکنش برای محاسبه مقدار انرژی به ازای هر مول که در یک واکنش آزاد یا تولید میشود، مفید است.
مقدار آنتالپی واکنش در اغلب موارد به طور مستقیم قابل اندازهگیری نیست. برای این منظور، تغییر دمای واکنش در طول زمان تا تغییر نهایی آنتالپی که با نشان داده میشود، اندازهگیری میشود. وقتی تغییر آنتالپی () مثبت باشد، واکنش اندوترمیک (گرماگیر) است. در حالی که وقتی منفی باشد، واکنش اگزوترمیک (گرماده) است.
به طور کلی، به صورت داده میشود، که در آن m جرم مواد واکنشدهنده، s ظرفیت گرمایی ویژه محصولات و تغییر دما در طول انجام واکنش است.
مقادیر آنتالپی پیوند
مقادیر آنتالپی پیوند بسیار مفید و کاربردی هستند. به همین علت، مقادیر میانگین آنتالپی پیوندهای رایج در جداول مرجع ارائه میشوند. قابل توجه است ک مقادیر آنتالپی پیوند میانگین ارائه شده در این جدولها با مقادیر واقعی تفاوت دارند. مقادیر واقعی آنتالپی پیوندهای مختلف به مولکولها و اتمهای اطراف پیوند بستگی دارد. با این حال، از مقادیر میانگین ارائه شده میتوان به عنوان یک تقریب خوب در محاسبات مختلف استفاده کرد.
نکته
مقادیر آنتالپی پیوند ارائه شده در جدولهای مرجع، مقادیر اندازهگیری شده برای یک مول پیوند تک هستند. این بدین معنا است که اگر تعداد بیشتر از آن پیوند در مولکول وجود داشته باشد، باید مقدار آنتالپی پیوند در تعداد پیوند ضرب شود. همچنین، باید از موازنه بودن واکنش شیمیایی و صحیح بودن و کمترین مقدار ممکن ضرایب استوکیومتری اطمینان حاصل کرد تا تعداد پیوندهای شیمیایی به درستی استفاده شود.
مثال
اگر میزان انرژی پیوند برای پیوند H-Cl برابر با ۴۳۱ کیلوژول بر مول باشد، میزان انرژی پیوند کلی برای ۲ مول اسید کلریدریک چقدر میشود؟
پاسخ
برای به دست اوردن میزان انرژی پیوند برای ۲ مول اسید تنها کافی است میزان انرژی پیوند داده شده را در عدد ۲ ضرب کنیم زیرا در تعریف آنتالپی پیوند میزان انرژی مورد نیاز برای شکستن ۱ مول از پیوند معرفی شده است. پس میزان انرژی پیوند ۲ مول اسید برابر با ۸۶۲ کیلوژول بر مول است.
آنتالپی پیوند برای مولکولهای دارای سه اتم یا بیشتر
اگر یک مولکول شامل چندین پیوند باشد، آنتالپی پیوند برای هر پیوند محاسبه میشود و مقدار میانگین آن در نظر گرفته میشود. به عنوان نمونه، متان () دارای چهار پیوند C-H است. مقدار میانگین انرژی این پیوندها برابر با ۱۶۵۲ کیلوژول و بهطور میانگین ۴۱۵٫۵ کیلوژول بر مول برای هر پیوند است.
وقتی که یک مولکول پیچیدهتر داریم که از سه اتم یا بیشتر تشکیل شده است، باید تمام پیوندهای موجود در مولکول را در نظر بگیریم. بنابراین، تغییر استاندارد آنتالپی برای واکنش گرماگیر که در آن تمام پیوندهای مولکول شکسته میشوند، برابر با مجموع تمام مقادیر انرژیهای پیوند خواهد بود.
علاوه بر این، آنتالپی پیوندها برای مولکولهای پیچیده مختلف به صورت مقادیر میانگین داده میشود. به عنوان مثال، پیوند C-H ممکن است توسط مولکولهای مختلف احاطه شده باشد، که به این معناست که آنتالپی پیوند احتمالا باید متفاوت باشد. با این حال، مقدار آنتالپی میانگین پیوند برای C-H یکسان است، که به این معناست که محاسبات با استفاده از مقادیر داده شده چندان قابل اعتماد نیستند.
از آنجا که انرژیهای پیوند بهطور متوسط برای تعداد زیادی مولکول که حاوی نوع خاصی از پیوند هستند، محاسبه میشوند، نتایج ممکن است به دلیل تغییرات در انرژی پیوند واقعی در مولکول خاصی که در نظر گرفته شده است، متفاوت شوند. معمولا، آنتالپیهای واکنشی که با این روش بهدست میآیند، تنها تا حدود ± ۵-۱۰% قابل اعتماد هستند.
جدول آنتالپی پیوند
در جدول زیر مقادیر آنتالپی برخی از پیوندهای مهم و پر کاربرد ارائه شده است.
| پیوند | آنتالپی پیوند (کیلوژول بر مول) |
| Cl-Cl | ۲۴۲ |
| Br-Br | ۱۹۳ |
| I-I | ۱۵۱ |
| H-F | ۵۶۷ |
| H-Cl | ۴۳۱ |
| O=O | ۴۹۵ |
| C-O | ۳۸۰ |
| O-H | ۴۶۳ |
| C-C | ۳۴۸ |
| C=O | ۷۹۹ |
| C-H | ۴۱۳ |
| C=C | ۶۱۴ |
مراحل محاسبه آنتالپی واکنش با آنتالپی پیوند
تا اینجا آموختیم آنتالپی پیوند چیست و چه تفاوتی با آنتالپی واکنش دارد. حال میتوانیم از آنتالپی پیوند برالی محاسبه آنتالپی واکنشهای شیمیایی استفاده کنیم. فرآیند محاسبه آنتالپی با استفاده از آنتالپی پیوند شامل ۵ مرحله کلی است که در ادامه توضیح داده میشود.
نکته: اگر تمامی موارد مورد بررسی در حالت گازی باشند، آنتالپی پیوند را میتوان بهطور مستقیم محاسبه کرد. اما اگر در حالت مایع باشند، انرژی اضافی برای تبدیل آنها از حالت مایع به گاز نیاز است.
مرحله اول
تشخیص این موضوع که کدام پیوندهای واکنشدهندهها شکسته میشوند و پیدا کردن آنتالپی پیوند آنها از جداول مرجع
مرحله دوم
جمع مقادیر آنتالپی پیوندهای درحال شکستن که از جدول مراجع به دست آوردهایم.
مرحله سوم
تشخیص این موضوع که کدام پیوندها در مواد فرآورده در حال تشکیل هستند و پیدا کردن آنتالپی تشکیل آنها از جداول مرجع. قبلا اشاره کردیم که آنتالپی تشکیل پیوند برابر با مقدار منفی شده آنتالپی تفکیک پیوند است.
مرحله چهارم
جمع مقادیر آنتالپی پیوندهای درحال تشکیل که از جدول مراجع به دست آوردهایم و مقادیر آنها را منفی میکنیم.
مرحله پنجم
جمع مقادیر آنتالپی پیوندهای در حال شکستن و درحال تشکیل (مراحل ۲ و ۴)
برای درک بهتر این روش محاسبه، این روش را برای واکنش هیدروژنه کردن پروپن انجام میدهیم. مقدار آنتالپی واکنش هیدروژنه کردن پروپن را با استفاده از آنتالپی پیوند مواد شرکت کننده در واکنش محاسبه کنید.
برای انجام شدن این واکنش، پیوند دوگانه کربن در پروپن و پیوند یگانه بین دو اتم هیدروژن در مولکول هیدروژن شکسته میشوند.
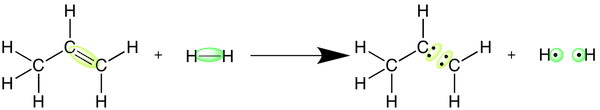
در مرحله اول با استفاده از یک جدول مرجع، مقادیر آنتالپی این پیوندها را مییابیم. در مرحله بعدی باید انرژی مورد نیاز تفکیک پیوندها را با یکدیگر جمع کنیم. در این واکنش از هر پیوند یک عدد وجود دارد.
در مرحله بعد، پیوندهایی که در حال تشکیل هستند را تشخیص داده و مقدار آنتالپی تشکیل پیوند آنها را با استفاده از جداول مرجع به دست میآوریم.
در این واکنش، با توجه به مواد فرآورده، دو پیوند (C-H) و یک پیوند (C-C) یگانه در حال تشکیل هستند. در مرحله بعد باید این مقادیر را با یکدیگر جمع کنیم. باید توجه داشته باشید که دو عدد از پیوند کربن هیدروژن در حال تشکیل داریم. همچنین، مقادیر آنتالپی پیوند در زمان تشکیل باید مقادیر منفی داشته باشند.
در مرحله آخر باید میزان انرژی پیوندهای در حال تشکیل را با میزان آنتالپی پیوندهای درحال شکستن جمع کنیم. بدین ترتیب آنتالپی واکنش از طریق زیر به دست خواهد آمد.
با توجه به منفی بودن علامت آنتالپی این واکنش شیمیایی، متوجه میشویم که واکنش گرماده است.
مثال محاسبه آنتالپی واکنش با آنتالپی پیوند
برای تمرین بهتر روش محاسبه آنتالپی واکنش به وسیله آنتالپی پیوند مواد شرکت کننده در واکنش، به مثالهای زیر توجه کنید.
مثال ۱
میزان آنتالپی واکنش هابر را با توجه به آنتالپی پیوند مواد به دست آورید. مقادیر آنتالپی پیوند در جدول زیر ارائه شده است.
| پیوند | آنتالپی میانگین پیوند (کیلوژول بر مول) |
| N-N (سهگانه) | ۹۴۵ |
| H-H | ۴۳۶ |
| N-H | ۳۹۱ |
پاسخ
برای پاسخ به این سوال، ابتدا واکنش هابر را نوشته و سپس پیوندهایی که در حال تشکیل و پیوندهایی که در حال شکستن هستند را تشخیص میدهیم.
در این واکنش، پیوندهای بین دو اتم نیتروژن و دو اتم هیدروژن در حال شکسته شدن و پیوندهای بین نیتروژن و هیدروژن در حال تشکیل هستند. میزان آنتالپی پیوندهای در حال شکسته شدن را با یکدیگر جمع میکنیم.
در این واکنش، یک پیوند نیتروژن- نیتروژن سه گانه و سه پیوند هیدروژن – هیدروژن در حال شکسته شدن هستند.
حال میزان آنتالپی پیوندهای در حال تشکیل را جمع میکنیم. در این واکنش، ۶ پیوند نیتروژن – هیدروژن در حال تشکیل هستند.
در نهایت، مقادیر به دست آمده آنتالپی پیوند تشکیل و تفکیک را با یکدیگر جمع میکنیم.
مثال ۲
میزان آنتالپی واکنش یک مول استیلن را با استفاده از جدول داده شده به دست آورید.
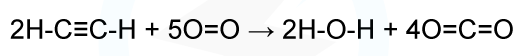
| پیوند | آنتالپی پیوند میانگین (کیلوژول بر مول) |
| C-H | ۴۱۴ |
| C-C (سهگانه) | ۸۳۹ |
| O=O | ۴۹۸ |
| C=O | ۸۰۴ |
| O-H | ۴۶۳ |
| O-C | ۳۵۸ |
پاسخ
در مرحله اول پیوندهای در حال شکستن و تعداد آنها را پیدا کرده و مقادیر آنتالپی تشکیل پیوند را با یکدیگر جمع میکنیم. در این واکنش، باید ضرایب استوکیومتری را بر عدد ۲ تقسیم کنیم تا مقادیر را طبق خواسته صورت سوال، برای یک مول از استیلن به دست آوریم. محاسبات مربوط به آنتالپی پیوند تشکیل در این واکنش به شکل زیر است.
در این واکنش یک پیوند سه گانه کربن – کربن، ۲ پیوند یگانه کربن – هیدروژن و ۲٫۵ پیوند دوگانه اکسیژن-اکسیژن وجود دارند که در حال شکسته شدن هستند. در ادامه، مقادیر آنتالپی پیوند را برای موادی که در حال تشکیل هستند محاسبه میکنیم. مقادیر آنتالپی پیوند در این پیوندها باید با علامت منفی درج شود. دو پیوند هیدروژن – اکسیژن و ۴ پیوند دوگانه کربن – اکسیژن در حال تشکیل هستند.
در نهایت مقادیر به دست آمده را با یکدیگر جمع میکنیم تا مقدار آنتالپی واکنش کلی به دست آید.
مثال ۳
میزان آنتالپی واکنش زیر را با استفاده از جدول داده شده به دست آورید.
| پیوند | آنتالپی پیوند (کیلوژول بر مول) |
| C-H | ۴۱۳ |
| Cl-Cl | ۲۴۳ |
| C-Cl | ۳۴۶ |
| H-Cl | ۴۳۲ |
پاسخ
با توجه به جدول و واکنش کلی، ۱ پیوند کربن – هیدروژن و ۱ پیوند کلر- کلر در حال شکستن هستند. مقدار آنتالپی پیوندهای در حال تفکیک در زیر محاسبه شده است.
همچنین، ۱ پیوند کربن – کلر و یک پیوند هیدروژن – کلر در حال تشکیل هستند. مقدار آنتالپی پیوندهای در حال تشکیل در زیر محاسبه شده است.
در نهایت، مقدار آنتالپی پیوند از روش زیر محاسبه میشود.
مثال ۵
در واکنش سوختن اتانول، آنتالپی واکنش را با استفاده از آنتالپی پیوند مواد با توجه به جدول به دست آورید.
| پیوند | آنتالپی پیوند (کیلوژول بر مول) |
| C-H | ۴۱۳ |
| C-C | ۳۴۸ |
| C-O | ۳۵۸ |
| O=O | ۴۹۵ |
| C=O | ۷۹۹ |
| O-H | ۴۶۳ |
پاسخ
برای پاسخ به این پرسش ابتدا باید پیوندهای در حال تشکیل و پیوندهای در حال تفکیک را تشخیص دهیم. برای درک بهتر این موضوع، واکنش را ابتدا به صورت زیر مینویسیم.
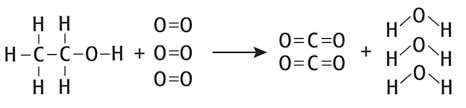
با توجه به تصویر متوجه میشویم ۵ پیوند هیدروژن – کربن، ۱ پیوند کربن – کربن، یک پیوند یگانه کربن – اکسیژن و سه پیوند دوگانه اکسیژن – اکسیژن درحال تفکیک هستند. همچنین، ۴ پیوند کربن – اکسیژن دوگانه و ۵ پیوند یگانه اکسیژن – هیدروژن در حال تشکیل هستند.
آنتالپی واکنش با توجه به تعداد پیوندها و مقادیر آنتالپی پیوند تفکیک و تشکیل به روش زیر محاسبه میشود.
مثال ۶
میزان تغییر آنتالپی را برای واکنش زیر به دست آورید و توضیح دهید واکنش گرماگیر است یا گرماده؟
- میزان آنتالپی پیوند (H-H): ۴۳۶ کیلوژول بر مول
- میزان آنتالپی پیوند (H-I): ۲۹۷ کیلوژول بر مول
- میزان آنتالپی پیوند (I-I): ۱۵۱ کیلوژول بر مول
پاسخ
در این واکنش شیمیایی، یک پیوند (هیدروژن- هیدروژن) و یک پیوند (ید – ید) در حال شکستن هستند. همچنین، ۲ پیوند (هیدروژن – ید) در حال تشکیل هستند. با توجه به مقادیر ارائه شده، میزان آنتالپی واکنش از محاسبات زیر به دست میآید.
با توجه به اینکه علامت آنتالپی کلی واکنش منفی است، گرما آزاد شده و واکنش گرماده است.
آنتالپی میانگین پیوند
در قسمتهای قبلی اشاره کردیم که میزان آنتالپی پیوند مواد مختلف در شرایط مختلف متفاوت است و مقدار نظری آن با مقدار عملی متفاوت خواهد بود. این پدیده به این علت است که در محیطهای متفاوت، میزان آنتالپی پیوند تحت تاثیر قرار میگیرد. به همین علت، یک میانگین از مقادیر آنتالپی پیوند برای پیوندهایی مشخص ولی در شرایط متفاوت اندازهگیری شده است. این مقادیر، با نام آنتالپی میانگین پیوند (آنتالپی متوسط پیوند) شناخته شدهاند. از آنجا که اندازهگیری میزان انرژی پیوندها به شکلی مستقیم امکانپذیر نیست، مقادیر آنتالپی میانگین پیوند با استفاده از واکنشهای چرخهای محاسبه میشود.
برای مثال، انرژی شکست پیوند HO-H در یک مولکول آب برابر با ۴۹۳ کیلوژول بر مول است، که انرژی مورد نیاز برای شکستن این پیوند و تولید یون هیدروکسیل (OH−) است. پس از آن، شکستن پیوند O-H در یون هیدروکسیل تولید شده به انرژی اضافی ۴۲۴ کیلوژول بر مول نیاز دارد. بنابراین، انرژی پیوند میانگین برای پیوند O-H در آب برابر با ۴۵۸٫۹ کیلوژول بر مول گزارش میشود که میانگین دو انرژی شکست پیوند است.
انرژیهای شکست پیوند به انرژیهای مورد نیاز برای شکستن پیوندهای فردی در یک مولکول اشاره دارند و این انرژیها بسته به موقعیت پیوندی که در یک مولکول شکسته میشود، متفاوت است. از سوی دیگر، آنتالپی پیوند، میانگین این انرژیهای شکست پیوند است. خواص دقیق یک نوع پیوند به طور جزئی به طبیعت دیگر پیوندهای موجود در مولکول بستگی دارد. برای مثال، انرژی پیوند C-H و طول آن میتواند بسته به اینکه چه اتمهایی به اتم کربن متصل هستند، متفاوت باشد. به همین دلیل، مقادیر موجود در جداول انرژی پیوند و طول پیوند معمولا میانگینی از اندازهگیریهای مختلفی است که روی ترکیبهای مختلفی که شامل جفتهای اتمی خاص هستند، انجام شده است.
انواع دیگر آنتالپی پیوند
در قسمتهای قبل آموختیم که آنتالپی تفکیک یا آنتالپی پیوند انرژی لازم برای شکستن یک مول پیوند خاص و تفکیک آن به اتمهای گازی است. انواع مختلفی از آنتالپی پیوند میتواند بنابر نوع پیوند و تفکیک آن تعریف شود. برخی از انواع آنتالپی پیوند عبارتند از آنتالپی اتمی کردن، آنتالپی تصعید، آنتالپی تغییر حالت، آنتالپی تبخیر استاندارد و … که برخی از آنها در ادامه توضیح داده میشوند.
آنتالپی اتمی کردن
آنتالپی اتمی کرد (اتمیزه کردن) به میزان تغییر انرژی حرارتی گفته میشود که صرف تولید عناصر خالص از یک ماده میشود. آنتالپی اتمی کردن همواره مقدار مثبتی دارد و نمیتواند منفی باشد. این آنتالپی با علامت نشان داده میشود. این تغییر آنتالپی زمانی اتفاق میافتد که یک مول از یک ماده به شکلی کامل تفکیک شود و محصوص تفکیک، اتمهای سازنده ماده باشند. این تفکیک در شرایط ۲۹۸٫۲۵ درجه کلوین و فشار ۱ بار اتفاق میافتد. برای مثال، آنتالپی تفکیک گاز کلر، مربوط به انجام واکنش تفکیک زیر است.
آنتالپی تغییر فاز (تغییر حالت)
هنگامی که یک ماده تغییر حالت میدهد، انرژی حرارتی دریافت یا آزاد میشود. برای مثال، هنگامی که یخ ذوب میشود، انرژی دریافت میکند. این آنتالپی در کتب درسی به عنوان آنتالپی پیوند تعریف نمیشود زیرا اتمهای سازنده ماده تفکیک نمیشوند. اما در حقیقت در این واکنشها نیز انرژی حرارتی صرف شکستن پیوندهای بین مولکول (واندروالسی ) مواد میشود.
آنتالپی استاندارد تبخیر
در دما و فشار ثابت، مقدار حرارتی که صرف تبخیر یک مول مایع میشود، آنتالپی استاندارد تبخیر آن است. این نوع واکنش نیز از نوع تغیر حالت و شکسته شدن پیوندهای واندروالسی است و به عنوان آنتالپی پیوند بررسی نمیشود.
تغییر و انتقال انرژی در این واکنشهای فیزیکی در برخی از منابع به عنوان آنتالپی پیوند معرفی شدهاند.
آنتالپی پیوند در حضور مواد مایع
استفاده از آنتالپی پیوند برای محاسبه میزان آنتالپی واکنش تنها زمانی قابل انجام است که تمامی مواد در فاز گازی باشند. استفاده از مقادیر آنتالپی پیوند برای مواد مایع مقادیر دقیق و نزدیک به مقادیر عملی آنتالپی واکنش را نتیجه نمیدهد. اگر یک یا چند ماده به صورت مایع وجود داشته باشند، به مقداری انرژی اضافی برای تغییر حالت از مایع به گاز نیاز است. این مقدار انرژی مقدار تغییر آنتالپی تبخیر نامیده میشود و با نماد یا نشان داده میشود.
تغییر آنتالپی تبخیر زمانی تعریف میشود که یک مول از مایع در نقطه جوش خود و تحت فشار ۱۰ کیلوپاسکال (۱ بار) به گاز تبدیل شود. در برخی از منابع فشار مورد نیاز برای اندازهگیری آنتالپی تبخیر، ۱ اتمسفر در نظر گرفته شده است. برای مثال، در مورد مولکولهای آب، آنتالپی تبخیر برابر با ۴۱ کیلوژول بر مول است. این عبارت به این معنی است که برای تبدیل ۱ مول آب به بخار آب، ۴۱ کیلوژول انرژی نیاز است. اگر ۱ مول بخار آب دوباره به آب تبدیل شود، تغییر آنتالپی برابر با منفی ۴۱ کیلوژل خواهد بود.
برای درک بهتر نحوه انجام محاسبات مربوط به آنتالپی واکنش در حضور مواد مایع، واکنش سوختن متان را در نظر بگیرید.
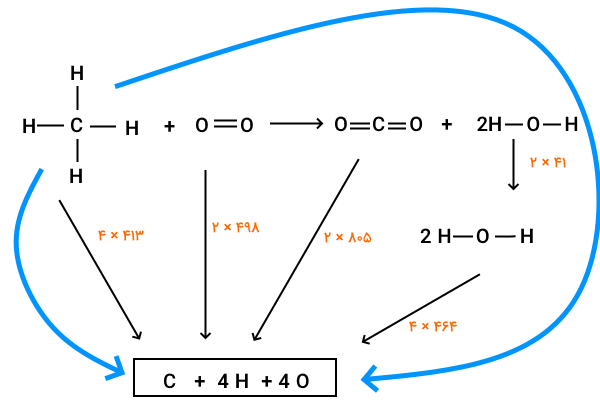
این نمودار شاید در نگاه اول پیچیدهتر از چرخههایی به نظر برسد که قبلا بررسی کردهایم، اما بهجز مرحله اضافی مربوط به تغییر آنتالپی تبخیر، پیچیده نیست. محاسبات این واکنش با توجه به تصویر و مقادیر آنتالپی پیوند و آنتالپی تبخیر به شکل زیر انجام میشود.
عوامل تاثیرگذار بر آنتالپی پیوند
برخی از عوامل میتوانند تاثیر مهمی بر مقدار آنتالپی پیوند بگذارند. در ادامه هریک از این عوامل بررسی میشوند. این عوامل شامل طول پیوند، تعداد جفت الکترونهای غیرپیوندی اتمها، مرتبه پیوند و آرایش الکترونی اتمها هستند.
آنتالپی پیوند با ویژگیهای اتمها تغییر میکند. برای مثال، هرچه اندازه اتم بزرگتر باشد، اندازه پیوند آن بلندتر میشود. هرچه آنتالپی پیوند کمتر باشد، قدرت پیوند کمتر است. همچنین، پیوندهای چندگانه، آنتالپی پیوند بیشتری نسبت به پیوندهای یگانه دارند.
تعداد جفت الکترونهای غیرپیوندی اتمها بر آنتالپی پیوند تاثیر میگذارد. هرچه دافعه بین اتمها در اثر وجود این الکترونها بیشتر باشد، آنتالپی پیوند کمتر است. مرتبه پیوند نیز بر آنتالپی پیوند تاثیر میگذارد. هرچه مرتبه پیوند بیشتر باشد، اندازه پیوند کوتاهتر و آنتالپی پیوند بییشتر است.
آرایش الکترونی اتمها نیز در آنتالپی پیوند تاثیرگذار است. برای مثال، الکترونهای لایه ظرفیت با این ترتیب آنتالپی پیوند بیشتری دارند.
قانون هس
یکی دیگر از روشهای محاسبه آنتالپی واکنش، استفاده از قانون هس است. قانون هس نسخهای از قانون اول ترمودینامیک است که بیان میکند تغییر آنتالپی کل برای یک واکنش مستقل از مسیری است که واکنش طی میکند.
برای بسیاری از فرآیندهای شیمیایی، اندازهگیری مستقیم تغییر آنتالپی ممکن نیست. این مسئله به دلایل مختلفی از جمله مسائل عملی یا حتی انجامپذیری آزمایش در محیط آزمایشگاهی بستگی دارد. در این موارد، با استفاده از تغییرات آنتالپی فرآیندهای دیگر، میتوانیم یک مسیر جایگزین از واکنشدهندهها به محصولات بسازیم.
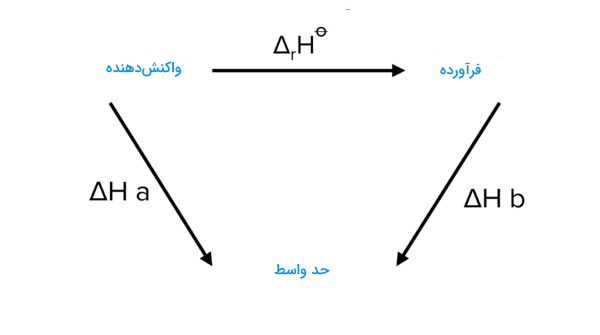
در واکنش بالا، واکنش میتواند دو مسیر مختلف را طی کند. در مسیر دوم، مقدار را کم میکنیم. میدانیم که باید را کم کنیم زیرا داریم در جهت مخالف پیکان مربوطه در چرخه هس حرکت میکنیم. این یک قاعده پذیرفته شده است که هنگام انجام محاسبات چرخه هس، مقادیر آنتالپیها قابل جمع هستند (یعنی در عبارت خود آنها را اضافه میکنیم) زمانی که در جهت پیکان مربوطه حرکت میکنیم. زمانی که در جهت مخالف پیکان حرکت میکنیم، مقدار آنها را کم میکنیم.
در ادامه مثالی را برای درک بهتر این روش به دست آوردن آنتالپی واکنش بررسی میکنیم. بنابر قانون هس، اگر واکنش از چند مرحله مختلف تشکیل شده باشد، آنتالپی کلی واکنش برابر با جمع آنتالپی مراحل مختلف است. این مراحل باید به گونهای دسته بندی و مرتب شوند که برآیند آنها واکنش اصلی را نتیجه دهد. برای مثال، واکنشهای زیر را در نظر بگیرید.
با دقت به واکنشهای بالا درمییابیم برآیند دو واکنش دوم و سوم، واکنش اول را نتیجه میدهد. پس میتوانیم برای به دست آوردن آنتالپی واکنش بالایی، آنتالپی دو واکنش دیگر را جمع کنیم.
آنتالپی واکنش کلی از روش زیر به دست میآید.
در ادامه برای درک بهتر این روش محاسبه، مثال زیر را حل کنید.
مثال
با استفاده از قانون هس، آنتالپی واکنش تولید کلرید آهن (III) را با استفاده از دو مرحله واکنش زیر به دست آورید.
پاسخ
برای به دست آوردن آنتالپی واکنش تولید کلرید آهن از قانون هس، باید واکنشهای داده شده را به شیوهای مرتب کنیم و آنتالپی آنها را جمع کنیم تا به واکنش زیر برسیم.
با توجه به این واکنش متوجه میشویم که با جمع واکنشهای داده شده به واکنش کلی میرسیم. پس آنتالپی این واکنش از طریق زیر به دست میآید.
یادگیری ترمودینامیک در شیمی با فرادرس
قوانین ترمودینامیک و کاربرد آنها، در شناسایی مواد و واکنشهای شیمیایی و یادگیری مباحثی چون مغناطیس، قطبشپذیری و الاستیسیته بسیار مفید است. ترمودینامیک، شرایط لازم برای انجام واکنشهای شیمیایی را بررسی میکند. برای یادگیری ترمودینامیک باید با مفاهیمی چون آنتالپی و آنتروپی، تعادل بین فازها، تغییرات انرژی و … آشنا شوید. با شناخت اصول و قواعد ترمودینامیک مواد، میتوانید مسائل مربوط به ترمودینامیک محلولها، مسائل مربوط به تعادل واکنشهای شیمیایی و …. را حل کنید. پیشنهاد میکنیم برای یادگیری بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش ترمودینامیک فرادرس مراجعه کنید که با زبانی ساده و به شکلی کاربردی این مسائل و مفاهیم را بررسی میکند.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه ترمودینامیک دسترسی داشته باشید.
انرژی بین دو اتم به عنوان تابعی از فاصله بین هستهای
یک منحنی مور نشان میدهد که چگونه انرژی یک سیستم دو اتمی با توجه به فاصله بین هستهای تغییر میکند. منحنی مور نموداری از انرژی پتانسیل در برابر فاصله بین دو اتم است. انرژی پیوند مقدار انرژی است که باید از حداقل انرژی پتانسیل تا نقطه انرژی صفر اضافه شود. این نقطه نشاندهنده وضعیتی است که در آن دو اتم به طور بینهایت از یکدیگر دور هستند، یا به عبارتی، به صورت عملی هیچ پیوندی با یکدیگر ندارند.
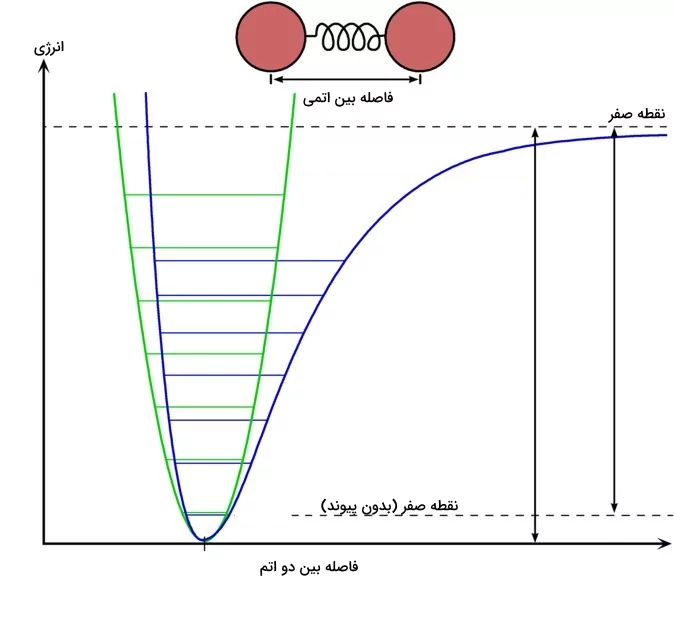
در فواصل بالای اتمها از یکدیگر، انرژی برابر با صفر است. بدین معنی که هیچ برهمکنشی بین مواد نیست. این دادهها با درک ما از اتمهایی که بی نهایت با یکدیگر فاصله دارند و با یکدیگر برهمکنش ندارند هماهنگ است. در فواصل بین هستهای که انرژی به حداقل مقدار خود میرسد، پیوند پایداری با طول مشخص بین اتمها برقرار میشود.
فاصله بین دو اتم که در یک پیوند درگیر هستند میتواند با آزمایشهایی خاصی اندازهگیری شود. برای مثال میتوان از تابش پرتو ایکس در این اندازهگیریها بهره برد. در این روش، پرتو ایکس به ساختارهای بلوری تابانده شده و میزان پراش آن اندازهگیری میشود. در نهایت این اندازهگیریها به همراه حجم کلی مولکول با محاسباتی میتواند اندازه فواصل بین اتمی را اندازهگیری کند.
این طول پیوند به عنوان یک مقدار «تعادلی» شناخته میشود، زیرا حرکت گرمایی باعث میشود دو اتم حول این فاصله ارتعاش کنند، درست مانند یک فنر که به دور فاصله تعادلی یا بدون کشیدگی خود، به جلو و عقب ارتعاش میکند. یک منحنی مور برای پیوندهایی که بین جفتهای مختلف اتمها تشکیل میشود، حداقل انرژی و وابستگی فاصله متفاوتی خواهد داشت. به طور کلی، هرچه پیوند بین دو اتم قویتر باشد، حداقل انرژی پایینتر و طول پیوند کوتاهتر است. آنتالپی پیوند مقدار کاری است که باید انجام شود تا دو اتم به طور کامل از هم جدا شوند.
جمعبندی
در این مطلب از مجله فرادرس آموختیم آنتالپی پیوند چیست و چگونه از آن در محاسبات مختلف استفاده میشود. آنتالپی پیوند مقدار انرژی است که صرف شکستن یک مول از یک پیوند در حالت گازی میشود. میزان آنتالپی پیوند با عوامل مختلفی مانند اتمها و الکترونهای نزدیک به پیوند تغییر میکند به همین علت مقادیر میانگین تجربی اندازهگیری شده برای هر پیوند در محیطهای متفاوت به عنوان آنتالپی پیوند میانگین ارائه شده است. مقدار آنتالپی پیوند همواره مقدار مثبتی دارد. به عکس، با تشکیل پیوند انرژی آزاد میشود و مقدار انرژی تشکیل پیوند مقداری منفی دارد.
در واکنشهای مختلف میتوان مقدار انرژی آنتالپی کلی واکنش را با استفاده از مقادیر آنتالپی پیوندهای درحال تفکیک و تشکیل واکنش اندازهگیری کرد. این مقادیر به دست آمده با تقریب خوبی به آنتالپی واقعی واکنش نزدیک هستند. آنتالپی واکنش مقدار انرژی پتانسیل کلی واکنش است که به شکل انرژی حرارتی در واکنشهای مختلف آزاد یا دریافت میشود اما آنتالپی پیوند تنها به شکستن پیوند بین اتمهای تک و در حالت گازی اندازهگیری و تعریف میشود.
source