شعاع یونی فاصله بین خارجیترین لایه الکترونی یک یون از هسته آن یون است. شعاع یونی نشاندهنده اندازه یک یون در یک بلور ترکیب یونی است. در بلورهای یونی، یونها به وسیله پیوندهای یونی به یکدیگر متصل شدهاند. شعاع یونی یک یون مشابه شعاع اتمی یک اتم است. شعاع یونی به فاصلهای از هسته یک یون تا دورترین ناحیه ابر الکترونی (الکترون لایه ظرفیت) آن گفته میشود. مقدار شعاع یونی به عواملی مانند بار یون و محیطی که یون در آن قرار دارد، بستگی دارد. شعاع یونی کاتیون کوچکتر از اتم خنثی آن و شعاع آنیون بزرگتر از اتم خنثی آن است. در این مطلب از مجله فرادرس میآموزیم شعاع یونی چیست و چگونه تغییر میکند.

در ابتدای این مطلب میآموزیم شعاع یونی چیست. سپس به بررسی تفاوتهای شعاع اتمی و شعاع یونی میپردازیم. در ادامه، روشهای اندازهگیری شعاع یونی عناصر و یونهای مختلف را بررسی میکنیم. یکی از مهمترین مباحث ارائه شده در مورد شعاع یونی، آموختن روش مقایسه صحیح شعاع یونی عناصر با توجه به موقعیت آنها در جدول تناوبی است. در ادامه متن با آموختن روش مقایسه شعاع یونی عناصر، مثالهایی را برای درک بهتر آن ارائه و بررسی میکنیم. سپس میآموزیم بار موثر هسته اتم چیست و چه تأثیری بر شعاع یونی دارد. با مطالعه این مطلب تا انتها میتوانید با این مباحث مهم و کاربردی آشنا شوید.
شعاع یونی چیست؟
شعاع یونی بیشترین فاصله بین آخرین لایه الکترونی (بیرونیترین لایه الکترون) یون و هسته آن یون است. شعاع یونی را میتوان به وسیله اندازهگیری طول پیوند یونی بین دو یون به دست آورد. هرچند، اندازه گیری دقیق مقدار شعاع یونی بسیار دشوار است. این پدیده به این علت است که شعاع یونی و فاصله بین هسته یونهای مختلف بسته به محیطی که در آن قرار دارند و پیوندهایی که برقرار کردهاند، متفاوت است.
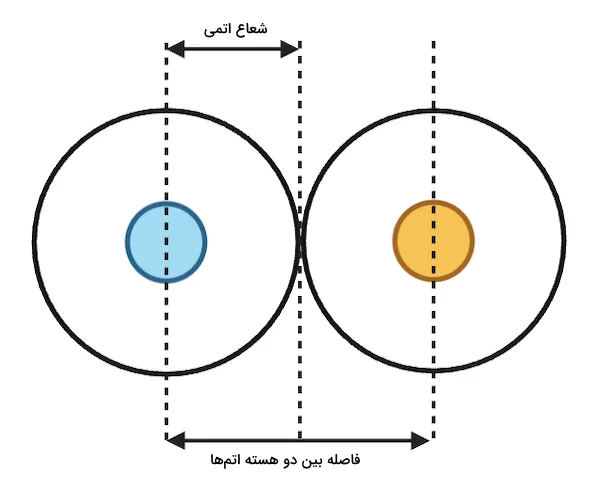
یونها زمانی تشکیل میشوند که یک اتم الکترون از دست بدهد یا الکترون به دست آورد. هنگامی که یک اتم الکترون از دست میدهد، کاتیون (یون مثبت) تشکیل میشود و وقتی الکترون به دست میآورد، به آنیون (یون منفی) تبدیل میشود. شعاع یونی را میتوان بهعنوان فاصله بین هسته یک یون و بیرونیترین لایه الکترونی آن توصیف کرد. اندازه شعاع یونی به عدد کئوردیناسیون ترکیبات کئوردیناسی و جهت اسپین (چرخش) یونها وابسته است. اندازه شعاع یونی معمولا با اندازهگیری فاصله بین دو هسته یون درگیر در یک پیوند یونی و تقسیم آن بر اندازه اتمها اندازهگیری میشود. شعاع یونی بر حسب پیکومتر (pm) یا نانومتر (nm) اندازهگیری میشود. تصویر زیر نشاندهنده شعاع یونی در یک ترکیب یونی است.

اشاره کردیم که شعاع یونی تحت تاثیر اسپین یون و عدد همبستگی (کئوردینانسیون) یون قرار میگیرد. همچنین تعداد پیوندها، اتمها یا یونهای اطراف آن یون، بر شعاع یونی اثر میگذارد. به عنوان مثال، یونهایی که اسپین بزرگتری دارند، شعاع یونی بزرگتری دارند. همچنین، شعاعی یونی یونهایی که در اطرافشان پیوندهایی وجود دارد، افزایش مییابد. زیرا بارهای مختلف از جهات مختلف آن یونها را جذب میکنند.
یادگیری شیمی دهم با فرادرس
برای یادگیری مبحث شعاع یونی در مقطع شیمی دهم متوسطه، ابتدا باید با مفاهیم پایهای مانند یونها و نحوه تشکیل آنها آشنا شوید. سپس به بررسی تفاوت بین کاتیونها و آنیونها پرداخته و تأثیر آنها بر شعاع یونی را مطالعه کنید. در مرحله بعد، به روند تغییر شعاع یونی در جدول تناوبی بپردازید و تفاوتهای آن در گروهها و دورهها را بررسی کنید. همچنین، با مفاهیم شعاع یونی و شعاع اتمی و ارتباط آنها آشنا شوید. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم به مجموعه دروس پایه دهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شعاعی یونی دسترسی داشته باشید.
تفاوت شعاع اتمی و شعاع یونی چیست؟
تا اینجا آموختیم شعاع اتمی و شعاع یونی چیست. شعاع یونی یک عنصر با شعاع اتمی آن متفاوت است. یونهای مثبت کوچکتر از اتمهای خنثی خود هستند، در حالی که یونهای منفی اندازه بزرگتری نسبت به اتمهای خنثی دارند. یک پیوند یونی زمانی تشکیل میشود که اتمی یک یا تعداد بیشتری از الکترونهای خود را از دست بدهد و اتم دیگر الکترونها را دریافت کند.
به اتمی که الکترون از دست میدهد «کاتیون» و به اتمی که الکترون دریافت میکند «آنیون» گفته میشود. شعاع یونی کاتیونها معمولا کوچکتر از شعاع اتمی آنها است. این پدیده به این علت است که وقتی یک اتم الکترون از دست میدهد ، یک لایه الکترونی از لایههای الکترونی آن کم میشود.
همچنین اثر جاذبه هسته بر الکترونهای باقی مانده بیشتر شده و به هسته اتم کمی نزدیکتر میشوند. از طرف دیگر، اندازه شعاع یونی آنیون از شعاع اتمی آن بزگتر است. هنگامی که الکترون به لایه ظرفیت اتم اضافه میشود، الکترونهای این لایه به یکدیگر دافعه وارد کرده و از یکدیگر دور میشوند. این پدیده باعث افزایش شعاع یونی میشود. پس عوامل تأثیرگذار بر مقدار شعاع یونی موارد زیر هستند.
- اثر دافعه الکترونهای آخرین لایه در آنیونها
- اثر افزایش لایه الکترونی برای الکترونهای لایه آخر آنیونها
- اثر جاذبه هسته بر الکترونهای باقیمانده در کاتیونها
- اثر کاهش لایه الکترونی در کاتیونها
تصویر زیر نمایانگر تفاوت شعاع یونی و اتمی اتمهای مختلف و یونهای آنها است. کرهها و اعداد صورتی و آبی در تصویر به ترتیب نشاندهنده شعاع کاتیونها و آنیونها هستند.
برای درک بهتر این مفاهیم به تفاوت شعاع یونی و شعاع اتمی اتم های سدیم و کلر دقت کنید.
- شعاع یونی کاتیون سدیم ۱۱۶ پیکومتر و اندازه شعاع اتمی اتم سدیم خنثی، ۱۵۴ پیکومتر است.
- شعاع یونی آنیون کلر ۱۶۷ پیکومتر و شعاع اتمی اتم کلر خنثی ۹۹ پیکومتر است.
بیشتر اتمهای جدول تناوبی (بجز گازهای نجیب) با از دست دادن یا دریافت الکترون، یون تشکیل میدهند. اندازه شعاع یونی یک کاتیون از شعاع اتم والد خود کوچکتر خواهد بود. از طرف دیگر، آنیون نسبت به اتم والد خود اندازه بزرگتری دارد. این تفاوت به این دلیل است که وقتی یک اتم الکترون دریافت میکند، تعداد کل الکترونها افزایش مییابد که باعث افزایش نیروی دافعه میان الکترونها میشود و در نتیجه تأثیر خالص بار موثر هسته را کاهش میدهد. همچنین، از دست دادن الکترنهای لایه ظرفیت برای تولید کاتیون معمولا با از دست رفتن کل لایه ظرفیت اتم انجام میشود که این خود باعث میشود شعاع یونی کاتیون نسبت به شعاع اتمی اتم مادر، کوچکتر شود.
برای تشخیص سازوکار و روند تغییر شعاع یونی عناصر باید به شکلی کامل با مفاهیم یون، کاتیون و آنیون آشنا باشید. پیشنهاد میکنیم برای یادگیری بهتر این مباحث، فیلم آموزش یونهای مثبت و منفی فرادرس که لینک آن در ادامه آمده است را مشاهده کنید.
تعریف شعاع اتمی
شعاع اتمی عناصر، فاصله بین هسته آنها تا آخرین لایه الکترونی (لایه ظرفیت) آنها در نظر گرفته میشود. این شعاع اتمی با اندازهگیری فاصله بین هسته دو اتم یکسان درگیر در پیوند و تقسیم آن بر عدد ۲ اندازهگیری میشود. مقدار شعاع اتمی ثابت نیست و بسته به پیوندی که اتم در آن شرکت میکند، متفاوت است. برای مثال، اتمها میتوانند پیوندهای کواالانسی یا واندروالسی تشکیل دهند. بسته به این پیوندها، میتوان برای اتمها شعاع کووالانسی یا واندروالسی را اندازهگیری کرد. شعاع اتمی در تصویر زیر مشخص شده است.
شعاع کووالانسی، نصف اندازه پیوند کووالانسی است. شعاع واندروالسی برای توصیف اندازه و فاصله بین اتمهایی که در یک پیوند نیستند استفاده میشوند. پیوند کووالانسی به فاصله بین هستههای دو اتم پیوندی اشاره دارد. شعاع کووالانسی نصف فاصله بین هستههای دو اتم پیوندی تکاتمی از یک اتم مشابه است. این در حالی است که شعاع واندروالس برای تعریف نصف فاصله نزدیکترین برخورد دو اتم غیرپیوندی از یک عنصر معین استفاده میشود. با شناخت شعاع اتمی راحتتر میتواند دریافت که شعاع یونی چیست.
شعاع کووالانسی
شعاع کووالانسی به اندازه یک اتم که بخشی از یک پیوند کووالانسی تک است، اشاره دارد. شعاع کووالانسی معمولا با واحدهای پیکومتر (pm) یا انگستروم () بیان میشود. به طور نظری، مجموع دو شعاع کووالانسی باید برابر با طول پیوند کووالانسی بین دو اتم باشد، اما در عمل طول پیوند به محیط شیمیایی بستگی دارد.
زمانی که یک پیوند کووالانسی بین دو اتم وجود دارد، شعاع کووالانسی قابل تعیین است. وقتی دو اتم از یک عنصر به طور کووالانسی پیوند برقرار میکنند، شعاع هر اتم نصف فاصله بین دو هسته خواهد بود زیرا هر دو اتم به طور مساوی الکترونها را جذب میکنند. فاصله بین دو هسته، قطر یک اتم را نشان میدهد، اما برای به دست آوردن شعاع باید نصف این قطر را در نظر گرفت.
شعاع کووالانسی و شعاع یونی ممکن است بزرگتر یا کوچکتر از شعاع اتمی یک اتم از یک عنصر باشند. به طور کلی، شعاع اتمی یک روند مشخص در جدول تناوبی دارد که در آن شعاع با حرکت به سمت پایین یک گروه از عناصر افزایش مییابد و با حرکت از چپ به راست در یک دوره کاهش مییابد. تصویر زیر نشاندهنده روش به دست آوردن شعاع کووالانسی است.

شعاع واندروالسی
شعاع واندروالسی برابر است با نصف فاصله بین دو اتم غیرپیوندی است، هنگامی که نیروهای الکترواستاتیک بین آنها متعادل باشند. به عبارت دیگر، این فاصله نصف نزدیکترین فاصله بین دو اتم است که پیوندی ندارند یا در یک مولکول قرار ندارند. معمولاً واحد اندازهگیری برای گزارش این مقدار، پیکومتر (pm) است.
این فاصله منعکسکننده اثر نیروهای بین مولکولی (مثل نیروهای دو قطبی – دو قطبی) است و به تعاملات مروبط به پیوندهای واندروالسی مربوط میشود. دانستن شعاع واندروالس میتواند در پیشبینی چگونگی تراکم اتمها برای تشکیل یک جامد مفید باشد. همچنین، شناخت این شعاع و انواع دیگر شعاع اتمی به ما کمک میکند بیاموزیم شعاع یونی چیست.
اندازهگیری شعاع یونی
یکی از روشهای اندازهگیری تقریبی شعاع یونی، اندازهگیری فاصله بین هسته یک کاتیون تا هسته آنیون مجاور آن در یک ترکیب یونی است. روش های متفاوتی برای محاسبه و تقسیم و اندازهگیری شعاع یونی مربوط به هریک از کاتیونها و آنیونهای درگیر در هر پیوند اختراع شده است. اندازهگیری دقیق مقدار عملی شعاع یونی عناصر مختلف ممکن نیست زیرا شعاع یونها بسته به شرایط محیطی که در آن قرار دارند، اتمهای اطرافشان و … تحت تأثیر قرار می گیرد. یون هنگامی شکل میگیرد که یک اتم خنثی الکترون بگیرد یا آن را از دست بدهد. ترکیبات یونی از تکرار آنیونها و کاتیونهایی که با پیوند یونی به یکدیگر متصل هستند به وجود میآید.
به طور کلی نمیتوان این موضوع را فهمید که برای هر یون، مقدار عملی شعاع یونی چیست. تعیین مقادیر شعاع یونی دشوار است و معمولا به روشی که برای اندازهگیری اندازه یون استفاده میشود، وابسته است. مقدار معمول برای شعاع یونی بین ۳۰ پیکومتر (معادل ۰٫۳ آنگستروم) تا ۲۰۰ پیکومتر ( معادل ۲ آنگستروم) متغیر است. شعاع یونی ممکن است با استفاده از روشهایی مانند بلورنگاری پرتوی ایکس یا تکنیکهای مشابه اندازهگیری شود. از آنجا که مرز پوسته الکترونی یک اتم تا حدی مبهم است، معمولا یونها بهصورت کرههای جامدی در نظر گرفته میشوند که در یک شبکه بلوری ثابت شدهاند.
این روش ها موفق شدهاند که اندازه شعاع هر یون مجزا را به گونهای اندازهگیری کنند که اندازه آن در ترکیبات یونی متفاوت تقریبا برابر باشد. این مقادیر تفاوتهای کمی با یکدیگر دارند. برای مثال، شعاع یونی یون سدیم در ترکیبات سدیم کلرید و سدیم سولفید برابر است. این به شرطی است که روش اندازهگیری شعاع یونی برای هردو ترکیب مشابه هم باشد. با وجود تفاوتهای ناچیز مشاهده شده در این روشها، روندهای مشابهی در تغییر این شعاعهای یونی از اتمی به اتم دیگر مشاهده شده. در قسمت بعدی این مطلب، این روندها را بررسی خواهیم کرد.
روند تغییر شعاع یونی عناصر
حال که آموختیم شعاع یونی چیست، با یادگیری روند تغییر آن در جدول تناوبی میتوانیم بسیاری از رفتارهای یونها را بررسی کنیم. با مقایسه شعاعی یونی اتمهای مختلف جدول تناوبی متوجه میشویم که شعاع یونی اتمهای جدول تناوبی با روند مشخصی بزرگ و کوچک میشود. این روند تغییر به شکل زیر است.
- شعاع یونی اتمها در هر گروه از بالا به پایین افزایش مییابد.
- شعاع یونی اتمها در هر دوره از چپ به راست کاهش مییابد.
هریک از این روندهای تغییر در ادامه توضیح داده می شود. در جدول تناوبی عناصر، به علت یکی یکی اضافه شدن تعداد الکترونها و پروتونها به اتمها، برخی از خواص با روندی مشخص و به شکلی دوره ای تغییر می کنند. پیشنهاد می کنیم برای درک بهتر این خواص دورهای جدول تناوبی، مطلب «قانون دورهای عنصرها» از مجله فرادرس را مطالعه کنید. لینک این مطلب در ادامه آورده شده است.
شعاع یونی در هر گروه جدول تناوبی
در هر گروه جدول تناوبی اندازه شعاع اتمی و شعاع یونی از بالا به پایین افزایش مییابد. این روند برای اتمهایی برقرار است که مقدار بار الکتریکی یا عدد اکسایش برابر و مشابه داشته باشند. دلیل این روند تغییر این است که هنگامی که یک لایه الکترونی به اتم اضافه میشود، الکترونهای ظرفیت از اتم فاصله میگیرند. الکترونهای لایههای درونی اتم، از الکترونهای لایههای بیرونی در برابر جاذبه هسته محافظت میکنند. این اثر در هر گروه از بالا به پایین افزایش مییابد زیرا تعداد لایههای الکترونی از بالا به پایین در هر گروه زیاد میشود.
در یک گروه، اتم دوره اول یک لایه الکترونی، اتم دوره دوم دو لایه الکترونی، اتم دوره سوم، سه لایه الکترونی و .. دارند. به همین ترتیب، نیروهای جاذبه الکترواستاتیک بین هسته و الکترونهای ظرفیت کاهش مییابد. این پدیده باعث دورتر شدن الکترونها از هسته اتم شده و در حالت کلی شعاع اتمی و شعاع یونی را افزایش میدهد. جدول زیر، اندازه شعاع یونی اتمهای گروه اول جدول تناوبی ، به همراه تعداد الکترونها در هر لایه آنها را نمایش میدهد. تعداد الکترونهای موجود در هر لایه از راست به چپ نشان دهنده لایه اول، دوم، سوم و … است.
| یون | تعداد الکترون لایهها | شعاع یونی بر حسب پیکومتر |
| لیتیوم | ۲ | ۹۰ |
| سدیم | ۲، ۸ | ۱۱۶ |
| پتاسیم | ۲، ۸، ۸ | ۱۵۲ |
| روبیدیوم | ۲، ۸، ۱۸، ۸ | ۱۶۶ |
| سزیم | ۲، ۸، ۱۸، ۱۸، ۸ | ۱۸۱ |
همچنین، جدول زیر، نمایشدهنده شعاع یونی اتمهای گروه ۱۷ جدول تناوبی (هالوژنها) به همراه تعداد الکترونهای موجود در هر لایه الکترونی آنها است. تعداد الکترونهای موجود در هر لایه از راست به چپ نشان دهنده لایه اول، دوم، سوم و … است.
| یون | تعداد الکترون لایهها | شعاع یونی بر حسب پیکومتر |
| فلوئور | ۲، ۸ | ۱۱۹ |
| کلر | ۲، ۸، ۸ | ۱۶۷ |
| برم | ۲، ۸، ۱۸، ۸ | ۱۸۲ |
| ید | ۲، ۸، ۱۸، ۱۸، ۸ | ۲۰۶ |
شعاع یونی در هر دوره جدول تناوبی
از آنجا که برخی از اتم ها توانایی از دست دادن یا دریافت بیش از ۱ الکترون را دارند، روند تغییر شعاع یونی در هر دوره کاملا مشابه روند تغییر شعاع اتمی آنها نیست. به طور معمول با حرکت از چپ به راست در یک دوره (ردیف) از جدول تناوبی، شعاع یونی کاهش مییابد. با افزایش عدد اتمی، اندازه هسته اتمی بزرگتر میشود، بار مثبت هسته، الکترونها را بیشتر جذب کرده و شعاع اتمی و یونی کاهش مییابد.
این امر به دلیل افزایش نیروی مثبت مؤثر هسته است که الکترونها را محکمتر به سمت خود میکشد. این روند به ویژه در فلزات که کاتیون تشکیل میدهند، آشکار است. این اتمها الکترون لایه خارجی خود را از دست میدهند و گاهی اوقات کل یک لایه الکترونی را از دست میدهند. با این حال، شعاع یونی فلزات واسطه در یک دوره، بهویژه در ابتدای یک سری، تغییر چندانی بین یک اتم و اتم بعدی ندارد. برای بررسی شعاع اتمی در هر دوره، کاتیونها و آنیونها را جداگانه بررسی خواهیم کرد.
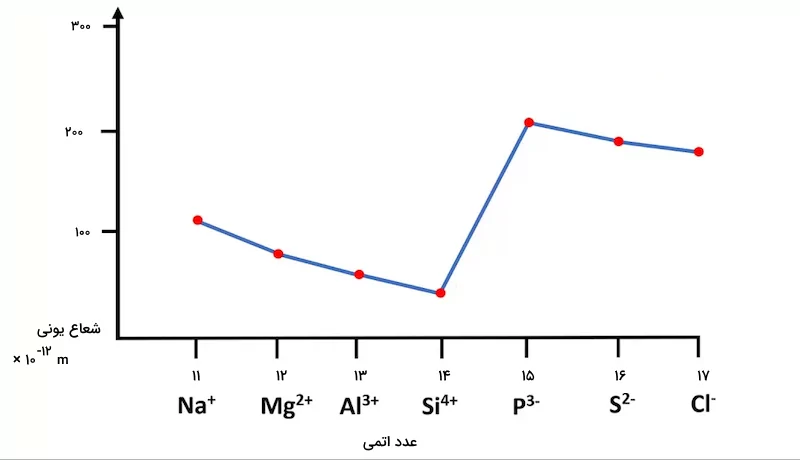
برای شروع، عناصر دوره سوم جدول تناوبی را در نظر بگیرید. این عناصر در جدول زیر به همراه شعاع اتمی و تعداد پروتونهای آنها نمایش داده شدهاند.
| یون | تعداد پروتونها | شعاع یونی |
| سدیم | ۱۱ | ۱۱۶ |
| منیزیم | ۱۲ | ۸۶ |
| آلومینیوم | ۱۳ | ۶۷٬۵ |
| فسفر | ۱۵ | ۲۱۲ |
| گوگرد | ۱۶ | ۱۸۴ |
| کلر | ۱۷ | ۱۶۷ |
در ادامه این روند تغییر را برای کاتیونها و آنیونها به شکلی جداگانه بررسی خواهیم کرد.
کاتیونها
کاتیونهای سدیم، منیزیم و آلومینیوم، تعداد برابری الکترون در لایه های الکترونی خود دارند و به آرایش اکتت (آرایش گاز نجیب) رسیدهاند. یونهایی که تعداد برابری الکترون دارند، ایزوالکترون نام دارند. شعاع یونی این یونها از چپ به راست کاهش پیدا کرده است.
دلیل این پدیده این است که افزایش تعداد پروتونها باعث افزایش نیروهای جاذبه الکترواستاتیک بین هسته و الکترونهای ظرفیت میشود. این الکترونها در مقایسه با الکترونهای اتم خنثی، با فاصله کمتری نسبت به هسته اتم قرار گرفتهاند. در نتیجه، اندازه شعاع یونی کاهش مییابد.
آنیونها
آنیونهای فسفر، گوگرد و کلر مانند کاتیونهای مطرح شده در قسمت قبل، ایزوالکترون هستند. شعاع یونی این یونها از چپ به راست کاهش مییابد. دلیل این اتفاق دقیقا مشابه دلیل توضیح داده شده برای کاتیونها است. افزایش تعداد پروتون های اتمها باعث افزایش نیروی جاذبه الکترواستاتیک بین هسته اتم و الکترونهای آن شده و باعث میشود شعاع اتمی کاهش بیابد.
همچنین با توجه به شعاع اتم یونهای فسفر و آلومینیوم میتوانید مشاهده کنید شعاع اتمی از آلومینیوم به فسفر به اندازه زیادی تغییر کرده است. این پدیده به علت افزایش یک لایه الکترونی است.
اتمهای هم الکترون (ایزوالکترون)
اندازه شعاع یونی یونهای همالکترون نیتروژن، اکسیژن، فلوئور، سدیم، منیزیم و آلومینیوم در جدول زیر ارائه شده است. تمامی این یونها در لایه اول الکترونی خود ۲ الکترون و در لایه دوم ۸ الکترون دارند.
| یون | شعاع یونی |
| نیتروژن | ۱۳۲ |
| اکسیژن | ۱۲۴ |
| فلوئور | ۱۱۹ |
| سدیم | ۱۱۶ |
| منیزیم | ۸۶ |
| آلومینیوم | ۶۷٫۵ |
این یونها در جدول بر اساس افزایش تعداد پروتون هایشان نوشته شدهاند. به روند تغییر شعاع یونی برای این یونها دقت کنید. اندازه شعاع یونی با افزایش تعداد پروتونهای اتمها، کاهش مییابد. افزایش تعداد پروتونهای یونهایی با تعداد الکترون برابر، باعث افزایش نیروهای جاذبه الکترواستاتیک بین هسته یون و الکترونهای آن شده و باعث میشود اندازه شعاع یونی کاهش بیابد.
یون فلزات واسطه
اندازه یون فلزات واسطه تغییر چندانی نمیکند. روند تغییر شعاع یونی در دورههای فلزات واسطه از الگوی مشخصی پیروی نمیکند.
مقایسه شعاع یونی آنیون و کاتیون
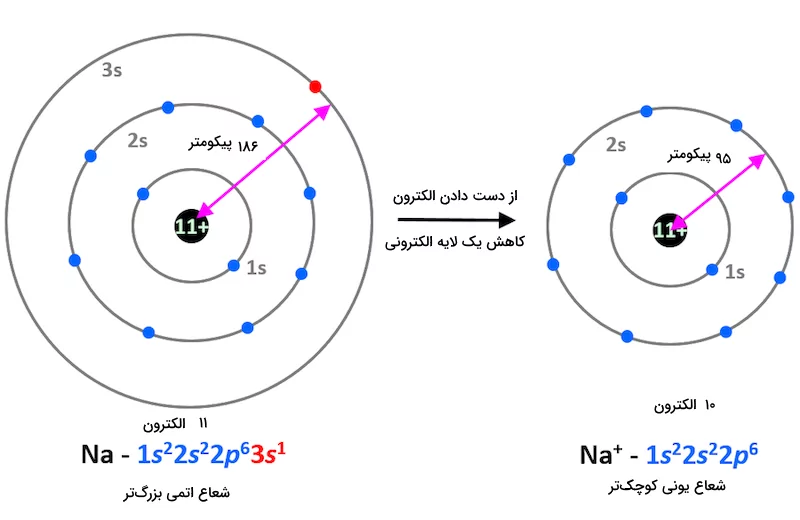
تا اینجا آموختیم شعاع یونی چیست و در هر گروه و ردیف چگونه تغییر میکند. آزمایشات انجام شده و مقایسه شعاع اتم خنثی و يون های آنها نشان داده است که کاتیون از اتم خنثی خود کوچکتر، و آنیون از اتم خنثی خود بزرگتر است. هنگامی که یک یا تعداد بیشتری الکترون از یک لایه الکترونی اتم خنثی جدا میشود، دو اتفاق مهم میافتد. اول اینکه دافعه بین الکترونهای باقیمانده در لایه الکترونی کم میشود زیرا تعداد الکترونهای کمتری در آن لایه وجود دارند. دوم اینکه اثر جاذبه هسته روی الکترونهای باقیمانده بیشتر است زیرا تعداد الکترون ها کمتر شده است. در نتیجه، شعاع یونی کاتیون نسبت به اتم خنثی خود کوچکتر میشود. تصویر زیر نشاندهنده این موضوع برای کاتیون سدیم است.
اگر تعداد متفاوتی الکترون بتواند از یک اتم جدا شود، یونهای متفاوتی تولید میشوند. این پدیده در فلزات واسطه مشاهده میشود. در این صورت، کاتیونی که بار مثبت بیشتری دارد، کوچکتر خواهد بود.
در مقابل، افزودن یک الکترون به یک لایه الکترونی اتم باعث میشود تعداد الکترونهای آن لایه افزایش یافته و دافعه بین آنها بیشتر شود. همچنین، به دلیل افزوده شدن الکترون و زیاد شدن تعداد کلی آنها، اثر جاذبه هسته اتم بر هر یک از الکترونها کمتر خواهد شد. در نتیجه، شعاع آنیون نسبت به اتم خنثی افزایش مییابد.
مقایسه شعاع یونی یونهای مختلف
تا اینجا آموختیم شعاع یونی چیست و در جدول تناوبی با چه روندی تغیر میکند. بسیاری از سوالات امتحانات نهایی و کنکور مربوط به مقایسه شعاع یونی یونهای مختلف است. با توجه به توضیحات ارائه شده در قسمت قبل و با به خاطر سپردن نکات زیر، میتوانید به راحتی شعاع یونهای مختلف را با یکدیگر مقایسه کنید.
- در هر دوره از بالا به پایین شعاع یونی افزایش مییابد.
- فلزات الکترون از دست داده و به کاتیون تبدیل میشوند.
- نافلزات الکترون دریافت کرده و آنیون تشکیل میدهند.
- شعاع یونی کاتیونها کمتر از شعاع اتمی آنها در حالت خنثی است.
- شعاع یونی آنیونها بیشتر از شعاع اتمی آنها در حالت خنثی است.
- برای یونهای هم الکترون، یونی که پروتون بیشتری دارد، شعاع یونی کمتری دارد.
- برای یونهای یک اتم یکسان، یونی که بار مثبتتری دارد، شعاع یونی کمتری دارد.
- برای یونهای یک اتم یکسان، یونی که بار منفیتری دارد، شعاع یونی بیشتری دارد.
مثال مقایسه شعاع یونی
حال که آموختید شعاع یونی چیست و با چه روندی تغییر میکند، با توجه به نکات قسمت قبل، به سوالات زیر پاسخ دهید.
مثال ۱
با مقایسه صحیح، ترتیب شعاع یونی را از کوچک به بزرگ برای یونهای کلر، پتاسیم، گوگرد و سلنیوم بنویسید.
پاسخ
برای حل اینگونه سوالات ابتدا با توجه به جدول تناوبی، شماره گروه اتمها و مقدار بار آنها را مشخص میکنیم.
- اتم کلر در گروه هالوژنها قرار دارد و آنیون یک بار منفی تولید می کند.
- اتم پتاسیم در گروه فلزات قلیایی است وکاتیون یک بار مثبت تولید میکند.
- اتم گوگرد در گروه اکسیژن قرار دارد و آنیون دو بار منفی تولید میکند.
- سلنیوم نیز در گروه اکسیژن قرار دارد و آنیون دو بار منفی تشکیل میدهد.
آموختیم که شعاع یونی کاتیونها کمتر از آنیونها است. پس بین این یونها، کاتیون پتاسیم کوچکترین اندازه را دارد. سپس به سراغ آنیونها میرویم. در قسمتهای قبلی اشاره کردیم که هرچه بار آنیون منفیتر باشد، شعاع یونی آن بزرگتر است. آنیون کلر یک بار منفی دارد پس از دو آنیون دیگر کوچکتر است. سلنیوم و گوگرد هردو در یک گروه از جدول تناوبی قرار دارند. گوگرد در ردیف ۳ جدول تناوبی و سلنیوم در ردیف ۴ قرار دارد. آموختیم که شعاع یونی در یک گروه از بالا به پایین افزایش مییابد. پس شعاع یونی سلنیوم بزرگتر از گوگرد خواهد بود.
مثال ۲
با مقایسه صحیح، ترتیب شعاع یونی را از کوچک به بزرگ برای یونهای برم، کلسیم، روبیدیم و استرانسیم بنویسید.
پاسخ
ابتدا مقدار بار و مکان یونها را مییابیم.
- برم در گروه هالوژنها و در ردیف ۳ جدول تناوبی قرار دارد و یون یک بار منفی تشکیل می دهد.
- اتم کلسیم در گروه دوم جدول تناوبی و دوره ۴ قرار دارد و کاتیون ۲ بار مثبت تشکیل میدهد.
- اتم روبیدیوم در گروه اول و در ردیف ۵ جدول تناوبی قرار دارد و کاتیون یک بار مثبت تولید میکند.
- اتم استرانسیوم در گروه دوم جدول تناوبی و در ردیف پنجم قرار دارد و یون ۲ بار مثبت تولید میکند.
با توجه به نکات قسمتهای قبل می دانیم که شعاع یونی آنیون بیشتر از کاتیون است پس شعاع یونی یون کلر از ۳ کاتیون دیگر بزرگتر است. سپس شعاع یونی کاتیونها را مقایسه میکنیم. در قسمت قبل اشاره کردیم که هرچه بار کاتیون مثبتتر باشد، شعاع یونی آن کمتر است. پس شعاع کاتیون روبیدیوم از دو کاتیون دوبار مثبت دیگر بیشتر است. بین کلسیم و استرانسیم، یون استرانسیوم که اتم ان در ردیف ۵ است از کلسیم که در ردیف سوم است، بزرگتر است.
مثال ۳
یونهای را بر اساس موقعیت آنها در جدول تناوبی، به ترتیب افزایش شعاع مرتب کنید.
پاسخ
برای مرتب کردن یونهای از نظر افزایش شعاع، باید به بار و موقعیت آنها در جدول تناوبی توجه کنیم. برای یونهای همدوره، شعاع یونی با افزایش بار مثبت یون کاهش مییابد، زیرا پروتونهای بیشتر الکترونها را به سمت هسته جذب میکنند. برای یونهایی با بار یکسان، شعاع یونی با پایین آمدن گروه افزایش مییابد، زیرا لایههای الکترونی بیشتری به یون اضافه میشود.
- پتاسیم دارای ۱۹ پروتون و ۱۸ الکترون است.
- کلسیم دارای ۲۰ پروتون و ۱۸ الکترون است.
- آلومینیوم دارای ۱۳ پروتون و ۱۰ الکترون است.
- سیلیسیم دارای ۱۴ پروتون و ۱۰ الکترون است.
تعداد الکترونها در یونهای و برابر است، اما تعداد پروتونها متفاوت است، شعاع یونی با افزایش تعداد پروتونها کاهش مییابد (زیرا بار هستهای مؤثر افزایش مییابد و الکترونها بیشتر به هسته جذب میشوند).
بنابراین، ترتیب شعاع یونی به ترتیب افزایش به این صورت است:
مثال ۴
یونهای ، ، و را بر اساس شعاع یونی به ترتیب افزایش فهرست کنید.
پاسخ
ابتدا مقدار بار و مکان یونها را مییابیم:
یون برم هالوژن با بار منفی یک و در گروه ۱۷ و دوره ۴ قرار دارد. کاتیون لیتیوم با بار مثبت یک و در گروه ۱ و دوره ۲ قرار دارد. یون ترلیوم با بار منفی دو و در گروه ۱۶ و دوره ۵ قرار دارد. کاتیون منیزیم با بار مثبت دو و در گروه ۲ و دوره ۳ قرار دارد.
با توجه به نکات قسمتهای قبل میدانیم که شعاع یونی آنیون بیشتر از کاتیون است. پس شعاع یونی یونهای و از کاتیونهای و بزرگتر است. همچنین، هر چه بار منفی بیشتر باشد، شعاع یونی آنیون بزرگتر میشود. بنابراین، یون که بار منفی بیشتری دارد از یون بزرگتر است.
بین کاتیونها، چون یون دو بار مثبت دارد و یون یک بار مثبت، شعاع یونی از کوچکتر است.
مثال ۵
شعاع یونی یونهای به ترتیب ۱۸۱ پیکومتر، ۱۸۴ پیکومتر و ۱۳۸ پیکومتر است. توضیح دهید چرا این یونها با اینکه تعداد الکترونهای یکسانی دارند، اندازههای متفاوتی دارند.
پاسخ
برای توضیح تفاوت در اندازه یونها، ابتدا به بار هر یون و موقعیت آنها در جدول تناوبی توجه میکنیم. یونهای از نظر تعداد الکترونها برابر هستند، زیرا این یونها همه دارای ۱۸ الکترون هستند. با این حال، این یونها از نظر تعداد پروتونها و بار مثبت هسته تفاوت دارند.
- در یون ، بار هسته نسبت به الکترونها کم است و نیروی جاذبه هستهای نسبت به الکترونها ضعیفتر است. بنابراین، الکترونها به طور ضعیفتری به هسته جذب میشوند و این آنیون شعاع یونی بزرگتری دارد.
- در یون، بار هسته اتم کمی بیشتر از یون است، اما هنوز نیروی جاذبه هسته در مقایسه با یون کمتر است، بنابراین شعاع یونی آن کوچکتر از است.
- در یون ، بار هسته اتم بیشتر از دو یون دیگر است و چون تعداد الکترونها کمتر از پروتونهاست، نیروی جاذبه هستهای به شدت بیشتر است که باعث میشود الکترونها به هسته جذب شوند و شعاع یونی آن کوچکتر از بقیه باشد.
بنابراین، هرچند این یونها تعداد الکترون یکسانی دارند، اما اختلاف در بار هسته (تعداد پروتونها) و نیروی جاذبه هسته موجب تفاوت در اندازه شعاع آنها شده است.
جدول شعاع یونی عناصر
در تصویر زیر، شعاع یونی عناصر جدول تناوبی زیر آنها نوشته شده است. برای یونهای فلزات واسطه که بارهای متفاوتی دارند، شعاع یونی یون رایجتر نوشته شده است. با توجه به این جدول و مقایسه شعاع یونی آنها بهتر میتوانید روند تغییر شعاع یونی را در جدول تناوبی مشاهده کرده و شعاع یونی عناصر مختلف را مقایسه کنید.
بار موثر هسته اتم چیست؟
برای یادگیری بهتر این موضوع که شعاع یونی چیست، باید با مفهوم بار موثر هسته اتم آشنا شویم. بار موثر هست اتم، مقدار بار مثبت احساس شده نوترونها توسط الکترونها است. کلمه موثر در تعریف این مفهوم به این علت است که الکترونهای موجود در لایههای داخلی اتم، مقدار اثر این بار مثبت هسته را برای الکترونهای لایههای بیرونی کم میکنند. به این پدیده، اثر پوششی الکترونهای درونی گفته میشود.
در بررسی شعاع یونی عناصر، باید همواره به تعداد لایههای الکترونی و تعداد پروتونها (بار موثر هسته) توجه داشته باشیم. در مقایسه دو یون مختلف با تعداد الکترون برابر، یونی که تعداد پروتون بیشتری داشته باشد، الکترونهایی دارد که به دلیل اثر بار موثر هسته اتم، متراکمتر هستند و شعاع یونی کمتری خواهد داشت. به همین ترتیب، اگر تعداد پروتونهای یک یون از یون دیگری با همان تعداد الکترون کمتر باشد، اثر بار موثر هسته اتم روی الکترونهای آن کاهش یافته و الکترونها با آزادی بیشتری در حرکت خواهند بود و به همین ترتیب، اندازه شعاع یونی آن بزرگتر خواهد بود.
یادگیری شیمی عمومی با فرادرس
تا اینجا مفاهیم پایهای را در مورد این موضوع که شعاع یونی چیست آموختید. برای یادگیری شعاع یونی در مقاطع بالاتر شیمی عمومی دانشگاهی، ابتدا با مفهوم پیوند آشنا شده و سپس پیوندها را در دو دسته یونی و کووالانسی بیاموزید. درک قاعده هشت تایی و ساختار لوییس برای درک نحوه تشکیل پیوندها ضروری است. با یادگیری این مفاهیم در مقاطع بالاتر می توانید به مطالعه اوربیتالهای مولکولی پرداخته و بیاموزید چگونه این اوربیتالها در پیوندها نقش دارند. همچنین میتوانید مفاهیم پیچیدهتری چون پیوند فلزی و چگونگی تأثیر آن بر ساختار فلزات را فرا بگیرید. پیشنهاد میکنیم برای درک بهتر این مباحث و مفاهیم به مجموعه آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شعاع یونی و مولکولی دسترسی داشته باشید.
جمعبندی
در این مطلب از مجله فرادرس آموختیم شعاع یونی چیست و چگونه تغییر میکند. اگر یک اتم الکترون از دست بدهد یا دریافت کند، یون تشکیل میدهد. زمانی که یک اتم الکترون از دست میدهد، به کاتیون تبدیل میشود و وقتی الکترون دریافت میکند، به آنیون تبدیل میشود. شعاع یونی به عنوان فاصله بین هسته یک یون و لایه بیرونی آن یون تعریف میشود. در جدول تناوبی، با حرکت در یک گروه، اتمها به ترتیب افزایش الکترون مرتب شدهاند که این موضوع باعث افزایش شعاع یونی عناصر میشود. شعاع یونی در هر گروه از بالا به پایین افزایش مییابد. شعاع یونی کاتیونها کمتر از اتم خنثی آنها و شعاع یونی آنیونها بیشتر از اتم خنثی آنها است. این تغییرات در شعاع یونی به دلیل افزایش یا کاهش لایههای الکترونی و همچنین تأثیر بار مثبت هسته اتم بر الکترونهای لایه ظرفیت اتفاق میافتد.
source