موازنه به روش وارسی، روشی برای تعیین ضریب استوکیومتری مواد در یک معادله واکنش شیمیایی است. این ضرایب باید به شکلی باشند که تعداد اتمهای هر دو طرف واکنش با یکدیگر برابر باشد تا قانون پایستگی جرم رعایت شود. در یک معادله واکنش موازنه شده، مقادیر نسبت واقعی ترکیب واکنشدهندههای مصرف شده و فرآوردههای تولید شده نشان داده میشود. موازنه صحیح واکنشهای شیمیایی برای حل مسائل استوکیومتری بسیار مهم است و نیازمند تمرین و حل مسائل بسیار است. در این مطلب از مجله فرادرس به توضیح موازنه به روش وارسی میپردازیم و انواع مسائل و تمرینهای مربوط به آن را، برای درک بهتر این روش ارائه میکنیم.

در ابتدای این مطلب، با نمایش معادله واکنش شیمیایی و قسمتهای مختلف تشکیلدهنده آن آشنا میشویم. سپس مراحل موازنه به روش وارسی را میآموزیم. در قسمتهای بعدی، این روش موازنه را برای معادلات واکنش پیچیدهتر شامل ترکیبات چنداتمی و یونها بررسی میکنیم. در مرحله بعد، تمرینهایی را برای درک بهتر موازنه به روش وارسی، حل میکنیم. در ادامه این مطلب یک روش دیگر نیز برای موازنه واکنشهای شیمیایی ارائه داده و مثالهایی را برای درک بهتر آن بررسی میکنیم. در نهایت نیز مثالهای موازنه به روش وارسی که در کتب شیمی دهم و یازدهم دوره متوسطه بیان شدهاند را حل میکنیم. با مطالعه این مطلب تا انتها میتوانید با این روش موازنه مهم آشنا شده و آن را به شکلی عمیق بیاموزید.
موازنه به روش وارسی چیست؟
موازنه به روش وارسی روشی برای تعیین صحیح ضرایب استوکیومتری در یک معادله واکنش شیمیایی است. در معادلات واکنش شیمیایی واکنشدهندهها با نسبتهای خاصی با بکدیگر ترکیب میشوند تا فرآوردهها را تولید کنند. این نسبتها به وسیله ضرایب استوکیومتری که در سمت چپ مواد و با اعداد ریاضی نوشته شده، مشخص میشود. موازنه به روش وارسی شامل مراحل زیر است. این مراحل در قسمتهای بعد به تفصیل و به همراه مثال، توضیح داده خواهند شد.
- انتخاب پیچیدهترین ترکیب و تعیین ضریب ۱ برای آن
- تعیین ضریب سایر مواد نسبت به ترکیب اولیه
- بررسی و از بین بردن مخرج کسرها با ضرب واکنش در مخرج مناسب
- شمارش اتمها در دوطرف معادله واکنش و موازنه واکنش
با استفاده از روش موازنه به روش وارسی، بیشتر واکنشهای شیمیایی به راحتی موازنه خواهند شد.
ویژگیهای واکنش شیمیایی
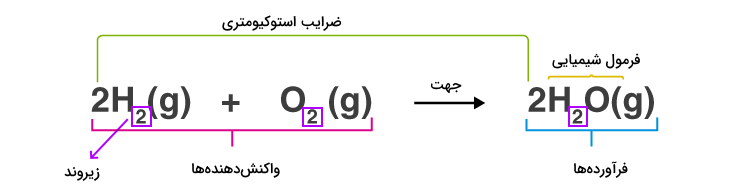
معادله واکنش شیمیایی متنی است که برای نشان دادن اتفاقاتی که در یک فرآیند شیمیایی رخ میدهد، استفاده میشود. موادی که واکنش را آغاز میکنند با نام واکنشدهنده، در سمت چپ معادله واکنش شیمیایی نوشته میشوند.
پس از آن از یک پیکان (جهت) برای نشاندادن جهت پیشرفت واکنش از سمت واکنشدهندهها به سمت راست رسم میشود. در سمت راست واکنش، موادی که به وجود آمدهاند با نام فرآورده نوشته میشوند.
نمایش واکنش شیمیایی
واکنشهای شیمیایی میتوانند به وسیله معادلات واکنش روی کاغذ نمایش داده شوند. یک معادله واکنش شیمیایی از قسمتهای زیر تشکیل شده است.
نماد شیمیایی
نماد شیمیایی عناصر درواقع همان حروفی است که برای نشان دادن اتمها و مولکولها به کار میرود. برای مثال در واکنش زیر، حروف نشاندهنده مولکول هیدروژن و اتمهای هیدروژن هستند. نشاندهنده مولکول آب است.
واکنشدهنده
واکنشدهندهها موادی هستند که در واکنش با یکدیگر مخلوط و ترکیب میشوند تا تغییرات آنها بررسی شود. واکنشدهندهها در سمت چپ معادله واکنش نوشته میشوند. در واکنش بالا، مولکولهای دواتمی هیدروژن و اکسیژن، واکنشدهندههای واکنش هستند.
فرآورده
فرآوردهها موادی هستند که در نتیجه ترکیب واکنشدهندهها به دست میآیند. فرآوردهها در واقع موادی هستند که پس از اتمام واکنش باقی میمانند. این مواد در سمت راست معادله واکنش شیمیایی نوشته میشوند. در واکنش بالا، مولکول آب فراورده است.
ضریب استوکیومتری
ضرایب استوکیومتری اعداد بزرگی هستند که در سمت چپ و قبل از نماد شیمیایی عناصر و مولکولها قرار میگیرند. این اعداد درواقع نسبت ترکیب شدن مواد با یکدیگر را نمایش میدهند. در واکنش بالا اعداد ۲ قبل از مولکول های هیدروژن و آب، ضرایب استوکیومتری هستند.
زیروند
زیروندها اعداد کوچکی هستند که در پایین و سمت راست مواد نوشته میشوند تا نسبت اتمها را در ترکیب مولکولی آنها مشخص کنند. این ضرایب به هیچوجه تغییر نمیکنند و نشانگر ساختار ماده هستند. برای مثال در مولکول آب () عدد ۲ زیروند است و نشاندهنده تعداد اتمهای هیدروژن در مولکول آب است و همواره مولکول آب بدین صورت نمایش داده میشود. در موازنه به روش وارسی، به هیچ وجه زیروند اتمها را تغییر نمیدهیم.
تعداد اتمهای موجود در یک ترکیب از ضرب ضریب استوکیومتری ترکیب در زیروند اتم به دست میآید. برای مثال در واکنش بالا تعداد اتمهای هیدروژن در ترکیب آب برابر با ۲×۲ است.
پیکان (جهت)
پیکان با جهت واکنش، نمادی به شکلهای «» یا «» است که از سمت واکنشدهندهها به فرآوردهها یا به صورت دوجهتی رسم میشود تا نشان دهد واکنش در چه جهتی انجام می شود.
نماد حالت ماده
نماد حالت ماده، حروف انگلیسی هستند که در سمت راست مولکولها برای نشان دادن حالت ماده آنها نوشته میشوند. در یک واکنش شیمیایی ممکن است با نمادهای زیر مواجه شوید.
- نماد «s» نشاندهنده حالت ماده جامد و حرف اختصاری کلمه انگلیسی «Solid» است.
- نماد «l» نشاندهنده حالت ماده مایع و حرف اختصاری کلمه انگلیسی «Liquid» است.
- نماد «g» نشاندهنده حالت ماده گاز و حرف اختصاری کلمه انگلیسی «Gas» است.
- نماد «aq» نشاندهنده حالت ماده محلول در آب و حرف اختصاری کلمه انگلیسی «Aqueous» است.
در تصویر زیر، هریک از اجزای یک واکنش شیمیایی مشخص شدهاند.
مراحل موازنه به روش وارسی
موازنه به روش وارسی یکی از پایهای ترین روشهای موازنه مواد است. این روش برای موازنه واکنشهای ساده، بسیار کارآمد است. برای موازنه معادله واکنشهای پیچیدهتر از روش جبری استفاده میشود که در بخشهای بعدی این مطلب به آن اشارهای میشود. در موازنه به روش وارسی، ۴ مرحله مهم و اساسی وجود دارد که با رعایت آنها و با دقت کافی میتوان به سرعت معادله واکنش شیمیایی را موازنه کرد. این ۴ مرحله به صورت زیر هستند.
- ابتدا باید پیچیدهترین ترکیب با بیشترین تعداد و نوع اتم درنظر گرفته شود.
- سپس یکی کردن تعداد اتمهای مختلف نسبت به این اتم پیچیده را آغاز میکنیم. موازنه کردن را از اتمهای سادهتر و مولکولهای تکاتمی آغاز میکنیم.
- سپس به سراغ مولکولهای چنداتمی میرویم و تعداد آنها را در دوطرف واکنش یکی میکنیم.
- در نهایت اگر ضریبی به صورت کسر باقی مانده بود، کل واکنش را در مخرج ضریب، ضرب میکنیم.
باید دقت داشته باشید، یک معادله واکنش موازنه شده حتی در صورتی که ضرایب بالاتری بگیرد نیز موازنه شده باقی میماند. برای مثال اگر کل ضرایب استوکیومتری واکنش را دوبرابر کنیم، همچنان نسبت ضرایب استوکیومتری مواد ثابت مانده و تعداد هریک از اتمها در دوطرف معادله واکنش برابر خواهد بود.
برای درک بهتر موازنه به روش وارسی، معادله واکنش زیر را درنظر بگیرید.
مرحله اول
در مرحله اول باید پیچیدهترین ترکیب را پیدا کنیم. در این معادله واکنش، پیچیدهترین ترکیب اتیلن گلایکول با ترکیب شیمیایی است. این ترکیب ۲ کربن، ۶ هیدروژن و ۲ اکسیژن دارد.
مرحله دوم
در مرحله دوم تعداد مولکولهای سادهتر یا اتمهایی را موازنه میکنیم که تنها در یک ترکیب وجود دارند. برای مثال اتم کربن در سمت فرآوردههای واکنش تنها در مولکول کربندیاکسید وجود دارد. تعداد کربنهای ترکیب اتیلن گلیکول، ۲ عدد است پس به کربن دیاکسید نیز ضریب ۲ میدهیم تا تعداد کربن موازنه شود.
سپس تعداد هیدروژن را موازنه میکنیم. این اتم در سمت فرآوردهها تنها در مولکول آب وجود دارد. در مولکول اتیلن گلیکول ۶ اتم هیدروژن و در آب ۲ اتم هیدروژن داریم. پس به آب ضریب ۳ میدهیم تا تعداد اتم هیدروژن برابر شود.
مرحله سوم
حال تنها تعداد اکسیژنها باید موازنه شود. برای این کار باید تعداد اکسیژن را در طرفی که موازنه شده است (فرآوردهها) با سمت دیگر مقایسه کنیم. در سمت فرآوردهها، مولکول آب ۳ اتم اکسیژن و مولکول کربندیاکسید ۴ اتم اکسیژن دارد که جمعا ۷ اتم اکسیژن میشود. در سمت واکنشدهندهها، اتم اتیلن گلیکول، ۲ اتم اکسیژن دارد. پس ۵ اتم اکسیژن دیگر نیاز است. اما مولکول باقیمانده مولکول اکسیژن دو اتمی است و برای تبدیل آن به ۵ اتم اکسیژن باید ضریب کسری ۵/۲ بگیرد.
مرحله چهارم
در مرحله آخر موازنه به روش وارسی، اگر ضریب کسری داشته باشیم، باید کل واکنش را در مخرج کسر ضرب کنیم. پس کل واکنش بالا در عدد ۲ ضرب میشود.
حال واکنش ما موازنه شده است. برای اطمینان از موازنه بودن واکنش، تعداد هریک از اتمها را در هر دو سمت واکنش، شمارش میکنیم.
| نام اتم | تعداد اتم در سمت واکنشدهندهها | تعداد اتم در سمت فرآوردهها |
| کربن | ۴ | ۴ |
| اکسیژن | ۱۴ | ۱۴ |
| هیدروژن | ۱۲ | ۱۲ |
یادگیری موازنه با فرادرس
واکنشهای شیمیایی پایه و اساس فرآیندهای شیمیایی هستند که در زندگی، طبیعت و ازمایشگاه رخ می دهند. یادگیری پایه و اصول این واکنشها به درک این پدیدهها و پیشبینی نتیجه فرآیندها کمک میکند. یکی از مهم ترین تمرینات استوکیومتری شیمی که در پایه متوسطه به آن پرداخته می شود، موازنه واکنش به روش وارسی است. برای یادگیری موازنه به روش وارسی ابتدا باید با مفاهیمی مانند محاسبات تبدیل کسرها، ضرایب استوکیومتری و … آشنا شوید. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش دروس دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در خصوص موازنه به روش وارسی دسترسی داشته باشید.
موازنه مولکولهای چند اتمی به روش وارسی
ممکن است در موازنه واکنشهای شیمیایی به ترکیباتی بر بخوریم که شامل مولکولهای چنداتمی مانند نیترات، فسفات، کربنات و … باشد. در صورت امکان و تغییر نکردن ترکیب این گروههای اتمی، بهتر است آنها را به عنوان یک واحد گروهی موازنه کنیم و هریک از اتمهای این گروهها را به صورت جداگانه موازنه نکنیم.
این روش در صرفهجویی در زمان موازنه واکنش بسیار اهمیت دارد. برای درک بهتر این موضوع، به معادله واکنش زیر دقت کنید.
در این معادله واکنش، یک گروه فسفات () در هر دو سمت معادله واکنش تکرار شده است. برای موازنه راحتتر، این گروه را به صورت یک اتم مستقل شمارش میکنیم. برای شروع موازنه از ترکیب شمارش را آغاز میکنیم. این ترکیب، ۳ اتم کلسیم و دو گروه فسفات دارد. با ضریب ۱ دادن به این ترکیب، به سراغ موازنه ترکیبات دیگر میرویم. در سمت واکنشدهندهها، تنها ترکیب کلسیم کربنات یک اتم کلسیم دارد. پس به آن ضریب ۳ میدهیم.
سپس گروه فسفات را به صورت یک اتم مستقل موازنه میکنیم. تنها ترکیبی که در سمت واکنشدهندهها، گروه فسفات دارد، اسید فسفریک با فرمول است. به این ترکیب ضریب ۲ میدهیم تا فسفات نیز موازنه شود.
حال تنها اتمهای اکسیژن و هیدروژن برای موازنه باقی ماندهاند. برای موازنه هیدروژن، در سمت فرآوردهها تنها ترکیب آب و در سمت واکنشدهندهها، تنها ترکیب اسید فسفریک مدنظر هستند. به ترکیب اسید فسفریک قبلا ضریب ۲ دادهایم و دارای ۶ اتم هیدروژن است. پس به ترکیب آب که ۲ اتم هیدروژن دارد، ضریب ۳ میدهیم تا تعداد هیدروژن نیز موازنه شود.
حال باید تعداد اتمهای اکسیژن را موازنه کنیم. دقت کنید در این روش گروه چنداتمی فسفات را به عنوان اتمی مستقل در نظر گرفتیم و موازنه کردیم و دیگر نیازی به شمارش تعداد اکسیژنهای این ترکیب در این مرحله نیست. پس در سمت واکنشدهندهها، تعداد اتمهای اکسیژن مولکولهای کلسیم کربنات (۹ عدد) و در سمت واکنشدهندهها تعداد اکسیژنهای ترکیبات آب (۳ عدد) و کربندیاکسید (موازنه نشده) را درنظر میگیریم. کربندیاکسید باید ضریب ۳ بگیرد تا سمت راست نیز ۹ اتم اکسیژن داشته باشیم.
و بدین ترتیب واکنش ما موازنه شده است. حال برای اطمینان از موازنه بودن واکنش، تعداد اتمها را در هر دو سمت واکنش شمارش میکنیم. در جدول زیر، تعداد اتمهای ترکیب فسفات به صورت جداگانه شمارش شدهاند تا درست بودن روش استفاده شده اثبات شود. در موازنه کلی، نیازی به جداگانه شمردن این اتمها نیست و فقط کافی است گروه چنداتمی تکرار شونده به عنوان یک واحد مستقل موازنه شود.
| نام اتم | تعداد اتم در واکنشدهندهها | تعداد اتم در فرآوردهها |
| کلسیم | ۳ | ۳ |
| کربن | ۳ | ۳ |
| اکسیژن | ۱۷ | ۱۷ |
| هیدروژن | ۶ | ۶ |
| فسفر | ۲ | ۲ |
موازنه مولکولهای باردار (یونها) به روش وارسی
اگر در یک معادله واکنش، برخی از ترکیبات به صورت اتم یا مولکولهای باردار (یون) باشند، میزان بار کلی واکنش نیز باید موازنه شود. در حالت کلی، یک معادله واکنش شیمیایی باید از لحاظ بار الکتریکی خنثی باشد. این بدان معنا است که میزان بارهای مثبت و منفی در معادله واکنش باید برابر باشند. معمولا استفاده از موازنه به روش وارسی، خودبهخود میزان بارهای واکنش را نیز موازنه میکند. اما باید توجه داشته باشیم که در این واکنشها همواره میزان بارهای مثبت و منفی نیز شمارش شوند.
برای درک بهتر موازنه واکنش های باردار به روش وارسی، به معادله واکنش زیر دقت کنید.
برای موازنه این واکنش به روش واسی، ابتدا پیچیدهترین ترکیب که فراورده است را انتخاب کرده و به آن ضریب ۱ میدهیم. سپس مانند روشی که در قسمت قبل توضیح داده شد، گروه فسفات را به صورت یک واحد مستقل موازنه کرده و به آن ضریب ۲ میدهیم.
سپس تعداد اتم آهن را موازنه میکنیم. این اتم در ترکیب فراورده ۳ عدد است پس به این اتم در سمت واکنشدهندهها نیز ضریب ۳ میدهیم.
در نهایت باید تعداد بارهای الکتریکی را شمارش کنیم. بارهای مثبت مربوط به اتم آهن با ۲ بار مثبت با ضریب ۳ هستند که جمعا ۶ بار مثبت را به خود اختصاص دادهاند. بارهای منفی، مربوط به گروه فسفات با ۳ بار مثبت و ضریب ۲ هستند که جمعا ۶ بار منفی را به خود اختصاص دادهاند. پس میزان بارهای الکتریکی نیز موازنه است و واکنش کلی در حالت خنثی است.
برای موازنه واکنشهای شیمیایی بهتر است اتمهایی را که بیشتر و در بسیاری از ترکیبات استفاده میشوند را در مراحل آخر موازنه کرد. برای مثال اکسیژن و هیدروژن دو اتمی هستند که در بسیاری از ترکیبات شیمیایی با تعداد مختلف وجود دارند.

حل مثال موازنه به روش وارسی
برای درک بهتر موازنه به روش وارسی، تمرینهای زیر را حل کنید.
مثال ۱
معادله واکنش زیر را موازنه کنید.
پاسخ
در قدم اول پیچیدهترین ترکیب را انتخاب میکنیم و به آن ضریب ۱ میدهیم. در این معادله واکنش ترکیب پیچیدهترین ترکیب است که شامل ۵ اتم کربن و ۱۲ اتم هیدروژن است. سپس به سراغ موازنه کربن میرویم. در سمت راست معادله، تنها کربندیاکسید شامل اتم کربن است. به آن ضریب ۵ میدهیم تا تعداد کربن موازنه شود.
سپس تعداد هیدروژنها را بررسی میکنیم. در سمت چپ معادله ۱۲ اتم هیدروژن داریم و در سمت راست معادله ترکیب آب با ۲ اتم هیدروژن را داریم. پس به آن ضریب ۶ میدهیم تا تعداد هیدروژنها موازنه شود.
حال نوبت به بررسی تعداد اتمهای اکسیژن رسیده است. در سمت راست معادله واکنش تمامی مولکولها ضریب دارند و قبلا موازنه شدهاند. پس تعداد اکسیژن ها را در این سمت بررسی میکنیم. ۱۰ اتم اکسیژن در ترکیب کربندیاکسید و ۶ اتم اکسیژن در ترکیب آب وجود دارد که جمعا ۱۶ اتم اکسیژن میشود. در سمت واکنشدهندهها، تنها مولکول دواتمی اکسیژن را داریم. پس به آن ضریب ۸ میدهیم تا تعداد اکسیژنها نیز موازنه شود.
بدین ترتیب معادله واکنش موازنه شده است.

مثال ۲
معادله واکنش زیر را موازنه کنید.
پاسخ
در قدم اول موازنه به روش وارسی، پیچیدهترین ترکیب را انتخاب میکنیم و به آن ضریب ۱ میدهیم که در این معادله واکنش ترکیب است. این ترکیب، یک اتم روی و دو اتم کلر دارد. سپس تعداد اتمهای روی را موازنه میکنیم. در سمت راست معادله تنها یک اتم روی و در سمت چپ نیز ترکیب تکاتمی روی را داریم پس به آن ضریب ۱ میدهیم.
سپس به بررسی تعداد اتمهای کلر میپردازیم. در سمت راست معادله، ۲ اتم کلر در ترکیب روی کلرید وجود دارد و در سمت چپ معادله، یک اتم کلر در ترکیب اسید کلریدریک وجود دارد. با ضریب ۲ دادن به این ترکیب، تعداد کلر نیز موازنه خواهد شد.
در نهایت به بررسی تعداد هیدروژنها میپردازیم. در سمت چپ معادله واکنش، دو اتم هیدروژن در ترکیب اسید کلریدریک وجود دارد و در سمت راست معادله وکنش، ترکیب دو اتمی هیدروژن را داریم که باید ضریب ۱ بگیرد.
بدین ترتیب معادله واکنش موازنه شده است.
مثال ۳
معادله واکنش زیر را موازنه کنید.
پاسخ
در قدم اول موازنه به روش وارسی، پیچیدهترین ترکیب را انتخاب میکنیم و به آن ضریب ۱ میدهیم. روش موازنه این واکنش مطابق روش موازنه مولکولهای چنداتمی است به این دلیل که گروه فسفات در این معادله واکنش تکرار شده است. در این معادله واکنش ترکیب ترکیب پیچیده با ۳ اتم کلسیم و دو گروه فسفات است. ابتدا تعداد اتمهای کلسیم را موازنه میکنیم. در سمت چپ معادله، ترکسیب کلسیم هیدروکسید، ۱ اتم کلسیم دارد پس به آن ضریب ۳ میدهیم.
سپس تعداد گروههای فسفات را موازنه میکنیم. در سمت راست معادله، دو گروه فسفات و در سمت چپ ۱ گروه فسفات داریم. پس به ترکیب اسید فسفریک ضریب ۲ میدهیم.
در مرحله بعدی، تعداد هیدروژنهای معادله را بررسی میکنیم. در سمت چپ معادله، ۶ اتم هیدروژن در ترکیب کلسیم هیدروکسید و ۶ اتم هیدروژن در ترکیب اسید فسفریک وجود دارد. در سمت راست معادله تنها در ترکیب آب دو اتم هیدروژن داریم. پس به آن ضریب ۶ میدهیم تا تعداد هیدروژنها برابر شود.
در نهایت، تعداد اکسیژنها را در معادله شمارش میکنیم. در سمت چپ معادله ترکیب کلسیم هیدروکسید ۶ اتم اکسیژن و در سمت راست معادله ترکیب آب نیز ۶ ام اکسیژن دارند و معادله موازنه شده است. باید توجه داشته باشید، نیازی نیست تعداد اکسیژنهای گروه فسفات را شمارش کنیم زیرا قبلا مولکول فسفات را به صورت یک واحد مستقل شمارش کردهایم.
برای یادگیری بیشتر موازنه و روشهای ان میتوانید فیلم آموزش حل موازنه به روش معادله فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال ۴
معادله واکنش زیر را موازنه کنید.
پاسخ
در قدم اول موازنه به روش وارسی، پیچیدهترین ترکیب را انتخاب میکنیم و به آن ضریب ۱ میدهیم. در این معادله بهتر است گروه هیدروکسید (-OH) به صورت واحدی مستقل شمرده شود. ترکیب را به عنوان ترکیب اول در نظر گرفته و به آن ضریب ۱ میدهیم. سپس تعداد آهنهای معادله را موازنه میکنیم. این ترکیب ۱ مولکول آهن دارد و در سمت راست معادله است. در سمت چپ معادله، ترکیب کلرید آهن، ۱ اتم آهن دارد و ضریب ۱ میگیرد.
در مرحله بعدی، تعداد گروههای هیدروکسید را شمارش میکنیم. در سمت راست معادله، ترکیب هیدروکسید آهن، ۳ گروه هیدروکسید و در سمت چپ معادله، ترکیب آمونیوم هیدروکسید، یک گروه هیدروکسید دارد. پس به آن ضریب ۳ میدهیم.
در نهایت تعداد کلرهای واکنش را بررسی میکنیم. در سمت چپ معادله، ۳ اتم کلر در ترکیب کلرید آهن وجود دارد. در سمت راست معادله، یک اتم کلر در ترکیب آمونیوم کلرید وجود دارد. پس به آن ضریب ۳ میدهیم.
حال تمامی ترکیبهای معادله ضریب استوکیومتری دارند اما هنوز تعداد هیدروژنها را شمارش نکردهایم. برای اطمینان از موازنه بودن واکنش، تعداد هیدروژنها را شمارش میکنیم. در سمت چپ معادله ۱۲ اتم هیدروژن (به جز گروه هیدروکسید) و در سمت راست معادله نیز ۱۲ اتم هیدروژن (به جز گروه هیدروکسید) وجود دارد.

مثال ۵
معادله واکنش زیر را موازنه کنید.
پاسخ
در این معادله واکنش ترکیب یکی از ترکیبهای پیچیده است پس به آن ضریب ۱ میدهیم. در این معادله، گروه فسفات تکرار شونده داریم. برای شروع از اتم آلومینیوم شروع میکنیم در ترکیب دو اتم آلومینیوم و در ترکیب یک اتم آلومینیوم است پس به آن ضریب ۲ میدهیم.
سپس به سراغ موازنه تعداد گروههای فسفات میرویم. در سمت راست واکنش ۲ گروه فسفات و در سمت چپ یک عدد داریم. پس به ترکیب اسید فسفریک ضریب ۲ میدهیم.
در مرحله بعدی، تعداد کربنها را بررسی میکنیم. در سمت چپ معادله، ۳ اتم کربن و در سمت فرآوردهها، ۱ اتم کربن در مولکول کربندیاکسید وجود دارد. پس به کربندیاکسید ضریب ۳ میدهیم.
در مرحله بعد، تعداد هیدروژنها را شمارش میکنیم. در سمت چپ معادله، ترکیب اسید فسفریک، ۶ اتم هیدروژن و در سمت راست، مولکول آب ۲ اتم هیدروژن دارد. پس به آب ضریب ۲ میدهیم.
بدین ترتیب معادله واکنش موازنه شده است.
مثال ۶
معادله واکنش زیر را موازنه کنید.
پاسخ
در این معادله واکنش، برخی از اتمها باردار هستند. پس باید دقت داشته باشیم در انتهای موازنه واکنش، تعداد بارهای مثبت و منفی با یکدیگر برابر باشد. در این معادله واکنش ترکیب ترکیب پیچیده است. این مولکول یک اتم سرب و دو مولکول اکسیژن دارد. برای شروع، به اتم سرب دوبار مثبت سمت راست واکنش، ضریب ۱ و به مولکول آب ضریب ۲ میدهیم تا تعداد اتمهای سرب و اکسیژن موازنه شود.
سپس تعداد اتمهای هیدروژن را موازنه میکنیم. در سمت راست معادله، ۴ اتم هیدروژن و در سمت چپ معادله تنها اتم تک هیدروژن یک بار مثبت را داریم پس به آن ضریب ۴ میدهیم.
حال نوبت آن است که تعداد بارهای مثبت و منفی را شمارش کنیم. در سمت چپ معادله ۴ یون هیدروژن یعنی ۴ بار مثبت داریم. در سمت راست معادله نیز دو یون سرب دوبار مثبت داریم یعنی جمعا ۴ بار مثبت. پس تعداد بارهای مثبت در این معادله برابر است و معادله خنثی است. نیازی نیست حتما در اینگونه واکنشها بار منفی نیز داشته باشیم. تنها باید دقت کنیم تعداد بارهای همسان در دوطرف معادله واکنش و بارهای مخالف در یک سمت واکنش برابر باشد تا اثر یکدیگر را خنثی کنند.
موازنه به روش جمع جبری
تا اینجا موازنه به روش وارسی را بررسی کردیم. حال با یک مثال نیز موازنه به روش جبری را توضیح میدهیم. موازنه به روش جبری کمی پیچیده است و نیازی به آموختن آن در مقطع دبیرستان نیست. این روش تنها در مواردی استفاده میشود که موازنه به روش وارسی برای یک معادله واکنش قابل انجام نباشد. در موازنه به روش جبری مراحل زیر را انجام میدهیم.
- ابتدا به جای ضرایب استوکیومتری قبل از هر مولکول حروف انگلیسی a، b، c، d، e و … قرار میدهیم.
- سپس برای هر اتم به صورت جداگانه، ضرایب را در تعداد اتم ضرب کرده و مقادیر به دست آمده برای هر اتم در دو سمت معادله را برابر قرار میدهیم.
- در مرحله سوم، برای اولین مقدار حرف a عدد ۱ را در نظر میگیریم و به وسیله آن معادلات به دست آمده را حل میکنیم.
- در مرحله آخر اگر ضرایب کسری به دست آورده باشیم، تمامی ضرایب را در بزرگترین مخرج ضرب میکنیم تا تمامی کسرها به عدد صحیح تبدیل شوند.
- پس از انجام این مراحل، معادله موازنه شده را نوشته و تعداد اتمها را برای اطمینان از موازنه بودن واکنش، شمارش میکنیم.
برای یادگیری این روش موازنه به معادله واکنش زیر دقت کنید.
در اولین مرحله قبل از هر مولکول به جای ضرایب استوکیومتری، حروف انگلیسی قرار میدهیم.
در مرحله بعد، برای هر اتم، ضرایب را در تعداد اتم موجود در مولکول ضرب کرده و برای هر دو طرف معادله، برابر قرار میدهیم. ضرایب به دست آمده برای اتم سدیم به شکل زیر است.
ضرایب به دست آمده برای اتم کلر به شکل زیر است.
ضرایب به دست آمده برای اتم برلیم به شکل زیر است.
ضرایب به دست آمده برای اتم فلوئور به شکل زیر است.
در مرحله بعدی a را برابر با ۱ قرار میدهیم و معادلات را حل میکنیم.
حال که ضرایب را به دست آوردهایم، باید آنها را در بزرگترین مخرج یعنی عدد ۲ ضرب کنیم. بدین ترتیب مقایر ضرایب به شکل زیر تبدیل میشود.
در نهایت ضرایب را قبل مولکولها نوشته و موازنه بودن واکنش را بررسی میکنیم.
مثال موازنه به روش جمع جبری
استفاده از موازنه به روش وارسی، در مورد تمامی واکنشهای شیمیایی کاربرد ندارد. در برخی از واکنشهای شیمیایی پیچیده، استفاده از روش وارسی به نتیجه نمیرسد. برای مثال واکنش زیر را در نظر بگیرید.
استفاده از موازنه وارسی در این واکنش بسیار مشکل خواهد بود. در این واکنش با موازنه به روش وارسی تنها میتواند تعداد کربنها را موازنه کرد. تمامی عناصر دیگر در چندین ترکیب وجود دارند و نمیتوان تعداد آنها را محاسبه کرد. پس برای موازنه این واکنش، از روش جبری استفاده میکنیم. در اولین مرحله، قبل از مولکولها ضریب حروف انگلیسی قرار میدهیم.
در مرحله بعد، برای هر اتم، ضرایب را بررسی میکنیم.
اتم کربن
اتم هیدروژن
اتم اکسیژن
اتم سدیم
اتم کلر
سپس با در نظر گرفتن مقدار ۱ برای ضریب a، مقادیر ضرایب را به دست میآوریم.

یادگیری دروس متوسطه با فرادرس
یادگیری صحیح دروس پایه متوسطه از جمله شیمی نقشی مهم در موفقیت در کنکور کارشناسی و قبولی در دانشگاه را دارد. با یادگیری اصولی مفاهیم پایه و پیچیده و یادگیری روش حل مسائل دروس مختلف، دانشآموزان می توانند آینده بهتری را برای خود رقم بزنند. پیشنهاد میکنیم برای یادگیری بهتر مسائل و مفاهیم مربوط به دروس متوسطه و کنکور به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور درس، تمرین، حل مثال و تست مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است میتوانید به آموزشهای بیشتری در خصوص دروس متوسطه دوم دسترسی داشته باشید.
مثالهای موازنه شیمی دهم و یازدهم
در کتابهای شیمی پایههای دهم و یازدهم دوره متوسطه، مثالها و تمرینها متفاوتی برای موازنه به روش وارسی ارائه شده است. در ادامه، روش موازنه این واکنشها را بررسی میکنیم.
شیمی دهم
ابتدا معادله واکنش های موازنه نشده شیمی دهم را بررسی و موازنه میکنیم.
مثال ۱
واکنش سولفور دی اکسید و اکسیژن را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش، ابتدا ترکیب به عنوان ترکیب پیچیده در نظر گرفته و به آن ضریب ۱ میدهیم. سپس تعداد اتمهای سولفور را موازنه کرده و به ضریب ۱ میدهیم. در نهایت تعداد اکسیژنها را موازنه کرده و به مولکول دواتمی اکسیژن ضریب ۱/۲ میدهیم. در نهایت کل ضرایب معادله را در عدد ۲ ضرب میکنیم تا واکنش موازنه شود.
در مطلب زیر از مجله فرادرس، فرمولهای کتاب شیمی دهم را به همراه مثالها و توضیح آنها را بررسی کردهایم.
مثال ۲
واکنش سوختن اتانول را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. سپس تعداد کربنها را موازنه کردن و به ترکیب کربندیاکسید ضریب ۲ میدهیم. در مرحله بعد، تعداد هیدروژنها را با توجه به اتانول موازنه کرده و به آن ضریب ۳ میدهیم. در مرحله آخر، تنها مولکول دو اتمی اکسیژن باقی میماند که با ضریب ۳ دادن به آن، تعداد اکسیژنهای هر دو طرف معادله واکنش برابر ۷ عدد میشود.

مثال ۳
واکنش زیر را موازنه کنید.
پاسخ
در اولین مرحله، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. سپس برای موازنه ابتدا تعداد کربنها، سپس هیدروژن و نیتروژن و در آخر تعداد اکسیژن را بررسی میکنیم. در اولین قدم برای موازنه شدن تعداد کربنها باید به ترکیب کربندیاکسید، ضریب ۱۲ بدهیم.
سپس برای موازنه تعداد هیدروژن به آب ضریب ۱۰ و برای موازنه نیتروژن به ترکیب دو اتمی نیتروژن ضریب ۶ میدهیم.
در آخرین مرحله، باید تعداد اکسیژنها را بررسی کنیم. در سمت چپ معادله، ۳۶ اتم اکسیژن در ترکیب واکنشدهنده داریم و در فرآوردهها، ۲۴ اتم اکسیژن مربوط به کربندیاکسید، ۱۰ اتم اکسیژن مربوط به ترکیب آب است پس جمعا ۳۴ اتم اکسیژن و یک مولکول اکسیژن دو اتمی داریم. با جمع مقادیر اکسیژن فرآوردهها در مییابیم در سمت راست واکنش نیز ۳۶ اتم اکسیژن وجود دارد و معادله واکنش موازنه شده است.
مثال ۴
واکنش کلسیم فسفید و آب را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. دقت داشته باشید، گروه هیدروکسیدی که در فرآوردها وجود دارد، در واکنشدهندهها تکرار نشده است پس نمیتوانیم آن را به عنوان یک گروه مستقل در نظر بگیریم. در اولین قدم برای موازنه، تعداد اتمهای کلسیم را موازنه کرده و به ترکیب کلسیم هیدروکسید، ضریب ۳ میدهیم. در قدم بعدی، تعداد فسفرها را شمارش کرده و به ترکیب ضریب ۲ میدهیم. حال در این مرحله نوبت به بررسی اتمهای اکسیژن و هیدروژن میرسد. در سمت راست واکنش، ۶ اتم اکسیژن مربوط به ترکیب کلسیم هیدروکسید است. پس به ترکیب آب در سمت واکنشدهندهها، ضریب ۶ میدهیم تا تعداد اکسیژنها موازنه شود. در نهایت تعداد هیدروژنها را بررسی میکنیم. در هر دو سمت معادله ۱۲ اتم هیدروژن وجود دارد و معادله واکنش موازنه شده است.

مثال ۵
واکنش سوختن الکل را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. سپس برای شروع موازنه، ابتدا تعداد کربنها را شمارش میکنیم. در سمت چپ معادله، ۵ اتم کربن وجود دارد. پس به ترکیب کربندیاکسید، ضریب ۵ میدهیم. سپس تعداد هیدروژنها را بررسی میکنیم. در سمت چپ معادله ۱۰ اتم هیدروژن وجود دارد پس به ترکیب آب، ضریب ۵ میدهیم.
در نهایت تعداد اکسیژن را بررسی میکنیم. در سمت راست معادله، ۱۵ اتم اکسیژن وجود دارد. در سمت چپ مولکول دو اتمی اکسیژن و ۲ اتم اکسیژن الکل را داریم . پس مولکول دو اتمی اکسیژن باید ضریب ۱۳/۲ بگیرد و معادله واکنش در نهایت در عدد ۲ ضرب شود.
مثال ۶
واکنش تولید فسفر تری کلرید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. ابتدا به ترکیب فسفر ۴ اتمی، ضریب ۱/۴ میدهیم و سپس برای موازنه تعداد کلر، به مولکول دو اتمی کلر ضرب ۳/۲ میدهیم. سپس برای از بین رفتن کسرها، کل ضرایب را در عدد ۴ ضرب میکنیم.
با شمارش تمامی اتمها می توانیم مشاهده کنیم که واکنش موازنه شده است.
مثال ۷
واکنش سدیم بورهیدرید و سولفوریک اسید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. سپس برای شروع موازنه، ابتدا از اتم سدیم شروع میکنیم. در سمت راست معادله، ۲ اتم سدیم داریم پس به ترکیب ضریب ۲ میدهیم.
سپس تعداد اتم بور را موازنه میکنیم. در سمت چپ معادله، ۲ اتم بور داریم پس به ترکیب ضریب ۱ میدهیم.
سپس به سراغ گروه سولفات میرویم. در سمت راست معادله، ۱ گروه سولفات داریم. پس به ترکیب اسید سولفوریک ضریب ۱ میدهیم.
حال تنها باید تعداد اتمهای هیدروژن را بررسی کنیم. در سمت چپ معادله، ۱۰ اتم هیدروژن داریم. در سمت راست یک مولکول دو اتمی هیدروژن و ۶ اتم هیدروژن در ترکیب موجود است. پس به ترکیب دو اتمی هیدروژن ضریب ۲ میدهیم تا در هر دو طرف معادله، ۱۰ اتم هیدروژن داشته باشیم.
مثال ۸
واکنش تجزیه هیدروژن سولفید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. سپس تعداد اتمهای گوگرد را موازنه میکنیم. در سمت راست معادله واکنش، ۱ اتم گوگرد داریم. پس به ترکیب ضریب ۱ میدهیم. سپس تعداد هیدروژنها را شمارش میکنیم. در سمت واکنشدهندهها ۲ اتم هیدروژk داریم و در ترکیب آب در فرآوردهها نیز ۲ اتم هیدروژن وجود دارد. پس باید به مولکول آب ضریب ۱ بدیم. در نهایت تعداد اتمهای اکسیژن را بررسی میکنیم. در سمت راست معادله، ۳ اتم اکسیژن داریم. پس باید به ترکیب ۲ اتمی اکسیژن در واکنشدهندهها ضریب ۳/۲ بدهیم و در نهایت کل ضرایب را در عدد ۲ ضرب کنیم تا کسرها از بین برود.
مثال ۹
واکنش طلا و سدیم سیانید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. ابتدا به موازنه تعداد اتمهای طلا میپردازیم. در سمت چپ مولکول تکاتمی طلا را داریم پس به آن ضریب ۱ میدهیم تا تعداد اتمهای طلا برابر شود. در قدم بعدی، تعداد گروههای سیانید (CN) را میشماریم. در سمت راست معادله، ۲ گروه سیانید داریم. پس به ترکیب سدیم سیانید ضریب ۲ میدهیم تا تعداد این گروه موازنه شود.
به موازنه تعداد اتمهای سدیم میپردازیم. در سمت چپ معادله ۲ اتم سدیم داریم و در سمت راست، ترکیب اولیه ۱ اتم سدیم و ترکیب دوم نیز یک اتم سدیم دارد. پس ضریب ترکیب سدیم هیدروکسید باید ۱ باشد.
برای موازنه تعداد اتمهای هیدروژن ، تعداد هیدروژنهای سمت چپ معادله باید با سمت راست (۱ عدد در ترکیب سدیم هیدروکسید) برابر باشد. در سمت چپ معادله، مولکول آب را با دو اتم هیدروژن داریم پس به آن ضریب ۱/۲ میدهیم.
در نهایت باید تعداد اتمهای اکسیژن را بررسی کنیم. در سمت راست معادله واکنش ۱ اتم اکسیژن داریم. در سمت چپ ۱/۲ اتم اکسیژن مربوط به مولکول آب است و باید ۱/۲ اتم اکسیژن دیگر داشته باشیم. اما مولکول اکسیژن دواتمی باقی مانده است. باید ضریبی به این مولکول بدهیم تا ۱/۲ را نتیجه دهد. پس به آن ضریب ۱/۴ میدهیم.
در نهایت تمامی ضرایب را در عدد ۴ ضرب میکنیم.
مثال ۱۰
واکنش اکسیداسیون آمونیاک را در نظر بگیرید و آن را موازنه کنید:
پاسخ
در اولین مرحله از موازنه به روش وارسی، ترکیب را به عنوان پیچیدهترین ترکیب در نظر گرفته و به آن ضریب ۱ میدهیم. سپس برای شروع تعداد اتمهای نیتروژن را محاسبه میکنیم. در سمت چپ معادله واکنش، ۱ اتم نیتروژن داریم پس باید از ترکیب نیز یک عدد داشته باشیم پس به آن ضریب ۱ میدهیم. سپس تعداد اتمهای هیدروژن را موازنه میکنیم. در سمت چپ معادله ترکیب آمونیاک ۳ اتم هیدروژن دارد. پس در سمت فرآوردهها نیز باید همین تعداد از اتم هیدروژن را داشته باشیم. ترکیب آب ۲ مولکول هیدروژن دارد و دیگر ترکیبی با اتم هیدروژن نداریم. پس این ترکیب باید ضریب ۳/۲ بگیرد.
در مرحله بعد باید تعداد اتمهای اکسیژن شمارش شوند. در سمت راست معادله، مولکول یک اتم اکسیژن دارد. مولکول آب، با ضریب ۳/۲، تعداد ۱٫۵ اتم اکسیژن دارد. در سمت چپ معادله، ترکیب ۲ اتمی اکسیژن را داریم که باید ۲٫۵ اتم اکسیژن (کسر ۵/۲ ) اتم اکسیژن داشته باشد. خود این ترکیب ۲ اتم اکسیژن دارد پس باید ضریب ۵/۴ بگیرد. در نهایت تمامی ضرایب در ۴ ضرب می شوند تا کسرها از بین بروند.
نکته
اگر پیدا کردن ضریب مادهای در مثالی مانند مثال قبل، به صورت کسری دشوار بنظر میرسد، میتوان قبل از پیدا کردن آن، کل ضرایب را در مخرج کسی که از قبل وجود دارد (کسر ۳/۲ برای آب) ضرب کرد. بدین صورت که قبل از ضرب کردن، به جای ضرایبی که هنوز به دست نیارودهایم یک مجهول قرار میدهیم و سپس ضرب میکنیم. برای مثال در این واکنش، قبل از پیدا کردن ضریب مولکول دو اتمی اکسیژن، ضرایب را در عدد ۲ ضرب کنیم تا کسر از بین برود. معادله این واکنش به شکل زیر نوشته میشود.
سپس تعداد اتمهای اکسیژن را شمارش میکنیم. در سمت راست معادله ۵ اتم اکسیژن داریم و در سمت چپ معادله اتم اکسیژن وجود دارد. حال با حل معادله ای بسیار ساده، ضریب اکسیژن به دست میآید.
پس x برابر با ۵/۲ است. حال دوباره برای از بین بردن کسر باید همه ضرایب را در عدد ۲ ضرب کرد. و معادله موازنه میشود.
حال که تمامی نکات موازنه به روش وارسی را آموختید، در ادامه این مطلب از مجله فرادرس، تنها صورت و پاسخ سوالات ارائه خواهد شد.

مثال ۱۱
واکنش کلسیم کلرید و سدیم فلوئورید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب کلسیم کلرید را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۱۲
واکنش سوختن ناقص متان را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب متان را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۱۳
سوختن اتانول را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب اتانول را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۱۴
واکنش نقره نیترات و سدیم کلرید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب سدیم نیترات را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۱۵
واکنش سدیم فسفات و کلسیم کلرید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب کلسیم فسفات را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۱۶
واکنش سدیم سولفات و باریم کلرید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب سدیم سولفات را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
شیمی یازدهم
مثال ۱
واکنش آهن (II) کلرید و سدیم هیدروکسید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب آهن (II) هیدروکسید را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۲
واکنش آهن (III) کلرید و سدیم هیدروکسید را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب آهن (III) هیدروکسید را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۳
واکنش ترمیت را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب تیتانیوم تترا کلرید را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.

مثال ۴
واکنش اکسید آهن (III) با تیتانیوم را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب اکسید آهن (III) را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۵
واکنش منیزیم و اکسید آهن (III) را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب اکسید آهن (III) را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
مثال ۶
واکنش اکسیداسیون سولفید مس را در نظر بگیرید و آن را موازنه کنید:
پاسخ
برای موازنه این واکنش ابتدا ترکیب سولفید مس را به عنوان پیچیدهترین ترکیب انتخاب کرده سپس باقی اتمها را نسبت به آن شمارش و موازنه میکنیم. معادله موازنه شده به شکل زیر خواهد بود.
source